Atividade prática - Como se forma a ferrugem? – Parte 2
1º e 2º anos do Ensino Médio
Objetivo
Vivenciar alguns testes para a determinação das causas do surgimento da ferrugem, ou seja, da
oxidação dos objetos de ferro metálico, assim como de alguns métodos interessantes de
prevenção dessa oxidação.
Introdução
Como vimos na parte 1, os metais são os elementos com tendência de perder elétrons, que é
o mesmo que “sofrer oxidação”. Portanto, os metais possuem facilidade de reagir com os
elementos que possuem tendência de ganhar elétrons, como oxigênio (O) e enxofre (S).
As poucas exceções são os “metais nobres”, ou seja, com baixa tendência de perder elétrons,
como o ouro (Au), a prata (Ag), o cobre (Cu), a platina (Pt) e o mercúrio (Hg). O ouro é o único
que sempre é encontrado já na forma de metal amarelo, incrustado em rochas no subsolo ou em
pequenas pepitas no leito de rios. Os outros metais nobres podem ser encontrados na forma
metálica, mas isso é raro; sendo mais comumente encontrados na forma de seus respectivos
minérios.
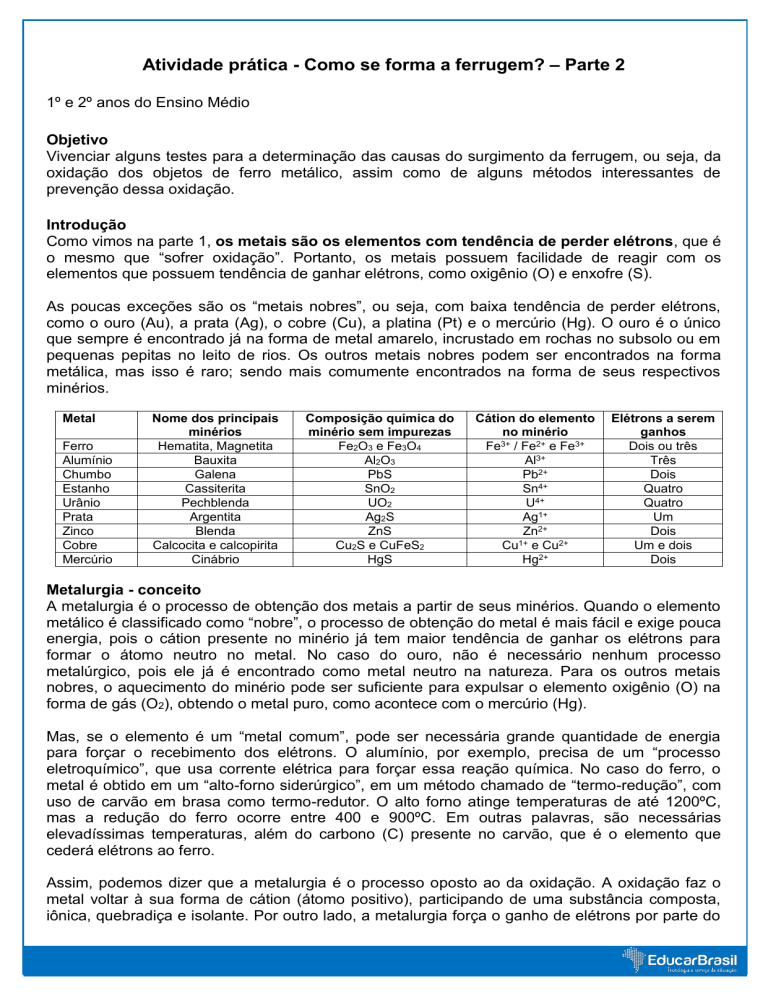
Metal
Ferro
Alumínio
Chumbo
Estanho
Urânio
Prata
Zinco
Cobre
Mercúrio
Nome dos principais
minérios
Hematita, Magnetita
Bauxita
Galena
Cassiterita
Pechblenda
Argentita
Blenda
Calcocita e calcopirita
Cinábrio
Composição química do
minério sem impurezas
Fe2O3 e Fe3O4
Al2O3
PbS
SnO2
UO2
Ag2S
ZnS
Cu2S e CuFeS2
HgS
Cátion do elemento
no minério
Fe3+ / Fe2+ e Fe3+
Al3+
Pb2+
Sn4+
U4+
Ag1+
Zn2+
1+
Cu e Cu2+
Hg2+
Elétrons a serem
ganhos
Dois ou três
Três
Dois
Quatro
Quatro
Um
Dois
Um e dois
Dois
Metalurgia - conceito
A metalurgia é o processo de obtenção dos metais a partir de seus minérios. Quando o elemento
metálico é classificado como “nobre”, o processo de obtenção do metal é mais fácil e exige pouca
energia, pois o cátion presente no minério já tem maior tendência de ganhar os elétrons para
formar o átomo neutro no metal. No caso do ouro, não é necessário nenhum processo
metalúrgico, pois ele já é encontrado como metal neutro na natureza. Para os outros metais
nobres, o aquecimento do minério pode ser suficiente para expulsar o elemento oxigênio (O) na
forma de gás (O2), obtendo o metal puro, como acontece com o mercúrio (Hg).
Mas, se o elemento é um “metal comum”, pode ser necessária grande quantidade de energia
para forçar o recebimento dos elétrons. O alumínio, por exemplo, precisa de um “processo
eletroquímico”, que usa corrente elétrica para forçar essa reação química. No caso do ferro, o
metal é obtido em um “alto-forno siderúrgico”, em um método chamado de “termo-redução”, com
uso de carvão em brasa como termo-redutor. O alto forno atinge temperaturas de até 1200ºC,
mas a redução do ferro ocorre entre 400 e 900ºC. Em outras palavras, são necessárias
elevadíssimas temperaturas, além do carbono (C) presente no carvão, que é o elemento que
cederá elétrons ao ferro.
Assim, podemos dizer que a metalurgia é o processo oposto ao da oxidação. A oxidação faz o
metal voltar à sua forma de cátion (átomo positivo), participando de uma substância composta,
iônica, quebradiça e isolante. Por outro lado, a metalurgia força o ganho de elétrons por parte do
cátion para torná-lo neutro, formando uma substância simples, metálica, dura, resistente, boa
condutora de calor e de eletricidade.
ENCONTRADO NA NATUREZA
Elemento na forma
de cátion (minério)
METALURGIA
←
→
OXIDAÇÃO
PRODUZIDO PELO HOMEM
Elemento neutro
(metal)
A metalurgia do ferro é conhecida como “siderurgia”. A técnica moderna consiste em alimentar 24
horas por dia um “alto forno” com camadas alternadas de minério de ferro e de carvão vegetal ou
mineral, pela sua parte alta. Essas camadas vão descendo, e o carvão é aquecido pelas camadas
mais baixas que já estavam quentes. Nessa fase, o carvão (carbono quase puro) oxida
parcialmente para a forma de gás monóxido de carbono (CO). Nas fases seguintes, o monóxido
de carbono reage com os cátions ferro (Fe2+ e Fe3+) presentes no minério, e o carbono sofre nova
oxidação formando o gás dióxido de carbono (CO 2). Nesse processo, o carbono cede elétrons
para os átomos de ferro, que se tornam neutros (metálicos). Como a temperatura de reação é
muito alta, o ferro metálico sai no estado líquido, na parte baixa do forno.
Esquerda: trabalhador de um alto forno.
Direita: esquema das temperaturas de um alto forno. A região três,
entre 400 e 900ºC corresponde ao processo de redução (ganho de
elétrons) do ferro, convertendo os cátions Fe2+ e Fe3+ para ferro
metálico Feº. Em “B” acontece entrada de ar para converter o carvão
(carbono quase puro) em gás monóxido de carbono (CO). Em “D”
acontece a saída do ferro metálico líquido. Em “C” acontece a saída
da “escória” derretida (impurezas).
Disponíveis (acesso: 11.12.2014):
http://commons.wikimedia.org/wiki/File:VysokePece1.jpg e
http://commons.wikimedia.org/wiki/File:Hochofenprozess1.svg
Experimento 2: “Influência dos ácidos na corrosão dos metais”
Material (por grupo de alunos)
A) Doze tubos de ensaio.
B) Solução 0,1mol/L de ácido clorídrico preparada pelo professor.
C) Solução 0,1mol/L de ácido acético preparada pelo professor.
D) Quatro pregos de ferro idênticos.
E) Quatro pedaços iguais de fio grosso de cobre.
F) Quatro pedaços iguais de alumínio (pode ser de latinha de refrigerante, sem tinta).
G) Outras sugestões de amostras metálicas: magnésio, chumbo, zinco e ouro 18 quilates.
Obs.: Não há riscos de corroer os objetos de ouro, caso sejam realmente de ouro 18 quilates,
como alianças. Se utilizar objetos “folheados” a ouro, ou seja, revestidos de ouro, eles não podem
conter arranhões, pois o metal interno pode estar exposto. O objetivo aqui é comprovar que o
ouro é resistente aos ácidos. Apenas a “água régia”, mistura de ácido clorídrico e ácido nítrico na
proporção de 3:1, é capaz de oxidar o ouro.
Obs.: Todas essas amostras metálicas precisam ser de tamanho suficiente para caber dentro dos
tubos de ensaio, com alguma sobra de tubo para serem cobertos com as soluções ácidas.
H) Suporte para tubos de ensaio.
I) Algodão.
J) Água destilada.
K) Caneta pincel para identificação dos tubos de ensaio.
Procedimento
1. Identifique os tubos de ensaio, em séries de quatro, numerando-os da seguinte forma: 1A, 1B,
1C e 1D para o ferro; 2A, 2B, 2C e 2D para o cobre; 3A, 3B, 3C e 3D para o alumínio etc.
2. Cuidadosamente, coloque os metais em cada tubo de ensaio, inclinando o tubo para que o
metal não quebre o tubo ao bater no fundo.
3. Adicione água destilada (se não tiver, pode ser água de torneira) a todos os tubos identificados
com “A”, para controle e comparação com os demais.
4. Cuidadosamente, adicione as soluções ácidas nos tubos, da seguinte forma: Tubos com “B”:
solução de ácido acético cobrindo o metal. Tubos com “C”: solução de ácido clorídrico cobrindo o
metal. Tubos com “D”: solução de ácido clorídrico cobrindo apenas metade do metal.
5. Coloque os tubos de forma organizada no suporte de tubos de ensaio e fotografe as amostras
em séries de quatro tubos, com as identificações bem visíveis. Observe quais amostras
apresentam bolhas, bem como a intensidade da produção dessas bolhas.
6. Coloque todas as amostras no suporte de tubos e deixe em repouso por três ou quatro dias.
Fotografe o resultado, repetindo as fotos em séries de quatro para cada metal, para comparação
com as fotos iniciais.
7. Além das fotos, registre suas impressões na tabela abaixo, como mudanças de coloração na
solução e graus de corrosão das amostras metálicas.
Tubos
1
(Fe)
Observações sobre os graus de alteração dos sistemas e de oxidação dos metais
ABCD-
2
(Cu)
ABCD-
3
(Al)
AB-
CD4
(Mg)
ABCD-
5
(Pb)
ABCD-
6
(Zn)
ABCD-
Observações e questões
1) Sabendo que o ácido clorídrico é um “ácido forte” e que o ácido acético é um “ácido fraco”,
responda se foi possível observar no experimento se, de uma maneira geral, houve diferença na
corrosão dos metais usando ácidos diferentes. Comente.
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
2) Você observou diferenças na corrosão dos metais nas amostras em que os mesmos estavam
totalmente cobertos das que estavam parcialmente cobertos pelas soluções ácidas? Comente.
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
3) Quais metais sofreram corrosão e quais não sofreram corrosão por nenhum dos ácidos
utilizados? Comente e explique, usando os conceitos de “metal nobre” e “metal comum”.
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
4) Sabendo que os metais reagem com ácidos formando gás hidrogênio (H 2) e um sal, monte as
equações balanceadas de:
I) alumínio + ácido clorídrico
→
II) zinco + ácido clorídrico
→
III) ferro + ácido clorídrico (formando o sal com cátion ferroso, Fe 2+)
→
IV) ferro + ácido clorídrico (formando o sal com cátion férrico, Fe 3+)
→
5) Sabemos que o experimento realizado com ácidos é uma situação um pouco diferente e mais
“violenta” que a da corrosão natural dos metais no ambiente. No caso da formação da ferrugem, a
oxidação do ferro envolve: a) reação com o gás oxigênio (O 2) presente no ar ou dissolvido na
água; e b) reação com a água. Sabendo que existem dois tipos de ferrugem, uma mais
amarelada (predominando Fe2+) e outra mais avermelhada (predominando Fe3+), e considerando
a fórmula da ferrugem avermelhada como Fe2O3.H2O(s), COMPLETE e BALANCEIE a equação do
ferro metálico com oxigênio e água, formando a ferrugem vermelha.
Fe (s)
+
+
→
Fe2O3.H2O(s)
6) Imprima e cole as fotos coloridas de cada série de tubos correspondente aos metais testados.
Tubos
1
(Fe)
2
(Cu)
Foto da série de tubos (antes)
Foto da série de tubos (depois)
3
(Al)
4
(Mg)
5
(Pb)