MICROBIOLOGIA AMBIENTAL
Cristiano Silva Leal
Tratamentos biológicos de águas residuais
Introdução
• A evolução demográfica e industrial trazem consigo um aumento da
produção de resíduos e águas residuais.
• É por isso necessária uma legislação e consciencialização ambientais
mais exigentes
• As águas residuais domésticas e de origem industrial podem conter
elevados teores de matéria orgânica
• A matéria orgânica é removida através do tratamento de águas
residuais
Ciclo urbano da água
Ciclo urbano da água
Caracterização de águas residuais
• COT - Carbono Orgânico Total
• Corresponde a todo o carbono, utilizado ou não pelos
microrganismos
• CQO - Carência Química de Oxigénio
• Corresponde à fracção orgânica da amostra susceptível de ser
oxidada por via química (um oxidante forte)
• CBO5 - Carência Bioquímica de Oxigénio após 5 dias
• Quantidade de oxigénio dissolvido consumido durante 5 dias,
(expresso em mg/L)na oxidação biológica aeróbia da matéria
orgânica e/ou inorgânica da amostra sob condições standard.
• Em águas residuais domésticas:
• CBO5/CQO= 0,4 a 0,6
Tipos de tratamento
Tipos de tratamento
Preliminar ou pré-tratamento
Primário
Secundário
Terciário
Processos
Gradagem
Tamisação
Trituração
Desarenação
Desengorduramento
Remoção de óleos e de hidrocarbonetos
Medição de caudal
Remoção de partículas de matéria insolúvel
através de sedimentação, adição de agentes
coagulantes e outros processos físicos, é
removida 20 a 30% da CBO na forma particulada
Remoção biológica da matéria orgânica
dissolvida, é removida 90 a 95% da CBO e muitas
bactérias patogénicas
Lamas activadas
Lagunagem
Leitos percoladores
Discos biológicos
Digestores anaeróbios
Remoção de nutrientes
Remoção e inactivação de vírus
Remoção de químicos residuais
Tratamento secundário
Tratamento secundário
Aeróbio
Lamas activadas
(biomassa em suspensão)
Leitos percoladores
(biomassa fixa)
Anaeróbio
Discos biológicos
rotativos
(biomassa fixa)
Tratamento apropriado
• A escolha da tecnologia utilizada no tratamento biológico de águas residuais
depende sobretudo das características (físico-químicas) do efluente a tratar e
do meio receptor da descarga
•
“Tratamento apropriado”
“O tratamento de águas residuais urbanas por qualquer processo e ou por
qualquer sistema de eliminação que, após a descarga, permita que as águas
receptoras satisfaçam os objectivos de qualidade que se lhes aplicam.”(Decretolei nº152/97 de 19 de Junho)
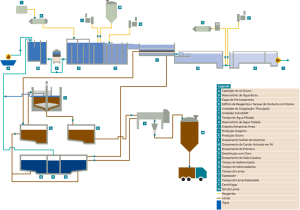
Esquema de uma ETAR
Esquema de uma ETAR
Lamas activadas
• Consiste numa cultura microbiana mantida em suspensão e arejada que
converte a carga poluente do efluente em biomassa e outros produtos
Mecanismo de decomposição aeróbia
Constituição das lamas activadas
• Bactérias (dispersas, formadoras de flocos e filamentosas)
• Protozoários e Metazoários
• Células mortas
• Fragmentos orgânicos não digeridos
• Precipitados de compostos inorgânicos
• A biomassa microbiana tem a capacidade de flocular e deste modo
promover a separação sólido-líquido resultando o efluente final
clarificado
• A biomassa pode ser recirculada para o reactor para induzir a pressão
selectiva de agregados com boas características de sedimentabilidade.
Caracterização do sistema de lamas
activadas
Sistema básico de lamas activadas
Reactor de lamas activadas(arejamento
prolongado)
Sistema básico de vala de oxidação
Reactor de lamas activadas(do tipo SBR)
Ciclo de funcionamento de um SBR
Dinâmica de colonização em lamas
activadas
Dinâmica de colonização da microfauna em sistemas de lamas activadas
Principais protozoários e
metazoários em lamas activadas
•
Flagelados
•Pequenos flagelados
•Grandes flagelados
•
Ciliados bacteriófagos
•Nadadores
•Sésseis
•Móveis de fundo
•
Ciliados carnívoros
•
Amebas
•Amebas nuas
•Amebas com teca
•
Metazoários
Principais protozoários e
metazoários em lamas activadas
Locais de alimentação dos diversos ciliados bacteriófagos em lamas activadas
A - nadadores B - sésseis C - móveis de fundo (Madoni, 1994).
Rede trófica em lamas activadas
Rede trófica em lamas activadas
Relação entre protozoários e
eficiência de tratamento
Grupo dominante
Eficiência
Causa possível
Pequenos flagelados
má
Lamas pouco oxigenadas; carga muito forte; entrada de
substâncias fermentescíveis
Pequenos ciliados nadadores (<50 µm)
medíocre
Tempo de contacto muito baixo; lamas pouco oxigenadas
Grandes ciliados nadadores (>50 µm)
medíocre
Carga muito forte
Ciliados móveis de fundo
boa
Ciliados sésseis + móveis de fundo
boa
Ciliados sésseis
baixa
Fenómenos transitórios (carga descontínua; extracção recente de
lamas)
Pequenas amebas nuas
má
Amebas com teca
boa
Carga muito elevada não facilmente biodegradável
Cristiano Silva Leal
Carga baixa; licor diluído; boa nitrificação
Índice biótico de lamas
• O índice biótico de lamas proposto por Madoni em 1994 visa avaliar a
qualidade biológica de lamas activadas
• Este índice tem por base a sensibilidade dos vários grupos de protozoários
ciliados alterações dos parâmetros físico-químicos e das variáveis
operacionais do processo
• Calcula-se avaliando o grupo de protozoários dominante a sua densidade e
a variedade de espécies presentes
• Avaliação com valores numéricos (de 0 a 10)
• Valores de IBL correspondentes a uma de quatro classes
Índice biótico de lamas (continuação)
Valor de IBL
Classe
Apreciação
8 a 10
I
lama estável e muito bem colonizada; excelente actividade biológica;
performance muito boa
6a7
II
lama estável e bem colonizada; actividade biológica em decadência;
boa performance
4a5
III
depuração biológica insuficiente no tanque de arejamento;
performance medíocre
0a3
IV
deficiente depuração biológica no tanque de arejamento,
baixa performance
Protozoários em lamas activadas
(flagelados)
•
•
•
•
Fusiformes
Um só tipo de núcleo
Reprodução assexuada por fissão binária
locomoção por flagelos
Flagelado (Peranema)
Protozoários em lamas activadas
(ciliados bacteriófagos)
• Constituem cerca de 70% da população de protozoários
em lamas activadas e dividem-se quanto ao seu modo de
nutrição e nicho ecológico que colonizam
I. Nadadores
II. Sésseis
III. Móveis de fundo
• Possuem dois tipos de núcleo
• Cílios como apêndices de locomoção
Móvel de fundo
(Aspidisca)
Séssil (Vorticella)
Protozoários em lamas activadas
(ciliados bacteriófagos)
Séssil (Opercularia)
Ciliado nadador(Paramecium)
Protozoários em lamas activadas
(ciliados carnívoros)
•
•
Ciliatura apenas na fase embrionária
Possuem tentáculos que sugam outros protozoários
Ciliado carnívoro (Tokophorya)
Protozoários em lamas activadas
(amebas)
• São protozoários sem parede celular, elevada flexibilidade corporal e
móveis por pseudópodes
• Algumas amebas possuem teca
Ameba com teca (Euglypha)
Ameba sem teca
Metazoários em lamas activadas
• Os metazoários podem ser considerados como tratando-se de animais
multicelulares que se alimentam essencialmente de bactérias
• Os metazoários mais comuns são os rotíferos, os anelídeos e os nemátodos
Rotífero(Monogononta)
Rotífero(Digononta)
Metazoários em lamas
activadas(continuação)
Nematoda
Anelídeo(Aelossoma )
Bactérias filamentosas
As bactérias filamentosas são organismos unicelulares que se multiplicam por
cissiparidade, ou fragmentação, permanecendo na vizinhança umas das outras
Bactérias filamentosas
Thiothrix
Microthrix parvicella
Nocardioformes
Haliscomenobacter hydrossis
Caracterização das principais
filamentosas em lamas activadas
•
Reacção à coloração de Gram;
•
Reacção à coloração de Neisser;
•
Forma e localização do filamento em relação ao floco;
•
Mobilidade;
•
Presença de septos;
•
Presença de bainha;
•
Presença de organismos aderidos ao filamento;
•
Presença intracelular de grânulos de enxofre;
•
Forma e tamanho das células individuais;
•
Características-chave;
•
Associações especiais formando gonídias ou rosetas.
Identificação de bactérias filamentosas
por técnicas FISH
A aplicação de técnicas FISH (do inglês “fluorescent in situ hybridization”)
aplicada à identificação de bactérias filamentosas de lamas activadas consiste
na:
•Aplicação de sondas de oligonucleótidos;
•Sondas capazes de entrar em células bacterianas fixadas;
•Formação de ligações estáveis(híbridos via pontes de hidrogénio entre
nucleótidos complementares) com a região 16S rRNA nos ribossomas.
Hibridização in situ com sondas de oligonucleótidos (Abreu,2004)
Sondas para identificação de bactérias
filamentosas de lamas activadas
Sondas para identificação de bactérias filamentosas
Sondas
Alvo
Referência
HHY
Haliscomenobacter
hyrossis
Wagner et al, 1994
TNI
Thiothrix nivea
Wagner et al, 1994
SNA
Sphaerotilus natans
Wagner et al, 1994
21N
Eikelboom Tipo 021N
Wagner et al, 1994
MNP1
Nocardioformes
actinomicetes
Schuppler et al, 1995
Bactérias filamentosas
Bactérias filamentosas em efluentes domésticos e industriais (adaptado de Spignoni 2001)
Espécie
Comum em instalações de
tratamento de efluentes domésticos
Sphaerotillus natans
x
Haliscomenobacter hydrossis
x
Tipo 1701
x
Tipo 0041/0675
Tipo 021N
Comum em instalações de
tratamento de efluentes Industriais
x
x
x
x
Microthrix parvicella
x
Tipo 0092
x
Nocardia
x
x
Tipo 1851
x
Tipo 0914/0803
x
Tipo 0961
x
Tipo 8581
x
Tipo 1863
x
Nostocoida limicola
x
x
Thiothrix
x
x
Beggiatoa
x
x
Thiothrix
• Morfologicamente caracterizam-se por serem células quadradas a rectangulares,
• crescimento estendendo-se a partir da superfície do floco, com inclusões de
enxofre e altamente refractivos.
• Geralmente Neisser negativo e Gram negativo, pode ser Gram positivo na
presença de substâncias sulfidicas
• Pode indicar fenómenos de bulking.
Nocardioformes
• Estrutura irregular
• Septação presente
• Os filamentos podem partir da superfície dos flocos ou estar dispersos no
líquido e com distinção de células individualizadas.
• Carácter Gram positivo
• Neisser negativo, contudo, são comummente observados grânulos Neisser
positivos na zona intracelular
•
Comuns em fenómenos de formação de espumas (foaming).
Haliscomenobacter hydrossis
• Morfologicamente caracterizam-se por serem filamentos muito finos, direitos ou
inclinados que se estendem da superfície do floco ou se encontram livres na
solução
• Com bainha, pode ainda ser observado crescimento de bactérias aderidas.
• Apresenta carácter Neisser negativo e Gram negativo.
Microthrix parvicella
• Morfologicamente caracterizam-se por serem filamentos irregulares
• Sem ramificações, e apresentando grandes massas de tricomas, sem
ramificação e com distinção de células individualizadas
•
Os filamentos podem ter origem no interior do floco, rodear o floco
ou encontrarem-se livres no líquido
• Carácter Gram positivo e Neisser negativo, contudo, são
comummente observados grânulos Neisser positivos na zona
intracelular
• Comuns em fenómenos de bulking e foaming,
Factores de crescimento de
bactérias filamentosas
Resumo de crescimento de organismos filamentosos em lamas activadas, e o factor
de crescimento associado.
Factor de crescimento
Organismos filamentosos associados
Baixo oxigénio dissolvido (para a carga
Tipo 1701, S. natans, H. hydrossis, M.parvicella
aplicada)
Baixa F/M
Tipo 0041; Tipo 0675; Tipo 1851; Tipo 0803; Tipo
0092; M. parvicella
Elevada concentração de ácidos orgânicos de
baixo peso molecular
Tipo 021N; Thiothrix I e II; N. limicola I, II e III; Tipo
0914; Tipo 0411; Tipo 0961; Tipo 0581; Tipo 0092
Efluentes contendo águas sépticas (Sulfuretos)
Thiothrix spp, Beggiatoa sp., Tipo 021N,Tipo 0914
Deficiência em nutrientes (N e/ou P)
Thiothrix spp, Tipos 021N, 0041,0675; N. limicola III;
H. hydrossis; S. natans;
pH baixo(<6.0)
M. parvicella, Nocardia ssp., H. hydrossis, Tipos 0041,
0675, 0092, 0581, 0961 e 0803, fungos
Bulking filamentoso
• Redução da velocidade de sedimentação, e da compactação das lamas, no
decantador secundário, devido à proliferação de determinados organismos
filamentosos
• Carência de nutrientes específicos (azoto e fósforo)
• Carência de oxigénio
• Substâncias tóxicas no licor misto
Flocos normais
Bulking filamentoso
Foaming filamentoso
• O fenómeno de foaming é caracterizado pela produção de
espumas no reactor /decantador secundário
• O foaming é causado pelo crescimento excessivo de bactérias
filamentosas hidrofóbicas
• As espumas são acastanhadas persistentes e viscosas
• Concentração elevada de organismos filamentosos na espuma face
ao licor misto
• As espumas constituem uma barreira à transferência de oxigénio
• Dificuldades de manutenção no sistema de lamas activadas
• Degradação da qualidade do efluente tratado
Espuma no sistema de lamas activadas (ASIS,2009)
Soluções para o bulking filamentoso
• Principais metodologias para eliminação de bactérias filamentosas causadoras
de bulking:
• Alteração das variáveis de operação para favorecer bactérias formadoras de
flocos: alteração da razão F:M, aumento da taxa de arejamento e
concentrações de substratos específicos ou redução da idade das lamas ;
• Possível criação de zona dentro do reactor com funções de selector;
• Adição de substâncias oxidantes (microbiocidas ou microbiostáticas): compostos
clorados (hipocloritos), peróxido de hidrogénio ou ozonização;
• Adição de iões férricos (cloreto de ferro, etc.), carbonato de cálcio ou polímeros
orgânicos sintéticos e/ou catiónicos, de acção coagulante e floculante.
Soluções para foaming filamentoso
• Principais metodologias
causadoras de foaming:
para eliminação de bactérias
filamentosas
• Alteração das variáveis de operação: aumento da taxa de recirculação das
lamas, e/ou redução do caudal de arejamento, pH e níveis de óleos e
gorduras no efluente;
• Adição de cloro, sais de ferro ou agentes anti-espumantes;
• Concentração e eliminação da espuma no sistema (de modo a impedir a
recirculação da mesma e consequente recontaminação do tanque de
arejamento);
• Metodologia de tratamento depende do microrganismo causador do
problema: arejamento completo para eliminar Microthrix parvicella, ou
condições anaeróbias ou anóxicas para eliminar Nocardia.
Remoção biológica de nutrientes
Importância ambiental da remoção biológica de nutrientes de águas
residuais :
• Elevados teores de nutrientes (N e P) potenciam fenómenos de
eutrofização
• Toxicidade
• Consumo de oxigénio dissolvido
Remoção biológica de azoto
Nitrificação
•Os géneros do tipo Nitrosomonas convertem NH4+a NO2NH4+ +1.5 O2 -> NO2- + 2H+ + H2O
•Os géneros do tipo Nitrobacter convertem NO2- a NO3NO2- +0.5 O2 -> NO3-
Desnitrificação
•Inclui géneros como por exemplo Pseudomonas e Thiobacillus
10(H+ + e-)+ 2NO3-+2H+ -> N2+6H2O
Remoção biológica de fósforo
•A remoção de fósforo por via biológica baseia-se no favorecimento de
desenvolvimento de organismos acumuladores de fósforo(PAO’s)
• Operação sequencial (fase anaeróbia/aeróbia)
• Acumulação de polihidroxialcanoatos (PHAs) com valor comercial e
ambiental acrescentados.
Remoção biológica de fósforo(Mesquita,2006)
Estudo da remoção biológica de
fósforo por análise de imagem
•Aplicação de técnicas de análise de imagem a processos biológicos
particularmente à remoção biológica de fósforo em reactores do tipo
SBR;
• Colorações em fluorescência para identificação de polímeros de
reserva em lamas activadas. (PHAs e polifosfatos);
oColoração com DAPI(do inglês 4’-6-Diamidino-2-phenylindole) para
identificação de grânulos de polifosfatos na zona intracelular;
oColoração com azul do Nilo para detecção de grânulos de PHAs.
Estudo da remoção biológica de
fósforo por análise de imagem
Coloração com DAPI para detecção de grânulos de polifosfatos
Coloração com azul do Nilo para detecção de grânulos de Poli-β-hidroxibutirato
Obrigado pela atenção!