III SIMPÓSIO INTERDISCIPLINAR FÍSICA +
BIOINFORMÁTICA
22 A 25 DE ABRIL DE 2014
UNIVERSIDADE FEDERAL DE UBERLÂNDIA, UBERLÂNDIA, MINAS GERAIS
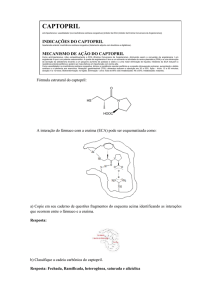
Modelagem molecular do Captopril com os domínios catalíticos da ECA
Flávio A. P. Paiva1 (IC)*; Dr. Milton T. Sonoda1 (PQ); Dr. Odonírio A. Jr.1 (PQ)
1
Universidade Federal do Triângulo Mineiro
[email protected]
Keywords: Captopril; Docking; Enzima Conversora de Angiotensina.
INTRODUÇÃO
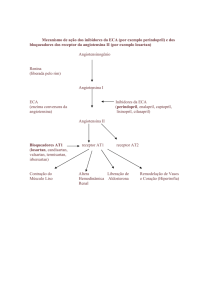
A Enzima Conversora de Angiotensina
(ECA) é uma dipeptil-carboxidipeptidase que possui
dois domínios catalíticos, N-domínio (ND) e Cdomínio (CD). A principal função da ECA é clivar
Angiotensina I (Ang I) em Angiotensina II (Ang II),
que possui atividade vasoconstritora [1], sendo
portanto um alvo terapêutico importante para o
desenvolvimento de inibidores para o tratamento de
hipertensão.
O Captopril, primeiro inibidor da ECA
descoberto na década de 70 experimentalmente [2],
é um fármaco competitivo peptídeo-mimético e
estéreo-específico. Apenas o estereoisômero LCaptopril é bioativo como inibidor da ECA. Neste
trabalho estudamos a estéreo-especificidade do
Captopril nos dois domínios catalíticos da ECA.
MÉTODOS
Modelamos as cargas parciais RESP da
Captopril a partir de cálculos HF/6-31G* no
Gaussian09 [3]. Empregamos o pacote AutoDock 4
para os cálculos de docking e clustering das
estruturas [4]. Nestes cálculos foi empregado o
Algorítimo Genético Lamarckiano, onde foram
obtidas 200 conformações por sistema ligantereceptor.
RESULTADOS AND DISCUSSÃO
No complexo CD com o L-Captopril temos
uma grande quantidade de conformações (4
clusters com população de 15 a 30 conformações
cada) em um nível de energia relativamente alto, em
torno de -2.2 Kcal/mol, próximos entre si e
estruturalmente próximos, ligados ao Zn2+ pelo S,
com conformações muito próximas à estrutura
observada experimentalmente por cristalografia de
raios-x [5]. Estes resultados indicam que a ligação
seja favorecida entropicamente.
Por outro lado, no complexo ND com o LCaptopril, os cálculos de docking prevêem uma
interação bidentada entre o Zn2+ e o S e a carbonila
do captopril, indicando que para este domínio a
afinidade se dá entalpicamente, com energia livre
de ligação de aproximadamente -6.0 Kcal/mol.
Infelizmente não existem estruturas experimentais
do complexo ND com o L-Captopril. Contudo, o
modo de ligação bidentado foi considerado em um
trabalho teórico do complexo captopril com a β-
lactamase [6]. Ainda, foi observado clusters com
conformações de interação monodentada pelo S
com grande população (35 a 50), de alta afinidade (4
Kcal/mol)
separados
por
energias
de
aproximadamente 0.5 Kcal/mol.
No caso do D-Captopril em complexo com o
CD,
as
conformações
observadas
não
apresentaram interações específicas do ligante com
o Zn+2, resultando em complexos de baixa afinidade,
com energias em torno de -0.5 e -1.5 Kcal/mol,
como era esperado pela conhecida estéreo
especificidade deste fármaco.
Com respeito ao D-Captopril com o ND, os
clusters de menores energias (~ -6.0 Kcal/mol)
apresentam conformação bidentada, porém eles
são pouco significativos por terem poucas
conformações (~ 10). Já os 3 clusters com maior
número de conformações, que ocorrem em torno de
-2.5 Kcal/mol, apresentam modos de ligação muito
distindos entre si, ora interagindo com o Zn2+ com o
S, ora com o carboxilato, ou com o S, mas com o
corpo do ligante fora do bolsão de ligação.
Entendemos que esses modos de ligação distintos
competem entre sí, diminuindo a afinidade efetiva.
CONCLUSÃO
A metodologia de docking molecular
utilizada foi eficiente para diferenciar as afinidades
de ligação, previstas pelo estéreo-especificidade.
Além disso, pode-se mostrar que as interações do
fármaco com os domínios análogos ECA se dão de
maneiras distintas. Enquando o L-Captopril se liga
ao ND por interações entálpicas, no caso do CD
contribuições entrópicas parecem ser importantes.
Para o D-Captopril, não bioativo, os cálculos
mostram que este não interage favoravelmente com
o CD, enquanto que com o ND ele apresenta
competição entre pelo menos três diferentes modos
de ligação pouco prováveis.
AGRADECIMENTOS
Agradeço à FAPEMIG/PIBIC-UFTM pelo
apoio financeiro à este projeto.
_____________________
1
Masuyer, Geoffrey; et. al. Scientific Reports, 2012, 2, 717.
Corradi, H. R.; et al. Biochemistry, 43, 2007, 5473–5478.3 G. D. Gopen
and J. A. Swan, American Scientist 78, 1990, 550.
3
Gaussian 09, Revision D.01, M. J. Frisch; et. al. Gaussian, Inc.,
Wallingford CT, 2009.
4
Huey, R.; et. al. J. Computational Chemistry, 28, 2007, 1145-1152
5
Corradi, H. R.; et. al. Journal of molecular biology, 357, 2006, 964–74.
6
Antony J; et. al. J. Comput. Chem., 23, 2002,1281–1296.
2