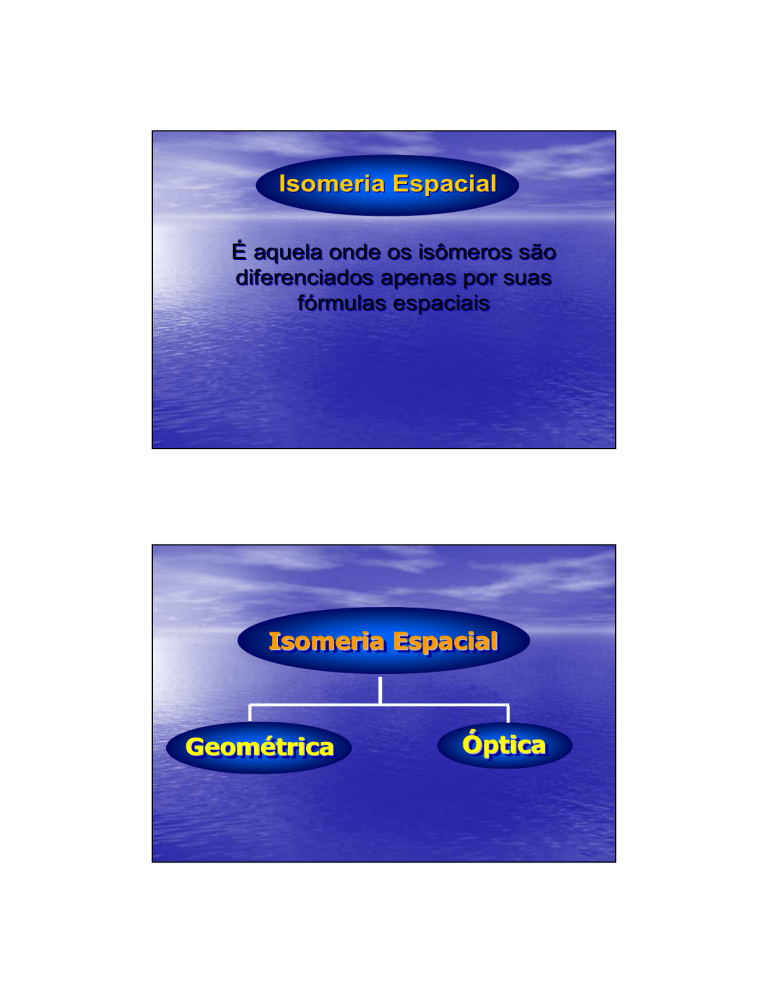
Isomeria Espacial
É aquela onde os isômeros são
diferenciados apenas por suas
fórmulas espaciais
Isomeria
Isomeria Espacial
Espacial
Geom
étrica
Geométrica
Ó
ptica
Óptica
H
C
H
C
Cl
Cl
1,2 - dicloroeteno
H
C
Cl
Densidade
P.E.
1,282 g/mL
≈ 59°
59°C
1,257 g/mL
≈ 48°
48°C
C
H
H
Cl
Cl
Cis-1,2- dicloroeteno
C
C
Cl
H
Trans-1,2- dicloroeteno
Densidade
P.E.
Densidade
P.E.
1,282 g/mL
≈ 59°
59°C
1,257 g/mL
≈ 48°
48°C
Isomeria
étrica
Isomeria Geom
Geométrica
Impedimento de rotação
1° Caso → Em compostos alifáticos
R1
C
R3
C
R2
R1 ≠ R2
e
R3 ≠ R 4
R4
Exemplo: 2-Buteno
H3 C
H3C
H
C
CH
C
CH3
H
Cis-2-Buteno
CH
CH3
H3C
H
H
C
C
CH3
Trans-2-Buteno
Exemplo: metil-2-Buteno
H3C
H
C
H3C
C
CH3
Não ocorre isomeria geométrica pois R1 = R2
Exemplo: Ácido butenodióico
O
OH HO
O
C
C
C
O
C
H
H
P.F.
130,5 °C
Cs
79 g/100g H2O
K1
1000
Ácido Cis-butenodióico
(Ácido Maléico)
HO
C
H
C
C
H
C
OH
O
302 °C
0,7 g/100g H2O
96
Ácido Trans-butenodióico
(Ácido Fumárico)
Ácido Maléico
Anidrido Maléico
OH HO
O
C
C
C
O
O
O
C
C
C
C
H
H
H
O
C
+ H2 O
H
Ácido Fumárico
O
HO
C
H
C
C
H
C
OH
O
Isomeria
étrica
Isomeria Geom
Geométrica
2° Caso → Em compostos Cíclicos
R1
R2
C
C
R3
R4
R1 ≠ R2
e
R3 ≠ R 4
Exemplo: 1,2-dimetilciclopentano
H3C
CH3
H
H3C
H
H
Cis -1,2-dimetilciclopentano
H
CH3
Trans -1,2-dimetilciclopentano
Exemplo: 1-cloro-2-metil-1-buteno
Cl
H
CH3
CH3
Os termos cis e trans podem se tornar ambíguos
se forem aplicados a alcenos cujos átomos de carbono
da dupla possuam em conjunto mais que dois ligantes
diferentes.
Nesses casos o mais correto é usar o sistema de
nomenclatura E-Z proposto pelo químico orgânico inglês
Christopher Kelk Ingold e pelo químico orgânico Vladimir
Prelog
Nesse sistema de nomenclatura analisamos os
dois grupos ligados a cada átomo de carbono da dupla
ligação e os colocamos em ordem de prioridade
Terá maior prioridade o ligante cujo
átomo imediatamente ligado ao carbono
da dupla tiver maior número atômico
Cl
H
CH3
CH3
Z-1-cloro-2-metil-1-buteno
Isômero Z → Aquele que apresentar os ligantes de maior
prioridade em um mesmo plano
zusammen
Isômero E → Aquele que apresentar os ligantes de maior
entgegen
prioridade em planos opostos
Isomeria
ptica
Isomeria Ó
Óptica
A Luz Natural
Luz Polarizada
Espato da Islândia
1808 Malus
Luz natural
“Constatei que algumas
soluções como o óleo de limão,
a cânfora em álcool e o caldode-cana, quando analisados no
polarizador tem a capacidade
de desviar o plano da luz
polarizada.“
1815 Jean-Batiste Biot
1829 Willian Nicol
Polarímetro
Aquiral
Quiral
Aquiral
Aquiral
QuiralAquiral
A contribuição de Louis Pasteur
O
OH
C
H
C
OH
H
C
OH
C
O
1846 Louis Pasteur
OH
Ácido-2,3-diidroxibutanodióico
Isomeria
ptica
Isomeria Ó
Óptica
A importância Biológica da Quiralidade
A maioria das moléculas que constituem os
vegetais e animais é quiral . Todos os 20
aminoácidos que cosntituem as proteínas de
ocorrência natural , exceto um, são quirais e todos
são classificados como esquerdo
Limoneno
Talidomida
Isomeria
ptica
Isomeria Ó
Óptica
1° Caso → A molécula possui carbono assimétrico
(carbono quiral)
R1
C
R2 R R4
3
R1 ≠ R2 ≠ R3 ≠ R4
Exemplo: Ácido lático
2
3
H3dC-Ácido láláCH
tico
OH
l-Ácido lá
lático
O
P.F.
1
Densidade
Constante de Ângulo
ionizaç
de desvio
ionização
52°
52°C
1,25 g/cm3
1,4 x 10-4
+ 2,6°
2,6°
1,4 x 10-4
- 2,6 °
C
52°
52°C
OH1,25 g/cm
3
H
H
C
C
H3C OH COOH
HOOC OH CH3
d - Ácido lático
l - Ácido lático
levógiro
dextrógiro
Antípodas ópticas ou enantiômeros