Fórmulas, moléculas e íons
6
De todos os elementos, apenas os gases nobres existem na natureza como átomos isolados. A
maior parte da matéria é composta por moléculas ou íons formados por átomos. Uma molécula é
um agregado de pelo menos dois átomos ligados por forças químicas. Ela pode conter átomos do
mesmo elemento químico, ou de átomos diferentes unidos numa razão fixa, de acordo com a lei das
proporções definidas.
Um íon é um átomo ou grupo de átomos que tem cargas positiva ou negativa. A perda de um
ou mais elétrons origina um cátion, ou seja um íon com carga positiva. Por outro lado, um ânion é
um íon com carga negativa, devido ao aumento no número de elétrons.
6.1 De acordo com o texto acima preencha a tabela
Átomo de Na
Íon Na+
11 prótons
11 elétrons
Íon Cl-
Átomo de Cl
17 prótons
17 elétrons
6.2 A união do íon Na+ com o íon Cl- forma qual composto químico?
6.3 Determine o número de prótons e de elétrons dos seguintes íons: (a) P3- e (b) Ti4+
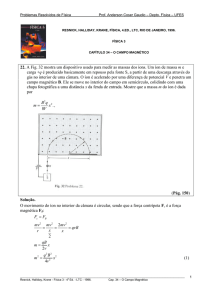
Um átomo pode perder ou ganhar mais de um elétron. O quadro abaixo mostra alguns íons
monoatômicos comuns dispostos de acordo com a sua posição na Tabela Periódica.
1
18
2
13
Li+
Na+
Mg2+ 3 4 5 6
K+
Ca2+
Rb+ Sr2+
Cs+
Ba2+
7
8
9
10
11
12
Cr2+ Mn2+ Fe2+ Co2+ Ni2+ Cu+ Zn2+
Cr3+ Mn3+ Fe3+ Co3+ Ni3+ Cu2+
Ag+ Cd2+
Al3+
14 15 16
C4- N3- O2-
17
F-
P3-
S2-
Cl-
Se2-
Br-
Te2- I-
Au+ Hg22+
Au3+ Hg2+
Em linhas gerais os metais formam cátions e os não-metais formam ânions. O nome dos cátions é o
nome do elemento acrescido da palavra “íon” e da carga quando diferente de 1. O nome do ânion é
modificado pelo sufixo “eto”. Por exemplo: Na+ íon sódio e Cu2+ íon cobre (II).
O número de oxidação que os átomos adquire num composto depende da diferença de
eletronegatividade entre eles, bem como, das propriedades atômicas específicas e, por isso, não existe uma
regra estabelecida. Mesmo assim, é possível observar algumas tendências na tabela periódica, como por
exemplo: os metais alcalinos formam cátions monovalentes, os alcalinos terrosos cátions bivalentes, os
halogênios formam ânions monovalentes e os calcogênios ânions bivalentes, bem como os metais de
transição que são capazes de formar dois ou mais diferentes cátions monoatômicos.
Os íons podem também ser poliatômicos, constituídos por dois ou mais átomos (Tabela 6.1). Neste
caso, a carga não é atribuída a um único átomo, mas de todo o íon poliatômico. A atribuição do nome de uma
composto iônico é bastante simples desde que se reconheçam os cátions e ânions na fórmula química. Esta
tarefa pode ser uma pouco mais trabalhosa quando há presença de dois ou mais cátions ou ânions na fórmula
química. De qualquer maneira, deve-se partir da premissa que todo composto é eletricamente neutro e, para
atribuir seu nome, o primeiro passo sempre será reconhecer os cátions e ânions do composto.
Tabela 6.1. Lista com símbolos e nomes de ânions e cátions comum.
TABELA DE ÂNIONS
TABELA DE CÁTIONS
HALOGÊNIOS
FClBrIClOClO2ClO3ClO4BrOBrO3IOIO3IO4CARBONO
CNCNOCNSCH3CO2CO32HCO3HCO2C2O42[Fe(CN)6]3[Fe(CN)6]4C22C4NITROGÊNIO
NO2NO3N3N3FÓSFORO
PO3H2PO2HPO32PO43P3P2O74P2O64ENXOFRE
S2SO42SO32S2O32S2O82S4O62SCNOUTROS
MnO4MnO42MnO32OH-
MONOVALENTES
Li+
Na+
K+
Rb+
Cs+
Ag+
Cu+
Au+
NH4+
Hg22+
BIVALENTES
Be2+
Mg2+
Ca2+
Sr2+
Zn2+
Cd2+
Cu2+
Hg2+
Fe2+
Co2+
Ni2+
Mn2+
Sn2+
Pb2+
Pt2+
TRIVALENTES
Al3+
Bi3+
Au3+
Fe3+
Co3+
Ni3+
Cr3+
TETRAVALENTES
Sn4+
Pb4+
Ti4+
Pt4+
OUTROS
Te2CrO42Cr2O72AsO33AsO43BO33[B4O5(OH)4]2HO2O22Si4Se2-
Fluoreto
Cloreto
Brometo
Iodeto
Hipoclorito
Clorito
Clorato
Perclorato
Hipobromito
Bromato
Hipoiodito
Iodato
Periodato
Cianeto
Cianeto
Tiocianato
Acetato
Carbonato
Hidrogenocarbonato
Formato
Oxalato
Ferricianeto
Ferrocianeto
Dicarbeto/acetileto
Carbeto/metileto
Nitrito
Nitrato
Azida
Nitreto
Metafosfato
Hipofosfito
Fosfito
Ortofosfato
Fosfeto
Pirofosfato
Hipofosfato
Sulfeto
Sulfato
Sulfito
Tiossulfato
Persulfato
Tetrationato
Tiocianato
Permanganeto
Manganato
Manganito
Hidróxido
Íon Lítio
Íon Sódio
Íon Potássio
Íon Rubídio
Íon Césio
Íon Prata
Íon Cobre(I) ou (cuproso)
Íon Ouro (I)
Íon Amônio
Íon Mercúrio(I)
Íon Berílio
Íon Magnésio
Íon Cálcio
Íon Estrôncio
Íon Zinco
Íon Cádmio
Íon Cobre(II) ou (cúprico)
Íon Mercúrio (II)
Íon Ferro(II) ou (ferroso)
Íon Cobalto
Íon Níquel (II)
Íon Manganês
Íon Estanho
Íon Chumbo(II)
Íon Platina(II)
Íon Alumínio
Íon Bismuto
Íon Ouro (III)
Íon Ferro(III) ou (férrico)
Íon Cobalto
Íon Níquel (III)
Íon Cromo (III)
Íon Estanho(IV)
Íon Chumbo(IV)
Titânio(IV)
Íon Platina(IV)
Telurieto
Cromato
Dicromato
Ortoarsenito
Arsenato
Borato
Tetraborato
Hidreto
Óxido
Peróxido
Silicieto
Selenieto
Fórmula e estrutura química
Existe uma série de maneiras diferentes para expressar um composto químico. Você pode usar
seu nome químico, sua fórmula química, sua estrutura química, entre outros. A fórmula química
contém mais informações sobre o composto químico do que o seu nome. Ela fornece informações
adicionais, como os átomos que compõem o composto químico particular.
6.4. O que é uma fórmula química? Dê exemplos.
6.5. O que significa S8? Como ele difere de 8S?
A fórmula química é uma representação simbólica que indica o número e o tipo de átomos
que constituem uma substância. Ela fornece informações úteis para os químicos, sobre a substância
que ela representa. Por exemplo, na fórmula do ácido sulfúrico, H2SO4, aparecem letras e número.
As letras representam os elementos químicos que se unem para formar a molécula de ácido
sulfúrico. Os números subscrito é chamado de índice e indica a quantidade de átomos do elemento
presente em cada molécula. Para o ácido sulfúrico, H2SO4, significa que cada molécula de ácido é
constituída por dois átomos de hidrogênio e um átomo de enxofre e quatro átomos de oxigênio. É
interessante notar que o número 1 é omitido na fórmula.
6.6 Marque com um X as representações corretas de uma fórmula química, no caso das erradas
corrija-as e em seguida escreva o nome de cada substância.
(
(
(
(
(
(
) H2O
) Al2O3
) S8
) ClNa
) HCl
) PCL3
Fórmula
corrigida
________
________
________
________
________
________
Nome
_________________
_________________
_________________
_________________
_________________
_________________
(
(
(
(
(
(
) O2
) H2O2
) CH4
) CACO3
) NI
) NH3
Fórmula
corrigida
________
________
________
________
________
________
Nome
_________________
_________________
_________________
_________________
_________________
_________________
A fórmula química não fornece a ordem em que os átomos se ligam, se estão agrupados em
unidades discretas (moléculas) ou em estruturas estendidas no espaço bi- ou tridimensional, como é
o caso de sólidos iônicos, metálicos e moleculares. Apesar de expressar o número de átomos, a
fórmula química é considerada um conceito macroscópico, uma vez que é determinada
experimentalmente. Aspectos microscópicos da composição de um compostos ou molécula é
fornecida pela estrutura química, enquanto para estruturas estendidas é fornecida pela estrutura
cristalina.
6.7 Complete o quadro a seguir com as visões macroscópicas das seguintes substâncias.
Nome
Cloreto de césio
Éter dimetílico
Microscópico (estrutura química)
Macroscópica (fórmula química)
A estrutura química revela a localização relativa de cada átomo na molécula e sua
conectividade. Ela pode ser representada de diferentes formas, sendo a fórmula estrutural uma das
mais uteis em química. Ao contrário das fórmulas químicas, que se limitam ao número e ao tipo de
átomos que constituem uma substância, as fórmulas estruturais fornecem uma representação
geométrica completa da estrutura molecular. Por exemplo, o etanol e o éter etílico que possuem a
mesma fórmula química, têm arranjos tridimensional de átomos totalmente diferentes, o que é
destacado nas diferenças nas suas propriedades.
A fórmula estrutural tem muito valor no estudo da química, em especial na química
orgânica, uma vez que permite avaliar diversas propriedades químicas e físicas das moléculas,
como: polaridade, reatividade, cor, magnetismo, bem como a atividade biológica.
A necessidade de uma representação mais compacta, leva ao uso da fórmula química
condensada que oferece algumas informações estruturais, sem a necessidade de desenhar toda a
molécula. Por exemplo, a fórmula condensada do etanol é, CH3CH2OH, que indica partes
importantes da molécula, como um grupo CH3, um grupo CH2 e um grupo OH que classifica-o na
famílias dos álcoois. O éter dimetílico, CH3OCH3, com dois grupo CH3 entre um oxigênio éter,
classifica-o na família dos éteres.
A Figura 6.1 apresenta as fórmulas moleculares e estruturais e os modelos moleculares de quatro
substâncias comuns.
Figura 6.1. Fórmula moleculares e estruturais. Fonte: Chang e Goldsby, 2013.
As estruturas cristalinas, por outro lado, são arranjos organizados bi- ou tridimencionais de
espécies químicas (átomos, moléculas ou íons) que se repetem no espaço. Não são formadas por
moléculas discretas com fórmulas estruturais definidas, mas por uma rede infinita de unidades,
como por exemplo o NaCl. Por isso, a composição desses materiais são invariavelmente descritas
pela fórmula empírica, que fornece a menor relação de proporção entre os elementos químicos
desses compostos.
6.8. Escreva a fórmula química das substâncias representadas a seguir:
Cloreto de sódio _________
Sulfato de cobre __________
Ferro ______________
Óxido de cálcio ___________
O sulfato de cobre, cloreto sódio e óxido de cálcio são formados por dois ou mais átomos
diferentes. Já o ferro, é formado pelo mesmo átomo. Diz-se então que o ferro é uma substância
simples, já que é formado pela união de átomos quimicamente iguais. O sulfato de cobre, cloreto de
sódio e óxido de cálcio são substâncias compostas, pois são formadas pela união de átomos
diferentes. Portanto, uma substância pode ser simples, quando é formada por apenas um tipo de
átomo, ou composta, quando em sua fórmula química há mais de um tipo de átomo ou de íon.
6.9. A partir dessa definição, é possível prever quais tipos de substâncias, simples ou compostas,
são as mais abundantes? Explique e dê exemplos.
No entanto, alguns elementos não-metálicos formam mais de um tipo de substância simples, como por
exemplo o O2 (oxigênio gasoso) e o O3 (ozônio) que são formas alotrópicas do oxigênio.
6.10 O que é alotropia e cite outros exemplos de substâncias alótropas.
6.10 Preencha o quadro abaixo com o número das substâncias simples, compostas ou misturas:
1. ozônio; 2. dióxido de carbono; 3. tricloreto de ferro(III); 4. dicloreto de cobre(II); 5. cloreto de
prata; 6. Nitrogênio gasoso; 7. diamante; 8. sacarose; 9. aço; 10. iodo; 11. carbonato de cálcio;
12. ferro; 13. alumínio; 14. Quartzo; 15. ar atmosférico.
Substância Simples
Substância Composta
Misturas
6.11 Dentre as substâncias compostas na questão anterior qual(is) é(são) considera(s)
molécula(s)?
Neste momento, podemos definir molécula como um conjunto de átomos que têm uma
composição fixa, estrutura e propriedades distintas, sendo eletricamente neutra que possui pelo
menos dois átomos ou uma unidade discreta, todos ligados entre si por ligação covalente. Isto exclui
todos os metais, que se constituem por inúmeros átomos de um único elemento todos ligados entre
si por ligação metálica e também todas as substâncias como o sal de cozinha, cujos átomos ligam-se
por ligação iônica formando um agregado iônico tridimensional e não moléculas.
Apesar do conceito de molécula aparecer em meados do século XVII, com os trabalhos de
Robert Boyle, somente em 1905, quando Albert Einstein mostrou que o movimento browniano
(deslocamento aleatório de partículas em suspensão num meio fluido), estava diretamente
relacionado à colisões de partículas do tamanho de moléculas, que o conceito de molécula foi
melhor abstraído. Contudo, só mais recentemente, em 2009, que a equipe de cientistas da IBM
Suíça liderada pelo pesquisador Leo Gross conseguiu a primeira imagem de uma molécula real,
usando a técnica de microscopia de força atômica. A técnica permitiu o registro da imagem da
molécula de pentaceno imobilizada numa superfície resfriada próximo do zero absoluto (L. Gross,
F. Mohn, N. Moll, P. Liljeroth e G. Meyer, The Chemical Structure of a Molecule Resolved by
Atomic Force Microscopy, Science (2009), 325 (5944), 1110-1114; DOI: 10.1126/science.1176210)
Fórmula de Compostos Iônicos
As fórmulas dos compostos iônicos são em geral as mesmas fórmulas empíricas ou mínimas,
porque estes não são formados por unidades moleculares e sim por agregados de íons. Para que um
composto iônico seja eletricamente neutro, a soma da carga do cátion e do ânion deve ser zero.
Se as cargas forem numericamente diferentes, aplicamos a seguinte regra: “o índice do cátion
é numericamente igual a carga do ânion, e o índice do ânion é numericamente igual a carga do
cátion”.
6.12. Com base nas cargas esperadas para os íons monoatômicos, dê as fórmulas químicas de cada um dos
seguintes compostos:
cloreto de alumínio fluoreto de bário
óxido de cálcio
sulfeto de sódio
nitreto de lítio
6.13. Determine a fórmula unitária, o nome e se eles são solúveis ou insolúveis dos seguintes compostos
iônicos formados entre os seguinte metais e não metais:
Li e F
Ca e Cl
Mg e O
KeS
Mg e N
6.14. Escreva as fórmulas (unitária ou molecular) dos seguintes compostos:
sulfato
cromo(III)
de carbonato
ferro(II)
de cianeto de sódio
nitrato de bário
hipoclorito
sódio
de
Fórmula de Compostos Moleculares
Ao contrário dos compostos iônicos, os moleculares contêm unidades discretas de moléculas.
Eles são formados por elementos não metálicos e geralmente são bivalentes. A nomenclatura é
semelhante aos iônicos, ou seja, o segundo elemento é lido primeiro, com uma terminação
adequada, e depois o primeiro elemento. Para diferenciar compostos moleculares formados pelos
mesmos átomos, mas em quantidade diferente, utiliza-se os prefixos gregos (mono, di, tri, tetra,
penta, hexa, hepta, octa, nona, deca). No entanto, o prefixo grego mono pode ser omitido para o
segundo elemento, por exemplo, PCl3 é chamado de tricloreto de fósforo. Nos óxidos pode ser
omitido a letra “a” do prefixo, por exemplo, N2O4 pode ser chamado de tetróxido de dinitrogênio
em vez de tetraóxido de dinitrogênio.
6.14. Complete o quadro a seguir com o nome do composto
Composto
Nome
Composto
CO2
HCl
HBr
SO3
SiC
NO2
Co
SiCl4
Nome