UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
Análise de sedimento de fundo: uma amostragem representativa
do estuário Potengi/RN
Aécia Seleide Dantas
_______________________________________
Dissertação de Mestrado
Natal/RN, setembro de 2009
Aécia Seleide Dantas
ANÁLISE DE SEDIMENTO DE FUNDO: UMA AMOSTRAGEM
REPRESENTATIVA DO ESTUÁRIO POTENGI/RN
Dissertação
apresentada
ao
Programa de Pós-Graduação em
Química, na Universidade Federal do
Rio Grande do Norte, como parte das
exigências para obtenção do título de
Mestre em Química.
Orientador: Prof. Dr. Djalma Ribeiro da
Silva.
Natal/RN
2009
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial de Química
Dantas, Aécia Seleide.
Análise de sedimento de fundo: uma amostragem representativa do estuário
Potengi/RN. Aécia Seleide Dantas. Natal, RN, 2009.
114 f.
Orientador: Djalma Ribeiro da Silva
Dissertação (Mestrado em Química) - Universidade Federal do Rio Grande do
Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em
Química.
1. Sendimentos – Dissertação. 2. Elementos traço – Dissertação. 3. ICP-OES –
Dissertação. I. Silva, Djalma Ribeiro da. II. Universidade Federal do Rio Grande do
Norte. III. Título.
RN/UFRN/BSE- Química
CDU 551.3.051
Porque o SENHOR dá a sabedoria; da
sua boca é que vem o conhecimento e
o
entendimento.
Ele
reserva
a
verdadeira sabedoria para os retos.
Escudo é para os que caminham na
sinceridade.
Provérbios 2.6-7
AGRADECIMENTOS
Agradeço acima de tudo a Jesus, pela sua misericórdia que se renova a cada
manhã, pois sem ela seria impossível concluir esse trabalho. O seu amor é o que
tenho de mais precioso.
A tio Mozart e sua família por me proporcionar moradia e conforto como uma
verdadeira família.
À minha amada irmã, Airley, por me apoiar em todos os momentos, e por ouvir
minhas neuras durante anos. Não tenho palavras para agradecer a Deus por ter
me dado você como irmã.
Aos meus pais, pelo amor, pelas conversas e pelas orações. É um alívio saber
que posso sempre contar com vocês.
Ao meu amado sobrinho, Ephram Lucas, simplesmente por ter vindo a esse
mundo e fazê-lo um lugar mais alegre com isso.
À minha “prima-irmã” Lorena, você sempre irá morar no meu coração.
Às minhas amigas químicas, Emily, Rina e Verushka, pelos cafés, discussões e
conselhos.
À minha amiga Tarcila pela companhia nas várias horas extras que foram vitais
para conclusão desse trabalho.
Ao prezado e querido Prof. Djalma, pela orientação e incentivo. Eu não poderia ter
melhor orientador.
Ao meu amigo Severino, meu muitíssimo obrigado.
Ao Pr. Fábio Rosseti pelas conversas que sempre me inspiram a procurar mais e
mais a sabedoria. Obrigada por dividir seus conhecimentos sem cobrar nada.
À Wilson Ferreira por sempre ter me ajudado a entender a técnica de ICP-OES.
À CAPES, pelo apoio financeiro, através da bolsa de estudo ao longo de dois
anos.
Ao IDEMA pelo apoio financeiro e por fornecer o mapa do Rio Potengi.
A todos que trabalham comigo no laboratório. Vocês são mais que colegas de
trabalho, são amigos.
RESUMO
Esse trabalho objetiva avaliar, por meio da quantificação, a presença dos
elementos maiores e menores nos sedimentos do estuário Potengi. Para o
estudo, foram definidos quatro pontos de amostragem georeferenciados, onde em
cada um deles foram coletadas amostras de sedimento na calha do rio e nas
margens esquerda e direita. Além disso, foram realizadas medidas de pH,
oxigênio dissolvido, salinidade e condutividade da água in situ no momento da
coleta. Em laboratório foram feitas determinações da porcentagem de matéria
orgânica por Gravimetria e análise granulométrica nas amostras de sedimento.
Para quantificação dos elementos maiores e menores foi realizado um teste
prévio para abertura da amostra com um padrão de sedimento estuarino NIST
1646a para escolha da melhor metodologia a ser adotada. As amostras de
sedimento foram digeridas em microondas com ácido nítrico e ácido clorídrico
segundo metodologia proposta pela US EPA 3051A. As análises quantitativas dos
elementos Al, Fe, Cd, Cr, Cu, Mn, Ni, Pb e Zn foram realizadas por espectrometria
de emissão ótica com plasma acoplado indutivamente (ICP-OES). Através destas
observou-se que as concentrações parciais dos elementos analisados estão
abaixo do folhelho padrão tomado como média mundial descritas por Turekian e
Wedepohl (1961).
Palavras- Chave: Sedimento. Elementos traço. ICP-OES.
ABSTRACT
The aim of this study is to quantify the presence of major and minor
elements in the sediments of estuary Potengi. Four georeferenced sampling points
were used in the study, at which sediment samples were collected in the channel
of the river and on the right and left banks. In addition, dissolved oxygen, salinity
and water conductivity were taken in situ at the time of sample collection. The
percentage of organic matter, determined by gravimetry, and granulometric
analysis of the sediment samples were conducted in the laboratory. To quantify
the major and minor elements a prior test to open the sample was conducted with
standard NIST 1646ª estuarine sediment to choose the best methodology to be
adopted. The sediment samples were dissolved in microwaves with nitric acid and
chloridric acid, according to methodology proposed by US EPA 3051ª.
Quantitative analyses of the elements Al, Fe, Cd, Cr, Cu, Mn, Ni, Pb and Zn were
conducted by inductively coupled plasma optical emission spectrometry (ICPOES). The results showed that the partial concentrations of the elements analyzed
are below average worldwide shale levels, the standard described by Turekian
and Wedepohl (1961).
Keywords: Sediment. trace elements, ICP-OES.
LISTA DE ILUSTRAÇÕES
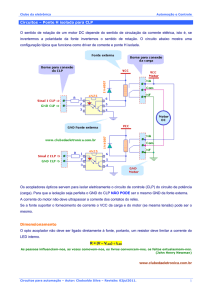
Figura 1
Camadas que compõem o solo................................................
22
Figura 2
Diagrama esquemático de uma fonte de plasma de argônio....
41
Figura 3
Representação da emissão atômica.........................................
43
Figura 4
Fluxograma das Etapas Desenvolvidas no trabalho.................
45
Figura 5
Localização dos pontos de amostragem do estuário Potengi...
47
Figura 6
Ponto E01 - Rio Potengi – Dique da Marinha do Brasil............
50
Figura 7
Ponto E02 - Rio Potengi - Jusante do Canal do Baldo.............
50
Figura 8
Ponto E03 - Rio Potengi - Em frente ao Iate Clube..................
51
Figura 9
Ponto E04 - Rio Potengi - Ponte Newton Navarro....................
51
Figura 10
Gráfico da granulometria do Ponto E01- Margem Direita.........
66
Figura 11
Gráfico da granulometria do Ponto E01- Calha........................
66
Figura 12
Gráfico da granulometria do Ponto E01-Margem Esquerda.....
66
Figura 13
Gráfico da granulometria do Ponto E02- Margem Direita.........
67
Figura 14
Gráfico da granulometria do Ponto E02- Calha........................
67
Figura 15
Gráfico da granulometria do Ponto E02-Margem Esquerda.....
67
Figura 16
Gráfico da granulometria do Ponto E03- Margem Direita.........
68
Figura 17
Gráfico da granulometria do Ponto E03- Calha........................
68
Figura 18
Gráfico da granulometria do Ponto E03-Margem Esquerda.....
68
Figura 19
Gráfico da granulometria do Ponto E04- Margem Direita.........
69
Figura 20
Gráfico da granulometria do Ponto E04- Calha........................
69
Figura 21
Gráfico da granulometria do Ponto E04-Margem Esquerda.....
69
Figura 22
Médias das concentrações do teor de matéria orgânica (%)
encontrada nas amostras de sedimento de fundo....................
Figura 23
Gráficos das concentrações de alumínio no sedimento, em
porcentagem.............................................................................
Figura 24
76
Gráficos das concentrações de manganês no sedimento, em
mg.Kg-1......................................................................................
Figura 26
75
Gráficos das concentrações de ferro no sedimento, em
porcentagem.............................................................................
Figura 25
70
76
Gráficos das concentrações de cádmio no sedimento, em
mg.Kg-1......................................................................................
78
Figura 27
Gráficos das concentrações de chumbo no sedimento, em
mg.Kg-1 ....................................................................................
Figura 28
Gráficos das concentrações de cobre no sedimento, em
mg.Kg-1 ....................................................................................
Figura 29
81
Gráficos das concentrações de cromo no sedimento, em
mg.Kg-1 .....................................................................................
Figura 31
81
Gráficos das concentrações de zinco no sedimento, em
mg.Kg-1 .....................................................................................
Figura 30
79
82
Gráficos das concentrações de níquel no sedimento, em
mg.Kg-1 .....................................................................................
83
Quadro 4.1 Estações de coletas, suas coordenadas e as possíveis fontes
poluidoras..................................................................................
49
Quadro 5.1 Classificação granulométrica dos sedimentos (CONAMA
344/2004*).................................................................................
63
LISTA DE TABELAS
Tabela 4.1
Resultados da média (n = 3) das recuperações dos analitos nas
diferentes extrações parciais (%).................................................
55
Tabela 4.2
Programação do digestor por microondas...................................
56
Tabela 4.3
Condições de operação do ICP-OES...........................................
58
Tabela 4.4
Comprimento de onda, coeficiente de correlação, faixa de
concentração e limites de detecção e quantificação, das curvas
analíticas utilizadas......................................................................
Tabela 5.1
Resultados obtidos na caracterização das amostras de água
nos pontos de amostragem do estuário Potengi/RN...................
Tabela 5.2
62
Resultado da caracterização granulométrica e classificação das
amostras segundo CONAMA 344/2004......................................
Tabela 5.3
59
64
Comparação das médias (n = 3) dos resultados da
porcentagem de matéria orgânica nas amostras de sedimento
e a média (n = 3) dos elementos menores, em mg.Kg-1..............
72
Tabela 5.4
Resultado da média (n = 3) da %MOT.........................................
73
Tabela 5.5
Resultados da Quantificação dos elementos maiores.................
77
Tabela 5.6
Resultados da quantificação dos elementos traço Cd, Cr e Cu...
84
Tabela 5.7
Resultados da quantificação dos elementos traço Ni, Pb e Zn....
84
Tabela 5.8
Comparação da concentração de elementos maiores e
menores em sedimentos de diversos estuários do estado do
-1
RN e do folhelho padrão mundial (em mg.Kg , Al e Fe em %)...
85
LISTA DE ABREVIATURAS E SIGLAS
%OD – Oxigênio Dissolvido e sua Saturação
µg.L-1 – Microgramas por Litro
µM – Micrômetros
APHA – American Public Health Association
CAERN – Companhia de Águas e Esgotos do RN
CETESB – Companhia de Tecnologia de Saneamento Ambiental
CONAMA – Conselho Nacional do Meio Ambiente
COT – Carbono Orgânico Total
DBO – Demanda Bioquímica de Oxigênio
DP – Desvio Padrão
DQO – Demanda Química de Oxigênio
GPS – Global Position Search
ICP-OES – Espectroscopia de Emissão com Fonte de Plasma Indutivamente
Acoplado
LD – Limite de Detecção
m3 – Metros Cúbicos
mg (Pt-Co).L-1 – Miligrama de Platina-Cobalto por Litro
mg.L-1 – Miligrama por Litro
MOT – Teor de Matéria Orgânica
OD – Oxigênio Dissolvido
pH – Potencial Hidrogeniônico
ppb – Partes por Bilhão
ppm – Partes por Milhão
SERHID – Secretaria de Recursos Hídricos
TOG – Teor de Óleos e Graxas
UNT – Unidade Nefelométrica de Turbidez
USEPA – United States Environmental Protection Agency
UTM – Universal Transverse Mercator
SUMÁRIO
1
INTRODUÇÃO.....................................................................................
15
2
OBJETIVOS.......................................................................................... 17
2.1
OBJETIVO GERAL............................................................................... 17
2.2
OBJETIVOS ESPECÍFICOS................................................................
17
3
REVISÃO BIBLIOGRÁFICA................................................................
19
3.1
ÁREA DE ESTUDO..............................................................................
19
3.1.1
Estuários ............................................................................................
19
3.1.1.1 Estuário Potengi ..................................................................................
19
3.2
SEDIMENTOS......................................................................................
20
3.3
PARÂMETROS ANALISADOS NESTE TRABALHO...........................
22
3.3.1
Granulometria.....................................................................................
22
3.3.1.1 Efeito do tamanho das partículas sobre a acumulação de metais
pesados................................................................................................
3.3.2
Teor da matéria orgânica ..................................................................
23
24
3.3.3
Elementos maiores e traços..............................................................
25
3.3.3.1 Alumínio................................................................................................ 27
3.3.3.2 Cádmio.................................................................................................
28
3.3.3.3 Chumbo................................................................................................
29
3.3.3.4 Cobre....................................................................................................
30
3.3.3.5 Cromo...................................................................................................
32
3.3.3.6 Ferro.....................................................................................................
33
3.3.3.7 Manganês.............................................................................................
35
3.3.3.8 Níquel...................................................................................................
36
3.3.3.9 Zinco.....................................................................................................
37
3.4
DIGESTÃO ÁCIDA POR MICROONDAS EM AMOSTRAS DE
SEDIMENTO........................................................................................
3.5
DETERMINAÇÃO DAS ESPÉCIES METÁLICAS................................
3.6
ESPECTROMETRIA DE EMISSÃO ÓPTICA COM PLASMA
38
39
ACOPLADO INDUTIVAMENTE (ICP-OES).........................................
3.6.1
40
Plasma indutivamente acoplado (ICP).............................................. 41
3.6.2
Introdução da amostra líquida..........................................................
3.6.3
Excitação da amostra......................................................................... 42
42
4
MATERIAIS E MÉTODOS...................................................................
45
4.1
FLUXOGRAMA DOS PROCEDIMENTOS...........................................
45
4.2
ÁREA DE ESTUDO..............................................................................
46
4.3
COLETA E ACONDICIONAMENTO DAS AMOSTRAS.......................
51
4.4
MATERIAIS, REAGENTES E VIDRARIAS..........................................
52
4.5
PREPARAÇÃO DAS AMOSTRAS PARA ANÁLISES..........................
4.5.1
53
Secagem das amostras...................................................................... 53
4.6
PARÂMETROS ANALISADOS............................................................. 53
4.6.1
Granulometria.....................................................................................
4.6.2
Determinação da matéria orgânica total nas amostras dos
sedimentos de superfície...................................................................
53
Determinação da concentração das espécies metálicas...............
54
54
4.6.3.1 Digestão ácida por microondas dos sedimentos..................................
56
4.6.3.2 Análise da concentração das espécies metálicas por ICP-OES..........
57
5
RESULTADOS E DISCUSSÃO...........................................................
61
5.1
CARACTERIZAÇÃO DA ÁGUA...........................................................
61
5.2
CARACTERIZAÇÃO GRANULOMÉTRICA.......................................... 63
5.3
TEOR DA MATÉRIA ORGÂNICA......................................................... 70
5.4
APRESENTAÇÃO DOS RESULTADOS DA QUANTIFICAÇÃO DOS
4.6.3
ELEMENTOS........................................................................................
5.4.1
74
Elementos maiores............................................................................. 74
5.4.2
Elementos traços................................................................................ 77
6
CONCLUSÕES E SUGESTÕES.......................................................... 87
6.1
CONCLUSÕES..................................................................................... 87
6.2
SUGESTÕES PARA TRABALHOS FUTUROS...................................
89
REFERÊNCIAS....................................................................................
91
APÊNDICE...........................................................................................
98
1 INTRODUÇÃO
15
1 INTRODUÇÃO
Sedimentos de rios, lagos e oceanos contaminados têm-se tornado
assunto de grande interesse mundial, pois estes estão associados a
contaminantes que podem se distribuir por ressuspensão de partículas do próprio
sedimento, podendo se acumular na cadeia alimentar ou afetar a biota. A
capacidade dos sedimentos em acumular compostos os torna carregadores e
possíveis fontes de poluição à água no ambiente aquático, uma vez que,
alterações no pH, potencial redox ou a presença de quelantes orgânicos podem
promover a redisposição dos metais retidos nos sedimento ( BEVILACQUA et al,
2009). Portanto, a análise de sedimento de rios e riachos tem provado ser uma
ferramenta muito útil nos estudos de poluição, pois as propriedades de acúmulo e
de redisposição de espécies nos sedimentos, os qualificam de extrema
importância em estudos de impacto ambiental, devido registrarem, em caráter
mais permanente, os efeitos de contaminação (ALMEIDA, 2007).
Dentre os compostos indicadores de contaminação ambiental de um corpo
d’água, encontram-se as espécies metálicas, principalmente os metais pesados,
os quais, quando encontrado em grande concentração, merecem maior
preocupação, por serem não degradáveis e, portanto, permanecendo por longos
períodos no ambiente, podendo, inclusive, introduzir-se na cadeia alimentar
através da bioacumulação e gerar efeitos tóxicos e crônicos aos seres humanos.
É importante destacar essa propriedade dos metais, visto que, em pequenas
quantidades, são essenciais aos organismos, mas quando em excesso,
desencadeiam
diversos
problemas,
comunidades
bentônicas,
perifítica,
causando
mortalidade
planctônica,
de
nectônica
peixes
e
e
seres
fotossintetizantes (SILVA, 2002).
Sendo assim, para se avaliar a contaminação dos sedimentos no meio
ambiente aquático, é necessário coletar amostras para definir adequadamente
suas características químicas e físicas. Até o presente, não há um método
definitivo de padronização na amostragem de sedimentos, e, além disso, é
importante escolher bem o método de abertura da amostra, uma vez que existem
diferentes tipos.
Aécia Seleide Dantas - 2009
16
Entre as várias fontes antrópicas de poluição por metais destacam-se:
contaminação por pesticidas, combustão de carvão e óleo, emissões veiculares,
incineração de resíduos urbanos e industriais, água contaminada na irrigação e,
principalmente, atividades de mineração, fundição e refinamento. Apresentamos
alguns exemplos:
• Impurezas em fertilizantes: Cd, Cr, Mo, Pb, U, V e Zn;
• pesticidas: Cu, As, Hg, Pb, Mn e Zn;
• preservativos de madeira: As, Cu e Cr;
• dejetos de produção intensiva de porcos e aves: Cu, As e Zn.
Nas últimas décadas, os corpos d’água da cidade de Natal, em particular o
meio estuarino do Rio Potengi, tem sido submetido aos efeitos da ocupação
desordenada, uso inadequado do solo, lançamento de efluentes domésticos e
industriais, sem qualquer tratamento prévio, gerando pontos críticos de poluição.
Esses fatores constituem potencial fonte de contaminação das reservas hídricas
subterrâneas e superficiais e uma grande ameaça à saúde pública.
Deste modo, tornar-se necessário o monitoramento das condições atuais
do sedimento de fundo do estuário em questão, por meio de um diagnóstico, para
assim avaliar as alterações ambientais ocasionadas e compreender melhor suas
consequências ao ecossistema.
Aécia Seleide Dantas - 2009
17
2 OBJETIVOS
2.1 OBJETIVO GERAL
O objetivo deste trabalho é avaliar, por meio da identificação e
quantificação, a qualidade dos sedimentos do Estuário Potengi, com ênfase na
análise das espécies metálicas, contribuindo, assim, para o diagnóstico dos
problemas ambientais.
2.2 OBJETIVOS ESPECÍFICOS
9 Determinar e quantificar as concentrações dos seguintes elementos:
alumínio, cádmio, chumbo, cobre, cromo, ferro, manganês, níquel e zinco,
nos sedimentos do Estuário Potengi.
9 Caracterizar os sedimentos por meio da análise granulométrica.
9 Determinar o teor de matéria orgânica.
9 Comparar as concentrações parciais das espécies metálicas nos
sedimentos da calha com os das margens direita e esquerda de cada
ponto de amostragem, para avaliar a influência da dinâmica do estuário.
Aécia Seleide Dantas - 2009
3 REVISÃO BIBLIOGRÁFICA
Aécia Seleide Dantas - 2009
19
3 REVISÃO BIBLIOGRÁFICA
3.1 ÁREA DE ESTUDO
3.1.1 Estuários
Zonas costeiras e estuários são ambientes de grande complexidade, nos
quais a água doce proveniente de rios e córregos flui até o oceano onde se
misturam com a água salgada do mar. Nestes estuários, a implantação
desordenada de uma série de atividades econômicas tem causado, nos últimos
anos, uma grande variedade de impactos. Dentre os principais impactos estão à
infiltração de contaminantes nas águas subterrâneas, descargas de efluentes
urbanos e industriais, deposição de resíduos e lixos, influência das atividades
agrícolas e ocupação urbana. Sendo assim, estuários de todo o mundo estão
sujeitos a transformações decorrentes das diversas atividades antrópicas
(COSTA, 2008; FERNANDES, 2001). Estes sistemas são extremamente
dinâmicos: movem-se e mudam constantemente em resposta aos ventos, às
marés e ao escoamento do rio. Daí que a compreensão do transporte e da
distribuição dos poluentes nestes sistemas requer um conhecimento dos
processos físico-químicos e biológicos, além das propriedades dos próprios
contaminantes que ocorrem em tais sistemas. (LANDAJO, 2004).
3.1.1.1 Estuário Potengi
O estuário do Rio Potengi está localizado no litoral oriental do Rio Grande
do Norte, compreendendo uma extensão marinha entre os baixios de Genipabu
(ao norte), até a praia do Meio (ao sul) (ARAÚJO, 2005). Tem como principais
Aécia Seleide Dantas - 2009
20
contribuintes os rios Potengi e Jundiaí. De acordo com o SEMARH (2009), esta
bacia abrange uma superfície de cerca de 4.093,0 Km2, equivalendo a 7,7% do
território estadual. Este estuário apresenta influência tipicamente marinha, onde a
ação das marés penetra com vazões que variam de 5.000 até 20.000 m3. s1
(COSTA, 2008).
Tomando como referência de estudo o estuários do Potengi, é possível
visualizar sinais de poluição nele, onde os possíveis responsáveis são as
atividades realizadas ao longo de sua extensão, e a ocupação populacional
desordenada. Esgotos domésticos e industriais sem tratamento vêm sendo
lançados diretamente no estuário em questão há muitos anos, como o Canal do
Baldo. Esses esgotos são provenientes das habitações urbanas, com uma carga
muito alta de resíduos originados de
instalações
sanitárias,
onde
há
concentrações de matéria orgânica. Os esgotos industriais também são grandes
agentes poluidores ao longo do estuário Potengi, principalmente os originários
das indústrias de beneficiamento de couro e de camarão (CUNHA, 2004).
3.2 SEDIMENTOS
Sedimentos de ambientes aquáticos são constituídos por diferentes formas,
tamanho de partículas minerais e orgânicas com granulometria variada que cobre
o fundo dos rios, lagos, reservatórios, estuários e oceanos (BAIRD, 2002). Sua
composição inclui partículas heterogêneas como colóides, detritos, bactérias,
algas, óxidos, hidróxidos, silicatos, carbonatos, sulfetos e fosfatos (MANAHAN,
2001). Entende-se que um sedimento é geralmente formado por fases sólidas de
elementos majoritários: metais (Fe, Al, Ca, Mn), não metais (C, S, Si e P) e
elementos-traço (Cd, Cr, Cu, Pb, Zn, Ni, etc); precipitados e compostos
hidrolisados
como
Cu2(OH)2CO3,
Pb5(PO4)3Cl,
Pb3(PO4)2,
Zn5(OH)6(CO3)2,
Zn3(PO4)2.H2O e ZnSiO4. Estes elementos podem estar presentes em altas
concentrações devido a processos diagenéticos ou por contaminação, pois
possuem maior tendência a co-precipitar e adsorver no material particulado
(LEMES, 2001).
Aécia Seleide Dantas - 2009
21
O sedimento tem um papel importante em relação à presença de metais,
pois, dependendo do ambiente em que se encontram, podem representar uma
fonte de liberação ou um sumidouro para os metais provenientes das águas
(FROEHNER, 2008). As concentrações totais de metais no sedimento não
indicam necessariamente a ocorrência de contaminação por fontes externas, pois
dependem do material de origem do sedimento e de suas propriedades. Por esse
motivo, o estudo das concentrações parciais dos metais, da granulometria das
amostras e da matéria orgânica é fundamental para se entender a dinâmica dos
metais em um ambiente aquático (ZAMBETTA, 2006).
O estudo de processos relacionados ao comportamento químico,
transporte e acúmulo de poluentes, principalmente metais pesados em rios e
estuários, apresenta relevância, não só para controle ambiental, mas também
para o entendimento dos mecanismos geoquímicos que ocorrem nestes
ambientes. Rejeitos industriais, esgotos domésticos, estruturas geoquímicas e
atividades de mineração são as principais fontes potenciais de poluição por
metais pesados do meio ambiente em geral. No ecossistema aquático, esses
metais têm recebido considerável atenção nos últimos anos, em virtude do seu
acúmulo e do potencial risco toxicológico à biota local (HORTELLANI et al., 2008).
Dentre as justificativas de se estudar a contaminação dos sedimentos por
espécies metálicas as duas mais importantes são:
1) a presença desses contaminantes nos sedimentos de rios, estuários e águas
marinhas costeiras, implicam em potencial degradação desses ambientes;
2) e a contaminação dos sedimentos pode vir a deteriorar continuamente a
qualidade da água de mananciais, mesmo após a redução ou completa
eliminação das emissões.
Aécia Seleide Dantas - 2009
22
3.3 PARÂMETROS ANALISADOS NESTE TRABALHO
3.3.1 Granulometria
O solo é um meio complexo e heterogêneo, produto de alteração do
remanejamento e da organização do material original (rocha, sedimento ou outro
solo), sob a ação dos seres vivos, da atmosfera e das trocas de energia que ali se
manifestam. É constituído por quantidades variáveis de minerais, matéria
orgânica, água, ar e organismos vivos, que incluem plantas, bactérias, fungos,
protozoários, invertebrados e outros animais (MEDEIROS, 2009). Dependendo da
espécie mineralógica que o originou e dos mecanismos de intemperismo e
transporte, o solo apresenta diferentes camadas que são constituídas das
frações: areia, siltes ou argilas, as quais são representadas na figura 1.
Figura 1 - Camadas que compõem o solo. Adaptado de NASCIMENTO, 2008.
Existem
diferentes
técnicas
para
a
determinação
da
distribuição
granulométrica no solo com base em diversos princípios físicos e que medem
propriedades distintas relacionadas com o tamanho das partículas, sempre
Aécia Seleide Dantas - 2009
23
consideradas esféricas. O Método de Espalhamento de Luz Laser, também
chamado de Difração Fraunhofer, utiliza, como princípio, a interação de um feixe
de luz com partículas em um meio fluido. Quando um feixe de luz monocromático
e colimado de um laser He-Ne atinge uma quantidade de partículas, parte desta
luz é submetida a um espalhamento, parte é absorvida e parte é transmitida. No
espalhamento, a luz pode ser difratada, refratada e refletida. Neste método, um
conjunto de lentes, detectores foto-elétrico e um microprocessador irão captar a
intensidade da energia espalhada e transformá-la em distribuição volumétrica das
partículas, assumindo-se, a princípio, que as partículas têm formato esférico
(RAWLE, 2002).
3.3.1.1 Efeito do tamanho das partículas sobre a acumulação de metais pesados
Constituídos de frações mineralógicas que possuem partículas de
tamanhos, formas e composições químicas distintas, os sedimentos constituem
vastas áreas de terras e suas propriedades dependem acentuadamente da
origem e do transporte sofridos por eles. (MANAHAM, 2001; BAIRD, 2002;
MENDES, 2006).
Esta variabilidade nos sedimentos tem importantes consequências, pois a
mineralogia e o conteúdo de elementos traço dependem do tamanho das
partículas. As partículas mais finas (aquelas com diâmetro menor que 4
micrometro, chamada fração pelítica ou argila), por exemplo, geralmente são
pobres em quartzo e feldspato potássico, mas ricas em minerais de argila, como
caulinita, montmorilonita, muscovita e paragonita, em relação às partículas mais
grossas (frações silte entre 4 e 63 micrometros, e areia maior que 63 micrometro).
A fração pelítica também é enriquecida em ferro, sob a forma de óxidos de ferro
ou como ferro associado às argilas, e em matéria orgânica. A fração fina contém
não apenas uma grande proporção de argila, ferro e matéria orgânica, mas
também elevadas concentrações de elementos traço (GARLIPP, 2006).
A literatura tem mostrado que, quanto mais fina for a textura do
solo/sedimento, maior será o teor de metais nele encontrado (ZAMBETA, 2006).
Isso se deve ao fato de que nas frações mais finas tem-se uma maior razão área
Aécia Seleide Dantas - 2009
24
superficial/tamanho do grão (SANTOS et al., 2006). Sedimentos contaminados,
frequentemente mostram um enriquecimento similar de metais nas frações mais
finas e autores têm sugerido que o grau de contaminação pode ser melhor
estimado pela análise da fração pelítica (BOSTELMANN, 2006). Contudo, existem
situações nas quais os metais contaminantes atingem as frações mais grossas do
sedimento. Por exemplo as atividades de mineração e fundição de lixo, pois,
podem em alguns casos aumentar a concentração de metais nas frações mais
grossas em relação às frações mais finas. Portanto, é importante se determinar as
concentrações de metais em várias frações de sedimentos contaminados, como
também no sedimento de regiões livres de contaminação (HOROWITZ, 1991;
WARREN, 1981 citado por GARLIPP, 2006).
3.3.2 Teor de matéria orgânica
A matéria orgânica desempenha um importante papel no meio aquático,
através da formação de complexos estáveis com os elementos metálicos (BAIRD,
2002). As substâncias orgânicas são capazes de complexar metais e aumentar a
solubilidade destes. Além do mais, alteram a distribuição entre as formas
oxidadas e reduzidas dos metais, a toxicidade do metal e a biodisponibilidade
para a vida aquática, além de influenciar em que extensão os metais são
adsorvidos na matéria suspensa.
Esta matéria orgânica está intimamente ligada aos elementos Cu, Zn e Fe
nos sedimentos de lagos e ao Cu nos sedimentos de rios, podendo ser agrupada
em substâncias húmicas e não húmicas. As substâncias não húmicas são
substâncias com características químicas definidas, tais como, polissacarídeos,
aminoácidos, açúcares, proteínas e ácidos orgânicos de baixa massa molar. Já as
substâncias húmicas não apresentam características químicas e físicas bem
definidas e se dividem em ácidos húmicos e ácidos fúlvicos, com base nas suas
características de solubilidade (VICENT-BECKETT et al.,1991).
Tais materiais húmicos têm uma grande afinidade pelos cátions de metais
pesados, de maneira que os extraem da água por meio de processos de troca
iônica. A fixação de cátions metálicos ocorre, em grande parte, por meio da
Aécia Seleide Dantas - 2009
25
formação de complexos com íons metálicos através dos grupos COOH dos ácidos
húmicos e fúlvicos (BAIRD, 2002). Essa excepcional capacidade de complexação
de metais pelo ácido húmico, está diretamente ligada ao teor de oxigênio
encontrado na estrutura na forma de grupos carboxílicos e fenólicos.
A matéria orgânica tem uma boa capacidade de adsorção para metais
pesados, e essa esta tende a diminuir na seqüência Cu, Zn, Pb, Cr, Ni e Cd.
(SOARES et al.,1999 citado por MARIANI, 2006). Uma importante propriedade
física da matéria orgânica está associada à textura fina dos sedimentos, contendo
geralmente uma porcentagem natural de material húmico, derivado de
transformações biológicas de plantas e detritos de animais. O material húmico
pode estar presente como uma discreta partícula ou como uma camada em
partículas de argila, pois ele aumenta a afinidade do sedimento com os metais
(FORSTNER & WITTMANN, 1981 citado por LIRA, 2008). Esta afinidade pode
tanto concentrar metais no ambiente, impactando-o, quanto pode ser empregada
na remoção de metais em ambientes impactados.
A matéria orgânica nos sedimentos pode ser originada de fontes naturais e
antrópicas. Contudo, a ação antrópica tem sido responsável por alterações
significativas nos fluxos de materiais principalmente nas zonas costeiras, devido a
quatro principais fatores: queima de combustíveis fósseis com conseqüente
emissão de C, N e S; mudanças no uso do solo, resultando em aumentos no
transporte de carbono orgânico, sedimentos e nutrientes para a zona costeira;
aplicação de fertilizantes contendo P e N; e descargas de esgotos domésticos
(CARREIRA
&
WAGENER,
2003
citado
por
NASCIMENTO,
2008).
A
sedimentação de metais pesados dissolvidos é favorecida, dentre outros
parâmetros, pela elevada concentração de compostos orgânicos no meio.
3.3.3 Elementos maiores e traços
As espécies metálicas são amplamente distribuídas pela crosta terrestre e,
juntamente com os outros elementos, fazem parte da estrutura cristalina das
rochas.
Aécia Seleide Dantas - 2009
26
Alguns elementos como Co, Fe, Mn, Mo, Ni, Se e V são essenciais em
funções fisiológicas e bioquímicas. O Cu, Cr e Zn também podem ser
considerados essenciais, porém, em altas concentrações passam a ser tóxicos.
Outros elementos como Hg, Ag, As, Cd e Pb não têm funções biológicas
conhecidas e são comprovadamente tóxicos para o homem.
Falando em toxicidade, esta é a propriedade dos agentes tóxicos de
promoverem efeitos nocivos às estruturas biológicas através de interações físicoquímicas. A toxicidade de qualquer substância depende da quantidade ingerida
por um determinado organismo (LEMES, 2001). Por outro lado, as espécies
metálicas são essenciais para a sobrevivência do homem e para o funcionamento
da sociedade moderna, onde as transformações de matérias primas em produtos
manufaturados tornaram-se uma condição necessária para a vida e o
desenvolvimento do homem.
A origem das espécies metálicas nos corpos hídricos provém de fontes
difusas, podendo ser dividida em geogênica e antropogênica. Fontes industriais e
urbanas foram identificadas como a causa primária da poluição por metais tóxicos
(CLARK, 2001). O lixiviamento dos solos urbanos e as emissões industriais são
as mais significativas fontes destes elementos para corpos receptores de água
nos arredores dos grandes centros urbanos e de zonas industriais.
As espécies metálicas ocorrem naturalmente no meio ambiente através da
desagregação das rochas. No entanto, a introdução destes elementos através das
atividades antrópicas pode alterar enormemente os ciclos biogeoquímicos
naturais dos mesmos em corpos hídricos (SALOMONS et al., 1995). Os efluentes
domésticos e industriais, além da drenagem urbana e rural, contribuem com
grandes quantidades de poluição por metais pesados para os ambientes
aquáticos, sendo que estas descargas ocorrem de modo pontual e podem levar a
uma carga local excessiva de metais pesados na água (STUMM E MORGAN,
1996).
Em geoquímica, os elementos são classificados de acordo com a sua
abundância na crosta terrestre em (LIRA, 2008):
•
Elementos maiores, quando a sua concentração é superior a 1,0 %
(maior que 10.000 ppm);
Aécia Seleide Dantas - 2009
27
•
elementos menores, quando a sua concentração está compreendida
entre 1,0 e 0,1 % (entre 1.000 e 10.000 ppm);
•
elementos traços, quando a sua concentração é inferior a 0,1 % (menor
que 1.000 ppm).
Neste trabalho usaremos essa classificação geoquímica para se referir à
concentração das espécies metálicas encontradas no sedimento de fundo.
3.3.3.1 Alumínio
A maior parte do alumínio existente na crosta terrestre ocorre em
aluminosilicatos e argilas, mas também é encontrado na caulinita (Al2(OH)4Si2O3),
porém o mineral mais importante é a bauxita e ambos são minerais insolúveis. A
bauxita é uma mistura complexa de hidróxidos de alumínio hidratado e óxido de
alumínio. Este último é conhecido como a alumina, que na natureza ocorre como
rubi, safira, coríndon e esmeril (HARRIS, 2005, SHRIVER, 2008).
No lençol freático, devido à sua baixa solubilidade, os teores de alumínio
geralmente não atingem alguns centésimos ou décimos de mg/L. Entretanto,
devido ao processo de acidificação dos solos, onde o pH atinge valores inferiores
a 5,0, há um aumento na dissolução de seus óxidos ou hidróxidos (MEDEIROS,
2009)
Numa concentração de 130 μg/L, o alumínio mata os peixes. A principal via
de exposição humana não ocupacional é pela ingestão de alimentos e água. A
dose fatal para o homem é considerada de 550 a 600 mg. Provoca efeitos no
coração, constrição dos vasos sangüíneos, elevando a pressão arterial e
causando efeitos sobre o sistema nervoso (CETESB, 2004).
O alumínio tem sido frequentemente usado como fator de normalização
para as concentrações de elementos traço em sedimentos, devido a sua elevada
concentração natural, além de fazer parte da estrutura dos minerais argilosos
(BROWNLOW, 1996 citado por GARLIPP, 2006).
Aécia Seleide Dantas - 2009
28
3.3.3.2 Cádmio
Metal de consistência mole, branco, brilhante, cuja superfície escurece
rapidamente em contato com o ar e que não oxida facilmente. Este pode ser
encontrado em elevadas concentrações em rochas sedimentares e fosfatos
marinhos. O cádmio apresenta-se nas águas devido às descargas de efluentes
industriais, principalmente as galvanoplastias, produção de pigmentos, soldas,
equipamentos eletrônicos, lubrificantes e baterias recarregáveis (Ni/Cd). É
também usado como inseticida. A queima de combustíveis fósseis consiste
também numa fonte de cádmio para o ambiente (COSTA, 2008; GARLIPP, 2006;
MENDES, 2006; ALMEIDA, 2007).
O cádmio tem mais mobilidade em ambientes aquáticos do que a maioria
dos outros metais. É encontrado em água de superfície ou subterrânea como o
íon Cd2+ hidratado, ou como um complexo iônico com outras substâncias
inorgânicas ou orgânicas. Enquanto as formas solúveis podem migrar na água; o
cádmio, em complexos insolúveis ou adsorvido a sedimentos, é relativamente
imóvel (LABUNSKA et al., 2000). Este último se associa principalmente aos
carbonatos e óxidos de Fe e Mn, em sedimentos oxidados (ROSENTAL et al.,
1986). Em sedimentos anóxicos. O Cd se associa quase que exclusivamente a
sulfetos (SALOMONS et al., 1987), sendo que os complexos de sulfeto e cádmio
são moderadamente solúveis; portanto a mobilidade do Cd em ambientes
redutores pode ser elevada.
A exposição humana ao cádmio ocorre pela ingestão de água e alimentos
contaminados
(é
um
elemento
bioacumulativo).
Os
efeitos
agudos
da
contaminação por cádmio em humanos são muito sérios e abrangem irritação
local nas vias aéreas, tosse persistente, dispnéia, dores toráxicas, náuseas e
vômito quando o Cd é inalado. O cádmio não apresenta até o presente, alguma
função biológica conhecida que o torne necessário ou essencial para os seres
vivos.
Aécia Seleide Dantas - 2009
29
3.3.3.3 Chumbo
As maiores fontes naturais de chumbo são emissões vulcânicas e
intemperismo geoquímico (WHO, 1995). É obtido a partir dos seus minérios como
sulfetos, sendo o principal deste elemento a galena, (PbS) que sob a ação do
oxigênio são convertidos em óxido (PbO), e podem ser reduzidos pelo carbono
em alto forno (SHRIVER, 2008; ATKINS & JONES, 2006):
O Pb é um metal mole de coloração branca-azulada, tornando-se
acinzentado quando exposto ao ar, e é também resistente à corrosão (COSTA,
2008; NASCIMENTO, 2008). Suas principais fontes antrópicas são a indústria
extrativa, a petrolífera, acumuladores, tintas, corantes, gráfica e bélica. A
produção mundial de chumbo é de aproximadamente 43 milhões de toneladas por
ano. Na forma metálica ele geralmente é recuperado e reciclado, mas a maior
parte do Pb usado na forma de composto é perdida para o meio ambiente
(ARAÚJO, 2005; NASCIMENTO, 2008).
O chumbo é depositado nos lagos, rios e oceanos, proveniente da
atmosfera ou do escoamento superficial do solo, oriundo de fontes naturais ou
antropogênicas. O metal que alcança a superfície das águas é adsorvido aos
sólidos suspensos e sedimentos. De acordo com Nascimento (2008), nos
sistemas aquáticos, grande parte do chumbo conduzido pelos rios se encontra na
forma insolúvel. Esta forma consiste em partículas de carbonato de chumbo,
óxido de chumbo, hidróxido de chumbo ou outros compostos incorporados em
outros componentes do material lixiviado do solo.
As concentrações de chumbo em sedimentos costeiros e estuarinos não
contaminados variam, geralmente, entre 5 e 30 μg/Kg de peso seco, sendo que a
maior parte do chumbo nos sedimentos se encontra associada ao conteúdo da
matéria orgânica presente e ao tamanho das partículas. Na ausência de espécies
complexantes solúveis, o chumbo é quase que totalmente adsorvido na forma de
espécies que se precipitam a pH maior que 6 (ALVES, 2001; NASCIMENTO,
2008). O chumbo residual (que faz parte da matriz mineral das partículas do
sedimento) em locais não contaminados, está associado principalmente com
aluminossilicatos, minerais de sulfetos e barita (BaSO4) podendo representar até
80 % do chumbo total. Este chumbo residual é imóvel e não biodisponível.
Aécia Seleide Dantas - 2009
30
Quando o chumbo é lançado no meio ambiente, ele tende a se acumular em solos
e sedimentos, onde, devido à baixa solubilidade, pode permanecer acessível à
cadeia alimentar e ao metabolismo humano por muito tempo.
O chumbo entra em contato com o homem pela inalação do ar atmosférico,
ingestão de água ou alimento contaminado. A absorção depende da concentração
do chumbo e do tempo de exposição, das propriedades físico-químicas do
composto, idade e estado fisiológico do indivíduo, e dos níveis de Ca, Mg, Fe, P e
vitamina D presentes na dieta. O chumbo tem sido responsável por sérios
problemas de intoxicação por ser um metal que apresenta efeito cumulativo no
organismo. As exposições crônicas causam vários males ao sistema nervoso,
como por exemplo, encefalopatia, irritabilidade, cefaléia, tremor muscular,
alucinações,
perda
de
memória
e
capacidade
de
concentração.
Suas
intoxicações, com concentração de chumbo entre 100 a 120 μg/dL de sangue em
indivíduos adultos e de 80 a 100 μg/dL de sangue em crianças, podem provocar
anorexia, constipação, apatia, vômitos, fadiga, anemia, gosto metálico na boca,
sede, entre outros (FIGUEIREDO, 1997; LEE, 2000; ARAÚJO, 2005; ALMEIDA,
2007).
3.3.3.4 Cobre
O minério mais comum do cobre é a calcopirita, CuFeS2. Outros minérios
são o sulfeto Cu2S, carbonato básico de cobre, CuCO3•Cu(OH)2, e o bornita
Cu5FeSO4. Está presente também na turquesa CuAl6(PO4)4(OH)8•4H2O que é
uma pedra semipreciosa, apreciada por sua coloração azul.
O cobre sofre oxidação na presença da umidade do ar, oxigênio e dióxido
de carbono. Dentre suas propriedades destacam-se a elevada condutividade
térmica e elétrica, maleabilidade, resistência à corrosão, capacidade de se
amalgamar e aspecto agradável (WHO, 1998). A combinação única das
propriedades desse metal determina sua ampla variadade de aplicações, sendo
usado na indústria elétrica, em tubulações de água, em ligas com Zn, Ni, P e Sn,
como supercondutor de altas temperaturas (YBa2Cu3O7), nas indústrias de
cachaça, algicidas, fungicidas, inseticidas, como conservante de madeiras e
Aécia Seleide Dantas - 2009
31
pinturas em cascos de navios (LEE, 2000; HARRIS, 2005; ARAÚJO, 2005;
MEDEIROS, 2009).
As principais fontes naturais do cobre são poeiras, emissões vulcânicas,
incêndios florestais, processos biogênicos e névoas aquáticas. As fontes
antropogênicas incluem a galvanoplastia, corrosão de tubos de cobre e de latão
por águas ácidas, fungicidas usados na preservação da madeira e efluentes de
esgotos sanitários, a emissão pelas atividades de mineração e fundição, pela
queima de carvão como fonte de energia e pelos incineradores de resíduos
municipais (ARAÚJO, 2005).
Em ambientes aquáticos o cobre ocorre tanto na forma solúvel como na
particulada e coloidal, sendo estas duas últimas as mais freqüentes. A fração
solúvel pode conter tanto o íon livre, como o cobre complexado a ligantes
orgânicos e inorgânicos. Sua especiação em águas naturais é influenciada pelo
pH, oxigênio dissolvido e pela presença de agentes oxidantes e compostos ou
íons complexantes. Sua toxicidade nesse meio depende da presença de
componentes orgânicos e da alcalinidade. O cobre é mais tóxico em baixas
alcalinidades (GARLIPP, 2006; ALMEIDA, 2007). Na água do mar este elemento
se encontra principalmente na forma de carbonato de cobre, ou em águas de
baixa salinidade, como hidróxido de cobre.
Em sedimento, o cobre é rapidamente adsorvido dependendo do tipo de
sedimento, do pH, dos cátions presentes, da presença de ligantes e dos óxidos de
manganês e ferro (ALVES, 2001; ALMEIDA, 2007; COSTA, 2008). A quantidade
de matéria orgânica apresenta uma grande influência na forma como o cobre se
encontra no sedimento. Quando esse teor é baixo, a maior parte do cobre que ele
contém se encontra na fração residual associado à rede silicática das argilas. Em
condições contrárias o cobre se associa principalmente aos sulfetos e à matéria
orgânica. Em sedimentos desprovidos de oxigênio, o cobre pode reagir com
diferentes espécies orgânicas e inorgânicas de enxofre, formando uma grande
variedade de complexos solúveis e insolúveis, como, por exemplo, a calcocita
(Cu2S), covelita (CuS), entre outros. Esses sulfetos apresentam baixa mobilidade
e biodisponibilidade (NASCIMENTO, 2008).
O cobre é um metal que ocorre naturalmente no ambiente, sendo um
elemento essencial para a fotossíntese nas plantas, bem como no metabolismo
animal. Uma pessoa adulta tem no organismo cerca de 100 mg de cobre. É a
Aécia Seleide Dantas - 2009
32
terceira maior quantidade de um metal de transição, inferior apenas ao Fe (4 g) e
ao Zn (2 g). Embora pequenas quantidades de cobre sejam essenciais, em níveis
elevados (doses entre 4 e 400 mg de Cu/Kg de peso) pode produzir efeitos
nocivos como, por exemplo, irritação no nariz, boca e olhos, como também
vômitos, diarréia, cólicas estomacais, náuseas e até a morte (ATSDR, 2004;
MEDEIROS, 2009).
3.3.3.5 Cromo
O cromo é um metal duro, quebradiço e apresenta alto ponto de fusão e
baixa volatilidade, tem coloração cinza aço, sem odor e muito resistente à
corrosão. Apenas as formas, trivalente Cr3+ e hexavalente Cr6+, são consideradas
de importância biológica (WHO, 1988). O único minério de cromo de importância
comercial é a cromita (FeCr2O4), do qual o metal é obtido por redução com
carbono em um forno de arco elétrico. O cromo é encontrado naturalmente em
rochas, animais, plantas, solo, poeiras e névoas vulcânicas (WHO, 1988). O metal
é importante na metalurgia porque é usado na fabricação de aço inoxidável e na
cromagem.
Pode ser introduzido no organismo por via oral, dérmica ou pulmonar e sua
absorção depende do seu estado de oxidação. Na forma trivalente, o cromo é
essencial ao metabolismo humano e sua carência causa doenças, já na forma
hexavalente é tóxico e cancerígeno. (LEE, 2000; ALMEIDA, 2007; MENDES,
2006; FIGUEIREDO, 1997).
Em ambientes aquáticos, o Cr6+ apresenta-se, predominantemente, na
forma solúvel. Essas formas solúveis podem ser estáveis o suficiente para
sofrerem o transporte entre meios, e, eventualmente, é convertido em Cr3+ por
ação de espécies redutoras como substâncias orgânicas, sulfeto de hidrogênio,
enxofre, amônio e nitrito. Essa forma trivalente geralmente não migra
significativamente em sistemas naturais. Ao contrário, ela é rapidamente
precipitada e adsorvida a partículas suspensas e sedimentos de fundo, por isso,
geralmente Cr3+ é mais abundante do que Cr6+ em sedimentos. No entanto,
mudanças nas propriedades químicas e físicas do ambiente aquático podem
Aécia Seleide Dantas - 2009
33
ocasionar mudanças no equilíbrio entre as formas trivalente e hexavalente. Quase
todo o cromo hexavalente existente no meio ambiente é proveniente das
atividades humanas (SILVA, 2001). Dentre as principais atividades humanas, nas
quais o cromo e seus compostos são liberados para o meio ambiente, estão as
emissões decorrentes da soldagem de ligas metálicas, fundições, manufatura do
aço e ligas, indústria de galvanoplastia, minas, incineração de lixo, curtumes, e
fertilizantes (WHO, 1988).
As concentrações de cromo total em sedimentos marinhos e estuarinos
não contaminados geralmente variam de 50 a 100 µg.g-1 peso seco. As pequenas
quantidades de Cr+6 em sedimentos geralmente estão firmemente ligadas à
matéria orgânica e ao óxido de ferro que cobre as partículas de argila. Nos
estuários que recebem cromo proveniente de curtumes e placas elétricas, mais de
80% do cromo total encontrado no sedimento está associado à matéria orgânica e
aos sulfetos. Já em sedimentos oxidados menos contaminados, o cromo
freqüentemente encontra-se adsorvido aos óxidos de ferro (50 a 70%), de acordo
com Kersten & Forstner (1986) citado por Garlipp (2006). Mais de 70% do cromo
em sedimentos não contaminados podem estar associados à fração residual, não
biodisponível.
3.3.3.6 Ferro
Quase todas as rochas e solos contêm menos traços de ferro
(GUIMARÃES, 2007; LIMA, 2001). O ferro tem como principais minérios: a
hematita, Fe2O3, a magnetita, Fe3O4, a limonita, FeO(OH), e a siderita, FeCO3.
Em virtude de afinidades geoquímicas, quase sempre é acompanhado pelo
manganês. Suas características estão relacionadas com seus estados de
oxidação e seu comportamento está ligado ao ciclo do carbono, oxigênio e
enxofre. O ferro puro é um metal de cor branco-prateado, maleável, muito reativo,
e facilmente oxidável (LIMA, 2001). Devido a essas características tornou-se um
elemento indispensável à indústria, sendo empregado formando ligas com outros
metais, resultando em uma grande variedade de tipos de aço indispensáveis ao
desenvolvimento e manutenção da sociedade moderna.
Aécia Seleide Dantas - 2009
34
Entre as fontes antropogênicas de ferro de origem industrial estão, as
emissões pelas atividades de mineração, fundição e soldagem. Nas de origem
urbana estão os efluentes de esgotos e o escoamento superficial urbano (LIMA,
2001; ABU-HILAL, 1990).
O ferro é um elemento essencial a todas as formas de vida e sua
importância biológica reside na sua função de transporte de elétrons em plantas e
animais (citocromos e ferredoxinas), no transporte de oxigênio no sangue de
animais mamíferos, no armazenamento de oxigênio na mioglobina; sendo,
portanto, essenciais para a vida animal e vegetal, quando presente em pequenas
doses. Do contrário, é tóxico, causando irritação da parede gastrintestinal,
problemas cardiovasculares e respiratórios, entre outros (LEE, 2000; ALMEIDA,
2007).
Em águas não poluídas, seu teor varia em função da litologia da região e
do período chuvoso, quando pode acontecer carreamento de solos com teores
mais elevados de ferro (ALMEIDA, 2007). A forma reduzida do ferro torna-se
+3
solúvel principalmente sob a forma de bicarbonato, ou íons Fe em equilíbrio com
o Fe(OH) , após sua oxidação (ESTEVES, 1998).
3
O ferro que se acumula no sedimento estuarino é oriundo de esgotos
domésticos, industriais e ainda da área portuária. Pode ocorrer sob a forma de
óxidos hidratados, de partículas coloidais ou na cobertura de outras partículas
minerais, podendo transportar metais pesados. Em ambientes estuarinos é
comum ocorrerem variações no Eh, devido a fatores que tornam o ambiente
anóxico. Desta forma, mudanças de fase podem ocorrer transformando em
sulfetos, os metais pesados que estivessem na forma de óxidos hidratados,
adsorvidos e co-precipitados. Assim, de acordo com esses fatores, os óxidos
hidratados de ferro, bem como os sulfetos, podem ser considerados
concentradores de metais pesados em sedimentos estuarinos (FIGUEIREDO,
1997).
Aécia Seleide Dantas - 2009
35
3.3.3.7 Manganês
Os compostos de Mn mais importantes, do ponto de vista ambiental, são
aqueles que contem Mn nos estados de oxidação +2, +4 e +7 (WHO, 1999). O
manganês é um metal que se apresenta como um sólido, frágil, quebradiço,
lustroso ou como um pó branco-acinzentado. (WHO, 1981). Ele reage lentamente
com H2O, liberando H2, e se dissolve facilmente em ácidos diluídos. O metal
finamente dividido é pirofórico quando exposto ao ar, mas o metal maciço não
reage a não ser quando aquecido. Além disso, apresenta pontos de fusão e de
ebulição elevados (ALMEIDA, 2007; LEE, 2000). Encontra-se largamente
distribuído na natureza, onde os óxidos, os carbonatos e os silicatos constituem
os compostos mais abundantes. Este elemento tem muitas aplicações na
indústria, sendo usado na indústria siderúrgica, para obter ligas, além de ser um
importante aditivo na fabricação do aço, fogos de artifício, pilhas e baterias secas,
fertilizantes, em compostos orgânicos para secagem de tintas e reagentes
químicos (LEE, 2000; GARLIPP, 2006; ALMEIDA, 2007; LARINI, 1997).
Este elemento é essencial para o homem assim como para grande
variedade de organismos vivos. O Mn2+ é importante tanto em enzimas animais
como em enzimas vegetais. Porém, o excesso de Mn no organismo pode causar
problemas neurológicos. Além disso, em pequenas quantidades é um elemento
essencial ao crescimento das plantas, daí sua aplicação em fertilizantes (LEE,
2000; GARLIPP, 2006).
Em águas naturais o manganês ocorre em pequenas concentrações devido
à lixiviação de minerais e solos, raramente são encontrados na água em
concentrações superiores a 1,0 mg/L (MARTINS, 2001). O comportamento do
manganês nas águas é muito semelhante ao do ferro em seus mais diversos
aspectos. Este metal desenvolve coloração negra na água, podendo se
apresentar em ambas as formas, dissolvida e em suspensão, nos estados de
oxidação Mn2+ (mais solúvel) e Mn4+ (menos solúvel). Os óxidos de manganês
são eficientes aprisionadores de metais-traço, assim como os óxidos de ferro.
Pequenas partículas dos óxidos de manganês ou camadas destes em outras
partículas encontram-se vastamente distribuídas em rios e solos; ou seja, é
freqüentemente transportado nos rios adsorvido em sedimentos suspensos,
Aécia Seleide Dantas - 2009
36
dependendo principalmente da capacidade de troca iônica do cátion (WHO, 1999;
GARLIPP, 2006; ALMEIDA, 2007).
A presença deste metal no solo e na água pode ser originária de produtos
e descargas industriais, rejeitos de minas, fertilizantes e determinados tipos de
desinfetantes (MENDES, 2006; ALMEIDA, 2007; MARTINS, 2001).
3.3.3.8 Níquel
O níquel é um metal branco-prateado, brilhante, muito dúctil e maleável,
razoavelmente duro, que pode ser facilmente forjado e soldado, com boa
condutividade térmica e elétrica (LEE, 2000; ARAÚJO, 2005). Ele se combina
com outros metais para formar ligas altamente resistentes à temperatura e à
corrosão, que são utilizadas na cunhagem de moedas e fabricação de jóias.
Também é usado em baterias de acumuladores, placas elétricas, veículos,
armamentos, utensílios domésticos e como catalisadores (ALMEIDA, 2007;
GARLIPP, 2006; ARAÚJO, 2005).
A maior fonte desse elemento para o meio ambiente, pela atividade
humana, é a queima de combustíveis fósseis, todavia existem outros contribuintes
principais, como os processos de mineração e fundição do metal, a incineração
do lixo, a galvanoplastia, os esgotos sanitários e a liberação dos resíduos das
indústrias que utilizam o níquel, ligas e compostos, no seu processo de fabricação
ou fundição (MENDES, 2006; ARAÚJO, 2005). Em seres humanos, a toxicidade
do níquel tem como principais sintomas de intoxicação: náuseas, vômito, diarréia,
vertigens, fraqueza, dor de cabeça e falta de ar (GARLLIP, 2006).
Em ambientes aquáticos a maior parte do Ni encontra-se na forma
particulada, havendo urna grande deposição em estuários. É um elemento
relativamente abundante em solos e sedimentos, sendo que suas concentrações
giram em torno de 50 μg.g-1 de peso seco em sedimentos marinhos e estuarinos.
O Ni é um contaminante significativo de sedimentos em áreas industrializadas.
Encontram-se sedimentos com altos níveis de contaminação provenientes da
dragagem de portos e canais por onde passam navios, bem como sedimentos
contaminados por esgotos (CLARK, 2001). A concentração deste elemento
Aécia Seleide Dantas - 2009
37
encontra-se com freqüência correlacionada positivamente com a quantidade de
argila dos sedimentos. Como também pode ser encontrado nos sedimentos ligado
a matéria orgânica, principalmente nos ácidos húmicos e fúlvicos, e em locais
onde possam ocorrer processos de troca iônica (ALVES, 2001). Em sedimentos
oxidados, a maior parte do níquel potencialmente biodisponível encontra-se
complexado com óxidos/ hidróxidos, carbonatos e silicatos de ferro e manganês.
Assim, a biodisponibilidade do níquel em sedimentos geralmente é baixa
(SIQUEIRA, 2006).
3.3.3.9 Zinco
O zinco é um metal de coloração prateada, brilhante quando polido, que se
torna ligeiramente opaco ao entrar em contato com o ar, devido à formação de
uma camada autoprotetora de óxido ou carbonato. Apresenta baixos pontos de
fusão e ebulição. Em quase todas as rochas ígneas o zinco ocorre em
quantidades mínimas. Seus principais depósitos são sulfetos sob a forma de
esfalerita (ZnS) (ARAÚJO, 2005; LEE, 2000).
O zinco é usado em grandes quantidades na metalurgia, principalmente
como constituinte do latão e bronze, e na galvanização, em que é depositado
como uma camada para inibir a corrosão do aço, na fundição de peças metálicas,
em pilhas secas, equipamentos para automóveis, produtos de uso médico e
dentário, antibióticos fungicidas e lubrificantes, cosmética, cerâmicas e em
indústrias gráficas (LEE, 2000; ARAÚJO, 2005; GARLIPP, 2006; ALMEIDA,
2007).
O zinco é considerado um elemento essencial no metabolismo de plantas e
animais. Por ser um elemento essencial para o ser humano, só se torna
prejudicial à saúde quando ingerido em concentrações muito altas, o que é
extremamente raro. Neste caso, pode acumular-se nos tecidos do organismo
humano; isso só ocorre quando as taxas de ingestão diária são elevadas
(COSTA, 2008; CETESB, 2004).
Aécia Seleide Dantas - 2009
38
Na natureza, o zinco é encontrado como sulfeto, muitas vezes associado a
outros elementos metálicos como chumbo, cádmio, cobre e ferro (SIQUEIRA,
2006). Na água, no sedimento e no solo, o transporte e liberação deste elemento
dependem da forma como ele se apresenta e das características físicas e
químicas do meio. O valor do pH influencia diretamente o zinco, que em
condições ácidas ele pode estar presente na fase aquosa em sua forma iônica.
Já, em condições básicas, pode precipitar ou formar compostos orgânicos
complexos, os quais podem acarretar o aumento da sua mobilidade. Sua
concentração nos sedimentos associa-se aos óxidos de ferro e manganês, e sua
concentração nos solos é governada pelos processos de adsorção/desorção,
precipitação/dissolução, complexação e oxirredução, que podem ser influenciados
por diversas propriedades dos solos, tais como pH, conteúdo de argila, teor de
matéria orgânica e capacidade de troca catiônica (RUSSEL, 1994; MARTINEZ e
MOTTO, 2000 citado por SOUZA, 2006).
A maior parte do zinco nos sedimentos encontra-se na fração residual, o
que o torna não biodisponível (ALMEIDA, 1997; ARAÚJO, 2005; GARLIPP, 2006).
O zinco residual geralmente está associado à rede cristalina das argilas e a uma
variedade de minerais pesados, incluindo cromita (FeCr2O4), ilmenita (FeTiO2) e
magnetita (Fe3O4). A esfalerita (ZnS) e a zincita (ZnO) são importantes
carreadores de zinco residual em alguns sedimentos (LORING, 1982 citado por
GARLIPP, 2006 ). O zinco não residual em muitos sedimentos oxidados encontrase associado principalmente às frações de óxidos de ferro e manganês. Já em
sedimentos reduzidos, a maior parte do zinco se associa com sulfetos e matéria
orgânica (ROSENTAL et al., 1986).
3.4 DIGESTÃO ÁCIDA POR MICROONDAS EM AMOSTRAS DE SEDIMENTO
Na literatura mundial, observa-se uma grande variação nas metodologias
de extração de metais em amostras de sedimento. Tem-se digestão total,
digestão parcial e extrações seqüenciais, com mudanças na fração usada e
diferentes misturas ácidas no processo de solubilização de metais, o que torna
Aécia Seleide Dantas - 2009
39
difícil a escolha da metodologia e a comparação entre os diversos trabalhos
(PEREZ-SANTANA, 2007).
O procedimento de digestão total inclui de maneira geral as misturas dos
ácidos nítrico, clorídrico e fluorídrico (HCI:HNO3 e HF). Essas misturas são
capazes de colocar em solução os elementos químicos que estejam associados a
todas fases ou fração geoquímica, ou seja, as frações adsorvidas, trocáveis,
oxidáveis, reduzidas e residual. As quatro primeiras correspondem às frações
lábeis e a última à fração associada à estrutura cristalina dos minerais, (FISZMAN
et al., 1984 citado por AGUIAR, 2007). Apesar das misturas ácidas, que utilizam
HF em sua composição, serem bastante eficiente no processo de solubilização da
matriz a ser avaliada; seu uso torna-se desnecessário, pois metais associados à
estrutura mineralógica de silicatos de origem litogênica, não caracterizam
contaminação antrópicas, o que provavelmente não daria contribuição ao estudo
de contaminação do meio ambiente.
3.5 DETERMINAÇÃO DAS ESPÉCIES METÁLICAS
Um dos maiores desafios para o estudo do comportamento de metais, em
amostras ambientais, reside na complexidade dessas matrizes, por apresentarem
muitas espécies em concentrações abaixo do nível de detecção das técnicas
empregadas. Embora as concentrações de cada espécie sejam muito baixas, elas
contribuem de forma significativa para a contaminação da biota aquática, além de
colaborar para o desequilíbrio do sistema aquático.
Alguns
dos
problemas
predominantes
associados
à
determinação
experimental são as baixas sensibilidades das técnicas e os processos de
abertura de amostras.
Aécia Seleide Dantas - 2009
40
3.6 ESPECTROMETRIA DE EMISSÃO ÓPTICA COM PLASMA ACOPLADO
INDUTIVAMENTE (ICP-OES)
A espectrometria de emissão óptica com fonte de plasma indutivamente
acoplado (ICP-OES) é amplamente utilizada para análises ambientais e
tradicionalmente utilizada para a análise de solos e sedimentos (YABE, 1995;
BETTINELLI, 2000). A técnica de ICP-OES tem sido utilizada amplamente devido
a uma série de vantagens que oferece, tais como: análise multielementar
simultânea e rápida de elementos maiores, menores e traço, alta sensibilidade,
precisões adequadamente altas e ampla faixa linear (LEMES, 2001).
A técnica de ICP-OES é baseada na medida da intensidade da radiação
emitida, quando um átomo ou íon excitado pelo plasma retorna ao seu estado
fundamental. A excitação da espécie ocorre quando seus elétrons mais externos
têm seu nível de energia aumentado, passando do estado fundamental para o
excitado. O elétron não é estável em níveis mais altos de energia, portanto
retorna ao seu estado fundamental, emitindo a energia que foi absorvida, sob a
forma de radiação eletromagnética.
As espécies atômicas emitem linhas espectrais, tantas quantas forem suas
possíveis transições eletrônicas. As linhas espectrais é que vão determinar o
espectro de cada elemento e a intensidade de cada linha vai depender da
probabilidade de transição e do número de átomos que atinge um determinado
estado excitado. A radiação emitida é direcionada para uma lente que tem a
função de ampliar e focalizar a zona de descarga luminosa do plasma quando
projetada sobre a fenda de entrada, promovendo uma melhor iluminação da rede
de difração. Após passar pela lente, a luz emitida direciona-se à fenda de entrada
do separador de linhas e chega ao monocromador, onde um prisma ou uma rede
de difração isola a linha medida. Em amostras de matrizes complexas, a escolha
da linha isenta de sobreposições é necessária para funcionamento ideal da
técnica. Essa é uma das razões pelas quais, a linha de maior intensidade nem
sempre seja a escolhida.
Aécia Seleide Dantas - 2009
41
3.6.1 Plasma indutivamente acoplado (ICP)
O plasma é por definição um gás parcialmente ionizado onde co-existem
elétrons livres e íons positivos em movimento, em um processo onde ocorre
transferência de energia por radiação, condução e aquecimento Joule entre
outros.
Na Figura 2 tem-se representado o esquema da tocha (quartzo) que é a
configuração que sustenta o plasma, circundada por uma bobina de indução
(resfriada a água ou ar) através da qual a energia de até 2-3 kW é fornecida,
sendo o gerador de freqüência de 27 ou 40 MHz.
Figura 2 – Diagrama esquemático de uma fonte de plasma de argônio
O plasma de argônio é formado na tocha que é constituída por três tubos
concêntricos. O fluxo de argônio que flui tangencialmente entre o tubo exterior e
intermediário (12-18 L min-1) é chamado gás refrigerante ou gás do plasma e atua
para formar o plasma e refrigerar a tocha. O tubo intermediário carrega o gás
argônio auxiliar num fluxo de 1,0 L min-1. A energia para manter a tocha do
plasma é fornecida por um gerador de radiofreqüência acoplado no plasma por
Aécia Seleide Dantas - 2009
42
meio de uma bobina de indução (bobina Tesla). O tubo central é o que conduz a
amostra em forma de aerossol para o plasma (0,7-1,5 L min-1) que é chamado de
gás de arraste (GUINÉ, 1998).
3.6.2 Introdução da amostra líquida
A amostra é introduzida seguindo na forma de aerossol produzido por
nebulizadores pneumáticos ou por nebulizadores ultra-sônicos. O nebulizador de
Fluxo Cruzado tem uma boa resistência ao ácido fluorídrico (HF) e não entope
facilmente. Ele suporta solução contendo 5 % de sal. Para soluções com alta
concentração de sal o nebulizador tipo spray (V-Groove) é o mais adequado. O
nebulizador tipo “Meinhard” dá uma boa sensibilidade para soluções com
concentração salina abaixo de 1 %. O seu tipo ultra-sônico requer uma
concentração salina muito menor do que os nebulizadores pneumáticos (Fluxo
Cruzado, Meinhard e V-Groove), e resulta um aumento de sensibilidade da ordem
de 10 a 50 vezes (SKOOG, 2006). Os nebulizadores pneumáticos produzem um
aerossol altamente disperso com gotículas de até 100 µm de diâmetro, sendo a
maioria das partículas retidas pela câmara de nebulização, aquelas com diâmetro
menor do que 10 µm, quando se emprega a combinação de nebulizadores
pneumáticos e câmara de nebulização convencional.
3.6.3 Excitação da amostra
A amostra em solução, por meio da nebulização, transforma-se em
aerossol, o qual, após desolvatação, passa a partícula seca que, por volatizaçãodissociação, vai para a forma de vapores atômicos–vapores iônicos, os quais são
excitados na forma de átomos-íons. O mecanismo de excitação é colisional. A
tendência dos elétrons excitados é de voltarem ao estado fundamental e, ao
fazerem isso, devolvem como energia de emissão, em que os comprimentos de
onda são característicos de cada elemento (Figura 3) e a intensidade da linha do
Aécia Seleide Dantas - 2009
43
espectro de emissão é proporcional à concentração do elemento em
determinação. (OLIVEIRA, 1998 citado por LEMES, 2001).
Figura 3 - Representação da emissão atômica
Aécia Seleide Dantas - 2009
4 MATERIAIS E MÉTODOS
45
4 MATERIAIS E MÉTODOS
Este capítulo faz uma descrição da metodologia adotada para o
desenvolvimento deste estudo, e traz também uma exposição da área de
amostragem, além de relacionar os materiais utilizados nas etapas experimentais
e descrever os procedimentos laboratoriais na fase analítica.
Para
facilitar
a
compreensão
dos
textos
apresentados
na
parte
experimental desta dissertação, apresentamos abaixo, um fluxograma dos
procedimentos seguidos conforme mostrado na figura 4.
4.1 FLUXOGRAMA DOS PROCEDIMENTOS
Figura 4 - Fluxograma das etapas desenvolvidas no trabalho.
Aécia Seleide Dantas - 2009
46
4.2 ÁREA DE ESTUDO
As coletas das amostras de sedimento foram realizadas em 4 (quatro)
estações no Estuário do Rio Potengi no trecho compreendido entre as pontes de
Igapó e a Newton Navarro (conforme descrito na Figura 5), no dia 17 de
Novembro de 2008, na maré baixa. Para cada estação de amostragem foram
realizadas coletas na calha e nas margens, esquerda e direita, todas em
triplicatas, para com isso detectarmos a variabilidade das concentrações dos
elementos nas amostras de sedimentos de uma mesma região.
Para identificação dos pontos de coleta foi usado um sistema de
navegação, o Sistema de Posicionamento Global (GPS), que é geralmente
escolhido como uma técnica de posicionamento exata, de fácil operação e
economicamente mais disponível se comparado a outros sistemas mais
sofisticados.
Os pontos das coletas estão apresentados na Figura 5.
Aécia Seleide Dantas - 2009
47
Figura 5 - Localização dos pontos de amostrage.
Aécia Seleide Dantas - 2009
48
O Quadro 3.1, mostrado a seguir, apresenta os pontos de coleta
identificando suas coordenadas em UTM. Todos os locais de amostragem foram
estabelecidos de forma a assegurar que as amostras fossem as mais
representativas possíveis para a caracterização do estuário, levando em
consideração os efluentes lançados próximos aos locais de amostragem.
As Figuras 6, 7, 8 e 9 mostram fotos dos locais de amostragem.
Aécia Seleide Dantas - 2009
49
Quadro 4.1. Estações de coletas, suas coordenadas e as possíveis fontes poluidoras.
PONTOS
LOCAL E REFERÊNCIA
UTM X
UTM Y
253.654
9.360.036
253.741
9.359.810
E 01 – Margem Esquerda
253.727
9.359.520
E 02– Margem Direita
254.705
9.360.478
254.950
9.360.238
E 02 – Margem Esquerda
255.042
9.360.132
E 03– Margem Direita
255.391
9.362.390
255.625
9.362.294
E 03 – Margem Esquerda
255.872
9.362.236
E 04– Margem Direita
255.921
9.363.350
256.093
9.363.298
256.301
9.363.074
E 01 – Margem Direita
E 01 – Calha
E 02 – Calha
E 03 – Calha
E 04 – Calha
E 04 – Margem Esquerda
Rio Potengi - Dique da Marinha do Brasil
Rio Potengi - Jusante do Canal do Baldo
Rio Potengi - Em frente ao Iate Clube
Rio Potengi - Ponte Newton Navarro
POSSÍVEIS FONTES POLUIDORAS
Lançamento de esgoto pela CAERN
do bairro das Quintas, Natal
Lançamento de esgoto do Canal do
Baldo, Natal.
Proximidade dos tanques de
armazenamento da PETROBRAS, e
trânsito de embarcações de pesca.
Foz do Rio Potengi
Aécia Seleide Dantas - 2009
50
Figura 6 - Ponto E01 - Rio Potengi – Dique da Marinha do Brasil
Figura 7 - Ponto E02 - Rio Potengi - Jusante do Canal do Baldo
Aécia Seleide Dantas - 2009
51
Figura 8 - Ponto E03 - Rio Potengi - Em frente ao Iate Clube
Figura 9 - Ponto E04 - Rio Potengi - Ponte Newton Navarro
4.3 COLETA E ACONDICIONAMENTO DAS AMOSTRAS
Os procedimentos de limpeza e descontaminação dos materiais foram
realizados em laboratório com solução de ácido nítrico 10% e água ultra pura.
Para a coleta do sedimento foi utilizado um amostrador do tipo van Veen,
pertencente ao grupo dos amostradores de superfície do tipo busca-fundo. Os
amostradores
pontuais
de
superfície
ou
busca-fundo
são
geralmente
Aécia Seleide Dantas - 2009
52
equipamentos leves, podendo ser utilizados em embarcações pequenas e
permitem rapidez na coleta das amostras (MEDEIROS, 2009).
As amostras foram coletadas em frascos de polietileno e durante o
transporte foram acondicionadas e mantidas refrigeradas à temperatura de 4°C.
Após chegada no laboratório as amostras foram conservadas a -18ºC até o
momento do preparo para posteriores análises.
Também foram realizadas, in loco, medidas das condições ambientais tais
como pH, teor de oxigênio dissolvido, temperatura, salinidade e condutividade das
águas.
4.4 MATERIAIS, REAGENTES E VIDRARIAS
O HNO3 utilizado neste trabalho era de grau PA (para análise), sendo
adquirido junto a TEDIA. O HCl, também era de grau PA, sendo adquirido junto a
MERCK. Os padrões dos metais Al, Fe, Mn, Cd, Pb, Cr, Cu, Ni e Zn,
são
específicos para ICP-OES (Espectrometria de Emissão Atômica com plasma
indutivo acoplado) e foram adquiridos junto a SpecSol e são rastreáveis ao NIST.
No preparo das soluções foi utilizada água ultrapura. O padrão de referência para
sedimento utilizado neste trabalho foi o 1646a – Estuarine Sediment – NIST.
No preparo dos padrões foram utilizados balões volumétricos calibrados e
micropipetas da marca Gilson nos volumes requeridos.
Aécia Seleide Dantas - 2009
53
4.5 PREPARAÇÃO DAS AMOSTRAS PARA ANÁLISES
4.5.1 Secagem das amostras
Toda amostra coletada foi homogeneizada, e uma alíquota quarteada foi
levada a uma estufa com circulação de ar por 16 horas à 60°C. Após serem
retiradas da estufa, foram colocadas em dessecador para resfriamento. Em
seguida, a amostra foi peneirada em peneira de aço inoxidável com malhas de 1
mm e desaglomerada em cadinho de porcelana. As amostras mais argilosas
necessitaram ser desaglomeradas antes de peneiradas.
4.6 PARÂMETROS ANALISADOS
4.6.1 Granulometria
A quantificação das frações granulométricas nas amostras de sedimento e
foi determinada em um granulometro da Microtrac S3500 Particle Size Analyser,
usando o Método de Espalhamento de Luz Laser, também chamado de Difração
Fraunhofer, que utiliza, como princípio, a interação de um feixe de luz com
partículas em um meio fluido. Cada amostragem foi analisada em quintuplicata.
Aécia Seleide Dantas - 2009
54
4.6.2 Determinação da matéria orgânica total nas amostras dos sedimentos
de superfície
O teor de matéria orgânica nas amostras de sedimento foi obtido por
calcinação. Antes das análises os cadinhos de porcelana foram levados a 500°C
na mufla para uma possível descontaminação. Primeiramente as amostras de
sedimento foram secas em estufa a 100°C por 16 horas para obtenção do peso
seco, e após resfriamento em dessecador foi pesado aproximadamente 1,0 g de
cada amostra e colocado em cadinho de porcelana. Em seguida, os cadinhos
foram levados à mufla a 360°C por 5 horas. Após esfriarem em dessecador, os
cadinhos contendo as amostras foram novamente pesados. A diferença de peso
obtida foi considerada a quantidade de matéria orgânica perdida na calcinação.
Cada amostra foi analisada em triplicata (GARLIPP, 2006).
Segundo Kralik (1999), nas metodologias que usam temperaturas
superiores a 400ºC a água contida na rede cristalina do carbonato de magnésio e
dos argilominerais de granulação muito fina e eliminada a essa temperatura, o
que pode resultar em uma superestimação do conteúdo de matéria orgânica no
sedimento.
4.6.3 Determinação da concentração das espécies metálicas
Devido os sedimentos serem considerados amostras de matriz complexa,
difíceis de tratar, a eleição de uma técnica de preparação química para este tipo
de amostra é muito importante. Com isso em mente, foi realizado um teste prévio
com o material de referência de sedimento de fundo de estuário, NIST 1646a (que
tem classificação granulométrica silte, utilizando três diferentes proporções de
mistura de ácidos, para escolha de qual extração parcial usar, baseado na
recuperação dos analitos.
Aécia Seleide Dantas - 2009
55
As misturas dos ácidos foram:
•
10mL de HNO3 – Metodologia segundo USEPA 3051A
•
9 mL de HNO3 + 3 mL de HCl - Metodologia segundo USEPA 3051A
•
3 mL de HNO3 + 9 mL de HCl - Água régia
A metodologia da USEPA (3051A) para análise de metais em sedimento de
fundo, com extração ácida por microondas, indica uso do ácido nítrico
concentrado para essa extração parcial. Porém, ela sugere o uso do ácido
clorídrico em conjunto com o ácido nítrico no caso de haver na solução, altos
níveis de alumínio, que é o caso das amostras de sedimento. Isso se mostrou
verdadeiro nesse teste prévio, como pode ser observado na Tabela 4.1, onde as
melhores recuperações dos analitos foram com essa mistura dos ácidos, com
exceção do Cd.
Tabela 4.1 Resultados da média (n = 3) das recuperações dos analitos nas diferentes extrações
parciais (%)
Analitos
10mL de HNO3
9 mL de HNO3
+ 3 mL de HCl
3 mL de HNO3
+ 9 mL de HCl
Cd
114,41 ± 0,008
129,37 ± 0,003
126,64 ± 0,007
Cr
54,87 ± 0,12
60,03 ± 0,24
58,37 ± 0,83
Cu
90,85 ± 0,22
98,93 ± 0,16
96,97 ± 0,66
Ni
73,68 ± 0,11
81,09 ± 0,24
76,51 ± 0,67
Pb
80,64 ± 0,19
89,97 ± 0,22
88,88 ± 0,44
Zn
81,41 ± 1,89
91,24 ± 0,31
87,59 ± 2,73
A partir desses resultados a metodologia escolhida foi a US EPA 3051A
com adição de HCl.
Aécia Seleide Dantas - 2009
56
4.6.3.1 Digestão ácida por microondas dos sedimentos
O ataque ácido em sistema fechado ou sistema de digestão em
microondas tem sido empregado com sucesso por vários investigadores
(NADKARNI, 1984 citado por GARLIPP, 2006). Esta técnica consiste em colocar
a amostra e os ácidos num copo de teflon hermeticamente fechado e submetê-la
a tratamento em forno de microondas. O sistema de microondas usa uma
combinação de ácido, temperatura e pressão, que permite a dissolução da
amostra, pois o ponto de ebulição aumenta com o aumento da pressão.
As concentrações parciais dos metais (AI, Cr, Cd, Cu, Fe, Mn, Ni, Pb e Zn)
foram obtidas a partir da digestão de 0,50 g da amostra de sedimento, no sistema
de digestão em microondas contendo 9 mL de HNO3 e 3 mL de HCl, seguindo a
metodologia do USEPA – 3051A, uma vez que ela se mostrou mais adequada
para amostras de sedimento de fundo, conforme estudo prévio, como citado
anteriormente.
A Tabela 4.2, a seguir, mostra a programação usada na digestão das
amostras.
Tabela 4.2 Programação do digestor por microondas.
TEMPO (minutos)
POTÊNCIA (W)
6
300
7
800
7
0
5
800
15
0
Após a digestão as amostras foram filtradas em papel de filtro quantitativo
e avolumadas para 35 mL em frascos de polietileno com água ultrapura para
leitura no ICP-OES.
Aécia Seleide Dantas - 2009
57
4.6.3.2 Análise da concentração das espécies metálicas por ICP-OES
As amostras foram analisadas em um Espectrômetro de Emissão Atômica
com Plasma Indutivo Acoplado, da marca Thermo Scientific, modelo iCAP 6300
Duo, com rede de difração Echelle e detector CID.
Como foi mencionado anteriormente, os metais analisados foram: alumínio
(Al), cádmio (Cd), cromo (Cr), cobre (Cu), ferro (Fe), manganês (Mn), níquel (Ni),
chumbo (Pb) e zinco (Zn). Soluções-padrão multi-elementar foram utilizadas para
calibração do instrumento, sendo preparadas a partir de uma solução de 1000
mg/L a concentrações específicas para cada elemento.
A escolha dos comprimentos de onda para amostras com matrizes
complexas exige um trabalho cuidadoso uma vez que interferentes são
frequentes, como é o caso de amostras de sedimento, as quais quando digeridas
em ácido produzem soluções com elementos maiores, em concentrações
elevadas, e elementos traços. Um desses elementos maiores é o Fe que
apresenta várias linhas de emissão e, com isso, torna-se interferente de
elementos como o Cu e Cd em algumas linhas de emissão. Isso ocorre devido a
proximidade das linhas de emissão, que o equipamento não é capaz de separar
por causa do alto sinal do Fe e do baixo sinal do elemento que está na
concentração de traço nessa solução.
Segue na Tabela 4.3 as condições de operação do ICP-OES para as
análises realizadas.
Aécia Seleide Dantas - 2009
58
Tabela 4.3 Condições de operação do ICP-OES
PARÂMETROS
VALORES
Nº Replicatas
5
Visão
Axial
Tempo de integração – Altos comprimentos de onda
10 seg
Tempo de integração – Baixos comprimentos de onda
10 seg
RF power
1150 W
Gás auxiliar
0,5 L/min
Pressão da câmara de nebulização
0,16 MPa
Tipo nebulizador
Mira Mist
Os resultados obtidos das leituras das amostras no ICP-OES são dados
em µg.L-1 , mas para interpretação dos dados os mesmos foram convertidos em
porcentagem para Al e Fe, e os demais elementos foram calculados para mg.Kg-1.
Os comprimentos de onda (λ) escolhidos, os coeficientes de correlação e
as faixas de concentração das curvas analíticas, como também os limites de
detecção e quantificação, são apresentados na Tabela 4.4 a seguir.
Aécia Seleide Dantas - 2009
59
Tabela 4.4 Comprimento de onda, coeficiente de correlação, faixa de concentração e limites de detecção e quantificação, das curvas analíticas utilizadas
LIMITE DE
ANALITO
λ (nm)
COEFICIENTE DE
FAIXA DE
CORRELAÇÃO
CONCENTRAÇÃO
LIMITE DE
QUANTIFICAÇÃO
DETECÇÃO (mg/L)
(mg/L)
Al
396,152
0,9994
1-50 (mg/L)
0,24
0,83
Cd
214,438
0,9999
1-100 (µg/L)
0,0003
0,001
Cr
267,716
0,9999
10-2000 (µg/L)
0,0007
0,002
Cu
324,754
0,9999
10-2000 (µg/L)
0,0006
0,002
Fe
259,940
0,9999
1-50 (mg/L)
0,58
1,96
Mn
260,569
0,9995
1-50 (mg/L)
0,05
0,17
Ni
216,556 / 232,003
0,9999
10-1000 (µg/L)
0,0005
0,002
Pb
220,353
0,9999
10-1000 (µg/L)
0,0007
0,002
Zn
206,200
0,9999
100-5000 (µg/L)
0,0007
0,002
Aécia Seleide Dantas - 2009
5 RESULTADOS E DISCUSSÃO
Aécia Seleide Dantas - 2009
61
5 RESULTADOS E DISCUSSÃO
Os
resultados
obtidos
na
caracterização
da
água,
na
análise
granulométrica, no teor de matéria orgânica e na quantificação dos elementos
analisados nas amostras coletadas no estuário Potengi, estão dispostos nesse
capítulo, bem como a discussão feita após a interpretação de cada um deles.
Todas as metodologias de análises foram seguidas conforme manual de análises
de águas APHA - Standard Methods for the Examination of Water and
Wastewater, 1998; e normas da USEPA.
5.1 CARACTERIZAÇÃO DA ÁGUA
A análise dos parâmetros físico-químicos da água como temperatura, pH e
oxigênio dissolvido são importantes, pois estes fatores influenciam fortemente no
teor de metais adsorvidos nos sedimentos. A temperatura da água tem forte
correlação com o pH e há correlação de algumas variáveis com a pluviosidade.
Uma delas é com o pH que aumenta com as chuvas devido a um provável efeito
de diluição dos ácidos orgânicos liberados por um determinado trecho de solo
para dentro do rio.
A Tabela 5.1 mostra todos os resultados obtidos na caracterização das
amostras de água para todos os pontos de amostragem.
Aécia Seleide Dantas - 2009
62
Tabela 5.1 Resultados obtidos na caracterização das amostras de água nos pontos de amostragem do estuário Potengi/RN.
E013
E023
E033
E043
VLP*
pH
7,78
7,96
8,18
8,10
6,0 a 9,01; 6,5 a 8,52,3
OD (mg.L-1)
6,52
5,95
7,77
7,18
;≥ 5,01,2 ;;≥ 6,0 ,3
DBO (mg.L-1)
9,15
5,25
6,00
8,55
≤ 5,0 1
COT (mg.L-1)
2,10
1,24
1,04
0,42
≤ 3,02,3
2,11
2,98
2,30
3,29
PARÂMETROS
Nitrogênio Total (mg.L-1)
-1
+
++ 1
≤ (0,03 e 0,05 ) ; ≤0,124 2; ≤ 0,0623
Fósforo Total (mg.L )
0,121
0,082
0,038
0,048
Sólidos Totais (mg.L-1)
36.162,65
37.061,43
37.407,12
37.891,08
-
8,61
9,31
7,38
8,70
≤ 1001
0,008
0,009
0,008
0,008
≤ 0,009 1; ≤ 0,005 2,3
Chumbo Total (mg.L-1)
< 0,001
< 0,001
< 0,001
< 0,001
≤ 0,01 1, 2,3
Cromo Total (mg.L-1)
< 0,001
< 0,001
< 0,001
< 0,001
≤ 0,05 1, 2,,3
Cádmio Total (mg.L-1)
< 0,001
< 0,001
< 0,001
< 0,001
≤ 0,001 1; ≤ 0,005 2,
Zinco Total (mg.L-1)
0,015
0,023
0,017
0,008
≤ 0,18 1; ≤ 0,09 2,3
Níquel Total (mg.L-1)
0,008
0,008
0,007
0,007
≤ 0,025 1, 2,3
Temperatura da amostra (0C)
28,60
28,70
29,15
28,80
-
Clorofila ‘a’ (µg.L )
2,01
2,01
1,80
1,70
≤ 301
Salinidade (g Kg-1)
33,80
34,60
35,10
35,60
Nitrogênio Amoniacal (mg.L-1)
< 0,10
< 0,10
< 0,10
< 0,10
0,5‰1; > 0,5 e < 30 ‰2; ;≥ 30 ‰3
(3,7 p/ pH =7,5 - 2,0 p/ 7,5 < pH =8 1 p/ 8<pH=8,5 e 0,5 p/ pH > 8,5)1;
0,40 2,3
Turbidez (NTU)
Cobre dissolvido (mg.L-1)
-1
*
VLP–Valores Limites Permitidos em mg/L para águas doces classe 2, salobras classe 1 e salinas classe 1, segundo Resolução CONAMA N° 357/20051 .
Águas doces, 2 Águas salobras, 3Águas salinas. E01-Em frente ao dique da Base Naval; E02-Jusante do canal do baldo; E03-Em frente ao Iate Clube;
E04-Vão central da ponte Nilton Navarro.
1
Aécia Seleide Dantas - 2009
63
5.2 CARACTERIZAÇÃO GRANULOMÉTRICA
O estudo da Granulometria é de fundamental importância na avaliação das
características químicas e físicas dos sedimentos, pois pode influenciar nas
condições ambientais.
O Quadro 4.1 e a Tabela 5.2 mostram a classificação granulométrica
segundo a Resolução 344, de 25 de março de 2004 do Conselho Nacional do
Meio Ambiente (CONAMA) e os resultados obtidos das análises granulométricas
dos sedimentos, respectivamente.
Quadro 4.1 Classificação granulométrica dos sedimentos (CONAMA 344/2004*)
CLASSIFICAÇÃO
Phi (φ)**
(mm)
Areia muito grossa
-1 a 0
2a1
Areia grossa
0a1
1 a 0,5
Areia média
1a2
0,5 a 0,25
Areia fina
2a3
0,25 a 0,125
Areia muito fina
3a4
0,125 a 0,062
Silte
4a8
0,062 a 0,00394
Argila
8 a 12
0,00394 a 0,0002
*Referência: Escala Granulométrica de Wentworth, 1922.
** Phi (φ) corresponde à unidade de medida do diâmetro da partícula do sedimento, cuja
equivalência em milímetros (mm) é apresentada na coluna 3 do Quadro acima.
Aécia Seleide Dantas - 2009
64
Tabela 5.2 Resultado da caracterização granulométrica e classificação das amostras segundo
CONAMA 344/2004.
AMOSTRAS
(mm)*
CLASSIFICAÇÃO
0,195 ± 0,02
Areia fina
0,332 ± 0,008
Areia média
0,089 ± 0,008
Areia muito fina
0,128 ± 0,015
Areia fina
0,461 ± 0,026
Areia média
E 02 – Margem Esquerda - Média
0,038 ± 0,002
Silte
E 03– Margem Direita - Média
0,293 ± 0,02
Areia média
E 03 – Calha - Média
0,202 0,021
Areia fina
E 03 – Margem Esquerda - Média
0,031 ± 0,008
Silte
E 04– Margem Direita - Média
0,189 ± 0,002
Areia fina
E 04 – Calha - Média
0,245 ± 0,176
Areia fina
E 04 – Margem Esquerda - Média
0,083 ± 0,004
Areia muito fina
E 01 – Margem Direita - Média
E 01 – Calha - Média
E 01 – Margem Esquerda - Média
E 02– Margem Direita - Média
E 02 – Calha - Média
*Diâmetros a 50%.
As frações de sedimentos de grãos finos (< 62 µm) compõem a parte de
maior poder de adsorção de contaminantes. Nas frações acima de 62 µm, que é
considerada essencialmente areia, nota-se um decréscimo linear no conteúdo de
metais, devido à menor razão área superficial/tamanho do grão e a mudança na
composição química.
Dos resultados encontrados nesse trabalho, apenas dois pontos, o E02-ME
e E03-ME, tem fração granulométrica silte, onde há maior capacidade de adsorver
metais. Todas as demais amostras são predominantemente compostas por areia,
que variou entre muito fina e média. Porém, observando-se os gráficos da análise
granulométrica (Figuras 10 a 21), vemos que para a margem esquerda (mangue)
dos pontos E01, E02 e E03 que a amostra é composta por granulometria variada.
Aécia Seleide Dantas - 2009
65
E que há, mesmo em pequena quantidade uma fração de silte, o que pode levar a
um aumento do teor de metais adsorvidos nessa área.
As Figuras correspondentes aos resultados das análises de granulometria
obtidas das amostras de sedimento estão representadas na Figuras de 10 a 21.
Aécia Seleide Dantas - 2009
66
Figura 10 - Gráfico da granulometria do Ponto E01- Margem Direita
Figura 11 - Gráfico da granulometria do Ponto E01- Calha
Figura 12 - Gráfico da granulometria do Ponto E01-Margem Esquerda
Aécia Seleide Dantas - 2009
67
Figura 13 - Gráfico da granulometria do Ponto E02- Margem Direita
Figura 14 - Gráfico da granulometria do Ponto E02- Calha
Figura 15 - Gráfico da granulometria do Ponto E02-Margem Esquerda
Aécia Seleide Dantas - 2009
68
Figura 16 - Gráfico da granulometria do Ponto E03- Margem Direita
Figura 17 - Gráfico da granulometria do Ponto E03- Calha
Figura 18 - Gráfico da granulometria do Ponto E03-Margem Esquerda
Aécia Seleide Dantas - 2009
69
Figura 19 - Gráfico da granulometria do Ponto E04- Margem Direita
Figura 20 - Gráfico da granulometria do Ponto E04- Calha
Figura 21 - Gráfico da granulometria do Ponto E04-Margem Esquerda
Aécia Seleide Dantas - 2009
70
5.3 TEOR DE MATÉRIA ORGÂNICA
Observando a Figura 22, vemos que as amostras que apresentaram os
maiores teores de matéria orgânica (em %) foram os pontos, E02-ME, E03-C,
E04-C e E04-ME. Além disso, observa-se uma tendência natural do crescimento
do teor de matéria orgânica da margem direita para a esquerda, com exceção do
ponto E03 que sofre influência do rio doce. Esses altos teores de matéria orgânica
encontrados podem ser explicados pela carga orgânica oriunda de efluentes das
indústrias de beneficiamento de camarão adjacentes, e a efluentes domésticos
que são lançados sem tratamento pelo Canal do Baldo.
20
Margem direita
Calha
Margem esquerda
18
16
MOT%
14
12
10
8
6
4
2
0
E01
E02
E03
E04
Pontos de Amostragem
Figura 22 - Médias das concentrações do teor de matéria orgânica (%) encontradas nas amostras
de sedimento de fundo.
Os sedimentos de granulometria mais fina (do tipo silte) apresentam,
geralmente, maiores porcentagens de matéria orgânica, embora valores
relativamente elevados de matéria orgânica também sejam encontrados nos
locais de amostragem com sedimento do tipo areia fina, como pode ser
Aécia Seleide Dantas - 2009
71
observado na Tabela 5.3. Vemos ainda, na mesma tabela, que neste trabalho o
Zn e Cr mostraram correlação com a matéria orgânica, apesar dos cátions Cu e
Zn serem mais prováveis de se ligarem aos sítios coordenadores existentes na
matéria orgânica que podem complexar elementos menores, em especial os
cátions divalentes citados.
Aécia Seleide Dantas - 2009
72
Tabela 5.3 Comparação das médias (n = 3) dos resultados da porcentagem de matéria orgânica nas amostras de sedimento e a média (n = 3) dos
elementos menores, em mg.Kg-1.
Classificação
AMOSTRA
MOT (%)
Cd
Cr
Cu
Ni
Pb
Zn
Granulométrica
E 01 – Margem Direita - Média
Areia fina
1,10 ± 0,43
0,11
11,93
4,79
4,90
3,93
19,16
Areia média
0,93 ± 0,13
<LD
6,07
1,83
2,96
2,33
13,05
Areia muito fina
4,67 ± 0,84
0,47
56,34
142,57
21,76
57,84
135,96
Areia fina
2,95 ± 0,69
0,16
22,66
7,30
8,73
7,56
24,68
Areia média
0,81 ± 0,17
<LD
3,63
1,25
1,49
1,98
30,05
Silte
16,09 ± 1,92
0,56
76,92
20,66
29,43
25,30
68,53
Areia média
6,66 ± 1,82
<LD
2,76
0,49
1,04
1,28
8,60
Areia fina
16,92 ± 0,63
0,11
14,21
2,80
5,69
4,40
18,65
Silte
7,11 ± 0,70
0,47
73,42
21,76
35,65
23,24
68,86
E 04– Margem Direita - Média
Areia fina
5,41 ± 1,33
<LD
5,11
1,07
2,00
2,01
15,38
E 04 – Calha - Média
Areia fina
11,34 ± 0,17
0,18
14,44
1,52
4,25
6,89
38,19
Areia muito fina
12,07 ± 1,81
0,14
20,21
3,25
7,30
8,37
22,62
E 01 – Calha - Média
E 01 – Margem Esquerda - Média
E 02– Margem Direita - Média
E 02 – Calha - Média
E 02 – Margem Esquerda - Média
E 03– Margem Direita - Média
E 03 – Calha - Média
E 03 – Margem Esquerda - Média
E 04 – Margem Esquerda - Média
Aécia Seleide Dantas - 2009
73
Tabela 5.4 Resultado da média (n = 3) da %MOT.
AMOSTRAS
%MOT ± DP
E 01 – Margem Direita - Média
1,10 ± 0,43
E 01 – Calha - Média
0,93 ± 0,13
E 01 – Margem Esquerda - Média
4,67 ± 0,84
E 02– Margem Direita - Média
2,95 ± 0,69
E 02 – Calha - Média
0,81 ± 0,17
E 02 – Margem Esquerda - Média
16,09 ± 1,92
E 03– Margem Direita - Média
6,66 ± 1,82
E 03 – Calha - Média
16,92 ± 0,63
E 03 – Margem Esquerda - Média
7,11 ± 0,70
E 04– Margem Direita - Média
5,41 ± 1,33
E 04 – Calha - Média
11,34 ± 0,17
E 04 – Margem Esquerda - Média
12,07 ± 1,81
Aécia Seleide Dantas - 2009
74
5.4
APRESENTAÇÃO
DOS
RESULTADOS
DA
QUANTIFICAÇÃO
DOS
ELEMENTOS
Nesse trabalho, as concentrações dos metais foram comparadas com
estudos realizados anteriormente nesse estuário, cujos pontos de amostragem
são próximos dos georeferenciados, com o “background” regional descrito por
Guedes (2003), e com as concentrações totais de metais presentes nos folhelhos
geológicos (Tabela 5.8). Estas concentrações do folhelho são tomadas como
média mundial descritas por Turekian e Wedepohl (1961). Estes valores foram
utilizados como referência em trabalhos de enfoque biogeoquímico e mesmo de
monitoramento. Salientando que o folhelho de referência refere-se à concentração
total dos metais, e que neste trabalho a concentração medida é parcial.
5.4.1 Elementos maiores
Para o objetivo do trabalho, que é a caracterização de amostras de
sedimento no estuário Potengi, fazendo comparação entre amostras coletadas na
calha do rio e nas suas margens, direita e esquerda, a determinação da
concentração de Fe, Al e Mn são importantes porque suas concentrações são
geralmente altas e constantes e não são influenciadas pela ação antropogênica.
O comportamento dos elementos Al, Fe e Mn é o mesmo para todos os
pontos, sempre com as maiores concentrações na margem esquerda, porém
apresentando valores abaixo do valor de referência do folhelho de Turekian e
Wedepohl (1961), que são 8% para o Al, 4,72% para o Fe e 850,00 mg/Kg para o
Mn.
As médias das concentrações de alumínio e ferro presentes nos
sedimentos do estuário Potengi variaram de 0,13% e 0,09% no ponto E03-MD a
4,97% e 3,65% no ponto E03-ME, respectivamente. Nos mesmos pontos
encontramos as médias das concentrações de manganês que variaram de 8,16 a
323,77 mg/Kg, respectivamente (Figuras 23 a 25).
Aécia Seleide Dantas - 2009
75
No “background” estudado por Guedes (2003), foi encontrada uma
concentração de 0,75% de Al. Neste trabalho, para os pontos E01-ME, E02-MD,
E02-ME, E03-ME, E04-C e E04-ME, as concentrações são maiores que as
encontradas no “background”. No caso do Fe os pontos cuja concentração
ultrapassou os valores do “background”, foram os mesmos que também
apresentaram maiores concentrações de Al, com exceção do E04-C, que está de
acordo com o valor do “background”, que é de 1,01% de Fe. Já o Mn apresentou
maiores concentrações para os pontos E01-ME, E02-ME, E03-ME e E04-ME, que
as encontradas por Guedes (2003), que é de 95,0 mg/Kg de Mn.
Observando as Figuras 23, 24 e 25, vemos que existem diferenças entre
os resultados das replicatas da amostragem de alguns pontos, o que pode ser
explicado pelo fato de que os sedimentos dos estuários estão em ambiente
dinâmico, e além disso a amostra sofre uma lixiviação no momento da coleta
1
2
3
4
5
6
Margem Direita
Calha
Margem Esquerda
0
Concentração de Al (Percentual)
7
devido a profundidade do rio nos pontos coletados.
E01
E02
E03
E04
Pontos de Amostragem
Figura 23 - Gráfico das concentrações de alumínio no sedimento, em porcentagem.
Aécia Seleide Dantas - 2009
1
2
3
4
5
Margem Direita
Calha
Margem Esquerda
0
Concentração de Fe (Percentual)
6
76
E01
E02
E03
E04
Pontos de Amostragem
150
250
350
Margem Direita
Calha
Margem Esquerda
0
50
Concentração de Mn (mg/Kg)
450
Figura 24 - Gráfico das concentrações de ferro no sedimento, em porcentagem.
E01
E02
E03
E04
Pontos de Amostragem
Figura 25 - Gráfico das concentrações de manganês no sedimento, em mg.Kg-1.
Nas Tabelas 4.7, 4.8, 4.9 e 4.10 a seguir são apresentados os resultados
da quantificação do elementos maiores.
Aécia Seleide Dantas - 2009
77
Tabela 5.5 Resultados da quantificação dos elementos maiores
PONTO DE
AMOSTRAGEM
MÉDIA E01 - MD
MÉDIA E01 - C
MÉDIA E01 - ME
Al (%)
Fe(%)
Mn (mg/Kg)
0,47 ± 0,22
0,28 ± 0,05
2,43 ± 0,39
0,44 ± 0,19
0,29 ± 0,06
2,35 ± 0,10
50,03 ± 14,15
46,12 ± 13,45
130,69 ± 13,05
MÉDIA E02 - MD
MÉDIA E02 - C
MÉDIA E02 - ME
1,29 ± 0,56
0,14 ± 0,03
4,70 ± 0,36
1,02 ± 0,38
0,16 ± 0,02
3,28 ± 0,33
75,33 ± 11,21
18,18 ± 6,04
292,32 ± 47,72
MÉDIA E03 - MD
MÉDIA E03 - C
MÉDIA E03 - ME
0,13 ± 0,026
0,74 ± 0,41
4,97 ± 0,36
0,08 ± 0,02
0,62 ± 0,29
3,65 ± 0,46
8,16 ± 2,15
58,88 ± 12,36
323,77 ± 28,74
MÉDIA E04 - MD
MÉDIA E04 - C
MÉDIA E04 - ME
0,207 ± 0,01
1,20 ± 1,74
1,35 ± 0,14
0,21 ± 0,008
0,54 ± 0,70
1,02 ± 0,06
18,88 ± 1,33
32,15 ± 33,04
98,65 ± 11,50
5.4.2 Elementos traços
O Cd se associa principalmente com carbonatos e óxidos de Fe e Mn. Em
termos químicos o cádmio é muito similar ao zinco, só que muito menos
abundante. Estes dois metais freqüentemente sofrem processos geoquímicos
juntos. O cádmio é um elemento que é encontrado principalmente em sedimentos
de fundo e em partículas em suspensão. Nessas formas, ele pode retornar à fase
aquosa pelo aumento da acidez.
Não foi possível obter com exatidão os valores para o Cd para todas as
replicatas nos pontos de amostragem, pois para algumas as concentrações
situaram-se abaixo do limite de detecção, que é de 0,08 mg.Kg-1.
As médias das concentrações de Cd e Pb na margem esquerda sempre
ultrapassaram os valores do “background” regional e do folhelho padrão, que são
respectivamente <0,2 e 0,30 mg.Kg-1, exceto para o ponto E04. Podemos atribuir
esse fato às características das amostras, como por exemplo a granulometria da
amostra de sedimento nas margens ser menor que da amostra da calha.
As concentrações de Cd encontradas nesse trabalho são maiores que as
encontradas em trabalhos anteriores no estuário Potengi por FIGUEIREDO (1997)
e MEDEIROS (2009). Já para as concentrações de chumbo, comparando com os
Aécia Seleide Dantas - 2009
78
mesmos autores, obteve-se valores menores, uma vez que comparou-se aos
valores das amostragens na calha do rio.
O chumbo é um metal que, em sua maior parte encontra-se associado às
partículas mais finas do sedimento. Apesar disso, a maior concentração de
chumbo encontrada foi no ponto E01-ME, que têm maior porcentagem de fração
granulométrica areia muito fina, e teor de matéria orgânica de 4,67%, não é
elevada. Em contraste, temos o ponto, E02-ME, onde a fração granulométrica é
silte, o teor de matéria orgânica encontrado foi 16,09% e a concentração de
chumbo encontrada foi de 25,30 mg.Kg-1.
Quando o chumbo é lançado no meio ambiente, ele tem um longo tempo
de residência comparado à maioria dos outros poluentes. Como resultado, ele
tende a se acumular em solos e sedimentos, onde, devido à baixa solubilidade,
pode permanecer acessível à cadeia alimentar e ao metabolismo humano por
muito tempo (CONCEIÇÃO, 2004).
Nas Figuras 26 e 27 a seguir, vemos a distribuição do Cd e Pb, nas
diversas partes de sedimento do rio amostradas.
Figura 26 - Gráfico das concentrações de cádmio no sedimento, em mg.Kg-1.
Aécia Seleide Dantas - 2009
10
20
30
40
50
60
Margem Direita
Calha
Margem Esquerda
0
Concentração de Pb (mg/Kg)
70
79
E01
E02
E03
E04
Pontos de Amostragem
Figura 27 - Gráfico das concentrações de chumbo no sedimento, em mg.Kg-1.
A quantidade de matéria orgânica apresenta uma grande influência na
forma como o cobre se encontra no sedimento. Quando o sedimento contém
baixas concentrações de matéria orgânica, a maior parte do cobre que ele contém
se encontra na fração residual associada à rede silicática das argilas (CHESTER
et al., 1988). Em sedimentos contendo altas concentrações de matéria orgânica, o
cobre se associa principalmente aos sulfetos e à matéria orgânica (NAVFAC,
2000).
Assim como o chumbo, a maior concentração de cobre e zinco
encontradas, não teve ligação com a granulometria mais fina e o mais alto teor de
matéria orgânica.
As concentrações encontradas estão entre 0,49 mg.Kg-1 e 142,57 mg.Kg-1
para o Cu, e entre 8,60 mg.Kg-1 e 135,96 mg.Kg-1 para o Zn, nos pontos E03-MD
e E01-ME respectivamente.
Com exceção do ponto E04, todas as amostragens da margem esquerda
estão acima do valor do “background” regional que é de 10,0 mg.Kg-1 de Cu, mas
apenas o ponto E01-ME está acima do folhelho padrão, que tem concentração
45,0 mg.Kg-1 . Em relação ao Zn, estão acima do “background” regional os pontos:
Aécia Seleide Dantas - 2009
80
E01-ME, E02-C, E02-ME, E03-ME e E04-C. E somente o ponto E01-ME está
acima do valor de referência do folhelho padrão, que é de 95,0 mg.Kg-1 para o Zn.
As altas concentrações encontradas no ponto E01-ME são preocupantes,
pois estão muito acima dos valores guias do folhelho para Cu e Zn, e pode estar
afetando a qualidade da água no estuário, uma vez que traços desses elementos
foram encontrados na análise da água realizada nesse trabalho e em todos os
pontos de amostragem, a concentração de Cu na água está acima do valor
máximo permitido pela Resolução CONAMA 357, como mostrado na Tabela 4.1.
Essa contaminação pode ser oriunda do efeito que os efluentes das
carciniculturas que são lançados neste estuário provocam, como por exemplo a
alteração do pH da água.
No entanto, as concentrações de Cu e Zn encontradas nesse trabalho são
menores que as encontradas em trabalhos anteriores no estuário Jundiaí-Potengi
(FIGUEIREDO,1997; MEDEIROS, 2009) e em Curimataú (GARLIPP, 2006), como
pode ser observado na Tabela 5.8. Comparando com as concentrações
encontradas por Figueiredo (1997) e Lira (2008), encontrou-se nesse trabalho
uma concentração mais alta de Zn. Levando em consideração que os solos
apresentam grande variedade ao longo de uma mesma região e entre diferentes
regiões (SUGUIO, 2003), e que, portanto, deve-se considerar que os metais não
estão distribuídos de forma homogênea entre as frações de sedimento e que
diferenças significativas nas concentrações totais de metais podem ser
observadas em amostras de sedimento de uma única localidade (SALOMONS &
FORSTNER, 1984). Essa premissa pode justificar os resultados observados nas
comparações realizadas nesse trabalho, visto que as concentrações dos metais
variaram até mesmo entre as replicatas de amostragem para alguns elementos.
Nas Figuras 28 e 29 vemos o comportamento do Cu e do Zn,
respectivamente.
Aécia Seleide Dantas - 2009
32
64
96
128
Margem Direita
Calha
Margem Esquerda
0
Concentração de Cu (mg/Kg)
160
81
E01
E02
E03
E04
Pontos de Amostragem
30
60
90
120
Margem Direita
Calha
Margem Esquerda
0
Concentração de Zn (mg/Kg)
150
Figura 28 - Gráfico das concentrações de cobre no sedimento, em mg.Kg-1.
E01
E02
E03
E04
Pontos de Amostragem
Figura 29 - Gráfico das concentrações de zinco no sedimento, em mg.Kg-1.
A maior parte do cromo em sedimentos encontra-se associada às argilas.
conforme indicado pela alta correlação entre as concentrações de alumínio e
cromo em sedimentos estuarinos na Flórida (SCHROPP et al., 1990).
Aécia Seleide Dantas - 2009
82
O Cr apresentou altas correlações relacionadas com a matéria orgânica e
fração silte (Tabelas 4.4). As médias das concentrações de Cr variaram de 2,76
mg.Kg-1 a 76,92 mg.Kg-1. Com exceção do ponto E04, todas as amostras da
margem esquerda estiveram acima do valor do “background” regional, que é de
28,5 mg.Kg-1 de Cr, e todos os pontos mostraram concentrações abaixo do
folhelho padrão, que tem o valor de Cr igual a 90,0 mg.Kg-1 .
Comparadas com as de outros trabalhos, as concentrações de Cr
encontradas nesse trabalho (na calha do rio Potengi) estão menores que as
encontradas em trabalhos anteriores no estuário Jundiaí (GUEDES, 2003; LIRA,
2008), no estuário Jundiaí-Potengi (FIGUEIREDO,1997; MEDEIROS, 2009) e em
Curimataú (GARLIPP, 2006), como pode ser observado na Tabela 5.8. A Figura
30, a seguir, mostra as médias das concentrações de Cr em todos os pontos de
30
50
70
90
Margem Direita
Calha
Margem Esquerda
0 10
Concentração de Cr (mg/Kg)
110
amostragem.
E01
E02
E03
E04
Pontos de Amostragem
Figura 30 - Gráfico das concentrações de cromo no sedimento, em mg.Kg-1.
As médias das concentrações de Ni variaram de 1,04 mg.Kg-1 a 35,65
mg.Kg-1. As concentrações para todas as amostras da margem esquerda estão
acima do valor do “background” regional, que é de 15,5 mg.Kg-1 de Ni, com
exceção do ponto E04. Para o Ni todos os pontos mostraram concentrações
abaixo do folhelho padrão, que tem o valor de 68,0 mg.Kg-1 .
Aécia Seleide Dantas - 2009
83
As concentrações de Ni na calha do Rio Potengi, encontradas nesse
trabalho, quando comparadas com trabalhos anteriores no estuário Jundiaí
(GUEDES, 2003; LIRA, 2008), no estuário Jundiaí-Potengi (MEDEIROS, 2009) e
em Curimataú (GARLIPP, 2006), encontraram-se menores como pode ser
observado na Tabela 5.8. Todavia, as análises de traços de níquel em água
realizadas nesse trabalho mostraram que já existe contaminação, embora ainda
estejam menores do que o valor máximo permitido pela Resolução CONAMA 357.
A Figura 31 mostra as médias das concentrações de Ni em todos os
10
20
30
40
Margem Direita
Calha
Margem Esquerda
0
Concentração de Ni (mg/Kg)
50
pontos de amostragem.
E01
E02
E03
E04
Pontos de Amostragem
Figura 31 - Gráfico das concentrações de níquel no sedimento, em mg.Kg-1.
A seguir serão apresentadas as tabelas 5.6 e 5.7, com os resultados da
quantificação do elementos menores.
As Tabelas 5.6 e 5.7 apresentam os resultados da quantificação dos
elementos menores.
Aécia Seleide Dantas - 2009
84
Tabela 5.6 Resultados da quantificação dos elementos traço Cd, Cr e Cu
PONTO DE
Cd (mg/Kg)
Cr (mg/Kg)
AMOSTRAGEM
MÉDIA E01 - MD
0,11 ± 0,033
11,93 ± 5,63
MÉDIA E01 - C
< LD
7,16 ± 1,83
MÉDIA E01 - ME
0,47 ± 0,02
56,33 ± 7,48
Cu (mg/Kg)
4,79 ± 1,31
1,83 ± 0,73
142,57 ± 15,91
MÉDIA E02 - MD
MÉDIA E02 - C
MÉDIA E02 - ME
0,16 ± 0,04
< LD
0,56 ± 0,05
22,66 ± 5,76
3,63 ± 0,71
76,92 ± 6,90
7,30 ± 2,35
1,25 ± 0,15
20,66 ± 1,96
MÉDIA E03 - MD
MÉDIA E03 - C
MÉDIA E03 - ME
< LD
0,10 ± 0,009
0,47 ± 0,07
2,76 ± 0,47
14,21 ± 6,73
73,42 ± 9,93
0,49 ± 0,08
2,80 ± 1,31
21,75 ± 4,35
MÉDIA E04 - MD
MÉDIA E04 - C
MÉDIA E04 - ME
< LD
0,18
0,14 ± 0,006
5,11 ± 0,21
14,43 ± 18,70
20,21 ± 1,41
1,07 ± 0,25
1,52 ± 1,29
3,25 ± 0,59
Tabela 5.7 Resultados da quantificação dos elementos traço Ni, Pb e Zn
PONTO DE
Ni (mg/Kg)
Pb (mg/Kg)
AMOSTRAGEM
MÉDIA E01 - MD
4,90 ± 2,46
3,93 ± 1,24
MÉDIA E01 - C
2,96 ± 0,73
2,33 ± 0,40
MÉDIA E01 - ME
19,42 ± 1,80
57,84 ± 7,05
Zn (mg/Kg)
19,16 ± 5,18
13,05 ± 2,18
135,96 ± 11,80
MÉDIA E02 - MD
MÉDIA E02 - C
MÉDIA E02 - ME
8,73 ± 2,60
1,49 ± 0,16
29,43 ± 3,54
7,56 ± 1,38
1,98 ± 0,19
22,98 ± 1,39
24,68 ± 5,52
16,90 ± 8,4
68,53 ± 8,47
MÉDIA E03 - MD
MÉDIA E03 - C
MÉDIA E03 - ME
1,04 ± 0,09
5,69 ± 2,74
35,65 ± 6,97
1,28 ± 0,20
4,40 ± 1,41
23,24 ± 1,09
8,60 ± 0,64
18,65 ± 5,59
68,86 ± 8,26
MÉDIA E04 - MD
MÉDIA E04 - C
MÉDIA E04 - ME
2,00 ± 0,03
4,25 ± 4,77
7,30 ± 0,81
2,01 ± 0,07
6,89 ± 8,38
8,37 ± 0,66
15,38 ± 0,48
38,19 ± 20,70
22,62 ± 1,59
Aécia Seleide Dantas - 2009
85
Tabela 5.8 Comparação entre as concentrações de elementos maiores e menores em sedimentos de diversos estuários do estado do RN com as do
-1
folhelho padrão mundial (em mg.Kg , Al e Fe em %).
ÁREAS
Al
Cd
Cr
Cu
Fe
Mn
Ni
Pb
Zn
“background” Regional 1
0,75
<LD (0,20)
28,50
10,00
1,01
95,00
15,50
14,00
26,00
Folhelho Padrão Mundial 2
8,00
0,30
90,00
45,00
4,72
850,00
68,00
20,00
95,00
Jundiaí 3
1,61
<LD (0,20)
59,90
31,00
2,07
463,40
43,10
38,20
62,00
Curimataú 4
8,76
<0,25
82,40
25,30
5,82
815,00
36,10
23,70
113,00
Potengi 5
-
-
36,60
17,50
0,02
-
-
23,20
25,50
Jundiaí 6
0,73
0,13
24,64
12,76
0,71
30,00
11,81
26,42
25,20
Jundiaí-Pontengi 7
1,28
<LD (0,28)
39,17
19,98
1,28
144,54
14,02
21,57
79,47
Potengi – MD 8
1,88
0,19
27,49
9,12
1,41
82,93
10,89
8,51
28,58
Potengi – Calha 9
1,02
0,18
19,74
3,68
0,82
71,34
7,83
6,89
61,94
Potengi – ME 10
5,36
0,62
84,36
151,88
3,67
343,05
42,00
65,77
148,24
1
GUEDES, 2003; 2TUREKIAN & WEDEPOHL, 1961; 3GUEDES, 2003; 4GARLIPP, 2006; 5FIGUEIREDO, 1997; 6LIRA,2008; 7MEDEIROS, 2009; 8Este
trabalho na margem direita, 2009; 9Este trabalho na calha, 2009; 10Este trabalho na margem esquerda, 2009.
Aécia Seleide Dantas - 2009
6 CONCLUSÕES E SUGESTÕES
Aécia Seleide Dantas - 2009
87
6 CONCLUSÕES E SUGESTÕES
6.1 CONCLUSÕES
A interpretação dos resultados das análises químicas do sedimento de
fundo do Estuário Potengi levou as seguintes conclusões:
A água analisada em todos os pontos desse trabalho mostra traços de Cu,
Ni e Zn, onde as concentrações de cobre são maiores que o valor máximo
permitido pela Resolução do CONAMA 357, indicando que este estuário já mostra
sinais de contaminação.
As partículas constituintes do sedimento de fundo não apresentaram
grandes variedades nos diâmetros das partículas ao longo do estuário. As médias
das frações detectadas pela análise granulométrica foram de silte e areia (média,
fina e muito fina). Porém deve-se observar que nem sempre a média representa
bem a característica da amostra.
Deve-se considerar que os solos apresentaram grande variedade ao longo
de uma mesma região e entre diferentes regiões e que, portanto, os metais
podem não estar distribuídos de forma homogênea entre as frações de sedimento
e que diferenças significativas nas concentrações totais de metais puderam ser
observadas em amostras de sedimento de uma única localidade.
Avaliando os resultados das análises de matéria orgânica, observou-se que
o teor desta no sedimento, não teve uma relação direta com a fração
granulométrica, uma vez que nos pontos de maiores teores de matéria orgânica,
encontraou-se tanto fração silte como areia fina. Esses pontos foram na calha e
na margem esquerda, respectivamente E03-C e E02-ME.
Os resultados analíticos apresentados pelas amostras de sedimentos de
fundo no estuário Potengi mostraram para todos os elementos e em todos os
pontos, que concentrações encontradas na margem esquerda foram maiores que
as concentrações da calha e da margem direita. As concentrações na margem
esquerda também foram maiores que o “background” regional, com exceção
apenas para o ponto E04-C que apresentou concentrações de Cd e Zn maiores
que o ponto E04-ME. O que pode ser justificado por fatores como:
Aécia Seleide Dantas - 2009
88
• na margem esquerda do estuário o movimento da água é menor do
que na calha e na margem direita deste rio, fazendo com que ocorra
uma maior sedimentação das partículas finas nessa região;
• existem diversas indústrias de beneficiamento de camarão próximas
a margem esquerda, as quais lançam seus efluentes diretamente no
Rio Potengi;
• por longos anos existiram indústrias que lançavam seus efluentes
sem tratamento também nessa região, como por exemplo indústrias
de couro, e como os sedimentos tem a característica de reter os
elementos por vários anos, esses resultados podem ser um histórico
do acúmulo de metais;
• a caracterização granulométrica das amostras da margem esquerda
mostra que nessa região os sedimentos tem uma granulometria
variada e com maior presença da fração silte do que as amostras da
calha e da margem direita deste rio, o que justifica o fato de na
margem esquerda existir uma maior adsorção de metais que nas
outras áreas.
Para que uma avaliação de sedimento de fundo em estuários seja feita em
relação à concentração de metais, é preciso levar em consideração fatores como:
o local da coleta, a profundidade do rio, o tipo de amostrador, a fração
granulométrica da amostra e o tipo de tratamento pelo qual a amostra passa para
análise quantitativa dos elementos, pois tudo isso influencia na interpretação dos
resultados obtidos. Desta maneira, do ponto de vista de um diagnóstico
ambiental, esses resultados são muito preocupantes, pois a digestão utilizada
nesse trabalho foi parcial, e mesmo assim as concentrações do elementos
cádmio, cobre, chumbo e zinco estão acima da média do folhelho padrão.
Aécia Seleide Dantas - 2009
89
6.2 SUGESTÕES PARA TRABALHOS FUTUROS
Aplicar métodos estatísticos avançados, como análise multivariada, e
relacionar, ao mesmo tempo, os diversos resultados encontrados para as análises
do teor de matéria orgânica, granulometria e concentração dos diversos
elementos encontrados nos diversos pontos de amostragem a fim de poder
visualizar de forma gráfica, eventuais fontes com maior carga de poluentes.
Analisar amostras de água e de sedimento a montante do rio e em um
ponto no mar para usá-los como “background”, e relacionar possíveis diferenças a
fim de que se possa justificar ação antrópica.
Procurar uma metodologia validada para análise do teor de matéria
orgânica em sedimento de fundo, além de usar análise térmica para ter certeza da
temperatura que deverá ser usada sem comprometer a formação geológica do
sedimento.
Aécia Seleide Dantas - 2009
REFERÊNCIAS
Aécia Seleide Dantas - 2009
91
REFERÊNCIAS
ABU-HILAL, A. H.; BADRAN, M. M.; Effect of Pollution Sources on Metal
Concentrations in Sediment Cores from Gulf of Aqaba (Red Sea). Marine Poll.
Bull., v. 21, n. 4, p. 190-197, 1990. Disponível em:
http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6V6N-488Y90X21C&_user=687335&_coverDate=04%2F30%2F1990&_rdoc=7&_fmt=high&_orig
=browse&_srch=docinfo(%23toc%235819%231990%23999789995%23413405%23FLP%23display%2
3Volume)&_cdi=5819&_sort=d&_docanchor=&_ct=21&_acct=C000037878&_versi
on=1&_urlVersion=0&_userid=687335&md5=19226e9d1a1bb69919d4e41bdeaf5a
60. Acesso em: 24 nov 2009. DOI :10.1016/0025-326X(90)90501-X
AGUIAR, J. E. Comparação de Metodologias para Caracterização da
Geoquímica de Metais-Traços em Sedimentos da Plataforma Continental do
Ceará. 2007. 114 f. Dissertação (Mestrado em Ciências Marinhas) - PósGraduação em Ciências Marinhas Tropicais, Instituto de Ciências Mar,
Universidade Federal do Ceará , Fortaleza, 2007.
______; MARINS, R. V.; ALMEIDA, M. D.; Comparação de Metodologias de
Digestão de Sedimentos Marinhos para Caracterização da Geoquímica de MetaisTraço na Plataforma Continental Nordeste Oriental Brasileira. Geochimica
Brasiliensis, v.21, n.3, p.304 - 323, 2007.
ALMEIDA, R. da S. Distribuição de Metais em Sedimentos do Rio ApodiMossoró/RN – Brasil. 2007. 107 f. Dissertação (Mestrado em Desenvolvimento e
Meio Ambiente) - Universidade do Estado do Rio Grande do Norte, Mossoró,
2007.
ALVES, J. P. H.; GARCIA, C. A. B.; AZEVEDO, M. P. D.; OLIVEIRA, A. P. C.
Avaliação da toxicidade de metais em sedimentos que recebem despejos de água
produzida usando a relação metal/sulfeto volatilizado em meio ácido. In:
CONGRESSO DE P&D EM PETRÓLEO E GÁS UFRN, 1, 2001, Natal.
Resumo… Natal: SBQ REGIONAL RN, 2001.
APHA - (AMERICAN PUBLIC HEALTH ASSOCIATION). Standard methods for
the examination of water and wastewater. 21. ed.. Washington: Centennial
Edition, 2005.
ARAÚJO, A. G. Avaliação da Poluição por Metais Pesados no Estuário do Rio
Potengi – Natal/RN. 2005. 92 f. Dissertação (Mestrado em Engenharia Sanitária)
- Programa de Pós-Graduação em Engenharia Sanitária, Centro de Tecnologia,
Universidade Federal do Rio Grande do Norte, Natal, 2005.
ATKINS, P.; JONES, L. Princípios de Química: Questionando a vida moderna
e o cotidiano. 3. ed. Porto Alegre: Bookman, 2006.
Aécia Seleide Dantas - 2009
92
ATSDR – AGENCY FOR TOXIC SUBSTANCES AND DESEASE REGISTRY.
Toxicological profile for Copper. Atlanta : GA: U. S. Department of Health and
Human Services, Public Health Service, 2004. Disponível em:
http://www.atsdr.cdc.gov/tfacts132.html. Acesso em: 12 mai 2009.
BAIRD, C. Química Ambiental. 2.ed. Porto Alegre: Bookman, 2002.
BETTINELLI, M.; BEONE, G. M.; SPEZIA, S.; BAFFI, C. Determination of heavy
metals in soils and sediments by microwave-assisted digestion and inductively
couple plasma optical emission spectrometry analysis. Analytica Chimica Acta,
v. 424, 289-296, 2000. Disponível em:
http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6TF4-41H3KDTH&_user=687335&_coverDate=12%2F01%2F2000&_rdoc=15&_fmt=high&_orig=
browse&_srch=docinfo%28%23toc%235216%232000%23995759997%23215471%23FLA%23displa
y%23Volume%29&_cdi=5216&_sort=d&_docanchor=&_ct=16&_acct=C00003787
8&_version=1&_urlVersion=0&_userid=687335&md5=e54434f34bf6321287560b4
dc9e7f2ad. Acesso em: 8 mai 2009. DOI 10.1016/S0003-2670(00)01123-5
BEVILAQUA, J. E.; SILVA, I. S.; LICHTIG, J.; MASINI, J. C. Extração seletiva de
metais em sedimentos de fundo do Rio Tiête, São Paulo. Química Nova, v.32, n.
1, p. 26-33, 2009. Disponível em: http://www.scielo.br/scielo.php?pid=S010040422009000100005&script=sci_arttext. Acesso em 8 mai 2009. DOI
10.1590/S0100-40422009000100005
BOSTELMANN, E. Avaliação da Concentração de Metais em Amostras de
Sedimento do Reservatório Billings, Braço Rio Grande, São Paulo, Brasil.
2006. 130 f. Dissertação (Mestrado em Tecnologia Nuclear) –Instituto de
Pesquisas Energéticas e Nucleares de São Paulo, Universidade de São Paulo,
São Paulo, 2006.
CETESB – Relatório de Qualidade das Águas Interiores do estado de São
Paulo 2003 – São Paulo, 2004. Disponível em:
http://www.cetesb.sp.gov.br/Agua/rios/publicacoes.asp . Acesso em: 12 mai 2009.
CHESTER, R.: THOMAS. A.; LIN. F.J.: BASAHAM. A. S.; JACINTO, G. The solid
state speciation of copper in surface water particles and oceanic sediments.
Marine chemistry, V. 24, p. 261-292, 1988.
CLARK, R.B. Marine pollution. Oxford: Oxford University Press, 2001, p. 161.
CONCEIÇÃO, G. Distribuição de Elementos-Traço em Sedimentos
Superficiais do Rio Itajaí-Mirim em Santa Catarina. 2004. 108 f. Dissertação
(Mestrado em Engenharia Ambiental) - Centro de Ciências Tecnológicas,
Programa de Pós-Graduação em Engenharia Ambiental, Universidade Regional
de Blumenau, Blumenau, SC, 2004.
COSTA, E. C. T. A. Diagnóstico Ambiental das Águas do Estuário JundiaíPotengi pela Determinação dos Índices de Qualidade da Água e Toxidez.
2008. 125 f. Dissertação (Mestrado em Química) – Programa de Pós-Graduação
Aécia Seleide Dantas - 2009
93
em Química, Centro de Ciências Exatas e da Terra, Universidade Federal do Rio
Grande do Norte – UFRN, Natal, RN, 2008.
CUNHA, E. M. S., Evolução atual do litoral de Natal–RN (Brasil) e suas
aplicações a gestão integrada. 2004. 393 p. Tese de Doutorado (Doutorado em
Ciências del Mar) - Programa Doctorado de Ciências del Mar, Departament
d’Ecologia i Departament d’Estratigrafia i Paleontologia de La Universitat de
Barcelona. Barcelona, 2004.
ESTEVES, F. Fundamentos de limnologia. 2. ed. Rio de Janeiro: Interciência,
1988.
FERNANDES, L. D. F.; Transporte de poluentes em estuários. Trabalho Final
de Curso da Licenciatura em Engenharia do Ambiente da Universidade Técnica
de Lisboa, Lisboa, 2001. 54 p.
FIGUEIREDO, F. G. de. Metais Pesados em Sedimentos Superficiais do
Estuário Potengi. 1997. 65 f. Dissertação (Mestrado em Química) - Universidade
Federal do Rio Grande do Norte, Centro de Ciências Exatas e da Terra, Programa
de Pós-Graduação em Química, Natal, 1997.
FORSTNER U. , WITTMANN G. Metal Pollution in the Aquatic Environment, 2.
ed., Berlin: Springer-Verlag, 1981.
FROEHNER, S.; MARTINS, R. F. Avaliação da composição química de
sedimentos do Rio Barigui na região metropolitana de Curitiba. Química Nova,
v.31, n. 8, p. 2020-2026, 2008. Disponível em:
http://www.scielo.br/scielo.php?pid=S010040422008000800020&script=sci_arttext. Acesso em: 12 mai 2009. DOI
10.1590/S0100-40422008000800020
GARLIPP, A. B. Variação Espacial e Sazonal de Elementos Maiores e Traços
no Estuário do Rio Curimataú (RN), Através de Dados Geoquímicos e de
Sensoriamento Remoto. 2006. 166 f. Tese (Doutorado em Geodinâmica e
Geofísica) - Programa de Pós-Graduação em Geodinâmica e Geofísica , Centro
de Ciências Exatas e da Terra, Universidade Federal do Rio Grande do Norte,
Natal, 2006.
GUEDES, J. A. Diagnóstico Geoquímico-Ambiental do Fundo Rio Jundiaí nas
Imediações da Cidade de Macaíba/RN. 2003. 130 f. Dissertação (Mestrado em
Geociência) - Pós-Graduação em Geociências, Centro de Ciências Exatas e da
Terra, Universidade Federal do Rio Grande do Norte Natal, 2003.
GUEDES, J. A. et al. Metais pesados em água do rio Jundiaí - Macaíba/RN.
Revista de Geologia, v.18, n.02, p.131-142, 2005.
GUIMARÃES, I. do R. Utilização de óxidos de ferro naturais e sintéticos na
degradação de compostos orgânicos. 2007. 84 f. Dissertação (Mestrado em
Agroquímica) – Departamento de Química, Universidade Federal de Lavras,
Lavras - MG, 2007.
Aécia Seleide Dantas - 2009
94
GUINÉ-ROSIAS, M. F. Espectrometria de emissão atômica com plasma
acoplado indutivamente. Piracicaba. CENA/USP, 1998.
HOROWITZ A. J.; A Primer on Sediment-Trace Metal Chemistry. 2.ed. Lewis
Publishers, MI, 1991.
HORTELLANI, M. A. et al. Avaliação da Contaminação por Elementos Metálicos
dos Sedimentos do Estuário Santos – São Vicente. Química Nova, v. 31, n.1,
p.10-19, 2008. Disponível em:
http://quimicanova.sbq.org.br/qn/qnol/2008/vol31n1/index.htm. Acesso em: 8
maio 2009.
KRALIK, M. A rapid procedure for environmental sampling and evaluation of
polluted sediments. Applied Geochemistry, v.14: p. 807-816, 1999. Disponível
em: http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6VDG3YJB7HW9&_user=687335&_coverDate=08%2F31%2F1999&_alid=1111283688&_rdoc=1&
_fmt=high&_orig=search&_cdi=5982&_sort=r&_docanchor=&view=c&_ct=1&_acct
=C000037878&_version=1&_urlVersion=0&_userid=687335&md5=c20e1c474c84
9a8ce2b6ac6a4b36ee3d. Acesso em: 12 mai 2009. DOI 10.1016/S08832927(98)00096-1
LANDAJO, A. et al. Analysis of heavy metal distribution in superficial estuarine
sediments (estuary of Bilbao, Basque Country) by open-focused microwaveassisted extraction and ICP-OES. Chemosphere, v. 56, p. 1033-1041, 2004.
Disponível em:
http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6V74-4CTCSX9N&_user=687335&_coverDate=09%2F30%2F2004&_alid=1111286373&_rdoc=1
&_fmt=high&_orig=search&_cdi=5832&_sort=r&_docanchor=&view=c&_ct=1&_ac
ct=C000037878&_version=1&_urlVersion=0&_userid=687335&md5=10a1ac994a
255f265647627569e32b0b. Acesso em 12 mai 2009. DOI
10.1016/j.chemosphere.2004.06.005
LARINI, L. Toxicologia. 3.ed. São Paulo: Manole, 1997.
LEE, J. D. Química Inorgânica não tão concisa. 5.ed. São Paulo: Edgard
Blücher, 2000.
LEMES, M. J. de L. Avaliação de Metais e Elementos-Traço em Águas e
Sedimentos das Bacias Hidrográficas dos Rios Mogi-Guaçu e Pardo, São
Paulo. 2001. 215 f. Dissertação (Mestrado em Ciências) –, Instituto de Pesquisas
Energéticas e Nucleares de São Paulo, Universidade de São Paulo São Paulo,
2001.
LIMA, I. V.; PEDROZO, M. F. M. Cadernos de Referência Ambiental:
Ecotoxicologia do ferro e seus compostos. v.04, 112f. Salvador: CRA, 2001.
LIMA, L. F. de. Geoquímica de Sedimentos de Fundo dos Rios Trairi e Ararí e
da Laguna de Nísia Floresta (RN). 2006. 52 f. Dissertação (Mestrado em
Geociências) - Programa de Pós-Graduação em Geociências, Centro de Ciências
Exatas e da Terra, Universidade Federal do Rio Grande do Norte, Natal, 2006.
Aécia Seleide Dantas - 2009
95
LIRA, D. de C. Desenvolvimento de uma metodologia para caracterização de
amostras de sedimento (Rio Jundiaí\RN). 2008. Dissertação (Mestrado em
Química) - Programa de Pós-Graduação em Química, Centro de Ciências Exatas
e da Terra, Universidade Federal do Rio Grande do Norte, Natal, 2008.
MAHAN, B. M.; MYERS, R. J. Química um curso universitário. 4. ed. São
Paulo: Edgard Blücher Ltda, 1995.
MANAHAN, S. E. F. Fundamentals of environmental chemistry. Second
Edition, Boca Ratom: CRC Press LLC, 2001.
MARIANI, C. F. Reservatório Rio Grande: Caracterização Limnológica da
Água e Biodisponibilidade de Metais-Traço no Sedimento. 2006. 123 f.
Dissertação (Mestrado em Ciências) - Instituto de Biociências, Departamento de
Ecologia, Universidade de São Paulo, São Paulo, 2006.
MARTINS, I.; LIMA, I. V. Cadernos de Referência Ambiental: Ecotoxicologia
do manganês e seus compostos. v.07, 121f. Salvador: CRA, 2001.
MEDEIROS, R. L. da S. Avaliação das condições física e química dos
sedimentos do estuário Jundiaí-Potengi. 2009. 107 f. Dissertação (Mestrado
em Química) – Programa de Pós-Graduação em Química, Centro de Ciências
Exatas e da Terra, Universidade Federal do Rio Grande do Norte, Natal, 2009.
MENDES, Franklin Silva. Estudo Ambiental de Hidrocarbonetos de Petróleo e
de Elementos Químicos em Sedimentos de Fundo de um Corpo Lacustre no
Município de Guamaré, Estado do Rio Grande do Norte. 2006. 172 f. Tese
(Doutorado em Química) –Programa de Pós-graduação de Química, Centro de
Ciências Exatas e da Terra, Universidade Federal do Rio Grande do Norte, Natal.
2006.
MENDONÇA, Maria Lucia Teixeira Guerra de. Metodologia para Determinação
de Metais em Sedimentos Utilizando Microondas com Frasco Fechado e
Análise Estatística Multivariada das Concentrações de Metais em
Sedimentos da Bacia de Campos. 2006. 181 f. Tese (Doutorado em Química) –
Programa de Pós-Graduação em Química, Pontifícia Universidade Católica do Rio
de Janeiro, Rio de Janeiro, 2006.
NASCIMENTO, Luciana Araújo do. Avaliação da influência da produção de
petróleo na concentração de metais traços e orgânicos totais em
sedimentos da Bacia Piranhas-Açu. 2008. 108 f. Dissertação (Mestrado em
Engenharia de Petróleo) – Programa de Pós-Graduação em Ciência e Engenharia
de Petróleo, Universidade Federal do Rio Grande do Norte, Natal, 2008.
NAVFAC. Guide for incorporating bioavailability adjustments into human
health and ecological risk assessments at U S. Navy and Marine Corps
Facilities - Part 1: overview of metals bioavailability. Naval Facilities Engineering
Service Center. User’s Guide UG-2041-ENV. Washington. DC, 2000.
PEREZ-SANTANA, S.; et al. Total and partial digestion of sediments for the
evaluation of trace element environmental pollution. Chemosphere, v. 66, p.
1545-1553, 2007. Disponível em:
Aécia Seleide Dantas - 2009
96
http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6V74-4M69JD21&_user=687335&_coverDate=01%2F31%2F2007&_alid=1111302036&_rdoc=1&
_fmt=high&_orig=search&_cdi=5832&_docanchor=&view=c&_ct=2&_acct=C0000
37878&_version=1&_urlVersion=0&_userid=687335&md5=deec1500a9b5b21bae
9d4ec5bde00986. Acesso em: 8 mai 2009. DOI 10.1016/j.chemosphere.2006.08.018
RAWLE A. The importance of Particle Size Analysis in the Pharmaceutical
Industry. Malvern. Spring Lane South, 2002. p.1-43. [ S.l]:
ROSENTAL, R.; EAGLE, G. A.; ORREN, M. J. Trace metal distribution in different
chemical fractions of nearshore marine sediments. Estuarine, Coastal and Shelf
Science, V. 22, p. 303-324,1986.
RUSSEL, J. B. Química Geral. São Paulo: Makron Books, 1994. v. 1 e 2.
SALOMONS, W. Environmental impact of metais derived from mining activities:
processes, predictions, prevention. Journai of Geochemical Exploration, 52: 523, 1995. Disponível em:
http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6VCP-3YXC0SK7&_user=687335&_coverDate=01%2F31%2F1995&_alid=1111310492&_rdoc=1&
_fmt=high&_orig=search&_cdi=5960&_sort=r&_docanchor=&view=c&_ct=4&_acct
=C000037878&_version=1&_urlVersion=0&_userid=687335&md5=feb74d73629d
88b28f7665fd1a3565e9 . Acesso em: 11 mai 2009. DOI 10.1016/03756742(94)00039-E
SANTOS, D. M. et al. Avaliação de Metais Pesados na Baía de Paranaguá, PR,
Brasil, sob influência das atividades antrópicas. J. Braz. Soc. Ecotoxicol., v.01,
n.02, p.157-160, 2006.
SECRETARIA DE ESTADO DO MEIO AMBIENTE E DOS RECURSOS
HÍDRICOS (Rio Grande do Norte). Disponível em:
http://www.semarh.rn.gov.br/consulta/cBaciaDetalhe.asp?CodigoEstadual=08.
Acesso em: 03. Jul. 2009.
SEDNET 2008 - European Sediment Research Network. Disponível em:
http://www.sednet.org. Acesso em: maio de 2009.
SHRIVER D. F.; ATKINS, P. W. Química Inorgânica. 4.ed., São Paulo:
Bookmam, 2008.
SILVA, C. S.; PEDROZO, M. F. M. Cadernos de Referência Ambiental:
Ecotoxicologia do cromo e seus compostos.. Salvador: CRA, 2001. . v. 5,. 100
p.
SILVA, M. R. C. Estudo de Sedimentos da Bacia Hidrográfica do Mogi-Guaçu,
com Ênfase na determinação de Metais. 2002. 113 f. Dissertação (Mestrado em
Ciências, Química Analítica) – Instituto de Química de São Carlos, Universidade
de São Paulo, São Carlos, 2002.
SIQUEIRA, G. W. et al. Determinação dos Elementos-Traço (Zn, Co e Ni) em
Sedimentos da Plataforma Continental Amazônica sob Influência da Descarga do
rio Amazonas. Acta Amazônica, v.36, n.3, p.321–326, 2006. Disponível em:
Aécia Seleide Dantas - 2009
97
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S004459672006000300005&lng=en&nrm=iso. Acesso em: 7 mai 2009. DOI
10.1590/S0044-59672006000300005
SKOOG, D. A.; WEST, D. M.; HOLLER, F. J.; CROUCH, S. R. Fundamentos de
Química Analítica. 8. ed. São Paulo: Thompson, 2006.
SOUZA, R. S. et al. Adsorção de zinco e sua relação com características de solos
do Estado da Paraíba. Revista Brasileira de Ciências Agrárias. v.01, p.1–6,
2006.
SUGUIO, K. Introdução à Sedimentologia. São Paulo: Edgard Blücher, 2003.
USEPA – U.S. Environmental Protection Agency (2007). Method 3051a.
Disponível em:
http://www.epa.gov/epawaste/hazard/testmethods/sw846/pdfs/3051a.pdf . Acesso
em: 20 mar 2009.
VICENT- BECKETT, V.A.; PASCUAL, C.B.; KAWN, C.S.; BECKET, R. Levels and
Distribution of Trace Metal in sediments of Laguna Lake (Philippines):
Inter.Journal.Anal.Chem. ; v. 45; p.101-116, 1991.
WHO - World Health Organization. Cadmium: Environmental Aspects. Geneva,
1992 (Environmental Health Criteria, No.134).
WHO - World Health Organization. Chromium: Environmental Aspects.
Geneva, 1988 (Environmental Health Criteria, No.61).
WHO - World Health Organization. Concise International Chemical Assessment
Document nº 12. Manganese and its compounds. Geneva, 1999.
WHO - World Health Organization. Copper: Environmental Aspects. Geneva,
1998 (Environmental Health Criteria, No. 200).
WHO - World Health Organization. Lead: Environmental Aspects. Geneva, 1995
(Environmental Health Criteria, No. 165).
WHO - World Health Organization. Manganese: Environmental Aspects.
Geneva, 1981 (Environmental Health Criteria, No.17).
YABE, M. J. S.; OLIVEIRA, E. Metais pesados em águas superficiais como
estratégia de caracterização de bacias hidrográficas. Química Nova, v.21, n. 5, p.
551-556, 1998. Disponível em:
http://quimicanova.sbq.org.br/qn/qnol/1998/vol21n5/index.htm. Acesso em: 8 mai
2009.
ZAMBETA, P. M. A. Espécies químicas inorgânicas (Al, As, Cd, Cr, Cu, Fe,
Hg, Mn, Ni, Pb e Sn) no sedimento e nos sólidos em suspensão do rio
Corumbataí, SP. 74 f. Dissertação (Mestrado em Ecologia de Agroecossistemas)
–Escola Superior de Agricultura Luiz de Queiroz, Universidade de São Paulo,
Piracicaba, 2006.
Aécia Seleide Dantas - 2009
APÊNDICE
Aécia Seleide Dantas - 2009
99
Tabela A1 Resultado da caracterização granulométrica e classificação das amostras segundo
CONAMA 344/2004, nos pontos E01 e E02.
AMOSTRAS
(mm)*
E 01 – Margem Direita R1
0,213 ± 0,003
E 01 – Margem Direita R2
0,174 ± 0,015
E 01 – Margem Direita R3
0,197 ± 0,007
E 01 – Margem Direita - Média
0,195 ± 0,02
E 01 – Calha R1
0,342 ± 0,006
E 01 – Calha R2
0,326 ± 0,007
E 01 – Calha R3
0,329 ± 0,017
E 01 – Calha - Média
0,332 ± 0,008
E 01 – Margem Esquerda R1
0,091 ± 0,01
E 01 – Margem Esquerda R2
0,080 ± 0,005
E 01 – Margem Esquerda R3
0,096 ± 0,003
E 01 – Margem Esquerda - Média
0,089 ± 0,008
E 02– Margem Direita R1
0,114 ± 0,005
E 02– Margem Direita R2
0,127 ± 0,002
E 02– Margem Direita R3
0,144 ± 0,004
E 02– Margem Direita - Média
0,128 ± 0,015
E 02 – Calha R1
0,489 ± 0,053
E 02 – Calha R3
0,437 ± 0,034
E 02 – Calha - Média
0,461 ± 0,026
E 02 – Margem Esquerda R2
E 02 – Margem Esquerda R3
E 02 – Margem Esquerda - Média
Areia fina
Areia média
Areia muito fina
Areia fina
0,455 ± 0,013
E 02 – Calha R2
E 02 – Margem Esquerda R1
CLASSIFICAÇÃO
Areia média
0,037 ± 0,004
0,037 ± 0,002
0,04 ± 0,001
0,038 ± 0,002
Silte
*Diâmetros a 50%.
Aécia Seleide Dantas - 2009
100
Tabela A2 Resultado da caracterização granulométrica e classificação das amostras segundo
CONAMA 344/2004, nos pontos E03 e E04.
AMOSTRAS
(mm)*
E 03– Margem Direita R1
0,310 ± 0,003
E 03– Margem Direita R2
0,271 ± 0,014
E 03– Margem Direita R3
0,297 ± 0,013
E 03– Margem Direita - Média
0,293 ± 0,02
E 03 – Calha R1
0,185 ± 0,005
E 03 – Calha R2
0,195 ± 0,002
E 03 – Calha R3
0,225 ± 0,002
E 03 – Calha - Média
0,202 0,021
E 03 – Margem Esquerda R1
0,030 ± 0,001
E 03 – Margem Esquerda R2
0,024 ± 0,001
E 03 – Margem Esquerda R3
0,040 ± 0,00
E 03 – Margem Esquerda - Média
0,031 ± 0,008
E 04– Margem Direita R1
0,191 ± 0,004
E 04– Margem Direita R2
0,187 ± 0,002
E 04– Margem Direita R3
0,190 ± 0,003
E 04– Margem Direita - Média
0,189 ± 0,002
E 04 – Calha R1
0,344 ± 0,013
E 04 – Calha R2
0,042 ± 0,000
E 04 – Calha R3
0,350 ± 0,014
E 04 – Calha - Média
0,245 ± 0,176
E 04 – Margem Esquerda R1
0,083 ± 0,002
E 04 – Margem Esquerda R2
0,079 ± 0,001
E 04 – Margem Esquerda R3
0,087 ± 0,001
E 04 – Margem Esquerda - Média
0,083 ± 0,004
CLASSIFICAÇÃO
Areia média
Areia fina
Silte
Areia fina
Areia fina
Areia muito fina
*Diâmetros a 50%.
Aécia Seleide Dantas - 2009
101
Tabela A3 Resultado da média (n = 3) da %MOT, nos pontos E01 e E02.
AMOSTRAS
%MOT ± DP
E 01 – Margem Direita 1
0,99 ± 0,25
E 01 – Margem Direita 2
1,58 ± 0,36
E 01 – Margem Direita 3
0,74 ± 0,15
E 01 – Margem Direita - Média
1,10 ± 0,43
E 01 – Calha 1
0,81 ± 0,21
E 01 – Calha 2
1,06 ± 0,18
E 01 – Calha 3
0,95 ± 0,27
E 01 – Calha - Média
0,93 ± 0,13
E 01 – Margem Esquerda 1
4,00 ± 0,09
E 01 – Margem Esquerda 2
4,41 ± 019
E 01 – Margem Esquerda 3
5,61 ± 0,13
E 01 – Margem Esquerda - Média
4,67 ± 0,84
E 02– Margem Direita 1
3,32 ± 0,17
E 02– Margem Direita 2
3,39 ± 0,09
E 02– Margem Direita 3
2,16 ± 0,50
E 02– Margem Direita - Média
2,95 ± 0,69
E 02 – Calha 1
0,69 ± 0,07
E 02 – Calha 2
NA*
E 02 – Calha 3
0,93 ± 0,25
E 02 – Calha - Média
0,81 ± 0,17
E 02 – Margem Esquerda 1
17,44 ± 1,97
E 02 – Margem Esquerda 2
14,73 ± 2,65
E 02 – Margem Esquerda 3
NA*
E 02 – Margem Esquerda - Média
16,09 ± 1,92
*NA – Não Realizada a Análise.
Aécia Seleide Dantas - 2009
102
Tabela A4 Resultado da média (n = 3) da %MOT, nos pontos E03 e E04.
AMOSTRAS
%MOT ± DP
E 03– Margem Direita 1
6,34 ± 1,62
E 03– Margem Direita 2
5,02 ± 1,54
E 03– Margem Direita 3
8,62 ± 2,24
E 03– Margem Direita - Média
6,66 ± 1,82
E 03 – Calha 1
16,47 ± 1,21
E 03 – Calha 2
17,36 ± 2,63
E 03 – Calha 3
NA*
E 03 – Calha - Média
16,92 ± 0,63
E 03 – Margem Esquerda 1
6,94 ± 0,64
E 03 – Margem Esquerda 2
6,51 ± 0,59
E 03 – Margem Esquerda 3
7,88 ± 1,30
E 03 – Margem Esquerda - Média
7,11 ± 0,70
E 04– Margem Direita 1
5,65 ± 0,97
E 04– Margem Direita 2
6,61 ± 0,88
E 04– Margem Direita 3
3,98 ± 0,05
E 04– Margem Direita - Média
5,41 ± 1,33
E 04 – Calha 1
11,46 ± 0,38
E 04 – Calha 2
11,22 ± 1,49
E 04 – Calha 3
NA*
E 04 – Calha - Média
11,34 ± 0,17
E 04 – Margem Esquerda 1
14,02 ± 0,34
E 04 – Margem Esquerda 2
11,76 ± 1,14
E 04 – Margem Esquerda 3
10,43 ± 2,65
E 04 – Margem Esquerda - Média
12,07 ± 1,81
*NA – Não Realizada a Análise.
Aécia Seleide Dantas - 2009
103
Tabela A5 Resultados da Quantificação dos elementos maiores no Ponto E01
PONTO DE
AMOSTRAGEM
Al (%)
Fe(%)
Mn (mg/Kg)
0,27
0,25
0,26
0,25
0,25
0,25
35,80
35,32
34,78
0,26 ± 0,008
0,25 ± 0,001
35,30 ± 0,51
0,71
0,70
0,69
0,64
0,66
0,63
64,96
63,50
62,13
Média E01 – MD2
0,70 ± 0,011
0,64 ± 0,016
63,53 ± 1,42
E01 – MD3 R1
E01 – MD3 R2
E01 – MD3 R3
Média E01 – MD3
0,47
0,45
0,46
0,46 ± 0,009
0,43
0,43
0,43
0,43 ± 0,001
51,26
50,63
51,88
51,26 ± 0,62
MÉDIA E01 - MD
0,47 ± 0,22
0,44 ± 0,19
50,03 ± 14,15
0,22
0,21
0,22
0,23
0,23
0,23
36,70
29,93
31,89
0,22 ± 0,009
0,23 ± 0,002
32,84 ± 3,48
0,32
0,31
0,32
0,35
0,34
0,34
60,03
57,89
61,30
0,32 ± 0,005
0,34 ± 0,001
59,74 ± 1,72
0,29
0,30
0,31
0,30
0,31
0,31
43,61
48,25
45,45
0,30 ± 0,01
0,28 ± 0,05
0,31 ± 0,004
0,29 ± 0,06
45,77 ± 2,33
46,12 ± 13,45
2,03
2,15
2,11
2,18
2,19
2,37
116,57
119,89
116,25
2,10 ± 0,059
2,25 ± 0,105
117,57 ± 2,02
2,33
2,30
2,37
2,45
2,34
2,37
131,23
127,83
133,61
2,33 ± 0,033
2,39 ± 0,052
130,89 ± 2,90
2,76
2,82
2,99
2,33
2,41
2,58
139,72
142,83
148,25
2,86 ± 0,119
2,43 ± 0,39
2,44 ± 0,127
2,35 ± 0,10
143,60 ± 4,31
130,69 ± 13,05
E01 – MD1 R1
E01 – MD1 R2
E01 – MD1 R3
Média E01 – MD1
E01 – MD2 R1
E01 – MD2 R2
E01 – MD2 R3
E01 – C1 R1
E01 – C1 R2
E01 – C1 R3
Média E01 – C1
E01 – C2 R1
E01 – C2 R2
E01 – C2 R3
Média E01 – C2
E01 – C3 R1
E01 – C3 R2
E01 – C3 R3
Média E01 – C3
MÉDIA E01 - C
E01 – ME1 R1
E01 – ME1 R2
E01 – ME1 R3
Média E01 – ME1
E01 – ME2 R1
E01 – ME2 R2
E01 – ME2 R3
Média E01 – ME2
E01 – ME3 R1
E01 – ME3 R2
E01 – ME3 R3
Média E01 – ME3
MÉDIA E01 - ME
Aécia Seleide Dantas - 2009
104
Tabela A6 Resultados da Quantificação dos elementos maiores no Ponto E02
PONTO DE
AMOSTRAGEM
E02 – MD1 R1
E02 – MD1 R2
E02 – MD1 R3
Média E02 – MD1
E02 – MD2 R1
E02 – MD2 R2
E02 – MD2 R3
Média E02 – MD2
E02 – MD3 R1
E02 – MD3 R2
E02 – MD3 R3
Média E02 – MD3
MÉDIA E02 - MD
E02 – C1 R1
E02 – C1 R2
E02 – C1 R3
Média E02 – C1
E02 – C2 R1
E02 – C2 R2
E02 – C2 R3
Média E02 – C2
E02 – C3 R1
E02 – C3 R2
E02 – C3 R3
Média E02 – C3
MÉDIA E02 - C
E02 – ME1 R1
E02 – ME1 R2
E02 – ME1 R3
Média E02 – ME1
E02 – ME2 R1
E02 – ME2 R2
E02 – ME2 R3
Média E02 – ME2
E02 – ME3 R1
E02 – ME3 R2
E02 – ME3 R3
Média E02 – ME3
MÉDIA E02 - ME
Al (%)
Fe(%)
Mn (mg/Kg)
1,45
1,46
2,73
1,11
1,12
2,00
82,30
81,69
77,82
1,88 ± 0,74
1,41 ± 0,51
80,60 ± 2,43
1,27
1,20
1,23
1,01
0,99
1,01
83,87
81,25
83,67
1,23 ± 0,04
1,00 ± 0,01
82,93 ± 1,46
0,79
0,77
0,76
0,67
0,64
0,63
64,50
59,43
63,43
0,77 ± 0,01
1,29 ± 0,56
0,65 ± 0,02
1,02 ± 0,38
62,45 ± 2,67
75,33 ± 11,21
0,11
0,12
0,12
0,15
0,14
0,14
17,47
17,72
19,67
0,12 ± 0,006
0,14 ± 0,005
18,28 ± 1,20
0,18
0,17
0,17
0,19
0,19
0,17
25,86
23,28
23,38
0,17 ± 0,004
0,18 ± 0,008
24,17 ± 1,46
0,14
0,14
0,14
0,15
0,16
0,16
12,00
12,62
11,67
0,14 ± 0,003
0,14 ± 0,03
0,16 ± 0,006
0,16 ± 0,02
12,09 ± 0,48
18,18 ± 6,04
5,16
5,11
5,09
3,63
3,61
3,68
339,45
337,33
339,30
5,12 ± 0,03
3,64 ± 0,04
338,69 ± 1,18
4,47
4,59
4,42
3,22
3,28
3,14
298,90
294,34
291,51
4,49 ± 0,09
3,21 ± 0,07
294,92 ± 3,73
4,53
4,61
4,33
3,01
3,00
2,96
247,10
246,15
236,80
4,49 ± 0,14
4,70 ± 0,36
2,99 ± 0,03
3,28 ± 0,33
243,35 ± 5,69
292,32 ± 47,72
Aécia Seleide Dantas - 2009
105
Tabela A7 Resultados da Quantificação dos elementos maiores no Ponto E03
PONTO DE
AMOSTRAGEM
E03 – MD1 R1
E03 – MD1 R2
E03 – MD1 R3
Média E03 – MD1
E03 – MD2 R1
E03 – MD2 R2
E03 – MD2 R3
Média E03 – MD2
E03 – MD3 R1
E03 – MD3 R2
E03 – MD3 R3
Média E03 – MD3
MÉDIA E03 - MD
E03 – C1 R1
E03 – C1 R2
E03 – C1 R3
Média E03 – C1
E03 – C2 R1
E03 – C2 R2
E03 – C2 R3
Média E03 – C2
E03 – C3 R1
E03 – C3 R2
E03 – C3 R3
Média E03 – C3
MÉDIA E03 - C
E03 – ME1 R1
E03 – ME1 R2
E03 – ME1 R3
Média E03 – ME1
E03 – ME2 R1
E03 – ME2 R2
E03 – ME2 R3
Média E03 – ME2
E03 – ME3 R1
E03 – ME3 R2
E03 – ME3 R3
Média E03 – ME3
MÉDIA E03 - ME
Al (%)
Fe(%)
Mn (mg/Kg)
0,10
0,11
0,11
0,06
0,07
0,07
6,03
6,33
5,78
0,11 ± 0,005
0,07 ± 0,002
6,05 ± 0,27
0,16
0,16
0,16
0,11
0,11
0,10
11,25
11,24
8,59
0,16 ± 0,002
0,10 ± 0,004
10,36 ± 1,53
0,13
0,13
0,13
0,08
0,09
0,08
7,65
8,33
8,23
0,13 ± 0,003
0,13 ± 0,026
0,09 ± 0,006
0,08 ± 0,02
8,07 ± 0,37
8,16 ± 2,15
0,91
0,92
0,95
0,84
0,80
0,84
69,79
70,37
73,87
0,92 ± 0,021
0,82 ± 0,025
71,34 ± 2,20
1,01
1,01
1,05
0,75
0,75
0,77
58,43
57,46
60,12
1,02 ± 0,024
0,76 ± 0,011
58,67 ± 1,35
0,27
0,26
0,29
0,27
0,27
0,30
42,87
44,58
52,40
0,27 ± 0,015
0,74 ± 0,41
0,28 ± 0,014
0,62 ± 0,29
46,62 ± 5,08
58,88 ± 12,36
4,84
4,98
4,83
3,66
3,68
3,67
292,31
293,24
286,66
4,89 ± 0,080
3,67 ± 0,014
290,74 ± 3,56
5,28
5,18
5,63
4,13
3,98
4,18
340,04
337,61
351,50
5,36 ± 0,235
4,10 ± 0,103
343,05 ± 7,42
4,71
4,61
4,63
3,21
3,18
3,14
337,26
340,14
335,14
4,65 ± 0,055
4,97 ± 0,36
3,18 ± 0,032
3,65 ± 0,46
337,51 ± 2,51
323,77 ± 28,74
Aécia Seleide Dantas - 2009
106
Tabela A8 Resultados da Quantificação dos elementos maiores no Ponto E04
PONTO DE
AMOSTRAGEM
E04 – MD1 R1
E04 – MD1 R2
E04 – MD1 R3
Média E04 – MD1
E04 – MD2 R1
E04 – MD2 R2
E04 – MD2 R3
Média E04 – MD2
E04 – MD3 R1
E04 – MD3 R2
E04 – MD3 R3
Média E04 – MD3
MÉDIA E04 - MD
E04 – C1 R1
E04 – C1 R2
E04 – C1 R3
Média E04 – C1
E04 – C2 R1
E04 – C2 R2
E04 – C2 R3
Média E04 – C2
E04 – C3 R1
E04 – C3 R2
E04 – C3 R3
Média E04 – C3
MÉDIA E04 - C
E04 – ME1 R1
E04 – ME1 R2
E04 – ME1 R3
Média E04 – ME1
E04 – ME2 R1
E04 – ME2 R2
E04 – ME2 R3
Média E04 – ME2
E04 – ME3 R1
E04 – ME3 R2
E04 – ME3 R3
Média E04 – ME3
MÉDIA E04 - ME
Al (%)
Fe(%)
Mn (mg/Kg)
0,21
0,22
0,22
0,20
0,21
0,20
16,61
18,25
17,25
0,22 ± 0,005
0,20 ± 0,004
17,37 ± 0,83
0,21
0,20
0,19
0,22
0,21
0,22
21,85
19,08
18,59
0,20 ± 0,011
0,22 ± 0,006
19,84 ± 1,75
0,21
0,19
0,21
0,22
0,21
0,22
20,24
17,83
20,29
0,20 ± 0,012
0,207 ± 0,01
0,22 ± 0,008
0,21 ± 0,008
19,45 ± 1,40
18,88 ± 1,33
0,14
0,15
0,14
0,11
0,11
0,11
10,19
10,17
10,68
0,14 ± 0,005
0,11 ± 0,00
10,35 ± 0,28
3,26
3,22
3,13
1,37
1,34
1,31
70,35
71,85
68,31
3,20 ± 0,065
1,34 ± 0,03
70,17 ± 1,78
0,25
0,25
0,26
0,17
0,19
0,17
15,51
16,91
15,37
0,25 ± 0,001
1,20 ± 1,74
0,17 ± 0,01
0,54 ± 0,70
15,93 ± 0,85
32,15 ± 33,04
1,47
1,44
1,47
1,03
1,06
1,04
105,42
103,97
107,40
1,46 ± 0,017
1,04 ± 0,015
105,60 ± 1,72
1,39
1,38
1,39
1,09
1,08
1,06
104,55
102,73
107,62
1,39 ± 0,008
1,08 ± 0,013
104,97 ± 2,47
1,20
1,19
1,19
0,94
0,95
0,97
85,08
85,24
85,84
1,19 ± 0,005
1,35 ± 0,14
0,96 ± 0,013
1,02 ± 0,06
85,39 ± 0,40
98,65 ± 11,50
Aécia Seleide Dantas - 2009
107
Tabela A9 Resultados da quantificação dos elementos traço Cd, Cr e Cu, no Ponto E01
PONTO DE
AMOSTRAGEM
Cd (mg/Kg)
Cr (mg/Kg)
Cu (mg/Kg)
E01 – MD1 R1
E01 – MD1 R2
E01 – MD1 R3
< LD
< LD
< LD
6,32
6,63
6,35
5,18
4,51
5,24
Média E01 – MD1
< LD
6,43 ± 0,17
4,98 ± 0,41
E01 – MD2 R1
E01 – MD2 R2
E01 – MD2 R3
0,13
0,14
0,13
17,65
18,19
17,19
5,67
6,64
5,70
0,13 ± 0,005
17,68 ± 0,50
6,00 ± 0,55
0,09
0,09
0,09
11,93
11,57
11,56
3,24
3,09
3,87
0,09 ± 0,001
0,11 ± 0,033
11,69 ± 0,21
11,93 ± 5,63
3,40 ± 0,41
4,79 ± 1,31
E01 – C1 R1
E01 – C1 R2
E01 – C1 R3
< LD
< LD
< LD
5,33
5,36
5,06
1,12
1,18
0,93
Média E01 – C1
< LD
5,25 ± 0,16
1,07 ± 0,13
E01 – C2 R1
E01 – C2 R2
E01 – C2 R3
< LD
< LD
< LD
7,98
8,00
8,28
2,04
1,59
2,05
Média E01 – C2
< LD
8,09 ± 0,17
1,89 ± 0,26
E01 – C3 R1
E01 – C3 R2
E01 – C3 R3
< LD
< LD
< LD
7,20
7,45
7,44
2,31
3,20
2,11
Média E01 – C3
MÉDIA E01 - C
< LD
< LD
7,36 ± 0,14
7,16 ± 1,83
2,54 ± 0,58
1,83 ± 0,73
E01 – ME1 R1
E01 – ME1 R2
E01 – ME1 R3
0,44
0,44
0,480
51,84
50,96
52,37
154,66
132,90
167,36
0,45 ± 0,02
51,72 ± 0,71
151,64 ± 17,42
0,47
0,45
0,48
51,48
50,80
54,68
119,51
113,78
139,30
0,47 ± 0,02
52,32 ± 2,07
124,20 ± 13,40
0,49
0,49
0,51
63,94
62,40
68,55
178,12
121,85
155,68
0,50 ± 0,01
0,47 ± 0,02
64,96 ± 3,20
56,33 ± 7,48
151,88 ± 28,33
142,57 ± 15,91
Média E01 – MD2
E01 – MD3 R1
E01 – MD3 R2
E01 – MD3 R3
Média E01 – MD3
MÉDIA E01 - MD
Média E01 – ME1
E01 – ME2 R1
E01 – ME2 R2
E01 – ME2 R3
Média E01 – ME2
E01 – ME3 R1
E01 – ME3 R2
E01 – ME3 R3
Média E01 – ME3
MÉDIA E01 - ME
Aécia Seleide Dantas - 2009
108
Tabela A10 Resultados da quantificação dos elementos traço Cd, Cr e Cu, no Ponto E02
PONTO DE
AMOSTRAGEM
Cd (mg/Kg)
Cr (mg/Kg)
Cu (mg/Kg)
0,19
0,19
0,19
27,74
27,82
26,93
9,52
9,29
8,57
0,19 ± 0,004
27,49 ± 0,49
9,12 ± 0,49
0,17
0,18
0,18
24,34
23,87
24,43
7,96
8,47
7,97
0,17 ± 0,001
24,21 ± 0,30
8,13 ± 0,29
0,12
0,11
0,11
16,76
15,95
16,14
4,43
4,72
4,81
0,11 ± 0,005
0,16 ± 0,04
16,29 ± 0,42
22,66 ± 5,76
4,65 ± 0,20
7,30 ± 2,35
E02 – C1 R1
E02 – C1 R2
E02 – C1 R3
< LD
< LD
< LD
2,77
3,16
2,93
1,21
1,98
1,07
Média E02 – C1
< LD
2,95 ± 0,19
1,42 ± 0,49
E02 – C2 R1
E02 – C2 R2
E02 – C2 R3
< LD
< LD
< LD
4,47
4,37
4,26
1,17
1,17
1,18
Média E02 – C2
< LD
4,36 ± 0,10
1,17 ± 0,005
E02 – C3 R1
E02 – C3 R2
E02 – C3 R3
< LD
< LD
< LD
3,54
3,59
3,62
1,09
1,23
1,13
Média E02 – C3
MÉDIA E02 - C
< LD
< LD
3,58 ± 0,04
3,63 ± 0,71
1,15 ± 0,07
1,25 ± 0,15
E02 – ME1 R1
E02 – ME1 R2
E02 – ME1 R3
0,63
0,61
0,62
85,25
83,25
84,59
22,90
22,59
23,05
0,62 ± 0,009
84,36 ± 1,02
22,85 ± 0,24
0,55
0,55
0,54
76,26
75,93
74,86
20,32
20,07
19,81
0,55 ± 0,005
75,68 ± 0,73
20,07 ± 0,25
0,52
0,52
0,50
71,96
71,56
68,66
19,31
19,23
18,63
0,52 ± 0,01
0,56 ± 0,05
70,73 ± 1,80
76,92 ± 6,90
19,06 ± 0,37
20,66 ± 1,96
E02 – MD1 R1
E02 – MD1 R2
E02 – MD1 R3
Média E02 – MD1
E02 – MD2 R1
E02 – MD2 R2
E02 – MD2 R3
Média E02 – MD2
E02 – MD3 R1
E02 – MD3 R2
E02 – MD3 R3
Média E02 – MD3
MÉDIA E02 - MD
Média E02 – ME1
E02 – ME2 R1
E02 – ME2 R2
E02 – ME2 R3
Média E02 – ME2
E02 – ME3 R1
E02 – ME3 R2
E02 – ME3 R3
Média E02 – ME3
MÉDIA E02 - ME
Aécia Seleide Dantas - 2009
109
Tabela A11 Resultados da quantificação dos elementos traço Cd, Cr e Cu, no Ponto E03
PONTO DE
AMOSTRAGEM
Cd (mg/Kg)
Cr (mg/Kg)
Cu (mg/Kg)
E03 – MD1 R1
E03 – MD1 R2
E03 – MD1 R3
< LD
< LD
< LD
2,28
2,36
2,22
0,39
0,55
0,31
Média E03 – MD1
< LD
2,29 ± 0,07
0,42 ± 0,12
E03 – MD2 R1
E03 – MD2 R2
E03 – MD2 R3
< LD
< LD
< LD
3,23
3,33
3,13
0,77
0,46
0,49
Média E03 – MD2
< LD
3,23 ± 0,10
0,58 ± 0,17
E03 – MD3 R1
E03 – MD3 R2
E03 – MD3 R3
< LD
< LD
< LD
2,67
2,90
2,73
0,55
0,44
0,48
Média E03 – MD3
MÉDIA E03 - MD
< LD
< LD
2,77 ± 0,12
2,76 ± 0,47
0,49 ± 0,06
0,49 ± 0,08
E03 – C1 R1
E03 – C1 R2
E03 – C1 R3
0,11
0,11
0,11
19,83
20,16
19,23
3,66
3,77
3,62
0,11 ± 0,003
19,74 ± 0,47
3,68 ± 0,08
0,10
0,01
0,01
16,22
16,06
16,21
3,38
3,34
3,56
0,01 ± 0,002
16,17 ± 0,09
3,43 ± 0,11
< LD
< LD
< LD
6,09
6,11
7,96
1,39
1,15
1,37
< LD
0,10 ± 0,009
6,72 ± 1,08
14,21 ± 6,73
1,30 ± 0,13
2,80 ± 1,31
0,48
0,49
0,47
74,65
75,56
73,25
22,80
23,63
22,34
0,48 ± 0,009
74,49 ± 1,16
22,92 ± 0,65
0,53
0,53
0,55
82,28
80,96
85,10
25,20
24,80
26,21
0,54 ± 0,01
82,78 ± 2,11
25,40 ± 0,73
0,40
0,41
0,40
62,89
63,44
62,67
16,92
17,04
16,86
0,40 ± 0,003
0,47 ± 0,07
63,00 ± 0,40
73,42 ± 9,93
16,94 ± 0,09
21,75 ± 4,35
Média E03 – C1
E03 – C2 R1
E03 – C2 R2
E03 – C2 R3
Média E03 – C2
E03 – C3 R1
E03 – C3 R2
E03 – C3 R3
Média E03 – C3
MÉDIA E03 - C
E03 – ME1 R1
E03 – ME1 R2
E03 – ME1 R3
Média E03 – ME1
E03 – ME2 R1
E03 – ME2 R2
E03 – ME2 R3
Média E03 – ME2
E03 – ME3 R1
E03 – ME3 R2
E03 – ME3 R3
Média E03 – ME3
MÉDIA E03 - ME
Aécia Seleide Dantas - 2009
110
Tabela A12 Resultados da quantificação dos elementos traço Cd, Cr e Cu, no Ponto E04
PONTO DE
AMOSTRAGEM
Cd (mg/Kg)
Cr (mg/Kg)
Cu (mg/Kg)
E04 – MD1 R1
E04 – MD1 R2
E04 – MD1 R3
< LD
< LD
< LD
4,69
6,36
4,91
0,97
0,93
0,84
Média E04 – MD1
< LD
5,32 ± 0,91
0,91 ± 0,07
E04 – MD2 R1
E04 – MD2 R2
E04 – MD2 R3
< LD
< LD
< LD
4,98
5,02
4,72
1,22
0,76
0,80
Média E04 – MD2
< LD
4,91 ± 0,17
0,93 ± 0,25
E04 – MD3 R1
E04 – MD3 R2
E04 – MD3 R3
< LD
< LD
< LD
5,11
5,01
5,21
1,24
1,83
1,02
Média E04 – MD3
MÉDIA E04 - MD
< LD
< LD
5,11 ± 0,10
5,11 ± 0,21
1,36 ± 0,42
1,07 ± 0,25
E04 – C1 R1
E04 – C1 R2
E04 – C1 R3
< LD
< LD
< LD
2,86
2,87
2,79
0,50
0,90
0,67
Média E04 – C1
< LD
2,84 ± 0,04
0,69 ± 0,20
E04 – C2 R1
E04 – C2 R2
E04 – C2 R3
0,180
0,177
0,176
40,88
34,00
33,16
3,25
2,92
2,88
Média E04 – C2
0,177 ± 0,002
36,01 ± 4,23
3,01 ± 0,21
E04 – C3 R1
E04 – C3 R2
E04 – C3 R3
< LD
< LD
< LD
4,45
4,44
4,48
0,87
0,91
0,81
Média E04 – C3
MÉDIA E04 - C
< LD
0,18
4,46 ± 0,02
14,43 ± 18,70
0,86 ± 0,05
1,52 ± 1,29
E04 – ME1 R1
E04 – ME1 R2
E04 – ME1 R3
0,142
0,140
0,144
21,22
20,77
21,56
4,26
3,54
3,82
Média E04 – ME1
0,142 ± 0,002
21,18 ± 0,40
3,88 ± 0,36
E04 – ME2 R1
E04 – ME2 R2
E04 – ME2 R3
0,145
0,142
0,148
20,82
20,51
21,22
3,08
3,20
3,23
Média E04 – ME2
0,145 ± 0,003
20,85 ± 0,35
3,17 ± 0,08
E04 – ME3 R1
E04 – ME3 R2
E04 – ME3 R3
0,133
0,132
0,133
18,63
18,47
18,67
2,71
2,74
2,67
Média E04 – ME3
MÉDIA E04 - ME
0,133 ± 0,001
0,14 ± 0,006
18,59 ± 0,10
20,21 ± 1,41
2,71 ± 0,03
3,25 ± 0,59
Aécia Seleide Dantas - 2009
111
Tabela A13 Resultados da quantificação dos elementos traço Ni, Pb e Zn, no Ponto E01
PONTO DE
AMOSTRAGEM
Ni (mg/Kg)
Pb (mg/Kg)
Zn (mg/Kg)
E01 – MD1 R1
E01 – MD1 R2
E01 – MD1 R3
2,55
2,58
2,47
2,99
2,78
2,78
14,14
14,81
11,76
Média E01 – MD1
2,53 ± 0,06
2,85 ± 0,12
13,57 ± 1,60
E01 – MD2 R1
E01 – MD2 R2
E01 – MD2 R3
7,42
7,72
7,19
5,28
5,41
5,18
22,95
23,55
24,88
Média E01 – MD2
7,44 ± 0,27
5,29 ± 0,12
23,80 ± 0,98
E01 – MD3 R1
E01 – MD3 R2
E01 – MD3 R3
4,73
4,73
4,68
3,77
3,60
3,62
19,36
18,88
22,11
Média E01 – MD3
MÉDIA E01 - MD
4,71 ± 0,03
4,90 ± 2,46
3,66 ± 0,09
3,93 ± 1,24
20,11 ± 1,74
19,16 ± 5,18
E01 – C1 R1
E01 – C1 R2
E01 – C1 R3
2,14
2,22
2,06
1,94
1,90
1,83
9,53
11,17
11,58
Média E01 – C1
2,14 ± 0,07
1,89 ± 0,05
10,76 ± 1,08
E01 – C2 R1
E01 – C2 R2
E01 – C2 R3
3,24
3,17
3,15
2,70
2,61
2,71
16,28
12,26
16,80
Média E01 – C2
3,19 ± 0,05
2,68 ± 0,05
15,11 ± 2,49
E01 – C3 R1
E01 – C3 R2
E01 – C3 R3
3,21
4,29
3,14
2,40
2,42
2,49
12,69
13,48
13,65
Média E01 – C3
MÉDIA E01 - C
3,55 ± 0,64
2,96 ± 0,73
2,44 ± 0,04
2,33 ± 0,40
13,27 ± 0,51
13,05 ± 2,18
E01 – ME1 R1
E01 – ME1 R2
E01 – ME1 R3
18,69
18,41
18,92
63,18
87,38
46,76
135,72
150,22
158,78
Média E01 – ME1
18,67 ± 0,26
65,77 ± 20,43
148,24 ± 11,66
E01 – ME2 R1
E01 – ME2 R2
E01 – ME2 R3
18,35
17,74
18,21
49,61
52,71
54,53
121,49
123,36
129,27
Média E01 – ME2
18,10 ± 0,32
52,28 ± 2,48
124,71 ± 4,06
E01 – ME3 R1
E01 – ME3 R2
E01 – ME3 R3
21,46
20,98
22,02
54,52
51,65
60,27
137,33
131,34
136,12
Média E01 – ME3
MÉDIA E01 - ME
21,48 ± 0,52
19,42 ± 1,80
55,48 ± 4,39
57,84 ± 7,05
134,93 ± 3,16
135,96 ± 11,80
Aécia Seleide Dantas - 2009
112
Tabela A14 Resultados da quantificação dos elementos traço Ni, Pb e Zn, no Ponto E02
PONTO DE
AMOSTRAGEM
Ni (mg/Kg)
Pb (mg/Kg)
Zn (mg/Kg)
E02 – MD1 R1
E02 – MD1 R2
E02 – MD1 R3
10,88
10,85
10,95
8,22
8,32
8,06
27,01
27,55
31,19
Média E02 – MD1
10,89 ± 0,05
8,20 ± 0,13
28,58 ± 2,27
E02 – MD2 R1
E02 – MD2 R2
E02 – MD2 R3
10,60
8,81
8,90
8,53
8,65
8,35
25,63
27,34
28,30
Média E02 – MD2
9,44 ± 1,00
8,51 ± 0,15
27,09 ± 1,35
E02 – MD3 R1
E02 – MD3 R2
E02 – MD3 R3
5,94
5,99
5,63
6,77
5,71
5,45
19,15
17,99
17,93
Média E02 – MD3
MÉDIA E02 - MD
5,86 ± 0,20
8,73 ± 2,60
5,98 ± 0,70
7,56 ± 1,38
18,36 ± 0,69
24,68 ± 5,52
E02 – C1 R1
E02 – C1 R2
E02 – C1 R3
1,22
1,68
1,12
1,72
1,90
1,69
28,32
NA
24,88
Média E02 – C1
1,34 ± 0,30
1,77 ± 0,11
26,60 ± 2,43
E02 – C2 R1
E02 – C2 R2
E02 – C2 R3
1,70
1,68
1,62
2,14
2,05
2,03
11,36
11,56
13,21
Média E02 – C2
1,67 ± 0,04
2,07 ± 0,06
12,04 ± 1,01
E02 – C3 R1
E02 – C3 R2
E02 – C3 R3
1,38
1,66
1,38
2,10
2,11
2,11
12,26
NA
11,88
Média E02 – C3
MÉDIA E02 - C
1,48 ± 0,16
1,49 ± 0,16
2,11 ± 0,006
1,98 ± 0,19
12,07 ± 0,19
16,90 ± 8,4
E02 – ME1 R1
E02 – ME1 R2
E02 – ME1 R3
33,13
32,51
33,04
24,93
24,24
24,57
72,45
77,31
84,88
Média E02 – ME1
32,89 ± 0,33
24,58 ± 0,34
78,21 ± 6,26
E02 – ME2 R1
E02 – ME2 R2
E02 – ME2 R3
29,77
29,63
29,40
22,23
22,35
21,63
65,61
63,31
65,71
Média E02 – ME2
29,60 ± 0,18
22,07 ± 0,39
64,88 ± 1,36
E02 – ME3 R1
E02 – ME3 R2
E02 – ME3 R3
26,19
26,11
25,12
22,71
22,80
22,42
63,10
63,56
60,83
Média E02 – ME3
MÉDIA E02 - ME
25,81 ± 0,60
29,43 ± 3,54
22,07 ± 0,77
22,98 ± 1,39
62,50 ± 1,46
68,53 ± 8,47
Aécia Seleide Dantas - 2009
113
Tabela A15 Resultados da quantificação dos elementos traço Ni, Pb e Zn, no Ponto E03
PONTO DE
AMOSTRAGEM
Ni (mg/Kg)
Pb (mg/Kg)
Zn (mg/Kg)
E03 – MD1 R1
E03 – MD1 R2
E03 – MD1 R3
0,89
1,15
0,77
1,09
1,20
0,99
7,19
9,01
7,56
Média E03 – MD1
0,93 ± 0,19
1,10 ± 0,10
7,92 ± 0,96
E03 – MD2 R1
E03 – MD2 R2
E03 – MD2 R3
1,14
1,13
1,07
1,47
1,53
1,50
9,68
9,19
8,69
Média E03 – MD2
1,12 ± 0,04
1,50 ± 0,03
9,19 ± 0,50
E03 – MD3 R1
E03 – MD3 R2
E03 – MD3 R3
0,97
1,01
1,20
1,24
1,26
1,26
9,14
7,84
9,14
Média E03 – MD3
MÉDIA E03 - MD
1,06 ± 0,12
1,04 ± 0,09
1,25 ± 0,01
1,28 ± 0,20
8,70 ± 0,75
8,60 ± 0,64
E03 – C1 R1
E03 – C1 R2
E03 – C1 R3
7,84
7,80
7,86
4,85
4,96
4,99
22,90
21,28
21,49
Média E03 – C1
7,83 ± 0,03
4,93 ± 0,07
21,89 ± 0,88
E03 – C2 R1
E03 – C2 R2
E03 – C2 R3
6,55
6,68
6,63
5,42
5,42
5,54
20,22
20,33
25,03
Média E03 – C2
6,62 ± 0,07
5,46 ± 0,07
21,86 ± 2,75
E03 – C3 R1
E03 – C3 R2
E03 – C3 R3
2,46
2,76
2,59
2,76
2,59
3,04
11,94
10,97
13,67
Média E03 – C3
MÉDIA E03 - C
2,60 ± 0,15
5,69 ± 2,74
2,80 ± 0,22
4,40 ± 1,41
12,19 ± 1,37
18,65 ± 5,59
E03 – ME1 R1
E03 – ME1 R2
E03 – ME1 R3
36,84
37,41
36,05
22,58
23,05
22,47
73,26
76,00
69,91
Média E03 – ME1
36,76 ± 0,68
22,70 ± 0,31
73,06 ± 3,05
E03 – ME2 R1
E03 – ME2 R2
E03 – ME2 R3
41,78
41,03
43,20
24,50
23,71
25,29
71,49
72,10
78,94
Média E03 – ME2
42,00 ± 1,10
24,50 ± 0,79
74,18 ± 4,14
E03 – ME3 R1
E03 – ME3 R2
E03 – ME3 R3
28,16
28,34
28,07
22,38
22,95
22,24
58,12
58,11
61,82
Média E03 – ME3
MÉDIA E03 - ME
28,19 ± 0,14
35,65 ± 6,97
22,53 ± 0,38
23,24 ± 1,09
59,35 ± 2,14
68,86 ± 8,26
Aécia Seleide Dantas - 2009
114
Tabela A16 Resultados da quantificação dos elementos traço Ni, Pb e Zn, no Ponto E04
PONTO DE
AMOSTRAGEM
Ni (mg/Kg)
Pb (mg/Kg)
Zn (mg/Kg)
E04 – MD1 R1
E04 – MD1 R2
E04 – MD1 R3
1,95
2,08
2,00
1,93
2,01
1,85
12,91
19,13
15,71
Média E04 – MD1
2,01 ± 0,06
1,93 ± 0,08
15,92 ± 3,11
E04 – MD2 R1
E04 – MD2 R2
E04 – MD2 R3
2,07
1,95
1,85
2,14
2,09
1,99
19,21
11,03
14,69
Média E04 – MD2
1,96 ± 0,11
2,07 ± 0,07
14,98 ± 4,09
E04 – MD3 R1
E04 – MD3 R2
E04 – MD3 R3
2,10
1,99
1,98
2,08
1,93
2,05
18,98
14,74
12,05
Média E04 – MD3
MÉDIA E04 - MD
2,02 ± 0,07
2,00 ± 0,03
2,02 ± 0,08
2,01 ± 0,07
15,25 ± 3,50
15,38 ± 0,48
E04 – C1 R1
E04 – C1 R2
E04 – C1 R3
1,14
1,30
1,58
1,54
1,57
1,47
59,26
64,93
NA
Média E04 – C1
1,34 ± 0,22
1,52 ± 0,05
62,07 ± 4,01
E04 – C2 R1
E04 – C2 R2
E04 – C2 R3
9,80
9,80
9,66
16,92
16,56
16,17
NA
28,66
24,62
Média E04 – C2
9,75 ± 0,08
16,55 ± 0,37
26,64 ± 2,85
E04 – C3 R1
E04 – C3 R2
E04 – C3 R3
1,62
1,78
1,59
2,61
2,59
2,61
26,64
NA
25,04
Média E04 – C3
MÉDIA E04 - C
1,66 ± 0,10
4,25 ± 4,77
2,60 ± 0,01
6,89 ± 8,38
25,84 ± 1,13
38,19 ± 20,70
E04 – ME1 R1
E04 – ME1 R2
E04 – ME1 R3
8,41
7,73
7,97
9,15
8,36
8,69
21,91
21,35
23,41
Média E04 – ME1
8,04 ± 0,34
8,73 ± 0,40
22,22 ± 1,06
E04 – ME2 R1
E04 – ME2 R2
E04 – ME2 R3
7,36
7,32
7,58
9,05
8,56
8,73
20,45
21,29
22,05
Média E04 – ME2
7,42 ± 0,14
8,78 ± 0,25
21,26 ± 0,80
E04 – ME3 R1
E04 – ME3 R2
E04 – ME3 R3
6,36
6,43
6,50
7,72
7,54
7,56
22,94
23,23
26,93
Média E04 – ME3
MÉDIA E04 - ME
6,43 ± 0,07
7,30 ± 0,81
7,60 ± 0,10
8,37 ± 0,66
24,37 ± 2,22
22,62 ± 1,59
Aécia Seleide Dantas - 2009