Setor 2322 – Aulas 1 e 2 – Sistemas
Resolução dos exercícios de aula
AULA 1
Exercício 1: (Discutido durante a aula) Um sistema será uma substância pura quando esse for
composto por um único tipo de substância. Nesse caso, o sistema será representado por uma
única fórmula, ou seja, moléculas iguais. Podem ser considerados como sendo substâncias
puras os sistemas I, III e IV.
As substâncias (puras) podem ser classificadas de acordo com a quantidade de elementos
químicos que as compõem. Uma substância formada por um único elemento químico é
chamada de substância simples. Uma substância formada por mais do que um elemento
químico é chamada de substância composta.
O sistema I tem suas moléculas formadas por apenas um tipo de elemento químico
(representado pela bola branca), sendo, portanto uma substância simples.
O sistema III tem suas moléculas formadas por dois tipos de elemento químico (representados
pela bola branca e pela bola preta), sendo, portanto, uma substância composta.
O sistema IV tem suas moléculas formadas por dois tipos de elemento químico (representados
pela bola branca e pela bola com X), sendo, portanto, uma substância composta.
Quando um sistema formado por mais do que uma substância ele será classificado como uma
mistura. Isso significa que esse sistema será formado por mais do que um tipo de molécula. É o
caso dos sistemas II, V e VI.
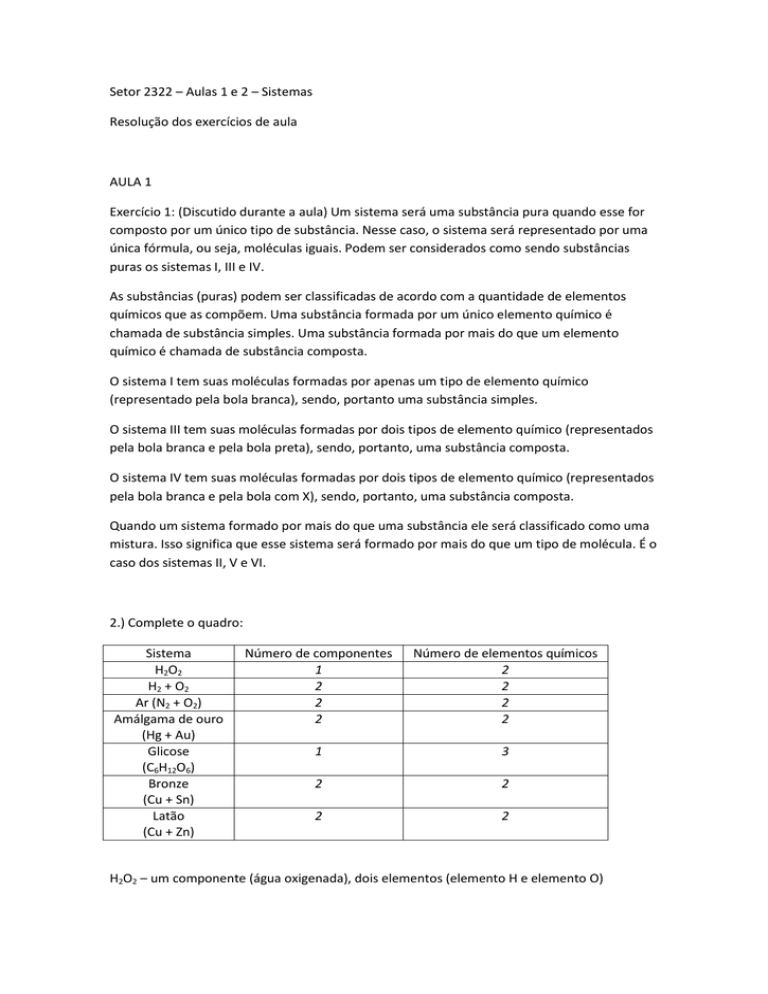
2.) Complete o quadro:
Sistema
H2O2
H2 + O2
Ar (N2 + O2)
Amálgama de ouro
(Hg + Au)
Glicose
(C6H12O6)
Bronze
(Cu + Sn)
Latão
(Cu + Zn)
Número de componentes
1
2
2
2
Número de elementos químicos
2
2
2
2
1
3
2
2
2
2
H2O2 – um componente (água oxigenada), dois elementos (elemento H e elemento O)
H2 + O2 – dois componentes (gás hidrogênio e gás oxigênio), dois elementos (elemento H e
elemento O).
Ar – dois componentes (gás nitrogênio e gás oxigênio), dois elementos (elemento N e
elemento O).
Amálgama – dois componentes (metal mercúrio e metal ouro), dois elementos (elemento Hg e
elemento Au).
Glicose – um componente, três elemento (elemento C, elemento H e elemento O).
Bronze – dois componentes (metal cobre e metal estanho), dois elementos (elemento Cu e
elemento Sn).
Latão – dois componentes (metal cobre e metal zinco), dois elementos (elemento Cu e
elemento Zn).
3) (discutido em aula). Para determinar o estado físico de uma substância em condições
ambientes, comparamos a temperatura em questão (25°C) com as temperaturas de fusão e
ebulição.
Se a temperatura ambiente for menor que a temperatura de fusão, a substância será sólida.
Se a temperatura ambiente for maior que a temperatura de fusão, mas menor que a
temperatura de ebulição, a substância será líquida.
Se a temperatura ambiente for maior que a temperatura de ebulição, a substância será gasosa.
X: -90°C (te) < 25°C, portanto gás.
Y: -30°C (tf) < 25°C < 45°C (te), portanto líquido.
Z: 25°C < 75°C (tf), portanto sólido.
4) (discutido em aula). Uma substância pura tem seus processos de mudança de fase
acontecendo com temperatura constante. No caso da água, a fusão ocorre a 0°C e a ebulição a
100°C:
AULA 2
1) O sistema no interior do frasco apresenta 1 componente e 3 fases. Portanto, é um sistema
heterogêneo.
O sistema é formado por apenas uma substância, a água (H2O), em três fases distintas (sólido,
líquido e gasoso). Como o sistema tem mais de uma fase, é classificado como sistema
heterogêneo.
2) Conceituar “solução”.
SOLUÇÃO É QUALQUER MISTURA HOMOGÊNEA.
3) O sistema I é uma mistura de dois sólidos, ouro e cobre. É então uma mistura heterogênea
com duas fases.
Aquecendo o sistema I, os dois metais fundem e se misturam de forma uniforme. O sistema II
é então uma mistura líquida homogênea dos dois metais.
Ao resfriar II, forma-se uma liga metálica, o ouro 18 quilates, uma mistura homogênea de ouro
e cobre. Corresponde então ao uma solução sólida.
Da massa total dos sistemas (24 gramas), 18 gramas correspondem ao ouro, ou seja, esse
equivale a 75% da massa da mistura.
4) O sistema apresenta 4 componentes: água, quartzo, feldspato e mica (os três últimos
componentes do granito).
O sistema apresenta 5 fases: água líquida, água sólida, quartzo, feldspato e mica.
6) a) o sistema é formado por duas fases: água e gasolina.
b) O petróleo flutua no mar por ser imiscível com a água e menos denso do que essa.