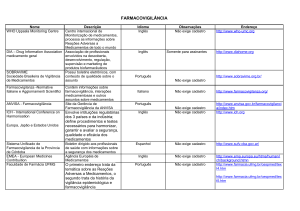
Novos Conceitos, Abordagens e Ferramentas para
Implantação da Farmacovigilância
Roberta Olmo Pinheiro1,3 Lusiele Guaraldo2, José Liporage Teixeira2 & Gilberto
Marcelo Sperandio da Silva1,2.
Resumo: O presente artigo visa identificar alguns conceitos, abordagens e
ferramentas para facilitar a implantação da Farmacovigilância nas comunidades científicas
que trabalham com Farmácia Hospitalar. Serão discutidos aspectos relacionados à interface
epidemiologia-notificação de eventos adversos a medicamentos e o fármaco como possível
agente causador de doenças. Serão apresentadas algumas dicas de “softwares” e estratégias
que podem ser utilizadas.
Abstract: The aim of the present article is to identify some concepts, boarding and
tools to facilitate pharmacovigilance implantation in scientific communities that work in
hospital pharmacy. It will be discussed mainly the interface epidemiology – drug adverse
events notification and drugs as possible conditioning agent of diseases. Some examples of
softwares and strategies will be presented.
Palavras-Chave: Farmacovigilância, Farmacoepidemiologia,
Toxicologia, Notificação, Eventos adversos a Medicamentos.
Epidemiologia,
Key Words: Pharmacovigilance; Pharmacoepidemiology;
Toxicology, Notification, Drug Adverse Events.
Epidemiology;
1. Introdução
A Farmacovigilância é a ciência relativa à detecção, avaliação, compreensão e
prevenção dos efeitos adversos ou quaisquer problemas relacionados a medicamentos
(ANVISA, 2007). Entretanto o conceito clássico pode ser entendido como o
acompanhamento dos eventos adversos a medicamentos, principalmente reações adversas a
medicamentos após a sua colocação no mercado (TALBOT & NILSSON, 1998; GOMES
& REIS, 2000). Como exemplo clássico, a referência ao trágico caso da talidomida, na
década de 60, do século passado, levou à ocorrência de cerca de 4500 mortes provocadas
por uma má-formação congênita, a focomelia (GOMES & REIS, 2000). Este fato ocorreu
devido a grandes limitações no desenho dos estudos clínicos nas fases anteriores à liberação
desse medicamento. Vale acrescentar o desafio de investigar e documentar, em termos
epidemiológicos e socioeconômicos, se o perfil de segurança obtido nos estudos clínicos,
em populações rigorosamente selecionadas, ainda é válido quando o medicamento é
utilizado na prática clínica (DAINESI, 2005).
Considerando que o tradicional conceito de que o medicamento é usado para fazer o
bem, dar um cunho epidemiológico aos estudos de Farmacogilância parece não ser uma
tarefa tão fácil principalmente registrando que os mesmos podem causar efeitos nocivos à
saúde. Portanto, o presente trabalho visa discutir a implantação de conceitos antigos e
novos, necessários para a pesquisa clínica relativa à Farmacovigilância.
2. A Epidemiologia e a Farmacovigilância.
A partir das definições de Castellanos (1987) e Castiel (1989) podemos inferir que a
epidemiologia estuda os problemas de saúde-doença que nesta categoria aparecem como
variações entre indivíduos ou atributos individuais; e a forma habitual de definição dos
mesmos é a freqüência e a gravidade de uma patologia ou acidente em particular, entre
pessoas com determinados atributos de tempo, espaço ou características biológicas/sociais
individuais (CASTELLANOS, 1987; CASTIEL, 1989). A partir daí percebe-se um enorme
potencial em investigar a freqüência de utilização de medicamentos e, ou, agravos à saúde
causados pelos mesmos ao longo do tempo e espaço. Como exemplo interessante
relacionado à freqüência, pode ser citada a descoberta da SIDA (Síndrome da
Imunodeficiência Adquirida), associada às características epidemiológicas ligadas ao
aumento repentino da utilização do isocianato de pentamidina no final da década de 70
(GOMES, 2000). Em relação aos agravos, pode ser citado o chamado Cutter Incident em
meados da década de 50, onde foram observados 260 casos de poliomielite vacinal e 11
óbitos após a vacinação contra poliomielite em crianças norte-americanas (GOMES, 2000).
Esses fatos, associados ao trágico evento da talidomida na década de 60, vem trazer um
grande impacto para a necessidade sistematização dos estudos de eventos adversos
associados a medicamentos.
3- Elementos essenciais à Farmacovigilância.
Dentre os métodos empregados em Farmacovigilância para a identificação de
reações adversas (RAMs), destacam-se a busca ativa e a notificação espontânea de casos. A
busca ativa de casos pode ser realizada em pacientes ambulatoriais ou internados
selecionados através de critérios pré-definidos como por exemplo: em pacientes de alto
risco para infecção hospitalar, com diagnósticos específicos (leucemia, linfoma,
granulocitopenia, diabetes, SIDA e dermatose extensa, entre outros); com exames
laboratoriais alterados (hemocultura positiva, TGO, TGP, Uréia, creatinina); com tempo de
internação prolongado ou ainda àqueles em uso de medicamentos para tratar as RAMs
(anti-alérgicos, anti-ulcerosos, anti-diarréicos , entre outros).
No método de notificação espontânea, as queixas de eventos adversos a
medicamentos (EAM) provenientes de pacientes são relatadas aos profissionais de saúde
para preenchimento do formulário de notificação de suspeita de evento adverso e queixa
técnica relacionados ao medicamento. Os formulários utilizados nos estudos de
Farmacovigilância devem apresentar, pelo menos, os campos de preenchimento propostos
na Tabela 1 (ANVISA, 2007b)
Tabela 1. Campos que devem apresentar em um Formulário de Notificação de Suspeita de
Reação Adversa e Queixa Técnica a Medicamento para os estudos de farmacovigilância
DADOS DO PACIENTE:
Nome ou iniciais para proteger a identidade do paciente, idade (< 1ano/meses), peso. O número do
prontuário e hospital, se for o caso;
DESCRIÇÃO DA REAÇÃO ADVERSA:
Deve ser Descrito o diagnóstico clínico - na sua ausência, os sinais e sintomas (ex: icterícia, náusea, tontura,
choque anafilático). A data (dia/mês/ano) do início e fim da reação bem como a duração aproximada (em
dias ou horas). Deve incluir dados laboratoriais relevantes.
MEDICAMENTO(S) SUSPEITO(S) DE CAUSAR RAM:
Deve ser notificado o medicamento que é considerado o mais provável de ter produzido a reação,
descrevendo o nome genérico ou comercial. - Dose diária; - Via de administração: Informação se oral,
intravenosa, subcutânea, intradérmica, ocular, sublingual, retal, tópico entre outros; - Tratamento: Data do
início e fim da terapêutica (dia/mês/ano) e duração (aproximada em dias ou horas); - Motivo da indicação:
causa ou sintomatologia que motivou a medicação. Caso exista mais medicamentos suspeitos, notificá-los.
MEDICAMENTOS PRESCRITOS OU TOMADOS POR AUTOMEDICAÇÃO:
Deve ser notificado os demais medicamentos prescritos e os utilizados nos últimos 15 dias, incluindo
automedicação, excluídos aqueles utilizados para o tratamento da RAM.
EVOLUÇÃO DO PACIENTE:
CONDUTA:
Informação sobre a terapêutica eventualmente instituída para o controle da RAM.
REEXPOSIÇÃO:
Informação se ocorreu a reexposição ao medicamento.
DADOS DO NOTIFICADOR
(Fonte: ANVISA, 2007b)
A partir da construção do formulário de notificação espontânea, processa-se a coleta
de dados dos pacientes com suspeita de RAM. A avaliação científica da farmacovigilância
baseia-se no acúmulo e na avaliação sistemática das notificações espontâneas de reações
adversas, cuja causalidade é avaliada com a aplicação de algoritmos desenvolvidos para
essa finalidade, sendo o mais conhecido o de Naranjo (NARANJO & BUSTO, 1992). Na
medida da consistência da hipótese de causalidade, da gravidade da reação observada, do
volume de notificações e do número potencial de pessoas afetadas, são tomadas decisões
quanto ao uso e comercialização do medicamento junto às autoridades sanitárias e
indústrias farmacêuticas envolvidas, solicitando as medidas cabíveis, ampla informação aos
profissionais de saúde ou, mesmo, ao público em geral.
Para que a correta análise das suspeitas de RAMs, as notificações coletadas devem
ser cuidadosamente examinadas para verificação da necessidade de informações
complementares e controle de qualidade (fonte da informação, clareza, campos não
preenchidos, qualidade do diagnóstico e acompanhamento), sendo em seguida numeradas e
codificadas. A padronização desta análise envolve classificações posteriores tais como a
classificação ATC para os medicamentos (Anatomical Therapeutical Chemical
Classification, 2007, OMS), a classificação WHO-ART para as reações adversas, (World
Health Organization- Adverse Reaction Terminology, 1997 – OMS, 1997) e para as
doenças, a Classificação Estatística Internacional de Doenças e Problemas Relacionados à
Saúde/CID-10 (OMS, 1996). A análise dos casos deve sempre ser acompanhada de revisão
bibliográfica, com busca de informações em bases de dados, tais como: Medline,
Micromedex e outros, na Internet.
4- Análise Farmacoepidemiológica
A análise das informações geradas pelo formulário de notificação de suspeita de
evento adverso e queixa técnica relacionados a medicamentos é facilitada pela construção
de um banco de dados construído por meio de “softwares” que possibilitem uma visão
estatística e epidemiológica dos dados coletados, como por exemplo os programas: EPI-
INFO (CDC, version 6.0) ou SPSS WIN 8.0 (© 2007 SPSS Inc.) ou Stata 7.0 (Stata
Corporation, College Station,. Estados Unidos). Os dados digitados e editados com a recodificação de variáveis facilitam as análises requeridas ao estudo dos efeitos adversos
(gravidade, tipo, causa provável, duração, conduta, dose de medicação e tratamento
concomitante).
1. Grupo de Pesquisa do Curso de Farmácia (GFAR). Centro Universitário Augusto Motta
(UNISUAM), Rio de Janeiro, RJ.
2. Instituto de Pesquisa Clínica Evandro Chagas (IPEC / FIOCRUZ) , Rio de Janeiro, RJ.
3. Instituto Oswaldo Cruz (IOC / FIOCRUZ)
e-mail do autor responsável: [email protected]
5. Referências:
ANVISA. Agência Nacional de Vigilância Sanitária (ANVISA). Disponível no site
http://www.anvisa.gov.br/servicos/form/farmaco/orienta.htm em 03/02/2007b.
ANVISA. Agência Nacional de Vigilância Sanitária (ANVISA). Disponível no site
http://www.anvisa.gov.br/farmacovigilancia/conceito_glossario.htm em 03/02/2007.
CASTELLANOS, P. 1987. Sobre el concepto de Salud - Enfermedad: un punto de vista
epidemiológico.Documento apresentado no V Congreso Mundial de Medicina Social
Medellin, Colombia, Julio, 1987.
CASTIEL, LD. 1989. O Epidemiologista e os Serviços de Saúde Coletiva no Brasil. Cad.
Saúde Pública. vol.5 no.1. 17-23.
DAINESI, S. 2005. Como colaborar na implantação da farmacovigilância em nosso país?
Rev. Assoc. Med. Bras. 51:4. 186.
GOMES, M. JVM.& REIS, AMM. 2000. Ciências Farmacêuticas - Uma abordagem em
Farmácia Hospitalar, São Paulo: Atheneu. 559p.
NARANJO, CA & BUSTO, UE. Desarrolo de medicamentos nuevos y regulaciones sobre
medicamentos. In: Metodos em farmacologia clinica (C. A. Naranjo, P. du Souich & U. E.
Busto, eds.). Washington, OPAS, 1992; 1-16.
OMS (Organização Mundial Da Saúde), 1996. CID-10: Classificação Estatística
Internacional de Doenças e Problemas Relacionados à Saúde. São Paulo: Centro
Colaborador da OMS para a Classificação de Doenças em Português/Edusp.
OMS (Organização Mundial de Saúde - WHO), 2007. Anatomical Therapeutical Chemical
Classification. Uppsala: Nordic Council on Medicines.
OMS (Organização Mundial de Saúde - WHO), 1997. Adverse Reaction Terminology.
Uppsala: The Uppsala Monitoring Centre.
TALBOT, JCC & NILSSON BS. 1998. Pharmacovigilance in the pharmaceutical industry.
J Clin Pharmacol 45: 427-31.