Mestrado Integrado em Engenharia Biomédica
Instituto Superior Técnico & Faculdade de Medicina
Ano Lectivo 2010/2011
2º ano – 2º semestre
Metabolismo e Endocrinologia
(Resumo da componente teórica)
Feito por:
Filipa Vieira
Sandro Nunes
Hemoglobina – é um tetrâmero formado por quatro subunidades agrupadas em dímeros. Cada
dímero tem uma subunidade alpha e outra beta e cada subunidade contém um grupo prostético, o
heme - formado por um átomo de Fe ligado a um anel orgânico e pode estabelecer uma ligação com
o oxigénio O2, ou com outros gases respiratórios.
fixação/libertação de uma molécula de O2 do heme leva à alteração da sua conformação e
consequente deformação da proteína.
oxihemoglobina tem uma estrutura mais compacta quando comparada com a
desoxihemoglobina porque na ausência de oxigénio a região do heme expande-se. Esta
alteração promove cooperatilvidade (quando uma subunidade fixa um oxigénio, diminui de
tamanho, e aumenta a afinidade das outras subunidades à molécula de O2. Assim quanto
maior a saturação em oxigénio de uma molécula, maior sua afinidade com este.
Regulação alostérica as propriedades de um dos locais de ligação da hemoglobina pode ser
alterada pela associação de uma molécula ligante a outro local de ligação da mesma
proteína. Vantagem: eficiência. Desvantagem: susceptível de ser regulada por factores
externos como pH, CO2, TºC.
Curva de sigmóide – relação entre a pressão parcial de oxigénio e a saturação da hemoglobina.
Pressão de O2 é baixa nos tecidos periféricos – há pouca fixação de O2 e este tende a ser libertado
da hemoglobina, permitindo a oxigenação dos tecidos. Pressão de O2 é elevada nos capilares
pulmonares – há concentrações elevadas de O2, a hemoglobina tende a ficar saturada. Este
mecanismo está na base do transporte de oxigénio entre os pulmões e os tecidos.
Efeito de Bohr – influência de pH e CO2 na afinidade de hemoglobina ao O2.
Nos tecidos periféricos – aumento de CO2 no sangue leva ao aumento de ácido
carbónico que diminui o pH. Os iões H+ ligam-se a resíduos de aminoácidos da
hemoglobina que vão diminui a afinidade desta com o O2, aumentando a oxigenação
dos tecidos e a fixação de CO2 pela hemoglobina. Há um deslocamento da curva de
saturação para baixo e para a direita.
Nos pulmões – há um deslocamento da curva de saturação para cima e para a esquerda.
BPG (2,3-bifosfoglicerato) na regulação da hemoglobina – Esta molécula liga-se a locais que não o de
fixação de O2 e reduz a afinidade da hemoglobina ao oxigénio. Facilita a libertação de O2 nos tecidos
e é muito importante na adaptação a altas altitudes.
Estratégias de regulação do metabolismo:
Fígado:
Essencial ao fornecimento de energia ao encéfalo, músculo e outros órgãos;
Armazena glicogénio e mantém níveis estáveis de glicose;
Faz gliconeogénese – a partir de lactato e de alanina dos músculos, glicerol do tecido
adiposo e aminoácidos glicogénicos da dieta;
Armazena ácidos gordos que lança na corrente sanguínea em VLDL
Em jejum, converte ácidos gordos em corpos cetónicos
Malonil CoA/Carnitina Aciltranferase I regulam degradação Vs envio para tecido adiposo
(armazenamento).
Tecido adiposo:
Reserva de triacilgliceróis;
Estérifica ácidos gordos em triacilgliceróis e hidrolisa triacilgliceróis;
3P-Glicerol (falta o enzima para fosforilar directamente o glicerol) é formado a partir da
glicose;
Hidrólise de triacilgliceróis é um processo controlado por lipases reguladoras por hormonas
através de fosforilação.
Glicerol resultante da hidrólise é exportado para o fígado.
Músculo:
Consome ácidos gordos, glicose e corpos cetónicos;
Armazena muito glicogénio;
Não armazena 6-P-glucose;
Num músculo muito activo, ritmo da glicólise supera ritmo do ácido cítrico e forma-se
lactato que vai para o fígado para formar glicose através do ciclo de Cori;
Em repouso, os ácidos gordos são a principal fonte de energia;
Corpos cetónicos são fonte energética principal do coração.
Encéfalo:
Só consome glicose, excepto em jejum muito prolongado (neste caso consome corpos
cetónicos)
Consome 60% da glicose total em repouso.
Hormonas reguladoras da concentração de glicose no sangue:
1. Insulina;
2. Glucagina;
3. Epinefrina
4. Cortisol
1. Insulina - é secretada no pâncreas (células β) quando aumenta a [glicose] no sangue. O
metabolismo da glicose nas células β aumenta os níveis intracelulares de ATP e leva ao fecho
dos canais de potássio, ocorrendo despolarização. Em resposta à variação do potencial, são
abertos canais de cálcio controlados por voltagem e a sua entrada na célula estimula a
exocitose de vesículas de insulina. A insulina liga-se à subunidade α dos receptores de
insulina existentes na membrana celular que leva à activação da tirosina cinase na
subunidade β por autofosforilação. Esta enzima inicia uma cascata de fosforilações
activando ou inibindo diversas enzimas, (como substratos do receptor de insulina (IRS),
responsáveis pelas acções biológicas da insulina).
A insulina:
- favorece o armazenamento de excesso de glicose sob a forma de glicogénio e triacilgliceróis,
através de:
Estimulação do consumo de glicose pelo músculo e tecido adiposo e a sua conversão em
glicose-6-fosfato;
Estimulação da síntese de glicogénio no fígado e inibição da sua degradação, através da
activação da enzima glicogénio-sintetase e inibição da glicogénio fosforilase;
Estimulação da síntese de lípidos, também no fígado;
Estimulação da oxidação de glicose-6-fosfato a piruvato pela via da glicólise e da oxidação de
piruvato a acetil-CoA. O acetil-CoA pode ser oxidado para obtenção de energia ou utilizado
na síntese de lípidos e seu armazenamento sob a forma de triacilgliceróis.
- também intervém no catabolismo proteico e na expressão genética através da:
Estimulação do transporte de aminoácidos para o meio intracelular;
Estimulação da tradução de mRNA, levando à síntese de proteínas;
Estimulação, ao fim de um longo período de tempo, de sequência de DNA específicas,
maioritariamente correspondentes a enzimas que intervenientes no armazenamento de
lípidos, glícidos e proteínas;
Inibição do catabolismo proteico.
- a produção é regulada por mecanismo de feedback negativo: aumento da [glicose] no sangue
provoca aumento da insulina que vai diminuir a concentração inicial de glicose no sangue. redução
da glicose é detectada pelas células β e a produção de insulina baixa.
Outros factores de regulação dos níveis de insulina:
Aminoácidos (arginina e lisina) e hormonas gastrointestinais (gastrina, secretina,
colecistoquininca e péptido inibitório gástrico) aumentam a sensibilidade das células beta e
promovem a produção de insulina;
Sistema Nervoso Autónomo e outras hormonas (glucagina, hormona do crescimento,
cortisol, progesterona e estrogénio), estimulam directamente a secreção de insulina ou
potenciam o efeito da glicose. Quando uma destas hormonas é produzida em grandes
quantidades durante um longo período de tempo há risco de exaustão das células β e
consequente desenvolvimento de diabetes Mellitus;
Epinefrina e somatostatina inibem a secreção de insulina.
2. Glucagina – também é produzida nos ilhéus de Langerhans, desta vez nas células α. Tem o
efeito contrário ao da insulina. A sua produção é estimulada quando os níveis de glicose se
encontram baixos. A glucagina funciona por fosforilação/desfoforilação de proteínas-alvo.
Efeitos metabólicos para elevar a glicemia:
Estimulação da glicogenólise no fígado através da activação da glicogénio-fosforilase e
inactivação da glicogénio-sintetase;
Inibição da glicólise e estimulação da gliconeogénese no fígado, pela redução da
concentração de frutose-2,6-bifosfato, um inibidor alostérico da fructose 1,6-bifosfatase e
activador da fosfofrutocinase;
Inibição da enzima piruvato cinase e impedimento da conversão de fosfoenolpiruvato em
piruvato e a sua integração no ciclo de Krebs. A acumulação de fosfoenolpiruvato estimula
ainda a gliconeogénese.
Os efeitos metabólicos da glucagina são mais acentuados no fígado, mas também se fazem sentir no
tecido adiposo, onde é estimulada a degradação de triacilgliceróis que depois são transportados
para o fígado e outros tecidos e usados como forma de obter energia, poupando assim a glicose para
ser utilizado pelo cérebro.
Agentes reguladores da secreção de glucagina:
A glicemia é o principal factor que controla os níveis da hormona, verificando-se que
uma baixa concentração de glicose no sangue estimula a secreção;
Excesso de aminoácidos (alanina e arginina), a seguir a uma reacção proteica estimula a
secreção de glucagina e a rápida conversão dos aminoácidos em glicose. Neste caso, o
efeito da glucagina não se opõe ao da insulina, contribuindo ambas, embora por
processos diferentes, para baixar a quantidade de aminoácidos livres em circulação;
Epinefrina estimula a secreção;
Insulina e somatostatina inibem a secreção.
3. Epinefrina – estimulando a secreção de glucagina e inibindo a de insulina, impedindo assim
o armazenamento de combustíveis energéticos e promovendo a sua mobilização. O modo
de actuação da epinefrina é semelhante ao da glucagina, mas os efeitos são mais intenso no
músculo do que fígado, activando aí mecanismos de degradação do glicogénio e
triacilgliceróis
4. Cortisol – produzida em situações de stress, actua de forma a estimular os níveis de glicose
no sangue e/ou aumentar reservas de glicogénio, facilitando resposta aguda. Estimula
também a lipólise no tecido adiposo e o catabolismo proteico no músculo, utilizando ácidos
gordos livres e aminoácidos como precursores da gliconeogénese
Vias metabólicas principais e a sua regulação
Metabolismo do glicogénio e sua regulação:
Excesso de glicose é convertido em polímeros – glicogénio e lípidos;
Glicogénio é essencialmente armazenado no fígado e no músculo-esquelético;
O glicogénio apresenta uma forma ramificada que permite que a sua degradação se
inicie em diversas pontas soltas (forma mais rápida de obtenção de glicose), a
ramificação também aumenta a densidade do composto e favorece a economia de
espaço.
Glicogénese – glicose forma glicogénio
Glicose (acção das hexocinases e gasto de ATP) -> 6P-glicose (acção da enzima fosfoglicomutase) ->
1P-glicose (reage com UTP e origina UDP-glicose por acção da uridil transferase) -> UDP-glicose
(moléculas de UDP-glicose são então directamente utilizadas na síntese do polímero glicogénio, num
processo catalisado por glicogénio sintetase) -> glicogénio
𝐺𝑙𝑢𝑐𝑜𝑠𝑒 − 6 − 𝑓𝑜𝑠𝑓𝑎𝑡𝑜 + 𝐴𝑇𝑃 + [𝐺𝑙𝑖𝑐𝑜𝑔é𝑛𝑖𝑜]𝑛 + 𝐻2 𝑂 → [𝐺𝑙𝑖𝑐𝑜𝑔é𝑛𝑖𝑜]𝑛+1 + 𝐴𝐷𝑃 + 2𝑃𝑖
Glicogenólise - glicogénio é degradado em glicose
Glicogénio (enzima glicogénio fosforilase)-> 1P-glicose-> (acção da fosfoglicomutase)-> glicose-6fosfato -> Músculo Esqulético (glicólise)
-> Fígado (desfoforilada antes de abandonar as células) -> 6P-Glicose (glicose – 6 - fosfatase)
-> Glicose)
[𝐺𝑙𝑖𝑐𝑜𝑔é𝑛𝑖𝑜]𝑛 + 𝑃𝑖 → [𝐺𝑙𝑖𝑐𝑜𝑔é𝑛𝑖𝑜]𝑛−1 + 𝑔𝑙𝑢𝑐𝑜𝑠𝑒 − 1 − 𝑓𝑜𝑠𝑓𝑎𝑡𝑜
Etapa reguladora da Glicogénese/Glicogenólise é a interconversão de 6P- glicose em 1P—
glicose, verificando-se que a presença de UTP favorece a glicogénese pois desloca o
equilíbrio da reacção no sentido de formação de 1P-glicose. A utilização de UTP em vez de
ATP confere uma regulação mais específica da glicogénese sem interferências indesejadas,
uma vez que o ATP actua em inúmeras vias, e a presença de glicose-6-fosfato na célula
activa a via de síntese do glicogénio.
Glicólise – glicose degradada em 2 moléculas de piruvato (molécula com 3 carbonos), através de 10
reacções catalizadas enzimaticamente.
Pode dividir-se em 3 fases:
Fase 1 (fase de activação): fosforilação da glicose com consumo de 2 ATP;
o Reacção 1: fosforilação da glicose em glicose-6-fosfato com gasto de 1 ATP. Enzima
interveniente: hexoquinase (ou glicoquinase);
o Reacção 2: isomerização da glicose-6-fosfato em frutose-6-fosfato. Enzima
interveniente: fosfohexose isomerase;
o Reacção 3: fosforilação da frutose-6-fosfato em frutose-1,6-bifosfato com gasto de 1
ATP. Enzima interveniente: fosfofrutocinase-1 sujeita a regulação alostérica;
Fase 2 (fase de clivagem): formação de 2 moléculas de gliceraldeído-3-fosfato;
o Reacção 4: cisão da frutose-1,6-bifosfato em gliceraldeído-3-fosfato e no seu
isómero di-hidroxiacetona-fosfato. Enzima interveniente: aldose;
o Reacção 5: isomerização de di-hidroxiacetona-fosfato em gliceraldeído-3-fosfato.
Enzima interveniente: triose-fosfato isomerase;
Os dois produtos da cisão são interconvertíveis e estão em equilíbrio químico,
equilíbrio este que vai sendo deslocado no sentido do gliceraldeído-3-fosfato uma
vez que a glicólise prossegue por este composto. Assim, por cada molécula de
glicose, formam-se duas moléculas de gliceraldeído-3-fosfato;
Fase 3: oxidação de cada gliceraldeído-3-fosfato (GAP) em piruvato e formação, no total, de
4 ATP e 2 NADH+H+. As reacções seguintes referem-se a cada molécula de gliceraldeído-3fosfato;
o Reacção 6: oxidação e fosforilação do gliceraldeído-3-fosfato em ácido 1,3difosfoglicérico com redução de NAD a NADH + H+. Enzima interveniente:
gliceraldeído-3-fosfato desidrogenase;
o Reacção 7: conversão do 1,3-difosfoglicerato em 3-fosfoglicerato com síntese de 1
ATP. Enzima interveniente: fosfoglicerato-cinase;
o Reacção 8: isomerização do ácido 3-difosfoglicérico em ácido 2-fosfoglicérico.
Enzima interveniente: fosfoglicerato-mutase;
o Reacção 9: desidratação do ácido 2-fosfoglicérico em fosfoenolpiruvato. Enzima
interveniente: enolase;
o Reacção 10: conversão de fosfoenolpiruvato em piruvato (piruvato) com síntese de
1 ATP. Enzima interveniente: piruvato-cinase;
𝐺𝑙𝑖𝑐𝑜𝑠𝑒 + 2𝐴𝐷𝑃 + 2𝑃𝑖 + 2𝑁𝐴𝐷 + → 2 𝑝𝑖𝑟𝑢𝑣𝑎𝑡𝑜 + 2𝐴𝑇𝑃 + 2𝑁𝐴𝐷𝐻 + 2𝐻 + + 2𝐻2 𝑂
Gliconeogénese – síntese de glicose a partir de piruvato, ou outros compostos com 3 ou mais
carbonos (lactato, ácidos gordos e alguns aminoácidos - xialamina). Ocorre principalmente no fígado,
em organismos diferentes da glicólise.
Durante o exercício físico intenso verifica-se a acumulação de lactato nos músculos, devido à
realização de fermentação láctica para rápida obtenção de energia. O lactato é muito solúvel e entra
em circulação e é transportada até ao fígado, onde vai ser utilizada na gliconeogénese. O lactato é
então regenerado em glicose (este processo tem um custo energético mas o balanço final, com a
disponibilização de glicose, é positivo) e entra de novo em circulação, podendo ser utilizada no
músculo para a reposição dos níveis de glicogénio durante o repouso. A este ciclo, glicose-lactatoglicose, dá-se o nome de Ciclo de Cori.
Em jejum pode ocorrer gliconeogénese a partir de aminoácidos, como a alanina. No fígado, estes são
convertidos em piruvato, que é utilizado na síntese de glicose, e é libertada amónia, que é excretada
sob a forma de ureia.
- Principais pontos de regulação das vias: gliconeogénese e glicólise:
(Reacção 10 da glicólise) fosforilação de piruvato em fosfoenolpiruvado (PEP). Piruvato é
transportado do citoplasma para a mitocôndria ou é aí gerado a partir de alanina (por uma
reacção de transaminação). O piruvato é então convertido em oxaloacetato por acção da
enzima piruvato carboxilase e com recurso a 2 ATP e a CO2. O oxoacelato, que também pode
provir do ciclo de Krebs, tem que ser reduzido a malato para poder ser transportado de novo
para o citoplasma (essa conversão é feita pela enzima malato desidrogenase) onde vai ser
finalmente convertido em fosfoenolpiruvato pela PEP carboxicinase, com recurso a 2 GTP
(guanina trifosfato). Quando o lactato é o principal precursor da glicose na gliconeogénese é
comum ocorrer a sua conversão em piruvato, pelo lactato desidrogenase e com redução de
NAD+, ainda no citoplasma. Já na mitocôndria, o piruvato é convertido em oxaloacetato e este,
por sua vez, é logo transformado em PEP por acção da PEP carboxicinase mitocondrial e com
libertação de CO2. A última via tem a vantagem de não ser necessário o transporte de NADH
para fora da mitocôndria. Contudo, a importância de cada via depende tanto da
disponibilidade de lactato como da necessidade de NADH por parte da célula.
(Reacção 3) desfosforilação da frutose-1,6-fosfato em frutose-6-fosfato;
(Reacção 1) desfosforilação da glicose-6-fosfato em glicose. Não há formação de ATP, dá-se
apenas uma reacção de hidrólise.
- Exemplos de mecanismos de regulação da gliconeogénese:
Glucagina estimula a gliconeogénese;
A enzima piruvato carboxilase é activada alostericamente pela presença de acetil-CoA. AcetilCoA está relacionado com o metabolismo dos lípidos e é um indicador de que a célula tem
fontes de energia disponíveis sob a forma de outros substratos que não a glicose, como ácidos
gordos;
AMP estimula vias que oxidam nutrientes fornecendo energia às células – estimula a glicólise;
Regulação da desidrogenase do piruvato: PDH - complexo enzimático piruvato-desidrogenase
(PDH), responsável pela conversão do piruvato em acetil-CoA, é regulado alostericamente. Verificase a inibição quando existem ácidos gordos e acetil-CoA disponíveis e quando os rácios
[ATP]/[ADP] e [NADH]/[NAD+] são elevados. (O complexo está ainda sob a acção de mecanismos de
regulação covalente, sendo inibido pela fosforilação reversível de um dos seus resíduos de serina
quando a concentração de ATP é elevada)
Ciclo do citrato (ciclo de Krebs) e sua regulação: ocorre na matriz mitocondrial. Consiste na
oxidação de acetil-CoA e CO2 com libertação de energia sob a forma de electrões, armazenada em
NADH e FADH2 (moléculas transportadores de electrões).
É necessário um passo intermédio para converter o piruvato em acetil-CoA por acção complexo
piruvato-desidrogenase.
Na respiração aeróbia, após a etapa da glicólise o piruvato entra nas mitocôndrias e, ao nível da
matriz mitocondrial, sofre 3 reacções que culminam na formação de acetil-CoA:
1. Descarboxilação: é removido um carbono ao piruvato. Forma-se acetaldeído e dióxido de
carbono;
2. Oxidação: são removidos dois H ao acetaldeído. Forma-se ácido acético e reduz-se NAD+ a
NADH+H+;
3. Formação de acetil-CoA: o ácido acético combina-se com uma coenzima A e forma-se
acetilcoenzima A.
O acetil-CoA vai agora integrar o Ciclo de Krebs, que tem 8 passos:
1. Formação de citrato: condensação de acetil-CoA com o ácido oxaloacético. Há transferência
do grupo acetilo e libertação da coenzima A. Enzima interveniente: citrato sintetase;
2. Formação de ácido isocítrico pela transferência do grupo OH da posição 3 para a posição 4.
Enzima interveniente: aconitase;
3. Oxidação do isocitrato a ácido α-cetoglutárico com libertação de NADH ou NADPH e CO2.
Enzima interveniente: isocitrato desidrogenase;
4. Oxidação do ácido α-cetoglutárico a succinil-CoA. Libertação de CO2 e produção do cofactor
NADH. Enzima interveniente: complexo α-cetoglutarato desidrogenase;
5. Hidrólise de succinil-CoA a ácido succínico com síntese de ATP. Enzima interveniente:
succinil-CoA sintetase;
6. Oxidação de succinato a ácido fumárico com libertação de FADH2. Enzima interveniente:
succinato desidrogenase;
7. Hidratação do ácido fumárico a ácido málico. Enzima interveniente: fumarase;
8. Oxidação do ácido malático a ácido oxaloacético. Enzima interveniente: malato
desidrogenase.
𝑎𝑐𝑒𝑡𝑖𝑙 − 𝐶𝑜𝐴 → 𝐴𝑇𝑃 + 3(𝑁𝐴𝐷𝐻 + 𝐻 + ) + 𝐹𝐴𝐷𝐻2 + 2𝐶𝑂2
Cada acetil-CoA contribui para a produção de 10 ATP:
1 (𝐴𝑇𝑃) + 3 × 2,5 (𝑁𝐴𝐷𝐻 + 𝐻 + ) + 1 × 1,5 (𝐹𝐴𝐷𝐻2 ) = 10 𝐴𝑇𝑃
É de notar que cada molécula de glicose permite a formação de duas moléculas de acetil-CoA.
Balanço no final do Ciclo de Krebs
ATP NADH+H+ FADH2
CO2
Glicólise
Obtenção de acetil-CoA
Ciclo de Krebs
2
2
2
2
6
2
2
4
Por molécula de glicose
4
10
2
6
A regulação do ciclo de Krebs dá-se a diversos níveis:
Conversão de piruvato a acetil-CoA pelo complexo piruvato-desidrogenase (PDH);
Entrada de acetil-CoA no ciclo (catalizada pela citrato sintetase). Este passo depende da
disponibilidade dos substratos oxaloacetato e acetil-CoA, do produto citrato, de ATP, NADH
e de succinil-CoA atrasa o ciclo.
A isocitrato desidrogenase é inibida na presença de ATP e activada por ADP e Ca2+.
Regulação do metabolismo de TAG (triacilgliceróis) e ácidos gordos
Quando é necessária mobilização de ácidos gordo para produção de energia, epinefrina e glucagina
estimulam a libertação de triacilgliceróis das células adiposas e a sua hidrólise. Simultaneamente,
estas hormonas diminuem o ritmo da glicólise e aumentam o da gliconeogénese no fígado.
Outras vias metabólicas
Via dos fosfatos de pentose (fosfopentoses) – caminho aeróbio alternativo à glicólise para a glicose6-fosfato responsável pela degradação de mais de 30% desta molécula no fígado e nas células
adiposas. Reagentes: NAP+ e 6P-glicose. Produtos: NADPH e 6P-glicose: pentose utilizada na síntese
de ácidos nucleicos.
Vantagens do NADPH:
Transportador utilizado na biossínte de lípidos e outras substâncias;
Previne efeitos prejudiciais do oxigénio radicalar;
Responsável por reacções de oxidação-redução necessárias à polihidroxilação de
substâncias a serem excretadas pelo sistema p450;
Torna oxigénio radicalar, necessário para reacções com microorganismos e sua eliminação;
Via das pentoses permite obtenção de energia independentemente do ciclo de Krebs (NADPH entra
directamente na cadeia transportadora de electrões)
Regulação da Via das Fosfopentoses – ligada ao ritmo de síntese de lípidos e proteínas:
- aumento de proteínas -> é privilegiada a fase não oxidante;
- aumento dos Lípidos -> privilegiada a fase oxidante, onde se produz NADPH, necessário para
converter acetil-coA em cadeias de ácidos gordos.
Catabolismo de Aminoácidos e Ciclo da Ureia
Degradação oxidativa de aminoácidos:
Ocorre no fígado (também se pode dar no músculo)
Leva à formação de amónia (excretada pelo ciclo de ureia)
Passo inicial da degradação é comum em todos os aminoácidos: remoção do grupo αamina, pode ocorrer em dois locais: citosol dos hepatócitos - Transaminação ou nas
mitocôndrias - Desaminação oxidativa
Aminoácidos cetogénicos: dão origem a intermediários de corpos cetónicos;
Aminoácidos glucogénicos: dão origem a intermediários na formação de glicose.
Ciclo da ureia: (excreção de amónia) – ocorre exclusivamente no fígado. Permite a conversão de
amónia em ureia que é posteriormente enviada aos rins pela corrente sanguínea e excretada na
urina.
Na matriz mitocondrial, a amónia é transformada em fosfato de carbamoilo numa reacção
irreversível dependente de ATP.
Ciclo da ureia alanina-glicose (excreção de amónia pelo músculo)
O glutamato formado na degradação de aminoácidos reage com piruvato proveniente da
glicólise e origina alanina.
A alanina é transportada pela corrente sanguínea até ao fígado onde reage de novo com a
alanino-transferase e forma piruvato e glutamato.
O glutamato entra nas mitocôndrias e integra a ciclo da ureia, enquanto o piruvato é
aproveitado para a gluconeogénese, possibilitando a síntese de glicose que vai ser levada
até ao músculo e aproveitada para a produção de ATP e de piruvato, reiniciando o ciclo.
Deste modo, elimina-se a amónia em excesso e o gasto energético necessário à
gluconeogénese é suportado inteiramente pelo fígado, garantindo-se que todo o ATP
disponível no músculo é aproveitado para a contracção.
Glutamina: transportador de azoto importante para a destoxificação da amónia produzida nos
tecidos extra-hepáticos.
Forma-se a partir de glutamato por acção da glutamina-sintetase.
Pode ser tranportado para o fígado onde vai integrar o ciclo da ureia, ou para o rim onde a
amónia é directamente excretada pela urina.
Ciclo Alimentado Jejum
Estado alimentado: Glicose, aminoácidos e ácidos gordos no intestino + glicose e aminoácidos no
sistema venoso portal (sistema portal)
Pâncreas: libertação de insulina pelas células beta e inibição de libertação de glucagina pelas
células alfa;
Tecido adiposo: síntese de triacilgliceróis; captação de glicose (por transportadores insulino
dependentes);
Fígado: Síntese de glicogénio; síntese de ácidos gordos; síntese de triacilgliceróis; síntese de
VLDL;
Músculo: Captação de glicose; síntese de glicogénio; síntese proteica;
Encéfalo: glicose completamente oxidada a CO2 e água
Captura de energia na forma de glicogénio e triacilgliceróis e reposição da proteína
degradada durante o período pós-absorvido.
Estado Jejum: ausência de nutrientes no intestino + diminuição de glicose e aminoácidos do sangue
(intestino e sistema porta)
Pâncreas: libertação de glucagina pelas células alfa e inibição da libertação de insulina pelas
células beta;
Tecido adiposo: libertação de ácidos gordos por hidrólise dos triacilgliceróis;
Fígado: libertação de glicose produzida pela glicogenólise e pela gliconeogenese; síntese e
libertação de corpos cetónicos;
Músculo: utilização de ácidos gordos r corpos cetónicos; libertação de aminoácidos;
Encéfalo: glicose e corpos cetónicos completamente oxidados a CO2 e água
Formação de glicose para o encéfalo e outros tecidos dependentes de glicose; forma-se
ácidos gordos e corpos cetónicos para tecidos que não dependem da glicose;
Diabetes de Mellitus - síndrome metabólica caracterizada por uma deficiência na secreção ou
acção da insulina. Existem dois tipos:
Diabetes tipo I ou insulino-dependente: causado por uma doença auto-imune ou infecciosa,
afecta o pâncreas e destrói as células β, comprometendo a secreção de insulina. Surge em
idade precoce, tem uma progressão bastante rápida e requer o controlo e administração
diários de insulina.
Diabetes tipo II ou não-insulino-dependente: surge tipicamente em indivíduos adultos e
obesos e é mais comum que a diabetes tipo I. É causada por uma crescente resistência à
insulina (sensibilidade aos efeitos metabólicos da insulina diminuída) e caracteriza-se por
uma concentração crescente desta hormona no plasma - hiperinsulinemia. A resistência à
insulina leva à redução do metabolismo de hidratos de carbono e ao aumento dos níveis de
glicose no sangue, estimulando um aumento compensatório da secreção da hormona.
A diabetes tipo II pode ser assintomática ou apresentar sintomas comuns à diabetes tipo I:
Glicemia elevada: falta de insulina diminui a captação de glicose pelos tecidos periféricos.
Este facto aliado à gliconeogénese hepática aumentada provoca um aumento da
concentração sanguínea de glicose. Consequentemente, o excesso de glicose vai ser
excretado pela urina e a presença deste açúcar no líquido filtrado reduz a absorção de água
nos túbulos renais. A urina resultante é abundante e doce. Usualmente ocorre desidratação,
levando a uma crescente sensação de sede;
Utilização crescente de ácidos gordos para obtenção de energia tem como consequência
aumento da produção de colesterol pelo fígado e corpos cetónicos (associado ao hálito a
maçã);
Esgotamento das proteínas: devido à utilização das mesmas para produzir energia. O
doente perde peso rapidamente apesar de ter muito apetite.
Lípidos – Nutrição e Digestão
A predominância de cada uma das vias depende das necessidades do organismo: em períodos de
rápido crescimento é favorecida a síntese de fosfolípidos que integram as membranas celulares;
quando o crescimento é mais lento e a ingestão de alimentos supera as necessidades energéticas
formam-se triacilgliceróis que são armazenados nas células adiposas. Triacilgliceróis são uma das
principais formas de armazenamento de energia e apresentam algumas vantagens e desvantagens
em relação às reservas de glicogénio: permitem armazenar uma maior quantidade de energia
recorrendo a uma menor massa, mas o processo de obtenção de energia a partir do glicogénio é
mais rápido.
Catabolismo (oxidação) de ácidos gordos
Para poderem entrar no ciclo de oxidação os ácidos gordos livres têm que ser activados, isto é, têm
que ser convertidos em acil-CoA gordo e transportados para as mitocôndrias, onde se vai dar todo o
processo de extracção de energia. A activação dos ácidos gordos dá-se na membrana mitocondrial
externa pela enzima acil-CoA gordo sintetase, com gasto passagem de 1 ATP a AMP, e o seu
transporte está dependente da bomba de carnitina, onde o grupo acil-CoA é substituído por acilcarnitina para poder entrar na mitocôndria. Uma vez dentro do organelo a acil-carnitina volta a ser
convertida em acil-CoA e o ácido gordo pode agora ser metabolizado.
A oxidação de ácidos gordos (activados) ocorre no interior das mitocôndrias, é um processo aeróbio
e envolve três etapas:
1ª etapa – β-oxidação: uma cadeia de ácidos gordos é oxidada dando origem a resíduos de
acetil-CoA (Ciclo de Lynen);
2ª etapa: acetil-CoA entram no ciclo de Krebs e são oxidadas a CO2;
3º etapa: os electrões provenientes das oxidações anteriores entram na cadeia respiratória e
permitem a síntese de ATP.
A β-oxidação é um ciclo em espiral e engloba 4 reacções:
1. Oxidação: remoção de H dos carbonos α e β (primeiros dois carbonos ligados a hidrogénios),
formação de uma ligação dupla C=C em trans e redução de FAD a FADH2;
2. Hidratação: adição de H2O à ligação dupla acabada de formar, processo catalisado pela
enzima enoil-CoA hidratase. Ao carbono α é adicionado um H e ao carbono β é adicionado
um grupo OH, formando um grupo hidroxilo (COH).
a. A enzima enoil-CoA hidratase só actua em ligações duplas do tipo trans.
Consequentemente, ácidos gordos insaturados, que contém ligações duplas do tipo
cis, requerem a acção um outra enzima - uma isomerase, que converte as ligações
cis em trans;
3. Segunda oxidação: oxidação do grupo hidroxilo, formação de um grupo cetona no carbono β
e redução de NAD+ a NADH;
4. Clivagem: a ligação entre Cα e Cβ é clivada dando origem a uma molécula de acetil-CoA e a
um acil-CoA gordo com menos dois carbonos que entra de novo no ciclo de β-oxidação.
Este processo decorre até que o ácido gordo original tenha sido completamente oxidado a móleculas
de acetil-CoA.
𝑛
𝑛
Balanço energético: 𝐴𝑇𝑃 = −2 + 5 × (2 − 1) + 12 × 2
A oxidação completa de ácidos gordos com um número ímpar de carbonos dá origem a uma
molécula com apenas 3 átomos de carbono na cadeia principal, proprionil-CoA; que sofre uma
carboxilação, formando-se sucinil-CoA que pode integrar o ciclo de Krebs.
Síntese de ácidos gordos: Ocorre no citosol e inicia-se com o acetil-CoA proveniente da oxidação do
piruvato ou do catabolismo de aminoácidos. A membrana mitocondrial não é permeável à acetilCoA, pelo que este reage com o oxaloacetato sob a acção da enzima citrato-sintetase, de modo a
formar citrato. O citrato é transportado para o citosol onde a reacção é revertida pela citrato-lipase,
com gato de ATP. A acetil-CoA é convertida em malonil-CoA pela acetil-CoA carboxilase. De seguida
dá-se a repetição de 4 reacções (condensação, redução, desidratação e redução) onde em cada ciclo
são adicionados 2 C’s à cadeia até perfazer um total de 16.
Colesterol:
Formado por um conjunto rígido de anéis associado a uma pequena cadeia carbonada;
Molécula anfipática;
Precursor de hormonas esteróides, como a testosterona, a progesterona e o estrogénio, e
dos sais biliares;
Maior parte sintetizado no fígado, a partir de acetil-CoA no processo que engloba um
condensação, conversão, polimerização e um ciclização;
Regula fluidez das membranas plasmáticas.
Lipoproteínas: São responsáveis pelo transporte de Lípidos na corrente sanguínea, constituídas por
proteínas, lípidos e colesterol; apresentando o seu núcleo lípidos hidrofóbicos rodeados por
apoproteínas, colesterol e lípidos hidrofílicos. Existem 4 classes:
1. Quilomicra - maiores e menos densas; transportam trigliceridos, isto é, gorduras da dieta
até aos tecidos onde estas serão consumidas ou armazenadas. A quilomicra remaniscente,
praticamente livre triacilgliceróis mas que ainda com colesterol, é levada para o fígado onde
é degradada por lisossomas;
2. VLDL - (very-low-density lipoprotein): transportam ácidos gordos em excesso na forma de
triacilgliceróis produzidas pelo fígado para o músculo e/ou tecido adiposo. O VLDL
remanescente é removido da circulação pelos hepatócitos ou origem a LDL;
3. LDL (low-density lipoprotein): contêm maioritariamente colesterol e ésteres de colesterol.
São responsáveis pelo seu transporte do fígado para os tecidos extra-hepáticos e ainda pela
regulação da quantidade do mesmo nesses tecidos, inibindo quer a síntese do próprio
colesterol como dos receptores das LDL; “mau colesterol”
4. HDL (high-density lipoprotein): contêm maioritariamente proteínas, apresentando uma
pequena quantidade de colesterol. São responsáveis pelo transporte de colesterol dos
tecidos periféricos até ao fígado, onde parte do colesterol vai ser convertido em sais biliares.
HDL libertas de colesterol podem não ser absorvidas pelo fígado e, em vez disso, podem
voltar a tecidos extra-hepáticos e remover o colesterol aí presente, originando o chamado
transporte reverso do colesterol. “bom colesterol”
Endocrinologia Molecular
Hormona: qualquer substância no organismo capaz de sinalizar uma alteração a nível celular.
Tipos de acção:
Endócrina - a hormona é libertada para a corrente sanguínea e é reconhecida por
receptores específicos no órgão alvo.
Parácrina - a hormona é libertada no espaço intersticial e actua em células na
vizinhança. Exemplos: transmissão sináptica e libertação de citocinas.
Autócrina - a hormona actua na própria célula que a sintetiza.
Os loops (ou ansas) de regulação consistem num mecanismo de retrocontrolo negativo. Podem
ocorrer a diferentes níveis:
Ao nível dos alvos secundários (ansa longa): célula secretora periférica inibe a
produção da respectiva trofina pela hipófise ou mesmo a síntese da hormona
libertadora ao nível do hipotálamo;
Ao nível dos alvos primários (ansa curta): a trofina libertada pela hipófise anterior inibe
a sua produção ao nível do hipotálamo ou da própria hipófise;
Ao nível do hipotálamo (ansa muito curta): a libertação dos factores hipotalâmicos
pode ter um efeito autócrino e inibir a sua própria produção.
Eixo Hipotálamo-Hipófise
Hipófise anterior (adenohipófise): responsável pela regulação de processos como stress,
crescimento e produção. Alguns exemplos de hormonas secretadas por esta são:
Adrenocorticotrofina (ACTH), secretada por acção da hormona libertadora de
corticotrofina (CRH);
Hormona estimuladora da tiróide (TSH), secretada por acção da hormona libertadora
de tireotrofina (TRH);
Hormona luteinizante (LH), secretada por acção da hormona libertadora de
gonadotrofina;
Hormona foliculo-estimulante (FSH), também secretada por acção da hormona
libertadora de gonadotrofina.
Hipófise posterior (neuro-hipófise): constituída por projecções do hipotálamo, sendo responsável
pelo armazenamento e secreção de importantes hormonas como por exemplo:
Oxitocina (produzida no hipotálamo mas armazenada e secretada pela hipófise
posterior);
Hormona antidiurética (ADH), também conhecida por vasopressina (produzida no
hipotálamo mas armazenada e secretada pela hipófise posterior).
Factores que determinam a acção de uma hormona ao nível da célula-alvo
Concentração da hormona que atinge a célula alvo:
taxa de síntese e secreção
distância a que se encontra a célula alvo
constante de dissociação entre a hormona/proteína de transporte no plasma
conversão de uma forma inactiva ou menos activa da hormona numa forma biologicamente
mais activa
clearance plasmática
Resposta da célula-alvo:
número, especificidade e selectividade do receptor
metabolização da hormona (activação/inactivação)
mecanismos de regulação do receptor após interacção com o ligando
presença de factores adicionais necessários para a resposta à hormona
Grupos de hormonas – características:
Grupo I
Hormonas esteróides,
Tipos
Iodotironinas, calcitriol, retinóides
Solubilidade
Lipofílicas
Proteínas de transporte Sim
Semi-vida no plasma
Longa (horas/dias)
Receptor
Intracelucar
Mecanismo de acção
Complexo hormona-receptor
Grupo II
Polipéptidos,
proteínas,
glicoproteínas,
catecolaminas
Hidrofílicas
Não
Curta (minutos)
Na membrana citoplasmática
Mensageiros secundários, cascatas de sinalização
Hormonas Derivadas ou Aminoácidos
Síntese de Iodotironinas
Tiroblobulina: é sintetizada e transportada para o lúmen, onde é armazenada sob a forma de
colóide. É constituída por duas subunidades idênticas e possui 115 resíduos de tirosina, potenciais
alvos de iodação.
Iodotironinas possuem iodo na sua composição, sendo este essencial para a sua actividade. O iodo é
captado por transporte activo na forma de ião iodeto ao nível da membrana basal da célula
folicular e é transportado para a superfície apical. Aqui é oxidado novamente a iodo e enviado para
o colóide.
Iodação da tiroglobulina: iodo reage com resíduos de tirosina consoante a ocorrência de 1 ou 2
iodações dos carbonos do anel aromático podem formar-se 2 iodotirosinas:
Monoiodotirosina (MIT) - resultante da iodação do carbono na posição 3
Diiodotirosina (DIT) - resultante da iodação do carbono na posição 3 e 5
Conjugação de iodotirosinas: ligação de 2 Dit, originando T4 ou ligação de MIT e DIT originando T3.
Secreção de Iodotironinas
Estímulo TSH tirotrofina -> Reabsorção da tiroglobulina -> proteólise (degradação) completa da
tiroglobulina por acção de proteases e peptidases -> libertação de T3, rT3 e T4 e também de MIT e
DIT não conjugados -> conjugação com proteínas transportadoras nos capilares sanguíneos.
Regulação da Síntese e Secreção de Iodotironinas
Mecanismo de feedback negativo:
1. Hipotálamo: liberta TRH (hormona libertadora da tirotrofina)
2. Hipófise anterior: liberta TSH (tirotrofina)
3. Aumento de T3 e T4
4. T3 e T4 diminuem a produção/libertação de TRH e TSH
A TSH tem um papel fundamental na regulação de vários processos, destacando-se os seguintes:
Transcrição do gene da tiroglobulina e da tiroperoxidase;
Processamento da tiroglobulina e a sua exocitose para o colóide;
Captação de iodo por activação do transportador de iões iodeto;
Rabsorção da tiroglobulina a partir do colóide;
Proteólise da tiroglobulina e libertação de T3 e T4
Concentração de ião iodeto: factor de regulação importante
1. Diminuição de Iodo – diminuição do rácio DIT/MIT e diminuição do rácio T4/T3.
2. Aumento de Iodo – inibição da proteólise da tiroglobulina e, por conseguinte, a uma
diminuição da síntese de T3 e T4.
Regulação Farmacológica
Em situações de hipertiroidismo: regulação da síntese de T3 e T4 por administração de 2 fármacos;
Antitiroideus – inibidores da tiroperoxidase, impedindo a concretização das suas funções
(iodação da tiroglobulina, oxidação do iodeto e conjugação das iodotirosinas;
inibidores aniónicos que actuam sobre o transportador do ião iodeto, impedindo a captação
de iodo pelas células foliculares.
Catecolaminas
Síntese de Catecolaminas: ocorre nas células cromafínicas da medula supra-renal.
A secreção destas células é essencialmente endócrina, embora se registe a produção e libertação de
neurotransmissores ao nível das terminações e das sinapses nervosas.
A síntese de catecolaminas é o resultado de uma série de reacções:
1. hidroxilação da tirosina a DOPA pela tirosina-hidroxilase. Esta é a etapa limitante e
principal reguladora desta via.
2. A DOPA é depois carboxilada a dopamina, uma cotecolamina com acção essencialmente
local (não se encontra geralmente em circulação)
3. A dopamina é transportada activamente para grânulos de secreção, onde se dá a sua
conversão em noraepinefrina (ou noradrenalina) pela dopamina β-hidroxilase.
4. Cerca de 15% da noraepinefrina é armazenada nestes grânulos, sendo que a grande maioria
é difundida novamente para o citoplasma onde é convertida em epinefrina, por acção da
enzima PNMT;
5. A epinefrina é incorporada em grânulos de armazenamento, sendo libertada quando há
estímulo para secreção.
Secreção de Catecolaminas: Ocorre em resposta a estímulos neuronais β-adrenérgicos ou
colinérgicos, por aumento do cálcio intracelular. O cálcio promove a fusão das membranas das
vesículas com a membrana da célula e a exocitose do conteúdo dos grânulos
Regulação da Síntese e Secreção de Catecolaminas - Existem dois mecanismos de regulação:
Regulação da actividade da tirosina-hidroxilase - inibida pelos produtos finais da via
(noraepinefrina, epinefrina e dopamina) ou estimulada neuronalmente (aumento da
produção de catecolaminas).
Regulação da indução da metil-transferase PNMT por parte de glicocorticóides
(nomeadamente do cortisol) que promovem a conversão da norepinefrina em epinefrina. O
cortisol libertado atinge directamente a medula e estimula a acção da PNMT, levando ao
aumento da produção de catecolaminas.
Hormonas Peptídicas
Alguns exemplos de hormonas peptídicas:
TRH (hormona libertadora da tirotrofina, tripéptido);
ACTH (corticotrofina, polipéptido);
Insulina (constituída por duas cadeias polipeptídicas);
TSH, SH e LH (hormonas libertadas pela hipófise anterior com complexos graus de
glicosilação)
Hormonas Lipídicas – consoante o composto que as origina, as hormonas lipídicas podem ser:
Hormonas derivadas do colesterol
Síntese de Hormonas Esteróides na supre-renal
Ocorre ao nível do córtex supra-renal (zona glomerulosa: corticóides; fasciculada:
glucocoticóides; reticular: androgénios e hormonas sexuais)
Independentemente do tipo de hormona esteróide, o processo inicia-se sempre com a
conversão do colesterol a pregnenolona
O colesterol, proveniente de lipoproteínas plasmáticas, é esterificado e transportado desde
o espaço intramembranar até ao interior da matriz mitocondrial pela proteína StAR
(steroidogenic acute regulatory protein). Aqui, uma enzima de clivagem da cadeia lateral
contendo citocromo P450 (P450scc) converte o colesterol em pregnenolona. A
pregnenolona irá depois deixar a mitocôndria para originar os seus diferentes produtos
finais.
Regulação da Síntese e Secreção de hormonas esteróide: eixo hipotálamo – hipófise - supra-renal
Mecanismo de feedback negativo:
1. Hipotálamo: liberta CRH (Corticotropic releasing hormone)
2. Hipófise anterior: liberta ACTH (adrenocorticotrofina)
3. Aumento da produção de corticoesteróides no córtex supra-renal:
3.1 A actividade do córtex é intensificada por situações de stress, que induzem a
libertação de CRH.
3.2 A actividade do córtex é inibida por níveis elevados de corticosteroides
(mecanismo de feedback negativo)
Hormonas Esteróides Masculinas e Femininas
Esteroiodogénese testicular
androgénios testiculares são sintetizados no tecido intersticial pelas células de Leydig. O
processo de conversão do colesterol a pregnenolona é também idêntico ao dos restantes
esteróides mas catalizado pela LH.
conversão da pregnenolona a testosterona ocorre pela via Δ5.
Conversão da testeterona a dihidrotestosterona (DHT) ocorre em tecidos periféricos (como
a próstata, a genitália externa e algumas áreas da pele por acção uma redutase e na
presença de NADPH.
Esteroiodogénese ovaliana
A androstenediona e a testosterona são produzidas pelas células da teca interna
converção pela enzima aromatase de androstenediona e a testosterona em estrona e
estradiol, nas células da granulosa,
A progesterona é sintetizada e secretada pelo corpo lúteo como um composto hormonal
final, pois tais células não possuem as enzimas necessárias para converter a progesterona
noutras hormonas.
Nota: a síntese de estrogénios pode também ocorrer no tecido adiposo, fígado e pele.
Esterogenização em situações fisiopatológicas
Obesidade: o excesso de tecido adiposo provoca grande concentração de aromatases, pelo
que ocorre maior produção de estrogénios a nível periférico;
Cirrose hepática: em situação de cirrose, a excreção de estrogénio endógeno encontra-se
diminuída. Este factor, aliado à menor produção de SHBG (glicoproteína transportadora de
hormonas sexuais), leva a um aumento dos níveis de estrogénio livre, o que vai permitir um
maior grau de aromatização periférica.
Hipertiroidismo: o excesso de hormonas tiroideias estimula a produção exagerada de SHBG
pelo fígado e a conversão de androstenediona em estrogénio e testosterona, pelo que os
níveis de estrogénio se encontram aumentados.
Envelhecimento: a produção de estrogénios a nível periférico encontra-se aumentada de
forma a tentar compensar a diminuição da sua produção a nível gonadal. No entanto, estes
valores não são suficientes para atingir os níveis de estrogénio pré-envelhecimento.
Regulação da Síntese e Secreção de hormonas esteróide Masculina e Feminina
Mecanismo de feedback negativo:
1. Hipotálamo: GnRH
2. Hipófise anterior: liberta FSH + LH
3. Aumento da produção de estrogénios M e F nos testículos/ovários.
4. Diminuição da Produção e Libertação de GnRH e FSH+LH
Síntese e Secreção de Calcitriol
Pele: Formação de vitaminas D3 por fotólise na camada de Malphig e da epiderme
Fígado: Vitamina D3 é hidróxidada a 25-hidroxivitamina D3
Rins: 25-hidroxivitamina D3 é hidróxidada na mitocôndria do Tubo Contornado Proximal por uma
monooxigenase
Derivadas do Ácido Araquidónico
Ácido araquidónico – ácido gordo composto por 20 carbonos e três ligações duplas contido nos
fosfolípidos, obtido através da alimentação. É armazenado na bicamada fosfolipídica das membranas
celulares e é libertado por clivagem dos fosfolípidos por acção da fosfolipase A2, originando-se
araquidonato e lisofosfolípidos.
Síntese das prostaglandinas, prostaciclinas, tromboxanos
Por acção da prostaglandina sintase, o araquidonato origina o primeiro intermediário – a
prostaglandina H2.
prostaglandina H2 é convertido nos seus produtos finais: prostaciclinas, restantes
prostaglandinas e tromboxanos
Síntese de Leucotrienos
Araquidonato é convertido a HPETE (hydroperoxyeicosatetraenoic acid) por acção da
lipooxigenase
o HPETE é convertido em leucotrieno A4, também por acção da lipooxigenase
o Leucotriena A é um composto instável que mediante o tipo de enzima que sobre ele
actua pode originar diferentes leucotrienos estável como C4, D4 e E4.
Transporte de Hormonas
Proteínas envolvidas no transporte de hormonas lipofílicas:
Transcortina ou CBG (corticoesteroid – binding globulin) – Cortisol
SHBG (sex hormone-binding globulin) – Testosterona, dihidrotestosterona (DHT) e estrogénios
TBG (thyroid-binding globulin) – T4 e T3
Vitamin D binding protein – Vitamina D e seus metabolitos
Albumina – hormonas lipofílicas, bilirrubina, ácidos-gordos livres e iões metálicos
Características das ligações: hormona-receptor e hormona-proteína transportadora
Receptores
Proteínas Transportadores
Concentração
Muito baixa
Muito alta
Afinidade de ligação Alta
Baixa
Especificidade
Muito alta
Baixa
Saturação
Sim
Não
Reversibilidade
Sim
Sim
Transdução do sinal
Sim
Não
Receptores e mecanismos de acção hormonal
Hormonas do tipo I (lipofílicas) - ligam-se a receptores intracelulares, pelo que o seu mecanismo de
acção é do tipo Complexo Hormona – Receptor.
Hormonas do tipo II (hidrofílicas) - ligam-se a receptores de membrana, recorrendo a mensageiros
secundários e a cascatas de sinalização para transmitirem informação ao interior da célula. Alguns
exemplos de mensageiros secundários são: cAMP; cGMP; cálcio, fosfatidilinositol ou diacilglicerol;
cinase ou fosfatase activada sequencialmente.
Hormonas que se ligam a receptores intracelulares
1. Glicocorticóides/Mineralocorticóides
Glicocorticóides como o cortisol controlam o metabolismo dos hidratos de carbono, gordura e
proteínas e são anti-inflamatórios.
Mineralocorticóides como a aldosterona controlam os níveis de electrólitos e água, principalmente
por promoverem a retenção de sódio no rim.
A concentração de glicocorticóides circulante é 100 a 1000 vezes superior à da aldosterona!
Os glicocorticóides/mineralocorticóides difundem-se através da membrana plasmática e
ligam-se a receptores no citoplasma das células-alvo.
O complexo hormona-receptor é transportado para o núcleo, com grande afinidade, com
uma sequência especifica de DNA conhecida como elemento de resposta hormonal (HRE).
O complexo funciona como local de ligação de alta afinidade, para uma ou mais proteínas
co-activadoras. Quando esta ligação ocorre, inicia-se uma transcrição genética acelerada.
2. Hormonas tiroideias e retinóides
As hormonas tiroideias e os retinóides atravessam a membrana plasmática, ligam-se
transientemente a proteínas do citosol antes de entrarem no núcleo.
De novo de forma livre entram no núcleo e encontram um complexo receptor (co-repressor
ligado à HRE)
Quando a hormona estabelecer ligação com este complexo, o co-reppressor dissocia-se,
formando um complexo ligante-receptor
Este complexo permite a ligação de proteínas co-activadores levando à transcrição génica
A acção desta hormona permite a síntese selectiva de proteínas e a alteração de quantidade
própria celular. A sua acção é muito específica (actua em menos de 1% dos genes)
- A acção das hormonas pode ser também não-genómica por alteração provocada directamente pelo
receptor.
Hormonas que se ligam a receptores membranares associados à transdução de sinal
Principais tipos de receptores extracelulares: receptores acoplados a proteínas G (GPCRs – protein
cpupled receptors), incluem 7 segmentos transmembranares, em hélice α, apresentando com
frequência pontes de glicosilação. Os receptores extracelulares estão geralmente associados a
mecanismos de transdução de sinal.
Os mecanismos de acção dependem de dois tipos de mensageiros:
1. cAMP como segundo mensageiro
Etapa 1: 1º mensageiro liga-se ao receptor de superfície;
Etapa 2: ligação hormona-receptor activa proteína G (constituída por 3 subunidades: α, β e γ),
subdividindo-se em subunidade α e subunidade β/γ;
Etapa 3: GDP é convertido em GTP pós a clivagem e o complexo subunidade α + GTP estimula
adenilato-ciclase. Se a subunidade α for do tipo α s, a adenilato-cinase é estimulada, se for do tipo αi
provoca a inibição da adenilato-cinase.
A adenilato-cinase é responsável pela conversão de ATP em cAMP (2º mensageiro) que,
por sua vez, activa a proteína cinase A (PKA) que inicia a fosforilação sucessiva de uma séria
de proteínas intracelulares, produzindo uma resposta na célula.
Um exemplo deste tipo de mecanismo é a ADH (vasopressina): a PKA fosforila uma
aquaporina que assume a estrutura de um poro na membrana das células do Tubo
Contornado Distal do rim, reabsorvendo água.
2. cGMP como 2º mensageiro (revela-se pouco importante)
Só são conhecidas duas hormonas que utilizam o mecanismo de transdução de sinal mediado por
cGMP: o Monóxido de Azoto (NO) e o Péptido/Factor Natriuriético Auricular (ANF).
3. Fosfatidilinositois, Diacilgliceróis e Cálcio como segundos mensageiros:
Hormona liga-se a um receptor acoplado a proteína Gq;
Ligação hormona-receptor activa a enzima fosfolipase C (PLC) que catalisa uma reacção
cujos produtos são dois mensageiros: o Trifosfato de Inositol (IP3) e o Diacilglicerol (DAG).
O Trifosfato de Inositol (IP3) circula pelo citosol, mobilizando iões cálcio das mitocôndrias e
retidulo endoplasmático.
O Diacilglicerol (DAG) permanece associado à membrana celular e, juntamente com o cálcio,
activa a Proteína Cinase C (PKC) que fosforila proteínas-alvo, alterando a sua actividade
catalítica.
Um exemplo concreto de uma hormona que utiliza este mecanismo de transdução de sinal é
a Hormona de Libertação de Gonadotrofinas (GnRH). A cascata de fosforilação culmina na
libertação de FSH e LH pela adeno-hipófise.
4. Cinases como segundos mensageiros
O exemplo mais conhecido deste grupo de receptores é o receptor de insulina (Fig.10),
constituído por duas cadeias α, orientadas para o lado extracelular e duas subunidades β
transmembranares, voltadas para o citosol;
Quando a insulina se liga a uma cadeia α, provoca a fosforilação cruzada, em que, a
subunidade β de um lado fosforila os resíduos de tirosina da outra subunidade β e viceversa, por transferência de um grupo fosfato do ATP para o grupo hidroxilo da tirosina;
Obtêm-se uma cadeia de fosforilações sobre um conjunto de proteínas-alvo (IRS1- Insuline
Receptor Substract);
O mecanismo de transdução de sinal da insulina é um dos mais complexos, envolvendo uma
série de cascatas de fosforilação (mediadas por cinases) e não só (Fig.10). Devido à enorme
complexidade funcional da insulina que, no interior da célula actua a vários níveis, o
mecanismo de transdução envolve também a regulação da expressão génica no núcleo, bem
como, por exemplo, a translocação para a membrana plasmática de transportadores de
entrada para a glicose.
Os mecanismos de transdução permitem, portanto a transmissão da sinalização associada a uma
determinada hormona para o interior da célula, desencadeando, através dos segundos mensageiros,
uma série de acontecimentos que culminam na resposta celular à hormona.
Contudo, o prolongamento do sinal por tempo indefinido seria insustentável, impedindo a
funcionalidade do próprio processo de sinalização, Assim existe um conjunto de mecanismos
responsável pela cessação do sinal hormonal. O mecanismo de cessação pode ser feito através da
endocitose e degradação do complexo hormona-receptor.
No caso das hormonas esteróides, a cessação do sinal faz-se habitualmente por:
oxidação dos grupos hidroxilo;
conjugação (formação de ésteres);
redução de ligações duplas (como no caso do cortisol).
No caso das hormonas peptídicas (proteínas e péptidos), o processo faz-se normalmente por:
quebra de pontes bissulfito (quando as há);
degradação por exopeptidases (em que ocorre clivagem na extremidade terminal amina ou
carboxilo e consequente degradação aminoácido a aminoácido);
proteinases (que reconhecem sequências internas).
Regulação hormonal da homeostasia do cálcio
Osteoclastos – reabsorvem osso, formando lacunas (têm de ser diferenciados de pré-osteoclastos
para osteoblastos e depois activados – processo conduzido pelo sistema RANK/RANKL/OPG com
intervenção dos osteoblastos, de forma a assegurar o equilíbrio entre reabsorção e formação do
osso)
Osteoblastos - preenchem as lacunas deixadas pelos osteoclastos
Principais hormonas intervenientes na regulação do cálcio
aumentar a calcémia: PTH e calcitriol
diminuir calcémia: Calcitonina
PTH: hormona proteica, não é regulada pelo eixo hipotálamo-hipófise, fica armazenada nas células
da paratiroideia e é libertada quando a calcémia diminui. Está sempre a ser sintetizada, sendo que o
principal de regulação é pós-tradução:
quando não há hipocalcémia, é degradada entre o complexo de Golgi e os retículos de
excreção, devido à sinalização por parte dos sensores membranares de cálcio;
quando há hipocalcémia, os sensores não são activados e a degradação diminui.
Principais órgãos:
Ossos: aumenta a reabsorção óssea, por activação dos osteoclastos.
Rins: aumenta da reabsorção de cálcio activando os canais de cálcio do Tubo Distal; diminui
a reabsorção de fosfato (para que não se formem precipitados de fosfato de cálcio),
degradando um tipo de transportador de fosfato presente no Tubo Proximal; aumenta a
síntese de calcitriol.
Calcitriol:
diminui a síntese de PTH;
aumenta a reabsorção óssea:
aumenta absorção de cálcio nos intestinos – promovendo a síntese de uma proteína de
ligação do cálcio nas células epiteliais intestinais. Essa proteína permanece nas células
durante várias semanas após a remoção do calcitriol do organismo, causando, assim, um
efeito prolongado sobre a absorção de cálcio;
aumenta a reabsorção renal de cálcio e fosfato.
Calcitonina: hormona tiroideia que regula a hipercalcémia. Principais efeitos:
Diminuição da reabsorção óssea;
Aumento da fixação de cálcio nos ossos;
Aumento da excreção de cálcio nos rins e intestinos.
Efeito muito fraco sobre a concentração plasmática de cálcio no ser humano adulto, quando
comparado com o efeito da PTH.
Efeito mais visível nas crianças, devido à rápida remodelação óssea; na vida extra ulterina a
concentração plasmática é controlada pela presença da PTH.
Regulação da secreção de aldosterona e efeitos na célula alvo
Sistema renina-angiotensina-aldosterona:
1. Diminuição da osmolaridade e da pressão arterial;
2. Rins produzem renina;
3. Renina cliva o angiotensinogénio em angiotensina I – nos rins
4. Angiotensina I é convertida em angiotensina II pela acção da enzima conversora de
angiotensina I – nos pulmões
5. A angiotensina II aumenta a reabsorção de Na+ e de H2O nos rins, estimula a libertação pela
hipófise de ACTH e vasopressina, e aumenta a produção de aldosterona no córtex das
glândulas supra-renais.
ACTH (hormona adrenocorticotrópica) – estimula libertação de hormonas na supra renal.
Vasopressina - aumenta a vasoconstrição – aumento da pressão arterial
Aldosterona - aumenta a permeabilidade das células do ducto colector ao sódio, aumentando a sua
reabsorção, e ainda aumenta a excreção de potássio
Avaliação da função endócrina
Hipocalcémia: espera-se maiores níveis de PTH, o que, se não acontecer, indica que a hipocalcémia
pode ser resultado da falta de PTH
Hipotiroidismo: (avaliação do eixo hipotalamo-hipófise-tiróide)
Primário – (causado por disfunção da tiróide): défice de T3 e T4 e excesso de TSH;
Secundário – (causado por disfunção da hipófise): défice de T3, T4 e TSH
Terciário – (causado por disfunção do hipotálamo): administra-se TSH: se os níveis de TRH
aumentarem é terciário, se se mantiverem é secundário.
Outras causas do hipotiroidismo:
doença de Graves (auto‐imune);
fármacos;
cirurgia (hipotiroidismo Iatrogénico).
Hipertirodismo – causa:
doença de Graves (auto‐imune),
adenoma tóxico,
arcinoma (tumor maligno desenvolvido a partir de células epiteliais ou glandulares),
indução por fármacos,
tumor hipofisário produtor de TSH (secundário)
Nota: como as doenças auto imunes são causas muito comuns, o hipo e hipertiroidismo são também
avaliadas pela medição de anticorpos antitiroideus
Avaliação da supra renal: mede-se hormonas ou metabolitos das hormonas, presentes na urina 24h
(é importante medir os níveis de um dia inteiro devido aos ritmos circadianos de secreção das
hormonas). Mede-se o cortisol, aldosterona e ACTH. Os testes realizados podem ser:
Teste de estimulação com CRH: espera-se o aumento de ACTH e de cortisol.
Teste de estimulação com análogo de ACTH: espera-se o aumento de cortisol e de
aldosterona.
Teste de supressão com dexametasona: (testa resposta aos efeitos da retroalimentação
negativa dos glicocorticóides) espera-se uma diminuição de cortisol.
Teste de estimulação com metirapona: inibe a síntese de cortisol e espera-se o aumento de
ACTH.
Produção de catecolaminas nas supra‐renais – determina-se os níveis de hormonas ou metabolitos
das hormonas como: adrenalina, dopamina, noradrenalina, cromogranina
Causas da hiperfunção da supre-renal:
síndrome de Cushing,
doença de Cushing (secundária a tumor hipofisário produtor de ACTH em excesso),
hiperplasia congénita da supra‐renal,
tumores da supra‐renal
hiperaldosteronismo;
Causas da sua hipofunção são:
insuficiência primária da supra‐renal (Doença de Addison),
insuficiência secundária da supra‐rena
hipoaldosteronismo secundário.
Integração Neuroendócrina/ Eixo hipotálamo-Hipófise, controlo térmico
Homeostasia - capacidade de manutenção de condições internas estáveis face às contínuas
alterações do meio exterior.
Componentes do mecanismos de controlo homeostático:
centro de controlo: analisa as informações recebidas e determina uma resposta apropriada;
receptor: recebe o estimulo e envia a informação ao centro de controlo por via aferente;
efector: recebe a informação do centro de controlo por via eferente e realiza a resposta ao
estímulo - pode moderar, acabar ou paralisar a reacção.
Comportamento (organização do cérebro do ponto de vista evolutivo)
1. Cérebro proto-reptiliano – comportamentos inatos como a alimentação, a luta, a fuga e a
reprodução. Esta divisão é formada pelo diencéfalo, gânglios basais e parte do sistema
olfatório.
2. Cérebro paleo-mamífero – é responsável pelas emoções, pela motivação, pela
aprendizagem e pela memória. Fornece uma maior flexibilidade de comportamento e
integra mensagens tanto interiores como exteriores ao corpo.
3. Cérebro neo-mamífero – é constituído pelo neocórtex. Relaciona-se com os acontecimentos
do mundo exterior. É responsável pela análise de estímulos complexos, por aspetos precisos
do controlo motor, por reforçar a aprendizagem e a memória, e pelo pensamento abstrato e
racional. Nos humanos é também responsável pela linguagem, planeamento, introspeção e
autoconhecimento (consciência). Permite tirar conclusões, traçar planos e inventar.
O Sistema Nervoso (SN) funciona sempre em arco-reflexo:
Notas:
O encéfalo é estimulado de duas formas: por estimulação directa do nível basal da actividade em
grandes áreas encefálicas; e por activação de sistemas neuro-hormonais onde as hormonas
libertadas vão excitar ou inibir áreas específicas do encéfalo.
Os sinais que passam pelo tálamo são de dois tipos: sinal rápido que excita o cérebro durante
milissegundos, tem origem em grandes corpos celulares; ou sinal de baixa velocidade, importante
para o controlo a longo prazo do nível basal da excitabilidade do encéfalo, tem origem num grande
número de pequenos neurónios.
A actividade encefálica também é regulada pela libertação de agentes hormonais
neurotransmissores responsáveis por longos períodos de controlo, em vez de activação ou inibição
instantânea.
Sistema Neuro-Hormonas
Norepinefrina - excita o encéfalo, aumentando a sua actividade; tem um efeito inibitório em
algumas áreas, devido à presença de receptores inibitórios em certas sinapses neuronais. Há
evidências de que este sistema tenha uma participação importante na produção do sono
REM (fase onde surgem os sonhos).
Serotina – efeito inibitório na produção do sono normal
Dopamina – efeito inibitório nos gânglios da base (destruição dos neurónios dopaminérgicos
da substância negra causa a doença de Parkinson)
Acetilcolina – neurotransmissor excitatório
Funções de controlo e vegetativas do hipotálamo (via eferente do sistema límbico - emoções)
Regulação cardiovascular. A estimulação do hipotálamo posterior ou lateral aumenta a
pressão arterial e a frequência cardíaca, enquanto a estimulação da área pré-ótica produz os
efeitos opostos. Estes efeitos são mediados pelos centros de controlo cardiovascular nas
regiões reticulares da ponte e do bulbo.
Regulação da temperatura corporal. A parte anterior do hipotálamo está relacionada com a
regulação da temperatura corporal. O aumento da temperatura do sangue que flui por essa
área aumenta a actividade de neurónios sensíveis à temperatura, enquanto a redução da
temperatura diminui a sua actividade. Por sua vez, estes neurónios controlam os
mecanismos de aumento e diminuição da temperatura corporal.
Regulação da água corporal. Ocorre por dois meios distintos: (1) Hipotálamo lateral cria
sensação de sede quando electrólitos dentro dos neurónios ficam muito concentrados, e (2)
quando os líquidos corporais se tornam mais espessos, neurónios segregam a antidiurética
para a hipófise posterior. Esta hormona é absorvida para o sangue e actua sobre os ductos
colectores dos rins, promovendo a reabsorção maciça de água, o que reduz a perda de água
pela urina.
Regulação da contractilidade uterina e da ejecção de leite pelas mamas. Secreção de
oxitocina, quando o bebe suga a mama materna, um sinal reflexo sai do mamilo indo para o
hipotálamo, produzindo libertação de oxitocina e esta, promove a ejecção do leite pelos
mamilos. No final da gravidez são secretadas grandes quantidades de oxitocina que ajudam
a expulsão o bebe.
Regulação gastrointestinal e da alimentação. A área mais associada à fome é a área
hipotalâmica lateral - a lesão desta área faz com que o animal perca o desejo de alimento. O
centro da saciedade, situa-se no núcleo ventromedial. Quando este centro é estimulado, o
animal que estiver comendo irá interromper abruptamente a ingestão de alimento e tornarse-á indiferente ao mesmo. De outro modo, se esta área for destruída bilateralmente, o
animal nunca pode ser saciado; do que resulta um grau extremo de obesidade.
Tipos de Temperatura – regulação por feedback negativo (centros reguladores do hipotálamo)
Temperatura Central (Tc): Conteúdo da cabeça, cavidade torácica abdominal – é
praticamente constante
Temperatura Superficial (Ts): Pele, tecido celular subcutâneo, gordura e maioria da massa
muscular – Aumenta ou diminui com a temperatura do meio ambiente
Temperatura Corporal (Tco): TCO=0.65xTc + 0.35xTS para uma temperatura neutra de 28 °C –
varia ligeiramente com o exercício e com extremos de temperatura do meio ambiente
Receptores térmicos periféricos: pele
Receptores térmicos profundos: medula espinal, vísceras abdominais, grandes veias
Para que a temperatura não esteja a variar constantemente tem de se verificar a seguinte equação:
M + R + C + K – E =0
M:Taxa de Metabolismo; R: Radiação; C: Convecção; K: Condução; E: Evaporação; tudo em Kcal/m2/h
animal homeotérmico – capaz de regular a temperatura corporal à custa de uma alta taxa
metabólica gerada pela combustão de alimento energético nas células.
animais poiquilotérmico – não possui mecanismo interno de regulação da temperatura
corporal, logo possui uma temperatura variável, consoante a do meio externo envolvente.
Factores que determinam a intensidade da produção de calor:
valor basal do metabolismo celular
actividade muscular
aumento do metabolismo motivado pela tiroxina, epinefrina, norapinefrina e estimulação
simpática
efeitos termogénico da alimentação
Perdas de calor: Principalmente pelo fígado, cérebro, coração e músculos esqueléticos. Calor é
conduzido até a pele onde é perdido para o exterior. Depende de 2 factores:
rapidez com que o calor é conduzido das partes centrais do corpo para a pele;
rapidez com que o calor é transferido da pele para o exterior.
Mecanismos neuronais que reduzem ou aumentem a temperatura corporal
Quando a temperatura é elevada:
vasodilatação: (inibição dos centros simpáticos do hipotálamo posterior) aumenta até 8
vezes a velocidade de perda de calor
sudorese: quando a temperatura corporal é superior a 37ºC (ponto crítico), aumentam as
perdas de calor por evaporação.
diminuição da produção de calor: mecanismos que causam produção excessiva de calor,
como calafrios e termogénese química são inibidos.
Quando a temperatura é baixa:
vasoconstrição: (estimulação dos centros simpáticos do hipotálamo posterior)
Polierecção: estimulação simpática provoca contracção dos músculos erectores dos pêlos,
formando uma camada de “ar isolante”, reduzindo as perdas de calor.
aumento da produção de calor: promoção de calafrios, excitação simpática (através da
libetação de epifenina e norapinefina que provocam oxidação de alimentos em excesso, com
consequente libertação de energia sob a forma de calor – termogénese química) para
produção de calor e secreção de tiroxina.
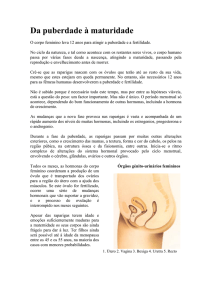
Pancrêas Endrócrino
Pâncreas – função exócrina (relacionada com a digestão) e uma função endócrina, (relacionada com
produção de insulina, glucagina, somatostatina, polipéptido pancreático, etc). Possui três tipos de
células:
1. α – Produtoras de glucagina;
2. β (60-70%) – Produtoras de insulina;
3. δ – Produtoras de somatostatina
Estimação da produção de insulina: após a ingestão de glícidos ocorre, numa 1ª fase, um choque
insulínico, observando-se uma estimulação súbita das células β para produção de insulina. Caso a
refeição tenha sido precedida de jejum prolongado, pode originar-se uma hipoglicémia no inicio da
refeição como resultado da elevada secreção pelas células β. Na fase seguinte, os níveis de insulina
no sangue estão de acordo com os valores glicémicos e o controlo metabólico é mais regulador,
estimulando-se a conversão da glicose a glicogénio sobretudo no fígado, músculo e tecido adiposo.
Quando se atinge o limite para a acumulação de glicogénio, a glicose passa a ser convertida em
ácidos gordos – aumento dos triglicéridos.
A semi-vida da insulina é de cerca de 6 minutos, o que facilita a regulação metabólica. É degradada
pela insulinase principalmente no fígado.
A insulina (hormona de construção anabólica) liga-se a receptores de membrana, constituídos por
2 subunidades α e β desencadeado uma cascata de fosforilação que pode levar a:
transporte de glicose para meio intracelular
síntese proteica
síntese de triglicéridos
síntese de glicogénio
expressão dos genes de crescimento
Fisiologia do Exercício Físico
Músculo esquelético – é responsável pela conversão de energia química em energia mecânica. A sua
subunidade básica é o sarcómero que pode encurtar e desenvolver-se movimento ou não encurtar e
desenvolver-se força.
Para que ocorra contracção muscular é necessário ATP (proveniente da glicose) e cálcio
(responsável pela activação das fibras de actina)
Em condições aeróbias é utilizada a mioglobina como fonte de O2.
Aptidões para haver contracção muscular:
Bioenergética – capacidade de formar ATP e disponibilizar O2;
Biomecânica – proteínas contrácteis que geram movimento/força, ossos, articulações,
músculos e actividade sensorial;
Termoregulação – manutenção de temperatura por termolise e sudorese;
Fases da resposta fisiológica aguda ao esforço (longo)
1. Fase de antecipação ao esforço: o indivíduo está sob tensão, trata-se de uma fase coordenada pelo
SNC e SNA na qual se inicia a preparação da componente cardiovascular, muscular e metabólica. Os
sinais basais aumentam nomeadamente a frequência cardíaca, débito cardiaco, pressão arterial,
complacência venosa.
2. Fase de início: primeiros movimentos consomem o oxigénio da mioglubina – cria-se um
défice de oxigénio [VolumeO2 = Frequência Cardíaca x Volume Sistólico X diferença
artereo venosa de O2].
3. Fase de estado estável: consumo de oxigénio teoricamente é igual à necessidade de O2
para produzir ATP via aeróbia.
4. Fase de esgotamento: é a fase em que se necessita de mais oxigénio, as reservas de glicose
começam a gastar-se rapidamente, e aumenta assim a produção de ácido láctico. O
indivíduo atinge a sua capacidade máxima de trabalho – esforço máximo. Verifica-se
aumento da ventilação, frequência cardíaca e temperatura corporal.
5. Fase de recuperação: Após cessar o exercício não ocorre uma mudança brusca pois existe
mais oxigénio do que o necessário, e este excesso permite repor a mioglobina.
Posteriormente ocorre a recuperação de mecanismos fisiológicos (redução da
temperatura, frequência cardíaca e redistribuição de débitos).
Caso os esforços sejam curtos e intensos apenas se consideram as fases de antecipação ao
esforço, esgotamento e recuperação.
Treino: pela modificação anatómica, fisiológica e constituição de reserva funcional permite a
adaptação ao exercício físico (exposição repetida às condições do exercido, permite menos repulsão
orgânica em nova situação de estímulo)
Princípios do treino:
Princípio da sobrecarga: é essencial no treino para exigir uma nova adaptação por parte do
organismo;
Princípio da sobrecarga progressiva: a sobrecarga deve ser aumentada periodicamente para
que se continue a estimular a adaptação;
Princípio da consistência: após um período de inactividade o indivíduo perde as
características anatómicas/fisiológicas que lhe proporcionavam adaptabilidade, assim existe
a necessidade de manter um treino consistente;
Princípio da especificidade: consoante o desporto que seja praticado, o treino deve incidir
sobre exercícios que desenvolvam características específicas;
Princípio da Individualidade: cada indivíduo possui a sua própria resposta ao treino, e
características únicas na prática desportiva. Estas diferenças prendem-se com factores
genéticos e/ou biológicos;
Princípio da alternância: o treino deve possuir uma alternância entre exercícios fáceis e
difíceis.
Princípio da segurança: a segurança do indivíduo deve ser preservada.
Funções Nervosas Superiores, Emoções, Amígdala e Auto-regulação
A actividade do encéfalo (dividido em 4 lobos) pode ser avaliada por técnicas imagiológicas, tais
como a ressonância magnética funcional (fMRI) e tomografia de emissão de positrões, ou por
electroencefalograma.
Lateralização funcional entre hemisférios
Hemisfério esquerdo: Responsável pela linguagem e informações de carácter simbólico
(raciocínio abstracto, cálculo, …)
Hemisfério direito: Responsável pela integração global multi-sensorial (identificação de uma
paisagem, melodia de musica, informação do sistema emocional)
Diferenças funcionais das regiões cerebrais
Lobo frontal – responsável pela actividade motora, linguagem, pensamento, concentração,
memória de trabalho, comportamento social e personalidade
Lobo parietal – responsável por sensibilidade corporal e capacidades visuo-construtivas
Lobo temporal – responsável por processamento de informações auditivas e memorização
Lobo occipital – responsável por processamento de informações visuais
Percurso do estímulo nervoso:
Informação aferente Córtex sensitivo primário Área de associação unimodal Área de
associação multimodal sensitiva Área de associação multimodal motora (lobo frontal)
Programação e planeamento dos movimentos Córtex pré-motor e motor primário
Áreas de Associação Corticais:
Associação Pré-Frontal: planeamento estratégico do comportamento motor e memória de
trabalho; respostas emocionais e personalidade
Associação Parietal: reconhecer/identificar objectos pelo tacto
Associação Occipital: percepção visual
Associação Temporal: memória verbal; reconhecimento de objectos e faces (bilateral)
Funções Nervosas Superiores
Atenção: relação de estímulos e interligação dos mesmos
Aprendizagem: aquisição de informação que permite alterar o comportamento com base na
experiência
Memória: retenção da informação adequirida.
Tipos de Memória:
Memória de curta duração: relacionada com hipocampo, dura segundos a horas
Memória de longa duração: envolve várias regiões do neocórtex e dura anos. Há 2 tipos:
explícita (relacionada com consciência, envolve factos, datas, eventos,..) associada ao
lobo temporal, sofre um processamento que envolve 4 passos:
1. Codificação – dá-se o processamento de informação nova;
2. Consolidação – a informação nova é alterada para se tornar uma memória de longo
termo;
3. Armazenamento – a informação é retida;
a. Recuperação – a informação armazenada é utilizada
implícita (é uma memória motora e perceptiva – não envolve consciência) associada ao
cérebro e amígdala (memorias associativas – aprendizagem da relação entre dois
estímulos) ou a vias reflexas (memórias não associativas – aprendizagem de um único
estímulo em caso de repetição de estímulos neutros verifica-se uma diminuição da
resposta e dera-se habituação. Em caso de repetição de estímulos
agradáveis/desagradáveis verifica-se o aumento da resposta evocada gerando
sensibilização,
Memória de trabalho: explicita mas de curta duração – permite planear algumas acções.
Linguagem: capacidade de exercer comunicação – desde do discurso (ou escrita) à compreensão da
palavra falada (ou escrita). Processamento na área de Broca-Wernicke.
Características: Compreensão, Fluidez, Nomear e Repetir.
Afasia da Broca: apenas compreende.
Afasia da nomeação: não nomea
Afasia da Wernicke: apenas é fluente
Afasia global: não faz nada!
Funções Executivas:
Praxia: capacidade de realizar actos voluntários adaptados a um objectivo definido
Apraxia: incapacidade de realizar uma série de movimentos complexos, embora a
sensibilidade, motricidade e compreensão da tarefa estejam inatos (exemplos: pentear o
cabelo, escovar os dentes).
Tipos de apraxias:
Apraxia ideomotora: não consegue executar gestos com significado simbólico tradicional
(assobiar, chamar alguém com a mão,...);
Apraxia ideativa: não consegue executar de forma lógica e harmoniosa uma sequência de
movimentos;
Apraxia construtiva: não consegue construir representações (desenhar uma árvore, um
quadrado,...);
Apraxia do vestir: não consegue colocar objectos no próprio corpo;
Apraxia do olhar;
Apraxia da marcha.
Sistema límbico: Responsável pelas emoções, constituído por tecido cortical que se localiza em redor do
hilo (Fissura ou depressão pela qual entram e saem elementos vasculares, nervosos e linfáticos) do hemisfério central,
estando associado à amígdala, hipocampo e núcleos do septo.
Hipocampo: localizado nos lobos temporais, é um canal pelo qual os estímulos sensoriais
podem iniciar comportamentos com diversos propósitos, como prazer, raiva, impulso sexual, … O
hipocampo cria respostas prolongadas e tem um papel importante na aprendizagem e memória.
Amígdala: Estimulação das amígdalas pode causar os mesmo efeitos que a estimulação do
hipotálamo. A sua conexão com o neocórtex permite incorporação de aprendizagem e
experiências nas emoções.
Fecundação, Gravidez, Parto e Lactação
Fecundação:
1. Ocorre na ampola da trompa de Falópio (extremidade junto ao ovário)
2. O espermatozóide tem de atravessar a coroa radiada e de perder parte da cabeça, para
conseguir penetrar no óvulo
3. Um oócito é viável para fecundação durante apenas 6 a 8 horas, já os espermatozóides podem
ficar no útero e permanecer viáveis até 8 dias.
Gravidez:
1. Duração de 40 2 semanas de gravidez, contadas a partir de 2 semanas após o último período
menstrual normal.
2. Uma vez ocorrida a fecundação, o blastocisto é transportado durante 3 a 4 dias através da
trompa de Falópio, até a cavidade do útero. Transporte através de líquido secretado pelo
epitélio e movimentos ciliares até ao útero. Essas secreções também servem para nutrição do
blastocisto.
3. No útero, formam-se vilosidades no endométrio (células inchadas pelos nutrientes
necessários ao embrião)
4. Ao fim de 4 dias de fecundação, é produzida gonadotrofina coriónica humana, que estimula o
aparecimento do corpo amarelo e tem um pico muito pronunciado ao fim de 10 a 12
semanas; esta hormona é medida pelos testes de gravidez, sendo que os falsos negativos
podem dever-se ao facto de ter valores muito variáveis nas primeiras 4 semanas.
5. A placenta começa a formar-se na 12ª semana (Os abortos espontâneos ocorrem antes de se
formar a placenta.); esta produz estrogénio, progesterona e relaxina, que relaxa os músculos
do miométrio dilatando o útero – permite o desenvolvimento do feto.
6. Os níveis de estrogénio e progesterona sobem durante a gravidez. Estimulam a formação de
glicogénio no fígado e as células do pâncreas, levando a hiperinsulinismo.
7. As trocas entre a mãe e o feto dão-se pelo cordão umbilical: gases e alimento da mãe para o
feto e produtos e gases excretados do feto para a mãe. O cordão tem uma veia e duas
artérias, provenientes das artérias umbilicais.
(Durante a gravidez há maior tempo de esvaziamento gástrico e os refluxos são resultado do
relaxamento do esfíncter esofágico (entre o esófago e o estômago).)
Parto:
1. O aumento da secreção de estrogénio e progesterona é igual até cerca do 7º mês, a partir do
qual apenas a secreção de estrogénio aumenta. Isto é importante para o parto porque a
progesterona inibe a contractilidade uterina, enquanto o estrogénio aumenta a
contractilidade uterina, impedindo a expulsão do feto.
2. Pensa-se que o parto é desencadeado por um estímulo hipotalâmico. Papel importante de
duas hormonas: prostaglandinas: aumentam a concentração de cálcio que aumenta a força
das contracções; oxitocina: aumenta a frequência das contracções.
3. A separação entre a mãe e o bebé é feita através do corte do cordão umbilical, que deve ser
feito entre duas pinças.
4. O bebé sofre uma diferença de temperatura e um aumento da pressão e resistência ao nível
central – necessidade de fazer o bebé chorar.
5. O aparelho circulatório do bebé continua a desenvolver-se: na altura do nascimento ainda
existe comunicação entre as aurículas, e portanto entre sangue venoso e arterial; o ventrículo
direito é mais espesso do que o esquerdo, o que se mantém até cerca do 2º mês.
Lactação:
1. A progesterona e o estrogénio inibem a secreção de leite;
2. Prolactina, cuja produção aumenta a partir da 5ª semana, estimula a produção de leite. Após
o nascimento do bebé, há períodos de cerca de 1 hora cada de secreção pronunciada de
prolactina durante e após amamentação.
3. Nos primeiros dias não há produção de leite, mas de colostro, que é mais concentrado, rico
em nutrientes e imunoglobulinas, logo importante para aumentar as defesas do bebé.
4. Vinculação entre mãe e filho pelo cheiro, através das feromonas que ela liberta.
5. A secreção do leite é contínua, sendo ejectado pela acção da oxitocina estimulada pela sucção
do mamilo. A sucção de um dos mamilos causa fluxo de leite não só nessa mama, mas
também na outra.
Obesidade
Classificação: baseia-se no Índice de Massa Corporal (IMC). Medir a massa e dividir pelo quadrado
do peso.
Outras formas de medir obesidade:
Medir o perímetro abdominal, que avalia a gordura visceral;
Bio impedância – gordura é mais isolante que o músculo, pelo que é possível inferir sobre os
níveis de gordura através da medição da impedância eléctrica. A percentagem normal de gordura é
de 30%;
Medição da hemoglobina glicosilada – o eritrócito tem um período de vida de cerca de 3 meses.
Se nesses 3 meses existir muita glicose em circulação, a glicose reage com os resíduos de lisina e
arginina da hemoglobina, glicosilando-os.
Leptina: Hormona produzida nas adipócitos que inibe a sensação de fome e estimula o gasto de
energia. Quanto maior for o adipócito ou quantos mais adipócitos existirem, maior será a produção
de leptina. A leptina actua no hipotálamo e faz com que a hormona norepinefrina através de
Proteínas Desacopladoras leve à desacoplação da cadeia transportadora de electrões na produção
de ATP e assim haja gasto das reservas lipídicas sobre a forma de calor.
Grelina: produzida no estômago, nas células épsilon do pâncreas e no hipotálamo, em situações de
esvaziamento gástrico. Aumenta a produção da hormona do crescimento; Provoca sensação de
fome; Estimula a produção de ácido pelo estômago; Estimula o crescimento celular normal da
mucosa do estômago, intestino e cólon; Induz a produção de pepsina (forma activa do
pepsinogénio), que na digestão actua sobre proteínas no processo de quimificação, dando origem ao
quimo. A Obestina e á forma activa da grelina, tem como efeito a potencial redução do apetite.
Processos orexigénicos - que despertam o apetite,
Processos anorexigénicos - que induzem a perda de apetite,
Processos adipogénicos - acumulação de lípidos nos adipócitos,
Processos adipostáticos - diminuem a quantidade de lípidos acumulados nos adipócitos.
Adiponectina: hormona sintetizada no tecido adiposo. Degrada a glicose e induz oxidação de ácidos
gordos ao nível do fígado e músculos.
Obesidade visceral: intra-abdominal e em grande quantidade. Induz respostas como tolerância à
glicose, patologias cardiovasculares, doenças inflamatórias, disfunção endotelial.
A razão pela qual a obesidade visceral induz todas estas respostas deve-se à localização das células
endoteliais. A vascularização dos epíploons é feita a partir das artérias mesentéricas e a drenagem
venosa a partir das veias mesentéricas e sistema porta. Isto significa que, enquanto todas as outras
células adiposas do organismo produzem mediadores (destaque para a leptina e para a
adiponectina) que se diluem na circulação sistémica, todos os produtos produzidos a nível da célula
adiposa na circulação mesentérica vão ser concentrados a nível da circulação porta hepática e vão
actuar sobre o fígado a uma concentração muito superior ou muito inferior daquela que estará
subjacente à circulação sistémica. Os efeitos sistémicos que também ocorrem são a resistência à
acção da insulina (diabetes tipo 2), um padrão pró-inflamatório (marcado pelas proteína de fase
aguda produzidas a nível no fígado, como a PCR) e patologia cardiovascular associada à hipertensão,
à alteração/disfunção endotelial e à disfunção pró-trombótica.
Causas: excesso de alimentos, Endócrinas: hipotiroidismo ou hipercortisolismo (padrões específicos),
deficiência nas células β (produção de muita insulina) leva a hipoglicémia que é contrária pela
constante ingestão de glícidos.
Tratamento: dieta, exercício físico, cirurgia, fármacos.