Tabela Periódica
1. (Uerj 2014)
O conjunto de elementos químicos
englobados no grupo 3 e no bloco f da tabela de
classificação periódica dos elementos, com exceção dos
actinídeos, é denominado “metais terras raras”.
Esses metais são encontrados comumente na forma de
óxidos, sendo o caráter iônico dos óxidos diretamente
proporcional ao raio atômico do metal.
O metal terra rara componente do óxido de maior caráter
iônico possui o seguinte símbolo:
a) Ac
b) La
c) Lu
d) Sc
2. (Fuvest 2014) Observe a posição do elemento químico
ródio (Rh) na tabela periódica.
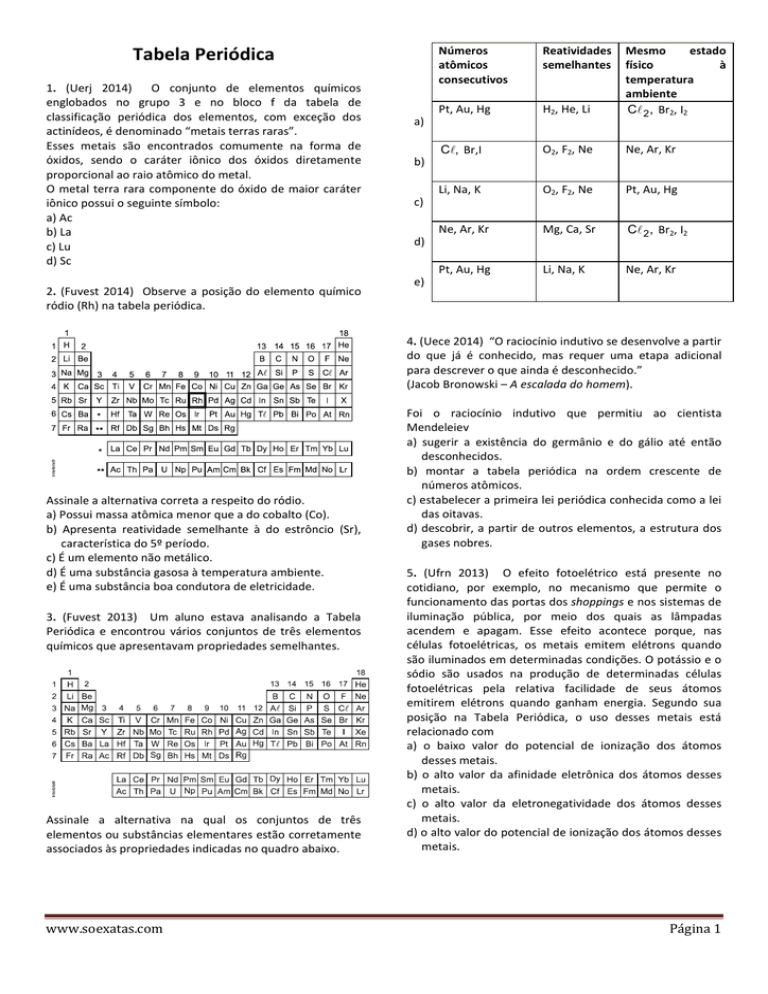
Números
atômicos
consecutivos
Reatividades
semelhantes
Pt, Au, Hg
H2, He, Li
Mesmo
estado
físico
à
temperatura
ambiente
Cℓ 2 , Br2, I2
Cℓ, Br,I
O2, F2, Ne
Ne, Ar, Kr
Li, Na, K
O2, F2, Ne
Pt, Au, Hg
Ne, Ar, Kr
Mg, Ca, Sr
Cℓ 2 , Br2, I2
Pt, Au, Hg
Li, Na, K
Ne, Ar, Kr
a)
b)
c)
d)
e)
4. (Uece 2014) “O raciocínio indutivo se desenvolve a partir
do que já é conhecido, mas requer uma etapa adicional
para descrever o que ainda é desconhecido.”
(Jacob Bronowski – A escalada do homem).
Assinale a alternativa correta a respeito do ródio.
a) Possui massa atômica menor que a do cobalto (Co).
b) Apresenta reatividade semelhante à do estrôncio (Sr),
característica do 5º período.
c) É um elemento não metálico.
d) É uma substância gasosa à temperatura ambiente.
e) É uma substância boa condutora de eletricidade.
3. (Fuvest 2013) Um aluno estava analisando a Tabela
Periódica e encontrou vários conjuntos de três elementos
químicos que apresentavam propriedades semelhantes.
Assinale a alternativa na qual os conjuntos de três
elementos ou substâncias elementares estão corretamente
associados às propriedades indicadas no quadro abaixo.
www.soexatas.com
Foi o raciocínio indutivo que permitiu ao cientista
Mendeleiev
a) sugerir a existência do germânio e do gálio até então
desconhecidos.
b) montar a tabela periódica na ordem crescente de
números atômicos.
c) estabelecer a primeira lei periódica conhecida como a lei
das oitavas.
d) descobrir, a partir de outros elementos, a estrutura dos
gases nobres.
5. (Ufrn 2013) O efeito fotoelétrico está presente no
cotidiano, por exemplo, no mecanismo que permite o
funcionamento das portas dos shoppings e nos sistemas de
iluminação pública, por meio dos quais as lâmpadas
acendem e apagam. Esse efeito acontece porque, nas
células fotoelétricas, os metais emitem elétrons quando
são iluminados em determinadas condições. O potássio e o
sódio são usados na produção de determinadas células
fotoelétricas pela relativa facilidade de seus átomos
emitirem elétrons quando ganham energia. Segundo sua
posição na Tabela Periódica, o uso desses metais está
relacionado com
a) o baixo valor do potencial de ionização dos átomos
desses metais.
b) o alto valor da afinidade eletrônica dos átomos desses
metais.
c) o alto valor da eletronegatividade dos átomos desses
metais.
d) o alto valor do potencial de ionização dos átomos desses
metais.
Página 1
6. (Ufjf 2012) Com base nos dados da Tabela Periódica,
assinale a alternativa INCORRETA.
a) O elemento estrôncio possui 02 (dois) elétrons na sua
camada de valência.
b) Elementos do grupo 17 têm a tendência de formar
ânions, enquanto os elementos do grupo 01 têm a
tendência de formar cátions.
c) O elemento que possui 52 prótons pertence ao 5º
período.
d) O fósforo possui, na sua camada de valência, a
configuração 3s2 3p5 .
e) O elemento do grupo 02 e período 06 possui maior raio
atômico do que o elemento do grupo 14 e período 04.
determinar se elementos proibidos pela legislação estão
presentes em produtos alimentícios.
Se um alimento contém um elemento químico indesejado
de número atômico 24 e massa atômica 52, então a
espectroscopia de absorção atômica o identificaria como
a) silício.
b) cromo.
c) telúrio.
d) magnésio.
9. (Uel 2007) Observe o desenho a seguir e correlacione as
letras A, B, C, D e E com as propriedades e características
dos elementos químicos representados na ilustração.
7. (Ufrn 2013)
A Lei Periódica e sua representação gráfica, a Tabela
Periódica, são dois conhecimentos essenciais para a
química e para os químicos. D. Mendeleev (1834-1907), em
meados do século XIX, organizou os elementos conhecidos
nessa época, aproximadamente 60, em ordem crescente de
seus pesos atômicos, segundo as propriedades
semelhantes, um abaixo do outro. Nessa organização,
alguns espaços ficaram em branco, pois não eram
conhecidos todos os elementos em questão, e Mendeleev
previu a existência do elemento hoje conhecido como
Germânio, o qual chamou de ekasilício, por estar na mesma
coluna do silício. Posteriormente, esse elemento foi
descoberto e suas propriedades coincidiram com as
previstas por Mendeleev. Hoje, a Tabela Periódica se
organiza em função das estruturas atômicas dos átomos.
a) Explique o que significa periodicidade no agrupamento
dos elementos na Tabela Periódica.
b) Como se explica o fato de Mendeleev poder prever as
propriedades de um elemento desconhecido na sua
época?
c) Represente a distribuição eletrônica por níveis e
subníveis para o átomo do elemento cloro.
8. (G1 - cftmg 2013)
No Laboratório de Análises
Instrumentais do CEFET-MG são analisados vários
elementos químicos por meio de técnicas, como a
espectroscopia de absorção atômica. Seu uso permite
www.soexatas.com
Assinale a alternativa correta:
a) A e D apresentam características básicas.
b) C forma óxidos e cloretos de fórmula mínima C2O e CCℓ2,
respectivamente.
c) D é um não metal que apresenta configuração eletrônica
2
2
da camada de valência ns np .
d) B é um metal de transição com características
anfotéricas.
2
e) E apresenta configuração eletrônica terminada em ns e
alto valor de eletronegatividade.
10. (Pucrj 2013) O elemento iodo é um sólido que sublima
na temperatura ambiente e que foi descoberto em 1811
por Bernard Courtois.
Sobre as características desse elemento e suas
propriedades, em função da sua posição na tabela
periódica, é correto afirmar que o iodo
a) é mais eletronegativo que o cloro.
b) no estado fundamental possui, na última camada, 1
elétron no subnível s e 5 no subnível p.
c) produz um hidrácido que possui fórmula H2I.
d) por ter brilho, é um metal.
e) combina-se com o hidrogênio formando ligação
covalente polar.
11. (Pucrs 2013) Analise o texto a seguir:
Na montagem de um automóvel, geralmente são usados
vários metais e ligas metálicas, como, por exemplo, ferro,
na forma de aço, na lataria; cobre, nos fios elétricos; ligas
de alumínio, magnésio e outros metais, nas rodas; chumbo,
Página 2
na bateria; níquel, nos adornos e acabamentos metálicos,
entre outros.
Em relação aos metais citados, é correto afirmar que
a) magnésio e alumínio estão no mesmo grupo da tabela
periódica.
b) ferro, cobre e níquel são elementos representativos e
estão no mesmo período da tabela periódica.
c) o chumbo tem maior ponto de fusão do que os demais
elementos.
d) o cobre é menos denso do que o alumínio.
e) o magnésio tem símbolo Mg e é o mais eletropositivo.
+
a) 35% em relação ao diâmetro do íon Na , pois há um
próton a mais em seu núcleo, aumentando a atração
núcleo-eletrosfera.
+
2+
b) 65% em relação ao diâmetro do íon Na , pois o íon Mg
tem carga efetiva e raio iônico maiores.
c) 65% em relação ao diâmetro do átomo de Mg, pois nem
todo cátion tem o raio iônico maior do que o raio
atômico do átomo do qual é derivado.
d) 35% em relação ao diâmetro do átomo de Na, pois o íon
2+
Mg tem maior carga efetiva e menor raio iônico.
+
e) 65% em relação ao diâmetro do íon Na , pois este tem
maior carga efetiva e menor raio iônico.
12. (Ufsc 2013) O Transtorno Bipolar do Humor é uma
doença caracterizada por rápidas oscilações ou mudanças
cíclicas de humor, as quais vão desde oscilações normais,
como nos estados de alegria e tristeza, até mudanças
patológicas acentuadas e diferentes do normal, como
episódios de mania, irritação e depressão. E relativamente
comum, acometendo aproximadamente 8 a cada 100
indivíduos, e manifesta-se igualmente em mulheres e
homens. Medicamentos à base de lítio, geralmente
carbonato de lítio, são indicados para diminuir a frequência
e a intensidade das crises, bem como para prevenir a fase
depressiva. O carbonato de lítio é um pó cristalino branco,
inodoro, de sabor levemente alcalino.
14. (Uepg 2013) Um elemento químico em seu estado
fundamental apresenta a distribuição eletrônica abaixo.
Com relação a esse elemento, assinale o que for correto.
Assinale a(s) proposição(ões) CORRETA(S).
01) O raio atômico do lítio é maior que o raio do respectivo
cátion.
02) O carbonato de lítio apresenta duas ligações iônicas.
04) O átomo de lítio possui dois elétrons na camada de
valência.
08) A ordem crescente de eletronegatividade dos
elementos químicos presentes no carbonato de lítio é:
lítio < carbono < oxigênio.
16) As ligações formadas entre os átomos que constituem o
íon carbonato possuem caráter predominantemente
iônico.
32) O número de oxidação do carbono no íon carbonato é
+4.
+
2+
64) Embora o íon lítio (Li ) e o íon berílio (Be ) sejam íons
2+
isoeletrônicos, o íon Be possui maior raio que o íon
+
Li .
15. (Ufg 2013) Os compostos químicos são formados por
ligações
entre
diferentes
elementos
químicos.
Considerando-se somente os elementos Na, Cℓ, C, H e O,
a) cite pelo menos três exemplos de compostos formados
por combinações entre os elementos citados que
apresentam alta solubilidade e condutividade elétrica
em solução aquosa (pode-se usar o mesmo elemento
mais de uma vez);
b) organize-os em ordem decrescente de raio atômico e
justifique essa organização.
13. (Ufg 2013) A tabela a seguir apresenta os valores de
raio atômico e raio iônico para alguns átomos e íons.
Na
+
Na
Mg
2+
Mg
Raio atômico
(em picômetros)
190
–
160
–
Raio iônico
(em picômetros)
–
90
–
60
De acordo com os dados apresentados, a porcentagem
2+
aproximada de diminuição do diâmetro do íon Mg bem
como a explicação para o fato são, respectivamente,
www.soexatas.com
– nível 1 (K): completo;
– nível 2 (L): completo;
– nível 3 (M): 4 elétrons.
01) Possui número atômico igual a 14.
02) Encontra-se no terceiro período da tabela periódica.
04) Pertence à família do carbono.
08) É um metal com elevada eletronegatividade.
16) Nessa mesma família, pode-se encontrar o elemento
germânio (Z=32).
16. (Uepg 2013)
Comparando-se as propriedades
periódicas dos elementos que compõem o KCℓ, assinale o
que for correto.
Dados: K (Z=19) e Cℓ (Z=17).
01) O potássio possui maior caráter metálico.
02) O cloro possui maior eletronegatividade.
04) O cloro tem maior raio atômico.
08) O potássio tem maior eletroafinidade.
16) O potássio tem maior potencial de ionização.
17. (Ufsj 2013) As terras raras constituem um grupo de
elementos cobiçado devido à sua utilização em produtos de
alta tecnologia: superímãs, telas de tablets, computadores,
celulares, painéis solares, geradores eólicos, carros elétricos
e outros. Sobre as terras raras, é CORRETO afirmar que são
formadas pelos elementos
a) Sc, Y, Zr, Os, Po.
b) Be, Mg, Ca, Sr, Ra.
c) Ac, Th, U, Bk, Cf.
d) La, Nd, Eu, Dy, Lu.
Página 3
18. (Uerj 2013) Em uma das primeiras classificações
periódicas, os elementos químicos eram organizados em
grupos de três, denominados tríades. Os elementos de cada
tríade apresentam propriedades químicas semelhantes, e a
massa atômica do elemento central equivale
aproximadamente à média aritmética das massas atômicas
dos outros dois. Observe as tríades a seguir:
Li
Na
K
Cℓ
Br
l
d) halogênios e calcogênios.
e) metais alcalinos terrosos e halogênios.
S
X
Te
Com base nos critérios desta classificação, a letra X
corresponde ao seguinte elemento químico:
a) O
b) As
c) Se
d) Po
19. (Unicamp 2013) Na década de 1970, a imprensa
veiculava uma propaganda sobre um fertilizante que dizia:
“contém N, P, K, mais enxofre.” Pode-se afirmar que o
fertilizante em questão continha em sua formulação,
respectivamente, os elementos químicos
a) nitrogênio, fósforo, potássio e enxofre, cujo símbolo é S.
b) níquel, potássio, criptônio e enxofre, cujo símbolo é Ex.
c) nitrogênio, fósforo, potássio e enxofre, cujo símbolo é Ex.
d) níquel, potássio, cálcio e enxofre, cujo símbolo é S.
20. (Ibmecrj 2013) De acordo com o a tabela periódica
abaixo, assinale a alternativa incorreta quanto à posição
dos algarismos romanos que estão substituindo os símbolos
dos elementos químicos:
a) O elemento químico representado por II é um gás nobre.
b) O elemento químico representado por VII possui número
atômico igual a 36.
c) O elemento químico representado por IX possui número
de massa igual a 133.
d) O elemento químico representado por I é um gás a
temperatura ambiente.
e) O elemento químico representado por X pode ser
classificado por metal alcalino terroso.
21. (G1 - utfpr 2013) Na classificação periódica, os
elementos químicos situados nas colunas IA e VIIA são
denominados, respectivamente, de:
a) metais alcalinos terrosos e calcogênios.
b) metais e gases nobres.
c) metais alcalinos e halogênios.
www.soexatas.com
Página 4












