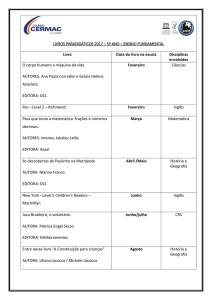
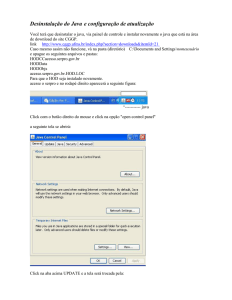
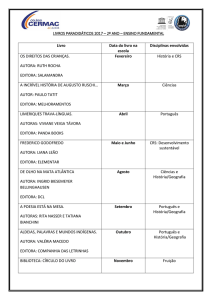
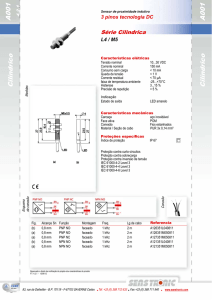
Teoria da Ligação Química
Click to edit Master title style
Moléculas poliatómicas
Considere-se a molécula H2O
•
•
•
•
•
Click to edit Master text styles
Second level
Third level
Fourth level
Fifth level
As ligações nesta molécula seriam explicadas com base na coalescência de duas orbitais p do átomo de
oxigénio com orbitais 1s dos átomos de hidrogénio.
O que está errado nesta descrição?
De facto, o ângulo que se obtém entre as duas ligações σ é de 90 ºC enquanto o valor experimental é
104 º
O mesmo problema ocorre para o caso do NH3. Dado que as ligações são feitas com as orbitais p do N,
o ângulo entre elas é de 90º, enquanto que o valor experimental é de 107º.
14
14
Teoria da Ligação Química
Click to edit Master title style
Considere-se o átomo de carbono. No estado fundamental a configuração é 1s2 2s2 2px1 2py1
Com esta configuração seria de esperar que a molécula mais simples formada por C e H fosse CH2...
• Click to edit Master text styles
• Second level
Já é possível explicar a ligação química na molécula CH ?
• Third level
• Fourth level
• Fifth level
Para o carbono ser tetravalente é necessário “promover” um
2pz (implica dispêndio de energia).
electrão da orbital 2s para a orbital
4
(ângulo exp. de 109º 28’)
Para explicar a formação de ligações químicas cujos ângulos não são os previstos pelo uso de orbitais
atómicas puras, a TEV usa o conceito de hibridação.
A hibridação consiste na mistura ou combinação linear de um certo numero de orbitais atómicas
“puras” de modo a obter um número igual de orbitais híbridas com propriedades direccionais
diferentes das de cada uma das orbitais “puras” usadas na combinações.
15
15
Teoria da Ligação Química
Click to edit Master title style
A orbital híbrida mais simples do ponto de vista matemático é a orbital sp:
ψsp= aψs + bψp
•
•
•
€
•
€
•
Click to edit Master text styles
1
Second
ψ =
ψ )
(ψ +level
2
1
Third
ψ = level
(ψ − ψ )
2
Fourth level
Fifth level
Aplicando a condição de normação, as duas orbitais sp vêm:
sp1
s
px
sp 2
s
px
Estas orbitais apresentam uma geometria linear
16
16
Teoria da Ligação Química
Click to edit Master title style
Existem outras possibilidades de combinar as orbitais “puras” s e p:
•
•
•
•
•
Click to edit
Master text styles
1
2
ψ =
ψ + ψ
3
3
Second level
1
1
1
ψ =
ψ −
ψ +
ψ
3
6
2
€
Third
level
1
1
1
ψ =
ψ −
ψ −
ψ
3
6
2
Fourth
level
€
Fifth
level
€
Hibridação sp2:
Geometria trigonal plana
1
s
px
2
s
px
py
3
s
px
py
17
17
Teoria da Ligação Química
Click to edit Master title style
Hibridação sp3:
Geometria tetraédrica
1
(ψ s − ψ px − ψ py − ψ pz )
2
1
ψ 2 = (ψ s − ψ p x + ψ p y + ψ p z )
2
ψ1 =
•
•
•
•
•
Click to edit Master text styles
1
€
ψ
=
(ψ + ψ − ψ + ψ )
Second level
2
€
1
ψ = (ψ + ψ + ψ − ψ )
Third level
2
€
Fourth
level
€
Fifth level
3
s
px
py
pz
4
s
px
py
pz
São possíveis também hibridações com orbitais d:
Número de orbitais
atómicas
2
3
4
5
6
Tipo de hibridação
sp
sp2
sp3
dsp3
d2sp3
Número de orbitais
híbridas
2
3
4
5
6
geometria
linear
Trigonal plana
Tetraédrica
Bipirâmide trigonal
Octaédrica
18
18
Teoria da Ligação Química
Click to edit Master title style
Descrever a ligação química na molécula CH4 é agora mais simples:
•
•
•
•
•
Click to edit Master text styles
Second level
Third level
Fourth level
Fifth level
Um tratamento semelhante pode ser feito para as moléculas H2O e NH3 tendo em atenção que os
coeficientes a usar nas combinações lineares devem ter em conta o ângulo entre as ligações, ou seja,
as orbitais híbridas obtidas devem devem estar de acordo com a geometria observada
experimentalmente.
A percentagem de carácter s e p pode variar de acordo com o ângulo das ligações :
CH4
Orbitais que fazem a ligação
Orbitais não ligantes
25% s, 75% p
NH3
23% s, 77% p
31% s, 69% p
19
Chemical Structure and Bonding, R. L. DeKock, H. B.19
Gray,
University Science Books, Sausalito, California,1989.
Teoria da Ligação Química
Click to edit Master title style
Ligações multiplas
Considere-se a molécula de eteno:
•
•
•
•
•
H
H
Click to edit Master text
styles
C C
H
H
Second level
Third level
Fourth level
Fifth level
A estrutura de Lewis prevê a existência de uma
ligação dupla entre os dois átomos de carbono:
Neste composto, as ligações à volta do átomo de carbono estão dispostas numa geometria trigonal
plana, pelo que a hibridação das orbitais a considerar será sp2. Forma-se uma ligação π pela coalescência
lateral das duas orbitais p que não participam na hibridação.
20
20
Teoria da Ligação Química
Click to edit Master title style
No caso do etino a estrutura de Lewis é
•
•
•
•
•
H
C
C
H
Click to edit Master text styles
Second level
Third level
Fourth level
Fifth level
Como a disposição das ligações é linear deve ser considerada a hibridação sp. As orbitais p que não
participam na hibridação formam duas ligações π.
21
21
Teoria da Ligação Química
Click to edit Master title style
Outras moléculas
BeCl2
•
•
•
•
•
~750 ºC
Click to edit Master text styles
Second level
Third level
Fourth level
Fifth level
<750 ºC
Ligação covalente dativa ou ligação coordenada
22
22
Teoria da Ligação Química
Click to edit Master title style
Cloreto de Berílio sólido
• Click to edit Master text styles
• Second level
• Third level
• Fourth level
BH
• Fifth level
3
(hipotética)
23
23
Teoria da Ligação Química
Click to edit Master title style
B2H6
•
•
•
•
•
Click to edit Master text styles
Second level
Third level
Fourth level
Fifth level
24
24
Teoria da Ligação Química
Click to edit Master title style
BX3
•
•
•
•
•
Click to edit Master text styles
Second level
Third level
Fourth level
Fifth level
25
25
Teoria da Ligação Química
Click to edit Master title style
Benzeno
•
•
•
•
•
Click to edit Master text styles
Second level
Third level
Fourth level
Fifth level
26
26
Teoria da Ligação Química
Click to edit Master title style
•
•
•
•
•
Click to edit Master text styles
Second level
Third level
Fourth level
Fifth level
27
27