Química Aplicada – Departamento de Ciências Naturais, ECBS/UNIRIO
PRÁTICA 6
Determinação do Teor de AAS em comprimidos
Obtenção de cola de caseína
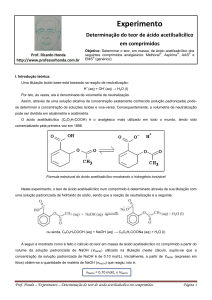
O ácido acetilsalicílico (C8O2H7COOH) é o analgésico mais utilizado em todo o mundo,
tendo sido comercializado pela primeira vez em 1898.
Fórmula estrutural do ácido acetilsalicílico mostrando o hidrogênio ionizável
Objetivo
Determinar o teor, em massa, de ácido acetilsalicílico em comprimidos de analgésicos
como Melhoral®, Aspirina®, AAS® etc.
Obter cola de caseína utilizando leite como matéria prima.
Procedimento experimental
Determinação do teor de AAS em comprimidos.
Reagentes: Comprimido de AAS® ou de Melhoral® ou de Aspirina® etc. Solução de
hidróxido de sódio 0,10 mol/L padronizada, etanol, água destilada, solução alcoólica de
fenolftaleína.
Aparelhagem: Balança de precisão, erlenmeyer de 125 mL, bureta, funil analítico.
Procedimento:
Pesar o comprimido de analgésico e anotar a massa obtida. Colocar o comprimido no
erlenmeyer de 250 mL de capacidade e adicionar 20 mL de água destilada. Agitar a
mistura até que o comprimido se desmanche (se necessário, quebre o comprimido com
Química Aplicada – Departamento de Ciências Naturais, ECBS/UNIRIO
um bastão de vidro). Adicionar 20 mL de etanol comercial ao erlenmeyer e agitar até a
solubilização total. Adicionar 3 a 5 gotas da solução alcoólica de fenolftaleína.
Encher a bureta com solução de hidróxido de sódio padronizada e iniciar a titulação
lentamente até o aparecimento de uma coloração rósea que persista por pelo menos 1
minuto. Anotar o volume da solução de hidróxido de sódio gasto para neutralizar o ácido
acetilsalicílico contido na solução do erlenmeyer. Calcular o teor em massa do ácido
acetilsalicílico no comprimido utilizando a seguinte expressão:
Reação de neutralização:
C8O2H7COOH(alc/aq) + NaOH(aq)
C8O2H7COONa(aq) + H2O(l)
Onde: alc/aq significa solução hidroalcoólica, isto é, ácido acetilsalicílico dissolvido
numa mistura etanol/água.
A seguir é mostrado como é feito o cálculo do teor em massa de ácido acetilsalicílico
no comprimido a partir do volume da solução padronizada de NaOH (VNaOH) utilizado na
titulação (neste cálculo, supôs-se que a concentração da solução padronizada de NaOH é
de 0,10 mol/L). Inicialmente, a partir de VNaOH (expresso em litros) obtém-se a quantidade
de matéria de NaOH (nNaOH) que reagiu, isto é:
nNaOH = 0,10 mol/L VNaOH
Então, utilizando-se a informação de que 1 mol de NaOH é consumido sempre que 1
mol de ácido acetilsalicílico reage (obtida da equação química balanceada da reação de
neutralização), obtém-se a quantidade de matéria de ácido acetilsalicílico no comprimido
(nAAS), ou seja:
nAAS = nNaOH (1 mol AAS/1 mol NaOH)
Finalmente, sabendo que a massa molar do ácido acetilsalicílico é 180,2 g/mol,
calcula-se a sua massa no comprimido (mAAS), isto é:
mAAS = nAAS 180,2 g/mol
Comparar o valor obtido com aquele indicado na embalagem do comprimido
analgésico analisado.
Química Aplicada – Departamento de Ciências Naturais, ECBS/UNIRIO
Obtenção de cola de caseína
Reagentes: 1,0 g de bicarbonato de sódio, 50 g de leite em pó, HCl concentrado, solução
de formol a 0,5%.
Aparelhagem: 2 béqueres de 200 mL, 1 proveta de 50 mL, bastão de vidro, 1 pedaço de
pano de aproximadamente 30 cm x 30 cm (malha de algodão) ou “perfex”, pedaço de
jornal.
Procedimento:
Adicionar aproximadamente 2 colheres de sopa de leite em pó a um bécher de 200
mL e 125 mL de água destilada. Adicionar à mistura 2 mL de ácido clorídrico concentrado.
Filtrar a mistura com auxílio de uma pano ou de “perfex”. Transferir o material filtrado para
um bécher de 200 mL, adicionar mais 0,5 mL de HCl concentrado e filtrar novamente.
Juntar o material sólido das duas filtrações (que deverá ter consistência semelhante à de
um queijo cremoso), adicionar 1,0 g de bicarbonato de sódio e misturar até que a mistura
se torne homogênea. Acrescentar 15 mL de água e agitar até que toda a massa seja
dissolvida. A reação do ácido restante com o bicarbonato de sódio deverá produzir uma
pequena quantidade de espuma que em pouco tempo se desfaz. Utilizar dois pedaços de
papel para testar as propriedades adesivas da cola obtida.
Dividir a cola restante em duas porções e armazenar em frascos com tampa. Em um
dos frascos adicionar algumas gotas da solução de formol a 0,5 %, fechar, agitar e
identificar os frascos. Deixar em repouso por quinze dias e após este período observar e
testar cada uma das colas em relação às suas propriedades adesivas.
Questionário
1. Qual a porcentagem em massa de ácido acetilsalicílico no comprimido analisado?
2. Para que se adiciona etanol no início do experimento?
3. Qual é o papel da fenolftaleína na titulação? Poderia ser utilizado um outro reagente?
4. Por que a caseína precipita?
5. Qual a finalidade da adição do merthiolate?