Mestrado Integrado em Engenharia Biomédica
Química Nuclear
e Radiofarmácia
T1
A C Santos
Diferenças entre física nuclear e química nuclear:
- sobreposição das 2 áreas muitas vezes referidas como ciência nuclear
- física nuclear: estudos detalhados das interacções fundamentais entre
partículas sub-atómicas e simetrias básicas que regulam o seu comportamento
- química nuclear: além das ligações estreitas à química tradicional, estuda
fenómenos + complexos em que o comportamento estatístico é importante (ex:
estudo do ciclo do fuel nuclear nos reactores ou migração de nuclidos no ambiente)
- radioquímica: termo frequentemente associado à química nuclear que se
refere à manipulação química de radioactividade e fenómenos associados
Todos os radioquímicos são, por definição, químicos nucleares mas nem todos os químicos
nucleares são radioquímicos. Muitos químicos nucleares usam técnicas puramente nãoquímicas, i.e. técnicas físicas, para estudar fenómenos nucleares e, assim, a sua área de
trabalho não é a radioquímica!
(a) estudo das propriedades químicas e físicas dos elementos pesados em que
a detecção do decaimento radioactivo é essencial;
(b) Estudo das propriedades nucleares tais como estrutura, reacções e
decaimento radioactivo (Química);
(c) estudos de fenómenos macroscópicos (ex: geocronologia e astrofísica) em
que os processos nucleares estão intimamente envolvidos;
(d) aplicação de técnicas de medida baseadas em fenómenos nucleares (ex:
análises de activação, radiotraçadores) em várias áreas.
Como ramo da Química, a química nuclear frequentemente
necessita de várias áreas mais tradicionais: orgânica, analítica,
inorgânica e química física. Os químicos nucleares sintetizam
e preparam frequentemente radiomoléculas para investigação
ou aplicação em Medicina.
Resenha histórica
Willhelm Conrad Roentgen
(1845-1923)
1895 - W. Roentgen descobriu que quando raios catódicos (e-)
chocavam com as paredes de um tubo de vidro sob vácuo
davam origem a que estas emitissem luz visível
(fluorescência) enquanto, em simultâneo, se produzia uma
radiação bastante penetrante = raios X.
H. Becquerel, que se interessava por espectros fluorescência de
minerais, decidiu investigar a possibilidade de que a fluorescência
observada nalguns sais quando expostos à luz solar também
provocasse a emissão de Rx.
Colocou cristais de sulfato de potássio de uranilo sobre películas
fotográficas (envolvidas em papel negro) e expôs o conjunto à luz
do sol. Após revelação das películas Becquerel concluiu
(erradamente) que, devido à presença de pontos pretos sob os
cristais, a fluorescência destes levava à emissão de Rx que
penetravam o papel do invólucro. No entanto, Becquerel
rapidamente percebeu que a radiação responsável pelo
enegrecimento não era “a transformação da energia solar”, uma
vez que este também ocorria quando não havia exposição à luz... o
sal de uranilo produzia radiação espontaneamente!
Esta radiação, primeiramente designada por raios de urânio (ou
raios de Becquerel) e só + tarde chamada radioactividade, era
similar aos Rx uma vez que ionizava o ar.
Henri Becquerel
(1852-1908)
Marie Curie mostrou que todos os compostos de
urânio e tório produziam radiação ionizante
independentemente da composição química dos
sais. Assim, a radiação era 1 propriedade dos
elementos urânio e tório.
Marie Sklodowska-Curie
(1867- 1934)
Marie Curie e Pierre Curie purificaram pecheblenda, medindo a
radiação na solução e no precipitado após cada passo da
separação. Estas 1ªs experiências radioquímicas foram muito bem
sucedidas tendo-se obtido + produtos activos: um deles 400 x +
activo que o urânio: polónio (1898) – elemento descoberto em
simultâneo e independentemente por W. Marckwald que lhe
chamou "radiotelúrio".
Juntamente com G. Bemont, o casal Curie isolou outra substância radioactiva: o rádio. Para
provar que o Po e o Ra eram 2 novos elementos processaram uma enorme quantidade de
pecheblenda e, em 1902, M. Curie anunciou ter isolado cerca de 0,1 g de cloreto de rádio
puro a partir de + de 1 ton de pecheblenda!! A determinação do peso atómico do Ra e a
obtenção do seu espectro de emissão provaram que era efectivamente 1 novo elemento.
Enquanto investigavam as propriedades
radioquímicas do urânio, W. Crookes e Becquerel
fizeram 1 importante descoberta: precipitando 1 sal
de carbonato a partir de 1 solução contendo iões
uranilo verificaram que, enquanto o U permanecia
no sobrenadante (na forma de 1 complexo
carbonado solúvel de uranilo), a radioactividade
originalmente associada ao U estava presente no
precipitado, que não continha U. Além disso, a
radioactividade do precipitado ↓ com o tempo,
enquanto a do sobrenadante ↑ durante o mesmo
período (Fig. 1). Hoje sabe-se que esta medição da
radioactividade teve em conta apenas as radiações
β e γ e não contabilizou a radiação α que é emitida
directamente pelo U.
Radioactividade (escala relativa)
decaimento radioactivo
Radioactividade
da sol. de U
Radioactividade
do precipitado
Tempo após a precipitação
Fig. 1 – Variação da radioactividade do precipitado de
carbonato e do sobrenadante (sol. de U ), i.e. separação
do elemento “filho” (Th) a partir do U “progenitor”.
Resultados similares foram obtidos por E. Rutherford e F. Soddy nos seus estudos sobre a
radioactividade do Th. + tarde Rutherford e F. E. Dorn demonstraram que era possível
separar gases radioactivos (emanações) a partir dos sais de U e Th. Após separação do
gás do sal a radioactividade do gás ↓ com o tempo, enquanto + radioactividade aparecia no
sal (≅ Fig. 1) com 1 velocidade ↑, completamente independente de processos químicos,
temperatura, etc.. Rutherford e Soddy concluíram que deveria haver alterações nos próprios
átomos o decaimento radioactivo ocorria e o U e o Th transformavam-se em átomos de
novos elementos.
O decaimento radioactivo é 1 transformação nuclear espontânea que se provou
ser independente das condições de pressão, temperatura, forma química,
etc. (excepto em casos muito especiais). Esta insensibilidade às condições
extranucleares permite-nos caracterizar os núcleos radioactivos pelo seu
período, modo e energia de decaimento sem ter em conta as suas condições
fisico-químicas.
O decaimento radioactivo envolve a transição de um estado quântico definido do
nuclido original para estado quântico do nuclido produto. A diferença de
energia entre os 2 níveis quânticos envolvidos na transição corresponde à
energia do decaimento. Esta energia do decaimento revela-se sob a forma
de radiação electromagnética e como a energia cinética dos produtos.
A dependência em relação ao tempo do decaimento radioactivo é expressa em
termos de “half-life” (t ½) , que corresponde ao tempo necessário para que ½
dos átomos radioactivos da amostra sofra decaimento. Na prática este tempo
é medido em termos de intensidade de radioactividade (ou simplesmente,
radioactividade de 1 amostra) que ↓ para ½ do valor anterior.
t ½ podem variar desde milhões de anos a fracções de seg. Enquanto t ½ entre 1
min e 1 ano são facilmente determinadas com métodos simples de laboratório,
a determinação de t ½ muito + curtas requer técnicas elaboradas com
instrumentação complexa. O t ½ + curto que hoje se consegue medir é ≈ 10-18
s. Consequentemente o decaimento radioactivo que ocorre n1 período de
tempo < 10-18 s é considerado instantâneo. Por outro lado, se o t ½ excede
1015 anos, o decaimento geralmente não pode ser observado acima do sinal
de fundo (“background”) presente nos detectores. Assim, nuclidos cujos t ½ >
1015 anos são normalmente considerados estáveis no que diz respeito ao
decaimento radioactivo. No entanto, alguns nuclidos instáveis com t ½
extremamente longos, ≥1020 y, foram identificados. Deve ter-se presente que
1015 anos é ≈ 105 x > que a idade do universo!
No decaimento radioactivo, bem como noutras reacções nucleares, as leis da
conservação têm de ser cumpridas:
X representa qualquer partícula nuclear ou elementar. Em reacções nucleares
induzidas X1 pode ser a partícula bombardeante (ex: 4He átomo n1 feixe de
partículas α) e X2 o átomo alvo (ex: 14N átomos), X3 e X4 são os produtos
formados (ex: 1H e 17O).
Para a reacção geral:
(a) a energia total de 1 sistema tem de permanecer constante, i.e. E inclui todas as
formas de energia : massa, cinética, electrostática, etc..
(b) a carga total (protões and electrões) do sistema tem de permanecer
constante, i.e.
(c) o nº de massa (nº de nucleões) no sistema tem de permanecer constante, i.e.
O estudo da radiação emitida por estes elementos radioactivos demonstrou que
consiste em 3 componentes: alfa (α), beta (β) e gama(γ).
Radiação alfa – iões de hélio
Radiação beta – electrões
Radiação gama – de natureza electromagnética tal como os Rx mas de ↑ energia.
A velocidade de decaimento/unidade de massa é constante para qualquer elemento
e independente do seu estado químico ou físico, embora varie muito para os
diferentes radioelementos. Pode ser expressa em termos de “half-life” (T ½), que
significa o tempo que é necessário para que a radioactividade do radioelemento
decaia para ½ do seu valor original. Os T ½ podem variar desde fracções de
segundo a milhões de anos e com várias utilizações (Tabela 1).
Radioisótopo
T½
Utilização em Medicina Nuclear
Phosphorous 32 (32P)
14.3 d
Tratamento do excesso de glóbulos vermelhos
Technetium 99m (99mTc)
6.1 h
Imagens: cérebro, osso, fígado, baço, rim e fluxo sanguíneo
Flúor 18 (18F)
109.9 min
Diagnóstico de determinados tipos de tumores
Iodo 131 (131I)
8.04 d
Diagnóstico e tratamento de tumores da tiróide
Iodo 123 (123I)
13.22 h
Para monitorizar as funções tiroideia e renal
Strontium 89 (89Sr)
50.5 d
Tratamento da dor óssea
Samarium 153 (153Sm)
46.7 h
Redução da dor associada a metástases ósseas
In 111 Octreotide (111In)
67.2 h
Diagóstico de tumores gastro-entero-pancreatico-neuroendócrinos (GEP) e
tumores carcinóides
Yttrium 90 (90Y)
64.1 h
Radiação, sinovectomia
Isótopos
Em 1910 tinham sido identificadas cerca de 40 espécies químicas diferentes,
através da sua natureza química, propriedades das suas radiações e T ½
característicos. Demonstrou-se que os radioelementos podiam ser divididos em
séries distintas, 2 delas com origem no U e a 3ª com origem no Th.
B. Boltwood descobriu que todas as séries acabavam no mesmo elemento → o
Pb.
# neutrões # atómico
vs
→ = decaimento α
→ = decaimento β
decaimento do 238U para 206Pb (estável)
A maior dificuldade para os cientistas da época é que enquanto na Tabela Periódica
(TP) só havia espaço para 11 elementos entre o Pb e o U, conheciam-se cerca
de 20 radioelementos nas séries de decaimento do U para o Pb. Em muitos
casos não era possível separar os radioelementos por processos químicos ou
estudos espectrográficos.
Em 1913 K. Fajans e Soddy
explicaram estas aparentes
situações contraditórias: pelo
processo α produz-se 1
elemento 2 “casas” à esquerda
do elemento “progenitor” na TP
e pelo processo β produz-se 1
elemento 1 “casa” à direita do
elemento “progenitor”. Os
radioelementos que “caem” na
mesma “casa” da TP são
quimicamente idênticos. Soddy
propôs chamar-se-lhes isótopos
- espécies radioactivas com a
mesma identidade química.
PROCESSOS ATÓMICOS
As dimensões e escalas de energia dos processos atómicos e nucleares são
muito ≠, o que nos permite considerá-las em separado.
Ionização
Supondo que 1 átomo colide com outro átomo, se a colisão for não-elástica
(a Ec dos núcleos não é conservada), pode ocorrer:
(a) excitação de 1 ou 2 átomos a 1 estado que envolve alteração da
configuração e-,
(b) ionização dos átomos, i.e., remoção de 1 ou + e- para formar 1 ião+.
Para haver ionização 1 e- tem de receber pelo menos a E equivalente à sua energia
de ligação, E esta ↑ que a Ec dos átomos de gás à temp. ambiente. Assim, os
átomos têm de movimentar-se a ↑↑ velocidade (ex: decaimento nuclear ou
aceleração) para ejectarem e- de outros átomos fortemente ligados.
E – energia, Ec – energia cinética, Ep – energia potencial
PROCESSOS ATÓMICOS (cont.)
Emissão de Rx
O termo “raios x " refere-se à radiação electromagnética produzida quando 1 e- de
uma camada electrónica externa preenche um lugar numa camada electrónica
interna (Fig 2), (ex: da camada M para a camada L).
O e- perde Ep nesta transição (vai para 1
camada de ligação + forte) e irradia esta E sob
a forma de Rx [não confundir com raios γ, +
energéticos, que resultam de transições entre n e
p+ no núcleo de 1 átomo]. A energia dos Rx é
dada pela diferença entre as E de ligação
dos e- nas 2 camadas, que dependem do nº
atómico do elemento. Estas E podem ser
usadas para determinar o nº atómico dos
elementos constituintes de um dado material
e são prova conclusiva para a identificação
de 1 elemento químico.
Fig. 2 – Esquema representativo da emissão de Rx
devido a decaimento radioactivo: 1 e- da camada L (A)
preenche 1 lugar da camada K (B), emitindo 1 Rx K
característico.
electrão
órbita
núcleo
Modelo de Rutherford
neutrão
núcleo
protão
electrão
Modelo de Bohr
Núcleos, propriedades nucleares,
isótopos, separação de isótopos
Modelo quântico
raio do átomo ~ 1-5 x 10-10 m (1-5 Å)
núcleo → r ~ 1-10 x10-15 m, contém quase toda a massa do átomo
neutrão
A=N+Z
protão
electrão
A = número de massa → total nucleões
Z = número atómico (= número de protões, carga +, p+ ou H+)
N = número de neutrões (massa ≈ ao protão, ≈ 1 u) no núcleo
A identidade elementar e as propriedades químicas são determinadas pelo
número atómico (Z). A maior parte do átomo é espaço vazio no qual os
e- (massa ≈ 1/1840 da massa do protão) circulam à volta do núcleo. Os eestão ligados por forças electrostáticas (Coulomb) ao núcleo +. Num
átomo neutro o nº e- = ao nº de p+ no núcleo.
1 núcleo com 1 determinado nº de p+ e n é designado nuclido.
Energia de Ligação por Nucleão
A energia de ligação por nucleão é a medida da
estabilidade relativa de 1 núcleo. Quanto
maior é a força de ligação no núcleo, maior
será a energia de ligação (B) por nucleão. A
observação do gráfico da energia de ligação
média por nucleão em função do nº de massa
permite-nos saber que 1 maior estabilidade
está associada aos núcleos de massa a ½ da
escala (núcleo + estável: 62Ni). Os núcleos +
pesados podem ↑ a sua estabilidade por
fissão, enquanto os núcleos + leves o podem
fazer por fusão para construir núcleos da
região do Fe-Ni.
A relativa independência de A da Bméd /nucleão
para a maioria dos núcleos (7,4 – 8,8 MeV ) é 1
consequência directa da acção a curta
distância e carácter de saturação da força
nuclear.
Bméd /nucleão vs. nº massa A para núcleos estáveis
(de Valentin).
Podem observar-se picos definidos na Bméd
/nucleão para determinados valores de A, o
que sugere que existem determinadas
configurações nucleares especiais estáveis ≈
às estruturas dos átomos dos gases inertes.
1 ↓ generalizada da Bméd para ↑ A é devida à
crescente influência da força de Coulomb.
Sistemática da Energia de Separação
Energia de separação de neutrões Sn, MeV
Para 1 dado nº Z, Sn é > para nº N par do que para 1 nº N impar e também para 1
dado N, Sp é > para 1 nº Z par do que para 1 nº Z impar. Este efeito é causado
pela porção da força nuclear que pretende ter n emparelhados com n (spin
antiparalelo) e p+ emparelhados com p+ mas não pares de n-p+. Este
emparelhamento faz com que núcleos nº Z par - nº N par sejam + estáveis do
que nuclidos par-impar ou impar-par que, por seu lado, são + estáveis do que
núcleos impar-impar.
O trabalho necessário para
separar 1 n, p+ ou partícula α,
etc. de 1 núcleo designa-se
por energia de separação S (n,
p+, α,...).
nº N de neutrões
Energia de separação dos n para os isótopos do Pb.
Nuclidos com = nº p+ no núcleo mas com ≠ nº de n chamam-se isótopos (do Grego
iso + topos, significando “mesmo lugar” e referindo-se à posição na TP). Os isótopos
têm comportamento químico muito ≈ pois têm a mesma configuração e-:
12
6
C
14
6
C
(T½ = 5730 a)
radionuclido designa qualquer espécie nuclear radioactiva,
embora radioisótopo seja um termo comumente usado.
Nuclidos com = nº n no núcleo, N, mas com ≠ nº p+, Z, são isótonos. Isótonos têm
algumas propriedades nucleares ≈ , ex:
3
4
1
H
2
He
Nuclidos com = nº de massa, A, mas com ≠ nº n e p+ são isóbaros. Isóbaros são
importantes nos processos de decaimento radioactivo, ex:
40
19
K
40
18
Ar
Isómeros são nuclidos num estado nuclear excitado que tem uma determinada
vida (>10-9 s) (ex: 6027mCo→ 6027g Co).
O nuclido 60mCo existe num estado excitado (↑ E) e decai espontaneamente por emissão γ
(T½ = 10,5 min) para o estado base (ground state, < E) 60gCo.
m - metastable, g (ou sem símbolo) - ground state
J. J. Thomson provou a existência dos isótopos.
Se 1 feixe de iões +, na forma de gás, atravessarem 1 campo eléctrico ou
magnético, seguirão trajectórias hiperbólicas dependentes da sua massa e
carga. Quando atingem placas fotográficas o enegrecimento desta é
proporcional ao nº de iões que nela embateram. Usando o gás neon,
Thomson descobriu que este era formado por 2 tipos de átomos com massas
atómicas diferentes: os 20Ne e 22Ne. Thomson calculou que 90% dos átomos
teriam massa 20 e 10% massa 22.
1 elemento químico pode consistir em vários tipos de átomos com massas
diferentes mas com as mesmas propriedades químicas. Assim, os 40
radioelementos eram isótopos dos 11 elementos químicos diferentes entre o
Pb e o U. Para identificar um isótopo particular de 1 elemento o número de
massa escreve-se em superscript à esquerda do símbolo químico [ex: 238U,
234Pa (protactinium)].
Isótopos estáveis e isótopos radioactivos
Os isótopos são átomos cujos núcleos diferem unicamente no nº
de n. Distinguem-se, tal como para os átomos “clássicos”, os
isótopos estáveis e os isótopos radioactivos. Cada 1 destes
isótopos é identificado pelo nome do átomo e pelo nº de nucleões
que varia de acordo com os isótopos. Certos isótopos existem na
natureza, dizem-se isótopos naturais (ex: 14C), e outros só se
produzem em laboratório: são os isótopos artificiais (ex: 99mTc –
do grego techknos).
Modelo dos 3 isótopos
do H: 1H, 2H (D), 3H (T)
Tabela de Isótopos
International Atomic Energy Agency
(IAEA) e Brookhaven National
Laboratory (BNL) ~3000 núcleos
...
A unidade universal de massa, u (por vezes amu unidade de massa atómica), é
definida como 1/12 da massa do 12C, definida exactamente por 12 u (padrão).
A massa absoluta de 1 átomo de 12C obtém-se dividindo o valor 12 pelo nº
Avogadro
(NA = 6,022137 × 1023). A massa de 1 átomo de 12C, i.e. o núcleo + 6 e-, é
1,992 648 × 10-23 g.
Em ciência nuclear usam-se massas atómicas em vez de massas nucleares. O nº
de e- é sempre balanceado n1 reacção nuclear e as alterações na E ligação
dos e- nos vários átomos são desprezáveis no cálculo da massa → a diferença
das massas atómicas dos reagentes e produtos n1 reacção nuclear dá a
diferença nas massas dos núcleos envolvidos. Todas as reacções nucleares
são acompanhadas de alterações nas massas nucleares.
Determinação de massa e abundância isotópica
A massa e abundância relativa dos isotópos naturais de 1 elemento podem ser
determinadas com grande exactidão usando a mesma técnica que J. J. Thomson
usou para demonstrar a presença de isotópos no Ne - a espectrometria de
massa.
Sistemática da Abundância
A par
Nº neutrões N
A impar
Nº atómico Z
Posição dos núcleos estáveis com A impar e par no
gráfico de Segre (de Meyerhof).
Comparemos
as
posições
de
nuclidos estáveis com nº A impar
com outros de nº A par: à medida
que Z ↑ a linha de estabilidade movese de N=Z to N/Z ~ 1.5 devido à
influência da força de Coulomb. Para
núcleos com nº A impar só há 1
isóbaro estável, enquanto que para 1
nº A par não existem, regra geral,
núcleos estáveis impar-impar.
H2O rios
H2O mar
Carbonatos de ↑ temp.
Rochas magmáticas
Rochas sedimentares
O2 atmosférico
Carbonatos sedimentares
Material orgânico
CO2
Relação de abundância dos isótopos 18O/16O (segundo Vinogradov).
A maioria dos núcleos dos átomos é estável, i.e. não se alteram/transformam e
permanecem idênticos ao longo do tempo.
Pelo contrário, outros núcleos de átomos particulares são instáveis, i.e. são ditos
radioactivos. Estes átomos, num dado momento da sua “vida”, libertam-se
espontaneamente de partículas emitindo radiações e energia: diz-se que os
átomos se desintegram. Assim, cada átomo transforma-se num átomo diferente
que pode ser estável ou não. Se o novo átomo não é estável vai desintegrar-se
também até se obter um átomo estável. O conjunto dos “descendentes” do átomo
inicial formam uma família radioactiva.
núcleo pesado radioactivo
raios α
Núcleo
de 4He
Núcleo
de 226Ra
Núcleo de 226Rn
No decaimento radioactivo há conservação do nº de massa e do nº atómico.
Deste modo, os dois 1ºs passos da série do 238U são:
notação comum:
Rutherford descobriu que há
3 processos radioactivos
básicos que denominou
como α, β, e γ de acordo
com o poder de penetração.
Todos estes tipos de
radiações são consideradas
ionizantes, i.e. são
radiações capazes de fazer
perder ou ganhar 1 ou mais
e- aos átomos, tendo
consequências sobre o
ambiente e em particular
sobre o nosso organismo.
folha de papel
folha de alumínio
chumbo / betão
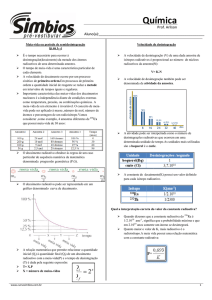
Cinética do decaimento Radioactivo
O nº de núcleos n1 amostra radioactiva que se desintegra durante 1 determinado
intervalo de tempo ↓ exponencialmente com o tempo. Como o núcleo está
isolado por 1 nuvem de e-, esta velocidade é essencialmente independente da
temperatura, da lei da acção da massa ou outro factor limitante que afecte
normalmente alterações químicas ou físicas.
Assim, a velocidade de decaimento serve como identificador de 1 dado nuclido. ! X
que o decaimento radioactivo representa 1 transformação de 1 radionuclido
instável n1 nuclido + estável, que também pode ser radioactivo, é 1 fenómeno
irreversível para cada nuclido.
Os
núcleos instáveis de 1 amostra radioactiva não decaem todos
simultaneamente. O decaimento é completamente ao acaso pelo que o seu
estudo utiliza métodos estatísticos. Com eles podemos observar 1 ↑ nº de
núcleos radioactivos e prever com relativa acuidade a fracção de núcleos que
se desintegra mas não quais ou quando.
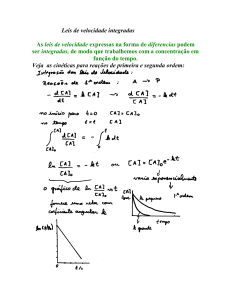
Equações Básicas de Decaimento
O decaimento radioactivo pode ser descrito como 1 reacção de 1ª ordem, i.e., o nº
de desintegrações é proporcional ao nº de núcleos presentes que decaíram:
Velocidade
de emissão
de partículas
=
Velocidade de
desintegração
de núcleos
radioactivos
∝
nº de núcleos
radioactivos
presentes
λ = probabilidade média/núcleo de ocorrer decaimento/unidade tempo
Velocidade de
desintegração
de núcleos
radioactivos
=
Constante de
decaimento
λ
∝
nº de núcleos
radioactivos
presentes
Se N = nº radionúcleos no tempo t que se reduz constantemente em função do tempo, então:
- dN = λ N
dt
- dN ∝ N
dt
dN = - λdt
N
N = Noe-λt
onde N é o nº de núcleos presentes n1 dado tempo t enquanto No é o nº de
núcleos presentes em t=0. A constante de decaimento λ, característica de
cada núcleo, está directamente relacionada com o “half-life” t½:
λ = ln 2 / t½
O tempo de meia-vida (“half-life”) é o tempo necessário para que o nº de
núcleos diminua por 1 factor de 2. O nº de decaimentos que ocorrem n1
amostra radioactiva n1 dado tempo designa-se por actividade A da amostra.
A actividade é igual ao nº de núcleos presentes, N, multiplicado pela
probabilidade de decaimento por núcleo, λ, i.e., A = λN. Assim, a actividade
decai exponencialmente com o tempo, i.e.
A = Aoe-λt
onde A é o nº de desintegrações por unidade de tempo no tempo t e Ao é a
actividade no tempo t=0.
O t½ dos núcleos (relacionado com o tipo de decaimento) é muitas vezes usado
para identificar os núcleos.
Curva de decaimento radioactivo
População inicial
T = período ou tempo
de meia-vida
1 T radioactividade ½
2T
“
¼
3T
“
1/8
4T
“
1/16
...
A taxa/velocidade de contagem (“counting rate”) n1 detector de radiação, C, é
igual à taxa/velocidade de desintegração dos núcleos radioactivos presentes
na amostra, A, multiplicada pela constante relacionada com a eficiência do
sistema de medida da radiação. Assim,
onde ε é a eficiência. Substituindo na equação
N = Noe-λt
então:
C = Coe-λt
tempo
Esta curva exponencial torna-se
plana e aproxima-se de 0. Se o
mesmo gráfico for feito em escala
semilog então a curva de
decaimento torna-se n1 linha
recta com 1 declive = ao valor de
-(λ/2.303).
Actividade observada (escala log)
Actividade observada (escala linear)
onde C é a taxa/velocidade de contagem n1 dado tempo t devido a 1 amostra
radioactiva que tem 1 taxa/velocidade de contagem C0 quando t = 0. As duas
equações anteriores são as equações básicas que comandam o nº de
núcleos presentes n1 amostra radiactiva e o nº de contagens observadas no
detector, em função do tempo.
tempo
De acordo com a definição de tempo de meia-vida, quando A/A0 = ½, então t = t½
Os T ou t½ para diferentes radionuclidos variam de menos de 10-6 seg a 1010 anos.
Quando temos 1 radionuclido desconhecido a determinação do seu T é dos 1ºs
passos para a sua identificação.
Esta determinação pode ser efectuada através de 1 gráfico semi log de 1 série de
observações durante 1 dado período de tempo.
Enquanto o cálculo do T de um radionuclido de vida curta é fácil de calcular, o
mesmo não se passa com 1 radionuclido de vida longa.
N = 6,023 x 1023 (nº de Avogadro) x massa do radionuclido
peso atómico do radionuclido
+ espectrometria de massa
O tempo de vida média (τ) de 1 população de átomos pode ser calculado e está
relacionado com a constante de decaimento:
τ = 1/λ
ou, expresso em termos de tempo de meia-vida:
τ 1.443 = t ½
Unidades de medida
A unidade natural de radioactividade é dada em desintegrações/tempo, por ex:
desintegrações/seg (dps) ou desintegrações/min (dpm), etc.. A unidade de
radioactividade do SI é o Becquerel (Bq):
1 Becquerel (Bq) ≡ 1 desintegração/seg
As contagens n1 sistema de detecção são dadas normalmente em counts per
second (cps), counts per minute (cpm), etc. e diferem da taxa/velocidade de
desintegração por 1 factor que representa a eficiência do detector, ε. Assim,
(dpm) ε = (cpm)
1 unidade + antiga de radioactividade ainda em uso é o curie (Ci), definido como
1 Curie (Ci) = 3,7x1010 Bq = 3,7x1010 desint/s
O Curie é 1 unidade de radioactividade que representa 1 quantidade razoável de
radioactividade e é aproximadamente igual à actividade de 1 g de radium.
Valores típicos de radiactividade de 1 reactor nuclear são da ordem de 109 Ci
enquanto os valores de radioactividade de traçadores em experiências são de
µCi e os níveis ambientais são de nCi or pCi.
Unidades de medida (cont)
Actividade da amostra:
Becquerel (Bq)
1Bq = 1 desintegração/s
É a unidade do SI de actividade; actividade que
corresponde ao nº de núcleos radioactivos que
se desintegram por seg. Esta actividade depende
da massa e da natureza da amostra radioactiva.
Dose absorvida: Gray (Gy)
1Gy = 1 J/kg de matéria irradiada
Equivalente de Dose absorvida:
Sievert (Sv)
1Sv = 1Gy * Factor
Débito de Dose
(Gy/s ou Sv/s)
Esta unidade de medida representa a
energia
da
radiação
ionizante
absorvida por unidade de massa de
matéria irradiada.
É o produto da dose absorvida por 1 factor que
depende do efeito nocivo da radiação (Alfa = 20
e Beta/Gama = 1). Assim, 1 dose Alfa é 20 x +
nociva que 1 dose Beta ou Gama
O débito de dose ou dose absorvida por segundo
representa a intensidade da radiação absorvida.
Permite avaliar o grau com que foram atingidos os
habitantes e o ambiente em caso de acidente.
O Sv/s só se utiliza quando se tem em conta a natureza
da radiação (Alfa, Beta ou Gama).
Características dos 3 processos radioactivos básicos α, β, e γ
Características do decaimento radioactivo
Tipo de
decaimento
Partícula
emitida
Exemplo
Ocorrência
Energia da
partícula
emitida
e- energético
estável
estável
e- energético,
núcleos leves
estável
núcleos pesados
fotão
electrão
qualquer
núcleo
excitado
Decaimento α
Velocidade de expulsão de partículas
15 000 km./s
O decaimento alfa observa-se em elementos + pesados que o Pb e para
alguns lantanídeos.
Núcleo
de hélio
Emissão α
No decaimento alfa (α) 1 núcleo pesado
emite espontaneamente um núcleo de
4He (uma partícula α). A partícula α
emitida é monoenergética e resulta do
decaimento. O átomo transforma-se
pois o seu núcleo perde 2 p+ e 2 n, ou
seja, 4 nucleões. É uma transmutação
de matéria, forma-se um novo
nuclido.
(núcleos com Z>83)
X indica qualquer elemento definido pela carga nuclear, Z e Z - 2 na eq.
Partículas α causam extensa ionização da matéria. Se as partículas
passarem através de 1 gás, os e- libertados pela ionização podem ser
recolhidos n1 eléctrodo + para produzir 1 pulso ou corrente.
As câmaras de Ionização e os contadores de proporcionalidade são
instrumentos deste tipo, que permitem a contagem individual de cada
partícula α emitida por 1 amostra.
A interacção das partículas α com a matéria pode também causar
excitação molecular que pode traduzir-se por fluorescência ou
cintilação, o que permitiu a 1ª observação de partículas nucleares
individualizadas.
A ionização em semicondutores devido a partículas α é hoje em dia 1 o
meio + comum de detecção.
Decaimento β
O decaimento nuclear beta (β) pode ocorrer por três modos:
β-, β+ e captura electrónica (EC).
Neste decaimento 1 neutrão (protão) altera-se para 1 protão (neutrão)
com a ejecção de neutrinos (pequenas partículas neutras) e electrões
(ou positrões).
Na
captura electrónica 1 e- orbital é capturado pelo núcleo,
transformando 1 protão n1 neutrão com a emissão de 1 neutrino.
O nº total de nucleões, A, no núcleo não altera neste decaimento, só o nº
relativo de neutrões e protões. De uma certa forma este processo
pode “corrigir” ou “ajustar” 1 desequilíbrio entre o nº de neutrões e
protões n1 núcleo.
Muitos milhares de núcleos podem ser produzidos em laboratório, no entanto
apenas < 300 destes são estáveis, os restantes são radioactivos.
O decaimento β designa o 2º tipo de radiações + ionizantes provenientes de
amostras de U. Os raios β que ocorrem naturalmente foram facilmente
identificados como e- rápidos mas só bastante tempo + tarde se percebeu
este processo de emissão. A dificuldade esteve relacionada com o facto
de que são “criadas” 2 partículas durante o decaimento β, enquanto que
no processo α há cissão de 1 núcleo pesado.
Este decaimento β tem de ocorrer entre níveis quânticos discretos do
nuclido “progenitor” (ex: 137Cs) e do nuclido “filho” (ex: 137mBa):
e- energéticos causam ionização e excitação molecular na matéria, embora o
efeito seja + fraco e + difícil de detectar do que para as partículas α. Assim, o
efeito tem de ser ampliado para contar individualmente as partículas β,
usando-se para tal a ionização em contadores proporcionais e Geiger.
Contagens por cintilação também podem ser usadas em vários sistemas
detectores.
O protão e o neutrão são 2 isóbaros possíveis para A=1.
O neutrão tem 1 massa > e a sua combinação é + instável do que protão com e-.
1 neutrão livre sofrerá decaimento β com 1 t½ de ≈ 12 min.
incompleta
Outra característica do decaimento β que levantou dúvidas foi, dado a eq. anterior
ser incompleta, saber se a radiação β tinha 1 distribuição de energia contínua,
i.e., os electrões são emitidos por 1 fonte com 1 distribuição de energias que
vai de 1 máx ao valor Q até zero?
Outra partícula invisível tem de ser criada e emitida! A lei da conservação referese à conservação do nº de partículas n1 reacção e a partícula invisível é 1
forma de neutrino, do italiano “neutro”.
Enrico Fermi postulou que a emissão de uma 3ª partícula era necessária para
equilibrar a emissão do e- no processo β.
Reescrevendo:
_
a notação ν (caracter grego nu) indica que o neutrino é 1 antipartícula. Os spins de
todos os produtos finais podem ser combinados de 2 formas e acoplados ao
spin inicial do neutrão.
O neutrino
Este problema de alteração de spin “errado" e o espectro contínuo "não-quântico"
levou W. Pauli a assumir que o processo β envolve emissão de outra partícula
que foi então denominada neutrino com o símbolo ν. O neutrino tem 1 valor de
spin de ½ e 1 carga eléctrica 0 e massa ≈ 0. É algo semelhante ao fotão que
não tem massa, carga ou spin. No entanto, enquanto o fotão interage
rapidamente com a matéria, o neutrino não. De facto esta interacção é tão
pouco provável que o neutrino tem ↑ 1 probabilidade de passar através do
planeta sem reagir!
A energia libertada no decaimento β é distribuída entre o neutrino, o e- e o núcleo
“filho” de retrocesso (“recoil”). Este último é muito < que os dois 1ºs e pode ser
desprezado numa 1ª aproximação. Assim, a energia total do decaimento β
pode considerar-se distribuída entre o neutrino e o e-.
Para o decaimento do 137Cs a 137mBa a energia total de decaimento Qβ é 0,514
MeV = Emax. O espectro de energia do neutrino é o complemento do espectro
de energia da partícula β: se a energia do e- = 0,400 MeV, a do neutrino é
0,114 MeV. Se a energia do e- é 0,114 MeV, a do neutrino é 0,400 MeV.
No decaimento β- o valor médio da energia da partícula β- é ≈ 0,3 Emax. Na emissão
de e+, a energia média da partícula β+ é ≈ 0,4 Emax.
Ex: decaimentos β permitidos
Efectuaram-se vários estudos sobre a interacção dos neutrinos com os núcleos
para determinar a massa do neutrino e para mostrar que `neutrinos' e
`antineutrinos' são produzidos, respectivamente, nos decaimentos β+ e β-.
Neutrinos também fornecem informações importantes sobre as reacções
estelares uma vez que têm baixa probabilidade de interagir com a matéria e
saem directamente do interior estelar.
Estas reacções, denominadas decaimento β inverso, foram obtidas adicionando
a antipartícula do e- a ambos os termos da equação normal do processo β .
A combinação de estudos de decaimento β inverso (usando reactores
nucleares como fonte de antineutrinos) mostraram que os neutrinos emitidos nos
processos β- e β+ são diferentes.
Na 1ª experiência, efectuada por Reines e Cowen, 1 ↑ volume de líquido de
cintilação foi irradiado, p+ da solução orgânica foram transformados em n + e+.
O e+ foi rapidamente aniquilado dando o 1º sinal de interacção.
O neutrão foi capturado em poucos µseg por núcleos de Cd que foram
adicionados ao cintilador e deram o 2º sinal correlacionado. O fluxo de
neutrinos do reactor foi suficiente para produzir algumas reacções/h n1 volume
de 1 m3 de cintilador.
No 2º estudo, Ray Davis et col. irradiaram 1 ↑ volume de líquido CCl4 com
antineutrinos de 1 reactor. A reacção
seria detectada por purga periódica do líquido, recolha do gás nobre e detecção
da actividade induzida (37Ar é obviamente instável), como não se observou
conclui-se que o reactor não produzia antineutrinos.
é 1 exemplo de alteração da estabilidade relativa a seguir a decaimento β.
Este nuclido “progenitor” (par/par) é um produto importante de fissão (t½ = 29
anos).
O 90Sr decai para 90Y (impar/impar – t½ = 64 h) que, por sua vez, decai para o
isóbaro estável 90Zr. Assim, uma preparação pura de 90Sr atingirá o equilíbrio
com o seu “filho” em cerca de 1 semana e a actividade resultante será a soma
dos 2 decaimentos.
O
90Sr
Pode usar-se 1 separação química para retirar a actividade do nuclido “filho”. Este
decai na amostra separada e continuará a aumentar na solução “progenitora”.
Há vários exemplos destes pares progenitor/filho que permitem obter fontes
apropriadas com actividades de curta duração.
ex: 99Mo (t½ = 66 h) decai predominantemente para 1 estado excitado do 99Tc
(t½ = 6 h) pois o decaimento para o estado basal iria requerer 1 grande
alteração de spin. O filho, 99mTc, é muito usado em medicina nuclear.
Decaimento β−
electrão
Emissão β−
Velocidade de expulsão de partículas
270 000 km/s
A energia de decaimento é partilhada entre os e- emitidos, os neutrinos
e o núcleo “filho”. O espectro de energia dos e- emitidos e dos
neutrinos varia de forma contínua do 0 à energia de decaimento.
Há uma perda de e-. Além disso, ocorre a transformação de 1 neutrão num
protão (= 1 antineutrino). A massa do átomo permanece a mesma mas o
nº atómico Z do átomo aumentou de 1 unidade.
Núcleos ricos em neutrões decaem por decaimento β-.
Decaimento β+
Electrão positivo
ou positrão
Velocidade de expulsão de partículas
270 000 km/s
Emissão β+
O decaimento β+ é favorecido nos núcleos leves e requer que a energia
de decaimento seja < 1,02 MeV.
A energia de decaimento é partilhada entre os e- emitidos, os neutrinos
e o núcleo “filho”. O espectro de energia dos e- emitidos e dos
neutrinos varia de forma contínua do 0 à energia de decaimento.
Núcleos ricos em protões decaem por processo β+ ou EC.
Captura electrónica - EC
No decaimento EC essencialmente toda a energia de decaimento é
libertada com o neutrino emitido.
Na captura electrónica 1 e- orbital é capturado pelo núcleo,
transformando 1 protão num neutrão com a emissão de 1 neutrino.
O e- capturado passa a fazer parte das orbitais + internas do átomo.
Dependendo da camada electrónica donde provém, designa-se o
processo por captura-K, captura-L, etc..
A probabilidade de 1 e- da camada-K ser capturado é várias vezes superior à
da camada-L, uma vez que a função de onda dos e- K no núcleo é >> que
a dos e- L.
Do mesmo modo, a probabilidade de captura de e- em camadas superiores ↓
com o nº quântico da camada electrónica.
O decaimento EC é característico principalmente de núcleos pesados.
Decaimento γ e IC
electrão
Emissão γ
fotão
Velocidade de expulsão de partículas
radiação electromagnética ≈ velocidade
da luz (300 000 km/s)
O decaimento electromagnético nuclear
ocorre sob duas formas:
decaimento γ e conversão interna (IC).
No decaimento γ 1 núcleo n1 estado excitado decai emitindo 1 fotão.
Na conversão interna este núcleo excitado transfere a sua energia, sem emitir
radiação, para 1 e- orbital que é ejectado pelo átomo. Esta transferência de
energia de excitação nuclear para o e- ocorre sem emissão de fotão.
Em ambos os tipos do decaimento, apenas diminui a energia de excitação do
núcleo sem alteração do nº de qualquer nucleão.
Este decaimento é diferente dos outros 2 processos: trata-se de uma radiação
electromagnética. Acompanha-se das emissões α e β: caracteriza-se por 1
fluxo de fotões durante o tempo que o núcleo demora até voltar a ser
estável.
Os decaimentos α e β podem deixar o núcleo filho n1 estado excitado, sendo
esta energia de excitação removida tanto por emissão γ como por
conversão interna.
Os raios γ produzem uma ionização de ↓↓ densidade nos gases, por isso,
normalmente, não são contados através de contadores de ionização,
proporcionais ou Geiger. No entanto, a fluorescência produzida em
cristais como por ex: o iodeto de sódio torna a contagem de cintilação dos
raios γ eficaz. O espectro gama pode ser medido com ↑↑ precisão usando
semicondutores como detectores.
Na grande maioria dos casos a emissão dos raios γ ocorre imediatamente após
decaimento α ou β, i.e. ≤ 10-12 s mas por vezes os núcleos permanecem n1
↑ estado energético durante 1 determinado período de tempo. Os núcleos
excitados de grande sobrevida são designados isómeros.
ex: 60mCo, t½ = 10,5 min para 60Co.
este decaimento refere-se como transição isomérica.
Raios γ podem interagir com e- orbitais de outros átomos de modo a que estes
últimos são expelidos com 1 certa energia cinética.
Um processo diferente - conversão interna – pode ocorrer no átomo que sofre
decaimento radioactivo. Uma vez que a função de onda de 1 e- orbital pode
sobrepôr-se à do núcleo excitado, a energia de excitação do núcleo pode ser
transferida directamente para o e- orbital (sem envolvimento de raios γ) que
sai do átomo com 1 determinada energia cinética Ee. Não então emissão γ
neste processo, que é uma alternativa de desexcitação dos núcleos.
A conversão interna pode representar-se simbolicamente por:
O decaimento radioactivo por emissão de protão é pouco frequente para
nuclidos deficientes em neutrões porque o decaimento
β+ ou EC
normalmente tem t½ muito curto.
Observou-se para o 53mCo (Ep = 1,55 MeV, t ½ = 0,25 s, ≈~1,5%).
No entanto, o decaimento β+ por vezes conduz o átomo a 1 estado excitado que
imediatamente (< 10-12 s) emite 1 p+. Vários emissores β+ do 9C ao 41Ti com
N = Z – 3 têm emissão de p+ com t ½ entre 10 -3 – 0,5 s.
Também foi observado decaimento radioactivo simultâneo de 2 p+ para alguns
nuclidos ricos em p+, ex: 16Ne, t ½ ~10-20 s.
Para os nuclidos ↑ ricos em n, alguns produtos de fissão, observa-se emissão
alongada de n. É importante conhecer este processo para trabalhar em
segurança nos reactores nucleares.
Decaimento por emissão de partículas + pesadas que raios α, ex:
energeticamente possível.
12C
e
16O,
é
Reacções de fissão e de fusão nuclear
A fissão nuclear
A fissão foi descoberta pelos Químicos Otto Hahn e Fritz Strassman em 1938.
90Sr
raios γ
(energia)
neutrões
libertados
neutrão
235U
colisão
nuclear
143Xe
A fissão nuclear
A fissão nuclear é 1 reacção durante a qual 1 núcleo radioactivo pesado é
cindido em 2 núcleos + leves de massas próximas: os produtos da fissão
são frequentemente eles mesmos radioactivos. Esta reacção é obtida por
bombardeamento do núcleo pesado cindível com neutrões. Os principais
núcleos pesados usados neste tipo de reacções são: 235U (isótopo natural),
233U, 239Pu e 241Pu (isótopos artificiais).
O interesse de 1 reacção reside na libertação de energia sob a forma de calor.
Além disso, trata-se de 1 reacção em cadeia: i.e. A fissão do núcleo é
sempre acompanhada da libertação de 2 ou 3 neutrões que, por seu turno,
vão provocar a fissão de outros núcleos.
Esta reacção é usada em centrais nucleares para produzir energia (de forma
controlada e parada quando se pretende) e também nas bombas nucleares
do tipo A (a reacção não é controlada e dá origem a uma explosão).
energia de ligação/nucleão
fissão
fusão
nº massa
A massa total dos produtos de fissão
e das partículas emitidas é ↓ à massa
do núcleo inicial 235U: houve
libertação de energia!
Produtos da fissão
Núcleo
cindível de U
Fissão espontânea
Em 1940 Petrzhak e Flerov descobriram que 238U decai espontaneamente
dando 2 fragmentos grandes (com 1 probabilidade 5 x 10-7 de sofrer
decaimento α).
+ de 100 exemplos deste modo de decaimento foram encontrados depois. A
fissão espontânea é rara nos actinídeos leves e ↑ com o nº atómico até 1
limite de estabilidade para núcleos com Z ≥ 98. Os t ½ variam por 1 factor de
1029 do núcleo com maior t ½ (U) até ao fermium (com < t ½).
Desde a descoberta do 1º isómero de fissão espontânea o nº de outros
exemplos foi aumentando.
Estes isómeros vão desde o thorium ao berkelium formando 1 ilha com 1 ponto
máximo de estabilidade perto do 242Am. O decaimento γ para o estado basal
limita o nº de casos com Z e N ↑. Os t½ variam de 10 -9 a 10-3 s enquanto os
t½ do estado basal são de ~10 25 a 1030 x + longos. A energia de excitação
típica destes isómeros é 2 – 3 MeV.
Cerac de 79% das centrais
nucleares actuais têm reactores de
H2O leve = light water reactor
(LWR), i.e. reactores de H2O
pressurizada = pressurized water
reactors (PWR) o de “H2O que
ferve” boiling water reactors (BWR).
Principais componentes de 1 pressurized light water refrigerado e reactor
(PWR) - Ringhals (Sweden) com 3 PWRs e 1 BWR.
A fusão nuclear
A fusão nuclear é 1 reacção durante a qual 2 núcleos leves (geralmente 2H e 3H)
se juntam para formar 1 só núcleo pesado (no ex: anterior o 4He) e liberta
grandes quantidades de energia sob a forma de calor.
raios γ
(energia)
neutrão
3H
1
4He
2
2H
1
fusão
nuclear
A fusão nuclear (cont.)
Esta reacção produz-se continuamente no sol onde a temperatura atinge
vários milhões de ºC. São estas reacções que lhe permitem brilhar e dar
luz e calor sob a forma de raios.
O interesse da reacção de fusão reside na enorme quantidade de energia
libertada e da pequena quantidade de detritos radiactivos que produz.
No entanto, para que ocorra é preciso atingir vários milhões de ºC e
actualmente só é possível realizá-la em laboratório e durante 4 min no
máximo.
O projecto Iter, a decorrer em Cadarach, terá por missão produzir reacções
de fusão durante + tempo, de preferência permanentemente.
Uma outra utilização deste tipo de reacção é a bomba nuclear de H.
Reacção de fusão nuclear
O reactor nuclear do projecto Iter
Efeitos dos Isótopos na cinética química
Os organismos superiores não conseguem sobreviver quando todos os átomos
de H são substituídos por D. O D não faz o deslocamento do equilíbrio
químico mas sim um deslocamento na velocidade de reacção, conduzindo a 1
↓ fatal da velocidade metabólica → isótopos + leves são substituídos por
isótopos + pesados.
Em contraste com o equilíbrio químico, a velocidade da reacção depende da
concentração dos reagentes e dos estados de transição mas não dos
produtos. A concentração dos estados de transição depende da sua energia
de activação e da frequência da sua decomposição em produtos. Regra geral
a diferença na energia de activação (EA) é > que a diferença no calor da
reacção ∆H para as moléculas do isótopo. Assim, em geral, os efeitos do
isótopo são > na cinética do que no equilíbrio.
Para isótopos de elementos + leves a energia de activação tem 1 > contributo no
efeito isotópico da velocidade de reacção, enquanto para elementos +
pesados a frequência vibracional, que causa decomposição em produtos,
desempenha 1 papel + importante.
Aplicação: ↓ da velocidade metabólica para compostos de 13C, que sugerem
a sua utilização em tratamento de determinadas doenças – ex: porfíria.
Processos de separação de Isótopos
Muitas áreas das ciências fundamentais usam isótopos puros ou enriquecidos.
A utilização industrial da energia nuclear também requer enriquecimento de
isótopos particulares (particularmente o fuel de U). Os métodos de
fraccionamento isotópico podem ser divididos em 2 grupos:
(a) processos de equilibrium – consomem pouca energia mas a dimensão do
efeito do isótopo no equilíbrio químico normal limita o seu uso no
fraccionamento de isótopos a elementos muito leves (Z <10);
(b) processos de velocidade - incluem processos que dependem em
fenómenos do tipo: mobilidade iónica, difusão, electrólise, separação
electromagnética, centrifugação e processos cinéticos de natureza
química. Os efeitos isotópicos nestes processos são > que para processos
de equilíbrio mas requerem 1 > quantidade de energia tendo restrições
económicas...
enriquecimento
extracção
Esquema de fraccionamento isotópico (ou
enriquecimento) baseado n1 valor α ≈1.
Cada passo consiste n1 nº de “células”
acopladas em paralelo. Na fig. 1 só está
representada 1 “célula” para cada passo
de modo a obter o > fluxo de produto.
Normalmente o nº de “células” é ↑ no
ponto de entrada e depois ↓ em direcção
ao produto e ao fluxo de desperdícios.
Cada “célula” tem 1 disposição física que
leva ao fraccionamento isotópico. Assim,
cada fracção atómica de 1 isótopo
particular é diferente em 2 fluxos de
saída da “célula”; no fluxo de produto o
isótopo é enriquecido (fracção atómica
x'), enquanto no fluxo de desperdício há
depleção (fracção atómica x"). O factor
de
separação α define-se como:
quociente entre os 2 ratios isotópicos
dos fluxos de produto e de desperdício
para 1 só passo”.
α tem, em muitos casos, 1 valor próximo
de 1, α – 1 = factor de enriquecimento.
Disposição do fluxo para 1 cascata ideal com refluxo para
separação de isótopos.
1 x que os factores de separação são geralmente pequenos é necessário usar
1 processo multifásico para obter 1 produto com ↑ enriquecimento.
O nº de passos determina o º de enriquecimento do produto, enquanto o nº e
dimensões das “células” em cada fase determinam a quantidade de
produto.
O nº de passos para separar a substância que entra em produto e desperdício
(composição específica) é 1 mínimo de refluxo total.
O tipo de cascata + económico ↔ + frequente com factor de separação α ≈ 1
designa-se cascata ideal, na qual não há mistura de fluxos de
concentrações diferentes.
As instalações para separação de isótopos podem ser muito grandes para
pequenos outputs. A separação isotópica à escala técnica usa “células” com
α ≈ 1, requerendo 1 grande nº de passos para obter 1 ↑ enriquecimento e ↑
quantidades de materiais para se obter 1 quantidade substancial de
produto.
Pequenas alterações de α têm grande impacto económico na separação de
isótopos.
Troca química
ex: processo de troca industrial de isótopos = produção de H2O pesada através da
reacção química:
H2O(l) + HDS(g) = HDO(l) + H2S(g)
k=2,32 (32ºC)
k=1,80 (138ºC)
Dos valores das constantes de equilíbrio k vemos que o enriquecimento de água
em D ↑ com a ↓ temp. Esta propriedade é usada no processo de troca de
H2O-H2S conhecido como processo G-S (Girdler-Sulphide), aplicada em muitos
países para produzir água pesada.
Pela torre sup. de destilação flui em sentido
descendente H2O natural, que entra em contacto
com gás H2S que sobe. Ocorre 1 troca entre H2O
e H2S e a H2O fica enriquecida em D. Na torre inf.,
a ↑ temp,
As condições de eq. São tais que D é enriquecido
em H2S e move-se com o gás para a torre sup.
Não é necessário nenhum catalisador para atingir
rapidamente o eq. O produto é H2O enriquecida
em D (torre sup.) e H2O pobre em D (torre inf.). O
H2S circula através das 2 torres sem perda net.
Canada, Índia e EUA – 1200 ton/ano.
Torres maiores = 60 m altura e Ø 6 m. Em 5
unidades [D2O] ↑ 0,014% - 15%. [D2O]f = 99.97% é
feita geralmente por destilação da H2O.
Electrólise
A electrólise da H2O produz H(g) no cátodo que contém [D] + ↓ que a H2O
original. O efeito de isótopo é devido ao facto de o H+ e o D+ da H2O terem
velocidades de dissociação e velocidades de neutralização diferentes, i. e.
tem 1 base cinética.
Dependendo das condições físicas obtêm-se valores de α entre 3 e 10.
Para α = 6 é necessário electrolisar 2 700 l H2O natural ([D] = 0.014%) para
produzir 1 l H2O com 10% D, principalmente na forma de HDO. Num
processo multifásico o H(g) pode ser queimado para recuperar energia ou ser
usado 1 processo químico (ex: síntese de amónia).
Este método foi usado na Noruega para produzir ton de D2O mas hoje em dia
não é considerado economicamente rentável a não ser para a purificação
final da D2O.
Difusão gasosa
N1 amostra gasosa as moléculas + leves têm 1 ↑ velocidade média que as
moléculas + pesadas.
Em 1913 F. W. Aston (UK) mostrou que o 20Ne difundia através das paredes de
vasos porosos + rapidamente que o 22Ne.
O
235U
é enriquecido através de difusão gasosa usando o composto + volátil UFδ.
Além da volatilidade UFδ tem a vantagem de que o F só tem 1 isótopo natural
19F.
Empreendimentos de difusão gasosa existem na Argentina, China, França,
Rússia e EUA, e a sua capacidade combinada era de ± 40 MSWU/ano no final
do ano 2000.
SWU = unidade de trabalho de separação
Separação isotópica electromagnética
Durante o Projecto Manhattan Project dos EUA, a separação electromagnética foi
usada para produzir 235U puro.
Os
separadores electromagnéticos gigantes foram designados calutrons
(California University Cyclotrons) e foram usados após a 2ª Guerra Mundial no
Oak Ridge National Laboratory para produzir “gramas” de isótopos estáveis da
maioria dos elementos com 1 pureza de 99,9% ou mais. Separadores
electromagnéticos de grande capacidade foram também criados e
desenvolvidos na ex- URSS e alguns outros países.
“gramas” de isótopos estáveis (electromagneticamente separados) da maioria dos
elementos estão comercialmente disponíveis com grande pureza isotópica.
Separadores electromagnéticos são também usados para separação on-line de
produtos de reacções nucleares.
Centrifugação gasosa
Embora a difusão gasosa seja o processo por excelência para o enriquecimento
de 235U, o seu ↓ factor de separação, ↑↑ consumo de energia e ser 1 processo
sigiloso levou à pesquisa de meios alternativos + vantajosos.
Os métodos por centrifugação têm sido bastante estudados pois atinge-se 1 ↑
factor de separação.
N1 centrífuga de gás, moléculas leves são enriquecidas no centro e moléculas
pesadas na periferia.
entrada
vácuo
Válvula
bloq
Fracção leve
Fracção pesada
Rolamento magnético
Tampa topo
bomba molecular
Centrífuga de gás para
enriquecimento de 235UFδ ½
direita = centrífuga em cascata
em funcionamento em Almelo.
Câmara rotativa
váuco
Câmara de vácuo
Abafador rotativo
Tampa base
Armadura
Motor
Rolamento de agulha
Há muitas fábricas em funcionamento, a maior é em Ekaterinburg (Rússia, 9
MSWU/ano; este tipo de fábricas na Rússia têm 1 capacidade total de 19 MSWU/ano),
Almelo (Holanda, 1,7 MSWU/ano), Capenhurst (UK, 1,1 MSWU/y) e Gronau
(Alemanha, 1,1 MSWU/ano).
Outros métodos de separação de isótopos
Em teoria todos os métodos fisico-químicos permitem de separar isótopos. Outros
métodos estudados incluem a destilação, extracção de solvente, troca iónica,
fotoionização e fotoexcitação.
Toneladas de D2O são purificadas anualmente na Índia por destilação criogénica
do H. Dezenas de Kg de 13C e 15N puros foram produzidos no Los Alamos
Scientific Laboratory através da destilação de NO e CO a -170ºC, ocorrendo
simultaneamente o fraccionamento entre 16O e 18O.
Foi desenvolvido no Japão 1 processo de enriquecimento de U através de troca
iónica contínua, sem revelar grandes pormenores... No entanto, sabe-se que o
“refluxo” é obtido por oxidação e redução de U4+ e UO2+. Uma fábrica de
demonstração com a capacidade de 2 kSWU/y funciona em Hyuga.
Vários processos de fotoionização e fotoexcitação estão a ser estudados para
efectuar a separação isotópica, principalmente do U.
N1 desses processos o UFδ é irradiado por 1 feixe laser que produz 1 excitação
vibracional selectiva na molécula 235UFδ. Com irradiação UV a molécula
excitada dissocia-se. É importante que o pulso UV seja logo a seguir ao pulso
laser, de modo a que a molécula excitada vibracionalmente 235UFδ não perca a
energia de excitação através de colisões com as moléculas vizinhas.
Neste processo são necessárias reacções de fase gasosa e o ião 235UFδ-n
formado através da dissociação (n < 6) é recolhido por campos
electromagnéticos.
Esta técnica não se aplica apenas a UFδ, vapor de U (metal puro) e compostos de
Pu foram separados dos seus constituintes isotópicos através de 2 ou 3
ionizações fotónicas com raios laser (ex: processo US AVLIS e processo
francês SILVA).
Outra alternativa é excitar selectivamente moléculas de 235UFδ por raios laser na
presença de 1 gás reactivo (processo CRISLA). As moléculas excitadas
reagem preferencialmente com as moléculas de gás formadas com menor
pressão de vapor que o UFδ.
Padrões de estabilidade nuclear
Existem aproximadamente 275 núcleos diferentes que não mostraram
evidência de decaimento radioactivo e que se podem considerar estáveis.
Quando estes núcleos são comparados com os seus nucleões constituintes
verifica-se que ≈ 60% têm nº par de p+ e de n (núcleos par/par). Os
restantes 40% estão igualmente divididos entre os que têm nº par de p+ e
nº par de n e os que têm nº impar de p+ e nº par de n (núcleos impar/par).
Só existem 5 núcleos estáveis conhecidos com nº impar de p+ e n (núcleos
impar/impar): 2H, 6Li, 10B, 14N e 50V.
Considerando este padrão de estabilidade pode concluir-se que a
estabilidade nuclear é favorecida por nºs pares de p+ e n.
Quadro de nuclidos estáveis em função do seu nº de p+ (Z) e n (N).
Elementos com nº atómico par (i.e. nº par de p+) são caracterizados por ter 1 nº
pequeno de isótopos estáveis, geralmente 3 ou +. Por ex: o estanho (nº
atómico = 50) tem 10 isótopos estáveis, enquanto o Cd (Z = 48) e o tellurium
(Z = 52) têm 8 cada. Por contraste, a Ag (Z = 47) e o antimónio (Z = 51) têm
só 2 cada, e o rhodium (Z = 45), indium (Z = 49) e iodo (Z = 53) têm só 1
isótopo estável.
As linhas de N e Z = 2, 8, 20, etc., não foram escolhidas arbitrariamente. Estes
nºs de p+ e n representam configurações muito estáveis.
Elementos com Z impar têm 0, 1 ou 2 isótopos e os seus isótopos estáveis têm nº par de n,
excepto os 5 já mencionados.
Isótopos estáveis com Z par (e N par ou impar) têm + isótopos, por ex: o estanho (Z = 50)
tem 7 isótopos par-par estáveis e 3 par-impar. O > nº de núcleos estáveis com nº par
de p+ e n é explicado em termos de ganho de energia de estabilização pela
combinação de nucleões para formar pares, i.e. p+ com p+ e n com n mas não p+ com
n.
Se o núcleo tiver nº impar de p+ pelo menos 1 destes p+ tem de existir n1 estado nãoemparelhado.
A ↑ estabilidade resulta de 1 completo emparelhamento em elementos com Z par porque
consegue “arrumar” 1 > nº n, ex: germanium (32Ge, 5 isótopos estáveis) comparando
com o gallium (31Ga, 2 isótopos estáveis) e o arsénico (33As, 1 isótopo estável).
Nos elementos com nº atómico par, se o nº de n é impar existe alguma estabilidade
conferida por emparelhamento p+/p+.
Nos elementos com nº atómico impar, a não ser que haja estabilidade devido 1 nº par
de n (emparelhamento n/n), os núcleos são radioactivos com raras excepções.
Nos elementos leves a estabilidade é conseguida quando o nº de n e p+ é ≈ (N =
Z).
Com o ↑ nº atómico do elemento (ao longo da linha Z) a razão n/p+ i.e. N/Z, para
a estabilidade nuclear ↑ de 1 a 1,5 no Bi. Assim, o emparelhamento de
nucleões não é 1 critério suficiente para a estabilidade, tem de existir 1
determinada N/Z. Tal não é suficiente porque para Z ↑ aparece o decaimento
α. Acima do Bi os nuclidos são todos instáveis para a emissão α e alguns são
também instáveis para o decaimento β.
Se 1 núcleo tem N/Z muito ↑ para a estabilidade diz-se rico em neutrões. Sofre
decaimento radioactivo de modo a que esta relação ↓ para se se aproximar do
valor estável. Em tais casos o núcleo tem de ↓ o valor de N e ↑ o valor de Z, o
que pode ser feito por conversão de n a p+. Quando esta conversão ocorre n1
núcleo há emissão β-, com a criação e emissão de 1 e- (e 1 antineutrino).
Para N/Z para além da denominada linha de queda de n, ou para núcleos
muitoexcitados, a emissão de n é 1 alternativa ao decaimento β.
Se N/Z for muito ↓ para a estabilidade, ocorre decaimento radioactivo de modo a
que ↓ Z e ↑ N por conversão de p+ em n. Isto pode ser conseguido através de
emissão de e+, i.e. criação e emissão de e+ (β+) ou por absorção pelo núcleo
de 1 e- orbital (captura electrónica, EC).
Ex:
Emissão de e+ e EC são processos competidores com grande probabilidade
para este último, ↑ o nº atómico.
1 alternativa ao decaimento por e+ (ou EC) é a emissão de p+, o que é raro mas foi
observado em cerca de 40 núcleos muito afastados da linha de estabilidade.
Estes núcleos têm t½ ≤ 1 min.
Por exemplo: 115Xe, t ½ (p) 18 s; p+/EC 3 × 10-3.
N/Z tem de ↑ com o nº atómico para ↑ estabilidade nuclear pois os p+ no núcleo
sofrem 1 força de Coulomb repulsiva. A existência de núcleos estáveis significa
que tem de haver 1 força atractiva que tende a manter juntos n e p+. Esta foraç
nuclear atractiva tem de ser suficiente para ultrapassar a força disruptiva de
Coulomb. Por outro lado, nos núcleos instáveis há 1 equilíbrio entre a força
nuclear atractiva e a força disruptiva de Coulomb. Á medida que o nº de p+ ↑, a
força repulsiva de Coulomb também tem de ↑.
No modelo aceite assume-se que n e p+ existem em orbitais de nucleões
separadas tal como as dos e-. Se o nº de n é muito > que o nº de p+, as orbitais
de neutrões ocupadas estendem-se para energias ↑ em relação às orbitais
ocupadas pelos p+. Quando N/Z ↑ pode haver 1 grande diferença considerável
de energia entre o n da última orbital preenchida e a última orbital de p+. A
estabilidade do núcleo pode aumentar quando 1 n impar na última orbital é
transformado n1 p+ que preenche n1 orbital de p+ livre n1 nível de energia + ↓.
Quando 2 elementos formam 1 composto n1 sistema químico, a quantidade de
calor libertado é a medida da estabilidade desse composto.
Quanto > for este calor de formação (entalpia, ∆H) > a estabilidade do composto.
Quando C se combina com O para formar CO2,
experimentalmente 1 calor de reacção de 393 kJ / mole de CO2.
determinou-se
Através da fórmula de Einstein podemos calcular que isto corresponde a 1 ↓ de
massa total de 4,4 × 10-9 g / mole de CO2 formado (44 g). Presentemente não
existem aparelhos suficientemente sensíveis para medir alterações tão pequenas.
As alterações de energia nas reacções nucleares são muito >.
Energia de ligação
A energia libertada na formação de CO2 dos seus elementos, o calor de reacção,
é a medida da estabilidade da molécula de CO2. Quanto > é o calor de
formação > é a energia necessária para decompôr a molécula nos átomos
seus componentes.
A energia libertada na formação de 1 núcleo a partir dos nucleões seus
componentes é a medida de estabilidade desse núcleo. Esta energia é
denominada energia de ligação (EB) e tem 1 significado ≈ na ciência nuclear
como o calor de formação na termodinâmica química
A EB do D = 2,22 MeV. O núcleo de 4He é composto por 2 n e 2 p+. A massa
medida do átomo 4He é 4,002 603 u.
instável
estável
A separação e emparelhamento de nucleões em níveis de
energia do isóbaro A = 12. t ½ para o 12B instável = 0,02 s e
para 12N t ½ = 0,01 s.
instável
Tabela – massas atómicas e energias de ligação.
Massa
atómica
Elemento
Excesso
de massa
Defeito
de massa
Energia
de ligação EB
A estabilidade relativa dos núcleos é melhor caracterizada pela relação EB/A.
Para 4He EB/A = 28,3/4 ou 7,1 MeV, enquanto para D é 1,11 para a ligação
entre 2 nucleões.
4He é muito + estável que o núcleo de D.
Para a maioria dos núcleos os valores de EB/A variam entre 5 - 8 MeV. Numa 1ª
aproximação EB/A é relativamente constante, o que significa que a energia de
ligação nuclear total é proporcional ao nº total de nucleões no núcleo.
Energia de ligação do nucleão
PAR – PAR
PAR – IMPAR, IMPAR - PAR
Nº de massa, A
Nesta fig verifica-se que os valores de EB/A ↑ com o nº de massa até 1
máximo de 60 e depois ↓. Então os núcleos com nº massa na zona dos
60, i.e. Ni, Fe, etc., são + estáveis. Também se verifica que certos nºs de
n e p+ formam configurações muito estáveis (pequenos “picos” na curva).
Se os 2 nuclidos podem reagir para formar 1 novo núcleo cujo valor de EB/A é >
do que as espécies reagentes, obviamente que 1 determinada EB seria
libertada.
O processo é denominado fusão e é exotérmico apenas para núcleos com nº
massa > 60.
EB/A para o Ne = 8,0 MeV e para Ca é 8,6 MeV.
Então, nos 2 núcleos de Ne = 2 × 20 × 8,0 = 320 MeV estão envolvidos na
energia de ligação, enquanto que 40 × 8,6 = 344 MeV estão envolvidos nos
núcleos de Ca.
Quando 2 núcleos de Ne reagem para formar o núcleo de Ca, a diferença na
energia total de ligação dos reagentes e produtos é libertada, 344 - 320 = 24
MeV; o cáculo da massa dá 20,75 MeV.
Da análise da fig anterior também se verifica que se pode obter 1 libertação de
energia de ligação ≈ se pode obter se elementos de nº massa> 60 se
separam dando nuclidos com valores + ↑ EB/A.
Este processo, onde 1 núcleo é cindido em 2 menores, é conhecido por fissão.
ex:
A energia de ligação / nucleão para o U = 7,6 MeV, enquanto para o 140Xe e 93Sr
são 8,4 e 8,7 MeV, respectivamente.
A quantidade de energia libertada nesta fissão é aproximadamente
140 × 8,4 + 93 × 8,7 - 236 × 7,6 = 191,5 MeV para cada fissão do U.
Raio nuclear
Rutherford mostrou com as suas experiências scattering que o núcleo ocupa 1
pequena porção do volume total do átomo. Os raios dos núcleos variam de
1/10 000 a1/100 000 do raio dos átomos. Enquanto os tamanhos atómicos são
da ordem dos 100 pm (10-10 m), a unidade comum de tamanho nuclear é o
fentómetro (1 fm = 10-15 m), por vezes referido como 1 Fermi.
Por bombardeamento de núcleos com e- ou p+ de ↑ energia (até ≥ 1 GeV) e
medindo o ângulo de scattering e a energia da partícula, pode-se estudar a
densidade de carga e matéria perto da superfície do núcleo irradiado.
Destas experiências concluiuse que os núcleos não
possuem 1 distribuição de
carga e matéria fora de uma
vizinhança limitada (curvas
em S).
Os elementos inexistentes 43Tc e 61Pm
Há 2 elementos que “faltam” entre os elementos estáveis 1H and 82Pb ": o nº
atómico 43, technetium (Tc), e o nº atómico 61, promethium (Pm).
Estes elementos podem ser produzidos em reacções nucleares e também se
frmam em estrelas mas não se encontram no nosso planeta porque os seus
isótopos têm t ½ muito pequenos par terem sobrevivido desde a sua
formação.
Promethium
, t ½ = 5,5 anos, decai por EC (63%) para 148Nd ou por emissão β (37%)
para 146Sm, que são ambos estáveis (i.e. têm ↑ EB).
146Pm
Promethium é 1 produto de fissão e pode ser isolado quimicamente sob fora
pura. Possui as propriedades típicas dos lantanídeos e é usado em tecnologia
e medicina como fonte de radiação.
Technetium
Os isótopos de > t ½ do technetium têm:
A = 97 (2,6×106 anos), A = 98 (4,2×106 anos) e A = 99 (2,1×106 anos).
Centenas de kg de 99Tc e do seu precursor 99Mo são formados todos os anos
como produtos de fissão nos reactores nucleares e centenas de kg de Tc têm
sido isolados e estudados quimicamente.
99Mo
decai por emissão β dando o 99mTc.
Este isómero decai com t ½ = 6,02 h para 99Tc, emitindo 1 só γ de 0,142 MeV.
O isómero 99mTc é 1 radionuclido muito usado em diagnóstico nuclear e pode ser
convenientemente retirado de geradores de 99Mo.