Otimização da extração de celulases fúngicas obtidas por fermentação em
estado sólido de bagaço de cana-de-açúcar
Paola Marchiori Munheiro (PIBIC/Fundação Araucária/Unioeste), Tales Prado Alves,
Kleber Saatkamp, Salah Din Mahmud Hasan(Orientador), e-mail:
[email protected]
Universidade Estadual do Oeste do Paraná/Centro de Engenharias e Ciências
Exatas/Toledo, PR.
Engenharias - Engenharia Química
Palavras-chave: celulases, fermentação em estado sólido, extração
Resumo
Diversas pesquisas têm sido realizadas na busca de enzimas capazes de hidrolisar
a celulose de maneira mais efetiva, seja pela otimização de processos
fermentativos, pela combinação de enzimas para a obtenção de complexos
celulásicos mais eficientes ou por métodos de engenharia genética. A extração
sólido-líquido das enzimas celulases obtidas na fermentação em estado sólido (FES)
com fungos é uma etapa importante na obtenção dos extratos que serão usados nos
processos de hidrólise da celulose do bagaço de cana para fins de geração dos
açúcares fermentescíveis necessários para a obtenção de bioetanol. Até o
momento, não há relatos na literatura de um estudo da otimização da extração
simultânea de celulases do tipo beta-glicosidases, FPases e endogliconases. O
objetivo principal deste trabalho foi avaliar as melhores condições de extração de
enzimas celulases (FPases, CMCases, e beta-glicosidases) obtidas por FES de
bagaço de cana com o fungo Aspergillus niger. Para isso fez-se a fermentação do
bagaço de cana com A. niger e a partir de planejamentos fatoriais otimizou-se a
extração das enzimas. As atividades máximas das enzimas foram obtidas para as
seguintes condições de extração: tempo de 35,8 min, temperatura de 45ºC e pH 7,2.
Introdução
Devido à incessante demanda das atividades agrícolas, cresce o acúmulo de
resíduos agrícolas e industriais causando a deterioração do meio ambiente e perda
de recursos, há uma crescente busca da utilização dos resíduos agroindustriais.
Nesse contexto, diversos processos são desenvolvidos para utilização desses
materiais, transformando-os em compostos químicos e produtos com alto valor
agregado como o álcool, enzimas, ácidos orgânicos, aminoácidos, etc. A utilização
do resíduo de bagaço de cana em bioprocessos é uma racional alternativa para a
produção de substratos, e uma ajuda para solucionar o problema da poluição
ambiental (Pandey et al., 2000). Uma das possibilidades na degradação de materiais
lignocelulolíticos é o uso de micro-organismos que produzem enzimas específicas
que hidrolisam a celulose, como carboximetilcelulase e β-glicosidase (Celulases),
enzimas que atuam sobre a porção celulósica. As xilanases, glucanases e
galactanases (Hemicelulases) atuam sobre a porção hemicelulósica. A extração
sólido-líquido das enzimas obtidas na fermentação em estado sólido com fungos é
uma etapa importante na obtenção dos extratos que serão usados nos processos de
hidrólise da celulose presente no bagaço de cana-de-açúcar para fins de geração
dos açúcares fermentescíveis que servirão de matéria prima em uma fermentação
posterior com leveduras para a obtenção de bioetanol (Garay & Kumar, 2013). O
objetivo principal deste trabalho foi avaliar as melhores condições de extração de
enzimas celulases (FPases, CMCases, e beta-glicosidases) obtidas por fermentação
em estado sólido de bagaço de cana-de-açúcar com o fungo Aspergillus niger.
Material e Métodos
- Resíduo lignocelulósico: bagaço de cana-de-açúcar cedido por usina de
álcool de Goioerê-PR. Os resíduos foram secos (70ºC) e depois moídos em moinho
com peneira de 1 mm. Pré-tratamentos do bagaço de cana: foi feito o tratamento
alcalino oxidativo, conforme descrito por Krishna (2000). Os resíduos tratados foram
secos a 65ºC.
- Fermentações em estado sólido: foram conduzidas para a produção das celulases,
sendo realizadas em frascos erlenmeyer de 250 mL em estufa bacteriológica à
temperatura constante de 30°C. Foi utilizada neste trabalho solução de esporos de
uma cepa local do fungo A. niger. Além do bagaço de cana pré-tratado, foi usado o
meio de cultura conforme Mandels & Weber (1969), acrescido de 60 g.L -1 de
permeado de soro de leite, obtido de indústria de laticínios local. As amostras foram
retiradas periodicamente, e submetidos à extração das enzimas, com posterior
análise do conteúdo de celulases (FPase, CMCase, e beta-glicosidase).
- Extração: ocorreu adicionando-se uma solução tampão fosfato de sódio 50 mM em
pH 7,0, na proporção de 1:17 (g de sólido/mL de solução tampão) em cada frasco
(erlenmeyer) contendo o material resultante da FES e inseridos em incubadora
Shaker por 2h, a uma temperatura de 35ºC com agitação de 150 rpm. O sólido foi
removido por filtração à vácuo com papel filtro, sendo o filtrado posteriormente
centrifugado (centrífuga Parsec CT – 0603) por 20 min em rotação de 3000 rpm. O
sobrenadante de cada amostra foi armazenado em freezer (-18ºC) em frascos de
polietileno até a posterior realização das análises. Por meio de planejamento
experimental foram testados a influência da trituração (maceração) do sólido
fermentado na presença de tampão ou água deionizada e a influência do uso do
ultrassom. Foi usado o Ultrassom (Sonicador de Ponteira): Marca Ultronique. Mod.
QR 500, 20 KHz, pot. 500W. Em outro planejamento experimental foram testados os
efeitos do tempo de agitação, temperatura e relação sólido-líquido na extração,
sendo avaliadas as 4 atividades enzimáticas.
- Métodos analíticos: As atividades enzimáticas de exocelulase (FPase),
endoglucanase (CMCase) e betaglicosidase foram avaliadas em triplicata, conforme
método padrão recomendado pela Comissão IUPAC sobre Biotecnologia (Wood &
Bhat, 1988). A atividade da celulase FPase foi determinada usando como substrato
papel de filtro (FPase) e os açúcares redutores liberados determinados pelo método
DNS (Miller, 1959). Da mesma forma, para se determinar a atividade CMCase
(endoglucanase) foi utilizado substrato carboximetilcelulose – CMC e para a
betaglicosidase a celobiose. Uma unidade de atividade de FPase, endoglucanase ou
beta-glicosidase corresponde a 1 microlitro de glicose liberada por minuto.
Resultados e Discussão
Os parâmetros da extração como uso do tampão, trituração e ultrassom sobre
as atividades das enzimas obtidas após a FES foram testados previamente segundo
um planejamento experimental do tipo 23 e resultados das atividades enzimáticas
AE, tendo sido analisadas as atividades da FPase, CMCase e beta-glicosidase.
Mediante análise estatística usando o software Statistica v.8.0 (Statsoft) verificou-se
que para a FPase, nenhum dos três parâmetros foi significativo indicando que não
há influencia dos mesmos sobre a extração da enzima (p > 0,05). Da mesma forma,
não se verificou diferença significativa entre o uso da água e do tampão citrato pH
7,0 como liquido extrator da enzima. Foi então proposto um novo planejamento do
tipo Box-Behnken para 3 variáveis de extração: temperatura (25 a 45ºC), tempo (10
a 60 min) e pH (5 a 9), conforme a Tabela 1.
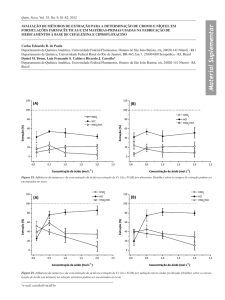
Verifica-se que os maiores valores de AE para FPase e Beta-glicosidase
estão próximos ao ponto central (ensaios 13 a 15), enquanto que para a CMCase
apresenta seus maiores valores de AE em temperaturas e pHs diferentes. Com a
obtenção das superfícies de resposta para as enzimas estudadas (FPase, Betaglicosidase e CMCase) e com o auxilio da função Desirability do Software Statistica
8.0, foi possível determinar as condições ótimas para a extração multienzimática,
com desejabilidade de 0,64% (Figura 1). Como pode ser observado essa função
desejabilidade, tem a proposta de otimizar o processo de extração, obtendo o
máximos das enzimas em uma mesma condição de extração, os valores ideais para
os parâmetros (tempo, temperatura e pH) da a extração multienzimática são: 35,83
min, 45°C e pH 7,2. Estes resultados estão condizentes com o obtido por Boico et al
(2015) e Scheufele (2012).
Tabela 1 - Planejamento experimental Box-Behnken e resultados das atividades enzimáticas AE.
Temperatura
25
pH
7
Fpase
β-glicosidase
CMCase
1
Tempo
10
0,291
2,462
0,022
2
60
25
7
0,286
2,422
0,024
3
10
45
7
0,291
2,466
0,035
4
60
45
7
0,298
2,552
0,036
5
10
35
5
0,284
3,135
0,026
6
60
35
5
0,306
3,052
0,024
7
10
35
9
0,321
2,754
0,023
8
60
35
9
0,316
2,628
0,027
9
35
25
5
0,298
2,816
0,026
10
35
45
5
0,312
2,743
0,055
11
35
25
9
0,309
1,861
0,050
12
35
45
9
0,297
2,012
0,052
13
35
35
7
0,361
3,221
0,040
14
35
35
7
0,355
2,994
0,038
15
35
35
7
0,347
3,144
0,043
Ensaio
Figura 1 – Função desirability do planejamento Box-Behnken para as 3 atividades enzimáticas.
Conclusões
Foi possível otimizar a extração por meio dos planejamentos, de cujos ensaios se
verificou as maiores atividades de FPase (0,361 U.mL-1), CMCase (0,055 U.mL-1) e
betaglicosidase (3,22 U.mL-1), para o ponto ótimo calculado para as seguintes
condições de extração: tempo de 35,8 min, temperatura de 45ºC e pH 7,2.
Agradecimentos
A Fundação Araucária pela concessão da bolsa PIBIC.
Referências
Boico, D.G., Deak, J.C.S., Munheiro, P.M., Silva, P.H.O.M., Langaro, C., Fiorese, M.
L., Hasan, S.D.M. (2015). Produção das enzimas celulase por fermentação em
estado sólido de bagaço de cana-de-açúcar. In: Anais 5º Simpósio de Biotecnologia
na Agroindústria, Palotina – Paraná, Brasil.
Garai, D. & Kumar, V. (2013). A Box-Behnken design approach for the production of
xylanase by Aspergillus candidus under solid state fermentation and its application in
saccharification of agro residues and Parthenium hysterophorus L. Industrial Crops
and Products 44, 352-363.
Krishna S.H., Rao, K.C.S., Babu, J.S. & Reddy, D.S. (2000). Studies on the
production and application of cellulose from Trichoderma reesei QM-9414.
Bioprocess Engineering, 22, 467-470.
Mandels, M., Weber, J. (1969). The production of cellulases. Advances in Chemistry
Series, 95, 391-414.
Miller, G.L. (1959). Use of dinitrosalicylic acid reagent for determination of reducing
sugar. Analytical Chemistry. 31(3), 426-428.
Pandey, A., Soccol, C.R. & Mitchell, D. (2000). Biotechnological potential of agroindustrial residues. I: sugarcane bagasse. Bioresource Technology 74, 69-80.
Scheufele, F.B. (2012). Bioconversão de resíduos agroindustriais por microorganismos do bioma amazônico produtores de enzimas lignocelulolíticas.
Wood, T.M. & Bhat, M.K. (1988). Methods for measuring cellulase activities. Methods
in Enzymology. 160, 87–112.