GRUPO DE ESTUDO - 2012
QUÍMICA I
PROFESSOR SOUZA
01) Assinale o que for correto.
01) O propanaldeído e o ácido propanóico são isômeros
de função.
02) Um hidrocarboneto somente apresentará isomeria
geométrica, se houver em sua estrutura dupla ligação
entre átomos de carbono.
04) Conceitos de equilíbrio químico podem ser usados
na explicação da tautomeria.
08) A imagem especular de uma mão em frente a um
espelho pode ser usada como exemplo na explicação
da isomeria ótica.
16) Se duas moléculas apresentarem um tipo qualquer
de isomeria entre si, apresentarão também
propriedades físicas como ponto de fusão e densidade
diferentes.
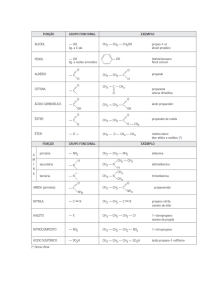
02) (UEL-2011) Analise os pares de fórmulas a seguir.
I. H3C – CH2 − COOH e H3C − COO – CH3
II. H3C − CO – CH2 – CH2 –
H3C − CO – CHCH3 – CH3
III. H3C − NH – CH2 – CH2 –
H3C – CH2 − NH – CH2 – CH3
IV. H3C − CHO e H2C = CHOH
V.
CH3
e
CH3
e
e
Associe cada par ao seu tipo de isomeria.
( ) A - Isomeria de cadeia
( ) B - Isomeria de função
( ) C - Isomeria de compensação
( ) D - Isomeria geométrica
( ) E - Tautomeria
Assinale a alternativa que apresenta a correspondência
correta.
a) I-A, II-E, III-D, IV-B e V-C
b) I-B, II-A, III-C, IV-E e V-D
c) I-C, II-B, III-E, IV-D e V-A
d) I-D, II-C, III-B, IV-A e V-E
e) I-E, II-D, III-A, IV-C e V-B
03) (UEL-2012) Escreva a fórmula estrutural de um
composto insaturado C5H9Br, que mostra:
a) Isomerismo cis-trans e que não possua atividade
óptica.
b) Nenhum isomerismo cis-trans, mas com atividade
óptica.
15/06/2012
04) (UNIOESTE-2012) Um dos grandes problemas de
poluição mundial e o descarte de detergentes nãobiodegradáveis nos rios, lagos e mananciais. Os
detergentes não biodegradáveis formam densas
espumas que impedem a entrada de gás oxigênio na
água e com isso afeta a vida das espécies aeróbicas
aquáticas. Para resolver ou amenizar este problema
surgiu o detergente biodegradável, a qual sua estrutura
pode ser observada abaixo: a
s
espumas que impedem a entrada
Com relação aos detergentes biodegradáveis, pode-se
afirmar que:
a) sua cadeia carbônica saturada apresenta somente
uma ramificação.
b) sua estrutura apresenta uma porção polar e uma
apolar.
c) o anel aromático e monossubstituido.
d) a parte apolar apresenta uma cadeia insaturada.
e) a porção sulfônica apresenta ligação metálica.
05) (UNIOESTE-2011) A reação de redução da 2butanona, mostrada abaixo, tem como único produto o
2-butanol como uma mistura racêmica. Supondo que
foram colocados para reagir 100 mL de 2-butanona,
cuja densidade e 0,8050 g/cm3, e que o rendimento
desta reação e de 80%, a massa aproximada (em
gramas) obtida do isômero levogiro do 2-butanol será
de:
a) 82,73.
b) 66,16.
c) 56,16.
d) 33,08.
e) 16,54.
06) (UNIOESTE-2011) O propanal, propanona, butano e
1-propanol
apresentam
massas
moleculares
semelhantes, porem propriedades físicas como
densidade, ponto de ebulição, completamente
diferentes. Qual a ordem CRESCENTE de pontos de
ebulição que estes compostos apresentam?
a) Propanal, propanona, butano e 1-propanol.
b) Butano, 1-propanol, propanona e propanal.
c) 1-Propanol, propanona, propanal e butano.
d) Butano, propanal, propanona e 1-propanol.
e) 1-Propanol, butano, propanal e propanona.
07) (UNIOESTE-2011) O aquecimento de gordura
animal ou óleo vegetal (triglicerídeo) com uma base
forte (soda caustica) em meio aquoso fornece um
produto bem conhecido. Este produto e o (a)
a) Biodiesel.
b) Detergente.
c) Sabao.
d) Colageno.
e) Resina.
GRUPO DE ESTUDO - 2012
QUÍMICA I
PROFESSOR SOUZA
GABARITO
1234567-
04 + 08 = 12
B
1-bromo-2-metil-but-1-eno e 4-bromo-pent-1-eno
B
D
D
C
15/06/2012
O oxigênio formado atacará a insaturação, quebrando
a estrutura do composto , resultando ácido carboxílico
e/ ou cetona e/ou gás carbônico.
Exemplo:
REAÇÕES DE OXIDAÇÕES
1 – Oxidação Branda - É conseguida usando-se
como oxidante uma solução aquosa diluída,neutra ou
levemente alcalina, de permanganato de potássio
(KMnO4).
ALCENO + [O] + H2O → DIÁLCOOL ( GLICOL)
A reação com KMnO4/H2SO4 é utilizada para
localizar a posição da insaturação na cadeia
carbônicas do composto. Vejamos;
TESTE DE BAEYER - Durante a reação, desaparece
a cor violeta da solução de KMnO4 e aparece um
precipitado marrom de MnO2. O descoramento da
solução acusa a presença de insaturações na cadeia
carbônica.
2 – Oxidação Energética - É conseguida usando-se,
como oxidante uma solução aquosa, concentrada,
ácida, de permanganato ou dicromato de potássio.
3- Ozonólise - É a reação de alcenos com ozônio (O3),
formando ozonetos, seguida por hidrólise desse
ozoneto, formando aldeído e/ou cetona e mais peróxido
de hidrogênio. Para evitar a oxidação do aldeído pela
água oxigenada, deve-se utilizar zinco na reação.
Exemplo:
Ozonólise do 2-metil-but-2-eno.
2 KMnO4 + 3 H2SO4 → K2SO4 + 2 MnSO4 + 3 H2O + 5 [ O ]
ou
K2CrO4 + 4 H2SO4 → K2SO4 + Cr(SO4)3 4 H2O + 3 [ O ]
Ozonólise do but-2-eno
GRUPO DE ESTUDO - 2012
QUÍMICA I
PROFESSOR SOUZA
15/06/2012
Ozonólise do 2,3-dimetil-but-2-eno
Reativo de Tollens - Solução Amoniacal de Nitrato de
Prata. Os aldeídos produzem um precipitado de prata
metálica nas paredes do frasco, formando um espelho
de prata. As cetonas não reagem com o licor de
Fehling.
A reação da ozonólise pode ser empregada para a
determinação da posição da dupla ligação na
cadeia carbônica do composto. Devemos eliminar
os átomos de oxigênio das duas moléculas e
juntar as estruturas resultantes por dupla
ligação. Vejamos:
Reativo de Fehling - Mistura de solução alcalina de
tartarato duplo de sódio e potássio (sal de seignette) e
solução de CuSO4. A mistura é um líquido de cor azul
escuro que contém o íon cobre II. Os aldeídos, quando
tratados pelo licor de Fehling dão um precipitado
vermelho-marrom de óxido cuproso.
Reação de Oxidação do Etanol no Bafômetro
4- Oxidação Energética de Álcool
1. Os álcoois primários oxidam, produzindo aldeído,
que é oxidado novamente e produz ácido carboxílico.
O etanol é convertido a ácido acético e o cromo, na
forma de íon cromato de cor amarelo alaranjado é
+3
transformado em Cr
de cor coloração verde.
3 CH CH OH + 2 K Cr O + 8 H SO
3
2
2
2
7
2
4
→
3 CH COOH + 2 Cr (SO ) + 2 K SO + 11 H O
3
2
4 3
2
4
2
Oxidação do metanol
2. Os álcoois secundários oxidam, produzindo cetona.
3. Os álcoois terciários não oxidam.
Lembrando: Reações de diferenciaçpão de aldeídos
de cetonas.
“O importante não é aquilo que fazem de nós,
mas o que nós mesmos fazemos com o que os
outros fizeram de nós”
Jean-Paul Satre