Rede de Educação Missionárias Servas do Espírito Santo
Colégio Nossa Senhora da Piedade
Av. Amaro Cavalcanti, 2591 – Encantado – Rio de Janeiro / RJ
CEP: 20735042 Tel: 2594-5043 – Fax: 2269-3409
E-mail: [email protected]
Home Page: www.cnsp.com.br
2ª Etapa – 2012
Disciplina:Química
Ano: 3º EM
Professor (a): Elisa Landim
Caro aluno, você está recebendo o conteúdo de recuperação.
Faça a lista de exercícios com atenção, ela norteará os seus estudos.
Utilize o livro didático adotado pela escola como fonte de estudo.
Se necessário, procure outras fontes como apoio (livros didáticos, exercícios além dos propostos, etc.).
Considere a recuperação como uma nova oportunidade de aprendizado.
Leve o seu trabalho a sério e com disciplina. Dessa forma, com certeza obterá sucesso.
Qualquer dúvida procure o professor responsável pela disciplina.
Recursos para Estudo /
Atividades
Conteúdo
Unidades de Estudo – conceitos e habilidades
•
•
Funções orgânicas - identificação e
nomenclatura:
Hidrocarbonetos
Álcool
Fenol
Éter
Aldeído
Cetona
Ácido carboxílico
Éster
Sal orgânico
Amina
Amida
Nitrila
Anidrido
Propriedades físicas de compostos orgânicos:
Ponto de ebulição
Solubilidade
•
Caderno
•
Livro didático adotado (Química –
Usberco e Salvador).
Unidade 21
Unidade 22
Unidade 23 até a página 554
•
Os módulos e avaliações
realizadas.
Rede de Educação Missionárias Servas do Espírito Santo
Colégio Nossa Senhora da Piedade
Av. Amaro Cavalcanti, 2591 – Encantado – Rio de Janeiro / RJ
CEP: 20735042 Tel: 2594-5043 – Fax: 2269-3409
E-mail: [email protected]
Home Page: www.cnsp.com.br
ENSINO MÉDIO
Área do Conhecimento: Ciências da Natureza
Disciplina: Química
Professor(a): Elisa Landim
Nome do (a) aluno (a):
Etapa:2ª
Data:_____/_____/2012.
Ano: 3º EM
Turma:
FG/TI
Nº:
BLOCO DE ATIVIDADES / EXERCÍCIOS PROPOSTOS
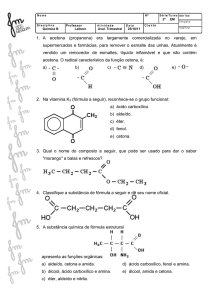
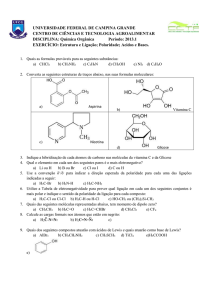
1. (Ufc 2008) A auroglaucina é um pigmento laranja natural que apresenta o núcleo básico I.
Sabendo que a estrutura da auroglaucina apresenta uma carbonila de aldeído não conjugada, uma
hidroxila ligada a carbono sp£ e um grupo heptil, represente a estrutura deste pigmento, substituindo R,
R‚ e Rƒ pelos átomos ou grupos adequados.
2. (Ufrj) A tabela a seguir apresenta algumas propriedades físicas de quatro substâncias orgânicas.
a) Explique por que o butanal apresenta um ponto de ebulição mais elevado do que o pentano.
b) Escreva a equação da reação do ácido propanóico com o butan-1-ol e dê o nome do composto
orgânico obtido.
3. (Fuvest) O fenol, substância de caráter ácido, tem a fórmula estrutural a seguir:
Sob mesma pressão, o ponto de ebulição do fenol deve ser maior ou menor do que o do benzeno?
Explique sua resposta.
4. (Ufg) Quando uma pessoa inala benzeno, seu organismo dispara um mecanismo de defesa que o
transforma no catecol, uma substância hidrossolúvel, como representado, a seguir:
a) Por que o catecol é mais solúvel em água que o benzeno?
b) Explique por que a temperatura ambiente e a 1 atm, o oxigênio é gás, o benzeno é líquido e o catecol é
sólido.
5. (Ufmg) Com relação ao benzeno, a afirmativa FALSA é
a) ele é insolúvel em água.
b) ele é um hidrocarboneto aromático.
c) Suas moléculas são insaturadas.
d) suas moléculas têm carbonos tetraédricos.
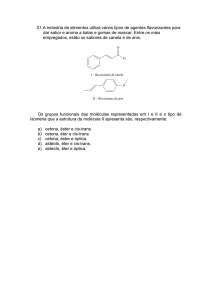
6. (Pucmg 2007) A gingerona é um componente do gengibre-rizoma (ou caule subterrâneo) do Zingiber
Officinale, de fórmula:
Ele apresenta grupos funcionais de:
a) éter, fenol e cetona.
c) álcool, éster e aldeído.
b) fenol, éster e aldeído.
d) álcool, éter e cetona.
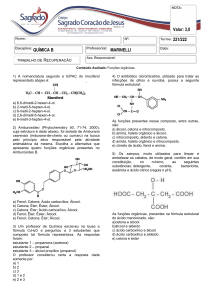
7. (Uel 2008) As aminas são um grupo de substâncias orgânicas usadas como medicamento. A ingestão
de um antistamínico diminui o efeito da histamina, que é uma substância produzida pelo corpo humano em
resposta às reações alérgicas. O medicamento Toradol é usado por dentistas para aliviar a dor de seus
pacientes.
As fórmulas das substâncias citadas no texto estão apresentadas na seqüência.
Com relação às fórmulas das moléculas representadas em (A), (B) e (C), são feitas as seguintes
afirmativas:
I. Na fórmula (A), identificam-se as funções éter e amina.
II. A histamina (B) possui duas aminas secundárias e uma amida.
III. A fórmula molecular da molécula (C) é C…NOƒH.
IV. Na fórmula (C), identificam-se as funções cetona, amina e ácido carboxílico.
Assinale a alternativa que contém todas as afirmativas corretas.
a) I e IV. b) I e III. c) II e III. d) I, II e III.
e) II, III e IV.
8. (Cesgranrio) Determina-se experimentalmente que, num álcool R-OH, a solubilidade em água varia
inversamente com o tamanho de R. Esse fato se deve:
a) somente às propriedades hidrófilas do radical hidroxila.
b) às propriedades hidrófilas de R, qualquer que seja seu tamanho.
c) às propriedades hidrófobas de R, qualquer que seja seu tamanho.
d) ao fato de o aumento de R corresponder ao aumento da parte apolar hidrofóbica.
e) ao fato de à diminuição de R corresponder uma diminuição na polaridade da molécula.
9. (Ita) Assinale a alternativa que contém a afirmação FALSA em relação à comparação das propriedades
do propan-1-ol com o butan-1-ol.
a) A temperatura de ebulição do butan-1-ol é maior.
b) Na mesma temperatura, a pressão de vapor do propan-1-ol é maior.
c) Nas mesmas condições de operação, a volatilidade do butan-1-ol é maior.
d) O propan-1-ol é mais solúvel em água.
e) O butan-1-ol é mais solúvel em n-hexano.
Obs: Volátil - Que se pode reduzir a gás ou a vapor em temperaturas ambientes.
10. (Ufmg) Em relação às moléculas do formaldeído, todas as alternativas estão corretas, EXCETO
a) Contêm átomos de carbono trigonal.
b) Podem formar ligações de hidrogênio entre si
d) A interação intermolecular é do tipo dipolo-dipolo.
e) São polares.
11. O gráfico a seguir apresenta os dados de massa molecular (M) x ponto de ebulição (P.E.) para quatro
álcoois primários.
Analisando-se os dados apresentados, verifica-se que os álcoois com massa molecular mais elevada
apresentam
a) maiores pontos de ebulição, devido à formação de pontes de hidrogênio intermoleculares.
b) maiores pontos de ebulição, devido à polaridade do grupo OH.
c) maiores pontos de ebulição devido ao aumento do número de interações intermoleculares do tipo Van
der Waals.
d) menores pontos de ebulição devido à diminuição do número de interações intermoleculares do tipo Van
der Waals.
e) menores pontos de ebulição, pois o aumento da cadeia carbônica diminui a polaridade do grupo OH.
12. Determine a nomenclatura do composto formado quando os 4 átomos de hidrogênio do metano são
substituídos pelos seguintes radicais: hidroxi, secbutil, isopropil e metil.
13. Qual a nomenclatura do composto orgânico formado pela reação do ácido pentanóico com o
metil-propan-1-ol?
14. Escreva a nomenclatura e a função de cada composto formado pela substituição do hidrogênio do
grupo aldoxila do butanal pelos seguintes grupos: amino, etil, hidroxi e metoxi
15. Qual a fórmula molecular das seguintes substâncias?
a)
b)
c)
d)
e)
etóxibenzeno
fenil-metilamina
hexanoato de tbutila
o-etilfenol
cianeto de etila
16. Qual a nomenclatura do composto formado pela união dos seguintes radicais?
a) metil e o-toluil
b) benzil e etil
17) Qual o nome e a função do composto formado pela reação entre o ácido acético e o hidróxido de
sódio?
18) Qual o nome do composto formado pela desidratação intermolecular entre duas moléculas de ácido
acético?