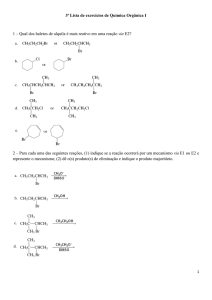
QUÍMICA
16. Das reações equacionadas, assinale a única que dá como produto um
composto que pertence à função ácido:
(A)
(B)
(C)
(D)
(E)
Ca + H2O o
Zn + HCA o
MgO + H2O o
HCA + Ag2SO4 o
H2SO4 + Ca(OH)2 o
21. Sabendo-se que a reatividade dos halogênios aumenta com o aumento
da eletronegatividade, assinale a alternativa que indica possibilidade de reação
química:
(A)
(B)
(C)
(D)
(E)
2 NaBr + CA2 o
2 NaBr + I2 o
2 NaCA + Br2 o
2 NaCA + I2 o
2 NaF + CA o
2
22. Observe as reações químicas:
MgO + H2O o Mg(OH)2
CO2 + H2O o H2CO3
K2O + 2 HCA o 2 KCA + H2O
SO3 + 2 NaOH o Na2SO4 + H2O
17. Os vapores de HCA e de NH4OH reagem no ar e formam um composto
que aparece como fumaça branca. O composto é:
I.
II.
III.
IV.
(A) NH3
(B) CA2
(C) NH4CA
Assinale a alternativa incorreta:
(D) H2O
(E) N2
18. Uma característica essencial dos fertilizantes é a sua solubilidade em
água. Por isso, a indústria de fertilizantes transforma o fosfato de cálcio, cuja
solubilidade em água é muito reduzida, num composto muito mais solúvel,
que é o superfosfato de cálcio. Representa-se esse processo pela equação:
Cax(PO4)2 + y H2SO4 o Ca(H2PO4)z + 2 CaSO4
onde os valores de x, y, e z são respectivamente:
(A) 4, 2 e 2;
(B) 3, 6 e 3;
(C) 2, 2 e 2;
(D) 5, 2 e 3;
(E) 3, 2 e 2.
19. Fazendo reagir as bases e os ácidos abaixo, em qual das reações a
relação de base para ácido é de 2:1? (Supor neutralização total.)
(A)
(B)
(C)
(D)
(E)
NaOH com HNO3;
KOH com H2SO4;
Ba(OH)2 com HNO3;
Mg(OH)2 com H2SO4;
NaOH com HCA.
20. O "leite de magnésia" é o resultado da mistura de sulfato de magnésio
com hidróxido de sódio e água destilada, aquecida ao fogo e submetida a
várias lavagens. É usado como antiácido e laxante. No combate à acidez
estomacal, o "leite de magnésia" reage produzindo:
(A) MgSO4
(B) Na2SO4
(C) NaCA
(D) Mg(OH)2
(E) MgCA2
(A)
(B)
(C)
(D)
(E)
As reações II e IV envolvem óxidos ácidos ou anidridos.
As reações I e III envolvem óxidos básicos.
O sal produzido na reação IV chama-se sulfato de sódio.
O sal produzido na reação III chama-se cloreto de potássio.
O caráter básico dos óxidos se acentua à medida que o oxigênio se liga
a elementos mais eletronegativos.
23. Discutem-se ultimamente os distúrbios ecológicos causados pelos
poluentes ambientais. A chamada "chuva ácida" constitui num exemplo das
conseqüências da poluição na atmosfera, onde a formação de ácidos pode
ser obtida a partir da dissolução de certas substâncias na água da chuva.
Dentre as substâncias passíveis de formar ácidos quando adicionadas à
água, podem-se citar:
(A) Na2O
(B) SO3
(C) AA2O3
(D) CaO
(E) BaO
24. O gráfico a seguir mostra a proporção, em número de átomos, de um
ametal X e de oxigênio, quando se ligam para formar um óxido:
Pela análise do gráfico, concluímos que, ao reagir uma molécula do óxido
com uma molécula de água, haverá formação do seguinte composto:
(A) H X O
(B) H X O2
(C) H X O3
(D) H X O4
(E) H X O5
'
PbS + O2
o PbO + SO2
25. Na reação 3 H2SO4 + 2 AA(OH)3 o forma-se água e:
(D) AA2(SO4)3
(E) AA3(SO4)2
(A) AASO4
(B) AA(SO4)2
(C) AA2SO4
26. Dadas as equações químicas incompletas,
I.
II.
III.
IV.
H2SO4 + MgCO3 o MgSO4 + H2O +_A_,
2 HCA + CuO o _B_+ H2O,
Na + H2O o NaOH + _C_,
Ca(OH)2 + _D_ o CaSO3 + 2 H2O,
as fórmulas que preenchem corretamente os espaços A, B, C e D são,
respectivamente:
(A)
(B)
(C)
(D)
(E)
Mg, H2, O2, SO2
CO2, CuCA2, H2, H2SO3
Mg(OH)2, O2, H2, SO3
MgSO4, CuCA, NaO, SO3
H2CO3, Cu(OH)2, O2, H2SO4
27. O carvão, ao contrário do hidrogênio, é um combustível altamente
poluente, pois sua queima contribui para o aumento do efeito estufa e para a
ocorrência da chuva ácida.
A equação balanceada abaixo representa a principal reação química que
ocorre na combustão do carvão:
C + O2 oCO2
O elemento que sofre redução e o agente oxidante estão, respectivamente,
indicados em:
(A) O e C;
(B) O e O2;
(C) C e O;
(D) C e O2;
(E) C e C.
28. Na reação Fe3O4 + 4 CO o 3 Fe + 4 CO2, utilizada na siderurgia para
a obtenção de ferro metálico:
(A)
(B)
(C)
(D)
(E)
29. A metalurgia, processo de produção de metais a partir de minérios,
sempre envolve reações de redox.
Na metalurgia do chumbo, um dos minérios utilizados é a galena (PbS). A
primeira etapa envolve a transformação do sulfeto de chumbo em seu óxido,
num processo chamado ustulação. A equação não balanceada é :
o ferro é reduzido e o carbono oxidado;
o carbono e o ferro são reduzidos;
o ferro e o oxigênio são reduzidos;
o ferro é oxidado e o carbono reduzido;
o carbono e o ferro são oxidados.
A equação balanceada terá como soma dos menores coeficientes inteiros:
(A) 8
(B) 9
(C) 10
(D) 11
(E) 12
30. Ao efetuarmos o balanceamento da reação abaixo:
H2S + HNO3 o H2SO4 + NO2 + H2O
podemos observar que a soma de seus menores coeficientes inteiros é:
(A) 12
(B) 25
(C) 15
(D) 18
(E) 22