4
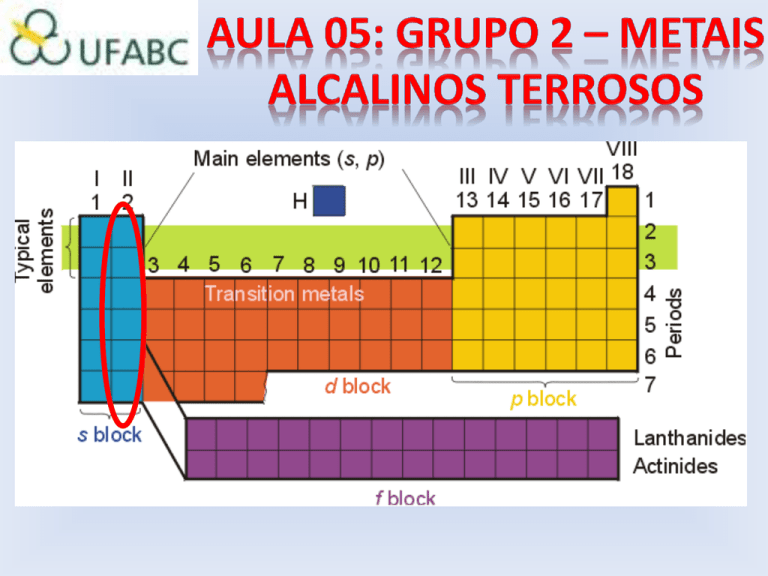
Grupo 2: METAIS ALCALINOS TERROSOS
2
Elemento
Z
Configuração
Be
Berílio
4
[He] 2s2
Mg
Magnésio
12
[Ne] 3s2
Ca
Cálcio
20
[Ar] 4s2
Sr
Estrôncio
38
[Kr] 5s2
Ba
Bário
56
[Xe] 6s2
Ra
Rádio
88
[Rn] 7s2
Grupo 2: METAIS ALCALINOS TERROSOS
Z=4
Be
Z = 20
Ca
Z = 12
Mg
Z = 56
Z = 38
Sr
Ba
Ocorrência na natureza
As abundâncias são dadas na forma logarítmica (base 10) em
gramas de metal por 1000 Kg de amostra.
Como a escala vertical e logartímica, as diferenças são muito maiores o que
aparentam.
Log Be = 0,30 Be = 100,30 2 g de Be / 1000 Kg
Log Ca = 4,71 Ca= 104,71 51.300 g de Ca / 1000 Kg
Log Na = 4,36 Na= 104,36 23.000 g de Na / 1000 Kg
Crosta
Ocorrência na natureza
Berílio berilo: 3BeO.Al2O3.6SiO2
Esmeralda: cristal de berilo com íons Cr3+ no
lugar do Al3+, responsáveis pela cor
Fenaquita - Be2SiO4
Bertrandita - Be4Si2O7(OH)2
Ocorrência na natureza
Magnésio: - água do mar
Cálcio: depósitos de CaCO3 (conchas de
exoesqueletos de organismos marinhos antigos)
Giz (mais mole), pedra calcária, mármore
(com impurezas)
Calcário
- dolomita: CaCO3.MgCO3
- magnesita: MgCO3
Gesso
Ocorrência na natureza
Estrôncio e Bário: ocorrem na
forma de minérios como
celestita (SrSO4), estroncianita
(SrCO3) e barita (BaSO4)
Celestita
Barita
Rádio: raro e radioativo. Obtido
por meio do processamento o
Urânio (Marie Curie)
Importância Biológica
John Emsley, Moléculas em exposição
Métodos de Obtenção
Por aquecimento (750oC) do berilo com hexafluorossilicato de sódio
(Na2SiF6) para produzir BeF2 que é reduzido a Be em presença de Mg
Be3 Al 2Si6O18 2 NaOH
3 BeO Na2O Al 2O3 6 SiO2 H2O
berilo
BeO C Cl2
BeCl2 CO
Eletrólise do cloreto de berílio fundido
BeCl2 (l) Be (l) + Cl2(g)
Eo = -1,85 - 1,36 = - 3,21 V
2 Cl- (aq) Cl2 (g) + 2 eBe+2 (l) + 2 e- Be (s)
Métodos de Obtenção
• A partir da dolomita:
MgCO3.CaCO3 (s) Mg (s)
Elevadas temperaturas
Mg é obtido no estado líquido
e removido por destilação
• Eletrólise do cloreto de magnésio (fundido), que é obtido a partir
da água do mar
Mg2+ (aq) + Ca(OH)2 (aq) Mg(OH)2 (s) + Ca2+ (aq)
Mg(OH)2 (s) + 2 H3O+ (aq) Mg2+ (aq) + 4 H2O (l)
MgCl2 (l) Mg (l) + Cl2(g)
Eo
= -2,37 - 1,36 = - 3,73 V
2 Cl-(aq) Cl2(g) + 2 eMg2+(l) + 2 e- Mg(s)
Métodos de Obtenção
CaCO3 (s) CaO (s) + CO2 (g)
CaO(s) + 2 NH4Cl(s) CaCl2(s) + 2 NH3(g) + H2O(l)
CaCl2 (l) Ca (l) + Cl2(g)
Eletrólise ígnea
Eo = -2,87 - 1,36 = - 4,23 V
2 Cl- (aq) Cl2 (g) + 2 eCa2+ (l) + 2 e- Ca (s)
Métodos de Obtenção
Eletrólise do cloreto fundido (BaCl2 ou SrCl2)
Redução do óxido com alumínio:
6 SrO(s)
+
2Al(s)
3Sr(s)
Aluminotermia
+
Sr3Al2O6(s)
Propriedades Atômicas
Propriedades Atômicas
Configuração Eletrônica
2 elétrons no orbital mais externo s
sem
considerar
a
configuração
interna:
1s2 , 2s2, 3s2, 4s2, 5s2, 6s2, 7s2
formam íons bivalentes
elétrons da última camada podem
ser promovidos para orbitais mais
externos pela energia de uma chama.
Sob a Chama
Magnésio
Bário
Estrôncio
Mistura
os átomos dos alcalinos terrosos são menores que os dos alcalinos. Por que?
(lembre-se que seus íons são menos volumosos que os átomos que lhe deram
origem)
os átomos dos alcalinos terrosos são menores que os dos alcalinos. Por que?
(lembre-se que seus íons são menos volumosos que os átomos que lhe deram origem)
são mais densos que os alcalinos
os átomos dos alcalinos terrosos são menores que os dos alcalinos. Por que?
(lembre-se que seus íons são menos volumosos que os átomos que lhe deram origem)
são mais densos que os alcalinos
possuem dois elétrons na camada de valência para participar de ligações
metálicas.
São, portanto, mais duros que os alcalinos. (Entretanto, também são moles em
comparação com demais metais)
os átomos dos alcalinos terrosos são menores que os dos alcalinos. Por que?
(lembre-se que seus íons são menos volumosos que os átomos que lhe deram origem)
são mais densos que os alcalinos
possuem dois elétrons na camada de valência para participar de ligações
metálicas.
PF e PE maiores que os alcalinos
Possuem energia de ionização maiores que os alcalinos
Energia de ionização
Apresentam a 2a E. I. superior que a 1a E.I.
condutores de eletricidade
altamamente reativos (são menos eletropositivos que os
alcalinos)
formam compostos iônicos incolores (sem elétrons
desemparelhados: diamagnéticos).
Entalpia de rede, HRo e o ciclo de Born-Haber
É a variação de entalpia molar
padrão que acompanha a
+ ½ Entalpia de dissociação
(H )
formação de íons gasosos a partir
do sólido:
d
MX(s) M+(g) + X-(g)
Hf = Hs + I + ½ Hd + E + U
Hs, I e Hd são positivas
E e U são geralmente negativas
- Afinidade Eletrônica (E)
+ Entalpia de
sublimação (Hs)
+ Energia de
ionização (I)
- Energia Reticular (U)
Entalpia de
formação (Hf)
Hf < 0
Entalpia de rede: será maior quanto menor forem os íons e com carga
elevada
• as energias reticulares são maiores no grupo 2 do que as do grupo 1
devido ao aumento da carga dos íons
•Pode ser considerada como o calor necessário para vaporizar o sólido.
Quanto maior a entalpia de rede, mais calor é exigido.
Entalpia de Hidratação “íons gasosos mergulhando em água”,
formando uma solução: Energia é liberada
Entalpia de hidratação NaCl (g) = -444 + (-340)
= - 784 KJ.mol-1
Entalpia de hidratação LiCl (g) = -558 + (-340)
= - 898 KJ.mol-1
Entalpia de hidratação CaCl2 (g) = -1657 + (2 x(-340))
= - 2337 KJ.mol-1
tanto a energia reticular quanto a
energia de hidratação diminuem com o
aumento do número atômico, sendo
que a de hidratação diminui mais
rapidamente que a reticular.
Para que uma substância se dissolva, a energia
liberada quando os íons se hidratam (energia de
hidratação) deve ser maior que a energia necessária
p/ romper o retículo cristalino (energia reticular - U).
Energia em processos de dissolução: Entalpia de Rede e Entalpia Hidratação
Processo de dissolução exotérmico
Luciana Almeida Silva, Cláudia Rocha Martins e Jailson Bittencourt de Andrade, Quim. Nova, Vol. 27, No. 6, 1016-1020, 2004.
Energia em processos de dissolução: Entalpia de Rede e Entalpia Hidratação
Processo de dissolução endotérmico
Luciana Almeida Silva, Cláudia Rocha Martins e Jailson Bittencourt de Andrade, Quim. Nova, Vol. 27, No. 6, 1016-1020, 2004.
Energia em processos de dissolução: Entalpia de Rede + Entalpia Hidratação
LiCl (s) Li+ (aq) + Cl- (aq)
861 + (-898) = - 37 KJ.mol-1
exotérmica
NaCl (s) Na+ (aq) + Cl- (aq)
787 + (-784) = +3 KJ.mol-1
endotérmica
KCl (s) K+ (aq) + Cl- (aq)
717 + (-701) = +16 KJ.mol-1
endotérmica
CaCl2 (s) Ca+ (aq) + 2 Cl- (aq) 2260 + (-2337) = -77 KJ.mol-1
exotérmica
MgCl2 (s) Mg+ (aq) + 2 Cl- (aq)2524 + (-2683) = -159 KJ.mol-1 exotérmica
H < 0
(exotérmico)
G < 0
Favorável
G = H - TS
Favorável
TS > H
Desfavorável
TS < H
Quando H > 0
(endotérmico)
SEMELHANTE DISSOLVE
SEMELHANTE
Apresenta diferenças consideráveis dos demais elementos do grupo:
é o menos metálico do grupo
ele é muito pequeno e tem eletronegatividade alta
seus compostos tem propriedades comumente atribuídas a ligações
covalentes
O acetato de Be consiste de um
átomo central de O rodeado por
um tetraedro de quatro átomos
de Be, os quais por sua vez
estão unidos por íons acetato.
O nível eletrônico mais externo do Berílio comporta no máximo oito elétrons.
Portanto, forma 4 ligações convencionais (maioria dos compostos NC = 4),
com unidades tetraédricas em cloretos, acetatos e hidretos sólidos.
(BeX2 deveriam ser lineares)
Ligação tricentrada com 2 elétrons =
Propriedades Químicas
Reação com H2O Formam hidróxido liberando H2
O Be não reage com água devido a película de BeO
Mg (s) + 2 H2O (l) Mg(OH)2 (aq) + H2 (g), a quente
Ca (s) + 2 H2O (l) Ca(OH)2 (aq) + H2 (g), a frio
Ba (s) + 2 H2O (l) Ba(OH)2 (aq) + H2 (g), rapidamente
Propriedades Óxidos Obtidos pela decomposição térmica dos
carbonatos.
MgCO3 (s) MgO (s) + CO2 (g)
Resistentes a altas temperaturas.
Reagem com água para formar os hidróxidos (exceto
BeO – película) BaO - insolúvel
MgO(s) + H2O (l) Mg(OH)2 (aq)
Propriedades Químicas
Reação com H2O Formam hidróxido liberando H2
Ba, Sr e Ca possuem potencias
semelhantes aos do Grupo 1:
reagem com água fria
Mg possui potencial intermediário: reage apenas com água quente
Be é muito menos eletropositivo (menos metálico): não reage com
água
Propriedades Químicas
Reação com não metais e com a água
Reação com O2 Formam uma película de óxido que
protege o metal
Be (s) + ½ O2 (g) BeO (s)
Mg (s) + ½ O2 (g) MgO (s)
A película formada de BeO resiste a altíssimas temperaturas.
No caso de Ca, Mg e Sr a proteção é parcial.
O Ba não forma a película e pode inflamar em ar úmido.
Propriedades Químicas
Propriedades Químicas
Forte relação diagonal com o
Alumínio:
• Be e Al formam hidretos, haletos e óxidos
covalentes
• Os óxidos de Be e Al são anfóteros
• Na presença de excesso de OH- formam [Be(OH)4]2- e
[Al(OH)4]-; Mg(OH)2 não reage com OH•Be e Al formam carbetos (C-4) e produzem metano por reação
com água; os demais formam C22- e liberam etino por reação
com água
• Be e Al se tornam passivos quando tratados com HNO3
• Potenciais padrão do Be (-1,85 V) se assemelha mais ao do
Al (-1,66 V)
Principais Compostos
- Liga de Be – Cu: O Be é adicionado ao cobre em pequenas
quantidades já que seu pequeno tamanho mantém os átomos de Cu
mais juntos, aumentando a rigidez (em relação ao cobre puro),
mantendo a condutividade.
Restringe utilização
- Os sais solúveis de Berílio são tóxicos
industrial
- O Berílio é anfótero, reage com ácidos e bases
Be (s) + 2 OH- (aq) [Be(OH)4]-2 (aq) + H2 (g)
Be (s) + 2 HCl (aq) BeCl2 (aq) + H2 (g)
Demais metais do grupo não são anfóteros
MgO (s) + 2 H2O (l) Mg(OH)2 (aq)
MgO (s) + 2 HCl (aq) MgCl2 (aq) + H2O (g)
MgO (s) + OH- (aq) x
Principais Compostos
Responsável pela
ativação de
muitas enzimas
• grande
Essencial para a
importância
saúde humana
biológica
• A densidade do Mg é 2/3 da densidade do Al, porém é mais mole.
Mas suas ligas têm grande resistência, e são aplicadas onde leveza e
dureza são exigidas: aviões!
Liga com Li (14%), Al (1%) e Mg (84%): estrutura de aeornaves
Problemas para seu emprego em larga escala:
- É mais caro que o aço e mais difícil de ser trabalhado.
- Funde a baixa temperatura e pode ser deformado facilmente.
- não pode ser resfriado com água, pois reage com esta.
Reage com N2 (Mg3N2) e com o CO2 (MgO (s) + CO2 (g) MgCO3 (s))
Principais Compostos
• Mg metálico é utilizado em flash, em velas de aniversário e para
iniciar reação de termita https://www.youtube.com/watch?v=a8XSmSdvEK4
• MgCO3 utilizado por ginastas com agente secante
Principais Compostos
Mg(OH)2: leite de magnésia, empregado como antiácido estomacal
MgO: formado por cátion (Mg2+) e ânion (O2-):
- alta resistência a fusão (2800 oC): uso em tijolos refratários
- bom condutor de calor e pobre condutor elétrico: uso em isolantes
de aquecedores elétricos
MgSO4: sal de Epson, empregado como purgativo
Clorofila: função do Mg2+ é manter o anel rígido,
para aumentar a eficiência na captação do fóton
luz e conversão em energia para a fotossíntese
Principais Compostos
CaCO3: - puros (calcita e aragonita) remanescentes da vida marinha
fossilizada
- impuros (giz e mármore)
HCO3- (aq) + H2O (l)
H3O+ (aq) + CO32- (aq)
Os hidrogenocarbonatos são mais solúveis e são
carregados para dentro do solo
mármore
Estalactite
Estalagmite
Problemas Ambientais: chuva ácida
Monumentos são feitos de CaCO3
CaCO3 (s) + 2 H3O+
(aq)
Ca2+ (aq) + 3 H2O (l) + CO2 (g)
Congonhas - MG
Os Profetas (Aleijadinho) são
feitos em pedra sabão
Também sofrem
c/ efeitos da
chuva ácida
Sistema fechado
O cimento Portland tem como matéria prima o calcário (basicamente de
carbonato de cálcio CaCO3), argila (silicatos complexos contendo
alumínio e ferro como cátions principais), minério de ferro, gesso e
aditivos.
Principais Compostos
CaO: cal viva, porque reage com a água rapidamente e
exotérmicamente (capaz de incendiar madeiras ou papéis úmidos)
CaO (s) + H2O (l) Ca(OH)2 (aq) Composto pouco solúvel conhecido
por cal extinta
Utilizada na metalurgia, para retirar a impureza SiO2 do mineral
CaO (s) + SiO2 (s) CaSiO3 (s)
Utilizada para a produção de acetileno, usado em maçaricos
CaO (s) + 3 C (s) CaC2 (s) + CO (g)
CaC2 (s) + 2 H2O (l) C2H2 (g) + Ca(OH)2 (aq)
Principais Compostos
Principais Compostos
CaO:
• siderúrgicas: usadas na fabricação de aço nos fornos, regulador de
pH em tratamento de águas;
• celulose e papel: para regenerar a soda caústica e para branquear
as polpas de papel, junto com outros reagentes;
• açúcar: na remoção dos compostos fosfáticos, dos compostos
orgânicos e no clareamento do açúcar;
• tintas: como pigmento e incorporante de tintas à base de cal;
• alumínio: como regeneradora da soda;
• diversas: cerâmica, graxas, tijolos sílica-cal, petróleo, couro,
etanol, metalurgia do cobre, produtos farmacêuticos e
alimentícios e biogás.
Principais Compostos
CaO:
• tratamento de água na correção do pH, na coagulação do alume e
dos sais metálicos, na remoção da sílica;
• estabilização de solos
• obtenção de argamassas de assentamento e revestimento como
plastificante, retentor de água e de incorporação de agregados
• misturas asfálticas como neutralizador de acidez e reforçador de
propriedades físicas (em geral, 1% das misturas);
• usos diversos: precipitação do SOx dos gases resultantes da queima
de combustíveis ricos em enxofre; proteção às árvores; desinfetantes
de fossas; proteção à estábulos e galinheiros.
Principais Compostos
Ca(OH)2: usado para testar a presença de CO2
Ca(OH)2 (aq) + CO2 (g) CaCO3 (s) + H2O (l)
Ca5(PO4)3OH: hidroxiapatita, esmalte dos dentes. O estrago nos
dentes é causado pelo ataque dos ácidos formados na digestão dos
alimentos por bactérias.
Ca5(PO4)3OH (s) + 4 H3O+ (aq) 5 Ca2+ (aq) + 3HPO42-(aq) + 5 H2O (l)
Tratamento com Flúor forma uma cobertura mais resistente ao ataque:
Ca5(PO4)3OH (s) + F- (aq) Ca5(PO4)3F (s) + OH-(aq)
CaSO4.2H2O: gesso, usado em construções na argamassa e na decoração
Aplicações Industriais
Compostos Organometálicos
Be e Mg formam número considerável de compostos deste tipo.
Reagente de Grignard (RMgBr), são utilizados na síntese de álcoois,
aldeídos e cetonas, além da sua aplicação em QI para obtenção de
outros compostos organometálicos.
Aplicações Industriais
USA 2004
Aplicações Industriais
Correção do pH do solo
Ca(OH)2 (s) + 2 H3O+
(aq)
Ca2+ (aq) + 4 H2O (l)
Aplicações Industriais
Celobar
O medicamento, utilizado para destacar órgãos em
exames radiológicos, pode ter causado a morte de pelo
menos 21 pessoas no país.
Sua matéria-prima é o sulfato de bário.
No entanto, análise preliminar da Fiocruz (Fundação Oswaldo Cruz) aponta a
presença de carbonato de bário, distribuído em diversos Estados pelo
laboratório Enila, do Rio de Janeiro. O carbonato de bário é utilizado em
venenos para rato.
O Enila informa a ANVISA que os 600 kg de carbonato de bário foram usados
para sintetizar 595 kg de sulfato de bário, matéria-prima do Celobar.
BaCO3 (s) + H2SO4 (aq) BaSO4 (s) + H2O (l) + CO2 (g)
Aplicações Industriais
Sr(NO3)2: utilizado em pirotecnia ou como sinalizadores
Vermelho
SrCl2.6H2O: adicionados a cremes dentais para
reduzir a sensibilidade dos dentes ao quente e frio
Aplicações Industriais
RaBr2 foi utilizado junto com ZnS em relógios
Bibliografia
•
Atkins, P., Jones, L., Princípios de Química - Questionando a Vida Moderna e o Meio
Ambiente, 3 ed., Porto Alegre: Bookman, 2006.
•
Shriver, D. F., Atkins, P., Química Inorgânica, Ed Artmed, 2003 .
•
Lee, J. D., Química Inorgânica Não Tão Concisa. Edgard Blucher Ltda, 3a ed., São
Paulo, 1980
•
Brent, R., The Golden book of Chemistry Experiments, Golden Press, New
York,1960