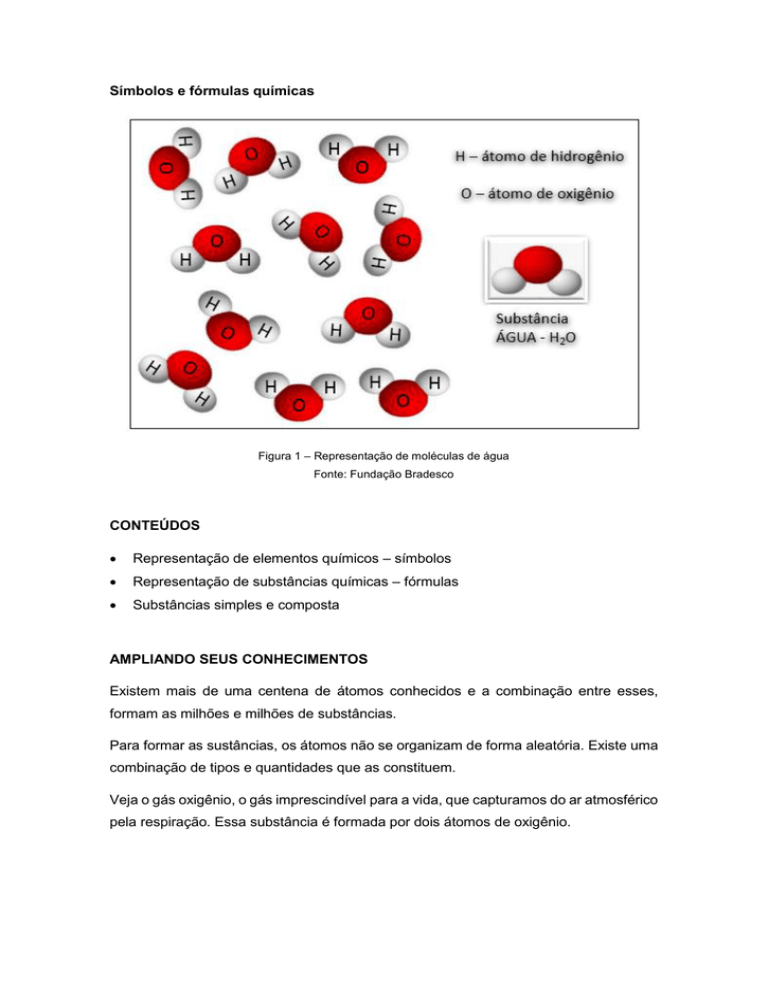
Símbolos e fórmulas químicas
Figura 1 – Representação de moléculas de água
Fonte: Fundação Bradesco
CONTEÚDOS
Representação de elementos químicos – símbolos
Representação de substâncias químicas – fórmulas
Substâncias simples e composta
AMPLIANDO SEUS CONHECIMENTOS
Existem mais de uma centena de átomos conhecidos e a combinação entre esses,
formam as milhões e milhões de substâncias.
Para formar as sustâncias, os átomos não se organizam de forma aleatória. Existe uma
combinação de tipos e quantidades que as constituem.
Veja o gás oxigênio, o gás imprescindível para a vida, que capturamos do ar atmosférico
pela respiração. Essa substância é formada por dois átomos de oxigênio.
Figura 2 – Representação da substância oxigênio
Fonte: Fundação Bradesco
Veja outra substância, o dióxido de carbono. Substância que é eliminada na expiração
humana. Essa substância é formada por um átomo de carbono e dois átomos de
oxigênio. Assim como dito, a proporção dos átomos e a forma como eles estão ligados
na substância, não é aleatória. Observe que a proporção é de dois átomos de oxigênio
para um átomo de carbono, ou seja, 2 átomos de oxigênio : 1 átomo de carbono.
Figura 3 – Representação da substância dióxido de carbono
Fonte: Fundação Bradesco
Agora, observe o caso da substância água. Substância abundante, que pode facilmente
ser encontrada nos três estados físicos. Ela é formada por dois átomos de hidrogênio e
um átomo de oxigênio, ou seja, 2 átomos de hidrogênio : 1 átomo de O.
Figura 4 – Representação da substância água
Fonte: Fundação Bradesco
Podemos representar cada um desses átomos e substâncias, usando a linguagem
científica.
Os químicos utilizam uma linguagem própria para facilitar a comunicação. Cada
elemento químico é representado pelo seu símbolo químico. Esses símbolos foram
definidos por critérios internacionais e, independente da língua ou alfabeto, os símbolos
químicos são os mesmos.
Regra
Os símbolos são expressos com letras maiúsculas e para o elemento cujo símbolo tem
duas letras, a segunda letra é minúscula. Exemplos:
Hidrogênio: H
Hélio: He
Oxigênio: O
Carbono: C
Cálcio: Ca
Cloro: Cl
Considerando os exemplos anteriores, temos:
Átomo
Representação de Dalton
Símbolo químico
Carbono
C
Oxigênio
O
Hidrogênio
H
Sabendo a proporção com que os átomos se combinam para formar as substâncias é
possível escrever a sua fórmula química.
Substância
Representação de Dalton
Gás oxigênio
Fórmula química
O2
Dióxido de
CO2
carbono
Água
H2O
As fórmulas das substâncias químicas indicam os tipos e as quantidades de átomos que
constituem as substâncias. Os tipos são representados pelos símbolos, e as
quantidades são representadas pelos índices (que são os números pequenos escritos
do lado direito do símbolo).
Figura 5 – Fórmulas químicas
Fonte: Fundação Bradesco
Atenção
Na fórmula, quando não aparece nenhum índice ao lado do símbolo, significa que a
substância é constituída por um átomo desse tipo. Ou seja, o índice é 1, e não precisa
ser representado.
Por exemplo, a fórmula do carbonato de cálcio, principal constituinte do mármore, é
CaCO3. A fórmula indica que a substância é formada por 1 átomo de cálcio (Ca), 1 átomo
de carbono (C) e 3 átomos de oxigênio, ou seja, 1 Ca : 1 C : 3 O.
Analisando a fórmula da substância, é possível saber sua composição, portanto, é
possível classificá-la em simples ou composta. A substância simples é aquela
constituída por um único tipo de átomo, como é o caso do gás oxigênio, O2. O ozônio é
uma substância formada somente por átomos de oxigênio também, sua fórmula é O 3.
Embora sejam formadas pelo mesmo tipo de átomos, são substâncias com
propriedades químicas diferentes.
Os metais são as únicas substâncias simples cuja representação da fórmula é como o
símbolo, na forma monoatômica. Por exemplo:
Ferro: Fe
Alumínio: Al
Potássio: K
Cobre: Cu
Sódio: Na
Ouro: Au
A substância composta é formada por mais de um tipo de átomo, como é o caso do
dióxido de carbono (CO2), da água (H2O) e do carbonato de cálcio (CaCO3).
ATIVIDADES
Para resolver as atividades propostas, consulte a tabela com os símbolos de alguns
elementos.
Nome
símbolo
Nome
símbolo
Nome
símbolo
alumínio
Al
estanho
Sn
níquel
Ni
argônio
Ar
ferro
Fe
nitrogênio
N
cálcio
Ca
flúor
Fe
ouro
Au
carbono
C
fósforo
Pb
oxigênio
O
chumbo
Pb
hélio
He
potássio
K
cloro
Cl
hidrogênio
He
prata
Ag
cobalto
Co
magnésio
Mg
silício
Si
cobre
Cu
manganês
Mn
sódio
Na
crômio
Cr
mercúrio
Hg
zinco
Zn
enxofre
S
neônio
Ne
1. A partir da descrição, escreva a fórmula das substâncias:
Atenção: Lembre-se que as quantidades de átomos nas fórmulas químicas, são
representas pelo índice.
a) Amônia: 1 átomo de nitrogênio e 3 átomos de hidrogênio.
_______________________________________________________________
b) Cloreto de cálcio: 1 átomo de cálcio e 2 átomos de cloro.
_______________________________________________________________
c) Óxido de manganês: 1 átomo de manganês e 2 átomos de oxigênio.
_______________________________________________________________
d) Acetileno: 2 átomos de carbono e 2 átomos de hidrogênio.
_______________________________________________________________
e) Hidreto de sódio: 1 átomo de sódio e 1 átomo de hidrogênio.
_______________________________________________________________
f)
Carbonato de cálcio: 1 átomo de cálcio, 1 átomo de carbono e 3 átomos de
oxigênio.
_______________________________________________________________
g) Trióxido de enxofre: 1 átomo de enxofre e 3 átomos de oxigênio.
_______________________________________________________________
2. Escreva a proporção dos átomos das substâncias. Procure utilizar os nomes das
substâncias e dos elementos químicos, assim você pratica e memoriza os símbolos
destes elementos.
a) Sulfeto de potássio: K2S
__________________________________________________________________
__________________________________________________________________
b) Sulfeto de ferro: FeS2
__________________________________________________________________
__________________________________________________________________
c) Óxido de alumínio: Al2O3
__________________________________________________________________
__________________________________________________________________
d) Óxido de magnésio: MgO
__________________________________________________________________
__________________________________________________________________
e) Permanganato de potássio: KMnO4
__________________________________________________________________
__________________________________________________________________
f)
Hidróxido de sódio: NaOH
__________________________________________________________________
__________________________________________________________________
g) Sulfato de chumbo: PbSO4
__________________________________________________________________
__________________________________________________________________
3. (UnB – DF) Examine as fórmulas representadas a seguir, e julgue os itens abaixo,
marcando C para os corretos e E para os errados.
P4, S8, Br2, CaBr2, Zn, He
a) O número de substâncias simples representada é dois.
b) O número de substâncias compostas representada é quatro.
c) O número de substâncias poliatômicas é um.
d) CaBr2 é uma mistura das substâncias Ca e Br2.
e) A fórmula S8 indica que oito átomos estão ligados formando uma única molécula.
4. (UFSC- SP) Dadas as fórmulas:
a) F2
e) NaCl
b) C2H6O
f) Cgrafita
c) H2O
g) H2
d) Cdiamante
Assinale e escolha a(s) proposição(ões) verdadeira(s):
a) c e d são substâncias compostas.
b) f e g são substâncias simples.
c) b é formada por 3 tipos diferentes de elementos químicos.
d) b e c são formados pelos mesmos elementos químicos.
e) d e f são formados pelo mesmo elemento químico.
5.
(UFSC – SP) O gás carbônico (CO2) é um(a):
a) substância simples.
b) substância composta binária.
c) elemento químico.
d) material homogêneo.
e) material heterogêneo.
6. (FUVEST – SP) A embalagem de um produto comestível “natural” traz impressos os
dizeres: ISENTO DE ELEMENTOS QUÍMICOS. Explique por que essa afirmação é
incorreta. Como ela poderia ser enunciada corretamente?
REFERÊNCIAS
ALMEIDA José Ricardo L.; BERGMAN Nelson; RAMUNNO Franco A. L. Química Geral
– Caderno de Atividades. 3 ed: São Paulo: Harbra, 2015.
ATKINS Peter; JONES Loretta. Princípios de química: questionando a vida moderna
e o meio ambiente. Porto Alegre: Bookman. 2001.
FUNDAÇÃO BRADESCO. Curso de Formação Inicial e Continuada de Ciências da
Natureza. 2014.
FUNDAÇÃO ROBERTO MARINHO. Novo Telecurso de Química – Teleaula 26.
Disponível
em:
<http://globotv.globo.com/fundacao-roberto-
marinho/telecurso/v/telecurso-ensino-medio-quimica-aula-26/1282665/>. Acesso em:
12 maio 2015. 11h25.
ISUYAMA Reiko. Novo Telecurso de Química. 2 ed. Rio de Janeiro. Fundação Roberto
Marinho, pág. 12-20. 2008.
PERUZZO Francisco Miragaia; CANTO Eduardo Leite do. Química na abordagem do
cotidiano. Volume único, 3.ed. São Paulo: Moderna, 2007.
DIAS Diogo Lopes. Substâncias Naturais Orgânicas e Inorgânicas; Brasil Escola.
Disponível
em:
<http://brasilescola.uol.com.br/quimica/substancias-naturais.htm>.
Acesso em: 14 abr. 2016. 15h25min.
USBERCO João; SALVADOR Edgar. Conecte química. Volume único, 1 ed., São
Paulo: Saraiva, 2014.
GABARITO
1.
a) NH3
b) CaCl2
c) MnO2
d) C2H2
e) NaH
f)
CaCO3
g) SO3
2.
a) 2 átomos de potássio : 1 átomo de enxofre
b) 1 átomo de ferro : 2 átomos de enxofre
c) 2 átomos de alumínio : 3 átomos de oxigênio
d) 1 átomo de magnésio : 1 átomo de oxigênio
e) 1 átomo de potássio : 1 átomo de manganês : 4 átomos de oxigênio
f)
1 átomo de sódio : 1 átomo de oxigênio : 1 átomo de hidrogênio
g) 1 átomo de chumbo : 1 átomo enxofre : 4 átomos de oxigênio
3.
a) Errado – são cinco substâncias simples: P4, S8, Br2, Zn e He
b) Errado – apenas uma substância é composta: CaBr2
c) Errado – existem quatro substâncias poliatômicas: P4, S8, Br2, CaBr2
d) Errado – é uma substância composta
e) Certo – o índice oito indica que a molécula é formada por oito átomos.
4.
a) F2: substância simples
b) C2H6O: substância composta formada por três elementos químicos.
c) H2O: substância composta
d) Cdiamante: substância simples
e) NaCl: substância composta
f)
Cgrafita: substância simples
g) H2: substância simples
Proposições verdadeiras: b; c; e
5. Alternativa B.
6. Qualquer material é formado por substâncias químicas, que por vez, são formadas
por átomos de elementos químicos. O que se poderia dizer é o que o alimento é isento
de aditivos alimentares que não são naturais.










