CENTRO DE ESTUDOS FETUS
AVALIAÇÃO DA VITALIDADE FETAL NAS INFECÇÕES CONGÊNITAS
MYLLENA DO VALE MACIEL
Orientador KYVIA BEZERRA MOTA
SÃO PAULO-SP
2010
MYLLENA DO VALE MACIEL
AVALIAÇÃO DA VITALIDADE FETAL NAS INFECÇÕES CONGÊNITAS
Monografia apresentada ao Centro
de Estudo Fetus para aprovação no
Curso de Pós-graduação em
Medicina Fetal sob a orientação da
Prof Kyvia Bezerra Mota.
SÃO PAULO-SP
2010
AVALIAÇÃO DA VITALIDADE FETAL NAS INFECÇÕES CONGÊNITAS
MYLLENA DO VALE MACIEL
Aprovada em ____/____/_____.
ORIENTADORA
Dra. Kyvia Bezerra Mota
BANCA EXAMINADORA
Dr. Airton Roberto Pastore
Professor Livre Docente do Departamento de Radiologia da USP
Especialista em Medicina Fetal (FEBRASGO)
Dra. Viviane Lopes
Mestre em Obstetrícia pela UNIFESP
Título em Ultra-sonografia em Ginecologia e Obstetrícia (FEBRASGO)
Especialista em Medicina Fetal (FEBRASGO)
AGRADECIMENTOS
A Jesus Cristo, aquele tornou tudo em minha vida possível.
Ao meu amor, Bruno, pelo incentivo diário e o carinho que torna a minha vida
cada dia mais feliz.
Aos meus pais, Antônio e Suely, pela dedicação que possibilitou a minha
formação e pelo amor de vocês que me acompanha nesta vida.
Aos meus sogros, Odilon e Mônica, pelo apoio constante e orações que me
abençoam.
Aos meus irmãos, Michelline, Michel e João e a minha sobrinha, Larissa, pelo
sentimento de união que há entre nós.
Aos meus tios Paulo e Pe. Alfredo pelo incentivo sem o qual muitos dos meus
sonhos não seriam possíveis.
Às minhas avós, Maria (in memorian) e Julieta (in memorian) por me
mostrarem a beleza do amor ao próximo em suas ações em vida.
À Kyvia que me ensinou o amor pela ultra-sonografia e a lição mais preciosa de
amizade.
À Charlene que dividiu comigo um sonho pelo qual lutamos ainda hoje.
A todos aqueles que estiveram envolvidos em minha vida e formação, o meu
sincero agradecimento.
RESUMO
As infecções congênitas são um grande desafio para o acompanhamento prénatal, considerando os inúmeros fatores implicados no prognóstico fetal e
conseqüentemente na conduta pré-natal.
Diante dos mais recentes avanços na propedêutica diagnóstica fetal, a
presente
revisão
tem
como
principal
objetivo
sugerir
diretrizes
no
acompanhamento da vitalidade fetal na presença das infecções congênitas que
estão
mais
comumente
associadas
ao
comprometimento
fetal,
mais
especificamente a toxoplasmose, citomegalovirose, infecção pelo parvovírus
B19, rubéola e sífilis.
A composição dos fluxogramas visa o melhor entendimento da sequência na
conduta indicada, facilitando e tornando mais rápido o acesso às informações
contidas no texto de modo a simplificar a leitura.
ABSTRACT
Congenital infections are a major challenge for the prenatal care, considering
the many factors involved in fetal prognosis and therefore the conduct prenatal
care.
Before the most recent advances in fetal diagnostic procedures, this review is
mainly intended to suggest the guidelines for fetal monitoring in the presence of
congenital infections that are most commonly associated with fetal compromise,
in particular toxoplasmosis, cytomegalovirus, parvovirus B19, rubella and
syphilis.
The composition of the flow is aimed at better understanding the behavior of the
sequence indicated, making it easier and faster access to information in the text
to simplify reading.
SUMÁRIO
1 TOXOPLASMOSE...................................................................................pág.9
Introdução...................................................................................................pág.9
Diagnóstico.................................................................................................pág.10
Conduta pré-natal.......................................................................................pág.15
Considerações............................................................................................pág.19
2 CITOMEGALOVÍRUS.............................................................................pág.20
Introdução...................................................................................................pág.20
Diagnóstico................................................................................................pág.21
Conduta pré-natal......................................................................................pág.27
Considerações..........................................................................................pág.29
3 PARVOVÍRUS B19................................................................................pág.29
Introdução..................................................................................................pág.29
Diagnóstico.................................................................................................pág.31
Conduta pré-natal.......................................................................................pág.33
Considerações............................................................................................pág.35
4 RUBÉOLA...............................................................................................pág.36
Introdução...................................................................................................pág.36
Diagnóstico................................................................................................pág.36
Conduta pré-natal......................................................................................pág.39
Considerações...........................................................................................pág.40
5 SÍFILIS...................................................................................................pág.41
Introdução.................................................................................................pág.41
Diagnóstico...............................................................................................pág.42
Conduta pré-natal.....................................................................................pág.44
Considerações finais...............................................................................pág.46
6 CONSIDERAÇÕES FINAIS.................................................................pág.46
7 REFERÊNCIAS BIBLIOGRÁFICAS.....................................................pág.47
1 TOXOPLASMOSE
1.1 INTRODUÇÃO
A infecção pelo Toxoplasma gondii adquirida durante a gestação e sua
transmissão ao feto continua sendo a causa de uma trágica e evitável doença
nos recém-nascidos (Remington, 2006).
Estima-se
que
500-5000
crianças
nascem
a
cada
ano
com
toxoplasmose congênita nos Estados Unidos (Roberts, 1990). No Brasil, entre
25 e 40% das gestantes são soronegativas para a toxoplamose (Spalding,
2000; Vaz, 1990). O risco de infecção aguda durante a gestação é de
aproximadamente 1% e a transmissão fetal ocorre em 30% dos casos, levando
a infecção fetal de gravidade variável (Wierden, 1999; Friedman, 1999).
O Toxoplasma gondii é um parasita intracelular obrigatório, existindo em
três formas: o oocysto, encontrado em fezes de gatos, o taquizoítos (uma
forma de divisão rápida encontrada na fase ativa da infecção), e o bradizoíto
(uma forma de crescimento lento observada nos cistos presentes nos tecidos).
(Montoya, 2004). A infecção materna normalmente resulta da ingesta de
oocistos, ou ainda de bradizoítos ou taquizoítos contidos em carne ou
derivados (Hill, 2002).
O parasita alcança o feto através da placenta, causando vários níveis de
prejuízo, dependendo de sua virulência, da resposta imune da mãe, ou do
período da gestação quando ocorreu a infecção, resultando em morte fetal ou
sintomas clínicos graves (Spalding, 2003).
Apesar de a gravidade do comprometimento fetal ser inversamente
proporcional à idade gestacional, a taxa de transmissão vertical é diretamente
proporcional ao estágio da gestação em que a mãe adquiriu a infecção (Sáfadi,
2003).
Embora haja uma alta prevalência de infecções inaparentes, a
toxoplasmose pode evoluir para uma doença sistêmica grave quando em sua
forma congênita, na qual a mãe, quando infectada pela primeira vez durante a
gravidez, pode apresentar uma parasitemia temporária com lesões focais na
placenta, infectando assim o feto (Dubey, 1977). A morbidade e a mortalidade
associadas à toxoplasmose estão bem documentadas (Petrof & McLeod 2002,
Remington et al. 2006, Boyer et al. 2008, Roberts et al. 2008).
1.2 DIAGNÓSTICO
INFECÇÃO NA GESTANTE
A maior parte das gestantes com infecção aguda não apresentam sinais
ou sintomas óbvios (Remington, 2006; Boyer, 2005). Uma minoria pode
experimentar mal-estar, febrícula e linfadenopatia. Raramente, as gestantes
apresentarão distúrbios visuais devido à coriorretinite toxoplásmica (Garweg,
2005) resultante de uma infecção adquirida recentemente ou da reativação de
uma infecção crônica. Um estudo recente revelou que 52% das mães que
deram
a
luz
a
fetos
congenitamente
infectados
não
relataram
ter
experimentado sintomas de infecção durante a gestação ou identificado um
contato com um fator de risco epidemiológico (Boyer, 2005).
Deste modo, o rastreamento sorológico sistemático para IgG e IgM
contra o Toxoplasma gondii em todas as gestantes deverá ser realizado o
mais precocemente possível (idealmente durante o primeiro trimestre) e o
acompanhamento sorológico mensal ou trimestral das pacientes soronegativas
seria o mais adequado. Na maioria dos casos, o teste realizado precocemente
na gestação pode estabelecer se a infecção não ocorreu, pela ausência de
ambos os anticorpos IgM e IgG, ou se a infecção foi adquirida em um passado
distante, com o resultado de IgG positiva e IgM negativa (Montoya, 2008).
É necessário enfatizar que um anticorpo anti-IgM positivo a qualquer
tempo antes ou durante a gestação não necessariamente significa infecção
adquirida recentemente (Liesenfield, 1997; Wilson, 1997). Os anticorpos IgM
podem persistir por mais de 1 ano após a infecção aguda, e a maior parte dos
resultados positivos para IgM são obtidos em gestantes que adquiriram a
infecção em um passado mais distante, além do período de risco fetal. Estas
pacientes estão cronicamente infectadas (Montoya, 2008).
O teste para avidez de IgG é um exame auxiliar para determinar se a
infecção é aguda ou previamente adquirida quando a IgM é reagente em
pacientes assintomáticas. O teste é baseado na maior força das ligações
iônicas entre antígeno e anticorpos produzidas pelas infecções antigas quando
comparadas com as recentes (Fricker-Hidalgo, 2007). Dependendo do método
usado, a gestante com anticorpos de alta avidez são aquelas que estão
infectadas há mais de 3-5 meses. Quando a avidez é limítrofe pode ser um
fator de confusão e uma interpretação cuidadosa se faz necessária. A baixa
avidez pode persistir por até um ano (Berrebi, 2007).
As figuras 1 e 2 demonstram como poderá ser realizado o
acompanhamento sorológico da gestante.
IgG / IgM
IgG (+)
e
IgM (-)
IgG (-)
e
IgM (-)
Nenhuma
evidência
de infecção
< 18
semanas
Acompanha
mento
sorológico
> 18
semanas
Infecção
prévia à
gestação
IgG (+)
e
IgM (+)
Repetir IgM
e IgG
(em 1 a 3
semanas)
Realizar
teste de
avidez
Infecção
antes ou
durante
gestação
Acompanha
mento de
rotina
Figura 1. Avaliação sorológica da gestante.
IgG (-)
e
IgM (+)
IgG (-)
e
IgM (+)
Acompanha
mento
sorológico
Repetir IgG
em 3
semanas
Teste de Avidez
IgG
Alta
(> 70%)
Baixa
(< 30 %)
Infecção passada ou reativação
Primoinfecção materna
Figura 2: Teste de avidez da IgG.
INFECÇÃO FETAL
O espectro clínico da infecção congênita pelo T. gondii varia de
alterações aparentes ao nascimento com morbimortalidade perinatal elevada
(microcefalia, crescimento intrauterino retardado, hidrocefalia) a uma infecção
subclínica com possibilidade de risco para o desenvolvimento de coriorretinite
e/ou complicações tardias na vida futura (hidrocefalia). O diagnóstico precoce
assim como o tratamento antiparasitário adequado da mãe tem demonstrado
ser capaz de reduzir a taxa de transmissão para o feto e por conseqüência o
número de seqüelas nos casos em que a infecção intrauterina já ocorreu
(Castro, 2001).
AVALIAÇÃO ULTRASSONOGRÁFICA
As alterações ultrassonográficas observadas nesses fetos têm recebido
grande atenção da literatura especializada (Friedman, 1999; Berrebi, 1993;
Cirino, 1999; Hohlfield, 1991). A incidência de anomalias ultra-sonográficas
varia de 18,1% (Berrebi, 1993, Abboud, 1995) a 36,4% (Crino, 1999), estando
associada à idade gestacional da infecção fetal (Berrebi, 1993). As alterações
observadas com maior freqüência são dilatação ventricular e calcificações
intracranianas. Já as anomalias extracerebrais, compatíveis com infecção fetal
sistêmica, são encontradas em 65% dos casos quando a infecção fetal ocorre
no primeiro trimestre e em 25% dos casos quando ocorre no segundo trimestre
da gestação (Hohlfield, 1991).
Estudo realizado por Couto e cols em 2004 mostrou as principais
alterações ultrassonográficas encontradas nos fetos sintomáticos: dilatação
ventricular, calcificações cranianas, espessamento placentário, calcificações
hepáticas, hesplenomegalia, polidrâmnio, derrame pericárdico, esplenomegalia
e restrição de crescimento intra-uterino. (Couto, 2004).
LÍQUIDO AMNIÓTICO
A utilização da biologia molecular revolucionou o acompanhamento prénatal da toxoplasmose, pois, além de permitir a identificação dos fetos
infectados,
possibilitou
que
a
terapia
antiparasitária
fosse
iniciada
precocemente, ainda na gestação (Berrebi, 1993; Abboud, 1995; Crino, 1999;
Hohlfield, 1991).
A amplificação do DNA do Toxoplasma gondii no líquido amniótico às 18
semanas de gestação (período ótimo) ou posteriormente, tem sido usada com
sucesso para o diagnóstico pré-natal da toxoplasmose congênita. (Romand,
2001; Grover, 1990; Hohlfeld, 1994). Suas sensibilidade e especificidade para o
líquido amniótico obtido antes das 18 semanas de gestação não foram
estudadas; além disso, o procedimento realizado precocemente na gestação
está associado a um risco mais alto para o feto e é menos útil.
Um estudo sobre a rotina do uso da PCR no líquido amniótico obtido às
18 semanas de gestação ou mais foi relatado na França apresentando
sensibilidade de 64% para o diagnóstico da infecção congênita no feto, um
valor preditivo negativo de 88%, e uma especificidade e valor preditivo positivo
de 100% (ou seja, um resultado positivo significa a infecção do feto) (Romand,
2001).
CORDOCENTESE
Através da cordocentese, pode-se ter acesso ao sangue fetal, no qual
podemos diagnosticar a infecção através da pesquisa direta do parasita no
sangue fetal, bem como verificar a presença de IgM específica para o mesmo,
ou ainda verificar achados inespecíficos como IgM total elevada ou presença
de eosinofilia.
Figura 3. Achados específicos e inespecíficos na toxoplasmose congênita.
1.3 CONDUTA PRÉ-NATAL
A prevenção da toxoplasmose humana é baseada no cuidado de evitar a
ingestão de cistos e oocistos encontrados no ambiente (Lappalainen, 2004)
Não há vacina para proteger os seres humanos contra esta doença. A
prevenção primária, quando aplicada durante os cuidados pré-natais, pode
reduzir as infecções durante o primeiro trimestre em mais de 63%. Consiste
basicamente em programas educacionais e de saúde pública, recomendando à
gestante evitar contato com material potencialmente contaminado com fezes de
gatos e evitar a ingestão de carne crua ou mal cozida ou subprodutos. O uso
de luvas quando manusear a terra também está fortemente recomendado
(Foulon, 1992).
A prevenção secundária consiste no diagnóstico precoce da mãe, do
feto, e do recém-nascido e em evitar ações que possam causar a transmissão
do parasita, através da intervenção terapêutica em gestantes e crianças que
apresentam a infecção aguda. A prevenção terciária está concentrada no
diagnóstico precoce através da dosagem de anticorpos específicos IgA e IgM
no sangue do recém-nascido, permitindo a terapêutica a fim de prevenir ou
diminuir os riscos de seqüelas (Hall, 1992)
Uma vez estabelecido que os resultados dos testes sorológicos são
consistentes com infecção adquirida recentemente e que a aquisição da
infecção durante as primeiras 18 semanas de gestação ou pouco antes do
período concepcional não pode ser excluída, uma tentativa de evitar a
transmissão vertical do parasita através do tratamento com espiramicina é
recomendada por muitos pesquisadores nos Estados Unidos e na Europa.
Se a infecção fetal for confirmada, através de um resultado positivo para
PCR no líquido amniótico às 18 semanas de gestação ou posteriormente, é
recomendado o tratamento com pirimetamina, sulfadiazina e ácido folínico (se
a paciente já estiver tomando a espiramicina, a recomendação é alternar com
esta combinação)(Gilbert, 2003).
A cordocentese pode ser realizada entre 20-24ª semanas de gestação
(preferencialmente na 23ª semana) naquelas pacientes que adquiriram a
infecção até 16 semanas. Para as infecções adquiridas entre 17- 25 semanas,
a coleta de sangue deve ser realizada em média, quatro semanas após a
soroconversão materna. Após 25 semanas, recomenda-se a terapia materna
com espiramicina até o termo, controle ultrassonográfico quinzenal e avaliação
neonatal (Daffos, 1989, Blanc, 1988).
Apesar dos efeitos colaterais do tratamento combinado, devido às altas
taxas de transmissão observadas após 18 semanas de gestação, Montoya e
cols sugerem que o tratamento com pirimetamina, sulfadiazina e ácido folínico
seja também usado em pacientes que adquiriram a infecção após 18 semanas
de gestação, em uma tentativa de evitar a infecção fetal e, se a transmissão
ocorreu (PCR positiva), de promover o tratamento do feto. A pirimetamina não
é utilizada mais cedo por ser potencialmente teratogênica (Montoya, 2004).
Recentemente foi relatado o resultado clínico das crianças com infecção
congênita, cujas mães adquiriram a infecção no primeiro trimestre da gestação,
que apresentaram exames ultrassonográficos normais e que receberam
espiramicina durante a gestação. Apesar de ser esperado que essas crianças
apresentassem danos graves, o seguimento após 2 anos não diferia
significantemente daquelas que nasceram de mães que adquiriram a infecção
durante o segundo e o terceiro trimestres. Os autores concluíram que, nestas
circunstâncias a resolução da gestação não era indicada. Entretanto o
tratamento apropriado é essencial, e os achados ultrassonográficos devem
estar livres de qualquer anomalia. Além da US, a ressonância magnética tem
sido
utilizada
na
procura
por
calcificações
intracranianas
e
outras
anormalidades no feto (Berrebi, 2007).
A figura 4 demonstra como poderá ser realizado o tratamento da
toxoplasmose de acordo com a idade gestacional em que ocorreu a
soroconversão, conforme proposta de Montoya em estudo publicado em 2004.
Gestante com diagnóstico de
toxoplasmose
< 18 semanas
≥ 18 semanas
Espiramicina
USG
PCR após 18 semanas
Pirimetamina +
Sulfadiazina +
Àcido Folínico
Figura 4. Tratamento da toxoplasmose de acordo com a idade gestacional em
que ocorreu a soroconversão (Montoya, 2004)
PCR
Negativa
Positiva
Continuar espiramicina até o parto
Intercalar espiramicina + sulfadiazina +
pirimetamina + ácido folínico
Figura 5. Tratamento da toxoplasmose de acordo com o resultado da PCR.
1.4 CONSIDERAÇÕES
Atualmente a avaliação da vitalidade nos fetos cujas mães são
sabidamente portadoras de toxoplasmose aguda adquirida na gestação está
baseada
na
confirmação
da
infecção
fetal
através
dos
achados
ultrassonográficos e da propedêutica invasiva (PCR no líquido amniótico e
cordocentese). Observando que o tratamento para esta patologia tem mostrado
boa eficácia, torna-se imprescindível o rastreamento sorológico de rotina no
pré-natal com objetivo de identificar as mães portadoras e dar sequência à
investigação sobre o possível comprometimento fetal e posteriormente ao
tratamento adequado conforme descrito.
2 CITOMEGALOVÍRUS
2.1 INTRODUÇÃO
O citomegalovírus humano (CMV) é a principal causa de infecção
congênita nos países desenvolvidos, com incidência variando entre 0,2 e 2,2%
de todos os nascidos vivos (Guerra, 2000; Revello, 2000). No Brasil, estudos
mostram prevalência de 2,1% a 6,2% dos recém-nascidos (Yamamoto, 2001;
Santos, 2000). A taxa de transmissão após infecção primária da mãe é de
aproximadamente 40%.
Somente 10-15% das crianças infectadas com CMV são sintomáticas ao
nascimento, e os sintomas variam desde leves a doença que ameaça a vida. O
restante (85-90%) das crianças é assintomático ao nascimento, mas 10%
desenvolverão complicações posteriormente, principalmente defeitos do
neurodesenvolvimento e perda auditiva neurossensorial. Entre as gestantes
com infecção recorrente, a taxa de transmissão para o recém-nascido está em
torno de 1%. Apesar de uma imunidade preexistente na mãe, os dados
epidemiológicos sugerem que a frequência e a severidade dos sintomas,
podem variar de forma semelhante ao que ocorre na infecção primária por
CMV (Gayant, 2002; Gayant, 2003).
A história natural da infecção intrauterina por CMV não é bem
conhecida, mas está claro que os fetos são prejudicados pelo vírus
irreversivelmente antes do nascimento. Estas crianças não serão muito
beneficiadas com a terapia pós-natal, mas se os fetos infectados puderem ser
detectados antes deste estágio irreversível, o tratamento intra-útero (quando
possível) poderá ter um efeito significativo no curso da doença (Whitley, 1997).
2.2 DIAGNÓSTICO
INFECÇÃO NA GESTANTE
No momento, não há um protocolo mundialmente aceito para o
rastreamento da infecção intrauterina por CMV durante a gestação e o período
neonatal. Avaliar o sangue materno para a presença de IgM CMV detectaria
aquelas mulheres sob risco de transmitir o vírus para o feto. Entretanto a
presença de IgM pode variar entre as diferentes situações clínicas, assim como
durante as fases aguda e de convalescença da infecção primária por CMV, ou
na persistência do anticorpo IgM (Revello, 2002). Diante de uma IgM positiva,
na ausência de anticorpos IgG, estes devem ser repetidos nas próximas 2 a 3
semanas posteriores para demonstrar a soroconversão. Se a IgG persiste
como negativa, será considerado um falso positivo da IgM, que pode se
apresentar como uma reatividade heteróloga com outros herpes-vírus,
especialmente com o vírus do Epstein-Baar (Stagno, 1986)
Se a gestante apresenta IgM e IgG positivas na primeira determinação,
não se pode assegurar que a infecção seja muito recente, já que os anticorpos
IgM se tornarão negativos após 3 a 4 meses, podendo persistir até 9 meses
após a primoinfecção (Stagno, 1986). Além disso, a IgM pode positivar-se em
gestantes previamente imunes por reativação da infecção viral (Pérez, 2005).
Portanto é indispensável realizar o exame de avidez dos anticorpos IgG. A
presença de anticorpos IgM e anticorpos IgG de alta avidez no primeiro
trimestre pode dever-se a uma infecção pré-gestacional, ou com menor
freqüência, a uma reativação ou reinfecção viral. Uma baixa avidez nos três
meses
anteriores
a determinação,
indica
uma
primoinfecção
recente
(Lazzarotto, 2004; Lazarroto, 2008).
IgM (+)
IgG
ALTA
INFECÇÃO
PASSADA OU
REATIVAÇÃO
POSITIVA
NEGATIVA
AVIDEZ IgG
REPETIR EM 03
SEMANAS
BAIXA
PRIMOINFECÇÃO
MATERNA
Figura 6. Acompanhamento sorológico da gestante com IgM positiva.
INFECÇÃO FETAL
Durante a gestação a transmissão para o feto ocorre em 40% dos casos
de infecção materna primária (Demler, 1991). Entre as mulheres nas quais os o
vírus reativou durante a gestação, taxa de transmissão ao feto é menor que 2%
(Yow, 1988). O diagnóstico é complicado, pois a evidência de infecção ativa na
mãe não fornece informações sobre se o feto foi infectado, se a criança
desenvolverá doença grave ou problemas de saúde na vida posteriormente
(Jones, 2000).
Duas questões devem ser consideradas em relação ao diagnóstico
antenatal da infecção por CMV. A primeira questão é se o feto está infectado, e
a segunda é se o feto está sintomático, e se está, o quão extensa é a infecção.
O objetivo do acompanhamento pré-natal dos fetos com infecção
congênita por CMV é detectar aqueles que desenvolverão deficiência
neurológica grave. Estes fetos poderiam ser selecionados para interrupção da
gestação, a depender da legislação corrente no país (Picone, 2004). Em todos
os casos, recomenda-se uma investigação pré-natal minuciosa.
EXAMES DE IMAGEM
As características ultrassonográficas dos fetos acometidos pela infecção
por CMV são numerosas e não específicas. Apesar de faltar estudos
longitudinais e de a imagem pós-natal ser baseada principalmente na
tomografia computadorizada, (Boppana, 1997; Noyola, 2001) uma imagem
anormal do cérebro à ultrassonografia (US) e à ressonância magnética (RM)
costuma ser encontrada em neonatos sintomáticos. (Steilin, 1996; Malinger,
2003) O desenvolvimento técnico no campo da RM, especialmente a
possibilidade de realizar sequências ultrarrápidas, tem possibilitado o estudo do
cérebro fetal e estudos sobre a anatomia e condições patológicas têm sido
publicados (Malinger, 2004).
O espectro de lesões cerebrais sugestivas de infecção pelo CMV é
heterogêneo, e são principalmente múltiplas e de ocorrência tardia (Steilin,
1996). A anormalidade na mielinização e na formação dos giros cerebrais do
feto são armadilhas para o exame ultrassonográfico do cérebro fetal, e o
desenvolvimento da RM fetal é um recente e seguro elemento valioso para a
completa avaliação dos fetos de alto risco, apesar de a RM ser menos sensível
que a US na detecção de calcificações cerebrais. (Barkovich and Lindan, 1994;
Soussotte, 2000; Malinger, 2003). Entretanto, Malinger e cols demonstraram
que uma neurosonografia é equivalente a uma RM e melhor do que US de
referência para o diagnóstico das anormalidades do cérebro fetal (Malinger,
2004).
A RM parece ser uma importante ferramenta na avaliação pré-natal da
infecção congênita pelo CMV, principalmente em duas situações. Nos casos
com anormalidades graves a US, a RM sempre confirma os achados
diagnósticos, e as vezes revela outras anomalias, permitindo uma informação
mais completa aos pais e um prognóstico mais acurado. Entretanto, não
modifica o prognóstico. Nos casos com características extracerebrais isoladas,
a RM revelou anomalias cerebrais em 07 dos 14 casos. Esta situação é mais
interessante porque a informação dada pela RM modifica o prognóstico
(Piccone, 2008).
LIQUIDO AMNIÓTICO
A detecção do CMV no líquido amniótico através de cultura viral ou PCR
é considerada efetiva na diferenciação entre os fetos infectados dos não
infectados (Lazzarotto, 1998; Lipitz, 1997; Revello, 2002). Devido ao atraso na
passagem transplacentária do vírus e porque a imaturidade renal do feto antes
das 21 semanas impede a eliminação do vírus no LA, é recomendável que a
amniocentese seja realizada após 21 semanas de gestação e seguindo um
intervalo de pelo menos 06 semanas após a infecção materna ter sido
diagnosticada com a finalidade de se obter resultados mais confiáveis
(Goegebuer, 2009).
A cultura do vírus no LA é 100% específica, porém apresenta muitos
falsos negativos. O melhor método diagnóstico é a PCR (reação da polimerase
em cadeia), que apresenta uma excelente sensibilidade (90-98%) e
especificidade (92-98%)(Barquero-Artigao, 2009).
O valor dos resultados da PCR quantitativa para CMV no LA como um
indicador prognóstico de infecção congênita já é mais controverso. Alguns
autores acreditam que uma alta carga viral no líquido amniótico está associada
com um alto risco de infecção sintomática para o feto. Entretanto, estudo
publicado por Goegebuer e colaboradores em março de 2009, demonstrou que
não há correlação entre a carga viral do CMV no LA e o prognóstico fetal. A
quantificação da carga viral do CMV no LA, portanto, não deve ser considerado
um marcador confiável em relação à gravidade da doença no feto (Goegebuer,
2009).
As figuras 6 e 7 mostram como pode ser feita a avaliação da vitalidade fetal
através da PCR e dos exames de imagem, respectivamente.
Figura 6. Diagnóstico da infecção fetal através da PCR.
Figura 7. Avaliação por imagem e conduta adequada ao feto infectado.
2.3 CONDUTA PRÉ-NATAL
VACINA
A
Infecção
congênita
por
citomegalovírus
(CMV)
causa
comprometimento auditivo, cognitivo e neurológico. Com base na análise
custo-efetividade, o desenvolvimento de uma vacina para a prevenção a
infecção por CMV foi listada no topo das prioridades para os Estados Unidos
por um comitê do Instituto de Medicina em 2001(Stratton, 2001). Apesar de os
primeiros estudos clínicos para criação de uma vacina contra o CMV terem se
iniciado há 30 anos, uma vacina efetiva para a prevenção da infecção pelo
CMV permanece um sonho. (Plotkin, 1984).
Pass e colaboradores publicaram em 2009, estudo placebo-controlado,
randomizado, duplo cego, no qual foi avaliada vacina que consistia em CMV
recombinante. A eficácia da vacina foi de 50% (95% de intervalo de confiança
7-73%). A conclusão dos autores foi de que a vacina tem o potencial de
diminuir a incidência dos casos de infecção materna e congênita pelo CMV
(Pass, 2009).
O pessimismo geral em relação à criação de uma vacina é, ao menos
em parte, resultante dos estudos que mostraram que infecções repetidas com
novas cepas do CMV ocorrendo em pessoas que haviam sido infectadas
anteriormente. Além disso, a infecção congênita pode ser devida tanto a
infecção materna primária durante a gestação, como por infecções em
mulheres com imunidade ao CMV antes da gestação (Pass, 2009).
GLOBULINA HIPERIMUNE
Estudo realizado por Nigro e colaboradores demonstrou que o
tratamento com globulina hiperimune na dose de 100 U/Kg pode diminuir os
efeitos
patogênicos
do
CMV
tanto
pela
neutralização
ou
efeitos
imunomodulatórios. A imunoglobulina parece ser menos efetiva para a
prevenção da infecção do que para o tratamento dos fetos. Apesar de o feto
estar infectado, entretanto, globulina hiperimune presumivelmente reduz a
reação inflamatória na placenta ou no feto, ou em ambos, resultando em
aumento do fluxo sanguíneo fetal com melhora da nutrição e oxigenação fetal.
Este mecanismo pode também influenciar na resolução das anormalidades
ultrassonográficas aparentemente associadas com a terapia com globulina
hiperimune, tendo em vista que a maioria dos sinais e sintomas da infecção
congênita geralmente se resolve durante as primeiras semanas de vida,
presumivelmente devido à melhora da nutrição e oxigenação (Nigro, 2005)
TRATAMENTO ANTIVIRAL DURANTE A GESTAÇÃO
Os antivirais com maior atividade frente ao CMV (ganciclovir, cidofovir e
foscarnet) têm efeitos teratogênicos em animais e não são recomendados
durante a gestação, entretanto, nos casos em que foi administrado ganciclovir
a mulheres gestantes, foram alcançadas concentrações adequadas no líquido
amniótico e no sangue fetal e não se observou efeitos teratogênicos no feto.
Um estudo recente avaliou o tratamento com valaciclovir em 20 gestantes com
infecção fetal demonstrada por PCR em líquido amniótico. A dose administrada
foi de 8 g/ dia desde a 28 semana até a finalização ou interrupção da gestação
(média de 07 semanas). O valaciclovir conseguiu diminuir a carga viral do feto,
e 10 dos 13 recém-nascidos não apresentaram seqüelas da infecção após um
ano se seguimento (Barquero-Artigao, 2009).
2.4 CONSIDERAÇÕES
Apesar de a infecção pelo citomegalovírus não apresentar alterações
específicas ao ultrassom, os constantes avanços das técnicas de imagem e da
biologia molecular, possibilitaram a avaliação da vitalidade dos fetos
acometidos pela infecção e, conseqüentemente permitiram que a conduta em
cada caso pudesse ser definida com maior precisão.
Além disso, estudos recentes sobre a possibilidade de tratamento da
infecção fetal através da globulina hiperimune e do uso de antivirais fortalecem
a expectativa de que no futuro possamos fazer uso de um tratamento efetivo
para esta infecção congênita tão freqüente e comprometedora para o feto.
3 PARVOVÍRUS B19
3.1 INTRODUÇÃO
O parvovirus B19 é um pequeno DNA vírus, não envelopado, que infecta
exclusivamente os seres humanos. Após a infecção, a replicação ocorre
primeiramente nos eritrócitos e eritroblastos, o que pode desencadear anemia
em indivíduos predispostos. Os adultos saudáveis geralmente apresentam
apenas sintomas leves. Em contraste, indivíduos imunocomprometidos,
incluindo fetos, podem desenvolver anemia crônica grave, necessitando de
tratamento imediato (Levi, 1997).
Apesar de a infecção em adultos ser geralmente leve, a infecção por
parvovírus no feto pode causar abortamento espontâneo no período inicial da
gestação e anemia aplástica, hidropsia fetal não imune e óbito fetal intra-útero
(Forestier, 1999). Estas complicações são mais frequentemente descritas
quando a infecção materna ocorre até a 20ª semana gestacional (Da Silva,
2006).
Estudos de prevalência de anticorpos IgG em gestantes indicam uma
variação muito grande, de 35-81%, dependendo da população estudada, sendo
que o número de casos de hidropsia fetal atribuídos ao parvovírus B19 pode
aumentar em anos epidêmicos de eritema infeccioso, atingindo até 13,5% das
gestantes susceptíveis não imunes. Gestantes cuja atividade ocupacional exige
contato freqüente com crianças e que possuem filhos menores de 10 anos de
idade são mais propensas à infecção aguda por parvovírus B19 (Da Silva,
2006).
O parvovírus tem um tropismo pelos precursores de eritrócitos de divisão
rápida, particularmente pronormoblastos e normoblastos, nos quais ele se
replica até altos títulos, destruindo as células infectadas (Guerrero 2006;
Cunninghan, 2006). Os fetos podem ser especialmente vulneráveis à anemia
por infecção pelo parvovírus B19 devido à curta meia-vida das células
vermelhas e a uma possível resposta imunológica ineficaz que pode conduzir a
uma infecção crônica. Casos raros na literatura já foram relatados em que o
parvovírus B19 pôde infectar outros tipos de células, causando encefalite e
miocardite (Guerrero 2006; Cunninghan, 2006; Von Kaisenberg, 2001).
A transmissão transplacentária pode ocorrer em qualquer tempo da
gestação. O risco de transmissão da mãe para o feto varia de 10 a 35%, sendo
mais freqüente no primeiro e segundo trimestres. A média de tempo entre o
diagnóstico e a resolução está em torno de 06 semanas (Guerrero, 2006;
Tolfvenstan, 2001). Apesar de o vírus poder ser encontrado em qualquer
trimestre, o segundo trimestre parece estar associado ao um maior risco de
perda fetal. Também se notou, sem que a relação causa-efeito fosse provada,
que havia uma incidência deste vírus de 2-3% em todos os abortos
espontâneos (Van Elsacker, 1989).
3.2 DIAGNÓSTICO
INFECÇÃO NA GESTANTE
Os achados clínicos coletados conduzem ao eritema infeccioso. As
diferentes fases da doença descrita apresentarão diferentes achados ao exame
físico. A primeira fase da doença provoca sintomas inespecíficos, incluindo
febre, mal-estar e outros sintomas virais. A paciente pode também apresentar
“rash” eritematoso fotossensível na face que se sobressai na zona nasal e
periorbital. A segunda fase, que é puramente clínica, sem qualquer mudança
nas imunoglobulinas, pode mostrar exantema maculopapular no tronco e nas
extremidades (Al-Khan, 2003).
O diagnóstico específico pode ser realizado pelos seguintes métodos:
Se uma mulher gestante foi exposta ao parvovírus B19, deve-se solicitar uma
avaliação sorológica para IgG e IgM específica para parvovírus assim que
possível. Resultado positivo para IgG e IgM indica que a infecção ocorreu há 7-
120 dias (possível risco para o feto). IgG negativa e IgM positiva indica infecção
aguda (alto risco para o feto).(Cunninghan, 2006)
INFECÇÃO FETAL
ULTRASSONOGRAFIA
Durante o primeiro trimestre, os fetos infectados com o parvovírus B19
podem apresentar translucência nucal aumentada. No segundo e no terceiro
trimestres, pode-se suspeitar da infecção fetal utilizando a ultrassonografia,
com a presença de hidropsia fetal, ascite, derrame pleural e pericárdico,
adelgaçamento da pele, cardiomiopatia hipertrófica, hepatoesplenomegalia,
hidrocefalia, microcefalia, calcificações intracranianas, placentomegalia, e
alterações no volume de líquido amniótico (Guerrero, 2006)
Anemia fetal está associada com circulação hiperdinâmica; deste modo,
através da mensuração pelo Doppler da velocidade do pico sistólico da artéria
cerebral média em gestações complicadas pela infecção por parvovírus B19,
através do aumento dos valores das velocidades previamente ao surgimento
de sinais ultrassonográficos de hidropsia (Delle Chiaie, 2001).
LÍQUIDO AMNIÓTICO
A PCR é a ferramenta clínica mais útil para diagnosticar a infecção e
detecta se o DNA viral está presente no sangue, líquido amniótico ou outros
líquidos corporais tanto em tecidos frescos como naqueles embebidos em
parafina. Um resultado positivo é indicativo de viremia/infecção. Microscopia
eletrônica também pode identificar o parvovírus B19 nos tecidos (Al-Khan,
2003).
CORDOCENTESE
A cordocentese pode ser realizada para fazer o teste para IgM
específica para o parvovírus B19 no sangue fetal. Além disso, pode ser
utilizada ainda para avaliar o grau de anemia do feto, a qual geralmente é
grave e acompanhada de neutropenia e plaquetopenia (pancitopenia) (Naides,
1989).
3.3 CONDUTA PRÉ-NATAL
Observou-se
que
3-19%
das
mulheres
gestantes
sofrerão
soroconversão para IgM positiva após a exposição ao parvovírus B19, com
uma taxa de transmissão vertical de 33%. (Van-Elsacker, 1989).
A prevenção da infecção é difícil, pois ocorrem infecções inaparentes em
30% dos indivíduos e nos casos de eritema infeccioso, o paciente já não é mais
transmissor quando há o surgimento do exantema típico. Não existe ainda uma
vacina disponível licenciada para a prevenção da infecção entre as gestantes
suscetíveis (Markeson, 1998; Young, 2004).
O tratamento da infecção pelo parvovírus B19 é dependente da idade
gestacional do feto. Se a mãe tem IgM positiva e IgG negativa (sugerindo
infecção recente), pelo menos até 20 semanas de gestação, nenhum
tratamento é necessário. Isto porque a infecção B19 está relacionada a um
risco muito pequeno de anomalias congênitas. Estas pacientes deveriam ser
submetidas a exames seriados de ultrassonografia para monitorar o
desenvolvimento de hidropisia fetal (Fairley, 1995).
A avaliação da artéria cerebral média é o mais sensível teste não
invasivo para anemia intrauterina (Fairley, 1995). Este teste pode ser usado
como uma ferramenta de diagnóstico e rastreamento para monitorar dano
intrauterino (hemólise / anemia)(Cosmi, 2002).
Observando que a maior manifestação da infecção pelo parvovírus é a
anemia, a transfusão intraútero deverá ser considerada se a cordocentese
identificar, em uma amostra de sangue fetal, o nível de hemoglobina < 10g/dL
(Lynch, 1989). Se o diagnóstico for feito a uma IG menor que 28 semanas, a
transfusão poderá ser realizada tanto intra-abdominal como por punção do
cordão umbilical (Makenson,1998; Brown, 1994).
Se anemia / hidropsia severa intrauterina for diagnosticada a uma idade
gestacional (IG) superior a 28 semanas, deve-se considerar realizar o parto e
proceder ao tratamento extra-útero (Al-Khan, 2003) A transfusão fetal
raramente é indicada após 33 a 34 semanas de gestação, quando o parto traz
chance de 95% de sobrevivência para a criança (Hsu, 2007).
A terapia com imunoglobulina intravenosa tem sido utilizada com
sucesso no período pós-natal. Ela tem se mostrado efetiva na resolução da
viremia e na melhora dos índices de células vermelhas (Cunninghan, 2006).
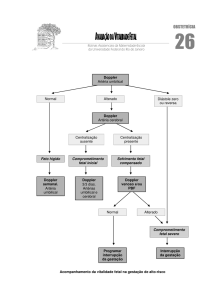
Figura 8. Acompanhamento da vitalidade fetal e tratamento adequado na
infecção pelo parvovírus B19.
3.4 CONSIDERAÇÕES
A infecção pelo parvovírus B19 na gestação pode provocar abortamento
precoce e óbito fetal. Entretanto, atualmente com os meios de vigilância do
bem estar fetal, como ultrassonografia com Doppler, PCR no líquido amniótico
e a cordocentese, é possível não só comprovar a infecção fetal, como
acompanhar as repercussões da infecção e tratar a anemia fetal, a principal
conseqüência da infecção, através da transfusão intra-útero.
4 RUBÉOLA
4.1 INTRODUÇÃO
A rubéola é uma doença leve que se apresenta com febre e erupção
cutânea. Entretanto, sua importância para a saúde publica está relacionada aos
efeitos teratogênicos quando a rubéola é adquirida nos primeiros meses da
gestação. A infecção do feto pela rubéola pode resultar em óbito fetal ou no
nascimento de uma criança com sérios defeitos congênitos. A Síndrome da
Rubéola Congênita (SRC) é uma importante causa de cegueira, surdez,
cardiopatia congênita e retardo mental (OMS, 2003).
Estima-se que a SRC ocorra em mais de 85% em crianças nascidas de
mães que foram infectadas nas primeiras 12 semanas de gestação, enquanto
os defeitos congênitos são raros após as 20 semanas (Plotkin, 1994). Em
geral, quando mais precocemente ocorre a infecção na gestação, maior o risco
para a SRC. O risco de SRC em crianças nascidas de mães previamente
imunizadas que se reinfectaram durante a gestação é mínimo (Watson, 1998;
MMWR, 1997).
DIAGNÓSTICO
INFECÇÃO MATERNA
O vírus é transmitido de pessoa para pessoa através de partículas em
aerossol. Os sintomas clínicos da rubéola adquirida são geralmente leves, e
muitas infecções são assintomáticas. A primeira manifestação clínica é
usualmente erupção cutânea maculopapular após 16 a 20 dias da exposição e
geralmente se apresenta primeiramente na face e depois se espalha pelo
tronco e em seguida pelas extremidades. Outros sintomas típicos incluem febre
baixa, linfadenopatia, irritação na orofaringe e mal estar geral. A linfadenopatia
também pode ser característica, envolvendo os linfonodos cervicais posteriores
e os occipitais, os quais podem persistir após a erupção cutânea ter se
resolvido (Lee, 2000.)
INFECÇÃO FETAL
Quando
há
diagnóstico
de
soroconversão
materna,
torna-se
imprescindível avaliar o feto quanto à possibilidade de ter ocorrido transmissão
vertical
da
patologia.
É
importante
considerar
que
os
achados
ultrassonográficos são inespecíficos e que a confirmação da infecção do
concepto deverá ser realizada através da análise do líquido amniótico,
vilosidade coriônica ou sangue fetal, especialmente quando a soroconversão
materna ocorreu até a 16ª semana (Daffos, 1984).
LÍQUIDO AMNIÓTICO
Assim como ocorre em outras infecções congênitas, a pesquisa do
material genético do vírus poderá ser realizada no líquido amniótico com o
objetivo de comprovar ou não a infecção do feto. Estudo publicado em 2005
por McIver e cols demonstrou a importância do desenvolvimento da técnica de
PCR multiplex na qual com volume menor de amostra é possível avaliar a
presença do material genético de vários agentes patogênicos como o T. gondii
e vírus como o CMV, herpes vírus e outros, incluindo o vírus da rubéola. Desse
modo, para qualquer síndrome clínica em que podem estar envolvidos vários
agentes patogênicos, especialmente nos casos de infecção congênita, a nova
técnica parece bastante promissora (McIver, 2005).
CORDOCENTESE
O diagnóstico da infecção congênita poderá ser realizado através da
cordocentese a partir da 22ª semana de gestação pela pesquisa da IgM
específica para rubéola. O diagnóstico pode ser igualmente evocado pela
presença da síndrome biológica da rubéola congênita, a qual associa:
eritroblastose, anemia, trombocitopenia, aumento de gamaglutamiltransferase
(GGT) e desidrogenase lática (LDH), e presença de interferon. A pesquisa
direta do vírus também pode ser realizada através de cultura (Daffos, 1984).
Figura 9. Avaliação da vitalidade fetal através do líquido amniótico e sangue
fetal.
Figura 10. Sinais inespecíficos da Síndrome da Rubéola Congênita.
4.3 CONDUTA PRÉ-NATAL
A conduta deve ser definida considerando especialmente o período da
gestação em que ocorreu a soroconversão materna. A propedêutica fetal
invasiva está indicada quando o evento ocorreu antes das 16 semanas de
gestação, quando o risco para o concepto é maior.
Quando a soroconversão materna ocorreu após a 16ª semana, orientase o acompanhamento ultrassonográfico da gestação em períodos mais curtos
do que o habitual e o acompanhamento pré-natal por um especialista em
medicina fetal. A avaliação através de ecocardiografia fetal também está
indicada, assim como em todas as infecções congênitas.
DIAGNÓSTICO DA
INFECÇÃO MATERNA
< 20 SEMANAS
> 20 SEMANAS
Propedêutica invasiva
Acompanhamento US
Propedêutica invasiva?
Figura 11. Avaliação da vitalidade fetal na infecção fetal pelo vírus da rubéola
Assim, o prognóstico fetal e a conduta do pré-natalista estão vinculadas
ao período em que ocorreu a soroconversão materna. Após a confirmação do
diagnóstico de infecção do concepto, a periodicidade das consultas e os
métodos de avaliação se modificam.
Quando comprovada a infecção fetal até 12 semanas, considera-se o
prognóstico fetal grave, indicando-se o controle ultrassonográfico quinzenal,
ecocardiografia seriada e acompanhamento com especialista. Se a infecção
ocorreu entre 13 e 16 semanas o feto tem prognóstico considerado
comprometido, sendo orientada a avaliação ultrassonográfica quinzenal e
pesquisa da acuidade auditiva às 28 semanas. Se o feto não foi infectado,
considerar acompanhamento ultrassonográfico quinzenal e ecocardiografia de
controle (Hohlfeld, 1990).
Acompanhamento fetal
< 12 semanas
13 a 16 semanas
> 16 semanas ou não
infectado
Prognóstico fetal grave
USG quinzenal
Eco fetal
Prognóstico comprometido
USG quinzenal
Controle acuidade auditiva
28 sem
Eco fetal
Melhor prognóstico
USG quinzenal
Eco fetal
Figura 12. Acompanhamento fetal relacionado à infecção pela rubéola
4.4 CONSIDERAÇÕES
Apesar de não haver tratamento específico para a rubéola, é possível,
através dos atuais métodos disponíveis de avaliação laboratorial, compreender
os possíveis danos ao concepto provocados pelo vírus da rubéola. Além disso,
nossa maior arma contra a rubéola congênita continua sendo a prevenção
através da vacina contra o vírus que deverá ser administrada especialmente
nas mulheres em idade fértil.
5 SÍFILIS
5.1 INTRODUÇÃO
A sífilis é causada pelo espiroqueta Treponema pallidum e se manifesta
como um processo infeccioso sistêmico. A sífilis pode ser transmitida
verticalmente, em geral através da placenta: o risco de infecção fetal aumenta
com a idade gestacional. A transmissão vertical pode ocorrer ocasionalmente
durante o parto se houver lesões genitais maternas (Manjeroni, 2007). As
conseqüências da sífilis congênita incluem prematuridade, baixo peso ao
nascer, hidropsia não imune, e óbito intrauterino (Chakraborty, 2008).
Avanços importantes no diagnóstico e tratamento da sífilis têm sido
obtidos desde que o organismo causador, Treponema pallidum, foi descoberto
em 1905 por Schaudinn e Hoffmann. Apesar destes feitos, a sífilis permanece
como um grande problema de saúde pública em muitos países em
desenvolvimento, e tem ressurgido nos países desenvolvidos (OMS, 1997;
Tichonova, 1998).
No Brasil, no ano de 2005 foram notificados e investigados 5.792 casos
de sífilis congênita em menores de um ano de idade. A incidência passou de
1,3 casos por mil nascidos vivos em 2000 para 1,9 casos por mil nascidos vivos
em 2005 (Norma Técnica CDC, 2008).
A sífilis congênita é decorrente da disseminação hematogênica do
Treponema Pallidum da gestante não tratada ou inadequadamente tratada para
o seu concepto, por via transplacentária. A transmissão pode ocorrer em
qualquer fase da gestação e em qualquer estágio da doença, com
probabilidades de 50% a 100% na sífilis primária e secundária, 40% na sífilis
latente precoce e 10% na sífilis latente tardia. É possível transmissão direta no
canal do parto. Ocorrendo a transmissão da sífilis congênita, cerca de 40 %
dos casos podem evoluir para aborto espontâneo, natimorto e óbito perinatal.
A sífilis congênita pode ser evitada se a infecção materna for detectada
e tratada por ocasião do segundo trimestre. O rastreamento pré-natal para
prevenção da sífilis congênita tem sido o principal foco dos programas de
controle da sífilis (OMS, 1999).
5.2 DIAGNÓSTICO
INFECÇÃO MATERNA
Os testes sorológicos permanecem como o método de escolha para o
diagnóstico de sífilis (Peeling, 2004). O VDRL (Veneral Diseases Research
Laboratory) e RPR (Rapid Plasma Reagin) são testes simples, rápidos, baratos
e apresentam excelente sensibilidade, especialmente na infecção precoce
(OMS, 1999). Em gestantes, a RPR pode apresentar falso positivo de 28%
(Watson-Jones, 2002). Falso negativo pode ocorrer quando há excesso de
anticorpo (conhecido como fenômeno prozona). A reação cruzada pode ocorrer
com outras infecções treponêmicas (Peeling, 2004).
Testes treponêmicos, como o ensaio de hemaglutinação para o T.
pallidum e o teste de imunoflorescência do anticorpo anti-treponêmico (FTAABS) são usados para confirmar os testes de rastreamento. Os testes
treponêmicos não são utilizados geralmente para rastreamento por não serem
tão sensíveis como os testes não-treponêmicos nas primeiras 2-3 semanas no
estágio de sífilis primária. Os anticorpos anti-treponêmicos podem persistir
durante a vida, fazendo com que estes sejam menos úteis como exames
confirmatórios em áreas onde a prevalência é alta; eles também não são úteis
para avaliar a efetividade do tratamento (Peeling, 2004)
Figura 11. Diagnóstico da infecção por sífilis
INFECÇÃO FETAL
A infecção transplacentária pode ocorrer em qualquer estágio da
gestação (Wicher, 2001). O estágio da sífilis materna, o período da gestação, o
tratamento adequado da paciente e a resposta imunológica do feto causam a
variedade de manifestações que podem ocorrer na sífilis congênita (Genc,
2000).
ACHADOS ULTRASSONOGRÁFICOS
O principal achado ultrassonográfico relacionado à sífilis congênita é o
espessamento placentário que ocorre como provável conseqüência de uma
vilosite sifilítica. Outros achados comuns estão relacionados à presença de
hidropsia fetal, como derrames intracavitários (derrame predicárdico, ascite e
derrame pleural). Entretanto, estes achados são tardios, não devendo ser
aguardados para a resolução da conduta pré-natal.
PROPEDÊUTICA INVASIVA
As técnicas sorológicas disponíveis não são ideais para o diagnóstico
fetal da sífilis congênita. Sabe-se também que a IgG atravessa passivamente a
placenta. Assim, a detecção de anticorpos na circulação fetal não representa
necessariamente infecção congênita. Por outro lado, os anticorpos do tipo IgM
(fetais) dificilmente são detectados no sangue do concepto até a 22ª semana,
de modo habitual. No entanto, na sífilis congênita, pode-se observar a ausência
desses anticorpos até o 3º mês após o nascimento. Logo, os testes que
identificam esses anticorpos (IgM fetal) não são suficientemente fidedignos,
podendo apresentar falsos-negativos (Isfer, 1989).
5.3 CONDUTA PRÉ-NATAL
Após a confirmação da infecção materna, o tratamento já está indicado,
o que por conseqüência promoverá o tratamento também do concepto.
A droga de escolha para o tratamento da gestante considerada infectada
é a penicilina, que atravessa a barreira transplacentária. O tratamento da sífilis
na gestação é o mesmo realizado para a sífilis adquirida, em conformidade
com a fase da doença:
• sífilis primária (com cancro duro): penicilina benzatina 2.400.000 UI via
intramuscular (1,2 milhões em cada glúteo na mesma aplicação);
• sífilis secundária (com lesões cutâneas não ulceradas) ou latente
precoce (com menos de um ano de evolução): penicilina benzatina 4.800.000
UI via intramuscular dose total, aplicar duas doses com intervalo de sete dias
(2,4 milhões por dose: 1,2 milhões em cada glúteo na mesma aplicação);
• sífilis terciária ou latente tardia (com mais de um ano de evolução ou
duração ignorada): penicilina benzatina 7.200.000 UI via intramuscular dose
total (três séries, com intervalo de sete dias: 2,4 milhões por dose - 1,2 milhões
em cada glúteo na mesma aplicação).
Além do tratamento medicamentoso, é necessário reforçar a orientação
sobre os riscos relacionados à infecção pelo T. pallidum por meio da
transmissão sexual, para que as mulheres com sífilis e seu(s) parceiro(s)
evitem relações sexuais ou mantenham práticas para o sexo seguro, com o uso
de preservativo, durante o tratamento. Recomendar o uso regular do
preservativo (masculino ou feminino) também no período pós-tratamento
(Norma Técnica CDC, 2008).
Mesmo após o tratamento ser efetivado, é importante manter o
acompanhamento
ultrassonográfico
semanas
desses
fetos,
e
um
ecocardiograma de controle deve ser indicado, assim como ocorre nas demais
infecções congênitas.
5.4 CONSIDERAÇÕES
A sífilis é uma das infecções congênitas que poderiam ser facilmente
evitadas, pois se conhece seu modo de transmissão, há métodos satisfatórios
e de baixo custo para o diagnóstico, bem como tratamento efetivo. Entretanto,
muitos
casos
permanecem
sem
acompanhamento
adequado
e
por
conseqüência comprometendo a saúde da mãe e do feto. Torna-se mandatório
manter a vigilância em todas as gestantes durante o pré-natal e o
acompanhamento com especialista daquelas que receberam o diagnóstico de
sífilis durante a gestação.
6 CONSIDERAÇÕES FINAIS
As infecções congênitas são ainda hoje motivo de grande preocupação
para todos aqueles envolvidos nos cuidados das gestantes e seus conceptos.
Algumas apresentam diagnóstico relativamente complicado ou não têm
tratamento efetivo, porém, todas podem ser acompanhadas com cuidado
através não só da ultrassonografia, mas especialmente das técnicas
atualmente disponíveis, como PCR no líquido amniótico, análise do sangue
fetal através da cordocentese, ressonância nuclear magnética, entre outras.
Importante é ressaltar que o melhor acompanhamento será sempre feito
através do especialista que não só compreende a diferença entre tratar e
cuidar, como se mantém atualizado para cuidar da melhor forma possível,
considerando a boa vitalidade fetal como seu objetivo final.
7 REFERÊNCIAS BIBLIOGRÁFICAS
Abboud ,P., Harika, G., Saniez, D. Signes échographiques de la fetopathie
toxoplasmique. J Gynecol Obstet Biol Reprod, Paris, v. 24, no 7, p 733-8, 1995.
Adler, SP. Risk of human parvovirus B19 infections among school and hospital
employees during endemic periods. J Infect Dis, Richmond, v. 168, no2 , p 3628, 1993.
Adler, SP., Nigro, G., Pereira, L. Recent advances in the prevention and
treatment of congenital cytomegalovirus infections. Semin Perinatol, Richmond,
v. 31, no 1, p 10 – 18, 2007.
Al-Khan, A., Caliguri, A., Apuzzio, J. Parvovirus B19 infection during pregnancy.
Infect Dis Obstet Gynecol, Newark, v. 11, no 3, p 175-179, 2003.
Barquero- Artigao, F. Citomegalovirus congénito: ¿ Es necesario um cribado
serológico
durante
el
embarazo?
Enferm
Infecc
Microbiol
Clin.
doi:
10.1016/j.eimc.2009.01.017. 2009.
Berrebi, A., Bardou, M., Bessieres, MH. Outcome for children infected with
congenital toxoplasmosis in the first trimester and with normal ultrasound
findings: a study of 36 cases. Eur J Obstet Gynecol Reprod Biol, Toulouse, v.
135, no 1, p 53–7, 2007.
Berrebi, A., Bessières, MH., Cohen-Khalas, Y. Diagnostic anténatal de la
toxoplasmose. A propos de 176 cas. J Gynecol Obstet Biol Reprod, Paris, v.
22, no 3, p 261-8, 1993.
Boyer, KM., Holfels, E., Roizen, N. Risk factors for Toxoplasma gondii infection
in mothers of infants with congenital toxoplasmosis: implications for prenatal
management and screening. Am J Obstet Gynecol, Chicago, v. 192, no 2, p
564–71, 2005.
Brown, KE., Green, S., Antunez-de-Mayolo, J. Congenital anemia following
transpplacental B19 parvovirus infection. Lancet, Bethesda , v. 343, p 895,
1994.
Castro FC, Castro MJ, Cabral AC. Comparação doa métodos para diagnóstico
da toxoplasmose congênita. RBGO, Rio de Janeiro, v. 23, no5, p 277-282,
2001.
Cosmi, E., Mari, G., Delle Chiaie, L. Non invasive diagnosis by Dopppler
ultrassonography of fetal anemia resulting from parvovirus B19 infection. Am J
Obstet Gynecol, Cincinnati, v. 187, no 5, p 1290-3, 2002.
Couto, JCF., Leite JM. Sinais ultra-sonográficos em fetos portadores de
toxoplasmose congênita. RBGO, Rio de Janeiro, v. 26, no 5, p 377-382, 2004.
Crino, JP. Ultrasound and fetal diagnosis of perinatal infection. Clin Obstet
Gynecol v. 42, no 1, p 71-80, 1999.
Cunningham, D., Rennels, MB., Parvovirus B19 infection. Available at:
http://www.emedicine.com/ped/topic192.htm. Data de acesso 09 dezembro
2009.
Daffos, F. Fetal Blood Sampling. Annu Ver Med, Paris, v.40, no1, p 319-29,
1989.
Da Silva, ARA., Nogueira, AS., Alzeguir, JCL., Da Costa, MCFL, Do
Nascimento, JP. Prevalência de Anticorpos IgG antiparvovírus B19 em
gestantes durante o atendimento pré-natal e casos de hidropisia fetal nãoimune atribuídos ao parvovírus B19, na cidade do Rio de Janeiro. Sociedade
Brasileira de Medicina Tropical, Rio de Janeiro, v. 39, no 5, p 467 – 472, 2006.
Delle Chiaie, L., Buck, G., Grab, D., Terinde R. Prediction of fetal anemia with
Doppler measurement of the middle cerebral artery peak systolic velocity in
pregnancies complicated by maternal blood group alloimmunization or
parvovirus B19 infection. Ultrasound Obstet Gynecol, Ulm, v.18, no 3, p 232–6,
2001.
Demmler,
G.
Summary
of
workshop
on
surveillance
for
congenital
cytomegalovirus disease. Rev. Infect. Dis, Houston, v. 13, no 2, p 315- 329,
1991.
Dubey, JP. Toxoplasma, Hammondia, Besnoitia, Sarcocystis and other tissue
cyst-forming coccidia of man and animals. Parasitic Protozoa Academic Press,
Montpelier, v. 3, p 101, 1977.
Fairley, C., Smoliniec, J., Caul, O. Observacional study of the effect of the
intrauterine transfusions on outcome of fetal hydrops after parvovirus B19
infection. Lancet, Londres, v. 346, no 8986, p 1335, 1995.
Fricker-Hidalgo, H., Brenier-Pinchart, MP., Schaal, JP., Equy, V., Bost-Bru, C.,
Pelloux, H. Value of Toxoplasma gondii detection in one hundred thirty-three
placentas for the diagnosis of congenital toxoplasmosis. Pediatr Infect Dis J,
Grenoble, v. 26, no 9, p 845–6, 2007.
Friedman, S., Ford-Jones, LE., Toi, A., Ryan, G., Blaser, S., Chitayat, D., 1999.
Congenital toxoplasmosis: prenatal diagnosis,
treatment and postnatal
outcome. Prenat Diagn, Toronto, v.19, no4, p 330-3, 1999.
Forestier, F., Tissot, J-D., Vial, Y., Daffos, F., Hohlfeld, P., 1999.
Haematological parameters of parvovirus B19 infection in 13 fetuses with
hydrops foetalis. British Journal of Haematology, Paris, v.104, no 4, p 925–927,
1999.
Foulon, W. Congenital toxoplasmosis: is screening desirable? Scand J Infec
Dis, Brussel, v. 84, p 11-17, 1992.
Garweg, JG., Scherrer, J., Wallon, M., Kodjikian, L, Peyron F. Reactivation of
ocular toxoplasmosis during pregnancy. BJOG, Berna, v. 112, p 241–2, 2005.
Gaytant, MA. Congenital cytomegalovirus infection: review of the epidemiology
and outcome. Obstet. Gynecol. Surv, Doetinchen, v.57, no4, p 245 – 256, 2002.
Gayant, MA. Congenital cytomegalovirus infection after recurrent infection: case
reports and review of the literature. Eur. J. Pediatr, Doetinchen, v.162, p 248 –
253, 2003.
Gilbert,
R.,
Grasm,
L.
European
Multicentre
Study
on
Congenital
Toxoplasmosis. Effect of timing and type of treatment on the risk of mother to
child transmission of Toxoplasma gondii. BJOG, Londres, v.110, no 2, p 112–
20, 2003.
Goegebuer, T. Van Meensel, B., Beuselinck, V. Clinical predictive value of realtime PCR quantification of human cytomegalovirus DNA in amniotic fluid
samples. J Clin Microbiol, Leuven, v. 47, no 3, p 660-665, 2009.
Grover, CM., Thulliez, P., Remington, JS., Boothroyd, JD. Rapid prenatal
diagnosis of congenital Toxoplasma infection by using polymerase chain
reaction and amniotic fluid. J Clin Microbiol, Palo Alto, v. 28, no 1, p 2297–301,
1990.
Guerra, BT. Prenatal diagnosis of symptomatic congenital cytomagalovirus
infection. Am. J. Obstet. Gynecol, Bolonha, v.183, no 2, p 476-482, 2000.
Guerrero,
LD.
Fetal
parvovirus
infection.
Available
at:
http://
www.thefetus.net/page.php?id=155 Data de acesso: 11 December 2009.
Hall, SM. Congenital Toxoplasmosis. B M J, Londres, v.305, no 6848, p 291-7,
1992.
Hill, D., Dubey, P. Toxoplasma gondii: transmission, diagnosis and prevention.
Clin Microbiol Infect, Maryland, v.8, no 10, p 634–640, 2002.
Hohlfeld, P., Daffos, F., Costa, J-M., Thulliez, P., Forestier, F., Vidaud, M.,
1994. Prenatal diagnosis of congenital toxoplasmosis with polymerasechainreaction test on amniotic fluid. N Engl J Med, Paris, v.331, no 1, p 695–9,
1994.
Hohlfeld P. Foetophathies infectieuses. Arch Gynecol Obstet, Paris, v.247, no 1,
p 15-24, 1990.
Hohlfeld, P., MacAleese, J., Capella-Pavlovski, M. Fetal toxoplasmosis:
ultrasonographic signs. Ultrasound Obstet Gynecol, v.1, no 1, p 241-4, 1991.
Hsu, S., Chen, Y., Huang, Y. Prenatal Diagnosis and Perinatal Management of
Maternal-fetal Congenital Parvovírus B19 Infection. Taiwan J Obst Gynecol,
Taichung, v.46, no 4, p 417-422, 2007.
Isfer, EV. Anasarque foeto-placentaire non immune. Memoire pour le Titre
D´Assistent Etranger. Paris Université René-Descartes, Faculté de Médecine,
1989.
Jones, RN. Development and application of a PCR-based method including an
internal control for diagnosis of congenital cytomegalovirus infection. J Clin
Microbiol, Wales, v.38, no1, p 1-6, 2000.
Lappalainen M., Hedman K. Serodiagnosis of toxoplasmosis. The impact of
measurement of IgG avidity. Ann Dell Istit Sup Di San, Haartmaninkatu, v.40, no
1, p 81- 8, 2004.
Lazarotto, T., Guerra, B., Spezzacatena, P., Varani, S., Gabrielli, P., Pradelli,
F., 1998. Prenatal diagnosis of congenital cytomegalovirus infection. J Clin.
Microbiol, Bolonha, v.36, no 12, p 3540 – 3544, 1998.
Lazzaroto, T. Congenital cytomegalovyrus infection: Recent advances in
diagnosis of maternal infection. Hum Immunol, Bolonha, v.65, no 5, p 410-5,
2004.
Lazzaroto, T. New advances in the diagnosis of congenital cytomegalovirus
infection. J Clin Virol, Bolonha, v.41, no 3, p 192-7, 2008.
Levy, R., Weissman, A., Blomberg, G., Hagay, J. Infection by parvovirus B19
during pregnancy: a review. Obstetrical & Gynecological Survey 52(4) 254–259.
Liesenfeld, O., Press, C., Montoya, JG. False-positive results in immunoglobulin
M (IgM) toxoplasma antibody tests and importance of confirmatory testing: the
Platelia Toxo IgM test. J Clin Microbiol, Palo Alto, v.35, no 1, p 174–8, 1997.
Lipitz, S., Yagel, E., Shalev, R., Achiron, R., Mashiac, S., Schiff, E. Prenatal
diagnosis of fetal primary cytomegalovirus infection. Obstet Gynecol, Tel
Hashamer, v.89, no 5, p 763 – 767, 1997.
Lynch, L., Mehalek, K., Berkowitz, RL. Invasive fetal therapy. Rodeck CH, ed.
Fetal Medicine, 1st edition. Oxford: Blackwell Scientific Publications 1989, 118–
53.
Makenson, GR., Yancey, ML. Parvovirus B19 infections in pregnancy. Semin
Perinatol, Boston, v.31, no 1, p 107-12, 1998.
McIver, CJ., Jacques, CFH., Chow, SSW., Munro, SC., Scott, GM., Roberts,
JA., Craig, ME. Development of Multiplex PCRs for Detection of Common Viral
Journal of Clinical Microbiology, New South Wales, v.43, no 10, p 5102–5110,
2005.
Montoya G, Liesenfeld O. Toxoplasmosis. Lancet, Palo Alto, v. 363, no 9425, p
1965–1976, 2004.
Nigro, G. Adler, S P. La Torre, R. Best, A M. Passive immunization during
pregnancy for congenital cytomegalovirus infection. N Engl J Med, Roma,
v.353, no13, p 1350 – 62, 2005.
Norma Técnica, CDC SP. Rev Saúde Pública, São Paulo, v.42, no4, p 768-72,
2008.
Pass,
R
F.
Zhang,
C.
Evans,
A.
Vaccine
prevention
of
maternal
cytomegalovirus infection. NEJM, Birminghan, v. 360, no 12, p 1191 – 9, 2009.
Peeling, RW., Htun, Y. Diagnostic tools for preventing and managing maternal
and congenital syphilis: an overview. Bulletin of the Wolrd Health Organization,
Gênova, v.82, no 6, p 439-446, 2004.
Pérez, JL. Diagnóstico microbiológico de las infecciones por herpes vírus.
Procedimentos em Microbiologia Clínica. Recomendaciones de La Sociedad
Española de Enfermedades Infecciosas y Microbiologia Clínica. Disponível em
HTTP://www.seimc.org/documentos/protocolos/microbiologia/indice8a.htm.
Data do acesso 20 de dezembro 2009.
Petrof, E., McLeod, R. Toxoplasma gondii and Toxoplasmosis. Therapy of
infectious diseases, WB Saunders Philadelphia, Filadelfia, v.1, no 1, p 653-696,
2002.
Picone, O., Costa, JM., Leruez-Ville, M., Ernaut, P., Olivi, M., Ville, Y.
Cytomegalovirus (CMV) glycoprotein B genotype and CMV DNA load in
amniotic fluid of infected fetuses. Prenat. Diag, Paris, v.24, no 12, p 1001-1004,
2004.
Plotkin, SA., Smiley, ML., Friedman, HM. Towne-vaccine induced prevention of
cytomegalovirus disease after renal transplants. Lancet, Londres, v.1, no1, p
528-30, 1984.
Pryde, PG., Nungent, CE., Pridijan, G. Spontaneous resolution of nonimmune
hydrops fetalis secondary to human parvovirus B19 infection. Obstet Gynecol,
Michigan, v.79, no 5, p 859, 1992.
Public Health Service, Department of Health and Human Services; US Food
and Drug Administration. FDA public health advisory: limitations of toxoplasma
IgM commercial test kits. Rockville, MD: Department of Health and Human
Services; US Food and Drug Administration, 3, 1997.
Remington, JS., McLeod, R., Thuilliez, P., Desmonts, G. Infectious diseases of
the fetus and newborn infant. Elsevier Saunders 947–109, 2006.
Revello, MG., 2000. Prenatal diagnostic and prognostic value of human
cytomegavirus load and IgM antibody response in blood of congenitally infected
fetuses. J Infected Dis, Pavia, v.180, no 1, p 1320-1323, 2000.
Revello, MG., Gerna, G. Diagnosis and management of human cytomegalovirus
infection in the mother, fetus and newborn infant. Clin Microbiol Rev, Pavia,
v.15, no1, p 680 -715, 2002 .
Roberts, T., Frenkel, JK. Estimating income losses and other preventable costs
caused by congenital toxoplasmosis in people in the United States. J Am Vet
Med Assoc, Washington, v.196, no 2, p 249–56, 1990.
Roberts, F., Kuo, A., Roberts, CW., Jones, L., McLeod, R. Ocular
Toxoplasmosis: clinical features, pathology, pathogenesis, animal models and
immune response. Toxoplasma: molecular and cellular biology, Elsevier,
Londres, p 59-92, 2008.
Romand, S., Wallon, M., Franck, J., Thulliez, P., Peyron, F., Dumon, H.
Prenatal diagnosis using polymerase chain reaction on amniotic fluid for
congenital toxoplasmosis. Obstet Gynecol, Paris, v.97, no2, p 296–300, 2001.
Santos, DV., 2000. Congenital cytomegalovirus infection in a neonatal intensive
care unit in Brazil evaluated by PCR and association with perinatal aspects.
Rev Inst Med Trop 42 (3), 129 - 32.
Sáfadi, MAP., Berezin, EN., Farhat CK., Carvalho, ES., 2003. Clinical
presentation and follow up of children with congenital toxoplasmosis in Brazil.
Braz J Infect Dis 7, 325-31.
Spalding, SM., 2000. Acompanhamento de gestantes com risco de transmissão
de infecção congênita por Toxoplasma gondii na região do alto Uruguai, RS,
Brasil: diagnósticos e aspectos epidemiológicos. Rio de Janeiro: Fundação
Oswaldo Cruz.
Spalding, SM., Amendoeira, MRR., Ribeiro LC., 2003. Estudo prospectivo de
gestantes e seus bebês com risco de transmissão de toxoplasmose congênita
em município do Rio Grande do Sul. Rev Soc Bras Med Trop 36, 483-91.
Stagno, S., 1986. Primary cytomegalovirus infection in pregnancy. Incidence,
transmission to fetus, and clinical outcome. JAMA 256, 1904-8.
Stratton, KR., Durch, JS., Lawrence, RS., 2001. Vaccines for the 21st century: a
tool for decision making. Washington DC: National Academy Press.
Van Elsacker- Niele, AM., Salimans, MM., Weiand, HT., 1989. Fetal pathology
in human parvovirus B19 infection. BrJ Obstet Gynaecol 96, 768-75.
Vaz, AJ., Guerra, EM., Ferratto, LCC., Toledo, LAS., Azevedo Neto, RS., 1990.
Sorologia positiva para sífilis, toxoplasmose e doença de Chagas em gestantes
de primeira consulta em centros de saúde da área metropolitana, Brasil. Rev
Saúde Pública 24, 373-9.
Von Kaisenberg, CS., Bender, G., Scheewe, J., 2001. A case of fetal parvovirus
B19
myocarditis,
terminal
cardiac
heart
failure,
and
perinatal
heart
transplantation. Fetal Diagn Ther 16, 427–3.
Tolfvenstam, T., Papadogiannakis, N., Norbeck, O., Petersson, K., Broliden, K.,
2001. Frequency of human parvovirus B19 infection in intrauterine fetal death.
Lancet 357, 1494–7.
Whitley,
RJ.,
1997.
Ganciclovir
treatment
of
symptomatic
congenital
cytomegalovirus infection: results of a phase II study. National Institute of
Allergy and Infectious Diseases Collaborative Antiviral Study Group. J. Infect.
Dis 175, 1080 – 1086.
Wilson, M., Remington, JS., Clavet, C., 1997. Evaluation of six commercial kits
for detection of human immunoglobulin M antibodies to Toxoplasma gondii. J
Clin Microbiol 35, 3112–5.
Wirden, M., Botterel, F., Romand, S., Ithier, G., Bourée, P., 1999. Intérêt du
dépistage en post-partum de la toxoplasmose congénitale après primo-infection
maternelle en fin de grossesse. J Gynecol Obstet Biol Reprod 28, 566-7.
Yamamoto, AY., 2001. Congenital cytomegalovirus infection in preterm and fullterm newborn infants from a population with a high seroprevalence rate. Pediatr
Infect Dis J 20(2), 188-92.
Young, NS., Brown, KE., 2004. Parvovírus B19. The New England Journal of
Medicine 350, 586- 597.
Yow, MD.,1988. Epidemiological characteristics of cytomegalovirus infection in
mothers and their infants. Am. J. Obstet. Gynecol 158, 1189-1195.