UNIVERSIDADE FEDERAL DE OURO PRETO
NÚCLEO DE PESQUISAS EM CIÊNCIAS BIOLÓGICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
Efeitos do treinamento em natação sobre
parâmetros celulares, estruturais e mecânicos do
ventrículo esquerdo de ratos hipertensos
Jamille Locatelli
Ouro Preto – MG
2016
Jamille Locatelli
Efeitos do treinamento em natação sobre
parâmetros celulares, estruturais e mecânicos do
ventrículo esquerdo de ratos hipertensos
Tese apresentada ao Programa de Pós-Graduação de
Ciências Biológicas do Núcleo de Pesquisas em Ciências
Biológicas da Universidade Federal de Ouro Preto, como
parte integrante dos requisitos para obtenção do Título de
Doutor em Ciências Biológicas, área de concentração
Bioquímica Metabólica e Fisiológica.
Orientador: Prof. Dr. Mauro César Isoldi
Coorientador: Prof. Dr. Antônio José Natali
II
Trabalho
desenvolvido
no
Laboratório
de
Hipertensão da Universidade Federal de Ouro Preto, em
parceria com o Laboratório de Biologia do Exercício da
Universidade Federal de Viçosa, com auxílio financeiro
do CNPQ, PROPP-UFOP.
III
Dedico este trabalho a Deus e aos meus familiares.
IV
AGRADECIMENTOS
A Deus e a Maria, pelas bênçãos e força de todos os dias.
Aos meus pais, Pedro e Zilda, que são exemplo de luta. Sem vocês nada disso seria
possível. Muitos dias foram difíceis e sempre encontrei apoio em vocês para continuar na
batalha. Vamos comemorar mais essa vitória!
Aos meus amados avós, em especial ao meu avô Bianor, a quem dedico essa vitória.
Onde ele estiver certamente estará feliz.
Ao Rodolpho, pela compreensão, incentivo e companheirismo.
Ao meu orientador, prof. Dr. Mauro César Isoldi, pelos ensinamentos e oportunidade e,
em especial, ao meu coorientador, prof. Dr. Antônio José Natali, por todas as
oportunidades, pela confiança, respeito e pelo exemplo de pesquisador. Meu sincero
OBRIGADA!
Às profas. Dra. Cláudia Martins Carneiro e Dra. Andréia Grabe-Guimarães, pela
colaboração, orientação e ajuda nos trabalhos de eletrocardiograma.
À profa. Dra. Paula Melo de Abreu Vieira, pela orientação nas análises de colágeno.
À Sara, ao Giovanni e à Fernanda pela colaboração nos experimentos. Vocês foram
pessoas fundamentais nesse processo.
À Lidiane, pela amizade em todos os momentos.
À Quênia, por me apresentar e me orientar no eletrocardiograma.
À Nívia Carolina, pelos ensinamentos, pela amizade e pela ajuda nos experimentos.
V
À equipe do Laboratório de Biologia do Exercício (UFV), em especial à Cláudia, ao
Miguel, ao Victor e ao Luís Henrique pelo apoio e prontidão.
Aos colegas do Laboratório de Hipertensão.
Aos funcionários do Centro de Ciência Animal da UFOP, pela amizade e pelo cuidado
com os animais.
Aos secretários do NUPEB, pela dedicação e prontidão.
Aos animais, que inocentemente sacrificaram suas vidas pela ciência.
VI
“Nós não somos o que gostaríamos de ser; nós não
somos o que ainda iremos ser; mas, graças a Deus, não
somos mais quem nós éramos.” (Martin Luther King)
VII
RESUMO
Introdução: a hipertensão arterial é considerada um grave problema de saúde pública,
pois, na maioria das vezes, está associada a outras doenças crônico-degenerativas que
afetam negativamente a qualidade de vida do indivíduo. Objetivo: avaliar os efeitos do
treinamento aeróbico em natação sobre parâmetros celulares, estruturais e mecânicos do
ventrículo esquerdo (VE) de ratos com hipertensão espontânea (SHR). Materiais e
métodos: ratos Wistar e SHR (4 meses de idade) foram distribuídos nos grupos
experimentais Sed (sedentário) e Ex (exercitado), sendo que os grupos Wistar foram
considerados como controles normotensos (Sed e Ex). Os animais dos grupos Ex foram
submetidos a um protocolo de natação (1h/dia, 5x/semana, durante 6 semanas). Após esse
período foram avaliados os seguintes parâmetros: in vivo, a pressão arterial média basal
(PAM) e a frequência cardíaca (FC) (em repouso e acordados); o índice QTc em ratos
anestesiados; post mortem, o diâmetro das fibras cardíacas, o número de células
inflamatórias e a área de colágeno no VE; in vitro, o comprimento, a largura e o volume
dos cardiomiócitos isolados do VE; tempo para o pico de contração, porcentagem de
amplitude do pico de contração e tempo para 50% do relaxamento de cardiomiócitos
isolados estimulados a 1 e 3 Hz. Resultados: O treinamento atenuou a PAM em ratos
acordados e a FC de ratos acordados no grupo SHR Ex, em relação a SHR Sed (164 ± 2
vs. 189 ± 4 mmHg e 384 ± 3 vs. 448 ± 10 bpm, respectivamente). O índice QTc também
diminuiu em SHR Ex (92,89 ± 3,12 vs. 110,9 ± 3,61 ms). Os grupos SHR apresentaram
redução na massa corporal e aumento na massa do coração e nas massas total e relativa
do VE, em relação aos grupos normotensos. O treinamento aumentou o comprimento de
cardiomiócitos Wistar, diminuiu o diâmetro das fibras cardíacas (19,88 ± 0,22 vs. 22,3 ±
0,41 µm) e também o número de células inflamatórias em SHR (107 ± 6 vs. 136 ± 2
µm2). O treinamento impediu a substituição do colágeno do tipo III pelo tipo I,
protegendo o VE da deposição de colágeno. Em relação à função ventricular, o
treinamento aeróbico provocou redução no tempo para o pico de contração em
cardiomiócitos de SHR Ex em ambas as frequências de estimulação, em relação a SHR
Sed (F1: 372 ± 9 vs. 446 ± 13 ms; F3: 296 ± 5 vs. 320 ± 5 ms). Em relação ao tempo para
50% do relaxamento, o exercício provocou redução em SHR apenas na frequência de 3
Hz (185 ± 8 vs. 218 ± 7 ms). Em ambas as frequências o exercício diminuiu a amplitude
VIII
para o pico de contração, comparada a SHR Sed (F1: 2,22 ± 0,17 vs. 4,2 ± 0,35%; F3:
2,96 ± 0,24 vs. 4,14 ± 0,32%). Conclusões: o treinamento em natação pode ter provocado
a diminuição do tônus simpático e da atividade do sistema renina-angiotensinaaldosterona e melhorias da função elétrica ventricular, além de ter protegido o ventrículo
esquerdo do remodelamento cardíaco patológico em SHR; o treinamento induziu
hipertrofia fisiológica em animais normotensos e pode ter provocado adaptações
benéficas nas funções sistólica e diastólica de ratos espontaneamente hipertensos.
Palavras-chave: natação; hipertensão; função ventricular; remodelamento cardíaco; ratos
espontaneamente hipertensos.
IX
ABSTRACT
Introduction: Hypertension is considered a serious public health issue because it is
associated to other chronic and degenerative diseases that affect negatively individual
quality of life. Objective: To evaluate the effects of aerobic swimming training on left
ventricle (LV) histologic parameters and on cardiomyocytes mechanic properties of nonhypertensive rat (Wistar) and spontaneously hypertensive rat (SHR). Methods and
materials: Wistar rat and SHR (age 4 months) were distributed into experimental groups
Sed (sedentary) and Ex (trained), in which Wistar groups were considered as control
groups (Sed and Ex). The rats were submitted to an initial swimming protocol (1 hour a
day, 5 times a week, for 6 weeks) after which the following parameters were assessed: in
vivo, medium base blood pressure (MBP) and heart rate (HR) were measured (during
awake resting), using direct register; QTc index in sedated rats were obtained after an
electrocardiogram; post mortem, diameter of cardiac fibers, the number of inflammatory
cells and the LV content of collagen by histologic analysis; in vitro, length, width and
volume of LV cardiomyocytes, using isolation and morphologic measure techniques;
time-to-peak contractions, contraction peak amplitude percentage and half-relaxation
time by stimulating cardiomyocyte with 1 and 3 hertz through cell contractility assay
technique. Results: Exercise decreased MBP and HR in awake SHR Ex compared to
SHR Sed (164± 2 vs. 189 ± 4 mmHg and 384 ± 3 vs. 448 ± 10 bpm, respectively). QTc
index also decreased in SHR Ex (92,89 ± 3,12 vs. 110,9 ± 3,61 ms). SHR groups had a
reduction in body mass and increased heart mass, LV total mass and relative mass,
compared to Wistar groups at the end of training protocol. Training increased
cardiomyocyte length in Wistar and decreased the number of inflammatory cells (107 ± 6
vs. 136 ± 2 µm2) and the diameter in SHR (19,88 ± 0,22 vs. 22,3 ± 0,41 µm). The
exercise training prevented the replacement of type III colagen into type I collagen,
protecting LV from collagen deposition. Aerobic training caused reduction on time-topeak contractions in SHR Ex in relation to ventricle function in both frequency stimuli
(F1: 372 ± 9 vs. 446 ± 13 ms; F3: 296 ± 5 vs. 320 ± 5 ms). Exercise caused reduction in
half-relaxation time in SHR only in 3Hz frequency (185 ± 8 vs. 218 ± 7 ms). In both
frequencies exercise diminished contraction peak amplitude percentage comparaed to
SHR Sed (F1: 2,22 ± 0,17 vs. 4,2 ± 0,35%; F3: 2,96 ± 0,24 vs. 4,14 ± 0,32%).
X
Conclusions: Swimming training may have triggered a decrease in sympathetic tonus
and activity of the renin-angiotensin-aldosterone system and improvements in left
ventricular eletric function and protected the left ventricle from pathologic cardiac
remodeling in SHR; exercise training induced physiologic hypertrophy in normotensive
rats and may have triggered beneficial adaptations in systolic and diastolic function of
spontaneously hypertensive rats.
Keywords:
swimming;
hypertension;
ventricle
function;
cardiac
remodeling;
spontaneously hypertensive rats.
XI
LISTA DE FIGURAS
Figura 1: Representação do programa utilizado na aquisição das imagens e dos registros
das contrações das células cardíacas (Ionoptix, EUA) ...................................................176
Figura 2: Representação de uma contração celular e os parâmetros avaliados ..............177
Figura 3: Valores do índice QTc de ratos Wistar e SHR anestesiados ..........................198
Figura 4: (A) Frequência cardíaca de repouso de ratos acordados; (B) Frequência
cardíaca de repouso de ratos anestesiados e (C) Pressão arterial média de ratos acordados
...........................................................................................................................................19
Figura 5: (A) Número de células inflamatórias no ventrículo esquerdo; (B) Diâmetro de
cardiomiócitos do VE de ratos Wistar e SHR..................................................................211
Figura 6: Fotomicrografias de cortes histológicos do ventrículo esquerdo de ratos
normotensos e hipertensos ...............................................................................................222
Figura 7: (A) Conteúdo de colágeno do tipo I e (B) Conteúdo de colágeno do tipo III no
ventrículo esquerdo de ratos Wistar e SHR .....................................................................233
Figura 8: Fotomicrografias de cortes histológicos do ventrículo esquerdo de ratos
normotensos e hipertensos ...............................................................................................244
Figura 9: (A) Comprimento e (B) Relação comprimento/largura de cardiomiócitos do
ventrículo esquerdo de ratos Wistar e SHR .....................................................................277
Figura 10: Função contrátil de cardiomiócitos de ratos Wistar e SHR estimulados a 1 Hz.
(A) tempo para o pico de contração e (B) amplitude de contração ...................................28
Figura 11: Amplitude de contração de cardiomiócitos de ratos Wistar e SHR estimulados
a 3 Hz. (A) tempo para o pico de contração; (B) Tempo para %0% de relaxamento e (C)
amplitude de contração. .....................................................................................................29
XII
LISTA DE TABELAS
Tabela 1: Massa corporal, massa do coração, massa dos ventrículos esquerdo e direito e
massas relativas dos grupos experimentais ......................................................................266
XIII
LISTA DE ABREVIATURAS
°C
Graus Celsius
µl
Microlitro
µm
Micrômetro
µm/seg
Micrômetro por segundo
Ang (1-7)
Angiotensina (1-7)
Ang II
Angiotensina II
ANOVA
Análise de variância
bpm
Batimento por minuto
Ca2+
Cálcio
CaCl2
Cloreto de cálcio
cm
Centímetro
DMSO
Dimetilsulfóxido
ECG
Eletrocardiograma
EGTA
Ácido tetracético etilenoglicol
EPM
Erro padrão da média
ET-1
Endotelina 1
Ex
Exercitado
FC
Frequência cardíaca
Fig
Figura
FLB
Fosfolamban
g
Grama
g/l
Grama por litro
HE
Hematoxilina/eosina
HEPES
Ácido etanosulfônicohidroxietil piperazina
Hz
Hertz
IGF-1
Fator de crescimento semelhante à insulina tipo 1
KCl
Cloreto de potássio
Kg
Quilograma
M
Molar
XIV
MCI
Massa corporal inicial
MCF
Massa corporal final
MC
Massa do coração
MEC
Matriz extracelular
mg
Miligramas
MgCl2
Cloreto de magnésio
min
Minuto
ml
Mililitro
mm
Milímetro
mM
Milimolar
mmHg
Milímetro de mercúrio
ms
Milisegundos
MV
Massa do ventrículo
MVD
Massa do ventrículo direito
MVE
Massa do ventrículo esquerdo
NaCl
Cloreto de sódio
NaH2PO4
Fosfato monossódico
NCX
Trocador de sódio/cálcio
NE
Noraepinefrina
NF-ƘB
Fator nuclear kappa B
O2
Oxigênio
PA
Pressão arterial
PAD
Pressão arterial diastólica
PAM
Pressão arterial média
PAP
Pressão arterial pulsátil
PAS
Pressão arterial sistólica
PE
Polietileno
pH
Potencial hidrogeniônico
pL
Picolitro
RNAm
Ácido ribonucléico mensageiro
RS
Retículo sarcoplasmático
XV
RyR
Receptor de rianodina
Sed
Sedentário
Ser
Serina
SERCA
Ca2+ ATPase do retículo sarcoplasmático
SHR
Rato espontaneamente hipertenso
SNS
Sistema nervoso simpático
SRAA
Sistema renina-angiotensina-aldosterona
TGF-β
Fator de crescimento tumoral beta
Thr
Treonina
TNF-α
Fator de necrose tumoral alfa
V
Volts
VD
Ventrículo direito
VE
Ventrículo esquerdo
VEGF
Fator de crescimento vascular endotelial
VO2máx
Volume máximo de oxigênio
vs
Versus
XVI
SUMÁRIO
RESUMO ............................................................................................................................ VIII
ABSTRACT ............................................................................................................................. X
LISTA DE FIGURAS .......................................................................................................... XII
LISTA DE TABELAS ....................................................................................................... XIII
LISTA DE ABREVIATURAS .......................................................................................... XIV
1.0. INTRODUÇÃO ................................................................................................................. 1
2.0. OBJETIVOS..................................................................................................................... 9
2.1 Geral: ................................................................................................................................... 9
2.2 Específicos: .......................................................................................................................... 9
3.0. METODOLOGIA .......................................................................................................... 10
3.1 Animais .............................................................................................................................. 10
3.2 Protocolo de exercício físico.............................................................................................. 10
3.3 Confecção de cânulas vasculares para registro de sinais cardiovasculares ....................... 11
3.4 Obtenção dos sinais cardiovasculares em ratos anestesiados ............................................ 12
3.5 Registro direto da frequência cardíaca e pressão arterial média em ratos acordados ........ 11
3.6 Retirada do coração ........................................................................................................... 12
3.7 Análise histológica ............................................................................................................. 12
3.8 Massa do coração e dos ventrículos ................................................................................... 13
3.9 Isolamento dos cardiomiócitos .......................................................................................... 14
3.9.1 Soluções de isolamento ...............................................................................15
3.9.2 Solução de perfusão tampão HEPES ...........................................................15
3.10 Contratilidade celular ....................................................................................................... 15
3.11 Análise estatística ............................................................................................................ 17
4.0. RESULTADOS ............................................................................................................... 18
XVII
4.1 Valores do índice QTc em ratos anestesiados ................................................................... 18
4.2 Níveis basais de FC e PAM em ratos acordados e anestesiados ................................... 1918
4.3 Avaliação morfológica do tecido cardíaco ........................................................................ 20
4.4 Massa corporal, massa do coração e massa dos ventrículos .............................................. 25
4.5 Dimensões dos cardiomiócitos .......................................................................................... 26
4.6 Contratilidade de cardiomiócitos ....................................................................................... 27
5.0. DISCUSSÃO.................................................................................................................... 30
6.0. CONCLUSÕES ............................................................................................................... 40
7.0. REFERÊNCIAS BIBLIOGRÁFICAS .......................................................................... 41
ANEXO I – Protocolo de aprovação do Comitê de Ética em Uso Animal........................64
XVIII
1.0. INTRODUÇÃO
A hipertensão arterial é uma doença crônica determinada por níveis de pressão
arterial sistólica de repouso ≥ 140 mmHg e/ou pressão arterial diastólica ≥ 90 mmHg
(International Society of Hypertension Writing Group, 2003). É considerada um grave
problema de saúde pública, por estar associada ao aparecimento de outras doenças
crônico-degenerativas que afetam negativamente a qualidade de vida de indivíduos
(SBC, 2010). Nessa desordem, o remodelamento patológico leva à disfunção cardíaca,
causada, parcialmente, pela alteração na expressão gênica e no fenótipo molecular no
coração (Beisvag et al., 2009).
A mortalidade por doenças cardiovasculares aumenta progressivamente com a
elevação da pressão arterial (PA) a partir de 115/75 mmHg, de forma linear, contínua e
independente (Lewington et al., 2002). Estudos clínicos demonstraram que a detecção, o
tratamento e o controle da hipertensão arterial sistêmica são fundamentais para a
redução de eventos cardiovasculares (SBC, 2006; Rosário et al., 2009).
Uma meta-análise de 354 estudos clínicos revelou que a redução da morbidade e
mortalidade é proporcional à queda da PA, tanto sistólica, quanto diastólica, podendo
reduzir em até 46% a ocorrência de infartos do miocárdio, e em 63% o número de
acidentes vasculares encefálicos (Law et al., 2003).
A hipertrofia do ventrículo esquerdo (VE) e a disfunção diastólica são as
primeiras manifestações de danos cardíacos em pacientes com hipertensão arterial (Fu
et al., 2014). O coração do indivíduo com hipertensão sofre um processo de
remodelamento estrutural e funcional. Além da hipertrofia dos cardiomiócitos, esse
processo consiste também no aumento na deposição de colágenos intersticial e
perivascular, além do remodelamento de arteríolas intramurais (Schwartzkopff et al.,
1995; Sano et al., 1998) e outros componentes.
A fase de hipertrofia ventricular é associada ao acúmulo progressivo de fibras
colágenas no VE. Esse fenômeno de fibrose progressiva inicia-se mesmo na ausência de
morte celular, sendo uma resposta adaptativa que preserva a capacidade de geração de
força contrátil. Mais tarde, persistindo o estímulo pressórico, surge a fibrose reparativa,
em resposta à morte celular. Todavia, com ou sem perda celular, a fibrose leva ao
1
enrijecimento tecidual, com diminuição na complacência e alteração na geometria do
ventrículo (Weber, 1989; Chancey et al., 2002).
No coração de mamíferos, a função cardíaca é regulada por interações dinâmicas
entre dois tipos celulares predominantes: cardiomiócitos e fibroblastos cardíacos, que
juntos, totalizam 90% do total de células do miocárdio (Porter e Turner, 2009). Os
cardiomiócitos, ainda que em menor número, ocupam o maior volume no miocárdio. Já
os fibroblastos correspondem a aproximadamente 70% do total de células do coração
humano e são os principais componentes do tecido conjuntivo, que é formado também
por colágenos dos tipos I e III (secretados pelos fibroblastos), elastina, fibrilina,
proteínas adesivas e proteoglicanos (Wilson e Spinalle, 2001). A eficiência mecânica do
músculo cardíaco depende das propriedades contráteis dos cardiomiócitos, associados
ao tecido conjuntivo (Wilson e Spinalle, 2001). Os fibroblastos produzem colágenos do
tipo I e III, além de fibronectina, proteoglicanos, metaloproteinases e seus inibidores; já
os cardiomiócitos e células endoteliais são responsáveis por sintetizar colágeno dos
tipos IV e VI (Janicki et al., 2006).
O colágeno é responsável pela integridade funcional do miocárdio, que permite
a interdigitação e a transmissão da força entre cardiomiócitos na contração (Mukherjee e
Sen, 1993). Já se sabe que a produção de colágeno sofre influência do aumento da
sobrecarga de pressão (Weber e Brilla, 1991). O aumento no conteúdo de colágeno leva
a prejuízos na capacidade do coração de bombear o sangue para o corpo.
Apesar de diversos tipos de colágenos serem expressos transitoriamente durante
o desenvolvimento embrionário e participarem diretamente na migração, diferenciação e
organização das estruturas cardíacas, o colágeno dos tipos I e III são os principais
colágenos do tipo fibrilar presentes em coração de adultos (Medugorac, 1982);
entretanto, durante a instalação do processo de fibrose cardíaca ocorre a predominância
de colágeno fibrilar do tipo I, que altera as propriedades elásticas do coração (Shahbaz
et al., 2010).
A linhagem de ratos espontaneamente hipertensos (SHR) vem sendo utilizada
como modelo experimental de hipertensão arterial, pois as alterações fisiopatológicas
encontradas nesses animais se assemelham às observadas na hipertensão humana
essencial. Outra vantagem desse modelo é a possibilidade de se estudar a progressão da
hipertensão, conforme em humanos, sendo caracterizadas 3 fases: pré-hipertensão,
2
desenvolvimento e sustentação dos níveis pressóricos (Risler et al., 2005). Os animais
SHR são pré-hipertensos entre 5 e 8 semanas de vida, com a PA sistólica em torno de
100 a 120 mmHg (Adams et al., 1989 apud Fazan Jr et al., 2001), apresentando um
nível pressórico que pode ser considerado como hipertensão arterial espontânea entre a
7a e a 15a semanas. Fazan Jr e colaboradores (2001) consideram ainda que o ápice
pressórico deve ser atingindo entre a 20a e 28a semanas de vida, não havendo influência
sexual nesse desenvolvimento.
Nesse modelo de hipertensão, os animais desenvolvem insuficiência cardíaca e
disfunção renal (Conrad et al., 1991; Frohlich et al., 1994; Linz et al., 2015). Além
disso, apresentam aumento na atividade do sistema nervoso simpático (SNS),
evidenciado pelo aumento da atividade simpática renal (Trippodo e Frohlich, 1981;
Jiang et al., 2012).
Alguns autores defendem que esse aumento da atividade simpática é uma das
características dos diferentes tipos de hipertensão arterial (Donohue et al., 1988;
Guyenet, 2006; Levick et al., 2010). A efetividade dos β-bloqueadores na redução da
hipertrofia induzida por hipertensão sugere que a hiperatividade simpática tem um papel
fundamental na hipertrofia e nos danos cardíacos na hipertensão arterial (Agarwal et al.,
2009). Além disso, a norepinefrina (NE) induz a produção de citocinas próinflamatórias nos cardiomiócitos (Fu et al., 2004), contribuindo para o aumento do
quadro inflamatório observado no modelo SHR. Agarwal e colaboradores (2009)
mostraram que os níveis circulantes de NE (um marcador indireto da atividade
simpática) foram maiores em SHR, comparados a Wistar Kyoto e que o treinamento em
esteira diminuiu significativamente esses valores.
O aumento da atividade local do sistema renina-angiotensina-aldosterona
(SRAA) no VE pode explicar também o aumento na massa cardíaca encontrada em
modelos de hipertensão arterial. Schunkert e colaboradores (1990) encontraram
aumento na atividade da enzima conversora de angiotensina no VE, mas não no
ventrículo direito (VD) de ratos com hipertrofia cardíaca.
Alguns autores sugerem que SHRs apresentam hipertrofia concêntrica, aumento
no tempo de contração e relaxamento de cardiomiócitos, além de aumento da
concentração de cálcio intracelular (Brooksby et al., 1992; McCrossan et al., 2004).
Nessa linhagem também se observam alterações nos parâmetros do eletrocardiograma
3
(ECG), tais como, o prolongamento do potencial de ação e do intervalo QT (Klimas et
al., 2012; Lee et al., 2013). O prolongamento do intervalo QT do ECG é um marcador
não específico de cardiotoxicidade de fármacos, drogas e de patologias cardíacas
associadas ao risco aumentado de doença cardíaca e morte súbita (Crumb e Cavero,
1999). A cardioproteção pode ser demonstrada experimentalmente pela redução do
prolongamento do intervalo QT ou pela capacidade em evitar o seu prolongamento em
condições de hiperatividade cardíaca (Baillard et al., 2000). O prolongamento do
intervalo QT também pode ser utilizado como uma forma de avaliar a repolarização
cardíaca (Klimas et al., 2008; Kmecova e Klimas, 2010). Na hipertensão, o
prolongamento do potencial de ação e a presença de arritmias podem levar a prejuízos
no mecanismos de contração do cardiomiócito.
A fibrose miocárdica é uma alteração patológica multifatorial que envolve o
remodelamento da matriz extracelular (MEC) e de seus componentes celulares (Mindan
e Panizo, 1993; Jellis et al., 2010). Isso resulta no remodelamento do ventrículo
esquerdo, o que causa anormalidade na função cardíaca, em especial, o prejuízo no
relaxamento diastólico (Slama et al., 2002) e hipertrofia acompanhada de insuficiência
cardíaca.
Em nível molecular, o remodelamento da MEC é mediado pela ativação de
sistemas neurohumorais, dentre eles, o SRAA e pelo fator de crescimento tumoral β
(TGF-β) (Rosenkranz, 2004). Alguns estudos já mostraram que a angiotensina II (Ang
II), o principal peptídeo do SRAA pode influenciar na síntese e degradação da MEC no
miocárdio, estimulando a expressão de colágeno miofibrilar, via ativação do receptor
AT1 (Weber et al., 1994). Sun e colaboradores (1998) mostraram também que esse
peptídeo estimula a fibrose em ratos infartados, através da ativação de TGF-β.
Um estudo utilizando tecido cardíaco de humanos com e sem insuficiência
mostrou um aumento nos níveis de TGF-β naqueles com insuficiência. Isso foi
acompanhado de elevação nos níveis de colágeno tipo I e III (Sivakumar et al., 2008).
Em modelo animal, se observa que a inibição do TGF-β melhora os efeitos prófibróticos dessa citocina (Kuwahara et al., 2002).
A sobrecarga mecânica exerte efeitos predominantemente pró-fibróticos em
fibroblastos cardíacos. A expressão de citocinas e fatores de crescimento estimulada
pelos fibroblastos é responsiva ao estiramento; este, por sua vez, leva ao aumento da
4
expressão gênica do fator de necrose tumoral alfa (TNF-α) (Yokoyama et al., 1999; Sato
et al., 2003), endotelina 1 (ET-1) (Pikkarainen et al., 2006) e TGF-β (Lindahl et al.,
2002) em ratos.
A Ang II induz a expressão de citocinas pró-inflamatórias (TGF-β, TNFα,
interleucina-6), peptídeos (ET-1 e peptídeos natriuréticos dos tipos A e B) e fatores de
crescimento (por ex., VEGF) em fibroblastos cardíacos (Chintalgattu et al., 2003; Sato
et al., 2003; Rosenkranz, 2004; Makino et al., 2006). Ela também atua nos fibroblastos
cardíacos, estimulando a síntese de colágeno dos tipos I e III e fibronectina, através da
ativação do receptor AT1 em roedores e humanos com insuficiência cardíaca (Agocha
et al., 1997; Hafizi et al., 1998; Staufenberger et al., 2001).
A hipertensão arterial pode provocar diversas alterações morfológicas nos
miócitos cardíacos e disfunções progressivas nas funções do miocárdio, dependentes do
tipo e do tempo da instalação do processo hipertensivo. Dentre as disfunções que
ocorrem no coração, McMullen e Jennings (2007), enumeram as disfunções mecânicas
durante a contração e o relaxamento e a dilatação do ventrículo esquerdo, provocando a
insuficiência cardíaca.
Em relação às propriedades mecânicas, muitos trabalhos mostram aumento do
tempo de relaxamento do coração em modelos de hipertensão (McCrossan et al., 2004;
Kemi et al., 2008; Carneiro-Júnior et al., 2013). Em contrapartida, os resultados sobre
amplitude do pico de contração são controversos. Yelamarty e colaboradores (1992)
mostraram que, em animais com hipertensão renovascular, a amplitude de contração
não foi alterada. Já Brown (2003) mostrou aumento na amplitude do pico em
cardiomiócitos de SHR estimulados a 0,5 Hz, corroborando com os resultados
apresentados por Brooksby et al. (1992) e Kobayashi et al. (1995). O potencial de ação
ventricular de SHR também é prolongado, quando comparado ao de animais WistarKyoto (Cerbai et al. 1994). Por sua vez, Li e colaboradores (2005), avaliaram SHR com
12 meses de idade e mostraram diminuição na amplitude do pico, após estimularem
cardiomiócitos isolados a 0,5 Hz.
A hipertensão também provoca diminuição nas velocidades de contração e de
relaxamento de miócitos isolados e aumento do tempo para o pico de contração
(Carneiro-Júnior et al., 2013).
5
O exercício físico é recomendado como uma terapia não farmacológica
importante no controle da hipertensão e na prevenção e atenuação do remodelamento
cardíaco induzido pela sobrecarga crônica de pressão (Mancia et al., 2013; Yancy et al.,
2013; Locatelli et al., 2014).
Também tem sido reportado que o exercício de baixa intensidade atrasa o início
da insuficiência cardíaca e melhora a sobrevida em SHR com quadro de insuficiência já
instalado (Emter et al., 2005).
O treinamento físico regular também melhora a sensibilidade dos baroreceptores
em animais normotensos e SHR, favorecendo o controle da PA (Brum et al., 2000;
Moraes-Silva et al., 2010). Além disso, observa-se no modelo SHR, redução na
atividade da renina plasmática, após a prática de exercício físico (Hayashi et al., 2000;
Zamo et al., 2004).
Em diferentes modelos de lesão cardíaca o exercício atenua a dilatação do
ventrículo, a hipertrofia dos miócitos, a fibrose do miocárdio, a disfunção mitocondrial,
as alterações na mobilização do cálcio, a simpatoexcitação, a disfunção cardíaca e
melhora o perfil inflamatório do tecido cardíaco (Rossoni et al., 2011; Llewellyn et al.,
2014; Locatelli et al., 2014; Melo et al., 2014).
A hipertrofia induzida pelo treinamento é uma importante adaptação fisiológica,
que envolve a via do fator de crescimento semelhante à insulina tipo 1 (IGF-1) (Opie,
2004). Em modelos animais, o exercício leva ao aumento das dimensões dos
cardiomiócitos numa média de 17 a 23% (Kemi et al., 2002).
O crescimento do coração em resposta ao exercício necessita de uma estrutura
vascular compatível com o aumento da demanda funcional. O fator de crescimento
vascular endotelial (VEGF) é fundamental no processo de angiogênese (Taimeh et al.,
2013). O exercício, através do aumento do sheer stress e/ou do estímulo bioquímico nos
vasos, contribui para a ativação da cascata de sinalização de VEGF, estimulando a
angiogênese (Brown, 2003).
Em modelos animais e humanos, o treinamento de resistência estimula o
crescimento de artérias coronárias, melhorando a capacidade de transporte e o fluxo
sanguíneo no coração (Kozakova et al., 2007; Duncker e Bache, 2008).
Atualmente acredita-se que o coração mantenha sua capacidade de renovação
pela formação de novos cardiomiócitos advindos de células progenitoras, de células
6
tronco cardíacas e proliferação de cardiomiócitos preexistentes (Porrello et al., 2011;
Senyo et al., 2013).
Um grande número de modelos animais para induzir a hipertrofia cardíaca tem
sido desenvolvido e diversos tipos de treinamento também são reconhecidos por induzir
a hipertrofia cardíaca fisiológica em animais, dentre eles, os protocolos envolvendo
treinamento em esteira e natação e a prática da corrida voluntária (Evangelista et al.,
2003; Medeiros et al., 2004; Locatelli et al., 2014). Nesse sentido, o treinamento em
natação parece ser tão efetivo quanto os demais programas para induzir a hipertrofia
cardíaca em ratos (Wang et al., 2010), provocando aumento significativo no volume
diastólico final em ratos (Dorn, 2007).
Já é bem estabelecido que a hipertensão provoca disfunções na mobilização do
cálcio (Ca2+) no coração de animais com hipertensão (Carneiro-Júnior et al., 2014;
Locatelli et al., 2014). Alterações nos níveis de Ca2+-ATPase do retículo
sarcoplasmático (RS) (SERCA) e trocador de sódio-cálcio (NCX) levam à diminuição
no pico de contratilidade, diminuição na remoção do cálcio intracelular e
prolongamento na duração do ciclo cardíaco (Houser et al., 2000). É possível que a
redução na expressão de SERCA e elevação nos de fosfolamban (FLB) e NCX sejam
responsáveis pela alteração na função contrátil em casos de hipertensão arterial.
Collins e colaboradores (2005) mostraram que SHR com idade entre 12 e 16
semanas apresentam diminuição na expressão de FLB e aumento nos níveis de RNAm
de NCX. Em ratos com hipertensão renovascular, Locatelli e cols. (2014) obtiveram os
mesmos resultados, com diminuição também dos níveis protéicos de SERCA2.
Todavia, o treinamento aeróbico tem sido efetivo em alterar o padrão de
expressão dessas proteínas, melhorando a função cardíaca, a sensibilidade ao cálcio e a
contratilidade dos cardiomiócitos (Carneiro-Júnior et al., 2013).
Garciarena e cols. (2009) mostraram que o treinamento em natação (90 min/dia,
5 dias/semana, 60 dias) aumentou a expressão da SERCA2, mas não influenciou a
expressão dos canais NCX em cardiomiócitos de ratos SHR exercitados. MacDonnell e
colaboradores (2005) demonstraram que, em ratas espontaneamente hipertensas
submetidas ao treinamento de baixa intensidade em esteira, houve aumento na
fosforilação nos canais de rianodina do tipo 2 (RyR2) e em 2 sítios de fosfolamban
(Ser16 e Thr17).
7
Entretanto, até o momento, pouco se sabe sobre os efeitos do treinamento em
natação com duração de 6 semanas sobre a deposição de colágeno, inflamação, diâmetro
de células do ventrículo esquerdo e propriedades mecânicas de cardiomiócitos de
animais espontaneamente hipertensos estimulados às frequências de 1 e 3 Hz.
Sabendo que o treinamento aeróbico de baixa intensidade é recomendado como
terapia não farmacológica no tratamento da hipertensão arterial sistêmica (Pescatello et
al., 2004) e que sua prática regular pode causar benefícios ao coração (Kolwicz et al.,
2007; Carneiro-Júnior et al., 2013; Locatelli et al., 2014), o objetivo principal desse
estudo foi investigar os efeitos do treinamento em natação de baixa intensidade sobre os
parâmetros morfológicos e sobre as propriedades mecânicas de cardiomiócitos de ratos
normotensos e hipertensos.
8
2.0. OBJETIVOS
2.1 Geral:
Investigar os efeitos do treinamento aeróbico em natação sobre parâmetros
celulares, estruturais e mecânicos do ventrículo esquerdo (VE) de ratos com hipertensão
espontânea (SHR).
2.2 Específicos:
Avaliar se o treinamento aeróbico em natação afeta os seguintes parâmetros em
ratos com hipertensão espontânea (SHR):
• respostas eletrocardiográficas;
• pressão arterial média e frequência cardíaca;
• a massa do coração e ventrículos;
• células inflamatórias e diâmetro das fibras cardíacas;
• conteúdo de colágeno;
• dimensões, amplitude de contração, tempo para o pico de contração e tempo
para metade do relaxamento de cardiomiócitos isolados do ventrículo esquerdo;
9
3.0. METODOLOGIA
3.1 Animais
Para a realização dos experimentos foram utilizados ratos das linhagens Wistar e
SHR, machos (Rattus norvegicus), com 4 meses de idade, provenientes do Centro de
Ciência Animal da Universidade Federal de Ouro Preto. Os experimentos se iniciaram
com um total de 80 animais e ocorreram perdas amostrais durante a realização de
algumas técnicas.
Os animais foram mantidos em caixas de polietileno, com no máximo 4 ratos
por caixa, receberam água e ração convencional ad libitum, em ambiente com ciclo
claro/escuro de 12 horas. Todos os protocolos realizados foram devidamente aprovados
pelo Comitê de Ética em Uso Animal (protocolo número 2012/54).
3.2 Protocolo de exercício físico
Cada linhagem foi dividida em dois grupos experimentais: ratos sedentários
(Sed) e ratos submetidos ao exercício físico (Ex) (natação sem carga) e todos os animais
foram pesados antes do início do protocolo de treinamento e ao final da última sessão de
treino do protocolo. Os animais foram submetidos ao treinamento de natação sem carga,
por este ser considerado um modelo descrito na literatura de indução de hipertrofia
cardíaca fisiológica em ratos (Locatelli et al., 2014).
No primeiro dia, os animais exercitados foram submetidos à natação por 20
minutos, no segundo dia, por 40 minutos e do terceiro ao trigésimo dia, por 60 minutos,
5 vezes por semana. A natação foi realizada em um tanque adaptado com 12 divisórias
de 38 por 60 cm de largura e 50 cm de profundidade e a temperatura da água era
mantida em 30 ± 2ºC, através do uso do termostato.
Os grupos de animais sedentários foram colocados em baldes (4 ratos por balde)
com água rasa (±15 cm de altura, em temperatura de 30±2ºC), para que os mesmos
fossem semelhantemente manipulados e expostos às condições de estresse dos grupos
exercitados (Locatelli et al., 2014). O protocolo de natação foi realizado no Centro de
Ciência Animal da UFOP.
10
3.3 Confecção de cânulas vasculares para registro de sinais cardiovasculares
Cânulas foram confeccionadas a partir de 4 cm de tubos de polietileno (PE) 10,
polimerizados por aquecimento e 16 cm de PE 50. O interior das cânulas foi preenchido
com uma solução salina (NaCl, 0,9%) e a extremidade livre de PE 50 foi fechada com
um oclusor metálico antes das canulações.
3.4 Obtenção dos sinais cardiovasculares em ratos anestesiados
A 1ª etapa dos experimentos foi realizada na Universidade Federal de Ouro
Preto.
Os animais dos grupos Wistar e SHR foram anestesiados com uma mistura de
ketamina e xilazina (50 mg/kg e 10 mg/kg, ip, respectivamente), por via intraperitoneal.
Após a anestesia foram realizadas a tricotomia e assepsia da região inguinal esquerda;
uma pequena incisão para exposição do feixe femoral foi realizada. Para obtenção do
sinal da pressão arterial foi inserido um catéter de PE na artéria femoral. Após a
cateterização, a extremidade mais fina (PE10) se localizava na aorta abdominal, abaixo
das artérias renais. A extremidade PE50 do catéter inserido na artéria femoral foi, então,
acoplada a um transdutor de pressão TruWave® (Edwards Lifescience, Canadá) para
aquisição do sinal de PA. Para possibilitar a medição da diferença de potencial relativa à
derivação DII do eletrocardiograma (ECG), agulhas hipodérmicas de aço inoxidável
foram inseridas no tecido subcutâneo dos animais. A derivação DӀӀ mediu a diferença
de potencial entre duas agulhas hipodérmicas posicionadas no membro inferior
esquerdo e superior direito do animal. Os registros tiveram duração de 2 minutos. Os
sensores de ECG e o transdutor de PA foram acoplados a um sistema condicionador,
que fornece sinais em tempo real, a uma frequência de 1200 Hz, processados por uma
placa conversora analógico-digital (DaqBoard/2001, EUA).
Os registros digitais dos experimentos foram convertidos pelo software Matlab
7.0 (MathWorks, EUA) e os sinais foram analisados por inspeção visual do registro com
o auxílio do software WinDaq/EX Playback and Analysis (DATAQ Instruments, USA).
Foram selecionados 3 segmentos de 2 segundos, que foram gravados para posterior
obtenção dos parâmetros cardiovasculares (Maciel, et al., 2010). Foram extraídos os
seguintes parâmetros cardiovasculares: PA sistólica (PAS) e diastólica (PAD),
frequência cardíaca (FC) obtida a partir do intervalo RR do ECG, o intervalo QT do
11
ECG e ainda o QTc (intervalo QT corrigido pelo índice de Fridericia, (1920): QTc =
QT/(RR)1/3), recomendado para intervalos RR menores que 500 ms. A PAM foi
calculada pela seguinte equação: PAM = PAD + 1/3 (PAS – PAD) (Guyton e Hall,
2006).
3.5 Registro direto da frequência cardíaca e pressão arterial média em ratos
acordados
A avaliação dos diferentes parâmetros cardiovasculares (PAM e FC) foi
realizada 24 horas após a realização do ECG. As cânulas arteriais foram acopladas ao
sistema computadorizado de aquisição de dados (Powerlab). Heparina foi injetada nas
cânulas antes da conexão junto ao transdutor.
A PA foi monitorada por um transdutor de pressão modelo Gould, conectado a
um amplificador (PM-1000, CWE). O sinal de pressão arterial pulsátil foi derivado para
um cardiotacômetro (PM-1000,CWE) para se obter a FC. A PAP e a FC foram
continuamente amostradas por um sistema de conversão analógico/digital de 12 bits
(Powerlab 4/20), a uma frequência de 800 Hz e armazenados em disco rígido.
Posteriormente, o sinal foi processado por um software (Powerlab 4/20) para se obter a
PAM, as características temporais e as alterações máximas dos parâmetros desejados.
Simultaneamente, a PAM e a FC foram calculadas a partir de pulsos de PA. Essas
variáveis foram apresentadas simultaneamente em canais distintos no monitor e
armazenadas em disco rígido do computador.
3.6 Retirada do coração
Ao término dos experimentos in vivo, os animais foram submetidos à eutanásia
por decapitação, submetidos a uma laparotomia mediana para ressecção do coração.
3.7 Análise histológica
Para as análises histológicas do ventrículo esquerdo, fragmentos não excedentes
a 1 cm de espessura dos tecidos foram fixados em Metanol 80% + Dimetilsulfóxido
(DMSO) 20% (Gava et al., 2012) e mantidos em geladeira -4°C até serem processados.
Nesse processo foram desidratados, diafanizados, embebidos e emblocados em
parafina. Secções parafinadas de aproximadamente 4µm de espessura foram obtidas
através de técnicas de microtomia, fixadas em lâminas de vidro. As lâminas obtidas
12
foram coradas pelas técnicas de Hematoxilina e Eosina (HE) ou Picrosirius Red para
avaliações das principais alterações estruturais.
Foram realizadas avaliações quantitativas por técnicas de morfometria digital.
Para isso, foram obtidas 10 imagens aleatórias do tecido cardíaco (Cabanelas et al.,
2012) com ocular de 10X e objetiva de 40X no microscópio Leica DM5000 acoplado a
câmera digital (Leica DFC 300 FX), com auxílio do software de captura de imagens
Leica Application Suite. As imagens foram analisadas no software Leica Qwin V.3.2.1
(Leica Switzerland). Para a avaliação do quadro inflamatório cardíaco, o número total
de células presentes no campo microscópico foi determinado pela contagem
semiautomática de núcleos celulares (Ferreira Júnior et al., 2015). Além disso, no
coração também foi avaliada a espessura das fibras miocárdicas, através de medidas
interativas, pelo desenho de uma reta ligando os limites celulares superior e inferior na
região do núcleo. Somente fibras com núcleos e limites celulares visíveis foram
incluídas, com total de cem cardiomiócitos analisados para cada animal.
Para a análise quantitativa do colágeno dos tipos I e III foi utilizada a coloração
de Picrosirius Red (Junqueira et al., 1979) e contagem das fibras em microscópio ótico
de luz polarizada, por meio de análise digital de birrefringência. Foram obtidas 20
imagens aleatórias do tecido cardíaco com objetiva de 20X no microscópio Leica
DM5000 acoplado a câmera digital (Leica DFC 300 FX) utilizando o software de
captura de imagens Leica Application Suite. A luz polarizada possibilita distinguir três
cores: a coloração verde, característica das fibras colágenas finas, reticulares do tipo III
e o espectro de cor amarela até a cor vemelha, que indica fibras colágenas densas do
tipo I. As imagens foram analisadas com o auxílio do software Leica Qwin V.3.2.1
(Leica Switzerland).
Todas as análises histológicas foram realizadas no setor de microscopia do
Laboratório Multiusuários do Núcleo de Pesquisas em Ciências Biológicas da UFOP.
3.8 Massa do coração e dos ventrículos
Na segunda etapa dos experimentos, que foi realizada na Universidade Federal
de Viçosa, foram avaliadas a massa do coração e dos ventrículos. Setenta e duas horas
após a última sessão do treinamento, os animais foram pesados, e em seguida, foi
realizada a eutanásia por decapitação em dois animais por dia, alternando os grupos
13
(sedentário e treinado). O coração foi removido através da toracotomia, lavado em
solução contendo 750 mM de CaCl2, para retirar o excesso de sangue, e, imediatamente
pesado em balança de precisão (Gehaka – Brasil, modelo AG 200).
Após a perfusão com as soluções de isolamento, os ventrículos direito e
esquerdo foram separados dos átrios e pesados. O índice de hipertrofia cardíaca foi
calculado pela razão entre a massa do coração (mg) e a massa corporal (g). Em
contrapartida, o índice de hipertrofia ventricular foi calculado pela razão entre a massa
do ventrículo (mg) e a massa corporal (g).
3.9 Isolamento dos cardiomiócitos
Após a eutanásia, o coração foi removido e lavado para retirar o excesso de
sangue, antes da perfusão das soluções de isolamento. Em seguida, a artéria aorta
ascendente foi canulada e o coração isolado foi colocado em um sistema de perfusão. A
solução de isolamento contendo 750 mM de CaCl2 (solução 1), foi perfundida, em fluxo
constante, até que os vasos coronarianos estivessem limpos. Logo após, foi trocada a
perfusão para a solução livre de cálcio, contendo 0,1 mM de ácido tetracético
etilenoglicol (EGTA) (solução 2), durante 4 a 6 minutos, para destruição dos discos
intercalares e quelação do Ca2+. Em seguida, o coração foi perfundido com uma solução
contendo 1mg.ml-1 de colagenase tipo 2 (Worthington, EUA) e 0,1mg.ml-1 de protease
(solução 3), durante 10 a 15 minutos, para destruição da matriz extracelular e fibras de
colágeno. Durante o isolamento, todas as soluções foram oxigenadas (O2 100% - White
Martins, Brasil) e mantidas em temperatura de 37º C.
Após a perfusão, os ventrículos (direito e esquerdo) foram separados dos átrios.
O ventrículo esquerdo foi aberto na região do septo interventricular. Os músculos
papilares e o tecido conjuntivo foram removidos manualmente de sua superfície.
Fragmentos finos (< 1mm) foram obtidos dos ventrículos esquerdo e direito. As
amostras foram identificadas e colocadas em solução contendo 5 ml de solução
enzimática (colagenase) e protease. Os frascos foram agitados durante 5 minutos, em
banho-maria, à temperatura de 37º C, com oxigenação dos tecidos (O2 100% - White
Martins, Brasil). A seguir, o conteúdo dos frascos foi filtrado e centrifugado (3000 rpm)
por 30 segundos. O sobrenadante foi removido e os cardiomiócitos suspendidos na
solução 750 mM de CaCl2. Os processos de agitação e filtração foram repetidos. Os
14
cardiomiócitos foram armazenados em placas de Petri em refrigerador (5ºC), até serem
utilizados.
3.9.1 Soluções de isolamento
As soluções utilizadas para o isolamento dos cardiomiócitos foram feitas
utilizando-se uma solução básica com água deionizada ultrapura (Milli-Q) e a seguinte
composição (em mM): NaCl – 7,6 g/l; MgCl2 – 0,28 g/l; KCl – 0,4 g/l; ácido
etanosulfônicohidroxietil piperazina (HEPES) – 1,2 g/l; glicose – 1,8 g/l; taurina – 2,5
g/l; creatina – 1,3 g/l; pH = 7,3; temperatura ambiente.
Solução 1:
Para se fazer a solução de isolamento contendo Ca2+, foram adicionados 375 µl
de CaCl2 (1M) em 500 ml da solução básica.
Solução 2:
Para a solução de isolamento livre de Ca2+, foram adicionados 200 µl de EGTA
(100 mM) em 250 ml da solução básica.
Solução 3:
Para a solução enzimática de isolamento, foram adicionados 30 mg de
colagenase e 3 mg de protease em 30 ml da solução básica.
3.9.2 Solução de perfusão tampão HEPES
Durante as análises da contratilidade celular, os cardiomiócitos isolados do
ventrículo esquerdo foram banhados com uma solução fisiológica contendo (em mM):
solução estoque: NaCl– 80 g/l; HEPES– 23,8 g/l; NaH2PO4– 0,51 g/l; MgCl2 – 5 g/l;
KCl – 4,25 g/. Para fazer um litro da solução de perfusão tampão HEPES, foram
adicionados 100 ml da solução estoque, 1 g de glicose e 1,8 ml de CaCl2 em 800 ml de
água deionizada ultrapura (Milli-Q). Esta solução foi equilibrada para um pH = 7,4 e
mantida em temperatura ambiente.
3.10 Contratilidade celular
As contrações dos cardiomiócitos isolados do ventrículo esquerdo foram
medidas através da técnica de alteração do comprimento das células, utilizando-se o
15
sistema de detecção de bordas (Ionoptix, EUA) montado num microscópio invertido
(Nikon Eclipse – TS100, EUA), equipado com uma lente objetiva de imersão em óleo (S
Fluor, 40x, Nikon, EUA). Para as análises das contrações foram utilizados somente as
células que estavam em boas condições, com as bordas e estriações sarcoméricas bem
definidas, relaxadas, sem apresentarem contrações involuntárias. Os cardiomiócitos
isolados foram acomodados em uma câmara experimental giratória com a base de vidro
montada no microscópio, e banhados pela solução de perfusão tampão HEPES (item
6.3.2) em temperatura ambiente (~ 25ºC). As células foram visualizadas em um monitor
através de uma câmera (Myocam, Ionoptix, EUA), acoplada ao microscópio invertido,
utilizando-se um programa de detecção de imagens (Ionwizard, Ionoptix, EUA) com
uma frequência de 240 Hz.
Os cardiomiócitos foram estimulados externamente à frequência de 1 e 3 Hz (20
V, duração de 5 ms) utilizando-se um par de eletrodos de aço, acoplado nos dois lados
internos da câmara, através de um estimulador elétrico (Myopacer, Field Stimulator,
Ionoptix, EUA). As bordas dos cardiomiócitos foram identificadas com duas janelas
(direita e esquerda) e definidas através do ajuste do contraste (preto e branco) gerado
pela qualidade da imagem projetada dos cardiomiócitos. As contrações dos
cardiomiócitos após a estimulação elétrica foram capturadas pelo sistema de detecção
de bordas (Ionwizard, Ionoptix, EUA) (Figura 1) e armazenadas para análise posterior.
Figura 1: Representação do programa utilizado na aquisição das imagens e dos registros das
contrações das células cardíacas (Ionoptix, EUA). As projeções dos picos verde e vermelho
representam as definições das bordas direita e esquerda de um cardiomiócito, respectivamente.
A partir dos registros obtidos, foram analisadas a amplitude de contração
(variação do comprimento celular de repouso, %), o tempo para o pico de contração e o
tempo para metade (50%) do relaxamento. Esses parâmetros foram determinados
16
utilizando um software desenvolvido em plataforma MatLab. Os principais parâmetros
avaliados são demonstrados na Figura 2.
Figura 2: Representação de uma contração celular e os parâmetros avaliados (adaptado de
Carneiro-Júnior, 2013).
3.11 Análise estatística
Para análise dos dados utilizamos o teste estatístico ANOVA two-way (Wistar X
SHR - fator hipertensão; Sedentários X Exercitados - fator exercício), seguido do pósteste de Bonferroni para os fatores que apresentaram interação. Para as comparações
entre as médias de massa corporal inicial e final foi utilizado o teste t de Student
pareado. Todas as análises foram realizadas pelo software GraphPad Prism 5. Foram
consideradas diferenças significativas para p < 0,05.
17
4.0. RESULTADOS
4.1 Valores do índice QTc em ratos anestesiados
É importante esclarecer que, ao iniciar os experimentos da 1ª etapa, o número de
animais em cada grupo era de 15. A nossa perda amostral ocorreu devido ao fato de
que alguns animais morreram após a canulação e, na segunda etapa dos experimentos,
muitas vezes a decapitação não foi realizada de maneira correta para a retirada do
coração com um prolongamento adequado da aorta para a canulação e o animal não era
utilizado.
Os dados foram analisados através da ANOVA two way e para os valores de QT
não houve interação entre os fatores. Contudo, houve efeito principal do fator exercício
(F(1,31)=30,73), mas não houve distinção de grupos onde esse efeito foi significativo. O
fator hipertensão também foi significativo (F(1,31)=5,28), sem identificação dos grupos
onde houve efeito principal.
Na figura 3 estão apresentados os valores do intervalo QT corrigido (QTc) dos
animais Wistar (n=9 para cada grupo) e SHR (n=11 para o grupo SHR Sed e n=8 para o
grupo SHR Ex) anestesiados. A ANOVA two way mostrou que houve interação entre
os fatores (F(1,30)=4,93) e efeito principal do fator exercício (F(1,30)=41,3). Após a análise
do pós-teste de Bonferroni, observou-se que os grupos treinados (Wistar Ex e SHR Ex)
apresentaram valores significativamente menores para o índice QTc, em relação aos
seus controles, mostrando que o treinamento provocou melhoria da atividade elétrica
ventricular. O valor apresentado pelo grupo SHR Sed foi menor, em relação ao grupo
Wistar Sed (110,9 ± 3,61 vs. 125,2 ± 5,39 ms).
Figura 3: Índice QTc de ratos Wistar e SHR anestesiados. Dados expressos como média ±
EPM. * diferente em relação a Wistar Sed. + diferente em relação a SHR Sed.
18
4.2 Níveis basais de frequência cardíaca e pressão arterial média em ratos
acordados e anestesiados
Os resultados da FC de ratos acordados e anestesiados e a PAM de ratos
acordados, obtidos após o protocolo de treinamento em natação, estão apresentados na
figura 4.
Figura 4: (A) Frequência cardíaca de repouso de ratos acordados; (B) Frequência cardíaca de
repouso de ratos anestesiados e (C) Pressão Arterial Média de ratos acordados. Dados expressos
como média ± EPM.* diferente em relação a Wistar Sed. # diferente em relação a Wistar Ex. +
diferente em relação a SHR Sed; n=6.
A análise através da ANOVA two way mostrou interação entre os fatores para os
dados de FC em animais acordados (F(1,20)=10,95) e efeitos principais do exercício
(F(1,20)=59,15) e da hipertensão (F(1,20)=80,78). Após a análise do pós-teste, observamos
que no grupo Wistar Ex houve redução nos valores de FC em animais acordados, em
relação ao grupo Wistar Sed. Da mesma forma, o grupo SHR Ex também apresentou
valores significativamente menores de FC, quando comparados aos valores do grupo
SHR Sed (384 ± 3 vs. 448 ± 10 bpm). Em contrapartida, mesmo após o exercício, o
19
grupo SHR Ex manteve elevados os valores de FC, em relação aos grupos Wistar Ex
(384 ± 2 vs. 323 ± 3 bpm) (figura 4A).
Houve interação entre os fatores na análise dos dados de FC de repouso de ratos
anestesiados (F(1,33)=27,94) e efeitos principais do exercício (F(1,33)=17,61) e da
hipertensão (F(1,33)=87,72). Os resultados do pós-teste mostraram que o grupo Wistar Ex
apresentou redução nos valores após o treinamento, em relação a Wistar Sed. Os grupos
SHR apresentaram valores significativamente menores de FC, em relação aos seus
respectivos controles (SHR Sed: 220 ± 3 vs. Wistar Sed: 189 ± 4 bpm; SHR Ex: 228 ± 6
bpm vs. Wistar Ex: 261 ± 10 bpm). Contudo, não houve diferença significativa entre os
grupos hipertensos (figura 4B).
Em relação aos valores de PAM de ratos acordados, observamos que houve
interação (F(1,20)=4,51) e efeitos principais do exercício (F(1,20)=30,8) e da hipertensão
(F(1,20)=233,4). O pós-teste mostrou que os animais SHR Sed apresentaram maiores
valores de PAM, em relação a Wistar Sed (189 ± 4 vs. 124 ± 1 mmHg). Ao final de 6
semanas de natação, o grupo SHR Ex apresentou valores significativamente menores de
PAM, em relação ao SHR Sed (164 ± 2 vs. 189 ± 4 mmHg) (figura 4C).
Ao analisarmos os valores de PAM em animais anestesiados, observamos que
não houve interação entre os fatores (F(1,33)=4,02). Contudo, houve efeito principal do
fator hipertensão (F(1,33)=83,7), mas não houve distinção de grupos onde esse efeito foi
significativo. O fator exercício também foi significativo (F(1,33)=6,33), sem identificação
dos grupos onde houve efeito principal.
4.3 Avaliação morfológica do tecido cardíaco
Em relação à avaliação histológica, as análises mostraram interação entre os
fatores, tanto no número de células inflamatórias (F(1,20)=14,93), quanto no diâmetro das
fibras cardíacas (F(1,20)=117,1).
Na análise do número de células inflamatórias observamos que houve efeito do
fator hipertensão (F(1,20)=5,73), mas não do fator exercício. O pós-teste mostrou que o
treinamento aumentou o número de células inflamatórias no grupo Wistar Ex, em
comparação a Wistar Sed (118 ± 13 vs. 89 ± 4 células/77.040µm2). A hipertensão
arterial provocou aumento da inflamação no grupo Sed, comparado a Wistar Sed (136 ±
20
2 vs. 89 ± 4 células/77.040µm2). Em contrapartida, após 6 semanas de natação o grupo
SHR Ex apresentou melhora no perfil inflamatório tecidual (107 ± 6 vs. 136 ± 2
células/77.040µm2) (figura 5A).
A figura 5B representa os valores do diâmetro das fibras cardíacas. Tanto o fator
exercício como o fato hipertensão tiveram efeitos principais (F(1,20)=188,1 e
F(1,20)=36,91, respectivamente). Após o exercício, o grupo Wistar Ex apresentou maior
diâmetro das fibras, em relação a Wistar Sed (18,4 ± 0,32 vs. 9,8 ± 0,84 µm). O grupo
de animais hipertensos sedentários também apresentou maiores valores no diâmetro da
fibra cardíaca, em relação ao grupo normotenso sedentário (22,3 ± 0,41 vs. 9,8 ± 0,84
µm). Em contrapartida, o protocolo de natação provocou redução nesses valores no
grupo SHR Ex, em relação ao grupo SHR Sed (19,8 ± 0,22 vs. 22,3 ± 0,41 µm).
Na figura 6 estão representados cortes histológicos do ventrículo esquerdo de
ratos Wistar e SHR, corados com hematoxilina/eosina. Em (a) se observa aspecto
histológico compatível com a normalidade, demonstrando ausência de processo
inflamatório; em (b) há processo inflamatório discreto de caráter difuso e hipertrofia de
grau leve; já em (c) um processo inflamatório moderado se apresenta, com caráter
multifocal e hipertrofia de grau moderado e na figura (d) há representação de um
processo inflamatório discreto de caráter multifocal e hipertrofia de grau leve.
Figura 3: (A) Número de células inflamatórias no ventrículo esquerdo; (B) Diâmetro de
cardiomiócitos do VE de ratos Wistar e SHR. Dados expressos como média ± EPM. * diferente
em relação a Wistar Sed.+ diferente em relação a SHR Sed.
21
a
Sedentário
b
Exercício
Wistar
c
Sedentário
d
Exercício
SHR
Figura 4: Fotomicrografias de cortes histológicos do ventrículo esquerdo de ratos normotensos e hipertensos. (a) Aspecto histológico compatível
com a normalidade demonstrando ausência de processo inflamatório e cardiomiócitos com diâmetros variando entre 7 e 11 µm em animais Wistar
Sed; (b) processo inflamatório discreto de caráter difuso e hipertrofia de grau leve em animais Wistar Ex; (c) processo inflamatório moderado de
caráter multifocal e hipertrofia de grau moderado em SHR Sed; (d) processo inflamatório discreto de caráter multifocal e hipertrofia de grau leve em
SHR Ex. Hematoxilina-Eosina. Barra = 50µm.
22
A análise de colágenos dos tipos I e III mostrou interação entre os fatores
(F(1,19)=29,48 e F(1,20)=21,07, respectivamente). Também houve efeito principal dos
fatores exercício e hipertensão (tipo I: F(1,19)=65,25 e F(1,19)=42,16; tipo III F(1,20)=99,73
e F(1,20)=10,81).
Animais hipertensos sedentários (SHR Sed) apresentaram aumento significativo
nas áreas de deposição de colágeno do tipo I (Figura 7A) e do tipo III (Figura 7B), em
relação aos animais Wistar Sed (tipo I: 8,28 ± 915 vs. 2,04 ± 356 µ 2; tipo III: 8,89 ± 519
vs. 5,32 ± 386 µ 2). Adicionalmente, foi possível observar que o treinamento físico
diminuiu a deposição de colágeno, reduzindo as áreas tanto de colágeno do tipo I (1.192
± 187 vs. 8.283 ± 915 µ 2) quanto de colágeno do tipo III (2.293 ± 574 vs. 8.898 ± 519
µ 2) em animais hipertensos (Figuras 7A e 7B).
As fotomicrografias representadas na figura 8 mostram a ocorrência de colágeno
dos tipos I e III em ventrículo esquerdo de ratos normotensos e hipertensos. Em (“a” e
“e”) há presença de fibras reticulares (colágeno tipo III, cabeça de seta); em (“b” e “f”)
há aspecto histológico compatível com a normalidade, demonstrando ausência de
processo de deposição de colágeno; as figuras (“c” e “g”) mostram deposição de
colágeno, com aumento expressivo de fibras reticulares (colágeno tipo III, cabeça de
seta) e de fibras colágenas tipo I (seta) e em (“d” e “h”) há aspecto histológico
compatível com a normalidade, demonstrando ausência de deposição de colágeno.
Figura 5: (A) Conteúdo de colágeno do tipo I e (B) Conteúdo de colágeno do tipo III no
ventrículo esquerdo de ratos Wistar e SHR. Dados expressos como média ± EPM. * diferente
em relação a Wistar Sed. + diferente em relação a SHR Sed.
23
a
b
c
d
e
f
g
h
Sedentário
Exercício
Wistar
Sedentário
Exercício
SHR
Figura 6: Fotomicrografias de cortes histológicos do ventrículo esquerdo de ratos normotensos e hipertensos; (a, e) Presença de fibras reticulares
(Colágeno tipo III, cabeça de seta) em animais Wistar Sed; (b, f) Aspecto histológico compatível com a normalidade demonstrando ausência de
processo de deposição de colágeno em animais Wistar Ex; (c, g) Deposição de colágeno com aumento expressivo de fibras reticulares (colágeno tipo
III, cabeça de seta) e de fibras colágenas tipo I (seta) em SHR Sed; (d, h) Aspecto histológico compatível com a normalidade demonstrando ausência
de processo de deposição de colágeno em SHR Ex. Picrosirius Red. Barra = 50µm.
24
4.4 Massa corporal, massa do coração e massa dos ventrículos
Na Tabela 1 estão apresentados os resultados referentes à massa corporal inicial
e final, massa do coração, massa dos ventrículos, massa relativa dos ventrículos, massa
do ventrículo esquerdo, massa relativa do ventrículo esquerdo, massa do ventrículo
direito e massa relativa do ventrículo direito dos ratos Wistar e SHR.
Conforme esperado, todos os animais aumentaram a massa corporal até o fim do
protocolo de treinamento. Os animais SHR apresentaram menor massa corporal ao final
de 6 semanas, quando comparado ao grupo Wistar. A massa dos ventrículos se
apresentou maior nos grupos hipertensos, em relação aos animais normotensos
sedentários. Os animais hipertensos submetidos ao treinamento demonstraram valores
ainda maiores, quando comparados ao grupo Wistar Ex. Da mesma maneira, os grupos
SHR apresentaram aumento na massa relativa do ventrículo esquerdo, em relação aos
grupos Wistar. Isso mostra que a hipertensão arterial promoveu a hipertrofia dos
ventrículos. Já em relação à massa total dos ventrículos e à massa total e relativa do
ventrículo direito, não foram observadas alterações significativas provocadas nem pela
hipertensão, nem pelo treinamento aeróbico.
25
Tabela 1: Massa corporal, massa do coração, massa dos ventrículos esquerdo e direito e massas
relativas dos grupos experimentais
Wistar Sed
Wistar Ex
SHR Sed
SHR Ex
MCI (g)
330,5 ± 7
336,1 ± 8
286,3 ± 5*#
284,1 ± 3*#
MCF (g)
382,7 ± 6+
363,5 ± 8+
314,2 ± 4*#+
303,4 ± 3*#+
MC (g)
1,17 ± 0,03
1,18 ± 0,02
1,32 ± 0,04*#
1,39 ± 0,03*#
MC/MCF
3,17 ± 0,13
3,38 ± 0,06
4,34 ± 0,12*#
4,58 ± 0,13*#
MV (g)
1,47 ± 0,12
1,64 ± 0,04
1,66 ± 0,04
1,72 ± 0,08
MV/MCF
3,95 ± 0,23
4,71 ± 0,12*
5,48 ± 0,15*
5,66 ± 0,3*#
MVE (g)
0,78 ± 0,02
0,81 ± 0,02
0,97 ± 0,04*#
0,95 ± 0,04*#
MVE/MCF
2,11 ± 0,03
2,32 ± 0,09
3,2 ± 0,15*#
3,13 ± 0,14*#
MVD (g)
0,27 ± 0,03
0,32 ± 0,02
0,25 ± 0,02
0,31 ± 0,03
MVD/MCF
0,72 ± 0,06
0,94 ± 0,07
0,84 ± 0,07
1,02 ± 0,11
(mg/g)
(mg/g)
(mg/g)
(mg/g)
Dados expressos como média ± EPM. MCI, Massa Corporal Inicial. MCF, Massa Corporal
Final. MC, Massa do Coração. MV, Massa do Ventrículo. MVE, Massa do Ventrículo
Esquerdo. MVD, Massa do Ventrículo Direito. * diferente em relação a Wistar Sed, comparando
a mesma variável. # diferente em relação a Wistar Ex, comparando a mesma variável. + diferente
em relação ao valor inicial dentro do mesmo grupo; n=5.
4.5 Dimensões dos cardiomiócitos isolados do ventrículo esquerdo
Na figura 9 estão representados graficamente os valores do comprimento e da
relação comprimento/largura de cardiomiócitos isolados do ventrículo esquerdo de ratos
Wistar e SHR.
A análise da ANOVA two way mostrou interação entre os fatores, tanto no
comprimento (F(1,175)=0,71), quanto na relação comprimento/largura (F(1,175)=4,35).
O pós-teste mostrou que o treinamento em natação induziu aumento no
comprimento celular (figura 9A) de cardiomiócitos de Wistar Ex, em relação a Wistar
Sed (122 ± 2,75 vs. 111,2 ± 3,22 µm), o que também ocorreu na relação
comprimento/largura (4,43 ± 016 vs. 3,55 ± 0,18 µm) (figura 9B).
26
Em relação à largura dos cardiomiócitos, só houve efeito principal do exercício
(F(1,176)=4,25), sem interação entre os fatores.
Após a análise dos dados de volume dos cardiomiócitos não houve interação e
nem efeito principal do exercício, tampouco da hipertensão.
Figura 7: (A) Comprimento e (B) Relação comprimento/largura de cardiomiócitos isolados do
ventrículo esquerdo de ratos Wistar e SHR. Dados expressos como média ± EPM. * diferente
em relação a Wistar Sed. n=50 células.
4.6 Contratilidade de cardiomiócitos isolados do ventrículo esquerdo
Os parâmetros para avaliação da contratilidade dos cardiomiócitos foram
analisados após a estimulação das células nas frequências de 1(F1) e 3 (F3) Hz (Figuras
10 e 11, respectivamente).
A análise de variância mostrou que houve interação entre os fatores para os
dados da variável tempo para o pico de contração (F(1,149)=10,41) em F1. Os fatores
exercício e hipertensão também tiveram efeitos principais (F(1,149)=10,41 e
F(1,149)=32,34, respectivamente). No pós-teste, verificamos que o tempo para o pico em
SHR Sed foi maior do que em Wistar Sed (446 ± 13 vs. 344 ± 11 ms). O treinamento
aeróbico provocou a redução desses valores em SHR Ex (372 ± 9 vs. 446 ± 13 ms)
(figura 10A).
A variável tempo para 50% do relaxamento mostrou efeito principal apenas para
o fator hipertensão (F(1,149)=36,38). Como não houve interação entre os fatores, não
pudemos identificar em quais grupos esse efeito foi maior.
Em relação à amplitude do pico, observamos que houve interação entre os
fatores (F(1,149)=16,54) e que o fator exercício apresentou efeito principal (F(1,149)=8,18).
27
Em SHR Sed os valores foram maiores, quando comparados a Wistar Sed (4,2 ± 0,35
vs. 2,6 ± 0,21 %). No grupo SHR Ex, observamos que houve redução nesses valores,
quando comparados aquele de SHR Sed (2,22 ± 0,17 vs. 4,2 ± 0,35%) (Figura 11B).
Figura 8: Função contrátil de cardiomiócitos isolados do ventrículo esquerdo de ratos Wistar e
SHR estimulados a 1 Hz. (A) Tempo para o pico de contração e (B) Amplitude de contração.
Dados expressos como média ± EPM. * diferente em relação a Wistar Sed. + diferente em
relação a SHR Sed; n=50 células.
As mesmas variáveis foram estudadas na frequência de 3 Hz. A ANOVA two
way mostrou que houve interação entre os fatores (F(1,140)=1,13). Também houve efeito
principal dos fatores exercício (F(1,140)=7,37) e hipertensão (F(1,140)=20,98). O tempo
para o pico foi maior em SHR Sed, em relação a Wistar Sed (320 ± 5 vs. 284 ± 7 ms).
Em contrapartida, o treinamento diminuiu esses valores no grupo hipertenso (296 ± 5
vs. 320 ± 5 ms) (figura 11A).
Ao analisarmos a variável tempo para 50% do relaxamento também verificamos
interação entre os fatores (F(1,140)=0,53). Houve efeito principal dos fatores exercício
(F(1,140)=12,55) e hipertensão (F(1,140)=25,13). O pós-teste mostrou que o grupo SHR Sed
apresentou maiores valores de tempo do que Wistar Sed (218 ± 7 vs. 173 ± 8 ms).
Todavia, o treinamento provocou redução nesses valores no grupo com hipertensão
(185 ± 8 vs. 218 ± 7 ms) (figura 11B).
A ANOVA two way mostrou que também houve interação entre os fatores na
variável amplitude de contração (F(1,140)=5,19). Entretanto, os fatores exercício e
hipertensão não mostraram efeitos principais isolados. O pós-teste mostrou que os
animais com hipertensão exercitados apresentaram amplitude do pico de contração
menor do que SHR Sed (2,96 ± 0,24 vs. 4,14 ± 0,32) na F3 (figura 11C).
28
Figura 9: Função contrátil de cardiomiócitos isolados do ventrículo esquerdo de ratos Wistar e
SHR estimulados a 3 Hz. (A) Tempo para o pico de contração; (B) Tempo para 50% do
relaxamento e (C) Amplitude de contração. Dados expressos como média ± EPM. * diferente em
relação a Wistar Sed. # diferente em relação a Wistar Ex. + diferente em relação a SHR Sed;
n=50 células.
29
5.0. DISCUSSÃO
Os resultados obtidos no presente estudo, em síntese, mostraram que o
treinamento em natação com duração de 6 semanas melhorou os parâmetros
morfológicos do tecido cardíaco, além de promover a redução da PAM e FC de ratos
espontaneamente hipertensos. Em se tratando da função ventricular, o exercício
provocou melhora nas funções sistólica e diastólica, representadas, respectivamente,
pela diminuição do tempo para o pico de contração e diminuição do tempo para metade
do relaxamento.
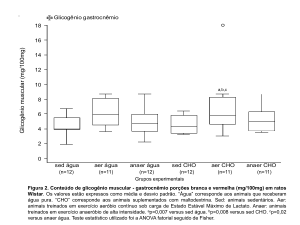
Os resultados desse estudo mostraram que o treinamento em natação reduziu os
níveis de PAM em animais hipertensos acordados. Acreditamos que essa redução esteja
relacionada à diminuição do tônus simpático e da atividade do sistema reninaangiotensina-aldosterona no coração, sem desconsiderar a atuação de mecanismos
periféricos, tais como a atenuação da resistência periférica total (provocada pela
diminuição da ativação simpática) e o aumento da produção de óxido nítrico, potente
vasodilatador.
Uma metanálise mostrou que indivíduos com hipertensão arterial que realizaram
exercício aeróbico regular tiveram reduções médias de 6,9/4,9 mmHg na PAM
(Cornelissen e Fagard, 2005). Dentre as principais recomendações que contribuem para
essa redução, podemos citar a prática de exercícios que envolvam grandes grupos
musculares, com intensidade entre 40 e 60% do VO2pico e volumes de treinamento
maiores (com maior frequência semanal e/ou maior duração das sessões) (Alves e
Forjaz, 2007).
Diversos fatores podem estar associados à diminuição da PA basal após o
treinamento físico, tais como a diminuição do tônus vasomotor simpático, da
reatividade vascular, da atividade do sistema renina-angiotensina-aldosterona e do
estresse oxidativo, além da diminuição da resistência periférica (Kadowaki, 2000;
Amaral e Michelini, 2011).
A normalização do tônus simpático, que se encontra aumentado na hipertensão,
pode estar associada à bradicardia de repouso observada em animais treinados em
registros sem efeito de anestesia, já demonstrada em outros estudos com animais
espontaneamente hipertensos treinados (Gava et al., 1995; Véras-Silva et al., 1997). A
30
resposta bradicárdica ocorre tanto em humanos (Sandercock et al., 2005) quanto em
animais (Medeiros et al., 2004; Evangelista et al., 2005; Locatelli et al., 2014). Essa
redução pode estar associada ao aumento da atividade parassimpática (Robergs e
Roberts, 1997; Medeiros et al., 2004) e/ou redução no tônus simpático.
Quando anestesiados, os valores de FC foram menores nos grupos SHR,
comparados aos grupos Wistar. Isso pode ser explicado pelo uso da associação de
ketamina e xilazina, que, segundo Bencze e colaboradores (2013), provoca redução na
atividade simpática em SHR.
Alguns autores também sugerem que a redução nos níveis de PAM esteja
relacionada à diminuição do débito cardíaco (Seals e Reiling, 1991; Véras-Silva et al.,
1997), que pode ser atribuída tanto à redução do volume sistólico, quanto da FC.
O SRAA modula a progressão da hipertensão em SHR (Zamo et al., 2010). Ao
utilizar inibidores da enzima conversora de angiotensina e bloqueadores dos receptores
de Ang II, observa-se que há redução nos níveis de PA, o que sugere que esse modelo é
dependente desse sistema para manter elevados os níveis de PA (Lundie et al. 1997;
Paull e Widdop, 2001). O treinamento aeróbico também provoca redução nos níveis de
PA nesse modelo experimental (Hayashi et al., 2000). Zamo e colaboradores (2011)
mostraram que o treinamento em natação com duração de 8 semanas reduziu os valores
de PA em SHR, com uma diminuição na atividade do SRAA no coração.
Nos resultados do presente estudo houve diminuição do índice QTc após o
treinamento em natação, mostrando que o exercício pode ter contribuído para reduzir as
possíveis alterações na repolarização cardíaca verificadas no modelo de hipertensão
estudado (Klimas et al., 2012) e melhorar a atividade elétrica ventricular desses animais.
Os mecanismos compensatórios que ocorrem no coração com sobrecarga de
pressão inicialmente trazem benefícios ao órgão, mas, com o passar do tempo, o
aumento da massa do ventrículo e o estado crônico de sobrecarga aumentam o colágeno
no interstício e reduzem a densidade capilar, além de provocar apoptose no tecido
cardíaco (Pontes e Leães, 2004; Matsubara et al., 2006).
Ao analisar os resultados do presente estudo, observamos que a massa do VE em
modelo SHR foi maior, quando comparada aos valores dos grupos Wistar. A hipótese é
de que o SRAA esteja envolvido no desenvolvimento da hipertrofia no modelo de
hipertensão utilizado nesse estudo. O aumento do diâmetro das fibras cardíacas
31
associado ao aumento no número de células inflamatórias e conteúdo de colágeno apoia
a hipótese de que o padrão de hipertrofia descrito se aproxima, em suas características,
de um perfil patológico, que, por sua vez, pode levar à disfunção ventricular.
A Ang II por si só estimula a hipertrofia dos cardiomiócitos e a proliferação de
células do músculo liso vascular (Crowley et al., 2006; Castoldi et al., 2007). O
aumento da expressão gênica de componentes do SRAA no coração e na aorta de SHR
mostra que a ativação local pode contribuir para a hipertrofia cardíaca e para
remodelamento arterial (Li et al., 2008). Na fase inicial da hipertensão em SHR, um
aumento na densidade de receptores α1-adrenérgicos parece estar envolvido no
desenvolvimento da hipertrofia cardíaca (Imai et al., 1995).
Já está bem estabelecido que o SNS também participa do desenvolvimento da
hipertrofia nesse modelo de hipertensão (Folkow, 1972; Adams et al., 1989). Lee e
colaboradores (1987), por sua vez, mostraram que o bloqueio da via simpática previne
completamente o aparecimento de hipertensão e, consequentemente, a hipertrofia
cardíaca.
Estudos já mostraram que os cardiomiócitos de SHR são maiores, quando
comparados à linhagem Wistar (Brooksby et al., 1992; 1993; Tsutsui et al., 1999) e
apresentam um padrão de hipertrofia concêntrica (McCrossan et al., 2004). Isso
caracteriza uma resposta compensatória para normalizar o aumento do estresse na
parede ventricular, provocado pela elevação da PA (Anversa et al., 1983). Além disso,
Sun e colaboradores (2006) mostraram a evolução do processo inflamatório no coração
de animais dessa linhagem, através do aumento da expressão de citocinas próinflamatórias e marcadores de inflamação, confirmando a ideia de desenvolvimento de
hipertrofia patológica nessa linhagem.
A Ang II estimula diversas vias de sinalização que ativam a via do fator nuclear
kappa B (NF-ƘB), que tem um papel importante na regulação transcricional de diversos
genes pró-inflamatórios (Kranzhofer et al., 1999; Brasier et al., 2000; Savoia et al.,
2006). Alguns autores têm mostrado que essa via participa de processos inflamatórios
em diversos tecidos, dentre eles o vascular, o renal e o cardíaco, em diferentes modelos
de hipertensão arterial (Gonzalez et al., 2000; Muller et al., 2000).
Por sua vez, a Angiotensina (1-7) (Ang 1-7) é considerada um importante
peptídeo do SRAA, pois a maioria de suas ações apresenta efeitos cardioprotetores em
32
relação aos provocados pela Ang II. Dentre seus efeitos benéficos, pode-se citar a
diminuição do crescimento de cardiomiócitos (Talland et al., 2005) e a inibição da
síntese de colágeno (Iwata et al., 2005; Grobe et al., 2006). Filho e colaboradores (2008)
mostraram que o treinamento em natação com 5% de carga aumentou a concentração de
Ang (1-7), acompanhada do aumento da expressão de seu principal receptor (Mas) no
VE de SHR. Além disso, os autores reportaram diminuição na concentração de Ang II
plasmática em ratos treinados. Isso mostra que o treinamento aeróbico é capaz de
modular o SRAA após instalação do processo de hipertensão arterial e que a Ang (1-7)
apresenta efeitos cardioprotetores nesse modelo. Adicionalmente, no sistema vascular, a
Ang (1-7) também regula a ativação da via NF-ƙβ, com consequente atuação também na
inibição da produção de citocinas pró-inflamatórias (Bihl et al., 2015).
No presente estudo, o grupo SHR Sed mostrou número de células inflamatórias e
área de colágeno maiores, em relação a Wistar Sed. Esses resultados estão de acordo
com os encontrados na literatura e anteriormente citados, comprovando que os animais
com 22 semanas já apresentam padrão de hipertrofia patológica definido. Em
contrapartida, o treinamento aeróbico em animais hipertensos diminuiu a proporção de
células inflamatórias, em relação ao grupo SHR Sed. Baseados na literatura apresentada
acredita-se que o treinamento em natação modulou a produção e atividade da Ang 1-7,
provocando melhoria dos parâmetros morfológicos encontrados em nosso estudo.
Além disso, observou-se também maior deposição de colágeno dos tipos I e III
no grupo SHR Sed. Por sua vez, o exercício diminuiu a deposição de colágeno III e
preveniu a transformação do colágeno tipo III em tipo I, tanto em ratos Wistar quanto
em SHR.
Nosso estudo é pioneiro em avaliar o efeito de um protocolo de treinamento em
natação sem carga com duração de 6 semanas sobre a deposição de colágeno, diâmetro
das fibras e número de células inflamatórias do VE de SHR.
Da Costa Rebelo e colaboradores (2012) também mostraram que a expressão de
marcadores pró-fibróticos, como por exemplo, TGF-β1 e colágeno III, foi atenuada após
protocolo de corrida voluntária em SHR. Os presentes resultados mostram que o
exercício aeróbico contribuiu para o remodelamento cardíaco fisiológico encontrado nos
animais hipertensos treinados.
33
Estudando o modelo SHR, Sano e colaboradores (1998) mostraram que a Ang II,
além de estimular a hipertrofia, também causa fibrose no tecido cardíaco. Em
fibroblastos cardíacos de SHR a síntese basal de colágeno é cerca de 1,6 vezes maior do
que em Wistar-Kyoto, com idade de 10 semanas. Os níveis de Ang II, de RNAm de
renina e de angiotensinogênio em fibroblastos também foi maior no grupo hipertenso
(Sano et al., 1998).
Os padrões de remodelamento cardíaco são determinados pelas sobrecargas de
pressão ou de volume, podendo ser classificados como concêntricos ou excêntricos. De
maneira geral, o treinamento aeróbico promove hipertrofia excêntrica, caracterizada
pelo crescimento do cardiomiócito, com a inserção de sarcômeros em série e poucas
alterações da matriz intersticial (Mill e Vassallo, 2001). A hipertrofia cardíaca
promovida pelo treinamento em natação ocorre em resposta a diversos estímulos, tais
como o aumento no volume sistólico e no débito cardíaco (Raquel et al., 2013).
No presente estudo, a massa total dos ventrículos relativa à massa corporal foi
maior em ratos Wistar Ex, em relação a Wistar Sed, apesar de não ser observado
aumento na massa do VE no mesmo grupo. Também houve aumento no comprimento
dos cardiomiócitos do VE em Wistar, após treinamento. Em contrapartida, as análises
histológicas mostraram aumento no diâmetro das fibras do VE em ratos Wistar Ex,
justificado como uma adaptação fisiológica ao treinamento aeróbico. Um estudo do
nosso laboratório mostrou que o protocolo de natação utilizado nesse trabalho foi capaz
de estimular o desenvolvimento da hipertrofia cardíaca excêntrica em ratos com
hipertensão renovascular (Locatelli et al., 2014), levando a crer que os resultados
morfológicos do presente estudo se aproximam do perfil fisiológico de hipertrofia.
A relação comprimento/largura também foi maior em animais treinados na
linhagem Wistar, mostrando que o treinamento aeróbico melhora parâmetros
morfológicos dos cardiomiócitos. Moore e colaboradores (1993) mostraram que o
aumento da dimensão interna das câmaras ventriculares que ocorre em processos de
hipertrofia fisiológica está associado ao aumento do comprimento dos cardiomiócitos.
Essas afirmações apoiam que o protocolo de treinamento utilizado nesse estudo foi
eficiente em estimular a hipertrofia fisiólogica do VE.
A hipertrofia cardíaca representa uma resposta compensatória importante do
miocárdio ao aumento de sobrecarga de longa duração. Ela está associada com algumas
34
alterações na contratilidade de cardiomiócitos, atribuídas às disfunções na mobilização
do cálcio no retículo sarcoplasmático (RS). Sabe-se que o cálcio intracelular tem um
papel fundamental na regulação das funções sistólica e diastólica do coração. Alguns
autores já mostraram que ocorrem alterações na expressão de SERCA2, na FLB e nos
canais de RyR2 em SHR (Shorofsky et al., 1999; Carneiro-Júnior et al., 2014).
Ainda são controversos os resultados dos estudos que investigaram a função
ventricular esquerda no modelo SHR. Com 10 meses de idade, a função sistólica em
fêmeas com hipertensão espontânea mostra sinais de deterioração, conforme observado
por Renna e colaboradores (2007). Em contrapartida, nessa mesma fase, Cingolani e
colaboradores (2003) observaram melhora da função sistólica, com comprometimento
da função diastólica. Na idade entre 2 e 3 meses se observou piora, tanto da função
sistólica, quanto da diastólica, avaliadas através de ecocardiograma (Kokubo et al.,
2005). Sabe-se que a fibrose miocárdica é a principal responsável pelo aumento da
rigidez do coração, que pode alterar as propriedades diastólicas do VE (Diez et al.,
2002).
No presente estudo observou-se aumento do tempo para o pico de contração em
cardiomiócitos de animais hipertensos sedentários, que se apresentou menor em animais
treinados nas análises da frequência de 1 e 3 Hz. Estes resultados corroboram com
aqueles apresentados por Carneiro-Júnior e colaboradores (2013), num estudo onde
ratos espontaneamente hipertensos com 4 meses de idade foram submetidos ao
treinamento em esteira com duração de 8 semanas. Os autores mostraram que, após
estimulação a 1 Hz, os animais treinados apresentaram diminuição no tempo para o pico
de contração, quando comparados ao grupo SHR Sed.
Já são bem estabelecidos os benefícios do exercício físico para o sistema
cardiovascular e melhora nas funções sistólica e diastólica, em modelos animais
normotensos (Moore et al., 1999). Em animais hipertensos, Carneiro-Júnior e
colaboradores (2010) mostraram que o treinamento aeróbico em esteira é eficaz em
aumentar as velocidades de contração e relaxamento de cardiomiócitos de SHR.
Contudo, não há registros na literatura que avaliem o efeito do protocolo de treinamento
em meio aquático com duração de 6 semanas sobre a função ventricular de SHR.
Sabe-se que a hipertensão provoca disfunções nos mecanismos de contração e
relaxamento das células cardíacas, causadas pela alteração na expressão de proteínas
35
envolvidas na mobilização do cálcio no coração. Os canais de liberação de Ca2+ do RS
(RyR2) são componentes fundamentais no mecanismo de excitação-contração do
músculo cardíaco. Eles são ativados pelo influxo de Ca2+ através dos canais de Ca2+ do
tipo L. A liberação do Ca2+ advindo do RS através dos canais de RyR2 inicia o processo
de contração do coração. Na hipertensão arterial ocorre aumento desordenado na
liberação de Ca2+ do RS, causando desarranjo na contração das células, que pode ser
devido ao aumento da expressão e da atividade dos canais de RyR2 (Chen-Izu et al.,
2007).
Tais
disfunções
encontradas
em
animais
hipertensos
também
foram
demonstradas por Carneiro-Júnior e cols. (2014), que encontraram níveis elevados de
RNAm de proteínas envolvidas na liberação de cálcio do RS em SHR. Os autores
mostraram também que o treinamento em esteira restaurou os níveis de expressão de
canais de RyR2 e da proteína FKPB12.6, que se liga aos canais para regular sua função.
No presente estudo acredita-se que o treinamento aeróbico em natação tenha provocado
a diminuição dos níveis dessas proteínas, em relação aos animais hipertensos
sedentários, otimizando a dinâmica de liberação de cálcio e, consequentemente,
diminuindo o tempo para o pico de contração em ratos hipertensos. Esses resultados
contribuem para a melhora da função sistólica em animais espontaneamente
hipertensos.
Para analisar a função diastólica, utilizou-se como parâmetro o tempo para 50%
do relaxamento das células cardíacas. Os resultados do presente estudo mostraram que
SHR apresentaram maiores valores de tempo para o relaxamento celular. Essa disfunção
diastólica também pode ser associada a alterações na expressão gênica de proteínas
envolvidas na mobilização do cálcio no RS. Em particular, uma diminuição nos níveis
de SERCA2a pode contribuir para a disfunção diastólica apresentada nesse modelo,
aumentando a sobrecarga de cálcio intracelular. Outros estudos têm mostrado que em
SHR ocorrem alterações moleculares na SERCA2a no ventrículo esquerdo em
diferentes fases da hipertensão arterial (Arata et al., 1999; Yao et al., 2009; Velez Rueda
et al., 2012). Contudo, nesse estudo não foi avaliada a expressão dessa Ca2+-ATPase do
RS.
Um estudo do nosso laboratório avaliou os efeitos do mesmo protocolo de
treinamento sobre a expressão de proteínas reguladoras de Ca2+ no ventrículo direito de
36
ratos com hipertensão renovascular (Locatelli et al., 2014). Demonstramos que a
hipertensão diminuiu os níveis proteicos de SERCA e FLB e que o treinamento
provocou reestabelecimento desses parâmetros em animais hipertensos. Em
contrapartida, ao analisarmos a expressão gênica de NCX1 (isoforma predominante no
coração), observamos que houve aumento na expressão no grupo hipertenso sedentário.
Ao final de 6 semanas de treinamento, mostramos que houve normalização nesses
índices.
A diminuição na expressão de SERCA e de canais de RyR2, associada ao
aumento na expressão de NCX1 têm sido relacionadas a disfunções na função contrátil
do coração (Arai et al., 1993; Dash et al., 2001). Em SHR, estudos mostram redução nos
níveis de SERCA2a e fosfolamban fosforilada (Yao et al., 2009; Dupont et al., 2012),
enquanto a expressão de RNAm e da proteína NCX1 parecem aumentar nesse modelo
(Li et al., 2005).
Considerando que o treinamento aeróbico restaura os níveis de proteínas
reguladoras de cálcio no coração, os resultados desse estudo podem ser justificados pela
adaptação provocada pelo exercício nesses parâmetros, que, em conjunto com os
benefícios morfológicos apresentados, contribuem para a melhoria da função diastólica
em animais treinados.
O presente estudo mostrou também que a hipertensão arterial aumentou a
amplitude de contração em cardiomiócitos de SHR estimulados a 1Hz. Brooksby e
colaboradores (1992) demonstraram que a amplitude de contração de células de SHR
estimuladas a 0,3, 1, 2 e 3 Hz foi maior, quando comparada a de Wistar. O mesmo
resultado foi encontrado por McCrossan e colaboradores (2004), utilizando a frequência
de estimulação de 1Hz.
Diversas investigações que utilizaram modelos de camundongos e ratos
mostraram que o treinamento aeróbico aumenta a amplitude de contração dos
cardiomiócitos, fornecendo evidências dos efeitos benéficos do exercício físico sobre o
músculo cardíaco (Kemi et al., 2004; Kemi et al., 2007). Todavia, nesse estudo, o
treinamento aeróbico provocou redução nesses valores, quando comparados a SHR Sed,
após a estimulação de 1 e de 3 Hz.
Os resultados aqui apresentados corroboram com os encontrados por Zhang e
colaboradores (2002), que também observaram a diminuição na amplitude de contração
37
de cardiomiócitos de ratos normotensos estimulados a 1 Hz. Os animais foram
submetidos a um treinamento intervalado de alta intensidade em esteira e, após a
estimulação elétrica, os autores obervaram também a diminuição nas velocidades de
contração e de relaxamento, que pode estar relacionada à redução da atividade e da
expressão de NCX, verificadas no mesmo estudo. Isso aumentaria o tempo de
permanência de Ca2+ intracelular. Em contrapartida, os resultados mostraram que não
houve alteração nos níveis de SERCA2 nos miócitos dos animais treinados.
Todavia, outros trabalhos que também utilizaram treinamento intervalado de alta
intensidade mostraram aumento na amplitude de contração em ratos normotensos
(Wisloff et al., 2001; Kemi et al., 2007). Já Carneiro-Júnior e colaboradores (2010)
mostraram que, SHR treinados durante 8 semanas em esteira não apresentaram
alterações na amplitude do pico de contração. De maneira geral, os resultados
encontrados na literatura são controversos, em relação à resposta da amplitude do pico
de contração ao treinamento aeróbico.
É possível que a duração do protocolo de treinamento do presente estudo tenha
sido ineficiente em promover alterações na amplitude de contração, mostradas por
autores supracitados. Outro fator a se considerar é diminuição da sensibilidade dos
miofilamentos ao Ca2+ provocada pela hipertensão (Sumida et al., 1998).
Em
contrapartida, o treinamento aeróbico de alta intensidade parece aumentar essa
sensibilidade (Kemi et al., 2004), melhorando a capacidade de encurtamento da célula
cardíaca. Dessa maneira, a intensidade do protocolo de treinamento utilizado em nesse
estudo pode não ter sido eficaz em melhorar a sensibilidade dos miofilamentos
contráteis ao Ca2+, tanto em animais normotensos, quanto hipertensos.
O conjunto dos resultados do presente estudo sugere a importância do
treinamento aeróbico de baixa intensidade no tratamento da hipertensão arterial. Além
disso, o exercício traz diversos benefícios ao tecido cardíaco, como a diminuição da
fibrose e do número de células inflamatórias, promovendo o remodelamento cardíaco. O
treinamento aeróbico pode interferir em diversas vias celulares envolvidas nessas
respostas, de diferentes maneiras; porém, acredita-se que haja uma forte correlação
entre o sistema renina-angiotensina-aldosterona e esses mecanismos. Ademais, o
treinamento em natação provocou melhorias na função ventricular, representadas pela
38
diminuição do tempo para metade do relaxamento e do tempo para o pico de contração
de cardiomiócitos isolados do ventrículo esquerdo de SHR.
O presente estudo apresentou algumas limitações metodológicas: a função
ventricular in vivo não foi avaliada pela técnica de ecocardiograma; os componentes do
sistema renina-angiotensina-aldosterona e a atividade do sistema nervoso simpático
também não foram avaliados para indicar a possível influência sobre as respostas
encontradas. Além disso, nenhuma investigação foi feita acerca da expressão de
proteínas mobilizadoras de cálcio, que podem provocar alterações na função ventricular.
Nesse sentido, mais investigações devem ser realizadas, a fim de elucidar as vias
envolvidas e possíveis respostas da pressão arterial e da função ventricular ao
treinamento aeróbico em animais com hipertensão espontânea.
39
6.0. CONCLUSÕES
Em síntese, os resultados do presente estudo permitem concluir que o treinamento
aeróbico em natação com duração de seis semanas:
• pode ter provocado a diminuição do tônus vasomotor simpático e da atividade
do
sistema
renina-angiotensina-aldosterona
em
ratos
com
hipertensão
espontânea;
• pode ter contribuído para a melhora na atividade elétrica ventricular, diminuindo
o risco de arritmias em ratos hipertensos;
• provocou remodelamento cardíaco em SHR e hipertrofia fisiológica em animais
Wistar;
• pode ter contribuído para a melhora da função ventricular de ratos hipertensos.
40
7.0. REFERÊNCIAS BIBLIOGRÁFICAS
Adams, M. A., A. Bobik, P. I. Korner (1989). Differential development of vascular and
cardiac-hypertrophy in genetic-hypertension - relation to sympathetic function.
Hypertension 14(2): 191-202.
Agarwal, D., M. Haque, S. Sriramula, N. Mariappan, R. Pariaut, J. Francis (2009). Role
of proinflammatory cytokines and redox homeostasis in exercise-induced delayed
progression of hypertension in spontaneously hypertensive rats. Hypertension 54(6):
1393-1400.
Agocha, A., H. W. Lee, M. EghbaliWebb (1997). Hypoxia regulates basal and induced
DNA synthesis and collagen type I production in human cardiac fibroblasts: Effects of
transforming growth factor beta 1, thyroid hormone, angiotensin II and basic fibroblast
growth factor. Journal of Molecular and Cellular Cardiology 29(8): 2233-2244t.
Alpert, N. R., L. A. Mulieri (1982). Increased myothermal economy of isometric force
generation in compensated cardiac-hypertrophy induced by pulmonary-artery
constriction in the rabbit - a characterization of heat liberation in normal and
hypertrophied right ventricular papillary-muscles. Circulation Research 50(4): 491-500.
Alves, L. L., Forjaz, C (2007). Influência da intensidade e do volume do treinamento
aeróbico na redução da pressão arterial de hipertensos. Revista Brasilerira de Ciência e
Movimento 15:115-22.
Anversa, P., V. Levicky, C. Beghi, S. L. Mcdonald, Y. Kikkawa (1983). Morphometry
of exercise-induced right ventricular hypertrophy in the rat. Circulation Research 52(1):
57-64.
Arai, M., N. R. Alpert, D. H. Maclennan, P. Barton, M. Periasamy (1993). Alterations
in sarcoplasmic-reticulum gene-expression in human heart-failure - a possible
41
mechanism for alterations in systolic and diastolic properties of the failing myocardium.
Circulation Research 72(2): 463-469.
Baillard, C., Mansier, P., Ennezat, P.V., Mangin, L., Medigue, C., Swynghedauw, B.,
Chevalier, B (2000). Converting enzyme inhibition normalizes QT interval in
spontaneously hypertensive rats. Hypertension 36(3): 350–354.
Beisvag, V., O. J. Kemi, I. Arbo, J. P. Loennechen, U. Wisloff, M. Langaas, A. K.
Sandvik, O. Ellingsen (2009). Pathological and physiological hypertrophies are
regulated by distinct gene programs. European Journal of Cardiovascular Prevention &
Rehabilitation 16(6): 690-697.
Bell, D., E. J. Kelso, C. C. H. Argent, G. R. Lee, A. R. Allen, B. J. McDermott (2004).
Temporal characteristics of cardiomyocyte hypertrophy in the spontaneously
hypertensive rat. Cardiovascular Pathology 13(2): 71-78.
Bencze, M., M. Behuliak, J. Zicha (2013). The impact of four different classes of
anesthetics on the mechanisms of blood pressure regulation in normotensive and
spontaneously hypertensive rats. Physiol Res 62(5): 471-478.
Bihl, J. C., C. Zhang, Y. H. Zhao, X. Xiao, X. T. Ma, Y. S. Chen, S. Z. Chen, B. Zhao,
Y. F. Chen (2015). Angiotensin (1-7) counteracts the effects of Ang II on vascular
smooth muscle cells, vascular remodeling and hemorrhagic stroke: Role of the NF
kappa B inflammatory pathway. Vascular Pharmacology 73: 115-123.
Brasier, A. R., M. Jamaluddin, Y. Q. Han, C. Patterson, M. S. Runge (2000).
Angiotensin II induces gene transcription through cell-type-dependent effects on the
nuclear factor-kappa B (NF-kappa B) transcription factor. Molecular and Cellular
Biochemistry 212(1-2): 155-169.
Brooksby, P., A. J. Levi, J. V. Jones (1992). Contractile properties of ventricular
myocytes isolated from spontaneously hypertensive rat. Journal of Hypertension 10(6):
521-527.
42
Brooksby, P., A. J. Levi, J. V. Jones (1993). Investigation of the mechanisms
underlying the increased contraction of hypertrophied ventricular myocytes isolated
from the spontaneously hypertensive rat. Cardiovascular Research 27(7): 1268-1277.
Brower, G. L., J. D. Gardner, M. F. Forman, D. B. Murray, T. Voloshenyuk, S. P.
Levick, J. S. Janicki (2006). The relationship between myocardial extracellular matrix
remodeling and ventricular function. European Journal of Cardio-Thoracic Surgery
30(4): 604-610.
Brown, M. D. (2003). Exercise and coronary vascular remodelling in the healthy heart.
Exp Physiol 88(5): 645-658.
Brum, P. C., G. J. J. Da Silva, E. D. Moreira, F. Ida, C. E. Negrao, E. M. Krieger
(2000). Exercise training increases baroreceptor gain sensitivity in normal and
hypertensive rats. Hypertension 36(6): 1018-1022.
Cabanelas, L. A., A. A. Carbonel, M. A. dos Santos, R. S. Simoes, A. W. LiberatoriFilho, E. C. Baracat, J. M. Soares Junior (2012). Cardiomyocytes morphology and
collagen quantification in the myocardium of female rats treated with isoflavones or
estrogens. Rev Bras Ginecol Obstet 34(10): 447-452.
Carneiro-Júnior, M. A. Efeitos do treinamento físico e do destreinamento sobre
propriedades moleculares e mecânicas de cardiomiócitos isolados de ratos normotensos
e hipertensos. Vitória. Tese [Doutorado em Ciências Fisiológicas] – Universidade
Federal do Espírito Santo, 2013.
Carneiro-Júnior, M. A., M. C. G. Peluzio, C. H. O. Silva, P. R. S. Amorim, K. A. Silva,
M. O. Souza, C. A. Castro, D. Roman-Campos, T. N. Primola-Gomes, A. J. Natali
(2010). Exercise training and detraining modify the morphological and mechanical
properties of single cardiac myocytes obtained from spontaneously hypertensive rats.
Brazilian Journal of Medical and Biological Research 43(11): 1042-1046.
43
Carneiro-Júnior, M. A., J. F. Quintao, L. R. Drummond, V. N. Lavorato, F. R.
Drummond, M. A. Amadeu, E. M. Oliveira, L. B. Felix, J. S. Cruz, J. G. Mill, A. J.
Natali, T. N. Primola-Gomes (2014). Effect of exercise training on Ca2+ release units of
left ventricular myocytes of spontaneously hypertensive rats. Brazilian Journal of
Medical and Biological Research 47(11): 960-965.
Carneiro-Júnior, M. A., J. F. Quintao, L. R. Drummond, V. N. Lavorato, F. R.
Drummond, D. N. Q. da Cunha, M. A. Amadeu, L. B. Felix, E. M. de Oliveira, J. S.
Cruz, T. N. Primola-Gomes, J. G. Mill, A. J. Natali (2013). The benefits of endurance
training in cardiomyocyte function in hypertensive rats are reversed within four weeks
of detraining. Journal of Molecular and Cellular Cardiology 57: 119-128.
Castoldi, G., C. R. T. di Gioia, C. Travaglini, G. Busca, S. Redaelli, C. Bombardi, A.
Stella (2007). Angiotensin II increases tissue-specific inhibitor of metalloproteinase-2
expression in rat aortic smooth muscle cells in vivo: Evidence of a pressure-independent
effect. Clinical and Experimental Pharmacology and Physiology 34(3): 205-209.
Cerbai, E., M. Barbieri, A. Mugelli (1994). Characterization of the HyperpolarizationActivated Current, I-F, in Ventricular Myocytes Isolated from Hypertensive Rats.
Journal of Physiology-London 481(3): 585-591.
Cezar, M. D. M., R. L. Damatto, P. F. Martinez, A. R. R. Lima, D. H. S. Campos, C. M.
Rosa, D. M. Guizoni, C. Bonomo, A. C. Cicogna, R. Gimenes, L. U. Pagan, M. P.
Okoshi, K. Okoshi (2013). Aldosterone blockade reduces mortality without changing
cardiac remodeling in spontaneously hypertensive rats. Cellular Physiology and
Biochemistry 32(5): 1275-1287.
Chancey, A. L., G. L. Brower, J. T. Peterson, J. S. Janicki (2002). Effects of matrix
metalloproteinase inhibition on ventricular remodeling due to volume overload.
Circulation 105(16): 1983-1988.
44
Chen-Izu, Y., C. W. Ward, W. Stark, T. Banyasz, M. P. Sumandea, C. W. Balke, L. T.
Izu, X. H. T. Wehrens (2007). Phosphorylation of RyR2 and shortening of RyR2 cluster
spacing in spontaneously hypertensive rat with heart failure. American Journal of
Physiology-Heart and Circulatory Physiology 293(4): H2409-H2417.
Chintalgattu, V., Nair, D. M., Katwa, L. C (2003). Cardiac myofibroblasts: a novel
source of vascular endothelial growth factor (VEGF) and its receptors Flt-1 and
KDR. Journal of Molecular and Cellular Cardiology 35: 277-286.
Cicogna, A. C., C. R. Padovani, K. Okoshi, F. F. Aragon, M. P. Okoshi (2000).
Myocardial function during chronic food restriction in isolated hypertrophied cardiac
muscle. American Journal of the Medical Sciences 320(4): 244-248.
Cingolani, O. H., X. P. Yang, M. A. Cavasin, O. A. Carretero (2003). Increased systolic
performance with diastolic dysfunction in adult spontaneously hypertensive rats.
Hypertension 41(2): 249-254.
Collins, H. L., Loka, A. M., Dicarlo, S. E (2005). Daily exercise-induced
cardioprotection is associated with changes in calcium regulatory proteins in
hypertensive rats. Am J Physiol Heart Circ Physiol 288:H532-40.
Conrad, C. H., W. W. Brooks, K. G. Robinson, O. H. L. Bing (1991). Impaired
myocardial-function in spontaneously hypertensive rats with heart-failure. American
Journal of Physiology 260(1): H136-H141.
Cornelissen, V. A., Fagard, R. H. (2005). Effects of endurance training on blood
pressure, blood pressure-regulating mechanisms, and cardiovascular risk factors.
Hypertension 46(4): 667-675.
Crowley, S. D., S. B. Gurley, M. J. Herrera, P. Ruiz, R. Griffiths, A. P. Kumar, H. S.
Kim, O. Smithies, T. H. Le, T. M. Coffman (2006). Angiotensin II causes hypertension
45
and cardiac hypertrophy through its receptors in the kidney. Proceedings of the National
Academy of Sciences of the United States of America 103(47): 17985-17990.
Crumb, W.; Cavero, I (1999). QT interval prolongation by non-cardiovascular drugs:
issues and solutions for novel drug development. Pharmaceutical Science and
Technology Today 2(7): 270–280.
Darling, E. A (1899). The effects of training: a study of the Harward University crews.
Boston Med Surg J 161: 229–233.
Dash, R., K. F. Frank, A. N. Carr, C. S. Moravec, E. G. Kranias (2001). Gender
influences on sarcoplasmic reticulum Ca2+-handling in failing human myocardium.
Journal of Molecular and Cellular Cardiology 33(7): 1345-1353.
Diez, J., R. Querejeta, B. Lopez, A. Gonzalez, M. Larman, J. L. M. Ubago (2002).
Losartan-dependent regression of myocardial fibrosis is associated with reduction of left
ventricular chamber stiffness in hypertensive patients. Circulation 105(21): 2512-2517.
Donohue, S. J., R. E. Stitzel, R. J. Head (1988). Time course of changes in the
norepinephrine content of tissues from spontaneously hypertensive and Wistar Kyoto
rats. Journal of Pharmacology and Experimental Therapeutics 245(1): 24-31.
Dorn, G. W. (2007). The fuzzy logic of physiological cardiac hypertrophy.
Hypertension 49(5): 962-970.
Duncker, D. J., Bache, R. J. (2008). Regulation of coronary blood flow during exercise.
Physiol Rev 88(3): 1009-1086.
Dupont, S., J. Maizel, R. Mentaverri, J. M. Chillon, I. Six, P. Giummelly, M. Brazier,
G. Choukroun, C. Tribouilloy, Z. A. Massy, M. Slama (2012). The onset of left
ventricular diastolic dysfunction in SHR rats is not related to hypertrophy or
46
hypertension. American Journal of Physiology-Heart and Circulatory Physiology
302(7): H1524-H1532.
Emter, C. A., S. A. McCune, G. C. Sparagna, M. J. Radin, R. L. Moore (2005). Lowintensity exercise training delays onset of decompensated heart failure in spontaneously
hypertensive heart failure rats. American Journal of Physiology-Heart and Circulatory
Physiology 289(5): H2030-H2038.
Evangelista, F. S., P. C. Brum, J. E. Krieger (2003). Duration-controlled swimming
exercise training induces cardiac hypertrophy in mice. Brazilian Journal of Medical and
Biological Research 36(12): 1751-1759.
Evangelista, F. S., S. E. D. Martuchi, C. E. Negrao, P. C. Brum (2005). Loss of resting
bradycardia with detraining is associated with intrinsic heart rate changes. Brazilian
Journal of Medical and Biological Research 38(7): 1141-1146.
Fazan Jr, R., V. J. D. Silva, H. C. Salgado (2001). Modelos de hipertensão arterial. Rev
Bras Hipertens 8:19-29.
Ferreira Júnior, M., S. A. Batista, P. V. T. Vidigal, A. C. C. Cordeiro, F. M. S. Oliveira,
L. O. Prata, A. E. T. Diniz, C. M. Barral, R. C. Barbuto, A. D. Gomes, I. D. Araújo, D.
M. Queiroz, M. V. Caliari (2015). Infection with CagA-positive Helicobacter pylori
strain containing three EPIYA C phosphorylation sites is associated with more severe
gastric lesions in experimentally infected Mongolian gerbils (Meriones unguiculatus).
European Journal of Histochemistry 59(2489): 137-146.
Filho, A. G., A. J. Ferreira, S. H. S. Santos, S. R. S. Neves, E. R., R. A. S. Santos
(2008). Selective increase of angiotensin (1-7) and its receptor in hearts of
spontaneously hypertensive rats subjected to physical training. Experimental Physiology
93(5): 589-598.
47
Folkow,
B.,
Y.
Lundgren,
L.
Weiss,
M.
Hallback
(1972).
Effects
of
immunosympathectomy on blood-pressure and vascular reactivity in normal and
spontaneously hypertensive rats. Acta Physiologica Scandinavica 84(4): 512-523.
Frohlich, E. D., K. Komatsu, H. Ono, Y. Ono (1994). Effects of ace-inhibitor on
glomerular dynamics and morphology in aged SHR. Hypertension 24(3): 408-408.
Fu, M. Q., J. M. Zhou, J. F. Xu, H. M. Zhu, J. Q. Liao, X. T. Cui, A. J. Sun, M. Fu, Y.
Z. Zou, K. Hu, J. B. Ge (2014). Olmesartan attenuates cardiac hypertrophy and
improves cardiac diastolic function in spontaneously hypertensive rats through
inhibition of calcineurin pathway. Journal of Cardiovascular Pharmacology 63(3): 218226.
Fu, Y. C., C. S. Chi, S. C. Yin, B. T. Hwang, Y. T. Chiu, S. L. Hsu (2004).
Norepinephrine induces apoptosis in neonatal rat cardiomyocytes through a reactive
oxygen species-TNF alpha-caspase signaling pathway. Cardiovascular Research 62(3):
558-567.
Garciarena, C. D., O. A. Pinilla, M. B. Nolly, R. P. Laguens, E. M. Escudero, H. E.,
Cingolani, I. L. Ennis (2009). Endurance training in the spontaneously hypertensive rat
conversion of pathological into physiological cardiac hypertrophy. Hypertension 53(4):
708-U229.
Gava, N. S., A. S. Verassilva, C. E. Negrao, E. M. Krieger (1995). Low-intensity
exercise training attenuates cardiac beta-adrenergic tone during exercise in
spontaneously hypertensive rats. Hypertension 26(6): 1129-1133.
Gava, E., de Castro, C. H., Ferreira, A. J., Colleta, H., Melo, M. B., Alenina, N., Bader,
M., Oliveira, L. A., Santos, R. A., Kitten, G. T (2012). Angiotensin-(1-7) receptor Mas
is an essential modulator of extracellular matrix protein expression in the heart.
Regulatory Peptides 175:30-42.
48
Gonzalez, W., V. Fontaine, M. E. Pueyo, N. Laquay, D. Messika-Zeitoun, M. Philippe,
J. F. Arnal, M. P. Jacob, J. B. Michel (2000). Molecular plasticity of vascular wall
during N-G-nitro-L-arginine methyl ester-induced hypertension - Modulation of
proinflammatory signals. Hypertension 36(1): 103-109.
Grobe, J. L., A. P. Mecca, H. Y. Mao, M. J. Katovich (2006). Chronic angiotensin-(1-7)
prevents cardiac fibrosis in DOCA-salt model of hypertension. American Journal of
Physiology-Heart and Circulatory Physiology 290(6): H2417-H2423.
Guyenet, P. G. (2006). The sympathetic control of blood pressure. Nature Reviews
Neuroscience 7(5): 335-346.
Guyton, A. C., Hall, J. E. Tratado de Fisiologia Médica. 11ª edição. Rio de Janeiro:
Elsevier. 2006.
Hafizi, S., Chester, A. H., Allen, S. P., Morgan, K., Yacoub, M. H (1998). Growth
response of human coronary smooth muscle cells to angiotensin II and influence of
angiotensin AT1 receptor blockade. Coronary Artery Disease 9: 167–175.
Hayashi, A., A. Kobayashi, R. Takahashi, F. Suzuki, T. Nakagawa, K. Kimoto (2000).
Effects of voluntary running exercise on blood pressure and renin-angiotensin system in
spontaneously hypertensive rats and normotensive Wistar-Kyoto rats. Journal of
Nutritional Science and Vitaminology 46(4): 165-170.
Houser, S. R., V. Piacentino, J. Mattiello, J. Weisser, J. P. Gaughan (2000). Functional
properties of failing human ventricular myocytes. Trends in Cardiovascular Medicine
10(3): 101-107.
Imai, C., M. Tozawa, O. Sunagawa, H. Muratani, S. Takishita, K. Fukiyama (1995).
Alterations of alpha1-adrenergic receptor densities in right and left ventricles of
spontaneously hypertensive rats. Biological & Pharmaceutical Bulletin 18(7): 10011005.
49
International Society of Hypertension Writing Group (2003). "2003 World Health
Organization (WHO)/International Society of Hypertension (ISH) statement on
management of hypertension." Journal of Hypertension 21(11): 1983-92.
Iwata, M., R. T. Cowling, D. Gurantz, C. Moore, S. Zhang, J. X. J. Yuan, B. H.
Greenberg (2005). Angiotensin (1-7) binds to specific receptors on cardiac fibroblasts to
initiate antifibrotic and antitrophic effects. American Journal of Physiology-Heart and
Circulatory Physiology 289(6): H2356-H2363.
Janicki, J. S., G. L. Brower, J. D. Gardner, M. F. Forman, J. A. Stewart, D. B. Murray,
A. L. Chancey (2006). Cardiac mast cell regulation of matrix metalloproteinase-related
ventricular remodeling in chronic pressure or volume overload. Cardiovascular
Research 69(3): 657-665.
Jellis, C., J. Martin, J. Narula, T. H. Marwick (2010). Assessment of nonischemic
myocardial fibrosis. Journal of the American College of Cardiology 56(2): 89-97.
Jiang, W. H., L. H. Tan, Y. Z. Guo, X. G. Li, X. H. Tang, K. Yang (2012). Effect of
renal denervation procedure on left ventricular hypertrophy of hypertensive rats and its
mechanisms. Acta Cirurgica Brasileira 27(11): 815-820.
Junqueira, L. C. U., G. Bignolas, R. R. Brentani (1979). Picrosirius staining plus
polarization microscopy, a specific method for collagen detection in tissue-sections.
Histochemical Journal 11(4): 447-455.
Kadowaki, T. (2000). Insights into insulin resistance and type 2 diabetes from knockout
mouse models. Journal of Clinical Investigation 106(4): 459-465.
Kemi, O. J., O. Ellingsen, M. Ceci, S. Grimaldi, G. L. Smith, G. Condorelli, U. Wisloff
(2007). Aerobic interval training enhances cardiomyocyte contractility and Ca2+ cycling
by phosphorylation of CaMKII and Thr-17 of phospholamban. Journal of Molecular
and Cellular Cardiology 43(3): 354-361.
50
Kemi, O. J., P. M. Haram, U. Wisloff and O. Ellingsen (2004). Aerobic fitness is
associated with cardiomyocyte contractile capacity and endothelial function in exercise
training and detraining. Circulation 109(23): 2897-2904.
Kemi, O. J., J. P. Loennechen, U. Wisloff, O. Ellingsen (2002). Intensity-controlled
treadmill running in mice: cardiac and skeletal muscle hypertrophy. J Appl Physiol
(1985) 93(4): 1301-1309.
Klimas, J., T. Stankovicova, J. Kyselovic, L. Bacharova (2008). Prolonged QT interval
is associated with blood pressure rather than left ventricular mass in spontaneously
hypertensive rats. Clinical and Experimental Hypertension 30(7): 475-485.
Klimas, J., V. Vaja, M. Vercinska, J. Kyselovic, P. Krenek (2012). Discrepant
regulation of QT (QTc) interval duration by calcium channel blockade and angiotensin
converting enzyme inhibition in experimental hypertension. Basic & Clinical
Pharmacology & Toxicology 111(4): 279-288.
Kmecova, J., Klimas, J. (2010). Heart rate correction of the QT duration in rats.
European Journal of Pharmacology 641(2-3): 187-192.
Kokubo, M., A. Uemura, T. Matsubara, T. Murohara (2005). Noninvasive evaluation of
the time course of change in cardiac function in spontaneously hypertensive rats by
echocardiography. Hypertension Research 28(7): 601-609.
Kolwicz, S. C., R. Seqqat, B. F. Renna, K. Rafiq, S. R. Houser, A. Sabri, J. R. Libonati
(2007). Exercise training attenuates apoptosis in the spontaneously hypertensive rat.
Faseb Journal 21(6): A934-A934.
Kozakova, M., M. Paterni, F. Bartolomucci, C. Morizzo, G. Rossi, F. Galetta, C.
Palombo (2007). Epicardial coronary artery size in hypertensive and physiologic left
ventricular hypertrophy. Am J Hypertens 20(3): 279-284.
51
Kranzhofer, R., M. Browatzki, J. Schmidt, W. Kubler (1999). Angiotensin II activates
the proinflammatory transcription factor nuclear factor-kappa B in human monocytes.
Biochemical and Biophysical Research Communications 257(3): 826-828.
Kuwahara, F., H. Kai, K. Tokuda, M. Kai, A. Takeshita, K. Egashira, T. Imaizumi
(2002). Transforming growth factor-beta function blocking prevents myocardial fibrosis
and diastolic dysfunction in pressure-overloaded rats. Circulation 106(1): 130-135.
Law, M. R., N. J. Wald, J. K. Morris, R. E. Jordan (2003). Value of low dose
combination treatment with blood pressure lowering drugs: analysis of 354 randomised
trials. British Medical Journal 326(7404): 1427-1431.
Lee, R. M. K. W., C. R. Triggle, D. W. T. Cheung, M. D. Coughlin (1987). Structural
and functional consequence of neonatal sympathectomy on the blood-vessels of
spontaneously hypertensive rats. Hypertension 10(3): 328-338.
Lee, T. I., Y. H. Kao, Y. C. Chen, J. H. Huang, M. I. Hsu, Y. J. Chen (2013). The
dipeptidyl
peptidase-4
inhibitor-sitagliptin
modulates
calcium
dysregulation,
inflammation, and PPARs in hypertensive cardiomyocytes. International Journal of
Cardiology 168(6): 5390-5395.
Levick, S. P., D. B. Murray, J. S. Janicki, G. L. Brower (2010). Sympathetic nervous
system modulation of inflammation and remodeling in the hypertensive heart.
Hypertension 55(2): 270-U129.
Lewington, S., R. Clarke, N. Qizilbash, R. Peto, R. Collins, P. S. Collaboration and
(2002). Age-specific relevance of usual blood pressure to vascular mortality: a metaanalysis of individual data for one million adults in 61 prospective studies. Lancet
360(9349): 1903-1913.
Li, L., W. L. Yi-Ming, Z. Z. Li, L. Zhao, Y. S. Yu, D. J. Li, C. Y. Xia, J. G. Liu, D. F.
Su (2008). Local RAS and inflammatory factors are involved in cardiovascular
52
hypertrophy in spontaneously hypertensive rats. Pharmacological Research 58(3-4):
196-201.
Li, S. Y., K. L. Golden, Y. Jiang, G. J. Wang, J. R. Privratsky, X. C. Zhang, A. R.
Eason, B. Culver, J. Ren (2005). Inhibition of sarco(endo)plasmic reticulum Ca2+ATPase differentially regulates contractile function in cardiac myocytes from
normotensive and spontaneously hypertensive rats - Role of Ca2+ regulatory proteins.
Cell Biochemistry and Biophysics 42(1): 1-12.
Lindahl, G. E., R. C. Chambers, J. Papakrivopoulou, S. J. Dawson, M. C. Jacobsen, J.
E. Bishop, G. J. Laurent (2002). Activation of fibroblast procollagen alpha 1
transcription by mechanical strain is transforming growth factor-beta-dependent and
involves increased binding of CCAAT-binding factor (CBF/NF-Y) at the proximal
promoter. Journal of Biological Chemistry 277(8): 6153-6161.
Linz, D., M. Hohl, J. Schutze, F. Mahfoud, T. Speer, B. Linz, T. Hubschle, H. P.
Juretschke, R. Dechend, J. Geisel, H. Rutten, M. Bohm (2015). Progression of kidney
injury and cardiac remodeling in obese spontaneously hypertensive rats: the role of
renal sympathetic innervation. American Journal of Hypertension 28(2): 256-265.
Llewellyn, T. L., N. M. Sharma, H. Zheng, K. P. Patel (2014). Effects of exercise
training on SFO-mediated sympathoexcitation during chronic heart failure. American
Journal of Physiology-Heart and Circulatory Physiology 306(1): H121-H131.
Locatelli, J., L. V. M. de Assis, C. M. Araujo, A. C. Alzamora, W. G. de Lima, M. J.
Campagnole-Santos, R. A. dos Santos, M. C. Isoldi (2014). Swimming training
promotes cardiac remodeling and alters the expression of mRNA and protein levels
involved in calcium handling in hypertensive rats. Life Sciences 117(2): 67-74.
Lundie, M. J., P. Friberg, R. L. Kline, M. A. Adams (1997). Long-term inhibition of the
renin-angiotensin system in genetic hypertension: analysis of the impact on blood
53
pressure and cardiovascular structural changes. Journal of Hypertension 15(11): U12U12.
MacDonnell, S. M., H. Kubo, D. L. Crabbe, B. F. Renna, P. O. Reger, J. Mohara, L. A.
Smithwick, W. J. Koch, S. R. Houser, J. R. Libonati (2005). Improved myocardial betaadrenergic responsiveness and signaling with exercise training in hypertension.
Circulation 111(25): 3420-3428.
Maciel N. R., P. G. Reis, K. C. Kato, A. T. Vidal, H. N. Guimarães, F. Frézard, N. M.
Silva-Barcellos, A. Grabe-Guimarães (2010). Reduced cardiovascular alterations of
tartar emetic administered in long-circulating liposomes in rats. Toxicology Letters
199(3): 234-8.
Makino, H., M. Haneda, T. Babazono, T. Moriya, S. Ito, Y. Iwamoto, R. Kawamori, M.
Takeuchi, S. Katayama (2006). Incipient to overt: Angiotensin II blocker, telmisartan,
investigation on type 2 diabetic nephropathy study. Journal of Hypertension 24: 31-31.
Mancia, G., R. Fagard, K. Narkiewicz, J. Redon, A. Zanchetti, M. Bohm, T.
Christiaens, R. Cifkova, G. De Backer, A. Dominiczak, M. Galderisi, D. E. Grobbee, T.
Jaarsma, P. Kirchhof, S. E. Kjeldsen, S. Laurent, A. J. Manolis, P. M. Nilsson, L. M.
Ruilope, R. E. Schmieder, P. A. Sirnes, P. Sleight, M. Viigimaa, B. Waeber, F. Zannad
(2013). 2013 ESH/ESC Guidelines for themanagement of arterial hypertension The
Task Force for the management ofarterial hypertension of the European Society of
Hypertension (ESH) and of the European Society of Cardiology (ESC). Journal of
Hypertension 31(7): 1281-1357.
Matsubara, L. S., S. Narikawa, A. L. Ferreira, S. A. Paiva, L. M. Zornoff, B. B.
Matsubara (2006). Myocardial remodeling in chronic pressure or volume overload in
the rat heart. Arq Bras Cardiol 86(2): 126-30.
54
McCrossan, Z. A., R. Billeter, E. White (2004). Transmural changes in size, contractile
and electrical properties of SHR left ventricular myocytes during compensated
hypertrophy. Cardiovascular Research 63(2): 283-292.
McMullen, J. R., Jennings, G. L. (2007). Differences between pathological and
physiological cardiac hypertrophy: Novel therapeutic strategies to treat heart failure.
Clinical and Experimental Pharmacology and Physiology 34(4): 255-262.
Medeiros, A., E. M. Oliveira, R. Gianolla, D. E. Casarini, C. E. Negrao, P. C. Brum
(2004). Swimming training increases cardiac vagal activity and induces cardiac
hypertrophy in rats. Brazilian Journal of Medical and Biological Research 37(12): 19091917.
Medugorac, I. (1982). Characterization of intramuscular collagen in the mammalian
left-ventricle. Basic Research in Cardiology 77(6): 589-598.
Melo, S. F. S., T. Fernandes, V. G. Barauna, K. C. Matos, A. A. S. Santos, P. J. F.
Tucci, E. M. Oliveira (2014). Expression of microRNA-29 and collagen in cardiac
muscle after swimming training in myocardial-infarcted rats. Cellular Physiology and
Biochemistry 33(3): 657-669.
Mindan, F. J., Panizo, P. A. (1993). Alterations in the extracellular-matrix of the
myocardium in essential-hypertension. European Heart Journal 14: 12-14.
Moore, R. L., T. I. Musch, R. V. Yelamarty, R. C. Scaduto, Jr., A. M. Semanchick, M.
Elensky, J. Y. Cheung (1993). Chronic exercise alters contractility and morphology of
isolated rat cardiac myocytes. Am J Physiol 264(5 Pt 1): C1180-1189.
Moore, R. L., Palmer, B. M (1999). Exercise training and cellular adaptations of normal
and diseased hearts. Exerc Sport Sci Rev 27: 285–315.
55
Moraes-Silva, I. C., R. N. De La Fuente, C. Mostarda, K. Rosa, K. Flues, N. R.
Damaceno-Rodrigues, E. G. Caldini, K. De Angelis, E. M. Krieger, M. C. Irigoyen
(2010). Baroreflex deficit blunts exercise training-induced cardiovascular and
autonomic adaptations in hypertensive rats. Clinical and Experimental Pharmacology
and Physiology 37(3): e114-e120.
Mukherjee, D., Sen, S. (1993). Alteration of cardiac collagen phenotypes in
hypertensive hypertrophy - role of blood-pressure. Journal of Molecular and Cellular
Cardiology 25(2): 185-196.
Mill, J. G., Vassallo, D. V (2001). Hipertrofia cardíaca. Rev Bras Hipertens 8(1): 18-29.
Muller, D. N., R. Dechend, E. M. A. Mervaala, J. K. Park, F. Schmidt, A. Fiebeler, J.
Theuer, V. Breu, D. Ganten, H. Haller, F. C. Luft (2000). NF-kappa B inhibition
ameliorates angiotensin II-induced inflammatory damage in rats. Hypertension 35(1):
193-201.
Okoshi, M. P., K. Okoshi, L. S. Matsubara, M. Dal Pai-Silva, A. L. Gut, C. R.
Padovani, V. Dal Pai, A. C. Cicogna (2006). Myocardial remodeling and dysfunction
are induced by chronic food restriction in spontaneously hypertensive rats. Nutrition
Research 26(11): 567-572.
Opie L. Heart physiology. 4a ed. Philadelphia, PA, USA: Lippincott, Williams and
Wilkins, 2004.
Paull, J. R. A., Widdop, R. E. (2001). Persistent cardiovascular effects of chronic reninangiotensin system inhibition following withdrawal in adult spontaneously hypertensive
rats. Journal of Hypertension 19(8): 1393-1402.
Pescatello, L. S., B. A. Franklin, R. Fagard, W. B. Farquhar, G. A. Kelley, C. A. Ray,
A. C. S. Med, (2004). Exercise and hypertension. Medicine and Science in Sports and
Exercise 36(3): 533-553.
56
Pikkarainen, S., H. Tokola, R. Kerkela, M. Ilves, M. Makinen, H. D. Orzechowski, M.
Paul, O. Vuolteenaho, H. Ruskoaho (2006). Inverse regulation of preproendothelin-1
and endothelin-converting enzyme-1 beta genes in cardiac cells by mechanical load.
American Journal of Physiology-Regulatory Integrative and Comparative Physiology
290(6): R1639-R1645.
Pontes, M. R. N., Leães, P. E (2004). Remodelamento ventricular: dos mecanismos
moleculares e celulares ao tratamento. Revista da Sociedade de Cardiologia do Rio
Grande do Sul 3:1-7.
Porrello, E. R., A. I. Mahmoud, E. Simpson, J. A. Hill, J. A. Richardson, E. N. Olson,
H. A. Sadek (2011). Transient regenerative potential of the neonatal mouse heart.
Science 331(6020): 1078-1080.
Porter, K. E., Turner, N. A. (2009). Cardiac fibroblasts: At the heart of myocardial
remodeling. Pharmacology & Therapeutics 123(2): 255-278.
Raquel, H. A., Lyra, A. A. S., Souza, C. O., Souza, H. M., Zaia, C. T. B. V. M.,
Martins-Pinge, M. C (2013). Caracterização bioquímica e composição corporal de um
modelo de treinamento físico de natação em ratos. Biosaúde (15)2: 55-64.
Rebelo, R. M. D., R. Schreckenberg, K. D. Schluter (2012). Adverse cardiac
remodelling in spontaneously hypertensive rats: acceleration by high aerobic exercise
intensity. Journal of Physiology-London 590(21): 5389-5400.
Renna, B. F., S. M. MacDonnell, P. O. Reger, D. L. Crabbe, S. R. Houser, J. R. Libonati
(2007). Relative systolic dysfunction in female spontaneously hypertensive rat
myocardium. Journal of Applied Physiology 103(1): 353-358.
Risler, N. R., M. C. Cruzado, R. M. Miatello (2005). Vascular remodeling in
experimental hypertension. Thescientificworldjournal 5: 959-971.
57
Robergs, S. O., Roberts R. A. Exercise Physiology: exercise, performance and clinical
applications. 1a ed. St Louis: Mosby. 1997.
Rosário, T. M., Scala, L. C. N., França, G. V. A., Pereira, M. R., Jardim, P. C. B. V
(2009). Fatores associados à hipertensão arterial sistêmica em Nobres-MT. Rev Bras
Epidemiol 12(2): 248-57.
Rosenkranz, S. (2004). TGF-beta1 and angiotensin networking in cardiac remodeling.
Cardiovascular Research 63(3): 423-432.
Rossoni, L. V., R. A. F. Oliveira, R. R. Caffaro, M. Miana, D. Sanz-Rosa, M. K. Koike,
S. L. Do Amaral, L. C. Michelini, V. Lahera, V. Cachofeiro (2011). Cardiac benefits of
exercise training in aging spontaneously hypertensive rats. Journal of Hypertension
29(12): 2349-2358.
Rueda, J. O. V., J. Palomeque, A. Mattiazzi (2012). Early apoptosis in different models
of cardiac hypertrophy induced by high renin-angiotensin system activity involves
CaMKII. Journal of Applied Physiology 112(12): 2110-2120.
Sandercock, G. R. H., P. D. Bromley, D. A. Brodie (2005). Effects of exercise on heart
rate variability: Inferences from meta-analysis. Medicine and Science in Sports and
Exercise 37(3): 433-439.
Sano, H., H. Okamoto, A. Kitabatake, K. Iizuka, T. Murakami, H. Kawaguchi (1998).
Increased mRNA expression of cardiac renin-angiotensin system and collagen synthesis
in spontaneously hypertensive rats. Molecular and Cellular Biochemistry 178(1-2): 5158.
Sato, H., A. Watanabe, T. Tanaka, N. Koitabashi, M. Arai, M. Kurabayashi, T.
Yokoyama (2003). Regulation of the human tumor necrosis factor-alpha promoter by
angiotensin II and lipopolysaccharide in cardiac fibroblasts: different cis-acting
58
promoter sequences and transcriptional factors. Journal of Molecular and Cellular
Cardiology 35(10): 1197-1205.
Savoia, C., Schiffrin, E. L. (2006). Inflammation in hypertension. Current Opinion in
Nephrology and Hypertension 15(2): 152-158.
Schunkert, H., V. J. Dzau, S. S. Tang, A. T. Hirsch, C. S. Apstein, B. H. Lorell (1990).
Increased rat cardiac angiotensin converting enzyme-activity and messenger-rna
expression in pressure overload left-ventricular hypertrophy - effects on coronary
resistance, contractility, and relaxation. Journal of Clinical Investigation 86(6): 19131920.
Schwartzkopff, B., M. Mundhenke, B. E. Strauer (1995). Remodeling of
intramyocardial arterioles and extracellular-matrix in patients with arterial-hypertension
and impaired coronary reserve. European Heart Journal 16: 82-86.
Seals, D. R., Reiling, M. J. (1991). Effect of regular exercise on 24-hour arterialpressure in older hypertensive humans. Hypertension 18(5): 583-592.
Senyo, S. E., M. L. Steinhauser, C. L. Pizzimenti, V. K. Yang, L. Cai, M. Wang, T. D.
Wu, J. L. Guerquin-Kern, C. P. Lechene, R. T. Lee (2013). Mammalian heart renewal
by pre-existing cardiomyocytes. Nature 493(7432): 433-436.
Shahbaz, A. U., Y. Sun, S. K. Bhattacharya, R. A. Ahokas, I. C. Gerling, J. E. Mcgee,
K. T. Weber (2010). Fibrosis in hypertensive heart disease: molecular pathways and
cardioprotective strategies. Journal of Hypertension 28: S25-S32.
Shorofsky, S. R., R. Aggarwal, M. Corretti, J. M. Baffa, J. M. Strum, B. A. Al-Seikhan,
Y. M. Kobayashi, L. R. Jones, W. G. Wier, C. W. Balke (1999). Cellular mechanisms of
altered contractility in the hypertrophied heart - Big hearts, big sparks. Circulation
Research 84(4): 424-434.
59
Sivakumar, P., S. Gupta, S. Sarkar, S. Sen (2008). Upregulation of lysyl oxidase and
MMPs during cardiac remodeling in human dilated cardiomyopathy. Molecular and
Cellular Biochemistry 307(1-2): 159-167.
Slama, M., D. Susic, J. Varagic, E. D. Frohlich (2002). Diastolic dysfunction in
hypertension. Current Opinion in Cardiology 17(4): 368-373.
Sociedade Brasileira de Cardiologia (2006). V Diretrizes Brasileiras de Hipertensão
Arterial. Disponível em: http://www.sbh.org.br/documentos. Brasil: 2006. Acesso em
março de 2016.
Sociedade Brasileira de Cardiologia (2010). VI Brazilian Guidelines on Hypertension.
Arq Bras Cardiol 95:1-51.
Staufenberger, S., M. Jacobs, K. Brandstatter, M. Hafner, V. Regitz-Zagrosek, G. Ertl,
W. Schorb (2001). Angiotensin II type 1 receptor regulation and differential trophic
effects on rat cardiac myofibroblasts after acute myocardial infarction. Journal of
Cellular Physiology 187(3): 326-335.
Sumida, E., M. Nohara, A. Muro, E. Sumida, H. Kaku, Y. Koga, H. Toshima, T.
Imaizumi (1998). Altered calcium handling in compensated hypertrophied rat
cardiomyocytes induced by pressure overload. Japanese Circulation Journal-English
Edition 62(1): 36-46.
Sun, L., Gao, Y.H., Tian, D.K., Zheng, J.P., Zhu, C.Y., Ke, Y., Bian. K (2006).
Inflammation of different tissues in spontaneously hypertensive rats. Sheng Li Xue Bao
58:318-323.
Sun, Y. O., J. Q. Zhang, J. K. Zhang, F. J. A. Ramires (1998). Angiotensin II,
transforming growth factor-beta 1 and repair in the infarcted heart. Journal of Molecular
and Cellular Cardiology 30(8): 1559-1569.
60
Swynghedauw, B., C. Delcayre, J. L. Samuel, A. Mebazaa, A. Cohen-Solal (2010).
Molecular mechanisms in evolutionary cardiology failure. analysis of cardiac
development: from embryo to old age. Annals of the New York Academy of Sciences
1188: 58-67.
Taimeh, Z., J. Loughran, E. J. Birks, R. Bolli (2013). Vascular endothelial growth factor
in heart failure. Nat Rev Cardiol 10(9): 519-530.
Tallant, E. A., C. M. Ferrario, P. E. Gallagher (2005). Angiotensin (1-7) inhibits growth
of cardiac myocytes through activation of the mas receptor. American Journal of
Physiology-Heart and Circulatory Physiology 289(4): H1560-H1566.
Trippodo, N. C., Frohlich, E. D. (1981). Similarities of genetic (spontaneous)
hypertension - man and rat. Circulation Research 48(3): 309-319.
Tsutsui, H., Y. Ishibashi, M. Takahashi, T. Namba, H. Tagawa, K. Imanaka-Yoshida,
A. Takeshita (1999). Chronic colchicine administration attenuates cardiac hypertrophy
in spontaneously hypertensive rats. Journal of Molecular and Cellular Cardiology 31(6):
1203-1213.
Veras-Silva, A. S., K. C. Mattos, N. S. Gava, P. C. Brum, C. E. Negrao, E. M. Krieger
(1997). Low-intensity exercise training decreases cardiac output and hypertension in
spontaneously hypertensive rats. American Journal of Physiology-Heart and Circulatory
Physiology 273(6): H2627-H2631.
Wang, Y., U. Wisloff, O. J. Kemi (2010). Animal models in the study of exerciseinduced cardiac hypertrophy. Physiological Research 59(5): 633-644.
Weber, K. T. (1989). Cardiac interstitium in health and disease - the fibrillar collagen
network. Journal of the American College of Cardiology 13(7): 1637-1652.
Weber, K. T., Brilla, C. G. (1991). Myocardial fibrosis and elevations in plasmaaldosterone in arterial-hypertension. Aldosterone 215: 117-120.
61
Weber, K. T., Y. Sun, S. C. Tyagi, J. P. M. Cleutjens (1994). Collagen network of the
myocardium - function, structural remodeling and regulatory mechanisms. Journal of
Molecular and Cellular Cardiology 26(3): 279-292.
Wilson, E. M., Spinale, F. G. (2001). Myocardial remodelling and matrix
metalloproteinases in heart failure: turmoil within the interstitium. Annals of Medicine
33(9): 623-634.
Wisloff, U., J. P. Loennechen, G. Falck, V. Beisvag, S. Currie, G. Smith, O. Ellingsen
(2001). Increased contractility and calcium sensitivity in cardiac myocytes isolated from
endurance trained rats. Cardiovascular Research 50(3): 495-508.
Yancy, C. W., M. Jessup, B. Bozkurt, J. Butler, D. E. Casey, M. H. Drazner, G. C.
Fonarow, S. A. Geraci, T. Horwich, J. L. Januzzi, M. R. Johnson, E. K. Kasper, W. C.
Levy, F. A. Masoudi, P. E. McBride, J. J. V. McMurray, J. E. Mitchell, P. N. Peterson,
B. Riegel, F. Sam, L. W. Stevenson, W. H. W. Tang, E. J. Tsai, B. L. Wilkoff, J. L.
Anderson, A. K. Jacobs, J. L. Halperin, N. M. Albert, B. Bozkurt, R. G. Brindis, M. A.
Creager, L. H. Curtis, D. DeMets, R. A. Guyton, J. S. Hochman, R. J. Kovacs, F. G.
Kushner, E. M. Ohman, S. J. Pressler, F. W. Sellke, W. K. Shen, W. G. Stevenson, C.
W. Yancy (2013). 2013 ACCF/AHA Guideline for the Management of Heart Failure:
Executive
Summary
A
Report
of
the
American
College
of
Cardiology
Foundation/American Heart Association Task Force on Practice Guidelines. Circulation
128(16): 1810-1852.
Yao, L., G. P. Chen, X. Lu, L. R. Zheng, Y. Mou, S. J. Hu (2009). Effects of
atorvastatin on calcium-regulating proteins: a possible mechanism to repair cardiac
dysfunction in spontaneously hypertensive rats. Basic Research in Cardiology 104(3):
258-268.
Yelamarty, R. V., R. L. Moore, F. T. S. Yu, M. Elensky, A. M. Semanchick, J. Y.
Cheung (1992). Relaxation abnormalities in single cardiac myocytes from renovascular
hypertensive rats. American Journal of Physiology 262(4): C980-C990.
62
Yokoyama, T., M. Arai, K. Sekiguchi, T. Tanaka, T. Kanda, T. Suzuki, R. Nagai
(1999). Tumor necrosis factor-alpha decreases the phosphorylation levels of
phospholamban and troponin I in spontaneously beating rat neonatal cardiac myocytes.
Journal of Molecular and Cellular Cardiology 31(1): 261-273.
Zamo, F. S., V. G. Barauna, S. Chiavegatto, M. C. Irigoyen, E. M. Oliveira (2011). The
renin-angiotensin system is modulated by swimming training depending on the age of
spontaneously hypertensive rats. Life Sciences 89(3-4): 93-99.
Zamo, F. S., S. Lacchini, C. Mostarda, S. Chiavegatto, I. C. M. Silva, E. M. Oliveira,
M. C. Irigoyen (2010). Hemodynamic, morphometric and autonomic patterns in
hypertensive rats - renin-angiotensin system modulation. Clinics 65(1): 85-92.
Zamo, F. S., E. M. Oliveira, E. M. Krieger, M. C. Irigoyen (2004). Exercise training
reduced hypertension and RAS activity but not the cardiac hypertrophy. Journal of
Hypertension 22: S72-S73.
Zhang, X. Q., J. L. Song, L. L. Carl, W. X. Shi, A. Qureshi, Q. Tian, J. Y. Cheung
(2002). Effects of sprint training on contractility and Ca2+(i) transients in adult rat
myocytes. Journal of Applied Physiology 93(4): 1310-1317.
63
ANEXO I
Protocolo de aprovação do Comitê de Ética em Uso Animal
64