INTRODUÇÃO À CINETICA E
TERMODINÂMICA
QUÍMICA
Principios de Termodinâmica
• Termodinamica determina se um
processo fisicoquímico é possível (i.e.
espontaneo)
• Termodinamica não providencia
informação sobre a velocidade deste
processo
Sistemas termodinâmicos
Fechado: Fisicoquímica (Equilibrio)
A
B
Aberto: Bioquímica (Steady-State)
A
B
Inputs and Outputs
Primeira and Segunda Lei da
Termodinamica
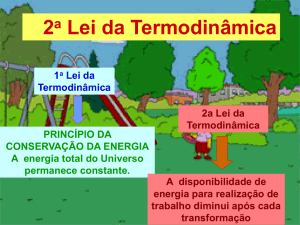
Primeira Lei da Termodinamica
Energia é conservada
ΔU=q+w (Energia = Trabalho + Calor)
Segunda Lei da Termodinamica
O universo tende a desordem
máxima
Consequências da Segunda Lei de
Termodinâmica
• Processos espontaneos favorecem o
aumento da desordem global do
universo.
• Ordem aumentada em um sistema
necessita de desordem aumentada na
vizinhança.
Processos Espontâneos
• A termodinâmica está relacionada com a
pergunta: uma reação pode ocorrer?
• A primeira lei de termodinâmica: a energia
é conservada.
• Qualquer processo que ocorra sem
intervenção externa é espontâneo.
• Quando dois ovos caem no chão, eles se
quebram espontaneamente.
• A reação inversa não é espontânea.
• Podemos concluir que um processo
espontâneo tem um sentido.
Processos Espontâneos
• Um processo que é espontâneo em um
sentido não é espontâneo no sentido
contrário.
• O sentido de um processo espontâneo
pode depender da temperatura: gelo
se transformando em água é
espontâneo a T > 0°C, água se
transformado em gelo é espontâneo a
T < 0°C.
7
Processos Espontâneos
• Processos reversíveis e irreversíveis
• Um processo reversível é o que pode ir e
voltar entre estados pela mesma
trajetória.
Processos Espontâneos
Processos reversíveis e irreversíveis
• Os sistemas químicos em equilíbrio são
reversíveis.
• Em qualquer processo espontâneo, a
trajetória entre reagentes e produtos é
irreversível.
• A termodinâmica nos fornece o sentido de
um processo. Ela não pode prever a
velocidade na qual o processo irá ocorrer.
• Por que as reações exotérmicas são
espontâneas?
9
Entropia e a 2ª Lei da
Termodinâmica
• Por que ocorrem os processos espontâneos?
• Considere um estado inicial: dois frascos
conectados por um registro fechado. Um
frasco é evacuado e o outro contém gás sob
1 atm.
• O estado final: dois frascos conectados por
um registro aberto. Cada frasco contém
gás sob 0,5 atm.
• A expansão do gás é isotérmica (com
temperatura constante).
Conseqüentemente, o gás não executa
trabalho e o calor não é transferido.
Entropia e a 2ª Lei da
Termodinâmica
• Por que um gás se expande?
Entropia
• Expansão espontânea de um gás
• Considere o simples caso onde existem duas
moléculas de gás nos frascos.
• Antes do registro ser aberto, ambas as
moléculas de gás estarão em um frasco.
• Uma vez que o registro é aberto, há uma
probabilidade maior que uma molécula
esteja em cada frasco do que ambas as
moléculas estarem no mesmo frasco.
Entropia
Expansão espontânea de um gás
• Quando existem muitas moléculas, é muito
mais provável que as moléculas se
distribuam entre os dois frascos do que
todas permanecerem em apenas um frasco.
Entropia
• A entropia, S, é uma medida da
desordem de um sistema.
• As reações espontâneas seguem no
sentido da diminuição de energia ou
do aumento da entropia.
• No gelo, as moléculas são muito bem
ordenadas por causa das ligações H.
• Portanto, o gelo tem uma entropia
baixa.
Entropia
• À medida que o gelo derrete,
quebram-se as forças
intermoleculares (requer energia),
mas a ordem é interrompida (então a
entropia aumenta).
• A água é mais desorganizada do que o
gelo, então o gelo derrete
espontaneamente à temperatura
ambiente.
Entropia
• Geralmente, quando um aumento na
entropia em um processo está
associado a uma diminuição na
entropia em outro sistema, predomina
o aumento em entropia.
• A entropia é uma função de estado.
• Para um sistema, ΔS = Sfinal Sinicial
• Se ΔS > 0, a desordem aumenta, se
ΔS < 0 a ordem aumenta.
Segunda Lei da
Termodinâmica
• A segunda lei da termodinâmica explica a
razão dos Processos espontâneos terem um
sentido.
• Em qualquer processo espontâneo, a
entropia do universo aumenta.
• ΔSuniv = ΔSsis + ΔSviz: a variação de
entropia do universo é a soma da variação
de entropia do sistema e a variação de
entropia da vizinhança.
• A entropia não é conservada: ΔSuniv está
aumentando
18
Segunda Lei da
Termodinâmica
• Para um processo reversível: ΔSuniv = 0.
• Para um processo espontâneo (e
irreversível): ΔSuniv > 0.
• Observe: a segunda lei afirma que a
entropia do universo deve aumentar em um
processo espontâneo. É possível que a
entropia de um sistema diminua desde que a
entropia da vizinhança aumente.
• Para um sistema isolado, ΔSsis = 0 para um
processo reversível e ΔSsis > 0 para um
processo espontâneo.
Interpretação Molecular da
Entropia
• Um gás é menos ordenado do que um
líquido, que é menos ordenado do que
um sólido.
• Qualquer processo que aumenta o
número de moléculas de gás leva a um
aumento em entropia.
• Quando NO(g) reage com O2(g) para
formar NO2(g), o número total de
moléculas de gás diminui e a entropia
diminui.
Entropia e a desordem
Quando um corpo recebe calor a
sua entropia aumenta.
∆S = ∆qT 0
Aumenta a EC e/ou a
agitação molecular
Aumenta a “desordem”
A entropia é a medida da desordem
ΔS = ∆ q/T < 0 → a “desordem” diminui.
Ordem e Energia - Sistemas Biológicos
Entropia
2a Lei
Evolução
natural
Ordem → Desordem
Como os sistemas biológicos se desenvolvem e mantém alto grau de ordem?
É uma violação da 2a Lei?
Ordem pode ser obtida as
custas de energia
Nos animais
Celulas – Mitocondria
armazenam moléculas de açucar para
formar moléculas altamente ordenadas
e estruturadass.
A fotosíntese converte energia solar em
energia potencial nas moléculas de glucose
com de alta ordem de organização.
Os organismos trocam energia e matéria
com o meio ambiente
Exemplo mecânico
Trabalho
realizado
Perda de
energia
potencial
Um objeto no
alto de um plano
inclinado
apresenta uma
certa
quantidade de
energia
potencial devido
á sua altura
Quando o objeto desliza para baixo a sua energia potencial
de posição pode ser acoplada para realizar uma certa
quantidade de trabalho
Variação de energia livre (G)
Exemplo químico
As moléculas
apresentam uma
certa quantidade
de energia
potencial química
Parte desta
energia pode ser
utilizada para
realizar trabalho
Esta fração de
energia, energia
livre, é designada
G 0: Liberação de energia livre (exergônica)
por G e a sua
G 0: Introdução de energia livre (endergônica)
variação em uma
G = 0: A reação está em equilíbrio
reação é G
Energia livre de Gibbs (G)
Nos sistemas biológicos (temperatura e pressão constantes) as
mudanças na energia livre (G), entalpia (H) e entropia estão
relacionadas entre si pela equação:
G = H - TS
Entalpia (delta H) = medição a energia em um sistema termodinâmico que está
disponível na forma de calor
Uma reação é espontânea
quando G é negativo
Uma reação que
apresenta G positivo
(endergônica) não
ocorre de forma
espontânea, a menos
que esteja acoplada a
uma reação exergônica
Reações químicas catalisadas e não catalisadas por enzimas
RELAÇÃO ENTRE A ENERGIA LIVRE PADRÃO DE
UMA REAÇÃO QUÍMICA E A CONSTANTE DE
EQUILÍBRIO
aA + bB
cC + dD
[C ] [ D ]
K eq
a
b
[A] [ B ]
c
d
a, b, c e d = número de moléculas
[A], [B], [C] e [D] = concentração molar dos
Componentes da reação no ponto de equilíbrio
Quando o sistema de reação não está em equilíbrio
a tendência de se mover em direção ao equilíbrio
representa uma força, cuja magnitude pode ser
expressa como a variação de energia livre para a
reação = G
Variação padrão de energia livre (G’)
A variação de energia livre (G) de uma reação química esta
diretamente relacionada com a constante de equilíbrio (Keq)
aA + bB
cC + dD
Keq =
[C]c x [D]d
[A]a x [B]b
Em condições padrão: T = 25°C e reagentes e produtos
inicialmente presentes em concentrações iguais a 1 M, a força
do sistema em direção ao equilíbrio é definida como a variação
de energia livre padrão (G)
G = - RT lnKeq
Entretanto, em bioquímica, a concentração de H+ é 10-7 M (pH 7)
e da água é 55,5 M. E a G passa a ser G’
G’ = - RT lnK’eq
Relação entre G’ e K’eq
das reações químicas
Variação padrão
de energia livre
aA + bB
Keq =
cC + dD
[C]c x [D]d
[A]a x [B]b
G’ = - RT lnK’eq
Relação entre G’, K’eq e a direção das reações químicas
em condições padrões
K’eq
G’
Condições padrão bioquímica
Ocorre de forma direta
Está no equilíbrio
Ocorre de forma inversa
G’ de algumas reações químicas em pH 7 e 25C
Vias metabólicas:
São diversas reações
químicas consecutivas
e interligadas para a
transferência de energia
Lei da ação das massas
A variação real de energia livre depende das concentrações de
reagentes e produtos
aA + bB
cC + dD
Keq =
[C]c x [D]d
[A]a x [B]b
G’ é uma constante estabelecida nas condições padrões,
entretanto a G depende das concentrações e temperatura
realmente existentes durante uma reação química
G = G’ - RT ln
[C]c [D]d
[A]a [B]b
Uma reação pode ser espontânea mesmo com G’ positivo, desde
que G seja negativo. Quando os produtos são imediatamente
removidos, a relação ([produtos]/[reagentes]) pode ficar abaixo de 1 e
RTln([produtos]/[reagentes]) pode assumir um valor grande e negativo
Energia livre de compostos celulares importantes
Grande variação de energia livre associada a
hidrólise de outros compostos fosforilados
Na hidrólise do fosfoenolpiruvato (PEP), os produtos piruvato e
fosfato são estabilizados por ressonância
A variação de energia livre na hidrólise do
ATP é grande e negativa
A hidrólise diminui a
repulsão entre as cargas
Estabilização
por ressonância
Ionização
Os produtos
formados na
hidrólise do ATP
são mais estáveis
porque fazem
ressonância e
apresentam menos
repulsão
eletrostática
Uma reação escrita
em um passo
Reação real