Curso: Medicina Veterinária
Período: 3º período
Disciplina: Biofísica
Data: 14/03/2012
Prof.:Érica Estanislau Muniz Faustino
ESTUDO DIRIGIDO 2- 1ª ETAPA- TERMODINÂMICA
1- Qual é a diferença entre sistema isolado,
sistema fechado e sistema aberto? Dê
exemplo em cada caso.
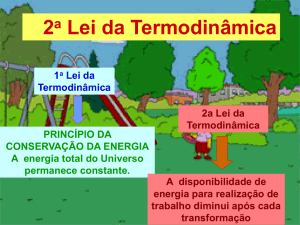
2- Explique por que a Primeira Lei da
Termodinâmica é chamada de Princípio da
Conservação de Energia.
3- O que é entropia? Relacione com os
sistemas biológicos.
4- Explique a Lei de Joule e relacione com a
entalpia.
5- Qual a relação entre o metabolismo animal
e a 1ª Lei da Termodinâmica.
6- Como é conhecida a energia que as
substâncias possuem? Defina.
7- Como a 2ª lei da Termodinâmica se
relaciona com o sentido do fluxo de calor?
8- Considere um sistema formado por uma
massa de um gás ideal encerrada num
reservatório provido de um embolo de massa
desprezível, de forma que seu volume possa
ser variado. Assinale as alternativas corretas:
a) Numa transformação isovolumétrica, o
trabalho realizado sobre o sistema é nulo.
b) Quando o gás se expande isobaricamente
ele não absorve nem cede energia.
c) Expandindo-se isotermicamente o gás, o
trabalho por ele realizado é igual à quantidade
de energia transferida, na forma de calor.
d) Para se comprimir isobaricamente o gás,
deve-se realizar um trabalho sobre ele igual
ao produto da pressão do gás pela variação de
seu volume.
e) Num processo qualquer de expansão do
gás, a energia transferida na forma de calor
será igual à variação de sua energia interna
somada ao trabalho por ele realizado.
9- A figura é um diagrama de uma substância
de uma usina termoelétrica em que foram
identificados seus componentes principais. A
partir de sua leitura, responda:
a) Qual é a substância de operação da usina a
“fonte” de energia?
b) Onde e qual é o trabalho realizado pela
substância de operação?
c) Quais são as transformações por que passa
a substância de operação?
d) Qual é o papel exercido pelo circuito por
onde flui a água do rio?
10- Analise cada sistema abaixo e responda
se a entropia aumenta ou diminui durante
cada um dos processos. Explique.
a) N2 (g) + 2 O2 (g)
b) CO2 (s)
2 NO2 (g)
CO2 (g)
c) resfriamento da água de 50°C a 4°C
11- Calcule o trabalho para um sistema que
absorve 150 KJ de calor em um processo
para o qual o aumento da energia interna é
120 KJ. Durante esse processo, o trabalho foi
realizado sobre ou pelo sistema?
12- Julgue cada item em Certo (C) ou errado
(E):
a) a formação de gotas de água em uma
nuvem ocorre com aumento de entropia.
b) a dissolução de açúcar em água ocorre o
aumento de entropia.
c) a vaporização do álcool no carburador de
um carro se dá com diminuição de entropia.
d) ao bombearmos o ar para encher um pneu,
ocorre diminuição de entropia.
e) na transformação de:
Br2(l) + Cl2
de entropia.
2BrCl (g) ocorre aumento
13- Um gás sofre um processo adiabático no
qual realiza um trabalho de 300 J.
a) o gás está se expandindo ou se contraindo?
Por quê?
b) qual a quantidade de calor que o gás está
trocando com o ambiente?
c) de quanto é a variação de energia interna
nesse processo?
d) explique como se modificam as variáveis
de estado (volume, temperatura e pressão) do
gás nessa transformação.