RESOLUÇÃO
Obs.: a sequência das questões pode não ser a mesma da sua prova
Química – Professor Sussumu
Prova Objetiva – 10ano – 4o Bim – 05/1
01. A tensão superficial da água explica vários fenômenos, como a capilaridade, a forma esférica das gotas
de água e o fato de alguns insetos poderem andar sobre a água. A alta tensão superficial da água é uma
consequência direta:
a)
b)
c)
d)
e)
da sua viscosidade;
do seu elevado ponto de fusão;
do seu elevado ponto de ebulição;
das atrações intermoleculares;
das ligações covalente entre os átomos de hidrogênio e oxigênio.
Tensão superficial é um efeito físico que ocorre na camada superficial de um líquido, quando entre suas
moléculas as atrações intermoleculares são muito intensas (pontes de hidrogênio), que leva a sua
superfície a se comportar como uma membrana plástica. As moléculas situadas no interior de um líquido
são atraídas em todas as direções pelas moléculas vizinhas e, por isso, a resultante das forças que
atuam sobre cada molécula é praticamente nula. As moléculas da superfície do líquido, entretanto,
sofrem apenas atração lateral e inferior. Esta força para o lado e para baixo cria a tensão na superfície,
que faz a mesma comportar-se como uma película plástica.
02. Qual força é responsável pelo fato do gelo (água sólida) flutuar no seu próprio líquido?
a) ligação covalente;
b) pontes de hidrogênio;
c) forças de Van der Waals (dipolo induzido);
d) ligação iônica;
e) ligação metal-metal.
Tensão superficial é um efeito físico que ocorre na camada superficial de um líquido, quando entre suas
moléculas as atrações intermoleculares são muito intensas (pontes de hidrogênio), que leva a sua
superfície a se comportar como uma membrana plástica. As moléculas situadas no interior de um líquido
são atraídas em todas as direções pelas moléculas vizinhas e, por isso, a resultante das forças que
atuam sobre cada molécula é praticamente nula. As moléculas da superfície do líquido, entretanto,
sofrem apenas atração lateral e inferior. Esta força para o lado e para baixo cria a tensão na superfície,
que faz a mesma comportar-se como uma película plástica.
03. A equação refere-se à transformação de ozônio em oxigênio comum, representada pela equação:
2O3
3O2
Os números 2 e 3 que aparecem no lado esquerdo (reagentes) da equação representam,
respectivamente:
a) coeficiente estequiométrico e número de átomos da molécula;
b) coeficiente estequiométrico e número de moléculas;
c) número de moléculas e coeficiente estequiométrico;
d) número de átomos da molécula e coeficiente estequiométrico;
e) número de átomos da molécula e número de moléculas.
O número 2 representa o coeficiente estequiométrico da equação química (número de moléculas ou
número de mols de moléculas) e o número 3 representa o número de átomos da molécula.
04. Em determinadas situações, como o nervosismo ou alimentação inadequada, o ácido clorídrico (HCl) é
produzido em grandes quantidades, causando acidez estomacal. Esta acidez pode ser regulada com o
uso de antiácido de hidróxido de magnésio – Mg(OH)2 – e hidróxido de alumínio – Al(OH)3, duas bases
que reduzem a acidez gástrica em níveis normais. As reações que ocorrem estão representadas abaixo
e são classificadas como:
a)
b)
c)
d)
e)
2HCl + Mg(OH)2
3HCl + Al(OH)3
reações de síntese;
reações de análise;
reações de dupla troca;
reações de deslocamento;
reações de oxirredução.
MgCl2 + 2H2O
AlCl3 + 3H2O
Nas reações de neutralização (ácido + base → sal + água) ocorrem duas trocas (dupla troca) e a carga
elétrica dos elementos envolvidos não varia (não ocorre oxirredução).
05. Um mol de gás ideal é submetido a uma transformação de estado cíclico, como mostra o gráfico a seguir:
volume (L)
A
B
C
pressão (atm)
Pode-se afirmar que as transformações A, B e C são, respectivamente:
a) isocórica, isotérmica e isocórica;
b) isobárica, isotérmica e isocórica;
c) isocórica, isotérmica e isobárica;
d) isotérmica, isobárica e isocórica;
e) isocórica, isobárica e isotérmica.
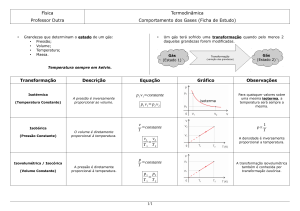
Transformação isocórica ocorre quando o volume não varia, transformação isobárica ocorre quando a
pressão não varia e a transformação isotérmica ocorre quando a temperatura não varia.
06. As seguintes características:
os gases sempre se expandem, procurando ocupar todo o volume do recipiente que os contém (grande
expansibilidade;
os gases são muito menos densos que os sólidos e líquidos, isto é, em igualdade de massa, os gases
ocupam um volume muito maior;
os gases sempre se misturam entre si (grande difusibilidade);
os volumes dos gases variam muito com a pressão (grande dilatabilidade).
São relativas à(às):
a) teoria cinética dos gases;
b) lei de Boyle-Mariotte;
c) lei de Charles e Gay-Lussac;
d) propriedades do estado gasoso;
e) hipótese de Avogadro;
07. Em 1738, o físico matemático Daniel Bernoulli Atim, publicou o trabalho Hidrodinâmica, posicionando seu
argumento, ainda sólido até a atualidade, que os gases consistem em um grande número de moléculas
se movendo em todas as direções, onde elas colidem entre si e esse impacto causa uma pressão na
superfície de contado que podemos sentir. Como exemplos, podemos citar o que nós sentimos como
calor, que corresponde simplesmente a energia cinética do seu movimento. A teoria não foi
imediatamente aceita, em parte por causa da conservação de energia que não estava bem estabelecida,
e ainda, não era óbvio aos físicos que as colisões entre as moléculas eram perfeitamente elásticas.
Este trabalho consistiu na base para a:
a) hipótese de Avogadro;
b) lei de Charles;
c) lei de Boyle-Mariotte;
d) teoria cinética dos gases;
e) equação de Clapeyron.
A Teoria Cinética dos Gases surgida no final do século XIX tenta explicar o comportamento
macroscópico dos gases com base nas propriedades microscópicas da matéria. Em outras palavras, a
teoria caracteriza – com base nas propriedades individuais das partículas que compõe o gás –, o
comportamento esperado para uma grande quantidade deste. Esse modelo admite que: um gás é feito
por partículas que estão em constante movimento desordenado e aleatório; o tamanho das partículas é
desprezível se comparado à distância entre elas; não existem forças atrativas ou repulsivas entre as
partículas; as colisões entre as partículas são perfeitamente elásticas; a energia total de uma amostra de
gás é igual a soma das energias cinéticas individuais de cada partícula presente.
08. Com relação aos sistemas gasosos, julgue os itens a seguir em falso ou verdadeiro, e assinale a
alternativa correta:
Uma transformação isobárica é aquela que ocorre à temperatura constante.
A Lei de Boyle-Mariotte se aplica às transformações isotérmicas.
Pressão, volume e temperatura são ditas variáveis de estado, ou seja, são grandezas que caracterizam
uma dada massa gasosa.
Uma transformação a volume constante é chamada de isocórica, isométrica ou isovolumétrica.
Nas equações de gases, a temperatura deve ser utilizada em graus Celsius.
1 mol de qualquer gás a 00C e 1 atm ocupa 22,4 litros.
a) F – V – V – V – F – V
b) F – V – V – V – V – V
c) F – V – V – F – F – V
d) F – V – V – V – F – F
e) V – V – V – V – F – V
Uma transformação isobárica é aquela que ocorre à pressão constante.
Nas equações de gases, a temperatura deve ser utilizada em Kelvin.
09. “Para dada amostra de substância gasosa, quando se dobra a pressão, à temperatura constante, o
volume se reduz a metade.”
Essa afirmação explicita o que é conhecido como Lei de:
a) Avogadro;
b) Dalton;
c) Gay-Lussac;
d) Boyle-Mariotte;
e) Lavoisier.
Em 1662, Robert Boyle publicou um trabalho chamado “The Spring and Weight of the Air”. Nesse
trabalho, Boyle apresenta uma série de experimentos nos quais ele media o volume de gases em
função da pressão exercida sobre estes, em diferentes temperaturas. Boyle observou que o volume de
um gás era inversamente proporcional à pressão aplicada sobre este.
10. Se numa transformação isobárica uma massa gasosa tiver seu volume aumentado em 3/4 , a
temperatura:
a) permanecerá constante;
b)
c)
d)
e)
aumentará na proporção de 7/4;
diminuirá na proporção de 7/4;
duplicará seu valor;
triplicará seu valor.
estado inicial
V1 = 1
T1
V1
T1
P = constante
=
V2
T2
1
T1
=
1,75
T2
T2 = 1,75T1
T2 = 7/4T1
estado final
V2 = 1 + 3/4 V2 = 1,75
T2 = ?
11. Certa massa gasosa sofre uma transformação física que pode ser representada pelo gráfico abaixo:
volume (L)
4
3
2
1
temperatura (K)
Assim, concluímos que se trata de uma transformação:
a) isocórica;
b) isobárica;
c) adiabática;
d) isotérmica;
e) isovolumétrica.
O gráfico refere-se a uma transformação isobárica, em que, mantendo-se a pressão constante, o
volume de uma dada massa gasosa será diretamente proporcional a temperatura absoluta.
12. Uma amostra de ozônio ocupa 250 mL a 210C. Que volume ocupará a 800C, se não houver variação da
pressão?
a) 1000 ml
b) 350 ml
c) 300 ml
d) 273 ml
e) 257 ml
estado inicial
V1 = 250 ml
T1 = 210C + 273
T1 = 294K
V1
T1
=
V2
T2
P = constante
estado final
V2 = ?
T2 = 800C + 273
T2 = 353K
250
294
=
V2
353
294 V2 = 250 353
V2 = 88250
294
V2 = 300 ml
13. A pressão total do ar no interior de um pneu era de 2,30 atm, quando a temperatura do pneu era de
270C. Depois de se rodar um certo tempo com esse pneu, mediu-se novamente sua pressão e verificouse que esta era agora de 2,53 atm. Supondo a variação de volume do pneu desprezível, a nova
temperatura será:
a) 29,70C
b) 570C
c) 330C
d) 3300C
e) 5700C
estado inicial
estado final
V = constante
P1 = 2,30 atm
P2 = 2,53 atm
T1 = 270C + 273
T2 = ?
T1 = 300K
P1
T1
=
P2
T2
2,30
300
2,53
T2
=
2,30 T2 = 300 2,53
T2 = 759
T2 = 330K
2,30
T2 = 330 – 273
T2 = 570C
14. Um recipiente fechado de volume V contém certa massa gasosa à temperatura de 27 0C, exercendo uma
pressão de 740mmHg. Após aquecimento, verificou-se que o novo valor da pressão era de 2 atm.
Supondo desprezível a variação de volume, a nova temperatura, em K, do sistema será,
aproximadamente:
a) 327
b) 540
c) 600
d) 273
e) 160
estado inicial
P2 = 2,00 atm
P2 = 1520 mmHg
T2 = ?
T1 = 270C + 273
T1 = 300K
P1
T1
=
P2
T2
estado final
V = constante
P1 = 740 mmHg
740
300
=
1520
T2
740 T2 = 300 1520
T2 = 456000
T2 = 616,2K
740
15. Se 4 gramas de etano (C2H6), estão a 270C e apresentam o volume de 3,5 litros, então a sua pressão em
mmHg é de:
(Dados: MC2H6 = 30g/mol; R = 62,3)
a) 1746
b) 712
c) 143
d) 158
e) 164,78
mgás = 4 g
T = 270C + 273 = 300K
V = 3,5 l
PV = mRT
M
P=mRT
MV
P = 2492
3,5
P = 4 62,3 300
30 3,5
P = 712 mmHg
16. Determine a massa, em gramas, de 112 litros de CO2 em CNTP.
(Dados: CO2 = 44g/mol)
a) 44
b) 220
c) 110
d) 224
e) 22,4
1mol de CO2 __________ 44g __________22,4l (em CNTP)
x __________ 112l
x = 44 112
22,4
17. Em 600 gramas de H2O, existem:
(Dados: H2O = 18g/mol)
a) 21025 moléculas
b) 18 moléculas
c) 61023 moléculas
x = 220g
P = 4 62,3 10
3,5
d) 16 moléculas
e) 3 moléculas
1 mol H2O ________18 gramas ________ 6 1023 moléculas
600 gramas ________
x
x = 6 102 6 1023
18
x = 6 102 1023
3
x = 2 1025 moléculas
18. O etano (C2H6) possui fórmula mínima:
a) CH
b) C2H
c) CH4
d) CH5
e) CH3
A fórmula mínima nos indica a menor proporção inteira em que os elementos combinam entre si.