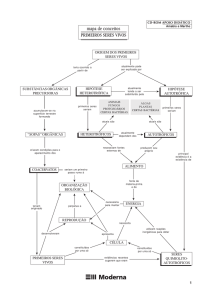
Composto orgânico
Acetona
Os compostos ou moléculas orgânicas são as substâncias químicas que contêm na sua
estrutura Carbono e Hidrogênio, e muitas vezes com oxigênio, nitrogênio, enxofre,
fósforo, boro, halogênios e outros. Não são moléculas orgânicas os carbetos, os
carbonatos e os óxidos de carbono.
Glicose
As moléculas orgânicas podem ser:
Moléculas orgânicas naturais: São as sintetizadas pelos seres vivos
denominadas biomoléculas, que são estudadas pela bioquímica.
Moléculas orgânicas artificiais: São substâncias que não existem na natureza e
têm sido fabricadas pelo homem, como os plásticos. A maioria dos compostos
orgânicos puros são produzidos artificialmente.
A linha que divide as moléculas orgânicas das inorgânicas tem originado polêmicas e
historicamente tem sido arbitrária, porém, geralmente os compostos orgânicos
apresentam carbono ligado a hidrogênio, e os compostos inorgânicos não. Deste modo,
o ácido carbônico é inorgânico, entretanto, o ácido fórmico, o primeiro ácido
carboxílico, é orgânico. O anidrido carbônico e o monóxido de carbono são compostos
inorgânicos. Portanto, todas as moléculas orgânicas contêm carbono, porém nem todas
as moléculas que tem carbono, são moléculas orgânicas.
A etimologia da palavra "orgânico" significa que procede de "organos", relacionada
com a vida, em oposição ao inorgânico que teria o significado de tudo que carece de
vida.
Síntese de Wohler
Para os químicos antigos, as substâncias orgânicas eram provenientes de fontes animais
ou vegetais, e as substâncias inorgânicas seriam aquelas de procedência mineral.
Durante muitos anos acreditava-se que entre a química orgânica e a química inorgância
existia uma barreira intransponível. No princípio do século XIX, o químico alemão
Friedrich A. Wöhler conseguiu sintetizar a uréia, um produto orgânico, a partir de
substâncias inorgânicas (o cianato de amônio), comprovando que tal divisão era
totalmente artificial, algo que é completamente evidente na química moderna.
Atualmente, o termo "orgânico" está sendo distorcido e utilizado de forma indevida para
se referir a alimentos não industrializados (naturais) ou produtos biodegradáveis.
Porém, existem diversos exemplos de produtos orgânicos que não são sequer
comestíveis e nem mesmo biodegradáveis.
Compostos orgânicos: características gerais
Por Líria Alves
Os compostos orgânicos em sua maioria são formados pela ligação entre átomos de carbono e
hidrogênio. Sendo assim, a atração entre elétrons das moléculas orgânicas é praticamente a
mesma, essa propriedade nos leva a abordar uma característica dos compostos orgânicos: a
polaridade.
Polaridade
Todas as ligações dos compostos orgânicos formadas somente por carbono e hidrogênio são
apolares, pois os átomos unidos demonstram uma pequena desigualdade de
eletronegatividade. Quando na molécula de um composto orgânico houver outro elemento
químico, além de carbono e hidrogênio, suas moléculas passarão a apresentar certa polaridade.
Solubilidade
Compostos orgânicos são praticamente insolúveis em água, mas por outro lado, tendem a se
dissolver em outros compostos orgânicos, sejam eles polares ou apolares. Toda regra tem
exceção e alguns compostos orgânicos que são polares podem se dissolver na água, como o
ácido acético, açúcar, álcool comum, acetona, etc.
Combustibilidade
A maioria dos compostos que são bons combustíveis, ou seja, se queimam com facilidade, são
de origem orgânica.
Exemplos: gás utilizado em fogões, álcool dos automóveis.
Temperatura de fusão e de ebulição
Em geral as temperaturas de fusão e de ebulição dos compostos orgânicos são baixas. A baixa
solubilidade dos compostos orgânicos apolares é responsável por pontos de fusão e ebulição
menores comparados aos dos compostos inorgânicos, ou seja, as interações intermoleculares
são mais fracas.
Outros fatores que influenciam a temperatura de ebulição e fusão de uma substância são o
tamanho e a geometria da molécula. A geometria de uma molécula interfere em sua força
intermolecular, quanto mais forte a ligação, mais elevado se tornará o ponto de ebulição. O
tamanho também julga, quanto maior um composto, maior sua massa molecular e
conseqüentemente, maior será seu ponto de ebulição.
Veja links relacionados: