QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
1. A comparação entre as proporções isotópicas de amostras de um mesmo material, que têm a mesma idade,
encontradas em diferentes regiões, pode ser utilizada para revelar se elas têm ou não a mesma origem. Se as
proporções são iguais, então é possível que tenham a mesma origem, mas se forem diferentes, é certeza que não
têm a mesma origem. A tabela a seguir apresenta os dados de algumas amostras de água, incluindo a de um cometa
no qual uma sonda pousou recentemente.
Ponto
de
ebulição (C)
Ponto
de
fusão (C)
Porcentagem
de deutério
H2O (Terra)
100
0
0,017
HDO
D2O
100,7
101,4
nd*
2,04
3,82
nd*
50
100
H2O (cometa)
*nd- não disponível
0,053
Com base nesses dados, pode-se afirmar corretamente que a água de nosso planeta
a) é proveniente dos cometas e a água da Terra e a do cometa têm propriedades físicas muito parecidas.
b) não é proveniente dos cometas, apesar de a água da Terra e a do cometa terem propriedades físicas muito
parecidas.
c) não é proveniente dos cometas, porque a água da Terra e a do cometa apresentam propriedades físicas muito
diferentes.
d) é proveniente dos cometas e a água da Terra e a do cometa têm as mesmas propriedades físicas.
2. São feitas as seguintes comparações sobre as capacidades caloríficas de diferentes substâncias puras, todas à
temperatura ambiente:
I. A capacidade calorífica da água é menor que a do peróxido de hidrogênio.
II. A capacidade calorífica do bromo é menor que a do tetracloreto de carbono.
III. A capacidade calorífica do metanol é menor que a do mercúrio.
Assinale a opção que apresenta a(s) comparação(ões) CORRETA(S).
a) Apenas I
b) Apenas I e II
c) Apenas II
d) Apenas II e III
e) Apenas III
3. Quando começaram a ser produzidos em larga escala, em meados do século XX, objetos de plástico eram
considerados substitutos de qualidade inferior para objetos feitos de outros materiais. Com o tempo, essa concepção
mudou bastante. Por exemplo, canecas eram feitas de folha de flandres, uma liga metálica, mas, hoje, também são
feitas de louça ou de plástico. Esses materiais podem apresentar vantagens e desvantagens para sua utilização em
canecas, como as listadas a seguir:
I. ter boa resistência a impactos, mas não poder ser levado diretamente ao fogo;
II. poder ser levado diretamente ao fogo, mas estar sujeito a corrosão;
III. apresentar pouca reatividade química, mas ter pouca resistência a impactos.
Os materiais utilizados na confecção de canecas os quais apresentam as propriedades I, II e III são,
respectivamente,
a) metal, plástico, louça.
b) metal, louça, plástico.
c) louça, metal, plástico.
d) plástico, louça, metal.
e) plástico, metal, louça.
4. Industrialmente é possível separar os componentes do ar, utilizando-se uma coluna de fracionamento. Com este
processo, obtêm-se gases como: oxigênio (O2), nitrogênio (N2) e argônio (Ar). Nesse processo o ar é comprimido e
se liquefaz; em seguida ele é expandido, volta ao estado gasoso e seus componentes se separam um a um.
A ordem de separação dos gases na coluna de fracionamento está baseada em qual propriedade da matéria?
a) Na densidade dos gases, ou seja, o menos denso separa-se primeiro.
b) Na pressão parcial dos gases, ou seja, o gás com menor pressão parcial separa-se primeiro.
c) Na capacidade térmica dos gases, ou seja, o gás que mais absorve calor separa-se primeiro.
d) Na condutividade térmica dos gases, ou seja, o gás que mais rápido absorve calor separa-se primeiro.
QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
e) Na temperatura de ebulição dos gases, ou seja, o gás com menor temperatura de ebulição separa-se primeiro.
5. Um aluno de ensino médio precisa partir um fio de cobre em dois e para isto ele dobra o fio várias vezes no
mesmo local até o seu rompimento. Assinale a alternativa que explica de forma correta o fenômeno observado.
a) O movimento executado pelo aluno provoca o deslocamento da nuvem eletrônica que envolve o núcleo, causando
forte repulsão nuclear e rompimento da ligação covalente.
b) O movimento executado pelo aluno provoca o deslocamento da nuvem eletrônica que envolve o núcleo, causando
forte repulsão nuclear e rompimento da ligação metálica.
c) O movimento executado pelo aluno gera uma corrente elétrica responsável pelo aquecimento do fio até sua fusão
e rompimento.
d) O movimento executado pelo aluno causa corrente elétrica responsável pelo aquecimento do fio até sua
vaporização e rompimento.
e) O movimento executado desloca os retículos cristalinos que geram alta repulsão iônica e fragmentação do fio.
6. O álcool etílico é usado na limpeza doméstica porque dissolve gorduras, é solúvel em água e é mais volátil do
que ela. Além disso, sua densidade é menor do que a da água. Essas propriedades são explicadas corretamente nas
alternativas abaixo, EXCETO em:
a) O etanol é solúvel em água porque forma ligações de hidrogênio com a mesma.
b) O etanol dissolve gorduras porque tem uma parte apolar em sua estrutura.
c) O etanol é mais volátil que a água porque suas ligações intermoleculares são mais fracas do que as da água.
d) O etanol é menos denso que a água porque sua temperatura de ebulição é menor do que a da água.
7. Diamante e grafite são sólidos covalentes, formados por um único tipo de elemento químico, o carbono, embora
apresentem propriedades distintas. Por exemplo, o diamante é duro, não é condutor elétrico, enquanto a grafite é
mole, apresenta condutividade elétrica, sendo, por isso, utilizada em fornos elétricos. As diferentes propriedades
evidenciadas nesses sólidos devem-se ao fato de
a) a ligação química ser mais forte no grafite.
b) o grafite apresentar moléculas mais organizadas.
c) o grafite possuir estrutura química diferente do diamante.
d) o grafite se apresentar na natureza constituído de moléculas discretas.
e) a quantidade de átomos em 1 mol das variedades alotrópicas do carbono ser diferente.
8. Um acidente comum ocorre com bastante frequência na cozinha. Uma panela com óleo quente para fritura é
esquecida sobre a chama de um fogão e, por um procedimento errado no momento da fritura, um pequeno incêndio
aparece na superfície do óleo. A boa prática de combate a incêndios recomenda que se desligue a chama do fogão e
se tampe a panela com um pano molhado.
a) Levando-se em conta que o fogo é um fenômeno em que está presente uma reação química, como se justifica o
uso do pano molhado, do ponto de vista químico?
b) Por outro lado, jogar água sobre a panela em chamas é uma prática totalmente desaconselhável. Descreva o que
pode ocorrer nesse caso e justifique, levando em conta transformações físicas e propriedades de estado.
9. Assinale a(s) alternativa(s) correta(s) com relação ao preenchimento da tabela abaixo, com respostas de acordo
com as colunas I, II, III e IV, respectivamente.
I
Substâncias
?
?
?
?
?
?
?
?
III
Conduz
corrente
elétrica no
estado
sólido?
?
?
?
?
?
?
?
Tipo de
ligação
II
Estado
físico a
25 C e
1atm
Iodo
Metano
Etanol
Platina
Cloreto
lítio
de
01) Iodo: iônica, líquido, não, não.
02) Metano: metálica, sólido, não, sim.
04) Etanol: covalente, líquido, não, não.
08) Platina: metálica, sólido, sim, não.
16) Cloreto de lítio: iônica, sólido, não, sim.
IV
Conduz
corrente
elétrica no
estado
líquido?
?
?
?
?
?
QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
10. Por descuido de um funcionário foram encontrados dois sólidos brancos sem rótulo na bancada de um depósito
de laboratório. Trata-se do nitrato de amônio (NH4NO3) e do carbonato de sódio (Na2CO3), substâncias usadas em
indústrias de fertilizantes. Assinale a informação que deve ser considerada para identificar corretamente essas
substâncias:
a) Propriedades organolépticas e o conhecimento de que o sódio (Na) é um metal alcalino.
b) Propriedades químicas, como a informação de que o vinagre é uma solução a 5% de ácido acético (H 3CCOOH).
c) Propriedades organolépticas e propriedades químicas que o levaram a concluir que carbonatos reagem com ácido,
produzindo efervescência.
d) Propriedades organolépticas, como o sabor ou o cheiro desses sais.
11. Em algumas extrações de ouro, sedimentos de fundo de rio e água são colocados em uma bateia, recipiente
cônico que se assemelha a um funil sem o buraco. Movimentos circulares da bateia permitem que o ouro metálico se
deposite sob o material sólido ali presente. Esse depósito, que contém principalmente ouro, é posto em contato com
mercúrio metálico; o amálgama formado é separado e aquecido com um maçarico, separando-se o ouro líquido do
mercúrio gasoso. Numa região próxima dali, o mercúrio gasoso se transforma em líquido e acaba indo para o leito
dos rios. Os três segmentos acima grifados se referem, respectivamente, às seguintes propriedades:
a) peso, temperatura de gaseificação e temperatura de liquefação.
b) densidade, temperatura de sublimação e temperatura de fusão.
c) peso, temperatura de ebulição e temperatura de fusão.
d) densidade, temperatura de ebulição e temperatura de liquefação.
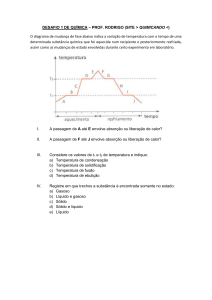
TEXTO PARA A PRÓXIMA QUESTÃO:
Na figura acima, são apresentadas duas curvas que relacionam o grau de seletividade de medicamentos com o
distúrbio cardiovascular e o distúrbio gastrintestinal.
12. Na tabela a seguir, são apresentadas informações contidas na bula de comprimidos sólidos de ibuprofeno.
cada comprimido contém
ibuprofeno
excipientes
300 mg
ácido cítrico, benzoato de sódio,
dióxido de titânio e amido
Assinale a opção que apresenta o gráfico que melhor representa a variação da temperatura em função do tempo
para um comprimido que tenha a composição mostrada na tabela e tenha sido macerado e aquecido.
a)
QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
b)
c)
d)
13. A solução de HCℓ em água é capaz de conduzir corrente elétrica, mas sua solução em benzeno não apresenta
condutividade.
Classifique a ligação interatômica presente na molécula de HCℓ e explique a diferença de condutividade elétrica entre
as duas soluções.
14.
Em um laboratório, foram encontrados dois frascos, I e II, cujas etiquetas apresentam informações dos
respectivos reagentes, conforme mostrado abaixo.
Com relação aos frascos, é correto afirmar-se que
a) por apresentarem as mesmas fórmulas moleculares, esses compostos devem ser considerados formas alotrópicas
da matéria.
b) a atomicidade de uma substância está relacionada à quantidade de átomos de um elemento presente no material,
assim a atomicidade do átomo de carbono, presente nestas substâncias simples, corresponde a 4.
c) se fosse feita uma avaliação das propriedades organolépticas destas substâncias, poderíamos, com toda a
convicção, proceder à identificação desses compostos.
d) se soubéssemos o volume ocupado por cada composto nos respectivos recipientes e a quantidade de massa
contida em cada recipiente, seria possível determinarmos as densidades específicas, que é uma propriedade
específica química destes materiais.
e) o que nos garante que estes materiais são realmente diferentes é a propriedade física, o ponto de ebulição
exposta no rótulo dos recipientes.
15. Em uma aula experimental de química, um grupo de alunos recebeu de seu professor três amostras de sólidos
brancos, não identificados, finamente pulverizados. O professor pediu aos alunos que descobrissem qual desses
compostos era o óxido de zinco (ZnO), qual era o cloreto de sódio (NaCℓ) e qual era o açúcar (C12H22O11). Após
alguns testes, os alunos observaram os resultados mostrados na tabela abaixo.
QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
Composto
A
B
C
Teste de fusão de até
200 ºC
Permanece sólido
Permanece sólido
Não
apresentou
condutividade
Não
apresentou
condutividade
Muda de estado:
sólido para líquido
solúvel
Praticamente insolúvel
Apresentou
condutividade
_____________
Teste de condução de
corrente elétrica no
sólido
Teste de solubilidade
na água
Não apresentou
condutividade
solúvel
Não apresentou
condutividade
Teste de condução de
energia elétrica em
solução aquosa
Sobre os testes realizados e a identificação dos compostos, assinale a alternativa correta.
a) O cloreto de sódio e o açúcar são os compostos que permanecem sólidos no teste de fusão.
b) O composto A é o cloreto de sódio, o B é o óxido de zinco e o C é o açúcar.
c) O cloreto de sódio é insolúvel em água.
d) O açúcar conduz corrente elétrica em solução aquosa.
16. Observe as representações a seguir e assinale a alternativa correta.
a) As figuras mostram substâncias que possuem as mesmas propriedades físicas e químicas.
b) As figuras representam formas alotrópicas do carbono, sendo que a estrutura dos fulerenos acima pode ser
comparada a uma bola de futebol.
c) As representações indicam que a ligação química entre os átomos de carbono − presentes nos fulerenos,
diamante e grafite − é do tipo iônica.
d) As substâncias representadas nas figuras podem ser classificadas como compostas, pois, por reações químicas,
formam outras mais simples.
17. Para aquecer sua casa de forma sustentável, Sr. João aproveitou o calor produzido pela decomposição do lixo,
como mostra a figura a seguir.
Para detalhar esse processo, assinale a alternativa cujas palavras completam, correta e respectivamente, o texto a
seguir.
O ar frio que está mais próximo do piso é _________ do que o ar quente, e entra pela abertura (1) do cano,
seguindo para a serpentina (S) onde recebe o calor do lixo. O ar aquecido se torna _________ e sobe até a saída (2)
do cano, por onde entra na casa.
QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
a) menos volátil ... mais denso
b) mais denso ... menos volátil
c) mais condutor ... menos condutor
d) mais denso ... menos denso
e) mais volátil ... menos volátil
18. Fabricantes de pigmentos para tatuagens deverão brevemente obter registro de seus produtos junto aos órgãos
oficiais. A preocupação com as normas para essas tintas decorre do fato de muitos pigmentos apresentarem
derivados de metais pesados, o que pode provocar efeitos adversos à saúde.
Atualmente, pode ser encontrado HgS no pigmento vermelho, PbCrO 4 no amarelo e Cr2O3 no verde.
Assinale a propriedade compartilhada pelos metais Hg (mercúrio), Pb (chumbo) e Cr (cromo).
a) Apresentam altos valores de potenciais de ionização.
b) Têm seus elétrons distribuídos em um mesmo número de camadas eletrônicas.
c) Reagem vigorosamente com a água, formando óxidos.
d) Apresentam elevados valores de eletronegatividade.
e) Podem apresentar mais de um estado de oxidação.
19. Pirita (FeS2) é um mineral conhecido como “ouro dos tolos” por ser amarelo e apresentar brilho metálico
semelhante ao do ouro (Au), embora não seja um metal. Entretanto, é possível saber facilmente se uma amostra é de
ouro puro ou é de pirita. Para isso, basta
I. determinar a massa;
II. testar a condutibilidade elétrica;
III. medir o volume.
É correto o que se afirma em
a) I, apenas.
b) II, apenas.
c) III, apenas.
d) I e II, apenas.
e) I, II e III.
20. As propriedades físicas utilizadas na identificação e determinação da pureza de um sólido desconhecido são
a) densidade e cor.
b) solubilidade e massa.
c) temperatura de fusão e densidade.
d) temperatura de ebulição e volume.
QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
Gabarito:
Resposta
[B]
da
questão
1:
A água de nosso planeta não é proveniente dos cometas, pois a porcentagem de deutério na água presente no
cometa é de 0,053%, ou seja, menor do que a porcentagem de deutério presente na água do planeta Terra que é de
0,017%.
Resposta
[B]
da
questão
2:
Definição de capacidade calorífica molar (Cm ) : quantidade de calor fornecida à um mol da substância para que sua
temperatura seja elevada em 1 K.
A capacidade calorífica molar depende das interações intermoleculares das substâncias, ou seja, quanto maior a
atração intermolecular, maior a capacidade calorífica molar.
Análise das opções:
[I] Correta. A capacidade calorífica molar da água é menor que a do peróxido de hidrogênio, pois este apresenta
maior atração intermolecular (pontes de hidrogênio).
[II] Correta. A capacidade calorífica molar do bromo é menor que a do tetracloreto de carbono, pois as forças
intermoleculares no tetracloreto de carbono são mais acentuadas (dipolo induzido).
[III] Incorreta. A capacidade calorífica molar do metanol é maior que a do mercúrio, pois as forças intermoleculares
presentes no metanol são maiores.
Resposta
[E]
da
questão
3:
O plástico (termoplástico) tem boa resistência a impactos, mas não poder ser levado diretamente ao fogo, pois pode
sofrer fusão.
O metal pode ser levado diretamente ao fogo, mas está sujeito a corrosão.
A louça (material cerâmico) apresenta pouca reatividade química, mas ter pouca resistência a impactos.
Resposta
[E]
da
questão
4:
A ordem de separação dos gases na coluna de fracionamento está baseada na temperatura de ebulição dos gases,
ou seja, o gás com menor temperatura de ebulição (aquele que apresenta menores forças intermoleculares) separase primeiro.
Resposta
[B]
da
questão
5:
O movimento executado pelo aluno provoca o deslocamento da nuvem eletrônica que envolve o núcleo, causando
forte repulsão nuclear e rompimento da ligação metálica.
O retículo cristalino dos sólidos metálicos é formado por cátions e elétrons deslocalizados (livres) entre eles.
Esse tipo de ligação entre cátions presos no retículo e elétrons livres é chamado de ligação metálica.
Elétrons deslocalizados num metal dão origem à condutividade elétrica e térmica.
Resposta
[D]
da
questão
6:
A densidade e temperatura de ebulição, apesar de serem propriedades específicas das substâncias, não apresentam
relação alguma.
Resposta
[C]
da
questão
7:
As diferentes propriedades evidenciadas nesses sólidos devem-se ao fato de o grafite possuir estrutura química
diferente do diamante, ou seja, serem alótropos.
QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
Resposta
da
questão
8:
a) Do ponto de vista químico, o pano molhado limita a quantidade de oxigênio (presente no ar) que pode reagir
com o óleo. Além disso, o fato do pano estar molhado dificulta sua queima, pois a água presente no pano absorve
calor e muda de estado de agregação; com isso, o pano demora a entrar em combustão.
b) Se a água for jogada diretamente sobre o óleo ocorrerá a seguinte transformação física:
H2O( ) calor H2O(v)
Consequentemente o vapor de água sofrerá expansão e poderá lançar o óleo fervente à distância causando
queimaduras em quem estiver por perto. O incêndio não poderá ser evitado sem acidentes.
Resposta
04 + 16 = 20.
da
questão
9:
Teremos:
I
Substâncias
Tipo de
ligação
II
Estado
físico a
25 C e
1atm
Iodo
Metano
Etanol
Platina
Cloreto de lítio
Resposta
[C]
covalente
covalente
covalente
metálica
iônica
sólido
gasoso
líquido
sólido
sólido
III
Conduz
corrente
elétrica no
estado
sólido?
não
não
não
sim
não
da
IV
Conduz
corrente
elétrica no
estado
líquido?
não
não
não
sim
sim
questão
10:
Propriedades organolépticas são aquelas que impressionam nossos sentidos, como o olfato. A efervescência ocorre
devido à liberação de gás carbônico.
QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
Resposta
[D]
da
questão
11:
Movimentos circulares da bateia permitem que o ouro metálico se deposite sob o material sólido: densidade (o
material mais denso se deposita no fundo).
O amálgama formado é separado e aquecido com um maçarico, separando-se o ouro líquido do mercúrio gasoso:
temperatura de ebulição (mudança do estado líquido para gasoso).
O mercúrio gasoso se transforma em líquido e acaba indo para o leito dos rios: temperatura de liquefação (mudança
do estado gasoso para o líquido).
Resposta
[C]
da
questão
12:
Resposta
da
questão
A ligação interatômica presente na molécula de HCℓ é do tipo covalente:
H – Cℓ
Em água, o HCℓ sofre ionização:
+
HCℓ H + Cℓ
+
Os íons H e Cℓ conduzem a corrente elétrica.
13:
Teremos:
A temperatura aumenta com o tempo (aquecimento de mistura sólida).
Em benzeno, o HCℓ não se ioniza, portanto não forma espécies condutoras de eletricidade.
Resposta
[E]
da
questão
14:
As propriedades físicas, como ponto de fusão, ponto de ebulição, densidade, etc., permitem a diferenciação das
substâncias contidas nos frascos, já que as moléculas das substâncias são isômeras.
Resposta
[B]
da
questão
15:
Alternativa [A] está incorreta. O cloreto de sódio e o óxido de zinco permanecem sólidos no teste de fusão. Por serem
compostos iônicos, apresentam altas temperaturas de fusão, portanto permanecem sólidos em temperaturas até
200°C. O açúcar é um composto molecular, por isso apresenta temperatura de fusão menor que composto iônicos e
funde a menos que 200°C.
Alternativa [B] está correta, pois de acordo com a análise da tabela, os resultados apresentados são coerentes com
os compostos testados. O cloreto de sódio é um sal solúvel em água. Por ser um composto iônico, apresenta alta
temperatura de fusão e condutividade elétrica quando dissolvido, mas não no estado sólido. O óxido de zinco é
praticamente insolúvel em água, já que os óxidos metálicos solúveis são os dos metais alcalinos e alcalinos terrosos,
não sendo, portanto, o caso do zinco. É também um composto iônico, por isso apresenta alta temperatura de fusão e
não conduz corrente elétrica no estado sólido. Por ser considerado insolúvel, não há como fazer o teste de
condutividade. O açúcar é um composto molecular, que por isso apresenta baixa temperatura de fusão. É solúvel em
água. Não conduz corrente elétrica no estado sólido e nem no estado dissolvido, pois não sofre ionização, ou seja,
não gera íons em solução.
Alternativa [C] está incorreta, pois o cloreto de sódio é solúvel em água, assim como a maioria dos cloretos.
Alternativa [D] está incorreta, já que o açúcar é um composto molecular que não sofre ionização, ou seja, não é
capaz de gerar íons em solução. Dessa forma, não conduz corrente elétrica em solução aquosa.
Resposta
[B]
da
questão
16:
QUESTÕES PARA ESTUDO - PROPRIEDADES DOS MATERIAIS
As figuras representam formas alotrópicas do carbono, sendo que a estrutura dos fulerenos acima pode ser
comparada a uma bola de futebol.
Resposta
[D]
da
questão
17:
A densidade de um gás pode ser dada por:
d
PM
, onde
RT
P = pressão
M = massa molar
R = constante universal dos gases
T = temperatura
Consequentemente, se a temperatura é menor (ar frio) a densidade é maior e vice-versa.
Resposta
[E]
da
questão
18:
A propriedade compartilhada pelos metais Hg (mercúrio), Pb (chumbo) e Cr (cromo) é que podem apresentar mais de
2+
2+
2+
4+
2+
3+
um estado de oxidação: Hg , [Hg2] ; Pb , Pb ; Cr , Cr .
Resposta
[B]
da
questão
19:
questão
20:
Devemos testar a condutibilidade elétrica.
Resposta
[C]
da
As propriedades físicas utilizadas na identificação e determinação da pureza de um sólido desconhecido são
temperatura de fusão e densidade.