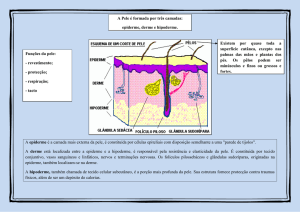
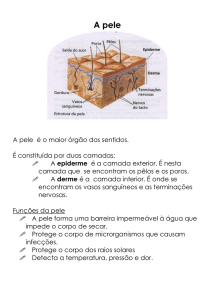
RESUMO
19ªEXPANDIDO
RAIB
174/010 239
CARACTERIZAÇÃO HISTOLÓGICA DA PELE DA RÃ-TOURO (RANA CATESBEIANA, SHAW 1802)
D.S. Ferreira, P.E.A. Júnior, C.S. Maia, W.E. Silva, D.F. França,
E.F. Moraes, V. Wanderley-Teixeira, A.A.C. Teixeira
Universidade Federal Rural de Pernambuco, Departamento de Morfologia e Fisiologia Animal, Laboratório de
Histologia, CP 23, CEP 52171-900, Recife, PE, Brasil. E-mail: [email protected]
RESUMO
A Rana catesbeiana (Shaw 1802) é um anfíbio anuro de grande importância comercial.
Conhecida vulgarmente por rã-touro é usada em larga escala por ranicultores por se
adaptar muito bem as condições de cativeiro. Sua pele vem sendo utilizada comercialmente para produção de objetos e em pesquisas que revelam sua utilidade como curativo
biológico para queimados, além de ser fonte de colágeno, sendo muito utilizada no setor
de cosmético. Apesar da diversificada utilização de sua pele existem poucos relatos
sobre a sua histologia. Objetivou-se caracterizar histologicamente a pele da rã-touro (R.
catesbeiana). Foram utilizadas peles de fêmeas e machos de rã-touro, provenientes do
LAFAQ (Laboratório de Fisioecologia Aquática) do Departamento de Pesca da Universidade Federal Rural de Pernambuco (UFRPE), onde foi realizado o abate e a retirada da
pele desses animais. Fragmentos de pele foram imediatamente mergulhados em líquido
de Bouin, permanecendo no mesmo por 48h, onde foram levados ao Laboratório da Área
de Histologia da UFRPE para processamento. Os resultados mostraram que na pele da
R. catesbeiana, a epiderme é estratificada e pouco queratinizada seguindo as características gerais descritas para os anfíbios, enquanto que a derme é constituída por grande
quantidade de fibras colágenas grossas e paralelas, poucas fibras elásticas, várias glândulas pluricelulares alveolares bem desenvolvidas, cromatóforos do tipo melanóforos e
ausência de fibras musculares.
PALAVRAS-CHAVE: Rana catesbeiana, pele, histologia, anfíbio.
ABSTRACT
HISTOLOGICAL CHARACTERIZATION OF THE SKIN OF THE BULLFROG (RANA
CATESBEIANA, SHAW 1802). The Rana catesbeiana (Shaw 1802) it is an anuran
amphibious of great commercial importance. Known commonly as the bullfrog, it is
used in wide scale on frog farms since it adapts very well to conditions of captivity. Its
skin has been used commercially for production of objects, and research studies have
revealed its usefulness as a biological curative for burns, besides being a source of
collagen, very much used in the area of cosmetics. Despite the diversified use of its skin,
there have been few reports concerning its histology. Therefore, the present study was
aimed to characterize the histology of bullfrog (R. catesbeiana) skin. Skins of female and
male bullfrogs were used, obtained from the LAFAQ (Aquatic Physioecology Laboratory)
Fishing Department of UFRPE, where the frogs were sacrificed and their skins removed.
Fragments of skin were immediately immersed in Bouin liquid stain for 48 hours, and
then taken the Histology Laboratory of the same university for histologic processing.
The results showed that in R. catesbeiana skin the epidermis is stratified and a little
keratinized in regard to the general characteristics described for the amphibians, while
the dermis it is constituted by a large quantity of thick and parallel collagen fibers, few
elastic fibers, various well-developed multicellular alveolar glands, chromatophores of
the melanophores type, and the absence of muscular fibers.
KEY WORDS: Rana catesbeiana, skin, histology, amphibian.
Biológico, São Paulo, v.68, Suplemento, p.239-243, 2006
240
19ª RAIB
INTRODUÇÃO
A rã como a maioria das espécies de anfíbios apresenta grande variedade de substâncias químicas no
muco secretado pelas glândulas epidérmicas, as quais
vêm sendo estudadas pela indústria farmacêutica para
a fabricação de antibióticos e outros medicamentos,
constituindo-se num novo campo de estudo da farmacologia (CLARK et al., 1994; MOR et al.,1994; FEIO, 1997).
Em muitos aspectos, a biologia dos anfíbios é determinada pelas propriedades da sua pele. A estrutura e
a função da pele podem ser características primárias
que modelaram a evolução e a ecologia dos anfíbios e
podem também ser responsáveis por alguns aspectos
de sua suscetibilidade à poluição (POUGH et al., 1999).
A Rana catesbeiana (Shaw 1802) é originária do continente norte-americano e de locais da América Central, como os sopés rochosos e também de algumas
regiões do Canadá. É uma espécie de grande porte,
atingindo cerca de 43 cm de comprimento e podendo
chegar a 2,5 kg (LONGO, 1987). A rã-touro, assim como
todos os anfíbios, é um animal ectotérmico, ou seja,
seu metabolismo está inteiramente dependente da
temperatura ambiente (BRAGA & LIMA, 2001).
Diferentemente de outros vertebrados, a pele das
rãs prende-se ao corpo apenas ao longo de determinadas linhas. Sua flexibilidade e superfície coberta de
muco permitem que a rã escape de um predador (STORER
et al., 1995). Sua cor pode variar de acordo com o ambiente ou também com fatores internos, mas em geral é
esverdeada ou parda na região dorsal e a região ventral apresenta-se branca, ou esbranquiçada com tonalidades mais ou menos amareladas e com manchas
escuras, sua cabeça é mais clara e às vezes esverdeada,
os membros são mais escuros, sendo que os anteriores
apresentam manchas pardo-escuras e os traseiros, com
linhas ou faixas também escuras (VIEIRA, 1979).
A criação de rãs é uma atividade em fase emergente
e em franco crescimento no Brasil (LIMA et al., 1999). A
pele, por exemplo, constitui 11% do peso vivo do animal e quando curtida é empregada como matéria prima na produção de inúmeros objetos, como cintos,
pulseiras, ornamentos do vestuário, bijuterias, carteiras, bolsas, sapatos e luvas. Pode ainda ser empregada
em encadernações, revestimento de porta-jóias e outras embalagens industriais requintadas (LIMA et al.,
1999). Além disso, é fonte de colágeno, constituinte do
tecido conjuntivo de largo emprego no setor de cosméticos e queratina, sendo utilizada ainda como um tecido regenerativo extraordinário, de grande utilidade no
tratamento de queimados, pois devido ao fato de ser
translúcida, permite a passagem da luz, fundamental
para a cicatrização da lesão (VELLY, 2001).
Apesar de sua grande importância, existe uma
escassez de literatura sobre a histologia da pele da R.
catesbeiana. Objetivou-se analisar, por meio da
microscopia de luz, os aspectos histológicos da pele
de rãs-touro adultas, utilizando colorações de rotina
(Hematoxilina-Eosina) e especiais (Tricrômico de
Mallory, Resorcina Fucsina Weigert e PAS-Ácido Periódico de Schiff).
MATERIAL E MÉTODOS
O experimento foi realizado no Laboratório da Área
de Histologia do Departamento de Morfologia e Fisiologia Animal da Universidade Federal Rural de
Pernambuco (UFRPE). Foram utilizadas peles de fêmeas e machos de rãs-touro (R. catesbeiana), provenientes do LAFAQ (Laboratório de Fisioecologia Aquática) do Departamento de Pesca da UFRPE, onde foi
realizado o abate e a retirada da pele dos animais.
Para o abate foi realizada a insensibilização das rãs
através de choque térmico com conseqüente paralisação e anestesia dos animais. Para o choque térmico
foi utilizado um balde de 5 L contendo bastante gelo e
um litro de água gelada e após um período de 10min
foi feita a decapitação. A pele foi removida realizando-se um corte superficial na região abdominal no
sentido cloaca-cabeça, e com auxílio dos dedos polegares e indicadores a pele ao redor do pescoço foi
solta, puxando-a inteira, no sentido cabeça-cloaca
seccionando-a na altura do ânus, obtendo-se a pele
inteira em forma de macacão. As peles foram imediatamente mergulhadas em líquido de Bouin e processadas para inclusão em parafina. A seguir os blocos
foram cortados em micrótomo do tipo Minot ajustados para 5 μm. Os cortes foram colocados em lâminas
previamente untadas com albumina de Mayer e mantidos em estufa regulada à temperatura de 37° C durante 24h para secagem. Após esses procedimentos,
os cortes foram submetidos às técnicas de colorações
por H.E. (hematoxilina-eosina), Tricrômico de
Mallory, Resorcina Fucsina Weigert e PAS. As lâminas foram analisadas em microscópio de luz e fotografados em fotomicroscópio.
RESULTADOS E DISCUSSÃO
Descrição histológica da pele de machos de rãtouro
A epiderme da região dorsal da rã-touro é revestida
por tecido epitelial estratificado pouco queratinizado.
Na derme papilar distingue-se o estrato esponjoso,
constituído por tecido conjuntivo frouxo, enquanto
que na região reticular observa-se o estrato compacto,
constituído por tecido conjuntivo denso modelado.
Na epiderme observa-se no epitélio estratificado
pavimentoso uma fina camada de queratina consti-
Biológico, São Paulo, v.68, Suplemento, p.239-243, 2006
19ª RAIB
tuindo o estrato córneo. Abaixo, no estrato esponjoso
da derme, nota-se a presença de glândulas alveolares
bem desenvolvidas, vasos e cromatóforos que se encontram circundados por tecido conjuntivo frouxo
(Fig. 1). Limitando a epiderme da derme, nota-se a
lâmina basal que em algumas regiões aparecem coberta por uma densa camada de cromatóforos da
derme subjacente (Fig. 2). Histologicamente, a
epiderme da região ventral apresentou-se semelhante à região dorsal, porém, o epitélio é mais espesso
podendo-se observar nitidamente o estrato intermediário que é constituído por células com morfologia
poligonais e logo abaixo o estrato germinativo constituído por células cúbicas. A derme também é constituída pelos estratos esponjoso e compacto, onde encontramos vasos sanguíneos, glândulas também bem
desenvolvidas e ausência de cromatóforos (Fig. 3). A
análise histoquímica revelou na derme a presença de
fibras elásticas (Fig. 4) e grande quantidade de fibras
colágenas, sendo esta última com maior predominância, principalmente, na região do estrato compacto,
apresentando-se grossas e paralelas (Fig. 5). A técnica do P.A.S. não revelou a presença de fibras musculares na derme (Fig. 2).
Fig. 1 - Pele da região dorsal da rã-touro macho. Observar epitélio estratificado pavimentoso (seta) acima o estrato córneo (EC); Estrato esponjoso (EE) com a presença
de glândulas alveolares (GL), cromatóforos (C) e tecido
conjuntivo frouxo (TC). Coloração H.E. ± 428x.
Fig. 2 - Pele da região dorsal da rã-touro macho. Observar lâmina basal (seta) e ausência de fibras musculares na
derme. Coloração PAS. ± 428x.
Fig. 3 - Pele da região ventral da rã-touro macho. Notar
presença de glândulas (GL) e vaso (V). Coloração H.E. ±
428x.
Fig. 4 - Pele da região dorsal da rã-touro macho. Observar fibras elásticas (setas) no estrato esponjoso. Coloração Fucsina-Resorcina de Weigert contra-corado pelo
método de Van Gienson ± 428x.
Biológico, São Paulo, v.68, Suplemento, p.239-243, 2006
241
242
19ª RAIB
Fig. 5 - Pele da região dorsal da rã-touro macho. Notar
estrato compacto (EC) preenchido por fibras colágenas.
Coloração Tricrômico de Mallory. ± 107x.
Descrição histológica da pele de fêmeas de rã-touro
Na epiderme também se observou o epitélio
estratificado pavimentoso pouco queratinizado formando o estrato córneo e a derme com seus estratos
esponjoso e compacto nas regiões dorsal e ventral.
No entanto, a análise morfológica revelou que a
epiderme, na região dorsal mostrou-se mais espessa
em relação à epiderme dorsal do macho. Abaixo desta, notamos o estrato esponjoso da derme, com presença de glândulas alveolares, vasos e cromatóforos
(Fig. 6). Na região ventral a ausência de cromatóforos
se confirmou da mesma forma que nos machos. As
colorações pelos Tricrômicos de Malorry e pelo P.A.S.
revelaram as mesmas características observadas na
pele dos machos.
A epiderme da rã-touro é estratificada como observada em todos os vertebrados, porém pouco
queratinizada. Segundo GEORGE et al. (1998), os anfíbios apresentam essa modificação no tegumento como
forma adaptativa à vida terrestre.
Com relação à epiderme da fêmea ter se mostrado mais espessa na região dorsal pode estar relacionada a muda, pois de acordo com STORER et al.
(1995) periodicamente a epiderme sofre um processo de renovação, onde se forma uma nova camada abaixo da existente. Esta muda está intimamente relacionada aos níveis do hormônio
tireoidiano que induz a atividade mitótica na camada germinativa.
De acordo com F ARQUHAR & P ALADE (1965),
HILDEBRAND (1995) e GEORGE et al. (1998) a derme
dos anfíbios é constituída por duas camadas bem
Fig. 6 - Pele da região dorsal da rã-touro fêmea. Notar
epitélio espesso (E) e estrato esponjoso (EE) com glândulas (GL), vaso (V) e cromatóforos (setas). Coloração H.E. ±
428x.
distintas, os estratos esponjoso e compacto, ambos
constituídos por tecido conjuntivo onde se observou glândulas, vasos e cromatóforos. A derme de R.
catesbeiana apresenta-se com uma intensa predominância de fibras colágenas que foram observadas
através das colorações pelos Tricromicos de
Mallory, além de algumas fibras elásticas comprovado pela coloração da fucsina-resorcina de
Weigter. No entanto, os dois últimos autores relatam a presença de fibras musculares, o que não foi
observado para a espécie estudada.
MORANDINI (1976) e GEORGe et al. (1998) afirmaram
que são encontradas glâdulas acinosas de dois tipos, mucosas e serosas, as quais têm origem da camada germinativa da epiderme. STORER et al. (1998) e
POUGH et al. (1999) relataram que os anfíbios possuem glândulas mucosas por toda a superfície do corpo, produzindo um fluido aquoso que mantém a pele
úmida, essencial para a respiração cutânea e escorregadia, servindo de proteção contra predação. As
glândulas serosas são mais escassas, porém maiores, produzem uma proteção espessa, esbranquiçada,
granulosa e alcalóide, constituindo as glândulas do
veneno.
Os cromatóforos são responsáveis pela coloração da pele dos anfíbios. Segundo STORER et al.
(1998), em R. pipiens e em outras rãs podem ser encontrados 3 tipos de cromatóforos: os xantóforos
que tem um tom amarelado, os iridóforos com
organelas que refletem luz e os melanóforos compostos por pigmentos de melanina. Na região
dorsal da pele de R. catesbeiana observou-se apenas
melanóforos.
Biológico, São Paulo, v.68, Suplemento, p.239-243, 2006
19ª RAIB
CONCLUSÃO
Histologicamente a epiderme de R. catesbeiana é
estratificada e pouco queratinizada seguindo as características gerais descritas para os anfíbios, enquanto a derme é constituída por grande quantidade de
fibras colágenas grossas e paralelas, poucas fibras
elásticas e ausência de fibras musculares, além de
cromatóforos do tipo melanóforos.
REFERENCIAS
BRAGA, L.G.T. & LIMA, S.L. Influência da Temperatura
Ambiente no Desempenho da Rã-touro, Rana
catesbeiana (Shaw, 1802) na Fase de Recria. Revista Brasileira de Zootecnia, v.30, n.6, p.1659-1663,
2001.
CLARK, D.P.; DURELL, S.; MALOY, W.L.; ZASLOFF, M.
Ranalexin, a novel antimicrobial peptide from
bullfrog (Rana catesbeiana) skin, structurally related
to the bacterial antibiotic, polymyxin. The Journal
of Biological Chemstry, v.269, n.14, p.10849-10855,
1994.
FARQUHAR, M.G. & PALADE, G.E. Cell junctions in
amphibian skin. The Journal of Cell Biology, v.6,
p.263-291, 1965.
FEIO, R.N. Diversidade de anfíbios no Brasil. In: ENCONTRO NACIONAL DE RANICULTURA, 9.;
INTERNATIONAL MEETING ON FROG
RESEARCH AND TECHNOLOGY, 2., 1997, Santos. Anais. Santos, 1997. p.67-74.
GEORGE, L.L.; ALVES, C.E.R.; CASTRO R.R.L. Histologia
comparada. 2.ed. São Paulo: Roca, 1998. p.258-260.
HILDEBRAND, M. Analise da estrutura dos vertebrados. 2.ed.
São Paulo: Atheneu, 1995. p. 235-236.
LIMA, S.L; CRUZ, T.A.; MOURA, M.O. Ranicultura: análise
da cadeia produtiva. Viçosa: Folha de Viçosa, 1999.
220p.
LONGO, A.D. Manual de ranicultura: uma nova opção da
pecuária. São Paulo: Ícone, 1987. p.33.
MOR, A.; KHALED, H.; NICOLAS, P. The vertebrate peptide
antibiotics dermaseptins have overlapping
structural features but target specific
microorganisms. The Journal of Biological Chemistry,
v.269, n.50, p.31635-31641, 1994.
M ORANDINI, C. Zoologia. São Paulo: Nobel, 1976.
p.235.
POUGH, F.H.; JANIS C.M. ; HEISER E.J.B. A vida dos vertebrados. 2.ed. São Paulo: Atheneu, 1999. p.353-354.
STORER, T.I.; USINGER, R L.; STEBBINS, R.C.; NYBAKKEN,
J.W. Zoologia geral. 6.ed. São Paulo: Nacional, 1995.
p.618-623.
VELLY, M.D.L. M. A pele animal e os comportamentos
mercadológicos para o novo milênio. Boletim Técnico Instituto de Pesca, n.31, p.26-28, 2001.
VIEIRA, M.I. Produção comercial de rãs. 6.ed. São Paulo:
Nobel, 1979. 182p.
Biológico, São Paulo, v.68, Suplemento, p.239-243, 2006
243