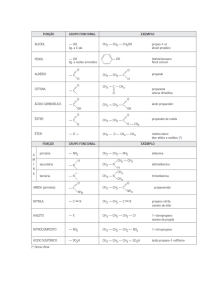
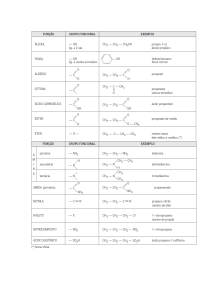
ISOMERIA
I – DEFINIÇÃO:
Compostos que apresentam a mesma fórmula molecular (portanto a mesma
massa molar), mas que apresentam fórmulas estruturais (planas e/ou espaciais)
diferentes.
Exemplo: com a fórmula molecular C2H6O poderemos ter dois compostos
diferentes: CH3-O-CH3 e CH3-CH2-OH
II – TIPOS DE ISOMERIA:
II.a) PLANA: Quando diferenciamos os compostos através da fórmula plana
(sem se preocupar com os ângulos verdadeiros)
II.b) ESPACIAL (ESTEREOISOMERIA): Quando os compostos são
diferenciáveis somente pela fórmula estrutural espacial.
III – ISOMERIA PLANA (ESTRUTURAL ou ESTRUTURAL PLANAR): Se
reclassifica em:
III.a) Entre compostos de mesma função
- CADEIA
- POSIÇÃO
- COMPENSAÇÃO (OU METAMERIA)
III.b) Entre compostos de diferentes funções
- FUNCIONAL
- TAUTOMERIA
1) Isomeria de Cadeia: ocorre entre compostos de mesma fórmula
molecular, mesma função, mas com diferenciação na cadeia carbônica, variando os
graus de ramificação e/ou saturação e/ou ciclização e/ou heterogenicidade.
Exemplos:
Fórmula Molecular
Composto 1
Composto 2
C4H10
n-butano
- grau de
ramificação
metil-propano
- grau de ciclização
e saturação
C3H6
propeno
C2H7N
Diferenciação
NH2
ciclopropano
H
N
etil-amina
- grau de
heterogenicidade
dimetil-amina
C5H12
- grau de
ramificação
metil-butano
dimetil-propano
2) Isomeria de Posição: ocorre entre compostos de mesma fórmula
molecular, mesma função, mesma cadeia carbônica, variando a posição de radicais
(orgânicos ou grupos funcionais) e insaturações.
Exemplos:
Fórmula Molecular
Composto 1
Composto 2
Diferenciação
OH
C3H8O
OH
propan-1-ol
propan-2-ol
- posição do grupo
funcional
- posição da
insaturação.
C4H8
but-1-eno
but-2-eno
CH3 O
O
C5H10O2
OH
OH
- posição do
radical orgânico.
ác. 3-metil-butanóico
CH3
ác. 2-metil-butanóico
- posição de união
do último núcleo
aromático.
C14H10
antraceno
fenantreno
OH
C3H6O
OH
prop-1-en-1-ol
prop-1-en-2-ol
- posição do grupo
funcional
mantendo a função
orgânica
3) Isomeria de Compensação (Metameria): ocorre entre compostos de
mesma fórmula molecular, mesma função e mesma cadeia, variando
exclusivamente o posicionamento de heteroátomos.
Exemplos:
Fórmula Molecular
C4H11N
Composto 1
H
N
Composto 2
metil-n-propil-amina
dietil-amina
N
H
O
C4H10O
O
etóxi-etano
éter etílico
1-metóxi-propano
éter metil-n-propílico
O
O
C4H8O2
O
O
propanoato de metila
etanoato de etila
O
O
C4H9NO
N
H
N-metil-propanamida
N
H
N-etil-etanamida
Diferenciação
- variação da
posição do
heteroátomo N
- variação da
posição do
heteroátomo O
- variação da
posição do
heteroátomo O em
relação aos demais
carbonos da cadeia
- variação da
posição do
heteroátomo N em
relação aos demais
carbonos da cadeia
4) Isomeria Funcional: ocorre entre compostos de mesma fórmula
molecular, mas pertencentes a diferentes funções, que não permanecem em
equilíbrio dinâmico entre si.
Exemplos
Fórmula Molecular
Composto 1
Composto 2
O
OH
C2H6O
etanol
O
metóxi-metano
O
C3H6O
H
propanal
propanona
O
O
C3H6O2
OH
ác. propanóico
O
etanoato de metila
OH
OH
C3H6O
prop-2-en-1-ol
prop-1-en-2-ol
CH 2-OH
OH
CH3
C7H8O
fenil-metanol
o-hidróxi-tolueno
5) Tautomeria (isomeria dinâmica): isomeria que ocorre entre compostos de
diferentes funções, mas que permanecem em equilíbrio dinâmico entre si.
Exemplos:
TIPO DE TAUTOMERIA
EQUILIBRIO DINÂMICO
H
H
O
OH
Aldo-enólica
H
prop-2-en-1-ol
H
propanal
OH
O
prop-1-en-2-ol
propanona
Ceto-enólica
O
Amida-iminol
OH
NH2
etanamida
N
Nitrilo-isonitrilo
cianeto de metila
NH
2-hidróxi-etilideno-imina
N
isocianeto de metila
IV – ISOMERIA ESPACIAL (ESTEREOISOMERIA)
a) Definição: isomeria onde os compostos são possíveis de serem
diferenciados apenas pela fórmula estrutural espacial.
b) Tipos: a isomeria espacial se divide em dois tipos:
b.1) Geométrica (ou CIS/TRANS)
b.2) Óptica
1) ISOMERIA GEOMÉTRICA: Ocorre com compostos que obedecem a uma das
condições a seguir:
a) Compostos com dupla e ligantes diferentes em cada carbono da dupla:
L1
L3
L2
L4
Onde L1L2 e L3L4
Como são denominados os isômeros geométricos?
Tais isômeros podem ser denominados por cis e trans ou por Z e E.
Critério cis-trans
1. Analise a repetibilidade de ligantes dos carbonos unidos pela dupla. Se
estiverem no mesmo semi-espaço (lado), será denominado de CIS. Se
estiverem em lados opostos, será denominado de TRANS.
2. Se não houver repetibilidade, verifique qual é o maior ligante (em
número de átomos). Se os maiores ligantes estiverem do mesmo lado,
será denominado de CIS. Caso o número de átomos seja igual, será
usada como critério de desempate a massa molar do radical.
Critério Z/E
1. Verifique qual é o maior ÁTOMO ligante de cada carbono da dupla (em
massa atômica). Se os átomos escolhidos de cada carbono estiverem no
mesmo semi-espaço, será denominado de isômero Z (zuzamen = ao
lado, em alemão); se estiverem em semi-espaços opostos, será
denominado de E (entgegen = do outro lado).
2. Se porventura os primeiros átomos ligantes do carbono insaturado por
dupla forem iguais, analisa-se o átomo subseqüente até que o maior
átomo desempate.
Cl
H
Cl
CH3
Cl
H3 C
cis-1,2-dicloro-propeno
Z-1,2-dicloro-propeno
FÓRM. MOLEC.
FÓRM. PLANAR
C4H8
CH3-CH=CH=CH3
C2H2Cl2
C2 H5
H
Cl-CH=CH-Cl
trans-3-cloro-pent-2-eno
Z-3-cloro-pent-2-eno
ESTRUTURA 1
ESTRUTURA 2
cis-but-2-eno
trans-but-2-eno
Cl
Cl
Cl
cis-1,2-dicloro-eteno
H
C2H5Cl
Cl-CH=CH-CH3
Cl
H
CH3
Z-1-cloro-propeno
H3 C
C6H12
CH3-CH=C(CH3)-C2H5
H
CH3
CH2-CH3
CIS-3-metil-pent-2-eno
E-3-metil-pent-2-eno
Cl
trans-1,2-cicloro-eteno
H
Cl
CH3
H
E-1-cloro-propeno
H3 C
H
CH2-CH3
CH3
trans-3-metil-pent-2-eno
Z-3-metil-pent-2-eno
b) Compostos com parte cíclica e com ligantes diferentes em, pelo menos,
2 carbonos da parte cíclica:
L1
L2
L3
L4
Da mesma forma, identificaremos os isômeros pelas denominações cis-trans
ou Z/E, seguindo os critérios anteriores.
Exemplos:
Nome do composto
1,2-dimetil-ciclobutano
Estrutura 1
H
H
H
H3C
CH3
H3C
cis-1,2-dimetil-ciclobutano
Z-1,2-dimetil-ciclobutano
H
H
1,3-dimetil-ciclobutano
H3C
H
HO
CH3
H
trans-1,2-dimetil-ciclobutano
E-1,2-dimetil-ciclobutano
CH3
H
CH3
H
H3C
cis-1,3-dimetil-ciclobutano
Z-1,3-dimetil-ciclobutano
2-cloro-2-metilciclopentan-1-ol
Estrutura 2
Cl
CH3
cis-2-cloro-2-metil-ciclopentan-1-ol
E-2-cloro-2-metil-ciclopentan-1-ol
trans-1,3-dimetil-ciclobuta
E-1,3-dimetil-ciclobutano
no
H
HO
CH3
Cl
trans-2-cloro-2-metil-ciclopentan-1-ol
Z-2-cloro-2-metil-ciclopentan-1-ol
2) ISOMERIA ÓPTICA: Ocorre com compostos que apresenta assimetria
(quiralidade) molecular. Compostos que são assimétricos (quirais), assim como
estruturas macroscópicas, são classificados em “direitos” e “esquerdos”.
Molecularmente, essa classificação (moléculas dextrógiras e levógiras) é verificada
através de um aparelho óptico denominado de polarímetro, que é um emissor de
luz polarizada e onde é verificada a capacidade do composto em desviar o plano da
luz polarizada emitida.
A quiralidade molecular, em compostos orgânicos, pode ocorrer em 3
situações:
a) Presença de Carbono(s) Quiral(ais): É denominado carbono quiral ao
carbono tetraédrico (acíclico ou cíclico), ou seja, com ângulos entre os ligantes de
109º28´, que apresente seus quatro ligantes diferentes entre si.
L1
L4
L2
L3
L1L2L3L4
Quanto maior a quantidade de carbonos quirais diferentes que um composto
apresentar, mais comportamentos ópticos diferentes a molécula poderá ter. Esse
número de comportamentos (isômeros opticamente ativos) pode ser calculado pela
fórmula 2n, onde n = número de carbonos quirais diferentes que a molécula
possuir. A metade desses isômeros terá comportamento dextrógiro (desvio da luz
polarizada para a direita) e a outra metade, levógiro (desvio da luz polarizada para
a esquerda). Os isômeros ópticos que forem exatamente opostos entre si, no
desvio da luz polarizada (o dextrógiro e o respectivo levógiro) são denominados de
antípodas ópticos, enantiômeros ou enantiomorfos.
A mistura equimolar de enanciômeros nos fornece uma mistura opticamente
inativa, denominada de mistura racêmica ou racemosa, abreviada para dl.
Exemplos:
Composto
Isômeros d
Isômeros l
Mistura racêmica
NH2
O
H3 C
ác. d-2-aminpropanóico
ác. l-2-aminpropanóico
ác. dl-2-aminpropanóico
d1-3-cloro-butan2-ol
d2-3-cloro-butan2-ol
l1-3-cloro-butan2-ol
l2-3-cloro-butan2-ol
d1l1-3-cloro-butan2-ol
d2l2-3-cloro-butan2-ol
d1, d2, d3, d4, d5,
d6, d7 e d8 -glicose
l1, l2, l3, l4, l5, l6, l7
e l8- glicose
d1l1, d2l2, d3l3, d4l4,
d5l5, d6l6, d7l7 e
d8l8 - glicose
H OH
ác. 2-amin-propanóico
(alanina)
OH
H
H3 C
C H3
H
Cl
3-cloro-butan-2-ol
OH OH O
HO
H
H
H
H
H
OH
H
H
OH
glicose n=4 C*
No caso de compostos que apresentam carbonos quirais equivalentes, pelo
menos uma das formas espaciais será simétrica, mesmo com a presença de
carbonos assimétricos, originando uma estrutura opticamente inativa denominada
de isômero mesógiro (ou mesoisômero).
Exemplo:
HO
OH
CH3
H3C
H
H
butan-2,3-diol
2 C* equivalentes
Os isômeros serão: d-butan-2,3-diol, l-butan-2,3-diol e meso-butan2,3-diol. A mistura dos isômeros d e l formará a mistura racêmica
b) Compostos Cíclicos quirais.
Certos compostos cíclicos apresentam quiralidade mesmo sem apresentar
carbono quiral. Devemos imaginar a estrutura espacial do referido composto e
verificar se existe ou não um plano de simetria. Caso não haja, o composto
apresentará isômeros d e l.
Exemplos:
Composto
Estrutura cis
Estrutura trans
Estereoisômeros
-cis-1,2-dimetilciclobutano
H
H
CH3 H
H
H
-trans-d-1,2dimetil-ciclobutano
H3C
CH3
CH3 CH3
H
CH3
-trans-l-1,2simétrica
assimétrica
1,2-dimetil-ciclobutano
dimetil-ciclobutano
H
H
H
H3C
CH3 H
H
CH3 OH
assimétrica
OH
2-metil-ciclobutanol
H
OH
H
H
H
OH
CH3
CH 3
simétrica
3-metil-ciclobutanol
H
OH
assimétrica
OH
H
CH3
H
simétrica
-cis-d-2-metilciclobutanol
-cis-l-2-metilciclobutanol
-trans-d-2-metilciclobutanol
-trans-l-2-metilciclobutanol
- cis-3-metilciclobutanol
-trans-3-metilciclobutanol (não
possui forma
quiral)
c) Derivados alênicos: são considerados derivados alênicos compostos
insaturados por duas duplas ligações localizadas no mesmo carbono. Se os ligantes
dos carbonos unidos ao carbono central apresentarem seus ligantes diferentes
entre si, o composto será assimétrico.
L1
L2
L3
L4
derivado alênico
Exemplos:
H3C
H
CH3
H
pent-2,3-dieno
isômeros d e l
Cl
H
CH3
H
1-cloro-but-1,2-dieno
isômeros d e l
EXERCÍCIO:
Dados os compostos:
I – butan-2-ol
II – butan-1-ol
III – metóxi-propano
IV – etóxi-etano
V – metil-propan-2-ol
VI – but-1-eno
VII – but-2-eno
VIII - ciclobutano
IX – 1,2-dimetil-ciclopropano
X – but-1-en-2-ol
Cite:
a)
b)
c)
d)
e)
f)
g)
isômeros de cadeia
isômeros de posição
isômeros de compensação (metâmeros)
isômeros funcionais
tautômeros
que apresentem isômeros geométricos
que apresentem isômeros ópticos