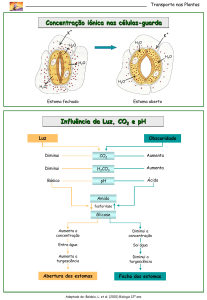
1. A aplicação excessiva de fertilizantes nitrogenados na agricultura pode acarretar alterações
no solo e na água pelo acúmulo de compostos nitrogenados, principalmente a forma mais
oxidada, favorecendo a proliferação de algas e plantas aquáticas e alterando o ciclo do
nitrogênio, representado no esquema. A espécie nitrogenada mais oxidada tem sua quantidade
controlada por ação de microrganismos que promovem a reação de redução dessa espécie, no
processo denominado desnitrificação.
O processo citado está representado na etapa
a) I.
b) II.
c) III.
d) IV.
e) V.
2. Os portugueses tiveram grande influência em nossa cultura e hábitos alimentares. Foram
eles que trouxeram o pão, produzido a base de cereais, como o trigo, a aveia e a cevada.
Fonte: UNIVERSIDADE
ATAN/DAB/SPS/MS.
FEDERAL DE BRASILIA.
A contribuição dos
portugueses.
Para fazer a massa de pães e bolos aumentarem de volume, e comum o uso de algumas
substâncias químicas:
I. O bromato de potássio era comumente utilizado no preparo do pão francês; no entanto, nos
dias atuais, essa substancia esta proibida mesmo em pequenas quantidades. O bromato de
potássio era utilizado para proporcionar um aumento de volume no produto final devido a
formação de O2 , conforme a reação
2KBrO3 (s) 2KBr(s) 302 (g)
II. A adição de fermentos, como o bicarbonato de sódio no preparo de bolos, é utilizada desde
a antiguidade até os dias atuais e resulta no crescimento da massa e na maciez do bolo. O
bicarbonato de sódio, devido à liberação de gás carbônico, é utilizado para expandir a massa
e deixá-la fofa, conforme a reação
2NaHCO3 (s) Na2CO3 (s) CO2 (g) H2O
Sobre essas reações, é correto afirmar que
a) a primeira é de síntese e a segunda é de deslocamento.
b) a primeira é de decomposição e a segunda é de deslocamento.
c) a primeira é de síntese e a segunda é de decomposição.
d) as duas são de decomposição.
e) as duas são de síntese, pois formam O2 e CO2 respectivamente.
3. Considerando a seguinte reação química, analise as assertivas abaixo e assinale V, se
verdadeiras, ou F, se falsas.
CaO H2O Ca(OH)2
(
(
(
(
(
) Esta equação, quando balanceada, obedece a lei de conservação das massas.
) O produto da reação entre o Óxido de Cálcio e a água é um Ácido de Arrhenius.
) Os coeficientes que balanceiam corretamente a reação são, respectivamente: 1 1 1.
) Na presença do indicador ácido-base Fenolftaleína, o Hidróxido de Cálcio apresenta
coloração rósea.
) A reação representada acima é uma reação de decomposição.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
a) V – F – F – V – F.
b) V – V – V – F – V.
c) F – V – V – V – F.
d) F – F – F – F – F.
e) V – F – V – V – F.
TEXTO PARA A PRÓXIMA QUESTÃO:
Analise a reação abaixo:
HC NaOH NaC H2O
4. Considerando o produto da reação, o NaC, assinale a alternativa correta.
NOTA:
2
Distribuição
2
6
2
eletrônica
do
Na : 1s2 , 2s2 , 2p6 , 3s1.
Distribuição
eletrônica
do
5
C : 1s , 2s , 2p , 3s , 3p .
a) O sal formado é um hidrogeno-sal.
b) A reação de formação do sal é do tipo de decomposição.
c) A ligação intramolecular no NaCl é do tipo iônica.
d) O NOX do C é 5.
e) O NaCl é formado em uma reação de neutralização parcial.
5. Na produção de eletricidade, são, algumas vezes, usados geradores a óleo. Quando o óleo
queima, produz SO2 , que deve ser eliminado antes de ser emitido ao ar, pois é formador de
chuva ácida. Um dos métodos para a sua eliminação usa o calcário, produzindo sulfito de
cálcio que, posteriormente, é removido por precipitação eletrostática.
As reações envolvidas na eliminação do SO2 são:
1. CaCO3 CaO(s) CO2(g)
2. CaO(s) SO2(g) CaSO3(s)
As reações 1 e 2 denominam-se, respectivamente, reações de
a) deslocamento e análise.
b) deslocamento e síntese.
c) síntese e análise.
d) análise e síntese.
e) síntese e deslocamento.
6. Alguns metais reagem com a água, quando aquecidos, formando óxidos e liberando gás
hidrogênio, como no caso da reação abaixo:
Fe(s) H2O() Fe3O4(s) H2(g)
Considerando a reação acima (não balanceada), é correto afirmar que:
a) é uma reação de decomposição.
b) é uma reação de neutralização.
c) é uma reação de oxidação-redução.
d) é uma reação que libera um mol de H2 .
e) é uma reação que consome um mol de H2O.
7. A equação que representa uma reação de neutralização é
a) HIaq KOHaq H2O KIaq
b) Zn s 2HCaq ZnC 2aq H2 g
c) Na s H2O NaOH aq 12 H2 g
d) HNO3 H2O H3Oaq NO3 aq
8. Considere as reações abaixo e assinale a(s) alternativa(s) correta(s).
I. SO3 H2O H2SO4
II. H2SO4 CaCO3 CaSO4 H2CO3
III. CaSO4 NaOH Ca OH2 Na2SO4
01) A reação I é uma reação de adição.
02) A reação III é uma reação de neutralização.
04) Todas as reações apresentadas acima estão balanceadas.
08) Carbonato de cálcio é um exemplo de sal insolúvel em água.
16) O ácido carbônico formado na reação II é um ácido fraco, instável e se decompõe
formando água e dióxido de carbono.
9. Dadas as equações:
I. CuC 2 H2SO4 CuSO4 2HC
II. CuSO4 2NaOH Cu OH2 Na2SO4
III. Cu OH2 CuO H2O
A classificação da reação equacionada e a função química do composto assinalado em negrito
são:
a) em I, dupla troca e ácido.
b) em II, dupla troca e base.
c) em III, síntese e óxido.
d) em I, simples troca e sal.
e) em III, análise e sal.
10. O oxigênio dissolvido (OD) na água é um dos parâmetros importantes para estabelecer a
sua qualidade e conhecer a possibilidade de vida nos sistemas aquáticos. A quantidade de
oxigênio dissolvido na água não pode ser menor que 2 mg/L para que os peixes sobrevivam.
A seguir, é apresentada a sequência de reações de um método desenvolvido em solução
aquosa, para a determinação da quantidade de oxigênio dissolvido na água:
I
MnSO4 aq 2NaOH aq Mn OH2
II
2Mn OH2
III
MnO OH2
IV
Mn SO4 2 aq 2KI aq Mn SO4 aq K 2 SO4 aq I2 aq
s Na2SO 4 aq
s O2 aq 2MnO OH2 s
s 2H2SO4 aq Mn SO4 2 aq 3H2O
V
I2aq 2Na2S2O3aq Na2S4O6aq 2NaIaq
A partir das reações observadas no método de determinação de oxigênio dissolvido, é correto
afirmar:
a) Na reação II, o oxigênio O2 age como agente redutor, uma vez que aumenta o seu número
de oxidação.
b) A reação I é de simples troca.
c) O I2aq formado no processo equivale à concentração de oxigênio dissolvido, o que
possibilita determinar o OD na água.
d) A reação V é de decomposição.
11. O quadro a seguir relaciona ordem, equaçمo quيmica e onde as mesmas ocorrem:
Ordem
Equaçمo Quيmica
I
3Ca OH2 aq A 2 SO4 3
II
2Mg s 1O2 g 2MgO s
III
Zn s 2HC aq ZnC 2aq H2 g
IV
NH4HCO3 s CO2 g NH3g H2O
s 2 A OH3 s 3Ca SO 4 aq
Ocorrem
Tratamento de
لgua
Flash
fotogrلfico
Ataque do لcido
clorيdrico
a
lâminas de zinco
Fermento
quيmico
As equaçُes quيmicas I, II, III e IV correspondem, nessa ordem, aos seguintes tipos de reaçمo:
a) I-síntese; II-análise; III-deslocamento e IV-dupla troca.
b) I-dupla troca; II-síntese; III-deslocamento e IV-análise.
c) I-análise; II-síntese; III-deslocamento e IV-dupla troca.
d) I-síntese; II-análise; III-dupla troca e IV-deslocamento.
e) I-deslocamento; II-análise; III-síntese e IV-dupla troca.
TEXTO PARA A PRÓXIMA QUESTÃO:
As informações fornecidas nos textos a seguir são importantes para a resolução da(s)
questão(ões)
a
seguir.
Texto I
As primeiras teorias para a composição da matéria
Historicamente, a humanidade buscou explicações para entender de que as coisas são
feitas. Alguns séculos a.C, surgem na Grécia as primeiras especulações de que se tem
registro. Demócrito e Leucipo acreditavam que tudo era feito de minúsculas partículas
indivisíveis (átomos). Competindo com essa ideia, aparece a teoria dos quatro elementos, que
sugeria que todo material seria constituído pela combinação de água, ar, fogo e terra. Dada a
influencia política e filosófica de importantes simpatizantes desta teoria, entre eles Aristóteles
de Estagira, esta se impôs até o século XVIII d.C. No entanto, nesse século, compreender a
queima de alguns materiais se tornara essencial para o desenvolvimento da indústria da época.
Assim, surge entre os alquimistas (os precursores dos químicos modernos) uma teoria errônea
que afirmava que os materiais que queimam são ricos em um componente chamado flogiston.
Apesar do flogiston não existir, segundo a visão química atual, ele foi um passo para a queda
da teoria dos quatro elementos. Para os defensores do flogiston, a madeira queima perdendo
flogiston, por isso fica mais leve, resultando em cinzas, que não queimam.
Texto II:
A queda das teorias dos quatro elementos e do flogiston
Grandes passos para ampliação do entendimento humano sobre a constituição da
matéria foram dados por Henry Cavendish, Joseph Priestley e Antoine Lavoisier. Cavendish fez
uma experiência adicionando zinco metálico em ácido. Atento, percebeu a formação de bolhas
de gás. Ao atear fogo nesse gás, Cavendish observou que ele era extremamente inflamável.
Entretanto, influenciado pela teoria do flogiston, Cavendish não sabia que tinha isolado o mais
simples dos elementos, o hidrogênio. Ele acreditava que tinha finalmente isolado o tal flogiston.
Por sua vez, Priestley aqueceu óxido de mercúrio de tal forma a obter mercúrio metálico,
quando observou a formação de um novo gás. Ele tentou asfixiar dois ratinhos com esse gás,
mas percebeu que eles ficavam mais espertos que antes, Então, ele mesmo experimentou o
gás e ficou maravilhado. Certamente, ele não imaginava que tinha conseguido isolar um dos
gases mais importantes para os seres vivos, o oxigênio.
Numa cartada genial, Lavoisier utilizou balanças muito precisas para medir as
variações de peso nos experimentos de Priestley. De forma inusitada, mediu também a reação
inversa. Desses e de outros experimentos, ele percebeu que a massa perdida quando um
óxido se transformava em metal era a mesma que se acrescentava quando o metal se
convertia em óxido novamente. Assim, Lavoisier nos convenceu de que o flogiston não existia
e a combustão se devia à adição de um dos componentes do ar aos materiais que queimam.
Aplicando isto à queima do gás de Cavendish, Lavoisier chega à conclusão que a água não é
um elemento, mas, sim, um composto, formado pelos gases de Cavendish e Priestley. Assim
caíam as teorias do flogiston e dos quatro elementos.
12. Os tipos de reações químicas que ocorrem nos experimentos de Cavendich (obtenção do
gás hidrogênio); Priestley (obtenção do gás oxigênio); e Lavoisier (obtenção da água a partir da
combustão do gás hidrogênio), respectivamente, são:
a) Dupla troca, decomposição e adição.
b) Decomposição, adição e simples troca.
c) Simples troca, adição e decomposição.
d) Simples troca, decomposição e adição.
e) Adição, decomposição e adição.
TEXTO PARA A PRÓXIMA QUESTÃO:
Com base no texto abaixo, responda à(s) questão(ões).
Emissões veiculares são responsáveis por 80% da poluição na RMC, aponta estudo
Dados podem ser ferramenta para planejamento, manutenção e controle da qualidade do ar
Estudo da qualidade do ar da Região Metropolitana de Campinas (RMC) concluiu que
cerca de 80% da poluição atmosférica é resultante principalmente das emissões veiculares. A
pesquisa considerou os poluentes monóxido de carbono (CO), óxidos de nitrogênio (NO X),
hidrocarbonetos (HC) e material particulado (MP). O trabalho foi aprofundado no
monitorarnento de Compostos Orgânicos Voláteis (COVs). Os COVs são constituídos
principalmente de hidrocarbonetos, aldeídos e cetonas, entre outros compostos, que se
encontram no estado gasoso à pressão e temperatura ambientes e participam pela ação da luz
e de reações fotoquímicas, dando origem a compostos que podem ser mais nocivos que os
originais. O monitoramento foi realizado inicialmente em dez locais e depois se concentrou em
cinco deles, em vista da seleção entre os que revelaram características semelhantes.
Jornal da Unicamp (Campinas, 13 a 26 de junho de 2011 – ANO XXV – N°498).
Autor: Carmo Gallo Netto
13. Uma reação fotoquímica só ocorre se
a) houver qualquer radiação eletromagnética que atinja o reagente.
b) existirem dois ou mais compostos para reagir.
c) houver radiação eletromagnética que possa induzir a reação.
d) houver exclusivamente radiação luminosa.
e) houver um catalisador.
14. Existem muitas reações químicas importantes que ocorrem no planeta terra, mas pode-se
afirmar sem exageros que uma das reações químicas mais importantes é a que ocorre nas
partes verdes das plantas. Esta reação é indicada a seguir:
CO2 H2O luz solar C6H12O6
Esta reação é classificada como:
a) simples troca.
b) decomposição.
c) síntese.
d) análise.
e) salificação.
15. Dadas as equações:
I. 2Mg s O2 g 2MgO s
II. H2SO4(aq) CaCO3(s) CaSO4(s) H2CO3aq
III. H2CO3aq CO2(g) H2O l
A classificação da equação e o nome do composto em destaque estão corretos em
a) I – deslocamento e óxido de magnésio.
b) II – dupla troca e sulfato de cálcio.
c) III – adição e dióxido de carbono.
d) I – análise e óxido de magnésio.
e) III – dupla troca e dióxido de carbono.
16. As misturas efervescentes, em pó ou em comprimidos, são comuns para a administração
de vitamina C ou de medicamentos para azia. Essa forma farmacêutica sólida foi desenvolvida
para facilitar o transporte, aumentar a estabilidade de substâncias e, quando em solução,
acelerar a absorção do fármaco pelo organismo.
A matérias-primas que atuam na efervescência são, em geral, o ácido tartárico ou o ácido
cítrico que reagem com um sal de caráter básico, como o bicarbonato de sódio (NaHCO 3),
quando em contato com a água. A partir do contato da mistura efervescente com a água,
ocorre uma série de reações químicas simultâneas: liberação de íons, formação de ácido e
liberação do gás carbônico- gerando a efervescência.
As equações a seguir representam as etapas da reação da mistura efervescente na água, em
que foram omitidos os estados de agregação dos reagentes, e H 3A representa o ácido cítrico.
+
I. NaHCO3 → Na + HCO 3
II. H2CO3 H2O + CO2
–
+
III. HCO 3 + H H2CO3
+
–
IV. H3A 3H + A
A ionização, a dissociação iônica, a formação do ácido e a liberação do gás ocorrem,
respectivamente, nas seguintes etapas:
a) IV, I, II e III
b) I, IV, III e II
c) IV, III, I e II
d) I, IV, II e III
e) IV, I, III e II
17. Considere os conteúdos dos cinco frascos a seguir representados:
Sobre o conteúdo desses frascos, suponha a adição de uma solução de HCℓ 6 mol/ℓ. A respeito
das interações que ocorrem após a adição do ácido, assinale o que for correto.
01) A prata não reage com o HCℓ.
02) O nitrato de prata reage com o HCℓ formando AgCℓ.
04) A reação entre o HCℓ e o hidróxido de sódio é de neutralização.
08) A reação entre o zinco e o HCℓ, classificada como de simples troca ou deslocamento,
ocorre com a liberação de H2.
16) A liberação de CO2, após a reação do HCℓ com o carbonato de sódio, ocorre pela
decomposição do ácido carbônico formado nessa reação.
18. As reações químicas a seguir representam a formação de chuvas ácidas, causadas pela
presença de SO3(g) na atmosfera e o ataque do produto formado às fachadas e estátuas de
mármore, cujo componente principal é o CaCO3.
SO3 g H2O H2SO4aq
H2SO4aq CaCO3 s CaSO4aq H2O CO2 g
Essas reações podem ser classificadas, respectivamente, como de:
a) análise e deslocamento.
b) síntese e dupla troca.
c) deslocamento e dupla troca.
d) síntese e decomposição.
e) análise e dupla troca.
TEXTO PARA A PRÓXIMA QUESTÃO:
O carbonato de cálcio pode ser encontrado na natureza na forma de rocha sedimentar
(calcário) ou como rocha metamórfica (mármore). Ambos encontram importantes aplicações
industriais e comerciais. Por exemplo, o mármore é bastante utilizado na construção civil tanto
para fins estruturais como ornamentais.
Já o calcário é usado como matéria-prima em diversos processos químicos, dentre eles, a
produção da cal.
19. A cal é obtida industrialmente por tratamento térmico do calcário em temperaturas acima
de 900 ºC, pela reação:
CaCO3 (s) → CaO (s) + CO2 (g)
Por suas diferentes aplicações, constitui-se num importante produto da indústria química. Na
agricultura é usado para correção da acidez do solo, na siderurgia como fundente e
escorificante, na fabricação do papel é um agente branqueador e corretor de acidez, no
tratamento de água também corrige a acidez e atua como agente floculante e na construção
civil é agente cimentante.
Sobre o processo de obtenção e as propriedades associadas ao produto, indique qual das
afirmações é totalmente correta.
a) A reação é de decomposição e o CaO é usado como branqueador na indústria do papel,
porque é um agente oxidante.
b) A reação é endotérmica e o CaO é classificado como um óxido ácido.
c) A reação é exotérmica e, se a cal reagir com água, produz Ca(OH) 2 que é um agente
cimentante.
d) A reação é endotérmica e o CaO é classificado como um óxido básico.
e) A reação é de decomposição e no tratamento de água o CaO reduz o pH, atuando como
floculante.
20. I. 2 NO2
N2O4
II. (NH4)2Cr2O7
Cr2O3 + N2 + 4 H2O
III. Zn + CuSO4
ZnSO4 + Cu
IV. Na2CO3 + 2 HCℓ
2 NaCℓ + H2O + CO2
As reações I, II, III e IV, acima representadas, são classificadas, respectivamente, como:
a) síntese, análise, dupla-troca e simples-troca.
b) análise, adição, dupla-troca e simples-troca.
c) síntese, análise, dupla-troca e decomposição.
d) adição, decomposição, deslocamento e dupla-troca.
e) análise, decomposição, deslocamento e dupla-troca.
21. Além de obedecer às leis ponderais, as reações químicas ainda necessitam atender
determinadas condições. A partir dessas considerações, assinale o correto.
a) Os ácidos sempre reagem com metais produzindo sal e liberando hidrogênio gasoso.
b) Ao reagir com o carbonato de cálcio, o ácido clorídrico produz, ao final, gás carbônico e
água.
c) Só ocorrerá reação de síntese se juntarmos substâncias simples.
d) Em todas as reações de análise ocorre óxido-redução.
TEXTO PARA A PRÓXIMA QUESTÃO:
O Carvão foi uma das primeiras fontes de energia e, em pleno século XXI, ainda é muito
empregado, haja vista a possibilidade de instalação, no Pará, de uma termoelétrica alimentada
por carvão mineral. Sua composição média varia muito, porém os valores mais comuns são:
4% de umidade, 5% de matéria volátil, 81% de carbono e materiais minerais diversos que
levam, após a combustão, à formação de, aproximadamente, 10% de cinzas. Estas cinzas ou
"pó do carvão" são muito leves e, para que não levantem poeira, devem ser armazenadas em
ambiente com umidade controlada. As cinzas são constituídas de uma de série elementos,
normalmente expressos na forma de óxidos: SiO 2, Aℓ2O3, TiO2, Fe2O3, CaO, MgO, K2O, Na2O,
P2O5, Mn3O4, BaO. Além desses, outro óxido importante é o SO 3, produzido e liberado na
forma gasosa durante o processo de combustão.
22. Considerando a presença de P2O5 na cinza armazenada, sua reação com a umidade do
ambiente pode ser classificada como
a) oxi-redução.
b) neutralização.
c) simples troca.
d) dupla troca.
e) síntese.
23. O cobre é uma substância que possui elevado potencial de redução e no seu estado
metálico sofre pouco em termos de oxidação frente a ácidos, não sendo oxidado pela maioria
deles. Todavia, ele é oxidado na presença de ácido nítrico, conforme mostra a equação não
balanceada de uma das possíveis reações:
Cu(s) HNO3(aq) Cu(NO3 )2(aq) NO(g) H2O( )
Após o balanceamento da equação com os coeficientes estequiométricos (menores números
inteiros) a soma destes coeficientes será igual a
a) 14
b) 18
c) 20
d) 24
e) 26
24. As fosfinas, PH3 , são precursoras de compostos empregados na indústria petroquímica,
de mineração e hidrometalurgia. Sua obtenção é feita a partir do fósforo elementar, em meio
ácido, sob elevada pressão, e a reação se processa de acordo com
P4 H2O PH3 H3PO4
A soma dos menores valores inteiros dos coeficientes estequiométricos dessa equação
corretamente balanceada é igual a
a) 10.
b) 11.
c) 15.
d) 22.
e) 24.
25.
O ácido clorídrico (HC ) reage com alguns metais. Ao reagir com o magnésio metálico
(Mg), forma como produtos um gás inflamável/explosivo e um sal. Os nomes destes produtos
formados são, respectivamente:
a) gás cloro e clorato de magnésio.
b) gás hidrogênio e clorato de magnésio.
c) gás oxigênio e cloreto de magnésio.
d) gás hidrogênio e cloreto de magnésio.
e) gás cloro e clorito de magnésio.
26. Borbulha-se gás cloro em solução aquosa diluída de hidróxido de sódio a 25C. Assinale
a opção que contém apenas produtos clorados resultantes.
a) C , CO3
b) OC , C
c) CO3 , CO4 , C
d) CO3 , OC
e) CO4 , CO3
27.
O sódio metálico reage com água, produzindo gás hidrogênio e hidróxido de sódio,
conforme a equação não balanceada:
Na(s) H2O() NaOH(aq) H2(g)
Baseado nessa reação, são feitas as seguintes afirmativas:
I. O sódio atua nessa reação como agente redutor.
II. A soma dos menores coeficientes inteiros que balanceiam corretamente a equação é 7.
III. Os dois produtos podem ser classificados como substâncias simples.
IV. Essa é uma reação de deslocamento.
Das afirmativas feitas, estão corretas:
a) Todas.
b) apenas I, II e III.
c) apenas I, II e IV.
d) apenas I, III e IV.
e) apenas II, III e IV.
28.
Assinale a opção que contém o número de oxidação do crômio no composto
[Cr(NH3 )4 C 2 ] .
a) Zero.
b) + 1.
c) + 2.
d) + 3.
e) + 4.
29.
A respeito da equação iônica de oxirredução abaixo, não balanceada, são feitas as
seguintes afirmações:
IO3 HSO3 I2 SO42 H H2O
I. a soma dos menores coeficientes inteiros possível para o balanceamento é 17.
II. o agente oxidante é o ânion iodato.
III. o composto que ganha elétrons sofre oxidação.
IV. o Nox do enxofre varia de +5 para +6.
Das afirmações acima, estão corretas somente
a) II e III.
b) I e II.
c) I e III.
d) II e IV.
e) I e IV.
30. Assinale a opção que contém o(s) produto(s) formado(s) durante o aquecimento de uma
mistura de Cu2O e Cu2S, em atmosfera inerte.
a) CuSO4
b) Cu2SO3
c) Cu e SO2
d) Cu e SO3
e) CuO e CuS
31. O dióxido de potássio tem várias aplicações, entre as quais, a
(a) produção de peróxido de hidrogênio (g) na presença de água.
(b) conversão de dióxido de carbono (g) para oxigênio (g).
(c) absorção de dióxido de carbono (g) na presença de H2O com formação de oxigênio (g).
Apresente as equações químicas balanceadas que representam as reações descritas nos itens
acima.
32. O ácido nítrico reage com metais, podendo liberar os seguintes produtos: NO (que pode
ser posteriormente oxidado na presença do ar), N2O, NO2 ou NH3 (que reage posteriormente
com HNO3, formando NH4NO3). A formação desses produtos depende da concentração do
ácido, da natureza do metal e da temperatura da reação.
Escreva qual(is) dos produtos citados acima é(são) formado(s) nas seguintes condições:
a) Zn (s) HNO3
muito diluído 2%
b) Zn (s) HNO3
diluído 10%
c) Zn (s) HNO3
concentrado
d) Sn (s) HNO3
diluído
e) Sn (s) HNO3
concentrado
33. Em 24.09.2013, uma carga de fertilizante à base de nitrato de amônio explodiu em um
galpão a dois quilômetros do porto de São Francisco do Sul, no Litoral Norte de Santa
Catarina. A decomposição do nitrato de amônio envolve uma reação química que ocorre com
grande velocidade e violência. A equação não balanceada dessa reação é:
__NH4NO3 __N2 __ O2 __H2O
Nessa equação, quando o coeficiente estequiométrico do nitrato de amônio é 2, os coeficientes
do nitrogênio, do oxigênio e da água são, respectivamente,
a) 2, 1 e 4.
b) 2, 2 e 4.
c) 2, 3 e 2.
d) 1, 2 e 2.
e) 1, 1 e 3.
34. Uma vela foi colocada dentro de um recipiente cilíndrico e com raio igual a 10 cm, sem
tampa, ao qual também foi adicionado hidrogenocarbonato de sódio sólido, NaHCO 3. A vela foi
acesa e adicionou-se ao recipiente, lentamente, solução aquosa de ácido acético, C 2H4O2, de
tal forma que o nível da solução atingiu somente a parte inferior da vela, ficando distante da
chama. Após 3 segundos, observou-se que a chama apagou.
a) Apresente a fórmula estrutural do ácido acético.
b) Escreva a equação química balanceada da reação entre o sólido e a solução aquosa de
ácido acético.
c) O experimento foi repetido com outra vela de mesma altura e com as mesmas quantidades
de reagentes utilizadas anteriormente. Mudou-se apenas o recipiente, que foi substituído por
outro, de mesma altura que o anterior, mas com raio igual a 20 cm. Dessa vez, após os
mesmos 3 segundos, observou-se que a chama não apagou. Proponha uma explicação para
esse fato, considerando a densidade das substâncias gasosas presentes.
Dados: Massa molar (g/mol): C=12; N=14; O=16.
35. Assinale a alternativa CORRETA para o par de substâncias cujas soluções aquosas, ao
serem misturadas, produz um precipitado amarelo.
a) AC 3 e KOH
b) Ba NO3 2 e Na2SO4
c) Cu NO3 2 e NaCO4
d) Pb C2H3O2 2 e KI
e) AgNO3 e NH4OH
36. O mármore é um material empregado para revestimento de pisos e um de seus principais
constituintes é o carbonato de cálcio. Na limpeza desses pisos com solução ácida, ocorre
efervescência. Nessa efervescência o gás liberado é o
a) oxigênio.
b) hidrogênio.
c) cloro.
d) dióxido de carbono.
e) monóxido de carbono.
37.
Dada a seguinte equação iônica de oxidorredução da reação, usualmente utilizada em
etapas de sínteses químicas, envolvendo o íon dicromato
H2C2O4 :
Cr2O72
e o ácido oxálico
Cr2O72 H2C2O4 H Cr 3 CO2 H2O
Considerando a equação acima e o balanceamento de equações químicas por oxidorredução,
a soma total dos coeficientes mínimos e inteiros obtidos das espécies envolvidas e a
substância que atua como agente redutor são, respectivamente,
a) 21 e ácido oxálico.
b) 26 e dicromato.
c) 19 e dicromato.
d) 27 e ácido oxálico.
e) 20 e hidrogênio.
38. Compostos de crômio têm aplicação em muitos processos industriais, como, por exemplo,
o tratamento de couro em curtumes e a fabricação de tintas e pigmentos. Os resíduos
2–
provenientes desses usos industriais contêm, em geral, misturas de íons cromato (CrO4 ),
dicromato e crômio, que não devem ser descartados no ambiente, por causarem impactos
significativos.
Sabendo que no ânion dicromato o número de oxidação do crômio é o mesmo que no ânion
cromato, e que é igual à metade desse valor no cátion crômio, as representações químicas que
correspondem aos íons de dicromato e crômio são, correta e respectivamente,
2–
4+
a) Cr2O5 e Cr .
2–
4+
b) Cr2O9 e Cr .
2–
3+
c) Cr2O9 e Cr .
2–
3+
d) Cr2O7 e Cr .
2–
2+
e) Cr2O5 e Cr .
39. Uma estudante de Química elaborou um experimento para investigar a reação entre cobre
metálico (Cu) e ácido nítrico (HNO3(aq)). Para isso, adicionou o ácido nítrico a um tubo de
ensaio (I) e, em seguida, adicionou raspas de cobre metálico a esse mesmo tubo. Observou
que houve liberação de calor e de um gás marrom, e que a solução se tornou azul. A seguir,
adicionou raspas de cobre a dois outros tubos (II e III), contendo, respectivamente, soluções
aquosas de ácido clorídrico (HC(aq)) e nitrato de sódio (NaNO3(aq)). Não observou qualquer
mudança nos tubos II e III, ao realizar esses testes.
2+
Sabe-se que soluções aquosas de íons Cu são azuis e que o gás NO2 é marrom.
a) Escreva, nos espaços delimitados abaixo, as equações que representam a semirreação de
oxidação e a semirreação de redução que ocorrem no tubo I.
Semirreação de oxidação
Semirreação de redução
b) Qual foi o objetivo da estudante ao realizar os testes com HC(aq) e NaNO3(aq)? Explique.
40.
O molibdênio é um metal de aplicação tecnológica em compostos como MoS 2 e o
espinélio, MoNa2O4, que, por apresentarem sensibilidade a variações de campo elétrico e
magnético, têm sido empregados em dispositivos eletrônicos. Os números de oxidação do
molibdênio no MoS2 e no MoNa2O4 são, respectivamente,
a) +2 e +2.
b) +2 e +3.
c) +4 e +3.
d) +4 e +4.
e) +4 e +6.
41. À medida que se expira sobre uma solução de azul de bromotimol e hidróxido de sódio
(NaOH), sua coloração azul característica vai se alterando. O azul de bromotimol é um
indicador ácido-base que adquire cor azul em pH básico, verde em pH neutro e amarela em pH
ácido. O gás carbônico (CO2) expirado reage com a água presente na solução (H 2O),
produzindo ácido carbônico (H2CO3). Este pode reagir com o NaOH da solução inicial,
produzindo bicarbonato de sódio (NaHCO3):
CO2 H2O H2CO3
H2CO3 NaOH NaHCO3 H2O
ARROIO, A. et AL. Química Nova na Escola, São Paulo, v. 29, 2006.
O que a pessoa irá observar à medida que expira no recipiente contendo essa solução?
a) A solução mudará de cor, de azul para verde, e, em seguida, de verde para amarelo. Com o
acréscimo de ácido carbônico, o pH da solução irá reduzir até tornar-se neutro. Em seguida,
um excesso de ácido carbônico tornará o pH da solução ácido.
b) A solução somente terá sua cor alterada de azul para amarelo, pois será formado um
excesso de ácido carbônico no recipiente, o que reduzirá bruscamente o pH da solução.
c) A cor da solução não será alterada com o acréscimo de ácido carbônico. Isso porque o meio
é inicialmente neutro e a presença de ácido carbônico não produzirá nenhuma mudança no
pH da solução.
d) A solução mudará de azul para verde e, em seguida, de verde para azul. Isso ocorrerá em
função da neutralização de um meio inicialmente básico acompanhado de um aumento de
pH na solução, à medida que ácido carbônico é adicionado ao meio.
e) A cor da solução alterará de azul para amarelo e, em seguida, de amarelo para verde. Esse
comportamento é justificado pelo fato de o ácido carbônico reduzir bruscamente o pH da
solução e depois ser neutralizado pelo restante de NaOH presente no meio.
42. Uma alíquota de uma solução aquosa constituída de haletos de sódio foi adicionada a
uma solução aquosa de nitrato de prata, com formação de um precipitado. À mistura contendo
o precipitado, foi adicionada uma alíquota de solução aquosa diluída de hidróxido de amônio,
com dissolução parcial do precipitado. Ao precipitado remanescente, foi adicionada uma
alíquota de solução aquosa concentrada de hidróxido de amônio, verificando-se uma nova
dissolução parcial do precipitado.
Sabendo que a mistura de haletos é constituída pelo fluoreto, brometo, cloreto e iodeto de
sódio, assinale a alternativa CORRETA para o(s) haleto(s) de prata presente(s) no precipitado
não dissolvido.
a) AgBr
b) AgC
c) AgF
d) AgI
e) AgBr e AgC
43.
A imagem é a fotografia de uma impressão digital coletada na superfície de um pedaço de
madeira. Para obtê-la, foi utilizada uma técnica baseada na reação entre o sal do suor NaC ,
presente na impressão digital, com solução aquosa diluída de um reagente específico. Depois
de secar em uma câmara escura, a madeira é exposta à luz solar.
Considere soluções aquosas diluídas de AgNO3 e de KNO3. Indique qual delas produziria um
registro fotográfico de impressão digital ao reagir com o sal do suor, nas condições descritas, e
justifique sua resposta descrevendo as reações químicas envolvidas.
44.
A transformação química em questão é representada pela equação:
a) CH3COOH (aq) NaHCO3 (s) Na (aq) CH3COO (aq) CO2 (g) H2O( )
b) CH3COOH (aq) NaHCO3 (s) Na (aq) CH3COO (aq) O2 (g) H2O( )
c) CH3COOH (aq) NaHCO3 (s) Na (aq) CH3COO (aq) H2O( )
d) CH3COOH (aq) NaHCO3 (s) NaCO2 (aq) CH3COO (aq) H2O( )
e) CH3COOH (aq) NaHCO3 (s) Na (aq) CH3COO (aq) H2 (g) H2O( )
45.
Por exposição à atmosfera ambiente, o hidróxido de cálcio hidratado (cal hidratada)
produz um filme que é utilizado na proteção de superfícies de alvenaria em um processo
denominado “caiação”. Escreva a(s) equação(ões) química(s) balanceada(s) da(s) reação(ões)
que representa(m), respectivamente,:
a) a formação do filme acima citado, e
b) o processo de produção industrial da cal hidratada.
46. Na temperatura ambiente, hidróxido de potássio sólido reage com o cloreto de amônio
sólido, com a liberação de um gás. Assinale a alternativa CORRETA para o gás liberado nesta
reação.
a) C 2
b) H2
c) HC
d) NH3
e) O2
47. Uma das etapas do processo de obtenção do metal zinco envolve o aquecimento do
mineral esfalerita, ZnS, em presença de oxigênio do ar. A equação química, não balanceada,
que representa essa transformação é:
....... ZnS s ....... O2 g ....... ZnO s ....... SO2 g
Nessa equação, se o coeficiente estequiométrico da esfalerita for 2, os coeficientes
estequiométricos do oxigênio, do óxido de zinco e do dióxido de enxofre serão,
respectivamente,
a) 2, 2 e 2.
b) 2, 2 e 3.
c) 2, 3 e 3.
d) 3, 2 e 2.
e) 3, 3 e 3.
48.
A imagem mostra uma transformação química que ocorre com formação de precipitado.
Foram adicionadas a uma solução de íons Ba2 , contida em um tubo de ensaio, gotas de
uma solução que contém íons sulfato SO 42 .
Escreva a equação completa dessa transformação química quando o cloreto de bário e o
sulfato de magnésio, devidamente dissolvidos em água, são colocados em contato, e explique
se a mesma imagem pode ser utilizada para ilustrar a transformação que ocorre se a solução
de cloreto de bário for substituída por NaOH aq .
49. Ácido muriático (ou ácido clorídrico comercial) é bastante utilizado na limpeza pesada de
pisos para remoção de resíduos de cimento, por exemplo. Sua aplicação em resíduos
contendo quantidades apreciáveis de CaCO3 resulta na liberação de um gás. Considerando a
ampla utilização desse ácido por profissionais da área de limpeza, torna-se importante
conhecer os produtos formados durante seu uso.
A fórmula do gás citado no texto e um teste que pode ser realizado para confirmar sua
presença são, respectivamente:
a) CO2 e borbulhá-lo em solução de KC
b) CO2 e borbulhá-lo em solução de HNO3
c) H2 e borbulhá-lo em solução de NaOH
d) H2 e borbulhá-lo em solução de H2SO4
e) CO2 e borbulhá-lo em solução de Ba(OH)2
50. Assinale a opção que apresenta os compostos nitrogenados em ordem crescente de
número de oxidação do átomo de nitrogênio.
a) N2H4 K2N2O2 NaNH2 NI3 Na2NO2
b) K 2N2O2 Na2NO2 NI3 NaNH2 N2H4
c) NaNH2 N2H4 K 2N2O2 Na2NO2 NI3
d) NI3 NaNH2 Na2NO2 N2H4 K2N2O2
e) Na2NO2 NI3 N2H4 K2N2O2 NaNH2
51. Dada a seguinte equação iônica de oxidorredução:
CrI3 C 2 OH1 IO14 CrO24 C1 H2O
Considerando o balanceamento de equações químicas por oxidorredução, a soma total dos
coeficientes mínimos e inteiros obtidos das espécies envolvidas e o(s) elemento(s) que sofrem
oxidação, são, respectivamente,
a) 215 e cloro.
b) 187, crômio e iodo.
c) 73, cloro e iodo.
d) 92, cloro e oxigênio.
e) 53 e crômio.
52. Nas latinhas de refrigerantes, o elemento alumínio (número atômico 13) está presente na
forma metálica e, na pedra-ume, está presente na forma de cátions trivalentes. Logo, as cargas
elétricas relativas do alumínio nas latinhas e na pedra-ume são, respectivamente,
a) 3- e 3+.
b) 3- e 0.
c) 0 e 3+.
d) 3+ e 0.
e) 3+ e 3-.
53. A produção de fertilizantes desempenha um papel muito importante na economia do país,
pois movimentam a indústria química de produção de insumos e a agricultura. Os fertilizantes
superfosfatos são produzidos por meio da acidulação de rochas fosfáticas com ácido sulfúrico
de acordo com a reação
Ca3 PO4 2 (s) H2SO4 () H2O() Ca H2PO4 2 (s) CaSO4 2H2O(s).
A soma dos coeficientes estequiométricos mínimos inteiros da reação é igual a
a) 8.
b) 9.
c) 10.
d) 11.
e) 12.
54. A queima de combustíveis fósseis é uma das principais fontes de poluentes causadores
da chuva ácida. Tanto o carvão mineral quanto os derivados de petróleo de maior peso
molecular (como o óleo diesel) apresentam teores relativamente elevados de X, gerando o Y
durante a combustão. A reação entre o oxigênio atmosférico e Y pode formar o gás Z, outro
poluente atmosférico. A reação entre Z e a água produz o A, responsável pelo abaixamento do
pH da chuva.
Os símbolos e fórmulas que substituem X, Y, Z e A apropriadamente são, respectivamente,
a) C, CO, CO2 e H2CO3.
b) C, CO2, CO e H2CO3.
c) S, SO2, SO3 e H2SO4.
d) N, NO, NO2 e H2NO3.
e) S, SO3, SO2 e H2SO3.
TEXTO PARA A PRÓXIMA QUESTÃO:
A siderurgia é o setor industrial que responde pela produção do ferro-gusa a partir de minérios
como a hematita (Fe2O3) processada no alto-forno. Ar quente é injetado na parte inferior do
alto-forno e o oxigênio interage com o carbono presente no carvão liberando calor, elevando a
temperatura até cerca de 1 500 ºC.
A equação global (não balanceada) a seguir representa a reação envolvida.
Fe2O3(s) C(s) O2(g) Fe(s) CO2(g) energia
55. Em relação às afirmações, pode-se afirmar que
I. a função do carvão, que contém o carbono, é de fornecer energia para o processo de
transformação da hematita, atuando como agente redutor;
II. o número de oxidação do elemento químico ferro passa de três para zero, indicando que ele
sofre redução;
III. o gás oxigênio provoca a oxidação do ferro, presente no minério, que se funde, resultando
no ferro-gusa.
Está correto apenas o contido em
a) I.
b) II.
c) III.
d) I e II.
e) II e III.
TEXTO PARA A PRÓXIMA QUESTÃO:
Leia o texto a seguir.
Pela 1.ª vez, drogas contra intoxicação radioativa alcançam bons resultados
Remédios para tratar intoxicação por radiação devem ser aprovados nos próximos anos. Hoje
não existe nenhuma terapia para o tratamento e a prevenção dos danos fisiológicos da
radiação, cujo principal efeito é a produção de radicais livres. A radiação atinge as moléculas
de água e oxigênio abundantes no organismo e produz os radicais livres, que ao reagir alteram
diversas estruturas celulares. A maioria das novas drogas tem a finalidade de diminuir os
estragos produzidos pelos radicais livres.
(O Estado de S.Paulo, 13.02.2012. Adaptado.)
56. Em química, uma substância que tem a propriedade de diminuir os estragos produzidos
por radicais livres é classificada como um
a) antiácido.
b) hidratante.
c) cicatrizante.
d) esterilizante.
e) antioxidante.
57.
Lamentavelmente, vem ocorrendo, com frequência maior do que a desejável, o
tombamento de caminhões que transportam produtos químicos tanto em vias urbanas quanto
em rodovias. Nesses acidentes, geralmente há vazamento do produto transportado, o que
requer ações imediatas dos órgãos competentes para evitar que haja contaminação do ar, do
solo e de cursos de água.
Assim, a imediata utilização de cal (CaO) ou de calcário CaCO3 em quantidades adequadas
é recomendada quando o produto transportado pelo caminhão que sofreu o acidente for
a) amônia, NH3 .
b) ácido clorídrico, HCℓ.
c) etanol, C2H5OH .
d) oxigênio, O 2 .
e) hidrogênio, H2 .
58. Dado: Os compostos iônicos de metais alcalinos são solúveis em água.
Um técnico de laboratório distraído preparou soluções de carbonato de potássio
K 2CO3 ,
hidróxido de sódio (NaOH) e de hidróxido de cálcio Ca OH , colocando-as em três frascos
2
não rotulados (frascos X, Y e Z).
Para identificar as soluções, um aluno misturou, em três tubos de ensaio distintos, amostras de
cada frasco com solução aquosa de ácido clorídrico. Nada foi observado nas soluções dos
frascos X e Y, mas ocorreu uma efervescência no tubo que continha a solução do frasco Y.
Em seguida, o aluno combinou, dois a dois, os conteúdos de cada frasco (frascos X, Y e Z) em
tubos de ensaio limpos. Observou que só houve formação de precipitado quando misturou as
soluções dos frascos X e Y.
Assinale a alternativa que identifica corretamente o conteúdo dos frascos X, Y e Z.
a) Frasco X - Ca OH ; Frasco Y – NaOH; Frasco Z - K 2CO3 .
2
b) Frasco X – NaOH; Frasco Y – Ca OH ; Frasco Z - K 2CO3 .
2
c) Frasco X – NaOH; Frasco Y – K 2CO3 ; Frasco Z - Ca OH .
2
d) Frasco X – Ca OH ; Frasco Y – K 2CO3 ; Frasco Z – NaOH.
2
e) Frasco X - K 2CO3 ; Frasco Y - Ca OH ; Frasco Z – NaOH.
2
59. A bateria de níquel-cádmio (pilha seca), usada rotineiramente em dispositivos eletrônicos,
apresenta a seguinte reação de oxirredução
Cd s NiO2 s 2 H2O Cd OH2 s Ni OH2 s
O agente oxidante e o agente redutor dessa reação, respectivamente, são:
a) H2O , Cd OH s
2
b) NiO2 s , Cd OH s
2
c) NiO2 s , Cd s
d) Cd s , Cd OH s
2
e) NiO2 s , Ni OH s
2
60. Dada a seguinte equação de óxido-redução:
Cr OH3(aq) IO13(aq)
OH1(aq)
CrO24(aq)
I1(aq)
H2O(l)
Considerando o método de balanceamento de equações químicas por oxi-redução, a soma
total dos coeficientes mínimos e inteiros das espécies envolvidas, após o balanceamento da
equação iônica, e o agente oxidante são, respectivamente,
a) 15 e o íon iodato.
b) 12 e o hidróxido de crômio.
c) 12 e o íon hidroxila.
d) 11 e a água.
e) 10 e o íon hidroxila.
61. Em um frasco de vidro, uma certa quantidade de Ba(OH) 2.8H2O(s) e adicionada a uma
quantidade, em excesso, de NH4NO3 (s), ambos pulverizados. Quando os dois reagentes são
misturados, observa-se a ocorrência de uma reação química. Imediatamente após a reação, o
frasco e colocado sobre um bloco de madeira umedecido, permanecendo aderido a ele por um
certo período de tempo.
Escreva a equação química balanceada que representa a reação observada. Explique por que
o frasco ficou aderido ao bloco de madeira, sabendo que o processo de dissolução em água do
NH4NO3 (s) e endotérmico.
62. O fluxograma a seguir representa um processo para a produção de magnésio metálico a
2+
partir dos íons Mg dissolvidos na água do mar.
a) Preencha a tabela da página a seguir com as fórmulas químicas das substâncias que foram
representadas, no fluxograma, pelas letras A, B, C e D.
Substância
Fórmula
Química
A
B
C
D
b) Escreva as duas semirreações que representam a eletrólise ígnea do MgCl 2, identificando
qual é a de oxidação e qual é a de redução.
c) Escreva a equação química que representa um método, economicamente viável, de produzir
a substância A.
63. A hidrazina (N2H4) e o tetróxido de dinitrogênio (N2O4) formam uma mistura autoignitora
que tem sido utilizada em propulsores de foguetes. Os produtos da reação são nitrogênio e
água. Forneça a equação química balanceada para essa reação e a estrutura de Lewis para a
molécula do reagente redutor.
Dados: Números atômicos: H = 1 N = 7 O = 8
64. O sulfeto de hidrogênio (H2S) é um composto corrosivo que pode ser encontrado no gás
natural, em alguns tipos de petróleo, que contém elevado teor de enxofre, e é facilmente
identificado por meio do seu odor característico de ovo podre.
A equação química a seguir, não balanceada, indica uma das possíveis reações do sulfeto de
hidrogênio.
H2S + Br2 + H2O H2SO4 + HBr
Dado: massa molar em (g/moℓ) H = 1, O = 16, S = 32, e Br = 80.
A respeito do processo acima, é INCORRETO afirmar que
a) o sulfeto de hidrogênio é o agente redutor.
b) para cada mol de H2S consumido, ocorre a produção de 196 g de H2SO4.
c) a soma dos menores coeficientes inteiros do balanceamento da equação é 18.
d) o bromo (Br2) sofre redução.
e) o número de oxidação do enxofre no ácido sulfúrico é +6.
65. A principal fonte de energia para o funcionamento do organismo humano é a oxidação da
glicose, cuja equação global não balanceada é:
1 C6H12O6 + x O2 y CO2 + z H2O
Nessa equação, os coeficientes estequiométricos x, y e z são, respectivamente,
a) 1, 1 e 1.
b) 1, 1 e 6.
c) 3, 6 e 12.
d) 3, 6 e 6.
e) 6, 6 e 6.
66. "Se beber não dirija. Se for dirigir não beba."
K2Cr2O7(aq) 4H2SO4(aq) 3C2H5OH(v) 3C2H4O(g) K2SO4(aq) Cr2 (SO4 )3(aq) xH2O( )
Um modo simples de simular o funcionamento do bafômetro, aparelho usado para identificar
motoristas que dirigem após a ingestão de bebidas alcoólicas, consiste em borrifar álcool
(colocado, por exemplo, em uma pisseta) em uma solução de dicromato de potássio em meio
ácido, contida em um tubo de ensaio. O dicromato, que é alaranjado, em contato com o vapor
de álcool, se transforma em uma substância de cor verde, conforme a equação dada acima.
Dessa reação de oxirredução, é correto afirmar que:
a) o número de oxidação do cromo não varia.
b) o valor de x que torna a equação corretamente balanceada é 7.
c) K2SO4 é a fórmula do sal de cor verde.
d) C2H5OH e C2H4O são fórmulas da mesma substância, ou seja, do etanol.
e) o meio ácido significa que a solução tem pH > 7.
67.
O nitrogênio pode existir na natureza em vários estados de oxidação. Em sistemas
aquáticos, os compostos que predominam e que são importantes para a qualidade da água
apresentam o nitrogênio com números de oxidação - 3, 0, + 3 ou + 5. Assinale a alternativa que
apresenta as espécies contendo nitrogênio com os respectivos números de oxidação, na
ordem descrita no texto.
a) NH3, N2, NO2 , NO3 .
b) NO2 , NO3 , NH3, N2.
c) NO3 , NH3, N2, NO2 .
d) NO2 , NH3, N2, NO3 .
e) NH3, N2, NO3 , NO2 .
68. Considere as reações químicas representadas pelas equações a seguir:
I. H3CCHCH2 + HI H3CCHICH3
II. H3CCOOH + NaOH H3CCOONa + H2O
III. LiAℓH4 + 4(H3C)2CO + 4H2O 4(H3C)2CHOH + LiOH + Aℓ(OH)3
IV. C6H6ONa + CH3CH2Cℓ C6H6OCH2CH3 + NaCℓ
V. H3CCH2OH + HCℓ H3CCH2Cℓ+ H2O
Assinale a opção que apresenta as equações químicas que configuram reações de óxidoredução.
a) Apenas I e II
b) Apenas I e III
c) Apenas II e IV
d) Apenas III e IV
e) Apenas V
69. Atualmente, a humanidade depende fortemente do uso de combustíveis fósseis para
atender suas necessidades energéticas. No processo de queima desses combustíveis, além
dos produtos diretos da reação de combustão - dióxido de carbono e vapor de água -, vários
outros poluentes gasosos são liberados para a atmosfera como, por exemplo, dióxido de
nitrogênio e dióxido de enxofre. Embora nos últimos anos tenha sido dado destaque especial
ao dióxido de carbono por seu papel no efeito estufa, ele, juntamente com os óxidos de
nitrogênio e enxofre, tem um outro impacto negativo sobre o meio ambiente: a propriedade de
se dissolver e reagir com a água, produzindo o ácido correspondente, que acarreta a
acidificação das águas das chuvas, rios, lagos e mares.
a) Escreva as equações químicas balanceadas das reações de dióxido de carbono e dióxido de
enxofre com a água, dando origem aos ácidos correspondentes.
b) A chuva acidificada pela poluição reage com o carbonato de cálcio, principal componente de
rochas calcárias, provocando a dissolução lenta dessas rochas. Escreva a equação química
+
balanceada entre o carbonato de cálcio e os íons H presentes na chuva acidificada.
70.
Vendo crianças brincando, correndo, pulando e gritando, costuma-se dizer: "Quanta
energia!" A que se deve tanta energia? Deve-se, entre outras coisas, à liberação de energia,
resultado da oxidação da glicose (C6H12O6), que pode ser representada pela seguinte equação:
C6H12O6 + ....... O2 ....... CO2 + ...... H2O
Uma equação química deve representar a conservação dos átomos, portanto, essa equação
estará correta se os coeficientes que estão faltando nas lacunas forem preenchidos,
respectivamente, por:
a) 1, 1, 1.
b) 2, 6, 6.
c) 3, 3, 3.
d) 3, 2, 6.
e) 6, 6, 6.
Gabarito:
Resposta
[E]
da
questão
1:
[Resposta do ponto de vista da disciplina Biologia]
A reposição do nitrogênio atmosférico é realizada por bactérias anaeróbicas e representada no
esquema pela etapa [V].
[Resposta do ponto de vista da disciplina Química]
Desnitrificação:
NO3 ... ... N2
redução
5
0
Resposta
[D]
da
questão
2:
2KBrO3 (s) 2KBr(s) 302 (g)
2NaHCO3 (s) Na2CO3 (s) CO2 (g) H2O
Ambas as reações são de decomposição, onde um reagente se decompõe em 2 ou mais
produtos.
Resposta
[E]
da
questão
3:
[V] A Lei de Conservação das massas, de Lavosier, enuncia que em um sistema fechado, a
soma das massas dos reagentes é igual a soma das massas dos produtos, assim teremos:
CaO H2O Ca(OH)2
561874g
74g
[F] Trata-se de uma base de Arrhenius, devido à presença do ânion OH .
[V] Os coeficientes que irão balancear corretamente a reação serão:
1 CaO 1 H2O 1 Ca(OH)2
[V] Em meio básico a fenolftaleína apresenta coloração rósea.
[F] Trata-se de uma reação de adição, onde 2 reagentes formam apenas um único produto.
Resposta
[C]
da
questão
4:
[A] Incorreta. O sal formado não apresenta hidrogênio em sua fórmula.
[B] Incorreta. A reação de formação é de dupla troca.
[C] Correta. A ligação entre o sódio e o cloro é do tipo iônica, ou seja, formada entre um cátion
e um anion.
[D] Incorreta. O nox do cloro é 1:
1 1
Na C
[E] Incorreta. O NaC é formado a partir de uma reação de neutralização total.
Resposta
da
questão
5:
[D]
Teremos:
1. CaCO3 CaO(s) CO2(g) : reação de análise ou decomposição.
2. CaO(s) SO2(g) CaSO3(s) : reação de síntese ou formação.
Resposta
[C]
da
questão
6:
[A] Incorreta. Em uma reação de decomposição, haverá apenas um reagente dando origem a
dois ou mais produtos.
[B] Incorreta. Uma reação de neutralização ocorre entre um ácido e uma base.
[C] Correta.
[D] Incorreta. A reação libera 4 mols de H2 .
3Fe(s) 4H2O() Fe3O4(s) 4H2(g)
[E] Incorreta. Com base no balanceamento acima, podemos perceber que a reação consome 4
mols de H2O.
Resposta
[A]
da
questão
7:
A equação que representa uma reação de neutralização, ou seja, na qual H OH HOH ,
é:
HI aq KOH aq H2O KI aq
H aq I aq K aq OH aq H2O KIaq
Resposta
01 + 08 + 16 = 25.
da
questão
8:
Teremos:
I. SO3 H2O H2SO4 (reação de síntese ou formação ou adição; balanceada)
II. H2SO4 CaCO3 CaSO4 H2CO3 (reação de dupla troca; balanceada)
sal insolúvel
em água
III. CaSO4 NaOH Ca OH2 Na2SO 4 (reação de dupla troca; não balanceada)
Observação:
H2CO3 H2O CO2
ácido
fraco
Resposta
[B]
Teremos:
da
questão
9:
I. CuC 2 H2SO4 CuSO4 2HC (dupla troca)
Sal
II. CuSO4 2NaOH Cu OH2 Na2SO4 (dupla troca)
Base
III. Cu OH2 CuO H2O (decomposição ou análise)
Óxido
Resposta
[C]
da
questão
10:
Análise das alternativas:
[A] Incorreta. Na reação II, o oxigênio O2 age como agente oxidante, uma vez que diminui o
seu número de oxidação.
oxidante
2Mn OH2 s O2 aq 2MnO OH2 s
0
2 (redução)
[B] Incorreta. A reação I é de dupla troca.
MnSO4 aq 2NaOH aq Mn OH2 s Na2SO4 aq
AB CD AD BC (dupla troca)
[C] Correta. O I2 aq formado no processo equivale, ou seja, é proporcional
concentração de oxigênio dissolvido, o que possibilita determinar o OD na água.
1: 1
à
2MnSO4 aq 4NaOH aq 2Mn OH2 s 2Na2SO4 aq
2Mn OH2 s O2 aq 2MnO OH2 s
2MnO OH2 s 2H2SO4 aq Mn(SO4 )2(aq) 3H2O
Mn(SO4 )2(aq) 2KI aq Mn SO4 aq K 2 SO4 aq I2(aq)
I2(aq) 2Na2S2O3 aq Na2S4O6 aq 2NaI aq
De acordo com as equações:
1 O2aq 1I2(aq)
[D] Incorreta. A reação V não é de decomposição.
I2aq 2Na2S2O3aq Na2S4O6aq 2NaIaq
Resposta
[B]
da
Teremos a seguinte classificação:
questão
11:
Ordem
Equação Química
Classificação
I
3Ca OH2 aq A 2 SO4 3
II
2Mg s 1O2 g 2MgO s
III
Zn s 2HC aq ZnC 2aq H2 g
IV
NH4HCO3 s CO2 g NH3g H2O
Resposta
[D]
s 2 A OH3 s 3Ca SO 4 aq
Dupla troca
Síntese
da
Deslocamento
ou
simples
troca
Decomposição
ou análise
questão
12:
Cavendish:
Zn(s) H2SO4(aq) ZnSO4(aq) H2(g) (reação de deslocamento ou simples troca).
Priestley:
2HgO(s) 2Hg() O2(g) (reação de decomposição ou análise).
Lavoisier:
1
H2 (g) O2 (g) H2O (reação de formação ou síntese ou adição).
2
Resposta
[C]
da
questão
13:
Uma reação fotoquímica só ocorre na presença de ondas eletromagnéticas (luz) capazes de
romper as ligações químicas.
Resposta
[C]
A reação:
fabricação.
Resposta
[B]
da
CO2 H2O luz solar C6H12O6
questão
14:
representa um processo de síntese ou
da
questão
15:
Teremos:
I. 2Mg s O2 g MgO(s) (reação de síntese ou adição)
II. H2SO4(aq) CaCO3(s) CaSO4(s) H2CO3(aq) (reação de dupla troca)
III. H2CO3(aq) CO2(g) H2O( ) (reação de decomposição ou análise)
Resposta
[E]
da
Teremos:
+
–
Ionização: H3A 3H + A
+
Dissociação iônica: NaHCO3 → Na + HCO 3
–
+
Formação de ácido: HCO3 + H H2CO3
Liberação de gás carbônico: H2CO3 H2O + CO2
questão
16:
Resposta
01+ 02 + 04 + 08 + 16 = 31
da
questão
17:
Análise das afirmações:
(01) Correta. A prata metálica (Ag(s)) não reage com HCℓ.
(02) Correta. O nitrato de prata reage com o HCℓ formando AgCℓ:
AgNO3(aq) + HCℓ (aq) AgCl(s) + HNO3(aq)
(04) Correta. A reação entre o HCℓl e o hidróxido de sódio (NaOH) é de neutralização:
NaOH(aq) + HCℓ (aq) H2O(l) + NaCℓ (aq)
(08) Correta. A reação entre o zinco e o HCℓ, classificada como de simples troca ou
deslocamento, ocorre com a liberação de H2: Zn(s) + 2HCℓ (aq) H2(g) + ZnCℓ2(aq).
(16) Correta. A liberação de CO2, após a reação do HCℓ com o carbonato de sódio, ocorre pela
decomposição do ácido carbônico formado nessa reação:
Na2CO3(aq) + 2HCℓ (aq) H2O(l) + CO2(g) + 2NaCℓ (aq)
Resposta
[B]
da
questão
18:
Teremos:
SO3 g H2O H2SO4aq (reação de síntese)
H2SO4aq CaCO3 s CaSO4aq H2O CO2g (reação de dupla troca)
H2 CO3
Resposta
[D]
da
questão
19:
A reação CaCO3(s) CaO(s) + CO2(g) é de análise ou decomposição. Ela ocorre com absorção
de calor, logo é um processo endotérmico. O óxido de cálcio é básico, em água ocorre a
seguinte reação: CaO(s) + H2O(ℓ) Ca(OH)2(aq).
Resposta
[D]
da
questão
20:
Resolução:
Análise das reações fornecidas no enunciado:
I. 2 NO2 N2O4 (adição ou síntese)
São aquelas reações nas quais várias substâncias reagem (ou mais de um mol da mesma
devido ao surgimento de radicais bivalentes) formando um único produto.
II. (NH4)2Cr2O7
Cr2O3 + N2 + 4 H2O (decomposição ou análise)
São aquelas reações nas quais um único reagente se decompõe em dois ou mais produtos.
III. Zn + CuSO4 ZnSO4 + Cu (deslocamento ou simples troca)
Reações de deslocamento ou simples troca são aquelas em que um elemento mais reativo
troca de lugar com outro menos reativo.
IV. Na2CO3 + 2 HCℓ 2 NaCℓ + H2O + CO2 (dupla troca)
Reações de Dupla troca são aquelas nas quais existe a troca de ânions entre 2 reagentes.
Comentário:
No caso da reação I também podemos usar o termo dimerização, pois duas moléculas se ligam
formando uma nova substância.
Resposta
[B]
da
questão
21:
Resposta
[E]
da
questão
22:
Resposta
[C]
da
questão
23:
da
questão
24:
da
questão
25:
Teremos:
Cu(s) HNO3(aq) Cu(NO3 )2(aq) NO(g) H2O( )
oxidação
0 2
redução
5
2
Cu0 Cu2 2e
N5 3e N2
0
2
3Cu
3Cu
6e
3Cu
5
2N
3Cu(NO3 )2
2
6e 2N
2NO
Então,
3Cu(s) 8HNO3(aq) 3Cu(NO3 )2(aq) 2NO(g) 4H2O( )
Soma 3 8 3 2 4 20
Resposta
[D]
Teremos:
0
3
3
3 5
8
P4 H2O P H3 H3 P O4
P0 3e P3 (redução)
(5)
P0 P5 5e (oxidação) (3)
5P0 15e 5P3 (redução)
3P0 3P5 15e (oxidação)
2P4 12H2O 5PH3 3H3PO4
Soma 2 12 5 3 22
Resposta
[D]
Teremos:
Mg(s) 2HC(aq) H2 (aq) MgC 2 (aq)
gás
hidrogênio
Resposta
[B]
cloreto
de
magnésio
da
questão
26:
Borbulha-se gás cloro em solução aquosa diluída de hidróxido de sódio a 25 C e ocorre a
seguinte reação:
25 C
C 2 (g) 2NaOH(aq)
C
O
(aq)
2Na (aq) C (aq) H2O( )
água
ou OC (aq)
Resposta
[C]
da
questão
27:
da
questão
28:
da
questão
29:
Teremos uma reação de deslocamento ou simples troca:
agente
agente
substância
substância
redutor
oxidante
composta
simples
2Na(s) 2H2O ( ) 2NaOH (aq) 1H2 (g)
oxidação
0 1
redução
1
0
2Na0 2Na 2e
2H 2e H2
2Na(s) 2H2O ( ) 2NaOH (aq) 1H2 (g)
Soma dos coeficientes 2 2 2 1 7
Resposta
[D]
Teremos:
[Cr
)4 C 2 ]
(NH
3
x
4(0)
2( 1)
x 0 2 1
x 3
Resposta
[B]
Teremos:
[I] e [II] estão corretas.
O composto que ganha elétrons sofre redução.
O Nox do enxofre varia de +4 para +6.
2IO3 5HSO3 1I2 5SO42 3H 1H2O
agente
oxidante
agente
redutor
2I5 10 e I2 (redução)
5S4 5S6 10 e (oxidação)
Soma dos coeficientes: 2 + 5 + 1 + 5 + 3 + 1 = 17.
Resposta
[C]
da
questão
30:
O aquecimento de uma mistura de Cu2O e Cu2S em atmosfera inerte produz dióxido de
enxofre e cobre metálico.
Δ
2Cu2O(s) Cu2S(s) SO2 (g) 6Cu(s)
Resposta
Teremos:
da
questão
31:
questão
32:
(a) KO2 (s) 2H2O( ) H2O2 (g) O2 (g) 2KOH(s)
peróxido
de hidrogênio
(b) 4KO2 (s) 2CO2 (g) 3O2 (g) 2K 2CO3 (s)
dióxido
de carbono
(c) 4KO2 (s) 4CO2 (g) 2H2O( ) 3O2 (g) 4KHCO3 (s)
dióxido
de carbono
Resposta
Teremos:
da
Informações: ácido nítrico reage com metais, podendo liberar os seguintes produtos: NO (que
pode ser posteriormente oxidado na presença do ar), N 2O, NO2 ou NH3 (que reage
posteriormente com HNO3, formando NH4NO3).
a) A reação do HNO3 com o Zn será posterior formando NH4NO3:
4Zn (s) 10HNO3
4Zn(NO3 )2 (aq) 3H2O() 1NH4NO3 (aq)
muito diluído 2%
b) 4Zn (s) 10HNO3
diluído 10%
4Zn(NO3 )2 (aq) 5H2O() 1N2O(g)
ou
3Zn (s) 8HNO3
diluído 10%
3Zn(NO3 )2 (aq) 4H2O() 2NO(g)
c) Zn (s) 4HNO3concentrado Zn(NO3 )2 (aq) 2H2O() 2NO2 (g)
d) 4Sn (s) 10HNO3diluído 4Sn(NO3 )2 (aq) 3H2O( ) 1NH4NO3 (aq)
e) Ácido nítrico converte-se em ácido estânico (insolúvel em ácidos):
15Sn (s) 20HNO3concentrado 5H2O() 15H2SnO3 20NO(g)
ou
3Sn (s) 4HNO3concentrado 1H2O() 3
Resposta
[A]
da
4NO(g)
H2SnO3
SnO2 .H2O
outra
representação
questão
33:
questão
34:
Pelo método das tentativas, vem:
1
O2 2H2O (2)
2
2 NH4NO3 2 N2 1 O2 4H2O
1 NH4NO3 1 N2
Resposta
da
a) Fórmula estrutural do ácido acético:
b) Teremos:
c) Massa molares dos gases envolvidos:
CO2 44 g / mol (produzido)
O2 32 g / mol
(presentes no ar)
N2 28 g / mol
Nas mesmas condições de pressão e temperatura, a densidade de um gás pode ser dada
por:
d
M(molar )
V(molar )
Como o volume molar é o mesmo, quanto maior a massa molar, mais denso será o gás e
vice-versa.
O gás carbônico formado é mais denso do que os outros gases presentes no sistema e se
acumula na parte de baixo do recipiente.
Quando o gás carbônico alcança o pavio da vela impede o contato do gás oxigênio com o
pavio e a combustão cessa.
Com o aumento do raio do recipiente, e supondo o mesmo volume de gás carbônico (em 3
segundos), o gás se acomodará na parte de baixo do recipiente e não atingirá o pavio e a vela
continuará acessa.
Resposta
[D]
da
questão
35:
O precipitado amarelo citado no texto do enunciado é o PbI2 .
Pb C2H3O2 2 KI
PbI2 2K 2C2H3O2
precipitado
amarelo
Resposta
[D]
da
questão
36:
Teremos a seguinte reação:
CaCO3 (s) 2H (aq) H2O( )
CO2 (g)
Ca2 (aq)
efervescência
(dióxido de carbono)
Resposta
[D]
da
questão
37:
da
questão
38:
da
questão
39:
Teremos:
2Cr2O72 6H2C2O4 16H 4Cr 3 12CO2 14H2O
Oxidante
Re dutor
+6
3
3 (redução)
4 (oxidação)
Coeficientes mínimos :
1Cr2O72 3H2C2O4 8H 2Cr 3 6CO2 7H2O
Oxidante
Re dutor
Soma = 1 + 3 + 8 + 2 + 6 + 7 = 27.
Resposta
[D]
Dicromato:
Cr2O72CrCrOOOOOOO = -2
x + x -2 -2 -2 -2 -2 -2 -2 = -2
x = +6
Crômio: Cr
3+
.
Resposta
a) Termos:
Semirreação de oxidação
Cu(s) Cu (aq) 2e
Semirreação de redução
2H (aq) NO3 (aq) e H2O() NO2 (g)
b) A estudante percebeu que o cobre metálico não reagiu com a solução de ácido clorídrico,
ou seja, não reage com cátions H .
A estudante percebeu, também, que o cobre metálico não reagiu com a solução de nitrato de
sódio, ou seja, não reage com ânions NO3 .
Mas, a estudante mostrou que o cobre metálico reage com o ânion nitrato (NO3 ) em meio
ácido.
Resposta
[E]
da
questão
40:
Teremos:
MoS2 Mo( 4) S( 2) S( 2)
MoNa2O4 Mo( 6) Na( 1) Na( 1) O( 2) O( 2) O( 2) O( 2)
Resposta
[A]
da
questão
41:
Teremos:
Azul de bromotimol NaOH (azul)
H2O H2CO3
azul (básico) para verde (neutro)
H2CO3 NaOH
3 H2O
NaHCO
meio
meio
básico
neutro
Excesso de H2CO3 implica em amarelo.
CO2
gás carbônico
expirado
ácido
carbônico
Resposta
[D]
da
questão
42:
Uma alíquota de uma solução aquosa constituída de haletos (Na , F ,C , Br ) de sódio foi
adicionada a uma solução aquosa de nitrato de prata (Ag , NO3 ), com formação de um
precipitado:
Na (aq) F (aq) Ag (aq) NO3 (aq) Na (aq) F (aq) Ag (aq) NO3 (aq)
Na (aq) C (aq) Ag (aq) NO3 (aq) Na (aq) NO3 (aq) AgC(s)
precipitado
Na (aq) Br (aq) Ag
(aq) NO3 (aq)
Na
(aq) NO3 (aq)
AgBr(s)
precipitado
Na (aq) I (aq) Ag
(aq) NO3 (aq)
Na
(aq) NO3 (aq)
AgI(s)
precipitado
Ordem crescente de solubilidade: AgI AgBr AgC.
À mistura contendo o precipitado, foi adicionada uma alíquota de solução aquosa diluída de
hidróxido de amônio, que dissolve o AgC :
NH4 (aq) OH (aq) AgC(s) Ag(NH3 )2 C
NH3 H2O
Ag(NH3 )2 C
NH3 H2O Ag(NH3 )2 C
NH4 (aq) OH (aq) AgBr(s) Ag(NH3 )2 Br
NH3 H2O
Ag(NH3 )2 Br
NH3 H2O Ag(NH3 )2 Br
Conclusão: O AgI é o haleto presente no precipitado.
Resposta
da
questão
Um registro fotográfico de impressão digital seria formado por prata sólida.
Então, teremos:
43:
NaC(aq) AgNO3 (aq) NaNO3 (aq) AgC(s)
Pr esente
no suor
Pr ecipitado
2AgC(s) 2Ag(s) C 2 (g)
Re gistro
da digital
Resposta
[A]
da
questão
44:
A transformação química em questão se dá pela reação entre ácido acético (CH3COOH),
presente no vinagre, e bicarbonato de sódio (NaHCO3 ) , presente no balão. O gás liberado é o
CO2 (gás carbônico):
CH3COOH(aq)
ácido acético
Na (aq) CH3COO (aq)
NaHCO3 (s)
bicarbonato de sódio
CO2 (g)
H2O()
gás carbônico
Resposta
da
questão
45:
a) O hidróxido de cálcio hidratado (cal hidratada) produz um filme que é utilizado na
proteção de superfícies de alvenaria, de acordo com a seguinte equação química:
Ca(OH)2 (aq) CO2 (g) CaCO3 (s) H2O( )
filme
b) Equação química do processo de produção industrial da cal hidratada:
Calcinação
1000 C;
CaCO3 (s)
CaO(s) CO2 (g)
CaO(s) H2O( ) Ca(OH)2 (aq)
cal viva
ou
cal virgem
cal hidratada
Resposta
[D]
da
Teremos:
NH4 C (aq) KOH
(aq) NH3 (g) H2O( ) KC(aq)
NH3HC
K OH
questão
46:
Resposta
[D]
da
questão
47:
questão
48:
A equação da reação devidamente balanceada é:
2ZnS s 3O2 g 2ZnO s 2SO2 g
Resposta
da
Equação completa dessa transformação química:
BaC 2 (aq) MgSO4 (aq) BaSO4 (s) MgC 2 (aq) .
Substituindo a solução de cloreto de bário por NaOH(aq):
2NaOH(aq) MgSO4 (aq) Mg(OH)2 (s) 2NaC(aq)
suspensão
"precipitado"
Conclusão: A mesma imagem pode ser utilizada, pois em ambos os casos é formado um
precipitado branco.
Observação: Na verdade o que ocorre com a substituição do cloreto de bário pelo hidróxido de
sódio é a formação de uma suspensão. Mas toma-se “no ensino médio” a expressão
precipitado, o que não está totalmente correto. Isto não impede que o aluno responda à
questão.
Resposta
[E]
da
questão
49:
A aplicação do ácido muriático em resíduos contendo quantidades apreciáveis de CaCO 3
resulta na liberação de gás carbônico:
2HC(aq) CaCO3 (s) H2O() CO2 (g) CaC 2 (aq)
O teste deve ser feito com uma base que produza um sal insolúvel:
CO2 (g) Ba(OH)2 (aq) BaCO3 H2O( )
Resposta
[C]
da
questão
50:
Teremos:
N2H4
NaNH2
Na
N
H
H
H
K 2N2O2
H
N
N
H
H
K
K
N
1 3 1 1 0
1 1 2 2 1 1
1 1 1
Na 1
N 3
H 1
H 1
N 2
K 1
N 1
O 2
N
O
O
1 2 2
Na2NO2
Na
1
NI3 (2 possibilidades)
Na
N
1 2
O
O
2 2
Na 1
N 2
O 2
N
I
I
I
3 1 1 1
N 3
I 1
ou
N
I
I
I
3 1 1 1
N 3
I 1
Observação:
Poderíamos ter, também, a seguinte ordem: NI3 NaNH2 N2H4 K2N2O2 Na2NO2 .
Resposta
[B]
da
questão
51:
Teremos:
CrI3 C 2 OH1 IO14 CrO24 C1 H2O
+3
1
0
6 (oxidação; cromo)
7 (oxidação; iodo)
1 (redução; cloro)
Cr 3 Cr 6 3e
3I1 3I7 24e
C 1e C1
C 1e C1
(1CrI3
Cr 3 Cr 6 3e
3I1 3I7 24e
3C 3e 3C1
24C 24e 24C1
27
C 2 32OH1 3IO14 1CrO24 27C1 16H2O) 2
2
2CrI3 27C 2 64OH1 6IO14 2CrO24 54C1 32H2O
Soma = 02 + 27 + 64 + 06 + 02 + 54 + 32 = 187.
O cromo ou (crômio) e o iodo sofrem oxidação.
Resposta
[C]
da
questão
52:
O alumínio metálico presente nas latinhas de refrigerante apresenta Nox igual a zero (A0 ).
A pedra-ume o alumínio está presente na forma de cátions (A3 ), neste caso o Nox é +3.
Resposta
[C]
da
questão
Partindo-se de 1 mol de Ca3 PO4 2 , pelo método das tentativas, vem:
53:
1Ca3 PO4 2 (s) 2H2SO4 () 4H2O() 1Ca H2PO4 2 (s) 2CaSO4 2H2O(s)
Soma = 1 + 2 + 4 + 1 + 2 = 10.
Resposta
[C]
da
questão
54:
Teremos:
A queima de combustнveis fуsseis й uma das principais fontes de poluentes causadores da chuva бcida.
Tanto o carvгo mineral quanto os derivados de petrуleo de maior peso molecular (como o уleo diesel)
apresentam teores relativamente elevados de enxofre (S), gerando o diуxido de enxofre (SO2) durante a
combustгo. A reaзгo entre o oxigкnio atmosfйrico e diуxido de enxofre (SO2) pode formar o gбs
triуxido de enxofre (SO3), outro poluente atmosfйrico. A reaзгo entre triуxido de enxofre (SO3) e a
бgua produz o бcido sulfъrico (H2SO4), responsбvel pelo abaixamento do pH da chuva.
S O2 SO2
1
O2 SO3
2
SO3 H2O
H2SO4
SO2
pH diminui
devido à
liberação de H
Resposta
[D]
da
questão
55:
questão
56:
Teremos:
agente
redutor
3
O2 (g) 3CO(g) calor
2
(0) ( 2) (oxidação)
3C(s)
agente
oxidante
Fe2O3 (s) 3CO(g) 3CO2 (g) 2Fe(s)
( 3) (0) (redução)
Resposta
[E]
da
Em química um radical livre é um átomo ou molécula que possui elétrons em quantidade ímpar
ou desemparelhados e são altamente reativos.
Exemplos: ânion superóxido (O2 ) , o óxido nítrico (NO ) e o radical hidroxila (OH) .
Devido às suas características um radical livre pode receber um elétron para “emparelhar” o
elétron “livre”, ou seja, sofre redução e consequentemente é um agente oxidante.
Uma substância que tem a propriedade de diminuir os estragos produzidos por radicais livres
precisa se combinar com o radical livre, e neste caso, a substância é classificada com
antioxidante.
Resposta
[B]
da
A imediata utilização de cal (CaO) ou de calcário
questão
CaCO3 em
57:
quantidades adequadas é
recomendada quando o produto transportado pelo caminhão que sofreu o acidente tiver caráter
ácido:
2HC CaO CaC 2 H2O
ou
2HC CaCO3 CaC 2 H2O CO2
Resposta
[D]
da
questão
58:
A solução do frasco Y (K 2CO3 ) reage com HC. A efervescência observada decorre da
liberação de gás carbônico (CO2 ): K2CO3 (aq) 2HC(aq) CO2 (g) H2O() 2KC(aq).
A solução do frasco X (Ca(OH)2 ) reage com a solução do frasco Y (K 2CO3 ). A formação de
precipitado
se
deve
à
formação
de
carbonato
de
cálcio
(CaCO3 ):
Ca(OH)2 (aq) K 2CO3 (aq) CaCO3 (s) 2KOH(aq)
precipitado
A solução do frasco Z é de hidróxido de sódio (NaOH).
Resposta
[C]
da
questão
59:
questão
60:
Teremos:
redutor oxidante
Cd s NiO2 s 2 H2O Cd OH2 s Ni OH2 s
0 oxidação 2
4 redução 2
Resposta
[A]
Teremos:
da
(redutor)
(oxidante)
Cr OH3(aq) IO13(aq)
OH1(aq)
CrO24(aq)
I1(aq)
H2O(l)
3
2Cr
5
( 3)
(5 )
2Cr
( 6)
6
6e
1
( 1)
I
6e I
Então,
2Cr OH3(aq) 1IO13(aq)
xOH1(aq)
2CrO24(aq)
1I1(aq)
yH2O(l)
0 1 x 2( 2) 1 y 0
x4y5
ou seja,
2Cr OH3(aq) 1IO13(aq)
4OH1(aq)
2CrO24(aq)
1I1(aq)
5H2O(l)
Soma 2 1 4 2 1 5 15
Resposta
da
questão
A equação química balanceada que representa a reação observada pode ser dada por:
61:
Ba(OH)2 .8H2O(s) NH4NO3(s) Ba(NO3 )2(aq) 2NH3(g) 10H2 O( )
Como o processo de dissolução em água do nitrato de amônio (NH 4NO3) é endotérmico, ocorre
absorção de calor da água presente na madeira que solidifica e adere ao frasco.
Resposta
a) No fluxograma:
Teremos:
da
questão
62:
A + H2O Ca(OH)2
A = CaO, então:
CaO + H2O Ca(OH)2
Mg (aq) + Ca(OH)2 Ca (aq) + B (precipitado)
B = Mg(OH)2, então:
2+
2+
Mg (aq) + Ca(OH)2 Ca (aq) + Mg(OH)2
2+
2+
B + D água + MgCl2
B = Mg(OH)2 e D = HCl, então:
Mg(OH)2 + 2HCl 2H2O + MgCl2
MgCl2
C = Cl2, então:
Mg(s) + C + subprodutos
MgCl2
Mg(s) + Cl2 + subprodutos
H2 + C D
C = Cl2 e D = HCl
H2 + Cl2 2HCl
A tabela será preenchida da seguinte maneira:
Substância A
B
C
Fórmula
CaO
Mg (OH)2 CI2
química
b)
Eletrólise
ígnea
(+)
2Cl (l)
2e
2+
(–) Mg (l) + 2e Mg(s) (redução/cátodo)
D
HCI
do
Cl2(g)
+
MgCl2(s):
(oxidação/ânodo)
c) Um método economicamente viável para produzir a substância A é a calcinação do CaCO 3:
CaCO3(s)
CaO(s) + CO2(g)
Resposta
da
A equação química será dada por:
questão
63:
2N2H4 + N2O4 3N2 + 4H2O
No N2H4 o número de oxidação do nitrogênio é – 2.
No N2 o número de oxidação do nitrogênio é + 2.
Isto significa que o nitrogênio sofre oxidação, logo o N2H4 é o agente redutor.
A estrutura de Lewis para o N2H4 pode ser representada por:
Resposta
[B]
da
A partir da reação fornecida, vem:
questão
64:
S S +8e
0
1Br + 1 e Br
2-
6+
-
Multiplicando a segunda equação por 8, teremos:
26+
S S +8e
0
18Br + 8 e 8Br
Então,
1H2S (redutor) + 4 Br2 + 4H2O 1H2SO4 + 8HBr
1 mol H2S --------------------------------- 1 mol H2SO4
1 mol H2S --------------------------------- 98 g de H2SO4
Concluímos que é incorreto o que se afirma na alternativa B.
Resposta
[E]
da
questão
65:
questão
66:
Teremos:
1 C6H12O6 + 6 O2 6 CO2 + 6 H2O
Resposta
[B]
da
Observe o balanceamento por oxirredução da principal reação do fenômeno observado:
Comentário:
É importante conhecermos as regras práticas para a determinação do Nox:
1ª.) Nas substâncias simples o Nox é zero.
2ª.) Em íons monoatômicos (um único elemento químico) a carga do íon é o próprio Nox.
3ª.) Para a maior parte dos compostos H = +1 e O = – 2.
4ª.) Nos hidretos metálicos (compostos que apresentam ligação iônica entre um metal e
hidrogênio): H = – 1.
5ª.) Nos peróxidos (compostos nos quais a carga do oxigênio é igual a – 1): O = – 1.
Exemplo:
6ª.) Metais alcalinos (família IA): Nox = +1.
7ª.) Metais alcalinos terrosos (família IIA): Nox = +2.
8ª.) Flúor: Nox = – 1.
9ª.) Alumínio: Nox = +3.
10ª.) Zinco: Nox = +2.
11ª.) Prata: Nox = +1.
Resposta
[A]
da
questão
67:
Resposta
[E]
da
questão
68:
Resposta
da
questão
69:
H2CO3(aq)
H (aq) + HCO3(aq)
a) CO2(g) + H2O(ℓ)
+
H2SO3(aq)
H+(aq) + HSO3(aq)
SO2(g) + H2O(ℓ)
2+
2
+
2+
b) Ca CO3 (s) + 2H (aq) Ca (aq) + H2O(ℓ) + CO2(g)
Resposta
[E]
da
questão
70: