QUIMICA ORGANICA BÁSICA
QMC 160 Prof Hugo Braibante _ UFSM
ANÁLISE CONFORMACIONAL
QMC 160 Prof Hugo Braibante _ UFSM
Química - UFSM
Fundamentos Eletrônicos da Estrutura Molecular
Estrutura molecular pode ser discutido em termos de distância intramolecular entre dois
átomos A e B
d
f
A e B são adjacentes
A e B são geminais
A e B são vicinais
1ligação - d distância
ligação
d distância e
- Ângulo entre ligações
3 Ligações
d distância
- Ângulo entre ligações
Ângulo diedro
3 dimensões
1 dimensão
Monodimensional
2 dimensões
Bidimensional
Tridimensional
Prof. Hugo Braibante - UFSM
Fundamentos Eletrônicos da Estrutura Molecular
Objetivo principal: Entender como forças intramoleculares tornam alguns arranjos espaciais energeticamente
mais favoráveis do que outros.
Ligações s e Rotação de Ligação:
i) Grupos ligados por apenas uma ligação s (sigma) podem sofrer rotações em torno desta ligação.
ii) Conformação : Qualquer arranjo tridimensional de átomos que resulta da rotação em torno de uma ligação
simples é chamado de conformação
iii) análise Conformacional: Uma análise da variação de energia que a molécula sofre com os grupos girando
em torno de uma ligação simples
Alternada
Eclipsada
Lembrar sempre: Moléculas orgânicas são objetos tridimensionais.
Prof. Hugo Braibante - UFSM
Estrutura Molecular
Projeção de Newman:
Projeção de Newman Vista Frontal
Vista Posterior
H
H
H
H
H
H
H
H
H
H
C
H
H
H
H
Prof. Hugo Braibante - UFSM
Estrutura Molecular
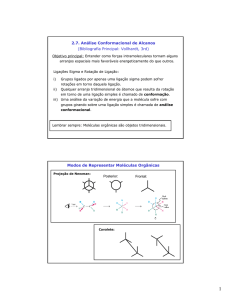
Modos de Representar Moléculas Orgânicas
X
Kenneth Pitzer
1936
Derek Barton
Nobel 1969
HOD HASSEL
Nobel 1969
Selo
Confôrmeros
Nobel 1969
X
Me
Existe um numero infinito de conformações geradas pela rotação em torno da ligação s.
Pitzer (1936) demonstrou que esta rotação não é totalmente livre, sendo que existe uma barreira energética (2,9
Kcal/mol no etano). Esta energia resultando do eclipsamento dos Hidrogênios quando o confôrmero apresenta
ângulo diedro de 0, 120 e 240º, energia denominada de energia torsional ou tensão de Pitzer.
Me
Barton e Hassel (1950) demonstraram a importância da consequência química das conformações,
principalmente dos Confôrmeros resultante de substituintes em moléculas cíclicas. Estas
considerações levaram estes pesquisadores ao Nobel de química em 1969.
Prof. Hugo Braibante - UFSM
Estrutura Molecular
Modos de Representar Moléculas Orgânicas
De acordo com o ângulo diedro, os grupos podem ser classificados
em Eclipsados (sp e ac), Gauche (sc) e Anti (ap)
No butano os dois grupos Metilas são usados como referência e pode variar de 0 a 360º. É conveniente
dividirmos o círculo em semicírculos sin (juntos) e anti (opostos) e em setores periplanar (quase plano) e
clinal (inclinado).
Eclipsados
Ângulo torsional 0º
Gauche
Anti
60º
180º
Prof. Hugo Braibante - UFSM
Estrutura Molecular
Modos de Representar Moléculas Orgânicas
De acordo com o ângulo diedro, os grupos podem ser classificados
em Eclipsados (sp e ac), Gauche (sc) e Anti (ap)
No butano os dois grupos Metilas são usados como referência e pode variar de 0 a 360º. É conveniente
dividirmos o círculo em semicírculos sin (juntos) e anti (opostos) e em setores periplanar (quase plano)
e clinal (inclinado).
sin
anti
sp
sc
ac
sc
ac
ap
clinal
clinal
Prof. Hugo Braibante - UFSM
Análise Conformacional
Análise Conformacional do Etano
i) Conformação mais estável é a conformação alternada. Ocorre a máxima separação possível dos pares de elétrons das
seis ligações C-H.
ii) Conformação menos estável é a conformação eclipsada. Requer a interação repulsiva máxima entre os elétrons das
seis ligações C-H.
Alternada
Eclipsada
Alternada
Lembrar que: maior energia → menor estabilidade
Prof. Hugo Braibante - UFSM
Análise Conformacional
Análise Conformacional
Efeitos estéreo-eletrônicos que influenciam na estabilidade dos Confôrmeros
i) Repulsão dos pares de elétrons s (sigma) quando eclipsados. Conformação mais estável é a conformação
alternada. Ocorre a máxima separação possível dos pares de elétrons das seis ligações C-H.
ii) Impedimento Estérico (ou espacial). Volume dos substituintes tendendo a ocupar o mesmo espaço aumenta a
energia. Conformação menos estável é a conformação eclipsada.
iii) Estabilização pela interação sCH //s*CH
Alternada
Eclipsada
Alternada
Lembrar que: maior energia → menor estabilidade
Prof. Hugo Braibante - UFSM
Análise Conformacional
Análise Conformacional
Efeitos estéreo-eletrônicos que influenciam na estabilidade dos Confôrmeros
i) Repulsão dos pares de elétrons s (sigma) quando eclipsados. Conformação mais estável é a conformação
alternada. Ocorre a máxima separação possível dos pares de elétrons das seis ligações C-H.
ii) Impedimento Estérico (ou espacial). Volume dos substituintes tendendo a ocupar o mesmo espaço aumenta a
energia. Conformação menos estável é a conformação eclipsada.
iii) Estabilização pela interação sCH //s*CH
Repulsão sCH//sCH
Estabilização sCH//s*CH
H
C1
C2
H
Alternada
Eclipsada
Es*C2H
EsC1H
Ess*
Prof. Hugo Braibante - UFSM
Análise Conformacional
Análise Conformacional do Etano
i) Conformação mais estável é a conformação alternada. Ocorre a máxima separação possível dos pares de
elétrons das seis ligações C-H.
ii)
Conformação menos estável é a conformação eclipsada. Requer a interação repulsiva máxima entre os
elétrons das seis ligações C-H
Prof. Hugo Braibante - UFSM
Análise Conformacional
Análise Conformacional do Etano
Energia Conformacional
G = -RTlnK
G = -RTlnK
G = - 2,303 RT.log K
R = 1,98 T =ta ºK
G = -1,36. logK
G = -1,36. logK
Conhecendo G:
0,9 = -1,36.log K 0,66 = -logK
OP {2nF} {10x} -0,66 { =}
K = 0,22
[%] = (1/1+K) (100) = maior concentração (1/1,22).(100) = 82%
[%] = (K / 1+K) . (100) = menor concentração (0,22/1,22) (100) = 18%
Estabilização sCH//s*CH
Repulsão sCH//sCH
Eclipsada
Alternada
Prof. Hugo Braibante - UFSM
Análise Conformacional - Etano
Diferença de energia entre as duas conformações do etano: 2,87 Kcal/mol (12 KJ/mol).
Esta diferença de energia é chamada de energia torsional.
Ea = 2,8 Kcal.mol-1
Na temperatura ambiente: 100 da conformação alternada pra 1 da eclipsada.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Etano
Diferença de energia entre as duas conformações do etano: 3 Kcal/mol (12 KJ/mol).
Esta diferença de energia é chamada de energia torsional.
Na temperatura ambiente: 100 da conformação alternada pra 1 da eclipsada.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Propano
Diferença de energia entre as duas conformações do propano: 3,1 Kcal/mol (13 KJ/mol).
Esta diferença de energia é chamada de energia torsional.
Me
H
Me
H
Girar 60º
Prof. Hugo Braibante - UFSM
Análise Conformacional - Propano
Diferença de energia entre as duas conformações do propano: 3,1 Kcal/mol (13 KJ/mol).
Esta diferença de energia é chamada de energia torsional.
Me
H
Me
H
Conhecendo G: = 3,1 Kcal/mol
3,1 = -1,36.log K 2,28 = -logK
OP {2nF} {10x} -2,28 { =}
K = 5,2 x 10-3
[%] = 1/1+K. (100) = (1/1,0052.(100) = 0.99 %
[%] = K / 1+K . (100) = (100 0,99) = 99,01%
Na temperatura ambiente: 100 conformações alternadas para 1conformação eclipsada.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Propano
Diferença de energia entre as duas conformações do propano: 3,3 Kcal/mol .
Esta diferença de energia é chamada de energia Torsional ou tensão de Pitzer
Na temperatura ambiente: 100 conformação alternada pra 1 conformação eclipsada.
Prof. Hugo Braibante - UFSM
E (Kcal/mol)
Análise Conformacional do Butano
Diferença de Energia
Entre as conformações
Angulo Diedro
Comparação entre conformações gauche (C) e anti (A)
D
C
B
A
B
C
D
Prof. Hugo Braibante - UFSM
Análise Conformacional do Butano
Temperatura de 25°C: 72% anti e 28% gauche.
Importante: As barreiras de rotação na molécula do butano e do etano são pequenas demais para permitir o isolamento dos confôrmeros
em temperaturas próximas ao ambiente. Podemos considerar que a rotação das ligações é livre.
Prof. Hugo Braibante - UFSM
Análise Conformacional do Butano
Temperatura de 25°C: 72% anti e 28% gauche.
Importante: As barreiras de rotação na molécula do butano e do etano são pequenas demais
para permitir o isolamento dos confôrmeros em temperaturas próximas ao ambiente.
Podemos considerar que a rotação das ligações é livre.
G = -RTlnK
G = - 2,303 RT.log K
R = 1,98 T =ta ºK (298)
G = -1,36. logK
K=0,22
G = - 2,303 RT.log K G = -1,36. logK se anti // gauche = 0,9
0,9/1,36 = -log K ou 10-0,66 ou K = 0,22
% = 100. (1/1+K)
% = 100. (1/1+0,22)
% = 100. (1/1,22)
%=18% e 82%
No slide anterior afirmamos que população dos confôrmeros era de 28% gauche e 72% anti.
% = 100. (1/1+0,22 +0,22)
% = 100. (1/1+0,44) = 71,5%~72%
Existe uma conformação anti e duas conformações vicinais (gauche) distintas.
Efeito entrópico G = H - TS
Equilíbrio
G = -RTlnK
Prof. Hugo Braibante - UFSM
Análise Conformacional do Butano
Temperatura de 25 °C: 72% anti e 28% gauche.
Importante: As barreiras de rotação na molécula do butano e do etano são pequenas demais para permitir o isolamento dos confôrmeros
em temperaturas próximas ao ambiente. Podemos considerar que a rotação das ligações é livre.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Acíclicos
Estabilidade Relativa : Tensão Torsional ou tensão de Pitzer
Uma estimativa das interações eclipsadas
H/H eclipsada : 0,9 kcal/mol
H/Me eclipsado: 1,4 kcal/mol
Me/Me eclipsado: 3,8 kcal/mol
Me/Me gauche : 0,9 kcal/mol
baseado nos números da barreira de 2,9 kcal / mol no etano.
PROJEÇÃO DE NEWMAN
anti
periplanar
plano
sin
anti
clinal
angulo
sin
"gauche"
Prof. Hugo Braibante - UFSM
Análise Conformacional - Acíclicos
Estabilidade Relativa : Tensão Torsional
Uma estimativa das interações eclipsadas
H/H eclipsada : 0,9 kcal/mol
H/Me eclipsado: 1,4 kcal/mol
Me/Me eclipsado: 3,8 kcal/mol
Me/Me gauche : 0,9 kcal/mol
valores baseado nos números da barreira de 2,9 kcal/mol no etano.
Converter para Kcal/mol
Prof. Hugo Braibante - UFSM
Análise Conformacional - Acíclicos
Estabilidade Relativa : Tensão Torsional
Haloalcanos
1-clorobutano
H
Et
Et
H
H
H
Cl
H
H
H
H
Cl
Mais estável
1,3Kj/mol (0,31 Kcal/mol)
H
CH3
H
CH3
H
H
CH2Cl
H
H
H
ClH2C
H
Mais estável
1,7Kj/mol (0,4 Kcal/mol)
Efeito Espacial
Efeito anomérico
CH 3
Cl
CH2Cl
CH3
Cl
C2 H5
CH 3
CH2Cl
H
Maior interação
sC-H//s*C-Cl
Maior repulsão e
Impedimento estérico
Prof. Hugo Braibante - UFSM
Análise Conformacional - Acíclicos
Estabilidade Relativa : Tensão Torsional
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cíclicos
Estabilidade Relativa dos Cicloalcanos: Tensão de Anel
Os cicloalcanos diferem em suas estabilidades relativas.
O cicloalcano mais estável é o cicloexano.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cíclicos
Calor de Combustão
O calor de combustão de um composto é a variação de entalpia na oxidação completa do composto, ou seja, a energia
liberada.
Tensão Hidrocarbonetos Cíclicos
Anel ΔH exp (-) ΔH/CH2(-) Tensão CH2
3
499
166,6
9,2
4
655
164,0
6,6
5
793
158,7
1,3
6
944
157,4
zero
7
1108
158,3
0,9
8
1269
158,6
1,2
9
1429
158,8
1,4
10
1586
158,6
1,2
11
1742
157,7
0,3
Tensão anel
27,2
26,3
6,5
Zero
6,3
10,0
12,9
12,0
3,3
Classificação
Pequeno
Comuns
Médios
Incremento regular de 157,4 Kcal mol-1 por cada grupo CH2 adicional. Assim, para cicloalcanos (cuja fórmula geral é (CH2)n
esperaríamos que
ΔH° = - (n X 157,4) Kcal mol-1
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cíclicos
Prof. Hugo Braibante - UFSM
Origem da Tensão de Anel no Ciclopropano
Razões da tensão de anel do ciclopropano:
i) Tensão angular: Energia necessária para distorcer os carbonos tetraédricos de modo a permitir a sobreposição
dos orbitais. Notar que não é possível uma sobreposição dos orbitais sp3 dos átomos de carbono de maneira tão
eficiente quanto em outros alcanos.
ii) Tensão torsional: hidrogênios eclipsados.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Ciclobutano
Origem da Tensão de Anel no Ciclobutano
Ciclobutano possui tensão de anel como o ciclopropano.
No ciclobutano, a distorção da planaridade diminui a tensão Torsional com relação ao ciclopentano. Tensão angular
também é menor do que no ciclopropano.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Ciclopentano
Análise Conformacional do Ciclopentano
A tensão de anel no ciclopentano é menor do que no ciclopropano e no ciclobutano.
No ciclopentano, a conformação mais estável é a envelope.
A conformação tipo envelope diminui a tensão torsional. A planaridade iria introduzir considerável tensão torsional,
pois todos os 10 átomos de hidrogênio estariam eclipsados.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional do Cicloexano: Conformações Possíveis
Conformação tipo cadeira: não tem tensão angular nem torsional.
Arranjo alternado dos substituintes na conformação cadeira:
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Átomos de Hidrogênio Axial e Equatorial
No cicloexano observamos dois tipos de hidrogênio:
a) 6 ligações C-H axiais
b) 6 ligações C-H equatoriais
Eixo de simetria
Prof. Hugo Braibante - UFSM
Análise Conformacional – Conformação Cadeira
conformação em cadeira
conformação em cadeira
Vista no plano da ligação
Projeção de Newman
Prof. Hugo Braibante - UFSM
Análise Conformacional – Conformação Cadeira
Desenhar conformação em cadeira
- passo a passo
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional do Cicloexano:
Como Desenhar conformação do Cicloexano
esqueleto
Paralelas ponto acima e abaixo plano
Posição Axial
Posição Equatorial
Perpendicular ao plano
paralela ao plano
Vértices p/ cima
paralela ao plano
Ver ligação adjacente
Unir os pontos
Vértices p/ baixo
paralela ao plano
Ver ligação adjacente
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional do Cicloexano:
Como Desenhar conformação do Cicloexano
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
A Conformação tipo barco:
i) não tem tensão angular, mas tem tensão torsional.
ii) Tem energia mais elevada do que a conformação cadeira.
Eclipsado
Conformação em barco
Conformação em barco simétrica
Eclipsado
Projeção de Newman
Barco
Barcotorcido
torcido
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional do Cicloexano: Conformações Possíveis
Conformação tipo barco:
i) não tem tensão angular, mas tem tensão torsional.
ii) Tem energia mais elevada do que a conformação cadeira.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional do Cicloexano: Conformações Possíveis
Conformação barco torcido é mais estável
do que a barco, já que a tensão torsional é menor.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Energia Conformações do Cicloexano
Como a conformação cadeira é mais estável do que as outras, mais de
99% das moléculas estão em um dado instante na conformação cadeira.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Energia Conformações do Cicloexano
Como a conformação cadeira é mais estável do que as outras, mais de
99% das moléculas estão em um dado instante na conformação cadeira.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Átomos de Hidrogênio Axial e Equatorial
Quando passamos de cadeira para outra, todas as ligações que eram axiais se tornam
equatoriais e vice-versa.
Temperatura ambiente: 100.000 conversões por segundo!
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional do Cicloexano:
Conformações do Metilcicloexano: Interação 1,3-Diaxial
A conformação com o grupo metila em equatorial é cerca de 1,8 Kcal/mol mais estável do que aquela
com a metila em axial.
Na temperatura ambiente, 95% das moléculas do metilcicloexano estão na conformação com a metila
em equatorial.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Conformações do Metilcicloexano
A tensão causada pela interação 1,3-diaxial no metilcicloexano é similar àquela causada pela
proximidade dos átomos de hidrogênio dos grupos metila na forma gauche do butano.
Equatorial ; Y
Axial ; Y
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional do Cicloexano:
Conformações do t-Butilcicloexano
A conformação do t-butilcicloexano com o grupo t-butila na posição equatorial é 5 kcal/mol mais estável do que
conformação com o grupo axial.
Me
~
Me
Me
Na temperatura ambiente, 99,99% das moléculas possuem o grupo t-butila na posição equatorial.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional do Cicloexano Substituídos
Energia Axial x Equatorial
A conformação do t-butilcicloexano com o grupo t-butila equatorial é 5 kcal/mol mais estável do que conformação
com o grupo axial.
O valor de ∆G é chamado valor A
Grupo
∆G Kcal/mol
Grupo
∆G Kcal/mol
Metila
1,8
COOH
1,4
Etila
2,0
NH2
1,2
i-Propíla
2,2
HO-
1,0
Fenila
t Butila
2,9
Cl, Br, I-
0,5
4,9
F, C≡N, -C≡CR
0,2
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional de Cicloalcanos Dissubstituídos
Exemplo 1: trans-1,4-Dimetilcicloexano: 99% das moléculas em diequatorial.
Diferença de energia: 3,4 Kcal/mol.
Exemplo 2: cis-1,4-Dimetil cicloexano: As duas conformações tipo cadeira são equivalentes.
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional de Cicloalcanos Dissubstituídos
Quando um grupo alquila é maior do que o outro, a conformação mais estável será aquela em que o grupo mais
volumoso encontra-se na posição equatorial. Desenhe a estrutura em cadeira
Exemplo: trans-1-t-butil-3-metilcicloexano
OH
t-Bu
cis
t-Bu
trans
HO
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional de Cicloalcanos Dissubstituídos
Quando um grupo alquila é mais volumoso do que o outro, a conformação mais estável será aquela em
Grupo
∆G Kcal/mol
que o grupo mais volumoso encontra-se na posição equatorial.
Metila
1,8
Exemplo: trans-1-t-butil-3-metilcicloexano calcule o Keq
Etila
2,0
i-Propíla
2,2
Fenila
2,9
t Butila
4,9
Prof. Hugo Braibante - UFSM
Análise Conformacional - Cicloexano
Análise Conformacional de Cicloalcanos
Calcule o Gº de equilíbrio entre os Confôrmeros
a) 1-etil-1-metil cicloexano
b) cis-1-etil-4-metil cicloexano
c) trans-1-etil-4-metil cicloexano
Prof. Hugo Braibante - UFSM
Bibliografia
1) Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 18.
2) 2) Organic Chemistry: Structure and Function, K. Peter C. Vollhardt, Neil E. Schore, W. H.
Freeman; 5th edition, 2005, cap. 2 e 4.
3) Introdução a Estereoquímica e a análise Conformacional, Eusébio Juaristi e Hélio Stefani,
Bookman, POA, 2012
4) Fundamentos de Estereoquímica dos Compostos Orgânicos, J. Ricardo Romero, Holos Ed. 1998
5) Química Orgânica , Paula Y Bruice, 4ed. Vol.1, Pearson, SP, 2006
Prof. Hugo Braibante - UFSM
53
Anotações
Prof. Hugo Braibante - UFSM
54