Tabela Periódica com Z = 1, configuração eletrônica 1s1, MA =
1,008, d = 0,0899 g.L-1, PF = - 259,14 °C, PE = -252,87 °C. Foi
descoberto em 1776 por Henry Cavendish. É o elemento de menor
número atômico e o mais abundante no Universo. Na Terra está
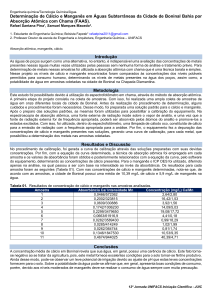
presente no ar, na água e em todos os compostos orgânicos. Tem
três isótopos, cada um deles com 0, 1 ou 2 nêutrons. O hidrogênio
ocorre naturalmente como o isótopo 1H (98,985%) ou 2H (deutério).
O isótopo com 2 nêutrons (trítio) é produzido artificialmente. Na
forma elementar ele ocorre como o gás H2, que é produzido
industrialmente por eletrólise da água ou por reforma de gás
natural. Ele é muito usado na produção de amônia (processo Haber)
e como agente redutor na industrialização de minérios, no
refinamento de petróleo, na produção de hidrocarbonetos a partir
de carvão e na hidrogenação de óleos vegetais. Também há grande
interesse no uso de H2 como combustível pois a sua combustão com
oxigênio produz água.
Oxigênio O. Elemento gasoso, incolor, inodoro, pertencente ao
Grupo VI da Tabela Periódica. Z = 8, configuração eletrônica: 1s2
2s2 2p4; MA = 15,9994, d = 1,429 g.L-1, PF = -214,4°C, PE = -183°C. É
o elemento mais abundante na crosta terreste (49,2% em peso) e
está presente na atmosfera (28% em volume). O oxigênio
atmosférico é de vital importância para todos os organismos que
fazem respiração aeróbica. Para processos industriais é obtido por
destilação fracionada do ar líquido. É usado em metalurgia, para
obtenção de chamas de altas temperaturas (por exemplo, para
soldagem) e em equipamentos para respiração. A forma mais comum
é diatômica, O2, mas também forma um alótropo reativo: ozônio, O3.
Quimicamente o oxigênio reage com a maioria dos elementos
formando os óxidos. Ele foi descoberto em 1774 por
Priestley.oxidação +2 e +3. Os sais de manganês (II) são mais
estáveis. Também forma compostos em estados de oxidação mais
altos como óxido de manganês (V) e sais de manganato (VI) e
permanganato (VII). O elemento foi descoberto em 1774 por
Scheele.
Manganês Mn. Elemento metálico de transição, de cor cinza, frágil.
Z = 25, configuração eletrônica: [Ar] 4s2 3d5, MA = 54,94, d = 7,4
g.cm-3, PF = 1244ºC, PE = 2040ºC. As principais fontes são
pirolusita ou manganês mole,(MnO2), psilomelana ou manganês duro
(MnO2) e rodocrosita (MnCO3). O metal pode ser extraído por
redução do óxido usando magnésio (processo Kroll) ou alumínio
(processo Goldschmidt). Freqüentemente o minério é misturado
com minério de ferro e reduzido em forno elétrico para produzir
ferro-manganês para uso em ligas de aços. O elemento é bastante
eletropositivo e reage com água e ácidos diluídos dando hidrogênio.
Quando aquecido combina com oxigênio, nitrogênio e com outros
metais. Sais de manganês contêm o elemento nos estados de
oxidação +2 e +3. Os sais de manganês (II) são mais estáveis.
Também forma compostos em estados de oxidação mais altos como
óxido de manganês (V) e sais de manganato (VI) e permanganato
(VII). O elemento foi descoberto em 1774 por Scheele.
Amostra
de
rodocrosita,
MnCO3.
Ademir Elenise Marta
Amostra
de
psilomelana,
MnO2