Introdução à classificação da
OMS dos tumores do tecido
linfóide (2008)
José Carlos Morais
UFRJ
Wilks S. Cases of lardaceous disease and some allied
affections with remarks
affections,
remarks. Guys Hosp Rep 1856;17:103
1856;17:103-32
32
“Esta doença é claramente separável da doença lardácea, do câncer e do
t bé l embora
tubérculo,
b
estas
t d
doenças possam tter relação
l ã uma com a outra.
t È
entretanto uma doença sui generis e merece uma descrição própria.”
Carl Sternberg
1898
• 15 casos
• 8 com ttuberculose
b
l
concomitante
• levou-o
levou o a concluir que a
Doença de Hodgkin era
um processo inflamatório
crônico possivelmente
causado pelo
M. tuberculosis
Johns Hopkins Medical School – Classe de 1900
“...possui um quadro histológico típico e peculiar, que consiste na
proliferação de células reticulares e endoteliais, formação de células linfóides
e características células gigantes, um aumento global do tecido conjuntivo,
resultando em fibrose e na maioria dos espécimes, a presença de um grande
número de eosinófilos.”
Outras notáveis observações
ç
((1902))
•
•
•
•
•
“A
A saúde do paciente antes do início
da doença é, em geral, excelente.”
Pico de incidência entre crianças e
adultos jovens
Apresenta-se como uma
linfadenopatia cervical indolor e sem
leucemia
O quadro histopatológico é
suficiente
fi i t para o di
diagnóstico
ó ti
Etiologia indeterminada, mas “sem
relação
ç direta com a tuberculose”
Casos Originais
G d Museum,
Gordon
M
Guy´s
G ´ Hospital,
H
it l Londres
L d
Reavaliação dos pacientes estudados por Thomas Hodgkin (1832) feitas
por Fox (1926), Symmers (1978) e Lennert (1987)
Gordon Museum, Guy´s Hospital, Londres
Paciente
ac e e
Diagnóstico
ag ós co
1
Tuberculose (+ doença de Hodgkin ?)
2
doença de Hodgkin
3
sífilis
4
doença de Hodgkin
5
“linfomatose
linfomatose sistêmica (linfocítica)”
(linfocítica)
6
imunocitoma linfoplasmocitóide
7
doença de Hodgkin ?
Linfoma de
g
Doença
deHodgkin
Hodgkin
Classificação
Jackson
Parker
1947
REAL/OMS
2001
Rye –eeNova
York
1966
Lukes
Butler
1966
FORMA
LH NODULAR
E DIFUSA
PREDOMÍNIO
O
O LINFOCITÁRIO
OC
O
PARAGRANULOMA
NODULAR
ESCLEROSE NODULAR
GRANULOMA
CELULARIDADE MISTA
FORMA
CLÁSSICA
RETICULAR
SARCOMA
DEPLEÇÃO LINFOCITÁRIA
FIBROSE DIFUSA
RICA EM LINFÓCITOS
Linfoma de Hodgkin
g
Classificação
OMS 2008
PREDOMÍNIO
O
O LINFOCITÁRIO
OC
O
ESCLEROSE NODULAR
CELULARIDADE MISTA
FORMA
CLÁSSICA
DEPLEÇÃO LINFOCITÁRIA
RICA EM LINFÓCITOS
CD20
Predomínio linfocitário nodular
Cél la
Célula
neoplásica
(2%)
X
Hospedeiro
(micro--ambiente)
(micro
CD20
CD30
CD3
CD15
Distribuição dos tipos
histológicos no Brasil
PL
5%
DL
5%
1025 casos entre
1990 e 2000
Celularidade
mista
21%
Esclerose
nodular
69%
Vassalo J et al. São Paulo Medical Journal 2005; 123(maio):134123(maio):134-6
Distribuição dos tipos histopatológicos
no Rio de Janeiro
Ano
EN
CM
PL
DL
1985--1990
1985
54%
36%
8%
2%
1993--1996
1993
65%
18%
8%
2%
2001--2004
2001
78%
18%
1%
3%
SPECTOR N, COSTA MA, PULCHERI W, NUCCI M, MORAIS JC, ANDRADE C, SCALETSKY A, BRABO
E, JORGE E, OLIVEIRA HP. Cancer, v.71, n.9, p.2823 - 2827, 1993.
SPECTOR N, COSTA MA, MORAIS JC, BIASOLI I, PORTUGAL R, PULCHERI W., NUCCI M,
GAUI MF, LOUREIRO M. Oncology Reports, v.9, n.2, p.439 - 442, 2002.
SPECTOR N, MILITO CB, BIASOLI I LUIZ RR, PULCHERI W, MORAIS JC. Leukemia and Lymphoma
18:1000-1004, 2005.
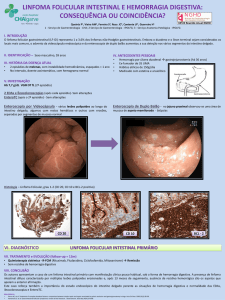
ESTUDO HISTOPATOLÓGICO DO LINFOMA DE HODGKIN NA CIDADE
DO RIO DE JANEIRO. AVALIAÇÃO DOS SUBTIPOS EM SEIS DÉCADAS
Albino Fonseca Júnior, Irene Biasoli, Cristiane Milito, Wolmar Pulcheri, Nelson Spector, José Carlos Morais
X
Tipo Histológico (EN x CM)
Período (1947-1980)
Esclerose Nodular
Celularidade Mista
Número de casos
77
39 (51%)
38 (49%)
ESTUDO HISTOPATOLÓGICO DO LINFOMA DE HODGKIN NA CIDADE
DO RIO DE JANEIRO. AVALIAÇÃO DOS SUBTIPOS EM SEIS DÉCADAS
Albino Fonseca Júnior, Irene Biasoli, Cristiane Milito, Wolmar Pulcheri, Nelson Spector, José Carlos Morais
X
Tipo Histológico (EN x CM)
Período (1947-1980)
Esclerose Nodular
Celularidade Mista
Número de casos
77
39 (51%)
38 (49%)
p < 0,0001
Período (1981-2006)
Esclerose Nodular
Celularidade Mista
183
148 (81%)
35 (19%)
Esclerose nodular
Grau II
Grau I
2001
2008
Classificação do Linfoma de Hodgkin não mudou
Como classificar os linfomas?
Convencionou-se chamar e agrupar
todas as doenças linfoproliferativas
clonais que não fossem doença de
Hodgkin como linfomas não-Hodgkin
Hodgkin
g
Como classificar os linfomas?
Rappaport
Lennert
Hartsock
O’Conor
Dorfman
Lennert
Rappaport
Lukes
Berard
WORKING FORMULATION FOR CLINICAL USAGE
Karl Lennert no nascimento da Classificação de Kiel (1974)
A Classificação REAL (Revised European-American Lymphoma)
1994
Classificação REAL
•
Representou um novo paradigma na classificação das neoplasias linfóides
•
Foco foi na identificação de “REAL diseases”
•
Relacionou, sempre que possível, com a célula normal no sistema de diferenciação
•
Listagem de entidades
•
Categorias provisórias
Classificação REAL
•
Representou um novo paradigma na classificação das neoplasias linfóides
•
Foco foi na identificação de “REAL diseases”
•
Relacionou, sempre que possível, com a célula normal no sistema de diferenciação
•
Listagem de entidades
•
Categorias provisórias
Classificação REAL
•
Representou um novo paradigma na classificação das neoplasias linfóides
•
Foco foi na identificação de “REAL diseases”
•
Relacionou, sempre que possível, com a célula normal no sistema de diferenciação
•
Listagem de entidades
•
Categorias provisórias
Classificação REAL
•
Representou um novo paradigma na classificação das neoplasias linfóides
•
Foco foi na identificação de “REAL diseases”
•
Relacionou, sempre que possível, com a célula normal no sistema de diferenciação
•
Listagem de entidades
•
Categorias provisórias
Classificação REAL
•
Representou um novo paradigma na classificação das neoplasias linfóides
•
Foco foi na identificação de “REAL diseases”
•
Relacionou, sempre que possível, com a célula normal no sistema de diferenciação
•
Listagem de entidades
•
Categorias provisórias
Linfoma de
Burkitt
Linfoma T
periférico
Linfoma
MALT
Linfoma de
grandes
células
LLC
Linfoma do
manto
Linfoma
folicular
O que é linfoma?
São tumores clonais de células B
e T/NK maturas ou imaturas em
vários estágios de diferenciação
Sistema Imune Inato
Sistema Imune Adaptativo
Granzima
célula T ,
NK tipo
T e células NK
-c B
Célula
CélulaT
Receptores tipo Toll
Não restrito ao CHM
CAP
Citocinas
Quimocinas
Q
Complemento
Vias apoptótica e de necrose celular
Primeira linha de defesa com
maior papel na barreira imunitária
Receptores Ag
específicos em
células B e T
Apresentação de
Ag às células T no
contexto do CHM
Defesa imunológica caracterizada pela
especificidade e memória
Tecido linfóide central
Células B precursoras
Medula óssea
Diagrama da diferenciação da célula B
Célula B progenitora
Tecido linfóide periférico
Células B maduras
Célula pré-B
Apoptose
Zona do
manto
Célula B imatura
Apoptose
Célula B de
memória
Célula folicular
dendrítica
Zona Marginal
Centrocito
Célula B naive
Centroblasto
Blasto B
extrafolicular
Imunoblasto
Plasmócito
Plasmócito de
vida curta
Área interfolicular
Área folicular
Área perifolicular
Tecido linfóide central
Células B precursoras
Medula óssea
Célula B progenitora
LINFOMA/LEUCEMIA
LINFOBLÁSTICA
Á
Célula pré-B
Zona do
manto
Célula B imatura
Apoptose
Célula B de
memória
Célula folicular
dendrítica
Centrocito
Zona Marginal
Célula B naive
Centroblasto
Blasto B
extrafolicular
Plasmócito de
vida curta
Área interfolicular
Imunoblasto
Plasmócito
Tecido linfóide periférico
Células B maduras
Área folicular
Área perifolicular
Tecido linfóide central
Células B precursoras
Medula óssea
Célula B progenitora
LINFOMA DE
CÉLULAS
É
DO MANTO
Célula pré-B
Zona do
manto
Célula B imatura
Apoptose
Célula B de
memória
Célula folicular
dendrítica
Centrocito
Zona Marginal
Célula B naive
Centroblasto
Blasto B
extrafolicular
Plasmócito de
vida curta
Área interfolicular
Imunoblasto
Plasmócito
Tecido linfóide periférico
Células B maduras
Área folicular
Área perifolicular
Tecido linfóide central
Células B precursoras
Medula óssea
LINFOMA
FOLICULAR
Célula B progenitora
Célula pré-B
Zona do
manto
Célula B imatura
Apoptose
Célula B de
memória
Célula folicular
dendrítica
Centrocito
Zona Marginal
Célula B naive
Centroblasto
Blasto B
extrafolicular
Plasmócito de
vida curta
Área interfolicular
Imunoblasto
Plasmócito
Tecido linfóide periférico
Células B maduras
Área folicular
Área perifolicular
Tecido linfóide central
Células B precursoras
Medula óssea
Célula B progenitora
LINFOMA DE
GRANDES CÉLULAS
É
Célula pré-B
Zona do
manto
Célula B imatura
Apoptose
Célula B de
memória
Célula folicular
dendrítica
Centrocito
Zona Marginal
Célula B naive
Centroblasto
Blasto B
extrafolicular
Plasmócito de
vida curta
Área interfolicular
Imunoblasto
Plasmócito
Tecido linfóide periférico
Células B maduras
Área folicular
Área perifolicular
Tecido linfóide central
Células B precursoras
Medula óssea
Célula B progenitora
LINFOMA LINFOCÍTICO
LEUCEMIA LINFÓIDE CRÔNICA
Célula pré-B
Zona do
manto
Célula B imatura
Apoptose
Célula B de
memória
Célula folicular
dendrítica
Centrocito
Zona Marginal
Célula B naive
Centroblasto
Blasto B
extrafolicular
Plasmócito de
vida curta
Área interfolicular
Imunoblasto
Plasmócito
Tecido linfóide periférico
Células B maduras
Área folicular
Área perifolicular
Tecido linfóide central
Células B precursoras
Medula óssea
LINFOMA MALT
Célula B progenitora
Célula pré-B
Zona do
manto
Célula B imatura
Apoptose
Célula B de
memória
Célula folicular
dendrítica
Centrocito
Zona Marginal
Célula B naive
Centroblasto
Blasto B
extrafolicular
Plasmócito de
vida curta
Área interfolicular
Imunoblasto
Plasmócito
Tecido linfóide periférico
Células B maduras
Área folicular
Área perifolicular
Tecido linfóide central
Células B precursoras
Medula óssea
Célula B progenitora
MIELOMA MÚLTIPLO
Célula pré-B
Zona do
manto
Célula B imatura
Apoptose
Célula B de
memória
Célula folicular
dendrítica
Centrocito
Zona Marginal
Célula B naive
Centroblasto
Blasto B
extrafolicular
Plasmócito de
vida curta
Área interfolicular
Imunoblasto
Plasmócito
Tecido linfóide periférico
Células B maduras
Área folicular
Área perifolicular
DIAGRAMA ESQUEMÁTICO DO FENÓTIPO B NOS VÁRIOS ESTÁGIOS DE MATURAÇÃO E
SUA RELAÇÃO COM A EXPRESSÃO ANTIGÊNICA
RCB
Pré-RCB
M
M
Pro B
Pre B
B Imaturo
B maturo
naive
Antígeno
g
independente
p
TDT
CD79A
PAX5
CD20
D
Troca de
classe
Centro
germinativo
M
Célula B
memória
(marginal)
Antígeno
g
dependente
p
Ig
citoplasmática
Plasmócito
Tecido linfóide central
Tecido linfóide periférico
Células T precursoras
Células T e NK maduras (periféricas)
Baço
Mucosa
Sangue periférico
Célula NK
Pró-timócito
Progenitor de célula T
Pele
Célula T
gama delta
Timócitos corticais
(subcapsular)
Efetora
CFC
Célula T
apoptótica
Naive
Blasto
Memória
Timócito comum
CD4+/CD8+
Timócito
medular
CD4+
Timócito
medular
CD8+
Efetora
Naive
Blasto
Memória
Célula T
folicular
Tecido linfóide central
Células T precursoras
Pró-timócito
Progenitor de célula T
Timócitos corticais
(subcapsular)
Célula T
apoptótica
Timócito comum
CD4+/CD8+
Timócito
medular
CD4+
Timócito
medular
CD8+
Leucemia e linfoma linfoblástico T
Tecido linfóide central
Tecido linfóide periférico
Células T precursoras
Células T e NK maduras (periféricas)
Célula NK
Pró-timócito
Progenitor de célula T
Baço
Mucosa
Sangue periférico
Pele
Célula T
gama delta
Timócitos corticais
(subcapsular)
São linfomas
Sã
li f
predominantemente
d i
t
t
extranodais e observados em crianças
e adultos jovens
Célula T
apoptótica
Timócito comum
CD4+/CD8+
Timócito
medular
CD4+
Timócito
medular
CD8+
Leucemia
L
i d
de célula
él l NK
NK, d
doença lilinfoproliferativa
f
lif ti
sistêmica EBV+ da criança, linfomas hepatoesplênicos,
linfomas gamadelta cutâneos e de mucosas
Tecido linfóide central
Leucemias e linfomas de células T periféricas
Células T precursoras
Pró-timócito
Progenitor de célula T
Timócitos corticais
(subcapsular)
Célula T
apoptótica
Efetora
Naive
Blasto
Memória
Timócito comum
CD4+/CD8+
Timócito
medular
CD4+
Timócito
medular
CD8+
Efetora
Naive
Blasto
Memória
Tecido linfóide central
Células T precursoras
Pró-timócito
Progenitor de célula T
Timócitos corticais
(subcapsular)
Linfoma T angioimunoblástico
CFC
Célula T
apoptótica
Timócito comum
CD4+/CD8+
Timócito
medular
CD4+
Timócito
medular
CD8+
T-helper
T
helper
folicular
DIAGRAMA ESQUEMÁTICO DO FENÓTIPO T NOS VÁRIOS ESTÁGIOS DE MATURAÇÃO E
SUA RELAÇÃO COM A EXPRESSÃO ANTIGÊNICA
Pró-timócito
Timócito
subcapsular
Timócito
cortical
CD7
CD1A
CD2/CD5
CD3 citoplasmático
CD4 e CD8
TDT
CD3 de superfície
CD4
CD8
Timócito
medular
Linfócito T
periférico
O que mais mudou na classificação?
Karl Lennert no nascimento da Classificação de Kiel (1974)
Comitê Clínico Consultivo
Primeiro Encontro em Airlie, Virginia, Março 1997
Classificação dos linfomas
“ Not only we clinicians have trouble
in understanding pathologists, but
y seem unable to
at times they
understand one another. ”
Alan Aisenberg
Two Clinical Advisory Committee
Meetings
• Myeloid - Chicago, February 2007
• Lymphoid - Airlie House, March 2007
Clinical Advisory Committee
Airlie, Virginia March 2007
Papel do Comitê Clínico Consultivo
•
Classificação deve ser útil para patologistas e clínicos
•
Classificação deve ser adequada para a prática diária e ensaios
clínicos
•
Comitê levantou questões de relevância clínica e alcançou
consenso em muitas delas
–
–
–
–
Forma de listagem
Uso de agrupamentos clínicos
Gradação
ç do linfoma folicular
Importância da genética na classificação da leucemia aguda
Questão central
• Reconhecimento de entidades que tenham uma
constante interrelação entre a patologia, a clínica,
a genética molecular e a epidemiologia.
• Definição
ç da doença
ç é um p
processo dinâmico e
evolutivo
• O processo é interativo
29 entidades
Células
pequenas
Morfologia
g de
células grandes
Linfoma difuso de grandes células B
(OMS 2008)
Variantes e subtipos/entidades
Linfoma difuso de grandes células B, sem outras
especificações (SOE)
(
)
Variantes morfológicas, subgrupos fenotípicos e
moleculares.
Linfoma difuso de grandes células B
Subtipos baseados nos achados clínicos (local
anatômico) ou estágios de diferenciação
(plasmablástico)
Casos limítrofes (“borderline cases”)
B kitt and
Burkitt
d LDGCB
Linfoma de Hodgkin e LDGCB
Morfologia
g
plasmoblástica
Entidades relacionadas a
infecção viral (EBV, HHV8, HIV)
Diferenciação
células B maduras
CD20
Diferenciação
plasmoblástica
CD138 CD38
Imunodeficiência
Moderada Idoso Outros HIV
Agentes virais
LDGCB, ALK+
Gran Linf
Plasmoblástico
LDGCB Castleman
LDGCB,
C tl
LDGCB, EBV+
Linfoma Efusão
Este grupo de tumores é caracterizado por uma diminuição na diferenciação das células B
maduras e aumento na diferenciação plasmoblástica. A maioria acomete pacientes
imunocomprometidos e as células tumorais são infectadas pelo EBV, pelo HHV8 ou ambos
Pontos ressaltados na
Cl
Classificação
ifi
ã da
d OMS (2008)
Local
L
l anatômico
tô i é importante
i
t t para a definição
d fi i ã da
d doença
d
Linfoma difuso de grandes células B do SNC
Linfoma primário
p
cutâneo “da p
perna” - leg
g type
yp
Linfoma difuso de grandes células primário do mediastino
Relacionado à
localização
Pontos ressaltados na
Classificação da OMS (2008)
Idade como um importante fator na definição da doença
LDGCB do idoso (provisório)
Linfoma folicular pediátrico
Linfoma de zona marginal pediátrico
Relacionado a
idade
Pontos ressaltados na
Classificação da OMS (2008)
Linfomas seguem
g
um processo
p
patogênico
p g
progressivo
p g
Lesões “in situ” com limitado potencial de progressão foram
identificados.
Linfoma folicular “in
in situ”
situ , linfoma de células do manto
manto.
Cong et al. Blood, 2002
• Achado de uma população clonal
restrita ao CG.
• Isto deve ser distinto de envolvimento
parcial
pa
c a po
por linfoma.
o a
• Neoplasia intrafolicular expansão de
células linfóides BCL-2 e CD10 que
carregam a translocação t(14;18)
t(14;18).
• Achado incidental. Em alguns pacientes
o achado durante o estagiamento, mas
50% não possuem evidências de LF
LINFOMA DE CÉLULAS DO MANTO “IN SITU”
HE
Ciclina D1
• Envolvimento p
precoce de linfonodo q
que carregam
g
a t(11;14)
(
) e expressam
p
ciclina D1.
• São predominantemente encontrados na parte interna da zona do manto.
• Restante do folículo é reacional
• Achado incidental
• Alguns não desenvolvem doença após anos e outros sim
• Possuem células t(11;14) circulantes sem desenvolver doença
Pontos ressaltados na
Cl
Classificação
ifi
ã da
d OMS (2008)
Categorias
C t
i de
d “zona
“
cinzenta”
i
t ” foram
f
identificados
id tifi d
Linfoma B de alto grau intermediário entre Burkitt e Grandes Células
Linfoma de células B intermediário entre Hodgkin
g
e Grandes Células
A grande premissa das classificações REAL e OMS tem sido que os linfomas são doenças distintas e entidades
não superpostas, cujos parâmetros são baseados nos achados clínicos, morfológicos, imunológicos e
biológicos.
biológicos
Entretanto recentes observações desafiam esta idéia de uma precisa separação entre entidades em determinadas
situações
A identificação de uma zona cinzenta entre o linfoma de Hodgkin e o linfoma primário de grandes células do
mediastino enfatizam como as células tumorais podem cruzar a fronteira e sugerem que algumas entidades
podem estar no limite deste espectro
p
p
O aumento no reconhecimento de uma relação clonal entre diferentes componentes de um linfoma composito
como linfoma folicular e linfoma MALT, entre LF e LH ressalta a complexa ontogenia destes tumores, que podem
compartilhar a célula de origem e os eventos iniciais de transformação
transformação,
Estudos recentes tem mostrado idêntico rearranjamento clonal entre o linfoma linfoblástico T e a histiocitose de
células de Langerhans ou LF e tumores histiocíticos indicando uma origem clonal entre tumores de linhagem
dif
diferente
t
Entidades distintas podem ser morfologicamente
semelhantes
Nem todos “linfomas foliculares” são parte da mesma entidade
Linfoma folicular, graus 1, 2, 3a
Linfoma folicular, grau 3b
Linfoma Folicular
Gradação do linfoma folicular
Grau 3a
Grau 3b
Grau 2
Grau 1
Este subgrupo é biologicamente distinto e com achados que
sugerem uma relação maior com o LDGCB – ausência do CD10 e
BCL2, expressão de MUM1 e rearranjo mais de BCL6 do que BCL2
CRITÉRIO PARA CLASSIFICAÇÃO
Número de g
grandes células por
p campo
p de grande
g
aumento
(centroblastos)
Baixo grau
Grau 1: 0
0-5
5 centroblastos
Grau 2: 6-15 centroblastos
G
Grau
3:
3 > 15 centroblastos
t bl t
3A – centrócitos presentes
3B – grupamentos sólidos de centroblastos
Entidades distintas podem ser morfologicamente
semelhantes
Nem todos “linfomas foliculares” são parte da mesma entidade
Linfoma folicular, graus 1, 2, 3a
Linfoma folicular, grau 3b
Linfoma cutâneo de células centro-foliculares
Linfoma folicular pediátrico (testicular/ nodal)
Entidades distintas podem ser morfologicamente
semelhantes
Nem todos “linfomas foliculares” são parte da mesma entidade
Linfoma folicular, graus 1, 2, 3a
Linfoma folicular, grau 3b
Linfoma cutâneo de células centro-foliculares
Linfoma folicular pediátrico (testicular/ nodal)
Linfoma folicular predominante difuso com doença “bulky”
bulky localizada (região
inguinal) com frequente deleção 1p36
Entidades distintas podem ser morfologicamente
semelhantes
Nem todos “linfomas foliculares” são parte da mesma entidade
Linfoma folicular, graus 1, 2, 3a
Linfoma folicular, grau 3b
Linfoma cutâneo de células centro-foliculares
Linfoma folicular pediátrico (testicular/ nodal)
Linfoma folicular predominante difuso com doença “bulky”
bulky localizada (região
inguinal) com frequente deleção 1p36
Linfoma folicular t(14;18) negativa com morfologia de ativação terminal do
CG e diferenciação
ç p
plasmocitária
2001
2008
18 entidades
• Leucêmicos
• Extranodais
• Cutâneos
• Nodais
Princípios da Classificação
G
Grau
e Agressividade
A
i id d
• Muitas entidades possui uma variação no grau
g
e no comportamento
p
clínico
histológico
– Linfoma folicular
– LLC/LLP
– Linfoma/leucemia de célula T do adulto
• Entidades com esta variação histológica e clínica são
uma única doença
• Consequentemente é difícil estratificar os linfomas de
acordo com os graus clínicos
clínicos.
Índice p
prognóstico
g
internacional
(IPI)
•
•
•
•
•
Idade > 60 anos
Estágio avançado: III ou IV
Nú
Número
d
de llocais
i extra-nodais
t
d i >1
1
Performance status > 2
Aumento de LDH no soro
Alto risco = escore 4 ou 5
Sobrevida pelo tipo
histológico associado ao IPI
Sobrevida global – 5 anos
IPI
0-1
4-5
Diagnóstico
Linfoma do manto
Difuso de GC
Linfoma T periférico
Primário do mediastino
57%
73%
36%
77%
0%
22%
15%
0%
Conclusões importantes para o diagnóstico
• O diagnóstico de linfoma é morfológico e depende de
uma ótima lâmina em HE
• O diagnóstico
di
ó ti d
de lilinfoma
f
não
ã pode
d ser ffeito
it no vácuo,
á
“Na
grandede
maioria
dos casos
não
mas
no contexto
uma completa
históriavocê
clínica.
precisa de imuno para
p
p
dizer que
q é linfoma,, mas
• Nenhum
é específico
paraque
qualquer
neoplasia
precisamarcador
de imuno
para dizer
linfoma
é.”
José Carlos Morais
Quem você levaria para uma ilha deserta?
Um
• Uma combinação de achados morfológicos, um painel
clínico
ou um antigênicos
técnico em
imuno-histoquímica?
de marcadores
associados
a correlação
clínica são necessários p
para um correto diagnóstico
g
• Técnicas de biologia molecular ocasionalmente são
recomendadas para um diagnóstico definitivo
“...
...”
LDGCB do
idoso
Embora, muitos não aceitem uma ou outra entidade, a Classificação da OMS de 2008
envolveu 130 experts, patologistas e hematologistas em busca do consenso.
É IMPORTANTE RECONHECER
QUE NEM SEMPRE TEMOS AS
MELHORES CONDIÇÕES PARA
UM DIAGNÓSTICO PRECISO
Mas não podemos deixar de ter um olhar
multidisciplinar para os linfomas e lançar
mão de todas as ferramentas disponíveis
para identificar com precisão cada entidade
MAS, SEM
EXAGEROS
OBRIGADO !
Pelo p
peso, acho q
que é
um grandes células!