UNIVERSIDADE DE CUIABÁ
Programa de Pós-Graduação em Ciências Odontológicas
Integradas
Área de Concentração Odontologia
MARIA CARMEN PALMA FARIA VOLPATO
ANALISE DA OCORRÊNCIA DA
PARACOCCIDIOIDOMICOSE COM MANIFESTAÇÃO
BUCAL NO ESTADO DE MATO GROSSO POR MEIO DO
GEORREFERENCIAMENTO
Cuiabá, 2013
UNIVERSIDADE DE CUIABÁ
Programa de Pós-Graduação em Ciências Odontológicas
Integradas
Área de Concentração Odontologia
MARIA CARMEN PALMA FARIA VOLPATO
ANALISE DA OCORRÊNCIA DA
PARACOCCIDIOIDOMICOSE COM MANIFESTAÇÃO
BUCAL NO ESTADO DE MATO GROSSO POR MEIO DO
GEORREFERENCIAMENTO
Cuiabá, 2013
MARIA CARMEN PALMA FARIA VOLPATO
ANALISE DA OCORRÊNCIA DA
PARACOCCIDIOIDOMICOSE COM MANIFESTAÇÃO
BUCAL NO ESTADO DE MATO GROSSO POR MEIO DO
GEORREFERENCIAMENTO
Dissertação de Mestrado apresentada ao
Programa de Pós-graduação em Ciências
Odontológicas Integradas, da Universidade de
Cuiabá – UNIC como requisito parcial para
obtenção do Título de Mestre em Ciências
Odontológicas Integradas Área de Concentração
Odontologia.
Orientador: Prof. Dr. Artur Aburad de Carvalhosa
Cuiabá, 2013
MARIA CARMEN PALMA FARIA VOLPATO
ANALISE DA OCORRÊNCIA DA
PARACOCCIDIOIDOMICOSE COM MANIFESTAÇÃO
BUCAL NO ESTADO DE MATO GROSSO POR MEIO DO
GEORREFERENCIAMENTO
Dissertação de Mestrado apresentada ao Programa de Pós-graduação em
Ciências Odontológicas Integradas, da Universidade de Cuiabá – UNIC como
requisito parcial para obtenção do Título de Mestre em Ciências Odontológicas
Integradas – Área de Concentração Odontologia.
BANCA EXAMINADORA
__________________________________________
Orientador: Prof. Dr. Artur Aburad de Carvalhosa
__________________________________________
Membro Titular: Prof. Dr. Álvaro Henrique Borges
__________________________________________
Membro Titular: Prof. Dr. Élcio Magdalena Giovani
Cuiabá,08 de Março de 2013
Conceito Final: _______________
Bibliotecária: Patrícia Jaeger / CRB1-1736.
V931a
Volpato, Maria Carmem Palma Faria.
Análise da ocorrência da paracoccidiodomicose com manifestação bucal no estado
de Mato Grosso por meio do Georreferenciamento / Maria Carmem Palma Faria Volpato –
Cuiabá: Universidade de Cuiabá - UNIC, 2013.
xxf.:Il.
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Ciências
Odontológicas Integradas, da Universidade de Cuiabá – UNIC, para obtenção do título de
Mestre em Ciências Odontológicas Integradas - área de concentração Odontologias.
Orientadora: Prof. Drº Artur Aburad de Carvalhosa.
1. Odontologia 2. Paracoccidioidomicose - Infecção Fúngica. 3. Biologia Celular 4.
Diagnóstico Bucal.
5. Epidemiologia. 6. Patologia Bucal. 7. I. Título. II. Volpato, Maria
Carmem Palma Faria III. Universidade de Cuiabá - UNIC.
CDU: 616.314:616.992 (817.2)
Ao Evaristo, à Maria Luiza e à Maria Julia
AGRADECIMENTOS
Agradeço a Deus por mais esta conquista e a todos que direta ou indiretamente
contribuíram para a conclusão deste trabalho, dentre os quais destaco:
Meu orientador e amigo Artur Aburad de Carvalhosa;
A equipe do MT-Laboratório: Marcelo Adriano, Mônica Mika, Silza Fátima,
Dilma, Maria Eugênia e Eduardo;
A Fundação de Amparo à Pesquisa do Estado de Mato Grosso;
Os Professores Doutores Carlo Ralph De Musis e Peter Zeilhofer;
Os colegas Ana Thereza, Maísa, Maura, Kássia, Hévelin, Débora, Rafaele,
Maria Sônia, Hedilza, Tarcísio, Marcus Vinícius, Carlos Rodrigo, Carlos
Antunes, Waldinei, Wissem, Alessandro;
Os amigos do Departamento de Odontologia do Hospital do Câncer de Mato
Grosso;
O amigo Paulo Henrique de Souza Castro;
O amigo Ricardo Miguel Carrión Carracedo;
Meus pais Mauricio e Constança;
Meus sogros Luiz e Luiza.
“Comece fazendo o que é necessário,
depois o que é possível e de repente
você estará fazendo o impossível.”
São Francisco de Assis
RESUMO
RESUMO
VOLPATO, M. C. P. F. Análise da ocorrência da paracoccidioidomicose
com manifestação bucal no estado de Mato Grosso por meio do
georreferenciamento. 2013. Dissertação (Mestrado) – Universidade de
Cuiabá
A Paracoccidioidomicose é considerada a infecção fúngica mais importante da
América Latina, sendo o Brasil um centro endêmico da doença. A procura por
tratamento geralmente ocorre quando o paciente já apresenta manifestações
bucais secundárias à infecção pulmonar. Assim, o cirurgião dentista exerce
importante papel no diagnóstico e encaminhamento do paciente para
tratamento. Face à morbidade associada à Paracoccidioidomicose e sua
incidência emergente em Mato Grosso, é importante que se conheça melhor
como a doença está distribuída no estado e se essa distribuição está
relacionada com determinada variável socioambiental. Deste modo, foi
analisada a ocorrência da Paracoccidioidomicose no Estado de Mato Grosso
por meio do georreferenciamento buscando identificar características
ambientais envolvidas. Para tal foi realizado estudo transversal, descritivo e
retrospectivo com a utilização dos laudos das lesões bucais do serviço de
patologia bucal do Laboratório Público do Estado de Mato Grosso do período
compreendido entre 2005 e 2011. A base de dados dos casos foi então
cruzada com a base espacial fornecida pelo servidor de mapas da Secretaria
de Estado de Planejamento e Coordenação Geral do Estado de Mato Grosso.
Os resultados do estudo demonstraram um maior número de diagnósticos no
ano de 2006 (25,6%), seguido dos anos de 2007 (18,4%) e 2009 (16,8%); 98
(78,4%) exames foram do tipo histológico; 123 casos (98,4%) eram de
pacientes do sexo masculino; 77 casos (61,6%) tinham idade entre 41 e 60
anos. Os casos procederam de 53 municípios. A análise espacial utilizando o
estimador de intensidade de Kernel permitiu a visualização de uma maior
concentração dos casos nas regiões norte e sul do estado. Foi possível
concluir que os casos estão distribuídos de forma heterogênea no estado,
apresentando maior concentração nas regiões de maior desenvolvimento
econômico, maior fluxo rodoviário e com presença de águas contaminadas.
Não houve casos em reservas indígenas ou ecológicas.
Palavras-chave: Biologia Celular. Brasil. Diagnóstico Bucal. /epidemiologia.
Paracoccidioidomicose. Patologia Bucal.
ABSTRACT
ABSTRACT
VOLPATO,
M.
C.
P.
F.
Analysis
of
the
occurrence
of
paracoccidioidomycosis with oral manifestation in the State of Mato
Grosso, Brazil, through georeferencing. 2013. Dissertation University of
Cuiabá.
Paracoccidioidomycosis is considered the most important fungal infection in
Latin America, with Brazil being an endemic center of the disease. The demand
for treatment usually occurs when the patient already has oral manifestations
secondary to pulmonary infection. Thus the dentist plays an important role in
diagnosing and referring patients for treatment. Given the morbidity associated
with paracoccidioidomycosis and its emerging incidence in Mato Grosso, it is
important to know better how the disease is distributed in the state and if this
distribution is related to particular environmental variable. So the occurrence of
paracoccidioidomycosis in Mato Grosso was analyzed by georeferencing,
seeking to identify environmental features involved. For this, a descriptive and
retrospective cross-sectional study was performed using the reports of oral
lesions in the oral pathology service of the Mato Grosso State Public Laboratory
between 2005 and 2011. The database of the cases was then crossed with the
spatial database provided by the maps server of the Planning and General
Coordination Mato Grosso State Secretariat. The study results demonstrated a
greater number of diagnoses in 2006 (25.6%), followed by the years of 2007
(18.4%) and 2009 (16.8%). 98 (78.4%) examinations were of histological type,
123 cases (98.4%) were male patients, 77 cases (61.6%) were aged between
41 and 60 years. The cases were from 53 municipalities. Spatial analysis using
kernel intensity estimator enabled visualization of a greater concentration of
cases in the north and south of the state. It was concluded that the cases are
distributed unevenly in the state, with higher concentrations in regions of greater
economic development, higher road flow and presence of contaminated water.
There were no cases in natives’ and ecological reserves.
Key-words:
Brazil.
Cell
Biology.
/epidemiology.
Paracoccidioidomycosis. Pathology, Oral.
Diagnosis,
Oral.
LISTA DE TABELAS
LISTA DE TABELAS
Tabela 1 -
Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato
Grosso segundo o ano de diagnóstico, no período de 2005
a 2011.
34
Tabela 2 -
Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato
Grosso, segundo o sexo do paciente, no período de 2005
a 2011.
34
Tabela 3 -
Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato
Grosso, segundo a faixa etária do paciente, no período de
2005 a 2011.
35
Tabela 4 -
Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato
Grosso, segundo o tipo de exame anatomopatológico
realizado, no período de 2005 a 2011.
35
Tabela 5 -
Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato
Grosso, segundo o município de procedência do paciente,
no período de 2005 a 2011.
35
LISTA DE FIGURAS
LISTA DE FIGURAS
Figura 1 -
Mapa político do Brasil, mostrando a divisão por estados e
regiões
22
Figura 2 -
Mapa de intensidade de concentração dos casos de
paracoccidioidomicose diagnosticados através de lesões
de boca no Estado de Mato Grosso, no período de 2005 a
2011.
37
Figura 3 -
Mapa do Sistema Viário do Estado de Mato Grosso. Fonte:
Camargo, 2011.
45
Figura 4 -
Mapa de usos preponderantes e comprometimento da
qualidade das águas no Estado de Mato Grosso. Fonte:
Camargo, 2011.
46
Figura 5 -
Mapa das unidades socioeconômico-ecológicas do Estado
de Mato Grosso. Fonte: Camargo, 2011.
47
LISTA DE
ABREVIATURAS
LISTA DE ABREVIATURAS
a.C.
antes de Cristo
AMP cíclico
monofosfato cíclico de adenosina
BR 163
Rodovia Federal 163 (Cuiabá – Santarém)
CEOPE
Centro Estadual de Odontologia para Pacientes Especiais
Cm
centímetros
CIE
contraimunoeletroforese
DNA
ácido desoxirribonucleico
°C
graus Celsius
gp
glicoproteína
HSP
heat shock proteins ou proteína de estresse
IDD
imunodifusão dupla em gel de ágar
IFI
imunofluorescência indireta
Kda
Kilodalts
Km
quilômetros
KOH
hidróxido de potássio
μm
micrometros
MT Laboratório
Laboratório Público do Estado de Mato Grosso
LS
latitude Sul
Mb
megabases
MT
Mato Grosso
nº
número
PCM
Paracoccidioidomicose
P. brasiliensis
Paracoccidioides brasiliensis
PS
phylogenetical species ou espécie filogenética
PCR
polymerase chain reaction ou reação em cadeia da
polimerase
SES/MT
Secretaria de Estado de Saúde de Mato Grosso
SNC
sistema nervoso central
SIG
Sistemas de Informação Geográfica
Sumário
1.
INTRODUÇÃO .......................................................................................................... 4
2.
REVISÃO DE LITERATURA ..................................................................................... 26
2.1.
HISTÓRICO ....................................................................................................... 26
2.2.
SINONÍMIA ................................................................................................... 27
2.3.
CARACTERÍSTICAS BIOLÓGICAS DO PARACOCCIDIOIDES BRASILIENSIS .......... 27
2.4.
PATOGÊNESE ............................................................................................... 29
2.5.
CLASSIFICAÇÃO DAS FORMAS CLÍNICAS ........................................................ 32
2.5.1.
Forma aguda ou subaguda (tipo juvenil) ................................................ 33
2.5.2.
Forma crônica (tipo adulto) ................................................................... 33
2.5.3.
Forma sequelar...................................................................................... 35
2.6.
MÉTODOS DE DIAGNÓSTICO ........................................................................ 35
2.7.
EPIDEMIOLOGIA ........................................................................................... 38
2.8.
RELAÇÃO PARACOCCIDIOIDES BRASILIENSIS E MEIO AMBIENTE E A DOENÇA40
2.9.
DISTRIBUIÇÃO GEOGRÁFICA DA PARACOCCIDIOIDOMICOSE ........................ 40
2.10. O ESTADO DE MATO GROSSO ....................................................................... 41
2.12 GEORREFERENCIAMENTO ............................................................................ 43
3.
PROPOSIÇÃO ....................................................................................................... 49
2.11. OBJETIVOS ESPECÍFICOS ............................................................................... 49
4.
MATERIAIS E MÉTODO ......................................................................................... 51
4.1.
DESENHO DO ESTUDO .................................................................................. 51
4.2.
POPULAÇÃO ................................................................................................. 51
4.3.
ANÁLISE DOS DADOS .................................................................................... 52
4.4.
PERÍODO DE ESTUDO ................................................................................... 53
4.5.
ASPECTOS ÉTICOS ........................................................................................ 53
5.
RESULTADOS........................................................................................................ 55
6.
DISCUSSÃO .......................................................................................................... 61
7.
6.1.
DISCUSSÃO DE MATERIAIS E MÉTODO ......................................................... 61
6.2.
DISCUSSÃO DOS RESULTADOS ...................................................................... 62
CONCLUSÕES ....................................................................................................... 71
REFERÊNCIAS BIBLIOGRÁFICAS ................................................................................... 73
ANEXOS ...................................................................................................................... 79
Anexo 1 .................................................................................................................. 79
Anexo 2 .................................................................................................................. 81
1. INTRODUÇÃO
1. INTRODUÇÃO
A Paracoccidioidomicose (PCM) é uma micose sistêmica, descrita há
mais de 100 anos por Adolpho Lutz. Ocorre em regiões tropicais e subtropicais
e é considerada a infecção fúngica mais importante da América Latina. O Brasil
é considerado um centro endêmico dessa doença, com maior prevalência nas
regiões Sul, Sudeste e Centro-Oeste (MALUF, 2003).
Nos últimos anos tem sido relatada a ocorrência de casos em áreas de
colonização mais recente, submetidas a desmatamento, como em partes da
Amazônia, atingindo áreas dos estados do Maranhão, Tocantins, Pará, Mato
Grosso, Rondônia, Acre e Amazonas, onde pode ser considerada uma micose
sistêmica emergente (BRASIL, 2012).
O homem é o hospedeiro acidental. A maioria dos casos ocorre em
indivíduos que, por sua atividade, permanecem com mais frequência
diretamente em contato com vegetais e a terra, sendo geralmente
trabalhadores rurais (ARAÚJO et al., 2003).
A
procura
por
tratamento
da
maior
parte
dos
casos
de
paracoccidioidomicose ocorre em fase adiantada da doença, quando esta já
apresenta manifestações bucais, secundárias à infecção pulmonar (VERLI et
al., 2005). Assim, o cirurgião dentista exerce um importante papel no
diagnóstico e encaminhamento para tratamento do paciente acometido por
essa micose (VERLI et al., 2005).
Diante do exposto, face à alta morbidade associada à PCM
(MARTINEZ, 2009) e a identificação de uma incidência emergente em Mato
Grosso, é importante que se conheça melhor a forma com que a doença está
distribuída no estado e se essa distribuição está relacionada com determinada
variável socioambiental. O Geoprocessamento e os Sistemas de Informações
Geográficas (SIG) são ferramentas que se mostram como instrumentos de
aperfeiçoamento da saúde, auxiliando no planejamento, na prestação e na
avaliação dos serviços à população, revelando-se útil para a gestão,
possibilitando análises de situações sanitárias,
avaliação de risco populacional, construção de cenários que viabilizem
o planejamento de estratégias de intervenções nos diversos níveis de saúde
(BRASIL, 2006.
Os resultados deste trabalho poderão subsidiar o desenvolvimento de
políticas públicas voltadas para o controle dessa infecção e para a sua
prevenção, uma vez que possibilita identificar as áreas de maior incidência da
PCM e as características ambientais associadas.
2. REVISÃO DE
LITERATURA
2. REVISÃO DE LITERATURA
2.1. HISTÓRICO
Há mais de cem anos, Adolpho Lutz (1908) publicou o relato pioneiro
de uma enfermidade descrita como micose pseudococcídica (TOLENTINO et
al., 2010), onde fez a descrição inicial da doença e de seu agente etiológico
(MARQUES, 2008). Este foi caracterizado morfo e biologicamente por Alonso
Splendore (1912), denominando-o Zymonema brasiliensis (PALMEIRO et al.,
2005) e por Floriano Paulo de Almeida (1930), recebendo a denominação de
Paracoccidioides brasiliensis (P. brasiliensis) (MARTINEZ, 2009). O termo
paracoccidioidomicose só foi adotado oficialmente em 1971, na reunião de
micologistas das Américas em Medelín (Colômbia) (MARQUES, 1998).
O primeiro estudo sistematizado das lesões nas mucosas causadas
pelo P. brasiliensis foi realizado em 1936, cabendo à Aguiar Pupo a descrição
da estomatite moriforme, que posteriormente recebeu seu nome (MENDES,
2009).
O comprometimento pulmonar por PCM foi relatado pela primeira vez
em 1911. Oito anos depois foi descrito o primeiro caso com participação
pulmonar
exclusiva,
sem
evidências
clínicas
de
comprometimento
extrapulmonar (MENDES, 2009).
O comprometimento de linfonodos foi relatado no trabalho de Lutz, em
1919, a que seguia a observação de que quanto mais precoce e intenso o
comprometimento de linfonodos, pior era o prognóstico (MENDES, 2009).
Em 1940, na Venezuela, Guerra relatou o primeiro caso de lesão
arterial acometendo aorta e mesentérica superior (MARTINEZ et al., 1985).
Posteriormente, novos casos de aortite blastomicótica foram relatados por
Angulo-Ortega, 1948; Benaim Pinto, 1950; Brass, 1969; Robledo, 1972;
Robledo, 1975; Goncalves, 1977 (CALDEIRA et al., 2011).
Em 1980, Mendes et al. relataram um caso de paciente portador de
PCM falecido em decorrência de insuficiência renal aguda, com autópsia
revelando acometimento vascular renal por poliarterite nodosa, sugerindo sua
possível correlação com a doença de base, sem, no entanto, confirmá-la
(CALDEIRA et al., 2011).
Em
1985,
Martinez
et
al.
relataram
o
primeiro
caso
de
comprometimento arterial de vasos de pequeno calibre por P. brasiliensis
(CALDEIRA et al., 2011).
Outros órgãos e tecidos também podem ser acometidos pela PCM,
como: fígado, baço, pele, rins, medula óssea, testículo, próstata, mama, olhos,
aparelho digestivo, etc. (MENDES, 2009).
2.2. SINONÍMIA
A PCM é, também, denominada doença de Lutz, blastomicose sulamericana, blastomicose brasileira, moléstia de Lutz-Splendore-Almeida e
micose de Lutz (GOMPERTZ et al., 2008; PALMEIRO et al., 2005).
2.3. CARACTERÍSTICAS
BIOLÓGICAS
DO
PARACOCCIDIOIDES BRASILIENSIS
O agente etiológico da PCM é o P. brasiliensis. Trata-se de um fungo
dimórfico (ALMEIDA, 2005), pois pode apresentar-se de duas formas distintas:
forma de micélio e forma da levedura (RAMOS-E-SILVA; SARAIVA, 2008), que
pertence ao Filo Ascomycota, Classe Eurotiomycetes, Ordem Onygenales e
Família Onygenaceae (MARTINEZ, 2009). Estudos genotípicos evidenciaram
três espécies crípticas de P. brasiliensis, relacionadas com a área geográfica
de origem: PS1 – isolados da Argentina, Brasil, Venezuela e Peru PS2 –
isolados do Brasil e da Venezuela e PS3 – amostras procedentes da Colômbia
(MARTINEZ, 2009).
O genoma do fungo foi estimado em 26 a 35 Mb para células
uninucleadas, tendo conteúdo haploide de DNA, contido em 4 a 5
cromossomos (MARTINEZ, 2009).
É um fungo assexuado, porém foi sugerida a presença de genes
relativos à reprodução sexuada e também à recombinação gênica intraespécie
(MARTINEZ, 2009).
O fungo é considerado termodinâmico, pois cresce tanto em
temperaturas ambiente entre 19 a 28° como em temperaturas mais altas entre
33 a 37°C (PALMEIRO et al., 2005). Em temperatura ambiente apresenta-se na
forma de micélio (ARAÚJO; SOUZA, 2002; MARTINEZ, 2004) formando hifas
finas e septadas, com clamidoconídios terminais ou intercalados, uninucleadas,
apresentando macroscopicamente aspecto de colônia cotonosa constituída de
filamentos curtos de cor branca (ARAÚJO; SOUZA, 2002; MARTINEZ, 2004;
MARTINEZ, 2009) que parece crescer no solo como sapróbio permanente
(MALUF et al., 2003).
O crescimento do micélio é lento, surgindo colônias somente depois de
2 a 4 semanas de semeadura de amostras de pacientes (MARTINEZ, 2009).
A transformação do micélio em levedura é ativada pela temperatura, na
qual ocorre a modificação de certos genes e alterações bioquímicas, como o
aumento da AMP cíclico e acúmulo de substâncias, incluindo proteínas do
choque térmico HSP70 e HSP60, havendo uma reestruturação da parede
celular (MARTINEZ, 2009).
As leveduras consistem em uma adaptação do P. brasilienses à vida
parasitária (MARTINEZ, 2009). Nos tecidos infectados, nas secreções e pus
das lesões são encontradas leveduras arredondadas, medindo de 5 a 25 μm de
diâmetro, isoladas ou em pequenos grupamentos de células, exibindo parede
celular espessa e birrefringente, podendo apresentar único ou múltiplos
brotamentos, que podem estar ligadas à célula-mãe (GOMPERTZ et al., 2008;
PALMEIRO et al., 2005).
Em meio de cultura, a 35°C as leveduras formam colônias de cor
creme e aspecto crebriforme (GOMPERTZ et al., 2008). Microscopicamente,
são células arredondadas ou ovaladas, com parede de contorno duplo, com
vesículas intracitoplasmáticas, formando agrupamentos de leveduras com
diferentes dimensões
(MARTINEZ,
2009).
Em geral
as
células
são
multinucleadas (MARTINEZ, 2009).
A transformação dimórfica é fundamental para que o fungo sobreviva
ao ambiente hostil encontrado no organismo do hospedeiro, este, muito diverso
das condições do ambiente normal de sua vida na natureza (FERREIRA;
TELES FILHO, 2009).
O P. brasiliensis é desprovido de sistemas de mobilidade e
desenvolveu evolutivamente características antigênicas para permitir sua
adesividade e interação com os tecidos do hospedeiro, impedindo a defesa
efetiva e garantindo sua sobrevivência (MENDES-GIANNINI et al., 2008;
FORTES et al., 2011). Os mecanismos imunopatológicos pelos quais ocorre a
persistência da infecção latente, invasão intravascular e disseminação do fungo
pelo organismo não são completamente esclarecidos, apesar de inúmeras
pesquisas relativas à fisiopatologia da doença e da biologia do fungo
(MENDES-GIANNINI et al., 2008; FORTES et al., 2011).
A falta de surtos documentados e o longo período entre a encubação e
a infecção e o desenvolvimento da doença constituem em importantes
obstáculos ao entendimento do ciclo biológico do P. brasiliensis (FERREIRA;
TELES FILHO, 2009).
2.4. PATOGÊNESE
A infecção pelo P. brasiliensis é adquirida nas duas primeiras décadas
de vida, com o pico de incidência entre 10 e 20 anos de idade. A evolução para
doença é incomum nessas décadas, ocorrendo mais em adultos entre 30 e 50
anos, como reativação de foco endógeno latente (PALMEIRO et al., 2005) e
depende de fatores relacionados tanto ao agente infeccioso quanto ao
hospedeiro (MALUF et al., 2003). Os mecanismos relacionados à resistência
ou a suscetibilidade do homem ao P. brasiliensis ainda são desconhecidos
(ZAITZ et al.,2006).
O homem é hospedeiro acidental do fungo. A maioria dos casos ocorre
em indivíduos que, por sua atividade, permanecem com mais frequência
diretamente em contato com vegetais e a terra, sendo geralmente
trabalhadores rurais (ARAÚJO et al., 2003).
A PCM pode resultar tanto da inalação de estruturas do fungo,
consideradas infectantes, como da reativação de algum foco preexistente
(GOMPERTZ et al., 2008).
O contágio do hospedeiro ocorre mais frequentemente pela inalação de
conídios e fragmentos micelianos, que alcançam os bronquíolos terminais e
alvéolos pulmonares, onde se transformam em células leveduriformes
(FORTES et al., 2011). No parênquima pulmonar esse fungo pode ser
destruído ou multiplicar-se e produzir foco de infecção, o qual é drenado para o
linfonodo regional localizado no hilo pulmonar, caracterizando, assim, o
complexo primário da PCM. No entanto essas lesões podem regredir
espontaneamente em indivíduos imunocompetentes, com destruição total ou
parcial do fungo, caracterizando a forma subclínica da doença (LOPEZ;
RESTREPO, 1983; LACAZ et al., 1959).
Eventualmente, os fungos contidos no complexo primário podem
disseminar por via linfática e/ou hematogênica, atingindo outros órgãos,
causando a forma juvenil ou aguda (LONDERO; DEL NIGRO, 1986). No
entanto, muitos indivíduos permanecem com o complexo primário cicatricial
contendo fungos viáveis, denominados de lesões quiescentes, que podem
evoluir para PCM crônica muitos anos após a infecção (FRANCO, 1986).
Após a infecção, a progressão da doença clinicamente aparente pode
depender da virulência e quantidade de inoculo da amostra inalada, assim
como da presença, da quantidade e da qualidade de defesa do organismo do
hospedeiro
infectado
(FERREIRA;
TELES
FILHO,
2009).
Fatores
circunstanciais como o estado nutricional e socioeconômico, coinfecções,
terapêuticas imunossupressoras, alcoolismo e tabagismo podem favorecer o
aparecimento da doença (SAMPAIO; RIVITTI, 2007; PEREIRA et al., 2011),
assim como os casos de reexposição às fontes de contágio (CALDEIRA et al.,
2011).
A associação da PCM com outras doenças granulomatosas ou
neoplasias tem sido observada, sendo a tuberculose a mais frequente
(FORTES et al., 2011).
Excepcionalmente, é possível a inoculação traumática do fungo, via
tegumentar (FORTES et al., 2011). Existem relatos de infecção através de
inoculação intradermica, mucosa ou via trato gastrintestinal, no entanto, as
mesmas parecem ser frustras ou autorresolutivas, haja vista o fungo não
cumprir o ciclo pulmonar (CALDEIRA et al., 2011).
Acreditava-se, no passado, que a implantação traumática do fungo na
mucosa oral, por meio de fragmentos de vegetais comumente usados para
limpeza dentária no meio rural, fosse a via de entrada desse agente infeccioso
em razão de muitos pacientes apresentarem ulcerações na boca (PALMEIRO
et al., 2005). Contudo, experimentos em animais não sustentam essa hipótese
(MARTINEZ, 2004; VERLI et al., 2005).
As lesões que comumente são vistas na mucosa bucal, retal, intestinal
e as cutâneas devem todas ser consideradas secundárias à disseminação
hematogênica do agente a partir dos pulmões (FERREIRA; TELES FILHO,
2009), embora as manifestações estomatológicas sejam o principal motivo da
consulta para tratamento (VERLI et al., 2005).
As lesões estomatológicas apresentam-se exulceradas e ulceradas, de
contornos e bordas irregulares, com superfície granulomatosa, de fundo
amarelado, entremeadas por pontos hemorrágicos que lhe conferem aspecto
moriforme (MARTINEZ, 2004). Estas são espontaneamente dolorosas durante
a mastigação, prejudicando a higiene oral e contribuindo efetivamente para a
depleção do quadro nutricional do paciente (VERLI et al., 2005). A cicatrização
das lesões provoca microstomia de intensidade variável como sequela da PCM
(VERLI et al., 2005).
O conhecimento dessa doença é de grande interesse odontológico,
uma vez que, entre suas manifestações, as lesões bucais concorrem para sua
caracterização clínica e condicionam a necessidade de participação do
cirurgião-dentista no diagnóstico e na terapêutica desta micose (VERLI et al.,
2005).
2.5. CLASSIFICAÇÃO DAS FORMAS CLÍNICAS
Diversas classificações das formas clinicas da PCM já foram descritas
desde o descobrimento da doença. Todas se baseiam em diferentes critérios
(topografia das lesões, gravidade da doença, resultado de reações sorológicas,
historia natural, etc.) e nenhuma delas passou a ser adotada de forma
sistêmica pelos pesquisadores (FERREIRA, 2009).
Na década de 1960, Fava Neto sugeriu uma classificação simples que
dividia a doença em duas modalidades: a benigna, forma não disseminada da
micose, com baixa concentração de anticorpos nas reações sorológicas, e a
grave, disseminada, com grande numero de anticorpos, sempre detectados na
forma ativa da moléstia (FERREIRA, 2009).
Em fevereiro de 1986 em Medellín, Colômbia, foi apresentada uma
nova classificação no International Colloquiumon Paracoccidioidomycosis, que
correlaciona dados clínicos à história natural da moléstia, que, à semelhança
de outras micoses presumia a existência de infecção e doença (FERREIRA,
2009; SHIKANAI-YASUDA et al., 2006). A proposta foi:
Paracoccidioidomicose – infecção
Paracoccidioidomicose – doença
o Forma aguda ou subaguda (tipo juvenil)
Moderada
Grave
o Forma crônica (tipo adulto)
Unifocal
Leve
Moderada
Grave
Multifocal
Leve
Moderada
Grave
Paracoccidioidomicose – residual ou sequelar
2.5.1. Forma aguda ou subaguda (tipo juvenil)
Atualmente não é utilizado o critério de idade para classificar o paciente
em “juvenil” ou “adulto” (FERREIRA, 2009).
Esta forma de apresentação clínica é responsável por 3 a 5% dos
casos da doença, predominando em crianças e adolescentes, mas podendo
eventualmente, acometer indivíduos até os 35 anos de idade. A distribuição da
forma aguda / subaguda é semelhante em crianças dos gêneros masculino e
feminino.
Esta forma clínica caracteriza-se por evolução mais rápida, onde o
paciente geralmente procura o serviço médico entre 4 a 12 semanas de
instalação da doença. Em ordem de frequência, podemos destacar a presença
de
linfadenomegalia,
manifestações
digestivas,
hepatoesplenomegalia,
envolvimento ósteo-articular e lesões cutâneas como as principais formas de
apresentação desta forma da micose. (SHIKANAI-YASUDA et al., 2006).
Formas pulmonares com envolvimento mucoso podem eventualmente
aparecer em adolescentes e adultos jovens (FERREIRA, 2009).
Não há formas leves do tipo juvenil (FERREIRA, 2009), bem como os
critérios de gravidade – moderado e grave – são subjetivos, podendo variar conforme
a análise individual do clínico (Brasil,2012).
2.5.2. Forma crônica (tipo adulto)
Esta forma clínica responde por mais de 90% dos pacientes, e
apresenta-se
principalmente
em
adultos
entre
os
30
e
60
anos,
predominantemente, do sexo masculino. A diferença nessa distribuição por
sexo deve-se não a maior exposição do homem às fontes de infecção, mas sim
a fatores reguladores hormonais (FERREIRA, 2009). Acredita-se que essa
diferença marcante seja atribuída ao efeito protetor dos hormônios femininos
(uma vez que o beta-estradiol inibe a formação de hifas dos micro-organismos
para a forma patogênica de leveduras) (NEVILLE, 2009). A doença progride
lentamente, de forma silenciosa, podendo levar anos até que seja
diagnosticada. As manifestações pulmonares estão presentes em 90% dos
pacientes (FERREIRA, 2009).
É chamada de apresentação unifocal quando a micose está restrita a
somente um órgão sendo a doença pulmonar isolada a mais comum, podendo
ser também isolada cutânea, com aparecimento de lesões sarcoidicas ou de
aspecto hansenóide e ainda, isolada ao sistema nervoso central (SNC),
manifestando-se com processos centro-encefálicos ou medulares (BRASIL,
2012; SHIKANAI-YASUDA et al., 2006; CALDEIRA et al., 2001).
No que se diz respeito à forma crônica multifocal, ocorre acometimento
conjunto de diversos órgãos e sistemas, entre eles pulmão, linfonodos, pele,
mucosas, trato respiratório alto, adrenais, ossos e SNC (CALDEIRA et al.,
2001).
O comprometimento adrenal tem sido registrado em cerca de 50% dos
casos; o SNC é comprometido em cerca de 6 a 25% dos casos, sendo mais
comuns às lesões expansivas, únicas ou múltiplas, em hemisférios do cérebro,
cerebelo ou de ambos. As manifestações de comprometimento linfático
(adenomegalia), adrenal (astenia, emagrecimento, hipotensão, escurecimento
de pele, dor abdominal), SNC (cefaleia, déficit motor, convulsões, alterações de
comportamento e/ou nível de consciência) e lesões ósteo-articulares, cujo
aspecto radiológico caracteriza-se por lesões líticas, também têm sido
relatadas (BRASIL, 2012).
Granulomas paracoccidioidomicóticos podem ser vistos ainda em
fígado, baço, intestinos, olhos, peritônio, pâncreas, ovários, útero, tireoide,
entre outros. Locais menos comumente descritos, porem acometidos, são os
vasos de grande, médio e pequeno calibre (CALDEIRA et al., 2001).
Para enquadrar um paciente da forma crônica nos subtipos unifocal ou
multifocal poderá ser necessária a realização de métodos propedêuticos mais
sofisticados, como por exemplo: exame de imagem (FERREIRA, 2009).
Os critérios de gravidade – leve, moderado e grave – podem auxiliar no
planejamento da terapêutica do paciente; são subjetivos, podendo variar conforme a
análise individual do clínico. Entretanto, alguns parâmetros devem ser utilizados para
enquadrar de maneira correta cada doente dentro da classificação (comprometimento
do estado geral, perda de peso, tipo de linfadenopatia e gravidade do envolvimento
pulmonar) (BRASIL, 2012).
A anamnese e o exame físico devem obrigatoriamente incluir a
pesquisa de sinais e sintomas relacionados ao envolvimento pulmonar,
tegumentar e laríngeo (tosse, dispneia, expectoração muco purulenta, lesões
ulceradas em pele, mucosa de nasofaringe, odinofagia, disfagia, disfonia)
(BRASIL, 2012).
2.5.3. Forma sequelar
As sequelas caracterizam-se pelas manifestações cicatriciais que se
seguem ao tratamento da micose. Por ser uma doença sistêmica, cuja resposta
do hospedeiro ao agente infectante consiste em processo inflamatório
granulomatoso, que leva à fibrose. O acúmulo de colágeno associado à
formação de fibrose pode levar a alterações anatômicas e funcionais dos
órgãos
acometidos
durante
a
doença,
particularmente
os
pulmões,
suprarrenais e sistema nervoso central. (BRASIL, 2012).
Além das sequelas relacionadas às lesões pulmonares, adrenais e do
sistema nervoso central, o processo de fibrose decorrente do envolvimento de
mucosas e pele pode causar alterações crônicas da voz (disfonia por lesão de
corda vocal), obstrução laríngea, com necessidade de traqueostomia, redução
da rima bucal e sinéquia de nádegas. Nas formas agudas, as sequelas mais
comuns são obstrução de linfáticos abdominais, com síndrome de má absorção
e perda de proteínas e quadros de icterícia obstrutiva (BRASIL, 2012).
2.6. MÉTODOS DE DIAGNÓSTICO
O diagnostico laboratorial pode ser realizado a partir da demonstração
do agente etiológico por exame a fresco, biopsia ou histopatológico e
confirmado pelo isolamento e cultura do fungo e por técnicas sorológicas,
sendo estas, mais utilizadas no seguimento terapêutico e pós-terapêutico
(CALDEIRA et al., 2001), e mais recentemente por métodos moleculares
(GIANNINI et al., 2009).
O padrão ouro para o diagnóstico laboratorial desta micose consiste na
identificação do fungo pelo exame micológico, que compreende a análise do
esfregaço ou material biológico diretamente em lâmina e lamínula e a cultura
(BRASIL, 2012).
As amostras biológicas mais comuns são as do trato respiratório como
escarro, de gânglios, lesões cutâneas como pus e mucosas, coletadas
segundo a localização da doença e na maiora das vezes, o P. brasilliensis
pode ser observado por meio de microscopia direta. O fungo é, em geral,
nessas lesões abundante e facilmente reconhecido, sem necessidade de
coloração especial (GIANNINI et al., 2009; GOMPERTZ et al., 2008).
A obtenção apropriada da amostra biológica, bem como sua
manipulação correta sem a perda da viabilidade do agente etiológico e possível
contaminação, são aspectos fundamentais para o diagnóstico laboratorial,
principalmente para o isolamento do agente (GIANNINI et al., 2009).
A citologia esfoliativa pode contribuir para o diagnóstico dessas lesões
(ARAÚJO et al., 2003). Acresce que, com o emprego de colorações especiais,
aumenta a acurácia da citologia esfoliativa oral no diagnóstico desta micose
(ARAÚJO et al., 2003). Como as regiões periodontal e labial são as mais
acometidas nas formas orais crônicas da PCM, a utilização da citologia
esfoliativa pode ajudar muito no diagnóstico destas lesões (ARAÚJO et al.,
2003).
A sensibilidade do exame direto (exame a fresco, esfregaço e
histopatológico) varia de 80 a 100%, dependendo do laboratório (Giannini et al.,
2009).
O exame histopatológico é de grande valor não só para a visualização
das formas fúngicas (célula mãe e brotamento) por colorações comuns
(hematoxilina eosina e tratamento pela prata), como também é indicado para
situações em que a amostra não permitiu a visualização do fungo, como no
líquor (baixa sensibilidade de técnica micológica) e quando clinicamente não há
focos que permitam o diagnóstico da doença sistêmica (BRASIL, 2012).
As biópsias de lesões orais extensas, ulcerativas e dolorosas são
pouco comuns na rotina da Odontologia, o que leva muitos casos da micose
serem diagnosticados tardiamente; levando a sérios prejuízos para o doente
(ARAÚJO et al., 2003; TOLENTINO et al., 2010).
Algumas situações que impossibilitam a coleta de material biológico,
como estado clínico do paciente e localização da lesão, emprega-se técnicas
sorológicas para o diagnóstico. As provas sorológicas específicas, pesquisam
o anticorpo específico anti-P. brasilliensis, e têm importância não apenas no
auxílio diagnóstico, como, particularmente, para permitir avaliação da resposta
do hospedeiro ao tratamento específico (BRASIL, 2012; FORJAZ et al.,1999).
Os testes sorológicos revelam a existência do microrganismo antes
mesmo dos exames cultural e histopatológico (PALMEIRO et al., 2005).
Usando-se técnicas padronizadas e antígenos adequados, esses testes
apresentam sensibilidade e especificidade entre 85 e 100% (GIANNINI et al.,
2009).
Testes sorológicos como Elisa, imunodifusão dupla em gel de agar
(IDD),
contraimunoeletroforese
(CIE)
(Giannini
et
al.,
2009)
e
imunofluorescência indireta (IFI) (BRASIL, 2012) são utilizados e mostram-se
eficazes no diagnóstico da doença (Giannini et al., 2009). Entre essas inúmeras
técnicas sorológicas disponíveis, a IDD destaca-se pela simplicidade de
execução, baixo custo e alta sensibilidade e especificidade (FORJAZ et al.,
1999).
Por meio da técnica de identificação molecular polymerase chain
reaction (PCR) ou suas variantes, pode-se detectar fragmentos de DNA do P.
brasiliensis, com finalidade diagnóstica, com sensibilidade e especificidade
elevadas (Giannini
et al., 2009). Essa metodologia apresenta maior
sensibilidade que os métodos de rotina (TOLENTINO et al., 2010).
Essa investigação indireta é baseada numa glicoproteína (gp) de 43
Kilodalts (Kda), conhecida como gp43, que é um importante componente
exocelular secretado pelo P. brasiliensis durante a sua fase patogênica
(TOLENTINO et al., 2010). Corresponde ao componente antigênico majoritário
excretado para meios de cultura e pode ser usada no reconhecimento de
anticorpos séricos em pacientes comprometidos pela doença (TOLENTINO et
al., 2010). Outro antígeno expresso pelo fungo é a glicoproteína de 70 Kda, a
gp70, reconhecida por 96% dos soros de pacientes portadores de PCM no
momento do diagnóstico. Uma fração recombinante de 27 Kda foi também
reconhecida por 91% dos soros de paciente com PCM ativa em ensaio
immunoblotting, com especificidade de 100% (Giannini et al., 2009).
O método de diagnósticos por imagem tem contribuído para detecção
dos sítios comprometidos em vigência de disseminação da micose (Giannini et
al., 2009).
Casos com resultados falsos negativos, observados com quaisquer dos
testes, na maioria das vezes se associam com lesões muito localizadas e com
hospedeiros imunodeprimidos (BRASIL, 2012).
A realização de exames mais complexos está condicionada a suspeita
clínica ou alterações laboratoriais que indiquem comprometimento do SNC,
gastrintestinal, disfunção adrenal, insuficiência respiratória ou lesões ósteoarticulares, entre outros (BRASIL, 2012).
2.7. EPIDEMIOLOGIA
Entre as doenças infecciosas e parasitárias, a PCM foi a oitava causa
de mortalidade no Brasil, no período de 1980 a 1995. A taxa média anual de
mortalidade da doença é maior em estados do Sul e Sudeste do Brasil,
alcançando até 3,8/milhão de habitantes (MARTINEZ, 2009).
Deve-se proceder a investigação epidemiológica frente à ocorrência
e/ou notificação de um ou mais casos do mesmo agravo, para que se
obtenham informações quanto à caracterização clínica do caso (incluindo a
análise dos exames laboratoriais), quanto às possíveis fontes de infecção e
para a avaliação das medidas de controle cabíveis em cada situação (BRASIL,
2012).
A PCM não é uma doença de notificação compulsória, apesar de ser
uma micose profunda que se não tratada adequadamente leva o paciente a
óbito (SPOSTO et al., 1994; BRASIL, 2012). A inexistência de vigilância
epidemiológica de rotina (BRASIL, 2012) faz com que uma análise quantitativa
e qualitativa não possa ser determinada precisamente (SPOSTO et al.,1994).
Por esse motivo, sua prevalência tem sido estimada a partir de casuísticas já
publicadas (CARVALHOSA et al., 2012; FORJAZ et al.,1999; GOLDANI, 2011;
PANIAGO et al., 2003; TRAD et al., 2006) e de estatísticas de hospitais
universitários (MARTINEZ, 2009).
Estimou-se a incidência anual da doença de 1 a 3 casos por 100.000
habitantes de áreas endêmicas da América Latina (MARTINEZ, 2009).
O conhecimento sobre a epidemiologia da infecção baseia-se em
inquéritos com a reação intradérmica de leitura tardia, que é considerada uma
estratégia simples, adequada e de baixo custo para avaliar a prevalência
regional do patógeno (PALMEIRO et al., 2005). Embora existam relatos
mostrando a dificuldade de comparar os resultados desse exame face à
heterogeneidade dos antígenos, há dados que demonstram que esses testes
são positivos nas formas subclínicas e crônicas e negativos nas formas agudas
e subagudas (tipo juvenil) (PALMEIRO et al., 2005). A porcentagem de
indivíduos normais com teste positivo variou, em valores de 2 a 70%,
verificando-se maior reatividade em áreas endêmicas e na população rural
(MARTINEZ, 2009). Apesar da possibilidade de reação cruzada com outros
fungos, particularmente o Histoplasma capsulatum, a resposta imunológica
específica ao P. brasiliensis é identificável (MANGIATERRA et al., 1996).
De acordo com dados de inquéritos epidemiológicos realizados com
paracoccidioidina no Brasil, Venezuela, Colômbia e Argentina, acredita-se que
em torno de 50% dos habitantes de zonas endêmicas tenham sido expostos ao
agente desta micose. Uma pequena proporção de indivíduos expostos ao P.
brasiliensis desenvolve alguma manifestação clínica da micose. Esta micose
representa um importante problema de Saúde Pública devido ao seu alto
potencial incapacitante e à quantidade de mortes prematuras que provoca
(SHIKANAI-YASUDA et al., 2006), quando não há intervenção terapêutica
oportuna (BRASIL, 2012). Isso é verdadeiro principalmente para segmentos
sociais específicos, como os trabalhadores rurais que ainda apresentam
grandes deficiências de acesso e suporte da rede dos serviços de saúde
favorecendo o diagnóstico tardio (SHIKANAI-YASUDA et al., 2006).
A maioria dos casos foi reportada nas regiões Sul, Sudeste e CentroOeste. Esta micose apresenta caráter endêmico entre as populações de zona
rural. Foi relatada a ocorrência de casos em áreas de colonização mais
recente, submetidas a desmatamento, como em partes da Amazônia, atingindo
áreas dos estados do Maranhão, Tocantins, Pará, Mato Grosso, Rondônia,
Acre e Amazonas, onde a PCM pode ser considerada uma micose sistêmica
emergente (BRASIL, 2012).
2.8. RELAÇÃO PARACOCCIDIOIDES BRASILIENSIS E MEIO
AMBIENTE E A DOENÇA
A relação entre o P. brasiliensis e o meio ambiente ainda não está
completamente esclarecida (FORTES et al., 2011), mas acredita-se que o
fungo viva saprofiticamente no solo úmido, rico em proteínas, e em solos
cercados por rios, lagos e pântanos, onde as variações de temperatura são
mínimas (ARAÚJO et al., 2003; FORTES et al., 2011). Nestes ambientes, os
fungos crescem na fase de micélio, produzindo conídios que sobrevivem por
vários meses, possibilitando a dispersão aérea, fazendo com que propágulos
infectantes sejam inalados pelo homem até os alvéolos pulmonares, dando
origem a uma infecção subclínica que poderá se disseminar para outros órgãos
por via linfo-hematogênica (ORTEGA et al., 1996).
2.9. DISTRIBUIÇÃO
PARACOCCIDIOIDOMICOSE
GEOGRÁFICA
DA
A PCM tem distribuição geográfica limitada à América Latina onde se
estima que cerca de 10 milhões de pessoas estejam infectadas (ALMEIDA,
2005; ALMEIDA et al., 2003).
A incidência da doença no Brasil, maior detentor dos casos, é
considerada endêmica, sendo observada nos estados do Rio Grande do Sul,
Paraná (MALUF et al., 2003), São Paulo, Rio de Janeiro, Minas Gerais
(ARAÚJO et al., 2000), Mato Grosso do Sul (PANIAGO et al., 2003) e regiões
de cerrado de Goiás e Mato Grosso (VERLI et al., 2005). A doença é menos
frequente no Nordeste do País, principalmente nas regiões de clima árido
(MARTINEZ, 2009).
A distribuição geográfica da doença parece ter mudado nas últimas
décadas, afetando principalmente as regiões Norte e Centro-Oeste do país,
provavelmente devido à abertura de novas fronteiras agrícolas (SHIKANAIYASUDA et al., 2006; RAMOS-E-SILVA et al., 2008).
2.10.
O ESTADO DE MATO GROSSO
Localizado no centro geodésico da América do Sul, e no Centro-Oeste
do Brasil, atrai contingentes populacionais de todas as regiões brasileiras com
destino principalmente às áreas de cerrados do planalto (CAMARGO, 2011).
Figura 1. Mapa político do Brasil, mostrando a divisão por estados e regiões
(Fonte: http://brazilbrazilian.blogspot.com.br/2010/08/mapa-politico-dobrasil.html)
Todo processo de atração migratória do Estado sempre esteve ligado à
sua estrutura socioeconômica pautada no processo de colonização ligado à
exploração de recursos naturais e nas politicas governamentais com
programas de ocupação e desenvolvimento regional no Estado (CAMARGO,
2011).
Como
consequência
desta
“colonização acelerada”,
ocorreu
a
multiplicação de diversos novos municípios nas áreas de fronteira, como é o
caso do norte de Mato Grosso, os quais sofrem até hoje com a ausência de
infraestrutura e serviços. São cidades pequenas, na maioria das vezes com
população variando entre 20 e 50 mil habitantes (CUNHA, 2006).
Nas ultimas décadas Mato Grosso vivência significativa transformação
socioeconômica que o projeta em destaque no cenário econômico nacional e
internacional (CAMARGO, 2011).
A economia de Mato Grosso baseia-se no agronegócio com 114.148
estabelecimentos agropecuários que somam 48.355.569 de hectares. Este
Estado amazônico possui 17.758.922 hectares de áreas de matas e florestas
(Brasil, 2006). A vegetação predominante é o cerrado, além de ter em seu
território parte da maior planície inundável do planeta, o pantanal matogrossense.
O Estado conta com 141 municípios distribuídos em 903.357.908 km²
de extensão territorial, com uma população estimada de 3.115.336 (Brasil,
2012a) e abrange três bacias hidrográficas: a Bacia do Rio Amazonas, a Bacia
do Rio Tocantins e a Bacia do Rio Paraná (CAMARGO, 2011).
O território do Estado de Mato Grosso, localizado entre as latitudes de
8 à 18º LS, encontra-se dentro da faixa intertropical da porção central do
Continente Sul-Americano. Primeiro fato que se pode traduzir desta posição
são elevados totais de radiação solar global, incidentes na superfície do solo,
praticamente o ano todo. Comprimento do dia, através da insolação, indica
pequenas varações entre os solstícios de inverno e verão. Resulta assim, o
domínio de climas Equatoriais e Tropicais Quentes com pequena variação
térmica sazonal e anual. Em termos médios, amplitude diária varia de 10 à
14ºC e em termos absolutos pode se aproximar com muita frequência de
valores entre 16° a 20°C, enquanto que a amplitude térmica anual varia entre
1,5° e 4,0°C (TARIFA, 2011).
O campo de variação da temperatura média anual no estado é de 21 a
26ºC (TARIFA, 2011).
A variação mensal das temperaturas médias compensadas mostra um
ritmo de máximo aquecimento no equinócio de primavera (outubro-novembro),
esta característica é comum a todas as unidades climáticas (TARIFA, 2011).
Em Alta Floresta, Matupá, Cotriguaçu, Juína e Vilhena, apresentam
amplitude térmica anual muito parecida, com valores entre 1,9 e 2,5ºC.
Destaca-se outubro como mês mais quente com temperaturas variando de
25,3ºC a 26,1ºC, enquanto o mês mais frio é julho com 23,4º C a 23,8ºC
(TARIFA, 2011).
2.12
GEORREFERENCIAMENTO
A influência do meio ambiente sobre as condições de saúde das
pessoas é uma preocupação antiga do ser humano. Ainda no século V a.C.,
Hipócrates já defendia a importância do espaço como o lócus de ocorrência
das doenças (MOREIRA et al., 2007).
Até os dias atuais, os epidemiologistas questionam se existe algum
padrão na distribuição da doença no espaço, se há alguma associação com
alguma fonte etiológica (água, poluição atmosférica, temperatura e violência
urbana, por exemplo), se há alguma evidência de transmissão e se houve
variação no tempo (MOREIRA et al., 2007).
Pessoas, lugar e tempo constituem a tríade básica da produção e
interpretação dos constructos epidemiológicos, podendo ser escrita como
pessoas em lugares/tempo, evidenciando o papel fundamental do espaço
(físico e histórico) na ocorrência de eventos em saúde. A visualização da
distribuição da tríade epidemiológica no espaço e a tradução dos padrões
existentes nesta distribuição vêm sendo cada vez mais refinadas com o
crescente uso dos Sistemas de Informação Geográfica (SIG) (MOREIRA et al.,
2007).
Para que sejam utilizadas como meio de análise, as bases de dados de
saúde devem ser georreferenciadas, integradas a dados ambientais e
socioeconômicos, e submetidas a procedimentos de avaliação de sua
distribuição espacial (BARCELLOS et al., 2008).
O objetivo destas análises é estudar a distribuição espacial dos pontos,
testando hipóteses sobre o padrão observado: se é aleatório, se apresenta-se
em aglomerados ou se os pontos estão regularmente distribuídos. O objeto de
interesse é a própria localização espacial dos eventos em estudo (CARVALHO;
CÂMARA, 2004).
Ao analisar padrões de distribuição de pontos, o interesse primário é
determinar se os eventos observados exibem algum padrão sistemático, em
oposição a uma distribuição aleatória. Busca-se detectar a existência de
padrão de conglomerados espaciais através da constatação de um número
acima do esperado de casos excessivamente próximos, considerando uma
distribuição estocástica, usualmente um processo de Poisson. Se um padrão
de eventos pontuais apresentar desvios significativos do comportamento
esperado para uma distribuição de Poisson, isto indica a existência de uma
distribuição espacial diferente da completa aleatoriedade, que merece ser
objeto de maior análise (CARVALHO; CÂMARA, 2004).
O georreferenciamento de um dado com endereço é definido como o
processo de associação desse dado a um mapa e pode ser efetuado de três
formas básicas: associação a um ponto, a uma linha ou a uma área. O
resultado desse processo é a criação de elementos gráficos que podem ser
usados para a análise espacial (BARCELLOS et al., 2008).
Na área da Saúde, os SIG têm se tornado ferramentas de grande
utilidade. Sua capacidade de integrar diversas operações, como captura,
armazenamento, manipulação, seleção e busca de informação, análise e
apresentação de dados, auxilia o processo de entendimento da ocorrência de
eventos, predição, tendência, simulação de situações, planejamento e definição
de estratégias no campo da Vigilância em Saúde (BARCELLOS et al., 2008).
A incorporação dos SIG pela Saúde tem história relativamente recente
e ainda depende de um conjunto de bases tecnológicas e metodológicas em
fase de implementação. Os últimos anos vêm sendo marcados pela crescente
disponibilidade e facilidade de acesso e análise de dados mediante sistemas
computacionais simples (BARCELLOS et al., 2008), com isso observa-se o
crescimento no numero de trabalhos utilizando essa metodologia (CHIESA et
al.,2002, MOREIRA et al., 2011; CORREA, 2012).
Uma alternativa para analisar o comportamento de padrões de pontos
é estimar a intensidade pontual do processo em toda a região de estudo. Para
isto,
pode-se
ajustar
uma
função
bi-dimensional
sobre
os
eventos
considerados, compondo uma superfície cujo valor será proporcional à
intensidade de amostras por unidade de área. Esta função realiza uma
contagem de todos os pontos dentro de uma região de influência, ponderandoos pela distância de cada um à localização de interesse, sendo denominada de
estimador de Kernel (CARVALHO; CÂMARA, 2004).
O estimador Kernel é um estimador de intensidade de padrões que
trabalha somente sobre as áreas onde a densidade de amostragem é grande,
identificando sobre estas áreas as maiores incidências da variável (OLIVEIRA,
SANTOS, 2011). Ele inicia-se como um conjunto de pontos de eventos de
interesse. Quando houver mais de um caso no mesmo ponto, eles estarão
sobrepostos no mapa. Para estimar a densidade de casos numa posição (x,y),
conta-se o numero de eventos dentro de um raio r em torno de (x,y). Essa
contagem é ponderada pela distância de cada evento ao ponto de referência
(x,y) através da função de suavização (função de Kernel) (OLIVEIRA,
SANTOS, 2011).
É um método bastante útil para fornecer uma visão geral da
distribuição de primeira ordem dos eventos, de fácil uso e interpretação
(CARVALHO; CÂMARA, 2004).
3. PROPOSIÇÃO
3.
PROPOSIÇÃO
Analisar através de georreferenciamento a ocorrência da PCM no
Estado de Mato Grosso buscando identificar características ambientais
envolvidas em sua incidência.
3.1. OBJETIVOS ESPECÍFICOS
Traçar o perfil dos casos de PCM segundo o sexo, idade e
ano de diagnóstico;
Analisar a distribuição espacial dos casos de PCM
correlacionando-a com as características ambientais e fatores sócios
geográficos do local de procedência dos casos através do uso de
técnicas de geoprocessamento.
4. MATERIAIS E
MÉTODO
4.
MATERIAIS E MÉTODO
4.1. DESENHO DO ESTUDO
Trata-se de um estudo transversal, descritivo e retrospectivo realizado
por meio de pesquisa documental. Como objeto de estudo foram eleitos os
laudos citológico e histopatológico das lesões bucais.
4.2. POPULAÇÃO
Foram utilizados como fonte de pesquisa os laudos citológicos e
histopatológicos do banco de lesões do serviço de patologia bucal do
Laboratório Público do Estado de Mato Grosso (MT Laboratório), referência na
realização de exames citológicos e histopatológicos de boca para os 1.255
estabelecimentos de saúde pertencentes ao SUS sediados em Mato Grosso
(CARVALHOSA et al., 2012).
Foram incluídos apenas exames de citologia esfoliativa bucal e biópsia
de lesões de boca, sendo excluídos os diagnósticos da PCM pelos métodos
micológico direto, cultura, exame sorológico e intradermorreação.
Os blocos de parafina do arquivo do MT Laboratório foram recortados,
e as novas lâminas foram coradas com coloração de rotina e especiais para
melhor evidenciação dos fungos.
O material de novos exames encaminhados durante o período de
estudo foi processado utilizando as técnicas histológicas de rotina para o
diagnostico, ou seja, fixação da peça cirúrgica, desidratação na cadeia
acedente do álcool, hidratação utilizando-se da cadeia descendente de álcool,
realizada no histotécnico (processador de tecidos). O material foi incluído em
parafina, e cortes de 5,0 cm foram realizados com micrótomo. Na sequência os
materiais dispostos nas lâminas foram corados e devidamente montados para
análise microscópica.
Com a confirmação do diagnóstico laboratorial, e recolhidas as
informações acerca do paciente e de sua procedência, foi construída a base de
dados dos casos de PCM e esta cruzada com a base de dados espacial. A
base de dados espacial utilizada na pesquisa foi fornecida pelo servidor de
mapas da Secretaria de Estado de Planejamento e Coordenação Geral do
Estado de Mato Grosso. A análise espacial utilizou o software ArcGIS 10.1
(ESRI, Redlands, Califórnia, E.U.A).
4.3. ANÁLISE DOS DADOS
Inicialmente foi realizada a análise descritiva dos casos de PCM
diagnosticados no MT Laboratório. As variáveis examinadas foram o método de
diagnóstico (citologia esfoliativa bucal ou biópsia); ano de diagnóstico; idade e
sexo do paciente e local de procedência do caso.
Dados como raça/cor de pele, ocupação e sítio anatômico da lesão não
foram incluídos, pois além de não estarem preenchidos em diversos laudos,
não vão ao encontro do objetivo deste trabalho.
Após a coleta e consolidação dos dados, foi realizada sua tabulação e
análise descritiva.
O processo de análise da distribuição espacial dos casos de PCM no
estado se deu pelo estudo do estimador de intensidade de Kernel, com
localização de maior ou menor concentração dos fenômenos no espaço.
A metodologia utilizada baseia-se em aplicação de técnicas de
estatística
espacial
e
de
geoprocessamento,
através de
ferramentas
computacionais dos SIG´s. Utilizando a técnica do estimador de Kernel foi
gerado uma grade com células e com processos pontuais da ocorrência dos
casos de PCM.
4.4. PERÍODO DE ESTUDO
Foram analisados os laudos emitidos desde o início da implantação do
serviço de patologia bucal (Janeiro de 2005) até Dezembro de 2011.
4.5. ASPECTOS ÉTICOS
O presente trabalho é complementar a pesquisa anterior cujo projeto foi
aprovado pelo Comitê de Ética em Pesquisa da Escola de Saúde Pública de
Mato Grosso / Secretaria de Estado de Saúde de Mato Grosso, através do
parecer nº 439/2009.
5. RESULTADOS
5.RESULTADOS
Os resultados referentes ao número de casos diagnosticados no
período de estudo e à descrição do perfil dos pacientes correspondentes aos
laudos citológicos e histopatológicos do banco de lesões do serviço de
patologia bucal do MT Laboratório estão descritos na forma de tabelas a seguir.
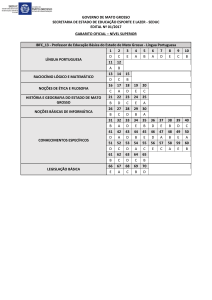
Tabela 1. Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato Grosso segundo o ano de
diagnóstico, no período de 2005 a 2011.
Ano de diagnóstico
n
%
2005
12
9,6
2006
32
25,6
2007
23
18,4
2008
14
11,2
2009
21
16,8
2010
11
8,8
2011
12
9,6
Total
125
100,0
A distribuição dos casos de paracoccidioidomicose diagnosticados
através de lesões de boca em Mato Grosso no período abarcado pelo estudo
mostra um maior número de diagnósticos no ano de 2006 (25,6%), seguido dos
anos de 2007 (18,4%) e 2009 (16,8%). O ano que apresentou o menor número
de diagnósticos de PCM no período de estudo foi 2010 (8,8%) (Tabela 1).
Tabela 2. Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato Grosso, segundo o sexo do
paciente, no período de 2005 a 2011.
Sexo
N
%
Masculino
123
98,4
Feminino
2
1,6
125
100,0
Total
Dentre os casos de paracoccidioidomicose diagnosticados através de
lesões de boca em Mato Grosso no período de 2005 a 2001, 123 casos
(98,4%) eram de pacientes do sexo masculino (Tabela 2).
Tabela 3. Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato Grosso, segundo a faixa
etária do paciente, no período de 2005 a 2011.
Idade
N
%
< 20 anos
2
1,6
21 – 40 anos
21
16,8
41 – 60 anos
77
61,6
61 – 80 anos
25
20,0
Total
125
100,0
Com relação à faixa etária, 77 casos (61,6%) eram de pacientes na
faixa etária compreendida entre 41 e 60 anos (Tabela 3).
Tabela 4. Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato Grosso, segundo o tipo de
exame anatomopatológico realizado, no período de 2005 a 2011.
Tipo de exame
n
%
Histológico
98
78,4
Citologia bucal
27
21,6
Total
125
100,0
Com relação ao tipo de exame anatomopatológico realizado, 98
(78,4%) destes eram exames histológicos (Tabela 4).
Tabela 5. Distribuição dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca em Mato Grosso, segundo o
município de procedência do paciente, no período de 2005 a 2011.
Município de procedência
N
%
Água Boa
1
0,8
Alta Floresta
10
8,0
Araputanga
1
0,8
Arenápolis
1
0,8
Brasnorte
5
4,0
Cáceres
1
0,8
Município de procedência
N
%
Campo Novo do Parecis
2
1,6
Campo Verde
2
1,6
Carlinda
3
2,4
Castanheira
3
2,4
Chapada dos Guimarães
1
0,8
Cláudia
1
0,8
Colíder
7
5,6
Colniza
1
0,8
Conquista do Oeste
1
0,8
Cotriguaçú
4
3,2
Cuiabá
7
5,6
Diamantino
1
0,8
Dom Aquino
4
3,2
Feliz Natal
1
0,8
General Carneiro
1
0,8
Guarantã do Norte
5
4,0
Guiratinga
1
0,8
Indiavaí
2
1,6
Ipiranga do Norte
3
2,4
Itanhangá
1
0,8
Itiquira
1
0,8
Jaciara
3
2,4
Juína
1
0,8
Lucas do Rio Verde
4
3,2
Marcelândia
1
0,8
Nova Bandeirantes
2
1,6
Nova Canaã
3
2,4
Nova Lacerda
4
3,2
Nova Mutum
3
2,4
Nova Xavantina
1
0,8
Novo Mundo
2
1,6
Paranaíta
2
1,6
Paranatinga
1
0,8
Pedra Preta
1
0,8
Poconé
2
1,6
Porto Alegre do Norte
3
2,4
Poxoréu
2
1,6
Primavera do Leste
2
1,6
Rondonópolis
4
3,2
Município de procedência
N
%
Santa Carmen
1
0,8
Santa Terezinha
1
0,8
Santo Antônio do Leverger
2
1,6
Sorriso
2
1,6
Tangará da Serra
1
0,8
Tapurah
2
1,6
Terra Nova do Norte
1
0,8
Várzea Grande
3
2,4
125
100,0
Total
Os casos de PCM identificados eram procedentes de 53 municípios
mato-grossenses diferentes. Os municípios com maior número de casos
diagnosticados foi Alta Floresta (n = 10, 8,0 %), Colíder e Cuiabá (n = 7, 5,6 %
cada município) (Tabela 5).
A partir da técnica de análise espacial utilizando o estimador de
intensidade de Kernel com o Raio de Influência (Tau) de 30 km, foi possível
identificar onde houve maior ocorrência de casos de PCM em Mato Grosso no
período de 2005 a 2011. Pode-se perceber uma maior concentração dos casos
de PCM nas áreas em vermelho (zona quente) nas regiões norte e sul do
estado, decaindo nos locais laranja, amarelo, respectivamente, até o verde,
onde não houve concentração, apenas alguns casos aleatórios (Figura 2).
Figura 2 - Mapa de intensidade de concentração dos casos de paracoccidioidomicose
diagnosticados através de lesões de boca no Estado de Mato Grosso, no período de 2005 a
2011.
6. DISCUSSÃO
6.DISCUSSÃO
6.1. DISCUSSÃO DE MATERIAIS E MÉTODO
Este levantamento sobre a PCM no Estado de Mato Grosso além de
apresentar dados relacionados aos casos da infecção e a forma como foi
diagnosticada, inova ao distribui-los espacialmente no território do estado,
identificando os locais com maior ou menor concentração de casos utilizando o
estimador de intensidade de Kernel.
O levantamento inicial dos casos de PCM foi possível de ser realizado
devido à instituição da Politica de atenção às doenças da boca e da face
através das Leis Estaduais nº 8342/2005 e nº 8344/2005 (Anexos 1 e 2).
A Lei Estadual nº 8342/2005, publicada em 30 de junho daquele ano,
previa em seu Artigo 2º que o atendimento aos pacientes com lesões da boca e
da face deveria iniciar nas unidades básicas de saúde, as quais atuariam em
atividades preventivas e na realização de exames de diagnóstico das lesões
buco-faciais. Previa no artigo seguinte (Artigo 3º) que o MT Laboratório atuaria
como referência estadual para a realização de exames de patologia bucal - cito
e histopatologia.
A Lei Estadual nº 8344/2005 também publicada em 30 de junho de
2005, criou o Centro Estadual de Odontologia para Pacientes Especiais
(CEOPE) no âmbito da Secretaria de Estado de Saúde de Mato Grosso
(SES/MT). Dentre as competências do CEOPE, está a de prestar serviço
permanente de diagnóstico das lesões bucais e das formas de prevenção das
doenças da boca e da face.
Como o MT laboratório passou a ser referência para o envio dos
exames histopatológicos e citológicos da boca e da face realizados nas
unidades públicas de saúde do Estado de Mato Grosso, ele passou a
concentrar em seus arquivos os diagnósticos das lesões de boca e face de
todo o estado, bem como dados referentes a esses casos como sexo, idade e
endereço de procedência do paciente bem como a unidade de saúde onde foi
realizada a biopsia e/ou citologia esfoliativa.
A concentração dos laudos em apenas um laboratório facilitou o
levantamento dos mesmos para a realização do estudo. Já a utilização do
laudo histopatológico das lesões bucais é sustentada por este ser considerado
padrão ouro para o diagnóstico da PCM (QUEIROZ et al., 2003).
Martinez (2009) relatou a incidência anual de 1 a 3 casos de PCM por
100.000 habitantes. Mato Grosso tem uma população estimada para o ano de
2012 de 3.115.336 habitantes (Brasil, 2012), assim, seria esperado em torno de
31 a 93 casos novos de PCM por ano no estado. No entanto, a média de casos
anuais encontrada nos sete anos de estudo foi de 17,86.
Cabe lembrar que neste trabalho foram incluídos apenas os casos de
PCM diagnosticados através de lesões de boca. Este critério de inclusão
limitou o número de casos estudados, apesar da quantidade significativa de
diagnósticos de PCM. Entretanto, todo exame que identifica o agente etiológico
do agravo é considerado padrão ouro para o seu diagnóstico (BRASIL, 2012) e
a mucosa bucal é o sítio secundário da infeção mais utilizado para coleta de
amostra para análise da PCM (FERREIRA; TELES FILHO, 2009).
Casos de infecção primária de PCM no pulmão, sem manifestações
bucais, não estão incluídos neste levantamento. Assim, o número real de
indivíduos com PCM em Mato Grosso deve ser maior que o identificado. A
dificuldade na determinação da real incidência da PCM já foi relatada
anteriormente (SPOSTO et al., 1994). Dessa forma, é importante que mais
atenção seja dada a essa micose profunda potencialmente fatal (SPOSTO et
al., 1994; BRASIL, 2012) por parte das autoridades oficiais de saúde, e que
maiores esforços sejam empenhados na sua prevenção, vigilância e
tratamento.
6.2. DISCUSSÃO DOS RESULTADOS
Não existe uma sistematização na busca pelos pacientes com PCM no
Estado de Mato Grosso. Para o seu diagnóstico é necessário que o paciente
busque espontaneamente tratamento e que o cirurgião dentista ou outro
profissional de saúde realize a biópsia ou citologia esfoliativa em busca da
definição do diagnóstico da lesão.
Como a maior parte dos casos se dá em trabalhadores da zona rural
de municípios distantes da capital é possível que o acesso dessas pessoas ao
tratamento e mesmo ao diagnóstico da lesão seja dificultado, e por isso haja
essa variância no numero anual de diagnóstico encontrado.
A hipótese de subestimação da PCM já foi levantada anteriormente em
estudo conduzido em operários de duas cidades do noroeste do Paraná
(FORNAJEIRO et al., 2005).
Com a promulgação das Leis Estaduais 8342 e 8344 (Anexos 1 e 2),
foram realizados a partir de julho de 2005 a dezembro de 2007 campanhas de
prevenção do câncer de boca e diagnóstico de lesões de boca que
contemplaram todos os polos regionais de saúde do estado de Mato Grosso.
Durante essas campanhas eram atendidos diversas pessoas com lesões de
boca e simultaneamente eram capacitados os profissionais das regiões. É
possível que tais ações tenham contribuído para um maior número de
diagnósticos nesse período. Não significa que o número de pessoas
acometidas nos anos subsequentes diminuiu, mas que pode ter havido uma
falha na busca ativa destes doentes crônicos. A queda no número de casos de
PCM diagnosticados após o encerramento das campanhas de prevenção do
câncer de boca evidencia a importância dessa atividade e a necessidade de
sua continuidade ou, se não, do desenvolvimento de alguma outra ação que
possa vir a substituí-la.
Assim como foi identificado em estudos anteriores realizados em
diferentes regiões do Brasil, no presente trabalho a maioria absoluta dos casos
de PCM (98,4%) acometeu o sexo masculino (CARVALHOSA et al., 2012;
LOTH et al., 2011; PANIAGO et al., 2003; SPOSTO et al., 1994; VERLI et al.,
2005).
Apesar do trabalho de Loth et al. (2011), único a apontar uma
tendência para a redução da diferença na incidência da PCM entre os sexos,
que os autores creditaram à mudanças no comportamento das mulheres que
aumentariam sua exposição ao fungo como o consumo de tabaco, álcool e
outras drogas e execução de atividades antes exclusivas ao sexo masculino,
no presente estudo a concentração dos casos se deu de forma quase absoluta
no sexo masculino.
Nos dois diagnósticos do sexo feminino, não se conseguiu averiguar se
as pacientes eram imunocompetentes ou se apresentavam algum distúrbio
endócrino justificando a manifestação da doença. Pesquisas sobre a ação de
hormônios esteroides em P. brasiliensis mostraram que o hormônio feminino
17-β-Estradiol induz alterações no perfil de síntese proteica inibindo a transição
do micélio ou conídio para a forma de levedura (SANTOS, 2007), justificando
assim menor número de mulheres acometidas por essa micose.
A Faixa etária de acometimento também é concordante com a literatura
pertinente (VERLI et al., 2005; PANIAGO et al.,2004; LOTH et al., 2011;
PANIAGO et al., 2003; SHIKANAI-YASUDA et al., 2006).
Deve-se lembrar de que existe a teoria que o fungo pode contaminar o
ser humano em idades precoces e ficar incubado por anos, e somente após
uma falha do sistema imunológico é que possibilita a manifestação da doença,
(LOTH et al., 2011; PANIAGO et al., 2003; SHIKANAI-YASUDA et al., 2006)
Sendo assim, apesar do contato inicial do homem com o fungo e a infecção
ocorrerem, muitas vezes, na infância, as manifestações clínicas da PCM, em
geral, são vistas em pacientes adultos.
Houve um diagnóstico de PCM em um paciente de cinco anos de
idade, caso isolado e fato raro, pois o esperado seria a manifestação aguda da
doença, ou seja, com acometimento visceral e ausência de comprometimento
pulmonar e da cavidade bucal, caso que promoveu um maior desvio padrão na
estatística referente à idade.
Deve-se considerar que essa doença acomete predominantemente
homens em idade produtiva, com a possibilidade de levá-los ao óbito ou grande
morbidade, pode-se concluir um enorme prejuízo sócio econômico para o
estado.
Apesar do exame de citologia bucal ser mais simples, foi observado
neste estudo que a maioria dos diagnósticos foi realizada através de biopsia.
Este fato pode estar associado a uma questão cultural regional, em que a
biopsia é o exame de eleição em casos de lesão de boca, ou pelo fato dessa
lesão ser um dos diagnósticos diferencias do câncer de boca, que não é
diagnosticado pelo exame citológico.
Os casos de PCM foram oriundos de 53 dos 141 municípios matogrossenses. O território do Estado de Mato Grosso encontra-se dentro da faixa
intertropical da porção central do continente sul-americano com elevados totais
de radiação solar global incidentes na superfície do solo praticamente o ano
todo com o domínio de climas Equatoriais e Tropicais Quentes com pequena
variação térmica sazonal e anual. O território reúne, então, características
ambientais que favorecem o estabelecimento do P. brasiliensis de forma
saprofítica: solo úmido, rico em proteínas e solos cercados por rios, lagos e
pântanos onde as variações de temperatura são mínimas (ARAÚJO et al.,
2003; FORTES et al., 2011).
Apesar do registro de casos em 37,5% dos municípios do estado,
percebe-se a sua maior concentração em duas regiões principais distintas, uma
ao norte, englobando os municípios com maior número de casos como Alta
Floresta, Colíder e Guarantã do Norte; e a outra ao sul do estado envolvendo
desde a baixada cuiabana aos municípios no entorno de Rondonópolis. Além
destas, percebe-se também outra região com concentração de menor
intensidade que as regiões anteriores, no centro do estado englobando os
municípios de Nova Mutum, Lucas do Rio Verde, Sorriso e Tapurah, como
pode ser visualizado na Figura 2.
Estas três manchas que correspondem às regiões com maior
incidência de casos apresentam-se de forma quase contígua, acompanhando o
trajeto da rodovia federal BR 163 (Figura 3). Pelo menos duas hipóteses
podem ser levantadas a partir dessa constatação. A primeira hipótese é que a
incidência da PCM em Mato Grosso estaria associada às áreas de pujante
desenvolvimento econômico do estado; a segunda hipótese é que os
moradores dessas regiões encontrariam maior facilidade de acesso à
assistência à saúde.
Assim, as pessoas residentes nas regiões economicamente mais
ativas, e que vêm experimentando um grande desenvolvimento no período
abarcado por este estudo, principalmente devido a atividades ligadas ao
agronegócio e à extração de madeira (ou seja, atividades ligadas ao campo),
estariam mais expostas à contaminação pelo P. brasiliensis. Alguns indícios
apontam para a associação entre a incidência da PCM e a ocupação
desordenada da terra, como o número de casos diagnosticados em municípios
inseridos em áreas banhadas por águas contaminadas (Figura 4) e a ausência
de casos em áreas de reservas indígenas e reservas ecológicas (Figura 5).
Figura 3 - Mapa do Sistema Viário do Estado de Mato Grosso. Fonte: Camargo, 2011.
Figura 4 - Mapa de usos preponderantes e comprometimento da qualidade das águas no
Estado de Mato Grosso. Fonte: Camargo, 2011.
Figura 5 - Mapa das unidades socioeconômico-ecológicas do Estado de Mato Grosso. Fonte:
Camargo, 2011.
Próximo do Rio Xingu existe uma extensa área indígena, localizada no
norte do MT, sem nenhum caso diagnosticado de PCM. Em área vizinha,
também no norte do estado, com as mesmas características geográficas,
também pertencentes à bacia do Rio Amazonas, exibindo as mesmas
variações de temperatura e com terras ricas, com características bioquímicas
muito semelhantes é a região de maior incidência de casos de PCM. A
característica que distingue a região sem casos diagnosticados e a região com
maior índice de PCM é o intenso desenvolvimento econômico recente.
A possibilidade dos residentes de municípios com menor dinamismo
econômico apresentarem menor número de casos diagnosticados também
pode estar relacionado a deficiências estruturais da rede de assistência à
saúde bem como a dificuldade de acesso do usuário a essa rede. Assim, não
haveria menos casos de PCM nesses municípios, mas os casos não estariam
sendo diagnosticados e consequentemente também não estariam sendo
tratados.
Este trabalho deve ser considerado um estudo inicial sobre a
epidemiologia da PCM no Estado de Mato Grosso e a sua relação com
determinantes socioambientais, porém ele sinaliza municípios e regiões de
maior incidência da doença e sugere variáveis que possam estar contribuindo
para essa distribuição espacial da doença.
Considerando a morbimortalidade associada à PCM bem como seu
custo financeiro e social, uma politica de atenção especial a essa micose
profunda faz-se necessária em Mato Grosso. O Governo estadual, através da
Secretaria
de
Estado
de
Saúde
deveria
determinar
que
os
casos
diagnosticados como PCM fossem notificados compulsoriamente, promovendo
um acompanhamento mais acurado da sua ocorrência e subsidiando os
gestores e conselhos de saúde no estabelecimento de políticas publicas
específicas que permitissem direcionar de forma mais coerente e resolutiva as
ações e recursos públicos.
7. CONCLUSÕES
7.CONCLUSÕES
Através do levantamento dos casos de paracoccidioidomicose
diagnosticados no Laboratório Público de Mato Grosso através de exames em
lesões de boca e após o georreferenciamento desses casos no Estado de Mato
Grosso foi possível identificar que:
A doença afeta predominantemente indivíduos do sexo masculino
(98,4%); na faixa de 41 e 60 anos de idade (61,6%); com o diagnóstico
realizado principalmente nos anos de 2006 (25,6%), 2007 (18,4%) e
2009 (16,8%);
Os casos estão distribuídos de forma heterogênea no estado,
apresentando maior concentração nos municípios de regiões de maior
desenvolvimento econômico, maior fluxo rodoviário e com presença de
águas contaminadas. Por outro lado foi percebida a ausência de casos
em reservas indígenas e reservas ecológicas.
REFERÊNCIAS
BIBLIOGRÁFICAS
REFERÊNCIAS BIBLIOGRÁFICAS
ALMEIDA, O. P.; JACKS Jr., J.; SCULLY, C. Paracoccidioidomycosis of the
mouth: an emerging deep mycosis. Crit Rev Oral Biol Med v. 14, n. 5, p. 377383, 2003.
ALMEIDA, S. M. de. Central nervous system paracoccidioidomycosis: an
overview. Braz J Infect Dis. v. 9, n. 2, p. 126-133, 2005.
ARAÚJO, M. S.; SOUZA, S. C. O. Análise epidemiológica de pacientes
acometidos com paracoccidioidomicose em região endêmica do estado de
Minas Gerais. Rev Pos-Grad. v. 7, p. 22-26, 2000.
ARAÚJO, M. S. de; SOUSA, S. C. O. M.; CORREIA, D. Avaliação do exame
citopatológico como método para diagnosticar a paracoccidioidomicose crônica
oral. Revista da Sociedade Brasileira de Medicina Tropical v. 36, n. 3, p. 427430, mai-jun, 2003.
BARCELLOS, C.; RAMALHO, W. M.; GRACIE, R.; MAGALHÃES, M. A. F. M.;
FONTES, M. P.; SKABA, D. Georreferenciamento de dados de saúde na
escala submunicipal: algumas experiências no Brasil. Epidemiol. Serv. Saúde,
Brasília, v. 17, n. 1, p.59-70, jan-mar, 2008.
BRASIL. Ministério da Saúde. Informações de saúde [acessado durante o ano
de 2012a] Disponível em: http://www.datasus.gov.br
BRASIL. Ministério da Saúde. Portal da Saúde. Paracoccidioidomicose.
Disponível em
http://portal.saude.gov.br/portal/saude/profissional/area.cfm?id_area=1662
Acesso em 03 de julho de 2012.
CALDEIRA, A. C. de B. F.; PINTO, T. P. L.; PÉS, C.; CAS, K da; ZÔMPERO,
C. M.; GUOLO, C. E. Vasculite de pequenos vasos como primeira
manifestação clínica de paracoccidiodomicose - Relato de caso. An Bras
Dermatol. v. 86, n. 6, p. 1208-1212, 2011.
CAMARGO, L. (org.). Atlas de Mato Grosso: Abordagem socioeconômicoecológica. Cuiabá: Entrelinhas, 2011.
CARVALHO, M. S.; CÂMARA, G. 2. Análise de eventos pontuais. In: DRUCK,
S.; CARVALHO, M. S.; CÂMARA, G.; MONTEIRO, A. V. M. (eds.). Análise
espacial de dados geográficos. Brasília: EMBRAPA, 2004. p. 2-1-2-15.
CARVALHOSA, A. A.; BORGES, F. T.; FRANÇA, D. C. C.; QUEIROZ, R. R.;
MOIMAZ, S. A. S.; GARBIN, C. A. S. Paracoccidioidomycosis prevalence in a
public laboratory of the Brazilian unified health system. J. Oral Diag. v. 1, n. 1,
p. 31-35, 2012.
CHIESA, A. M.; WESTPHAL, M. F.; KASHIWAGI, N. M. Geoprocessamento e a
promoção da saúde: desigualdades sociais e ambientais em São Paulo. Rev.
Saúde Pública v. 36, n. 5, p. 559-567, 2002.
CORREA, F. G. S. Análise especial dos casos de histoplasmose disseminada
associada a AIDS no município de Fortaleza, 2002. Dissertação [Mestrado em
Saúde Pública] Universidade Federal do Ceará. Faculdade de Medicina,
Fortaleza, 2012.
CUNHA, J. M. P. Dinâmica migratória e o processo de ocupação do CentroOeste brasileiro: o caso de Mato Grosso. R. Bras. Est. Pop., São Paulo, v. 23,
n. 1, p. 87-107, jan./jun. 2006.
FERREIRA, M. S. Capítulo 83.3 Classificação das formas clínicas In:
FOCACCIA, R. (editor). Tratado de infectologia. 4 ed. São Paulo: Atheneu,
2009. p. 1524-1525.
FERREIRA, M. S.; TELES FILHO, F. Q. Capítulo 83.2 Imunopatogênese e
patologia. In: FOCACCIA, R. (editor). Tratado de infectologia. 4 ed. São Paulo:
Atheneu, 2009. p. 1518-1523.
FORJAZ, M. H. H.; FISCHMAN, O.; CAMARGO, Z. P.; VIEIRA FILHO, J. P. B.;
COLOMBO, A. L. Paracoccidioidomicose em índios brasileiros da tribo Suruí:
estudo clínico-laboratorial de 2 casos. Revista da Sociedade Brasileira de
Medicina Tropical v. 32, n. 5, p. 571-575, set-out, 1999.
FORNAJEIRO, N.; MALUF, M. L. F.; TAKAHACHI, G.; SVIDZINSKI, T. I. E.
Inquérito epidemiológico sobre a paracoccidioidomicose utilizando a gp43 em
dois municípios do noroeste do Paraná, Brasil. Soc Bras Med Trop. v. 38, n. 2,
p. 191-193, mar-abr, 2005.
FORTES, M. R. P.; KUROKAWA, C. S.; MARQUES, S. A.; MIOT, H. A.;
MARQUES, M. E. A. Imunologia da paracoccidioidomicose. An Bras Dermatol.
v. 86, n. 3, p. 516-526, 2011.
FRANCO, M. Host-parasite relatioships in paracoccidioidomycosis. J Med Vet
Mycol. v. 25, p. 5-18, 1986.
GIANNINI, M. J. S. M.; DEL NEGRO, G. M. B.; GONÇALVES, E. G. Capítulo
83.6. Diagnóstico laboratorial e radiológico. In: FOCACCIA, R. (editor). Tratado
de infectologia. 4 ed. São Paulo: Atheneu, 2009. p. 1533-1539.
GOLDANI, L. Z. Gastrointestinal Paracoccidioidomycosis An Overview. J Clin
Gastroenterol v. 45, n. 2, p. 87-91, February 2011.
GOMPERTZ, O. F.; GAMBALE, W.; PAULA, C. R.; CORRÊA, B. Capítulo 69.
Micoses Sistêmicas. In: TRABULSI, L. R.; ALTERTHUM, F. (editores)
Microbiologia. 5 ed. São Paulo: Atheneu, 2008. p. 517-523.
LACAZ, C. S.; PASSOS FILHO, M. C. R.; FAVA NETTO, C.; MACARRON, R.
Contribuição para o estudo da Blastomicose-infecção: inquérito com
paracoccidioidina. Estudo sorológico e clínico radiológico dos
paracoccidioidinos-positivos. Rev Inst Med Trop São Paulo. v. 1, p. 245-259,
1959.
LONDERO, A. T.; DEL NIGRO, G. Paracoccidioidomicose. J Pneumol. v. 12, p.
41-60, 1986.
LOPEZ, R. C.; RESTREPO, A. Spontaneous regression of pulmonar
paracoccidioidomycosis. Mycopathol. v. 83, p. 187-189, 1983.
LOTH, E. A.; CASTRO, S. V.; SILVA, J. R.; GANDRA, R. F. Occurrence of 102
cases of paracoccidioidomycosis in 18 months in the Itaipu Lake region,
western Paraná. Soc Bras Med Trop. v. 44, n. 5, p. 636-637, 2011.
MALUF, M. L. F.; PEREIRA, S. R. C.; TAKAHACHI, G.; SVIDZINSKI, T. I. E.
Prevalência de paracoccidioidomicose: infecção determinada através de teste
sorológico em doadores de sangue na região noroeste do Paraná, Brasil. Rev
Soc Bras Med Trop. v.36, n.1, p. 11-16, 2003.
MANGIATERRA, M.; ALONSO, J.; GALVAN, M.; GIUSIANO, G.; GORODNER,
J. Histoplasmin and paracoccidioidin skin reactivity in infantile population of
northern Argentina. Rev Inst Med Trop v. 38, n. 5, p. 349-353. São Paulo. 1996.
MARQUES, S. A. Paracoccidioidomicose. An Bras Dermatol., v. 73, p. 455-469,
1998.
MARQUES, S. A. Paracoccidioidomicose: centenário do primeiro relato de
caso. An Bras Dermatol., v. 83, n. 3, p. 271-273, 2008.
MARTINEZ, J. E.; ATRA, E.; CUNHA, M. F. L.; PEREIRA, C. A. P.; SATO, E. I.
Blastomicose sul-americana com vasculite: relato de caso. Rev Bras de
Reumatol. v. 25, p. 211-213, 1985.
MARTINEZ, R. Capítulo 83.1 Etioepidemiologia e Ecologia. In: FOCACCIA, R.
(editor). Tratado de infectologia. 4 ed. São Paulo: Atheneu, 2009. p. 1515-1518.
MARTINEZ, R. Paracoccidioidomicose. In: SIDRIM, J. J. C.; ROCHA, M. F. G.
Micologia médica à luz de autores contemporâneos. Rio de Janeiro: Guanabara
Koogan; 2004. p. 204-21.
MENDES-GIANNINI, M. J.; MONTEIRO da SILVA, J. L.; FÁTIMA da SILVA, J
de; DONOFRIO, F. C.; MIRANDA, E. T.; ANDREOTTI, P. F.; SOARES, C. P.
Interactions of Paracoccidioides brasiliensis with host cells: recent advances.
Mycopathologia. v. 165, p. 237-248, 2008.
MENDES, R. P. Capítulo 83.4 Quadro Clínico. In: FOCACCIA, R. (editor).
Tratado de infectologia. 4 ed. São Paulo: Atheneu, 2009. p. 1525-1531.
MOREIRA, R. S.; NICO, L. S.; TOMITA, N. E. A relação entre o espaço e a
saúde bucal coletiva: por uma epidemiologia georreferenciada. Ciência &
Saúde Coletiva v. 12, n. 1, p. 275-284, 2007.
MOREIRA, R. S.; NICO, L. S.; TOMITA, N. E. O risco espacial e fatores
associados ao edentulismo em idosos em município do sudeste do Brasil. Cad.
Saúde Pública v. 27, n. 10, p. 2041-2053, 2011.
NEVILLE, B.; DAMM, D. D.; ALLEN, C. M. Patologia oral e maxilofacial. Rio de
Janeiro: Elsevier, 2009.
OLIVEIRA, C. F.; SANTOS, R. L. Mapeamento e aplicação de estatística
espacial dos deslizamentos em Salvador – BA. Feira de Santana:
Geotecnologia e Interdisciplinaridade, 2011. (evento)
ORTEGA, K. L.; OLIVEIRA, P. T.; MAGALHÃES, M. H. C. G.; ARAÚJO, N. S. A
citologia esfoliativa no diagnóstico da Paracoccidiodomicose. Relato de caso.
Revista de Pós-Graduação da Faculdade de Odontologia da Universidade de
São Paulo v. 3, p.148-153, 1996.
PALMEIRO, M.; CHERUBINI, K.; YURGEL, L. S. Paracoccidioidomicose –
Revisão da Literatura. Scientia Medica, v. 15, n. 4, p. 274-278, out./dez. 2005.
PANIAGO, A. M. M.; AGUIAR, J. I. A.; AGUIAR, E. S.; CUNHA, R. V.;
PEREIRA, G. R. O. L.; LONDERO, A. T.; WANKE, B. Paracoccidioidomicose:
estudo clínico e epidemiológico de 422 casos observados no Estado de Mato
Grosso do Sul. Revista da Sociedade Brasileira de Medicina Tropical v. 36, n.
4, p. 455-459, jul-ago, 2003.
PEREIRA, P. M. R.; LIMA, L. L. de; JALKH, A. P.; AKEL, P. B. de M.; KIMURA,
E. N. Paracoccidioidomicose sistêmica multifocal – desafio diagnóstico por
manifestação cutânea tardia. An Bras Dermatol. v. 86, n. 1, p. 149-152, 2011.
RAMOS-E-SILVA, M. SARAIVA, L. do E. S. Paracoccidioidomycosis. Dermatol
Clin. v. 26, p. 257-269, 2008.
SAMPAIO, S. A. P.; RIVITTI, E. A. Micoses Profundas. In: SAMPAIO, S. A. P.;
RIVITTI, E. A. (editores). Dermatologia. 3 ed. São Paulo: Artes Médicas; 2007.
p. 723-733.
SANTOS, M. O. Caracterização da N-acetil-β-D-glicosaminidase de
Paracoccidioides brasiliensis. [tese] Universidade de Brasília, Faculdade de
Medicina, Programa de Pós-graduação em Patologia Molecular (doutorado).
Brasília, 2007.
SHIKANAI-YASUDA, M. A.; TELLES FILHO, F. de Q.; MENDES, R. P.;
COLOMBO, A. L.; MORETTI, M. L.; KONO, A. S.; TRESOLDI, A. T.; WANKE,
B.; CARVALHO, C. R.; FERREIRA, M. S.; SILVA-VERGARA, M. L.;
MARTINEZ, R. Revista da Sociedade Brasileira de Medicina Tropical v. 39, n.
3, p. 297-310, mai-jun, 2006.
SPOSTO, M. R.; MENDES-GIANNINI M, J.; MORAES, R. A.; BRANCO, F. C.;
SCULLY, J. C. Paracoccidioidotnycosis manifesting as oral lesions; clinical,
cylological and scrological investigation. J Oral Pathol Med 1994; 23; 85-87.
TARIFA, J. R. Mato Grosso: Clima: Análise e representação cartográfica.
Cuiabá: Entrelinhas, 2011.
TOLENTINO, E. S.; BARBOSA, B. A.; TAVEIRA, L. A. de A.; CHINELLATO, L.
E. M. Manifestações bucais daparacoccidioidomicose – considerações gerais e
relato de caso. RFO, v. 15, n. 1, p. 71-76, janeiro/abril 2010.
TRAD, H. S.; TRAD, C. S.; ELIAS JUNIOR, J.; MUGLIA, V. F. Revisão
radiológica de 173 casos consecutivos de paracoccidioidomicose. Radiol Bras
v. 39, n. 3, p. 175-179, 2006.
VERLI, F. D.; MARINHO, S. A.; SOUZA, S. C. de; FIGUEIREDO, M. A. Z. de;
YURGEL, L. S. Perfil clínico-epidemiológico dos pacientes portadores de
paracoccidioidomicose no Serviço de Estomatologia do Hospital São Lucas da
Pontifícia Universidade Católica do Rio Grande do Sul. Revista da Sociedade
Brasileira de Medicina Tropical v. 38, n. 3, p. 234-237, mai-jun, 2005.
ZAITZ, C.; RUIZ, L. R. B.; FRAMIL, V. M. S. Paracoccidioidomicose:
Diagnóstico e Tratamento. Manual de Conduta. Jornal da Sociedade Brasileira
de Dermatologia. v. 10, p. 191-196, 2006.
ANEXOS
ANEXOS
Anexo 1
LEI Nº 8.342, DE 30 DE JUNHO DE 2005 - D.O. 30.06.05.
Autor: Poder Executivo
Institui a Política Estadual de Atenção às Doenças da Boca e da
Face, no âmbito da Secretaria de Estado de Saúde - SES.
A ASSEMBLÉIA LEGISLATIVA DO ESTADO DE MATO GROSSO,
tendo em vista o que dispõe o art. 42 da Constituição Estadual, aprova e o
Governador do Estado sanciona a seguinte lei:
Art. 1º Esta lei institui o Serviço Estadual de Atenção às Doenças da
Boca e da Face, no âmbito da Secretaria de Estado de Saúde - SES.
Parágrafo único O Serviço Estadual de Atenção às Doenças da Boca
e da Face atuará como referência, no âmbito estadual, será regulado pela
Superintendência de Regulação da Secretaria de Estado de Saúde - SES, para
a realização de exames de diagnóstico.
Art. 2º O atendimento aos pacientes com lesões da boca e da face
deverá iniciar nas unidades básicas de saúde, as quais atuarão em atividades
preventivas e na realização de exames de diagnóstico das lesões buco-faciais.
Art. 3º O MT Laboratório atuará como referência estadual para a
realização de exames de patologia bucal - cito e histopatologia.
Parágrafo único Os exames realizados nas unidades de saúde do
Estado de Mato Grosso poderão ser encaminhados para outros laboratórios de
anatomia patológica, devidamente credenciada pelos municípios.
Art. 4º É obrigatória a comunicação dos casos diagnosticados de
câncer bucal, conforme o Código Internacional de Doenças - CID, descrito no
Anexo Único, ao Programa de Avaliação e Vigilância da Coordenação de
Prevenção e Controle do Câncer da Secretaria de Estado de Saúde - SES,
pelos laboratórios de anatomia patológica credenciados.
Art. 5º Esta lei entra em vigor na data de sua publicação.
Palácio Paiaguás, em Cuiabá, 30 de junho de 2005.
as) BLAIRO BORGES MAGGI
Governador do Estado
Anexo 2
LEI Nº 8.344, DE 30 DE JUNHO DE 2005 - D.O. 30.06.05.
Autor: Poder Executivo
Cria o Centro Estadual de Odontologia para Pacientes Especiais CEOPE, no âmbito da Secretaria de Estado de Saúde - SES.
A ASSEMBLÉIA LEGISLATIVA DO ESTADO DE MATO GROSSO,
tendo em vista o que dispõe o art. 42 da Constituição Estadual, aprova e o
Governador do Estado sanciona a seguinte lei:
Art. 1º Fica criado o Centro Estadual de Odontologia para Pacientes
Especiais - CEOPE, no âmbito da Secretaria de Estado de Saúde - SES.
Parágrafo único Considera-se paciente especial todo cidadão que
possui alterações físicas, orgânicas, intelectuais, sociais ou emocionais,
alteração essa aguda ou crônica, simples ou complexa.
Art. 2º Compete ao Centro Estadual de Odontologia para Pacientes
Especiais - CEOPE:
I - atuar como referência estadual na assistência odontológica aos
pacientes especiais que necessitam de educação especial e instruções
suplementares temporária ou terminantemente;
II - elaborar políticas de atendimento odontológico ao paciente especial
no Estado de Mato Grosso;
III - prestar serviço permanente de diagnóstico das lesões bucais e das
formas de prevenção das doenças da boca e da face;
IV - promover a capacitação profissional e educação continuada, em
parceria com a Escola de Saúde Pública da Secretaria de Estado de Saúde SES, para os dentistas do Estado de Mato Grosso, voltado ao atendimento do
paciente especial.
Art. 3º Ficam criados, no âmbito da Secretaria de Estado de Saúde, os
seguintes cargos em comissão:
I - 01 (um) cargo de Diretor Geral, Nível DGA-4;
II - 01 (um) cargo de Coordenador Técnico, Nível DAS-4;
III - 01 (um) cargo de Coordenador Administrativo, Nível DAS-4;
IV - 01 (um) cargo de Gerente de Apoio Logístico, Nível DAS-2.
Art. 4º As despesas decorrentes da aplicação desta lei correrão à
conta da Secretaria de Estado de Saúde - SES.
Parágrafo único (VETADO).
Art. 5º Esta lei entra em vigor na data de sua publicação
Palácio Paiaguás, em Cuiabá, 30 de junho de 2005.
BLAIRO BORGES MAGGI
Governador do Estado