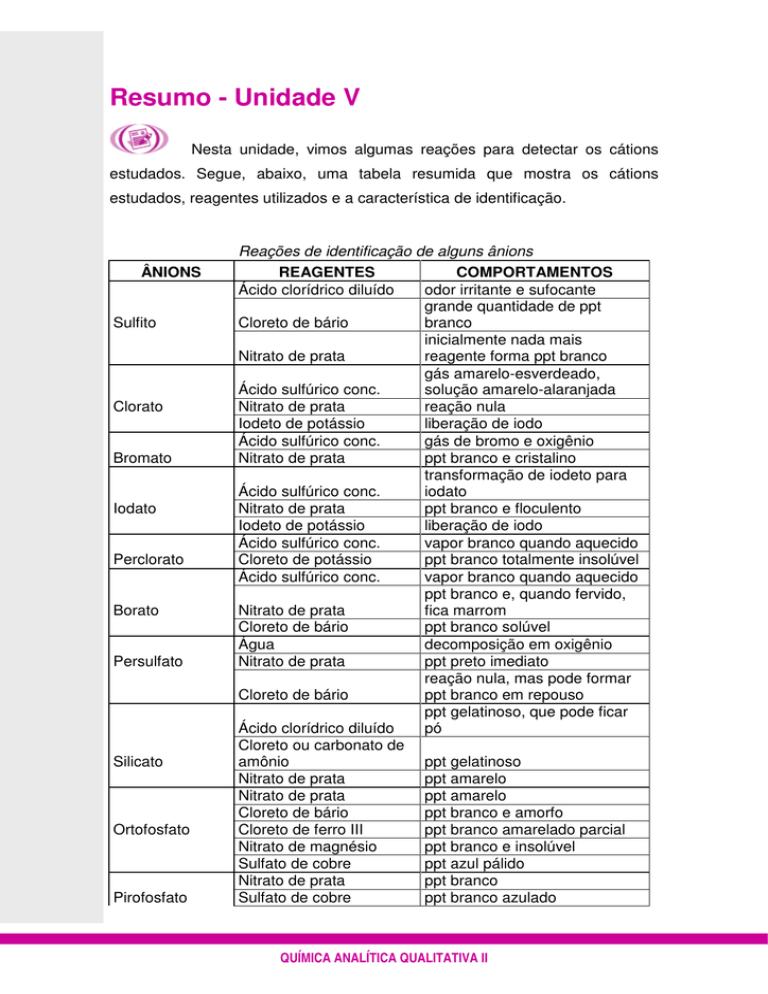
Resumo - Unidade V
Nesta unidade, vimos algumas reações para detectar os cátions
estudados. Segue, abaixo, uma tabela resumida que mostra os cátions
estudados, reagentes utilizados e a característica de identificação.
ÂNIONS
Sulfito
Clorato
Bromato
Iodato
Perclorato
Borato
Persulfato
Silicato
Ortofosfato
Pirofosfato
Reações de identificação de alguns ânions
REAGENTES
COMPORTAMENTOS
Ácido clorídrico diluído
odor irritante e sufocante
grande quantidade de ppt
Cloreto de bário
branco
inicialmente nada mais
Nitrato de prata
reagente forma ppt branco
gás amarelo-esverdeado,
Ácido sulfúrico conc.
solução amarelo-alaranjada
Nitrato de prata
reação nula
Iodeto de potássio
liberação de iodo
Ácido sulfúrico conc.
gás de bromo e oxigênio
Nitrato de prata
ppt branco e cristalino
transformação de iodeto para
Ácido sulfúrico conc.
iodato
Nitrato de prata
ppt branco e floculento
Iodeto de potássio
liberação de iodo
Ácido sulfúrico conc.
vapor branco quando aquecido
Cloreto de potássio
ppt branco totalmente insolúvel
Ácido sulfúrico conc.
vapor branco quando aquecido
ppt branco e, quando fervido,
Nitrato de prata
fica marrom
Cloreto de bário
ppt branco solúvel
Água
decomposição em oxigênio
Nitrato de prata
ppt preto imediato
reação nula, mas pode formar
Cloreto de bário
ppt branco em repouso
ppt gelatinoso, que pode ficar
Ácido clorídrico diluído
pó
Cloreto ou carbonato de
amônio
ppt gelatinoso
Nitrato de prata
ppt amarelo
Nitrato de prata
ppt amarelo
Cloreto de bário
ppt branco e amorfo
Cloreto de ferro III
ppt branco amarelado parcial
Nitrato de magnésio
ppt branco e insolúvel
Sulfato de cobre
ppt azul pálido
Nitrato de prata
ppt branco
Sulfato de cobre
ppt branco azulado
QUÍMICA ANALÍTICA QUALITATIVA II
Metafosfato
Fosfito
Hipofosfito
Nitrato de magnésio
Sulfato de cobre
Nitrato de prata
Nitrato de magnésio
Nitrato de prata
Ácido sulfúrico conc.
Cloreto de bário
Sulfato de cobre
Nitrato de prata
Ácido sulfúrico conc.
Cloreto de bário
Sulfato de cobre
Cloreto de bário
Cromato
Nitrato de prata
Cloreto de bário
Dicromato
Nitrato de prata
Ácido clorídrico diluído
Nitrato de prata
Cianeto
Ácido sulfúrico conc.
Cianato
Tiocianato
Succinato
Tartarato
Oxalato
Ácido sulfúrico diluído
Nitrato de prata
Acetato de cobalto
Cloreto de bário
Ácido sulfúrico conc.
Nitrato de prata
Sulfato de cobre
Cloreto de ferro III
Nitrato de prata
Cloreto de ferro III
Cloreto de cálcio
Ácido sulfúrico conc.
Nitrato de prata
Cloreto de potássio
Ácido sulfúrico conc.
Nitrato de prata
Permanganato de
potássio
ppt branco em pouca
quantidade
não há precipitação
ppt branco formado lentamente
reação nula
ppt branco, que passa para
preto-metálico
odor forte quando aquecido
ppt branco
ppt azul bem claro
ppt branco instantâneo
odor de dióxido de enxofre
reação nula
ppt vermelho em aquecimento
ppt amarelo-pálido permanente
ppt marrom-avermelhado
insolúvel
ppt amarelo-pálido reversível
ppt marrom-avermelhado
solúvel
gás com cheiro de amêndoas
ppt branco solúvel
libera monóxido de carbono,
quando aquecido
efervescência vigorosa com
cheiro ruim
ppt branco floculento
solução azul
reação nula
solução amarela
ppt branco floculento
solução verde e depois ppt
preto
solução vermelho-rubra
ppt branco
ppt marrom bem claro
ppt banco formado lentamente
gases com odor de açúcar
queimado
ppt branco e floculento
ppt incolor e cristalino
ação desidratante com
liberação de gás
ppt branco e floculento
descoloração do permanganato
ppt – precipitado
QUÍMICA ANALÍTICA QUALITATIVA II
Referências Bibliográficas
KOTZ, J. C.; TREICHEL, P. Jr. Química e reações químicas. 4. ed. Volume 2.
Rio de Janeiro: LTC Editora, 2002.
MAHAN, B. M.; MYERS, R. J. Química – Um curso universitário. São Paulo:
Editora Edgard Blucher LTDA, 2002.
VOGEL, Arthur I. Química Analítica Qualitativa. 5. ed. São Paulo: Editora
Mestre Jou, 1981, 659 p.
QUÍMICA ANALÍTICA QUALITATIVA II