UNIVERSIDADE FEDERAL DE RORAIMA
CENTRO DE CIÊNCIAS DA SAÚDE
CURSO DE GRADUAÇÃO EM MEDICINA
KELLY KARINE FRAGA VIEIRA
SÍNDROME DE STEVENS-JOHNSON E NECRÓLISE EPIDÉRMICA TÓXICA:
EMERGÊNCIA DERMATOLÓGICA
RELATO DE CASO E REVISÃO DE LITERATURA
Boa Vista, RR
2016
KELLY KARINE FRAGA VIEIRA
SÍNDROME DE STEVENS-JOHNSON E NECRÓLISE EPIDÉRMICA TÓXICA:
EMERGÊNCIA DERMATOLÓGICA - RELATO DE CASO E REVISÃO DE
LITERATURA
Monografia apresentada como pré-requisito para
obtenção do grau de bacharel em Medicina da
Universidade Federal de Roraima.
Orientadora: Profª MSc. Jucineide Vieira Araújo.
Co-orientador: Profº. Esp. Roberto Carlos Cruz
Carbonell.
Boa Vista, RR
2016
Dados Internacionais de Catalogação na publicação (CIP)
(Biblioteca Central Maria Auxiliadora de Sousa Melo)
Vieira, Kelly Karine Fraga.
Síndrome de Stevens-Johnson e necrólise epidérmica tóxica: emergência
dermatológica. Relato de caso e revisão de literatura/ Kelly Karine Fraga
Vieira – Boa Vista, 2016.
79 p.
Orientadora: Profª. MSc. Jucineide Vieira Araújo.
Co-orientador: Profº. Esp. Roberto Carlos Cruz Carbonell
Monografia (graduação) – Universidade Federal de Roraima,
Bacharel em Medicina.
1 – Síndrome de Stevens-Johnson. 2 – Necrólise Epidérmica
Tóxica. 3 – Fármacos.
FOLHA DE APROVAÇÃO
KELLY KARINE FRAGA VIEIRA
SÍNDROME DE STEVENS-JOHNSON E NECRÓLISE EPIDÉRMICA TÓXICA:
EMERGÊNCIA DERMATOLÓGICA - RELATO DE CASO E REVISÃO DE
LITERATURA
Monografia apresentada como pré-requisito para
obtenção do grau de bacharel em Medicina da
Universidade Federal de Roraima.
_________________________________________________________
Profª. MSc. Jucineide Vieira Araújo
Orientadora / Profª. Efetiva / Curso de Medicina – UFRR
_____________________________________________________________
Membro
Curso de Medicina– UFRR
_______________________________________________________________
Membro
Curso de Medicina– UFRR
Aos meus pais.
Sempre incentivando, sempre ajudando com carinho e dedicação.
Sem o apoio de vocês, a caminhada seria mais árdua.
AGRADECIMENTOS
À Deus, que nos presenteou com o bem mais precioso que poderíamos receber um dia,
a vida, e com ela a capacidade para pensarmos, amarmos e lutarmos pela conquista de nossos
ideais.
À minha mãe, Josefa Fraga Rabelo, exemplo de força e determinação, pelo seu imenso
amor, base da minha vida, que nunca mediu esforços para a realização dos meus sonhos, que
abriu mão de tantas coisas por mim, sem você eu não seria quem sou hoje e jamais teria chegado
até aqui.
Ao meu pai, Cícero Dias Vieira, pelo seu apoio e torcida incondicionais.
À Dra. Profª Msc. Jucineide Vieira Araújo, pela atenção, paciência e, principalmente,
por aceitar ser minha orientadora.
Ao Dr. Roberto Carlos Cruz Carbonell, à Dra. Fabiana Vieira Zimmermann e à Dra.
Déborah Acássia Mamed Rodrigues pelo apoio, companheirismo e ensinamentos
compartilhados durante os rodízios de Pneumologia/Infectologia.
À todos os médicos e médicas do HGR, pela paciência, atenção e por terem contribuído
com meu aprendizado nos dois anos de internato.
Ao Dr. Robledo e toda equipe da Unidade de Anatomia Patológica e Citologia
(LAPER) pelo carinho e por disponibilizarem as fotografias do histopatológico para ilustração
deste trabalho.
Sobretudo aos nossos pacientes, razão de nosso esforço e motivação para sempre
melhorar...
RESUMO
A síndrome de Stevens-Johnson (SSJ) e a Necrólise Epidérmica Tóxica (NET) são
caracterizadas
por
reações
mucocutâneas
potencialmente
fatais
que resultam
de
hipersensibilidade a fatores precipitantes variados, como infecções por vírus, fungos, bactérias,
enfermidades do tecido conjuntivo, neoplasias malignas, vacinas e múltiplos medicamentos,
sendo maioritariamente induzida por fármacos. Nesse contexto, o presente estudo relata um
caso de um paciente jovem, portador de Síndrome de Stevens-Johnson/Necrólise Epidérmica
Tóxica, no Hospital Geral de Roraima (HGR) – Boa Vista –2016. Para a fundamentação
teórico-metodológica, foi realizada a revisão de prontuário, após autorização da pesquisa pelo
Comitê de Ética em Pesquisa da Universidade Federal de Roraima (UFRR), e a revisão literária
com base nos artigos científicos nacionais e internacionais sobre o tema. O caso-fonte e a
literatura pesquisada confirmam que a Síndrome de Stevens-Johnson e a necrólise epidérmica
tóxica constituem reações adversas a fármacos graves com uma morbilidade e uma mortalidade
importantes. Clinicamente manifestam-se por um exantema, muitas vezes morbiliforme ou com
lesões em alvo atípicas, que evolui para descolamento epidérmico. Há atingimento das mucosas
na quase totalidade dos doentes. Os fármacos mais frequentemente implicados são o alopurinol,
os antibióticos, nomeadamente os ß-lactâmicos e as sulfamidas, os anti-inflamatórios não
esteróides (AINE) e os anticonvulsivantes aromáticos. As manifestações clínicas surgem em
média 7 a 21 dias após o início do fármaco implicado. O diagnóstico é clínico e apoiado pela
histologia cujo principal achado é a necrose dos queratinócitos e a clivagem da junção dermoepidérmica. A abordagem dos doentes com Síndrome de Stevens-Johnson e Necrólise
Epidérmica Tóxica NET exige diagnóstico rápido, identificação e suspensão do fármaco
suspeito, avaliação do prognóstico, terapêutica de suporte, abordagem multidisciplinar e o
seguimento ambulatorial. Assim, o reconhecimento é fundamental para uma intervenção
precoce, visando diminuir a elevada morbimortalidade.
Palavras-chave: Síndrome de Stevens-Johnson. Necrólise Epidérmica Tóxica. Fármacos.
LISTA DE ABREVIATURAS E SIGLAS
ABNT – Associação Brasileira de Normas Técnicas
AINE - anti-inflamatórios não esteroides
APC - Célula apresentadora de antígenos
BDBTD – Biblioteca Digital Brasileira de Teses e Dissertações
CEP – Comitê de Ética em Pesquisa
CMV – Citomegalovírus
DNA - Ácido desoxirribonucleico
DRESS – Drug reaction with eosinophilia and systemic symptoms
EBV – Vírus Epstein-Barr
EM – Eritema multiforme
EMM - Eritema Multiforme Major
FADD (Fas-Associated Death Domain protein)
FasL – Ligando Fas
GVHD – Graft Versus Host Disease
HGR – Hospital Geral de Roraima
HIV - Vírus da imunodeficiência humana
HHV-6 - Vírus herpes humano 6
HLA - Human Leukocyte Antigen system
HUC – Hospital Universitário de Coimbra
IFN-α – Interferon α
IFN-γ – Interferon γ
IV – Intravenoso
LES - Lúpus Eritematoso Sistémico
M. pneumoniae - Mycoplasma pneumoniae
NET – Necrólise Epidérmica Tóxica
NK – Natural killer
PAAR – Pronto Atendimento
PCR – Proteína-c reativa
PEAG – Pustulose Exantemática Aguda Generalizada
PPN - Pênfigo Paraneoplásico
PMN – Polimorfonucleares
SAME – Serviço de Arquivo Médico e Estatística
SC – Superfície Corporal
SCAR – Severe Cutaneous Adverse Reactions
SCIELO – Scientific Electronic Library Online
SCORTEN – Severity of Illness Score for Toxic Epidermal Necrolysis
sFasL - Ligando Fas solúvel
SIDA - Síndrome de Imunodeficiência Adquirida
SNG - Sonda Nasogástrica
SSJ - Síndrome de Stevens-Johnson
SVD - Sonda Vesical de Demora
TCC – Trabalho de Conclusão de Curso
TCLE – Termo de Consentimento Livre e Esclarecido
TCR - Receptores específicos dos linfócitos
TNF-α – Tumor necrosis factor α (fator de necrose tumoral α)
Treg – T reguladores
Th – T helper
UCI - Unidade de Cuidados Intensivos
UFRR – Universidade Federal de Roraima
US FDA AERS - Sistema de Informação de Reações Adversas da Administração dos
alimentos e Medicamentos dos Estados Unidos da América
VHS - Velocidade de Hemossedimentação
LISTA DE QUADROS E TABELAS
Tabela 1. Fármacos implicados no Síndrome de Stevens-Johnson e na Necrólise Epidérmica
Tóxica........................................................................................................................................24
Tabela 2. Principais alelos HLA associados a predisposição genética para SSJ/NET segundo
grupo populacional....................................................................................................................27
Tabela 3. SCORTEN – critérios de gravidade e respectiva mortalidade...................................33
Quadro 1. Hemograma, gasometria venosa, eletrólitos, bioquímica, função renal, função
hepática, provas de atividade inflamatória, coagulograma, enzimas cardíacas..........................72
LISTA DE FIGURAS
Figura 1. Representação da SSJ, NET e sobreposição SSJ e NET de acordo com a percentagem
de descolamento epidérmico.....................................................................................................19
Figura 2. Modelo da apresentação antigênica das APC ao linfócito T citotóxico e da apoptose
dos queratinócitos induzida pela interação fármaco-HLA-TCR na SSJ/NET............................28
Figura 3. Patogênese da necrose epidérmica e apoptose disseminada de queratinócitos na
SSJ/NET....................................................................................................................................31
Figura 4 – Histopatologia NET................................................................................................34
LISTA DE FOTOGRAFIAS
Fotografia 1. Lesões cutâneas eritemato-bolhosas em tronco, membros inferiores e superiores;
lesões vesículo-bolhosas ulcerativas na cavidade bucal e acometimento ocular bilateral..........47
Fotografia 2. Lesões cutâneas crostosas em face, conjuntivite e envolvimento cutâneo superior
a 30% da superfície corporal......................................................................................................49
Fotografia 3. Lesões cutâneas descamativas em todo o corpo..................................................49
Fotografia 4. Histopatologia NET............................................................................................50
Fotografia 5. Raio-X de tórax sem evidência de condensação..................................................51
Fotografia 6. Lesões maculares de distribuição difusa.............................................................52
SUMÁRIO
1
INTRODUÇÃO ..........................................................................................................14
2
OBJETIVO .................................................................................................................16
3
JUSTIFICATIVA .......................................................................................................17
4
REVISÃO DA LITERATURA ..................................................................................18
4.1
DEFINIÇÃO .................................................................................................................18
4.2
HISTÓRICO .................................................................................................................19
4.3
EPIDEMIOLOGIA .......................................................................................................20
4.4
ETIOLOGIA .................................................................................................................21
4.5
FISIOPATOLOGIA E IMUNOPATOGENIA .............................................................25
4.6
QUADRO CLÍNICO ....................................................................................................32
4.7
DIAGNÓSTICO ...........................................................................................................33
4.8
DIAGNÓSTICO DIFERENCIAL ................................................................................35
4.9
TRATAMENTO ...........................................................................................................38
4.10
PROGNÓSTICO ..........................................................................................................40
5
METODOLOGIA .......................................................................................................42
5.1
TIPO DE PESQUISA ...................................................................................................42
5.2
LOCAL DO ESTUDO ..................................................................................................42
5.3
MÉTODO .....................................................................................................................43
5.3.1 Revisão de Prontuário ................................................................................................43
5.3.2 Pesquisa Bibliográfica ................................................................................................43
5.3.3 Critérios de Inclusão e Exclusão ................................................................................43
5.4
MATERIAL E FONTE DE COLETA DE DADOS ....................................................43
5.5
CRITÉRIOS E PROCEDIMENTOS DE ANÁLISE DOS DADOS .............................44
5.6
FORMAS DE APRESENTAÇÃO DOS RESULTADOS ............................................44
5.7
ASPECTOS ÉTICOS ...................................................................................................44
5.7.1 Análise crítica de desconfortos e riscos previsíveis ...................................................45
5.7.2 Análise crítica de benefícios esperados ......................................................................45
5.7.3 Monitoramento da coleta de dados e proteção à confidencialidade ........................45
5.8
NORMAS ADOTADAS ..............................................................................................46
6
RELATO DE CASO ...................................................................................................47
7
DISCUSSÃO ...............................................................................................................53
8
CONSIDERAÇÕES FINAIS .....................................................................................59
REFERÊNCIAS .........................................................................................................60
ANEXOS .....................................................................................................................72
1 INTRODUÇÃO
A Síndrome de Stevens-Johnson (SSJ) e a necrólise epidérmica tóxica (NET) são
reações adversas medicamentosas cutâneas graves, tais como a Pustulose Exantemática Aguda
Generalizada e a Síndrome de Hipersensibilidade a fármacos, também conhecida como reação
medicamentosa com eosinofilia e sintomas sistêmicos (sigla inglesa: DRESS). Estas reações
pertencem ao grupo das toxidermias graves, tendo em comum mecanismos de
hipersensibilidade retardada. E por serem consideradas emergências médicas, juntamente com
algumas reações de hipersensibilidade imediata ou do tipo I (anafilaxia), podem tornar-se fatais.
As toxidermias graves são situações raras, pois a maioria das toxidermias constituem situações
benignas e transitórias (DUARTE et al., 2010; BŁASZCZYK et al., 2013).
A SSJ foi primeiramente descrita em 1922, como uma síndrome mucocutânea aguda
em dois jovens rapazes com conjuntivite purulenta severa, estomatite severa com extensa
necrose da mucosa, e manchas purpúricas. A doença tornou-se conhecida como SSJ e foi
caracterizada como uma doença severa mucocutânea com um curso clínico prolongado e
potencialmente fatal em certos casos, sendo maioritariamente induzida por fármacos (HARR;
FRENCH, 2010).
Em 1956, Alan Lyell descreveu a NET também conhecida como Síndrome de Lyell,
em quatro doentes com uma erupção cutânea idêntica a “pele escaldada”. Mais tarde concluiuse que a NET era induzida por fármacos como as sulfonamidas, pirazolonas, barbitúricos e
antiepilépticos (HARR; FRENCH, 2010; SCHWARTZ; MCDONOUGH; LEE, 2013).
Até 1993 o eritema multiforme (EM) ou eritema polimorfo era considerado juntamente
com a SSJ e NET como espectros da mesma doença. A classificação publicada por BastujiGarin et al (1993) coloca o EM em posição nosológica diferente considerando-o como uma
doença distinta baseando-se no tipo de lesões cutâneas (lesões em alvo típicas), e na extensão
das vesículas e erosões relativamente à superfície corporal afetada (HARR; FRENCH, 2010;
MOCKENHAUPT, 2011). Assim, segundo esta classificação a SSJ e NET constituem dois
extremos do mesmo espectro clínico de toxidermias graves com necrose epidérmica, diferindo
apenas na extensão do descolamento epidérmico (DUARTE et al., 2010; MOCKENHAUPT,
2011; OLIVEIRA; SANCHES; SELORES, 2011).
Na SSJ o descolamento epidérmico é inferior a 10% da área de superfície corporal,
enquanto que na NET o descolamento epidérmico atinge pelo menos 30% da área de superfície
14
corporal, configurando uma situação mais severa. Entre estes dois limites são consideradas
formas intermediárias ou síndrome de sobreposição SSJ e NET (CASTELAIN; HUMBERT,
2012).
O interesse pelo tema surgiu quando a investigadora, ao realizar o internato em
pneumologia, participou do atendimento, sob preceptoria, ao paciente com a SSJ/NET,
despertando o interesse, pois associam-se a elevada morbidade/mortalidade. Portanto, seu
reconhecimento é importante para uma intervenção precoce.
Diante do exposto, houve a iniciativa de relatar e fazer revisão literária da síndrome
de Stevens-Johnson/Necrólise Epidérmica Tóxica em um paciente jovem, internado no Serviço
de Pneumologia do Hospital Geral de Roraima.
15
2 OBJETIVO
Relatar um caso de síndrome de Stevens-Johnson/Necrólise Epidérmica Tóxica,
diagnosticado em um paciente jovem no Hospital Geral de Roraima (HGR) – Boa Vista – em
2016.
16
3 JUSTIFICATIVA
A síndrome de Stevens-Johnson/Necrólise Epidérmica Tóxica, embora seja um
fenômeno patológico de ocorrência rara, apresenta implicações sérias que podem colocar em
risco a vida do paciente. Entretanto, quando o diagnóstico é feito precocemente e os clínicos
solicitam a troca ou interrupção do uso da medicação promotora da patologia, diminui a
probabilidade de evoluir para quadros graves ou até mesmo ao óbito. Dessa forma, é necessário
o maior entendimento acerca dos fatores precipitantes desse agravo, para auxiliar o médico
durante a condução clínica.
17
4 REVISÃO DA LITERATURA
4.1 DEFINIÇÃO
A síndrome de Stevens-Johnson é caracterizada por reações mucocutâneas
potencialmente fatais que resultam de hipersensibilidade a fatores precipitantes variados, como
infecções por vírus, fungos, bactérias, enfermidades do tecido conjuntivo, neoplasias malignas,
vacinas e múltiplos medicamentos (ROUJEAL; STERN, 1994; COCKEY et al, 1996). A
mucosa oral, lábios e conjuntiva são as principais regiões acometidas. A síndrome de Stevens
Johnson não apresenta etiologia conhecida, porém, provavelmente é oriunda de uma desordem
imunológica, com o envolvimento de vasos superficiais, que resulta em um processo patológico
(VANFLETEREN; GYSEL; DE BRANDT, 2003).
A Necrólise Epidérmica Tóxica (NET), também conhecida como Síndrome de Lyell,
representa o extremo de gravidade do eritema multiforme major, quando o descolamento
cutâneo ultrapassa 30% da superfície cutânea. Mais de 80% dos casos têm associação com
drogas (ROUJEAU, 2005).
Segundo a classificação proposta por Bastuji-Garin et al (1993) a SSJ e a NET
representam espectros opostos da mesma doença, e são classificados de acordo com a extensão
do destacamento epidérmico: na SSJ a percentagem de descolamento é inferior a 10% da
superfície corporal, enquanto que na NET este parâmetro é superior a 30%. Quando há
atingimento de 10 a 30% do tegumento cutâneo estamos perante uma sobreposição das duas
situações (Figura 1).
18
Figura 1
Representação da SSJ, NET e sobreposição SSJ e NET de acordo com a percentagem de descolamento
epidérmico.
Fonte: Adaptado (HARR; FRENCH, 2010)
.
4.2 HISTÓRICO
A necrólise epidérmica tóxica (NET), também referida como síndrome de Lyell, é
afecção
grave
desencadeada
por
infecções,
mas
principalmente
medicamentos,
conceitualmente caracterizada por morte generalizada dos queratinócitos e destacamento da
epiderme no nível da junção dermo-epidérmica (CHAVE et al, 2005). O termo foi proposto
por Lyell em 1956 para indicar afecção mucocutânea rara e emergencial precedida por febre,
tosse, rinite, queimação conjuntival, dor de garganta, cefaleia, vômitos, diarreia, anorexia e malestar. Suas manifestações dermatológicas incluem erupção maculo-papular discreta semelhante
19
a um exantema morbiliforme, que precede a formação de bolhas de conteúdo sero-hemático,
erosões em mucosas e, posteriormente, o destacamento da epiderme, atingindo mais de 30% da
superfície corpórea total (LISSIA et al., 2010). Possui baixa incidência e alta mortalidade,
configurando um quadro extremamente grave e que, portanto, deve ser prontamente
reconhecido (CHAVE et al., 2005; LISSIA et al., 2010).
Em 1922, Stevens e Johnson descreveram dois pacientes com erupções cutâneas
generalizadas, febre contínua, mucosa oral inflamada e conjuntivite purulenta grave (FOSTER
et al, 2015), quadro denominado de eritema multiforme (EM); em 1950, esse quadro foi
dividido em duas categorias: eritema multiforme minor (descrito por Ferdinand Von Hebra) e
eritema multiforme major (EMM), também conhecido como síndrome de Stevens Johnson
(SSJ). Desde 1983, o epônimo de Stevens Johnson passou a ser usado como sinônimo de EMM.
Em 1993, Bastuji e Roujeau propuseram que EMM e SSJ eram doenças distintas e
sugeriram que a denominação de eritema multiforme deveria ser restrita para pacientes com
lesões em alvo ou pápulas edematosas, com ou sem lesões mucosas; a denominação de SSJ
deveria ser usada como síndrome caracterizada por erosões mucosas, bolhas pequenas e lesões
eritematosas ou purpúricas que são diferentes dos alvos clássicos (BASTUJ-GARIN et al.,
1993). De acordo com esta classificação clínica, SSJ e EMM passaram a ser consideradas
doenças distintas, com lesões mucosas similares e diferentes padrões de lesões cutâneas.
A síndrome de Stevens Johnson (SSJ) e a Necrólise Epidérmica Tóxica (NET) são
reações cutâneas graves, com potencial para morbidade e mortalidade elevadas acometendo a
pele e a membrana mucosa, caracterizada por exantema eritematoso disseminado, com
acometimento centrífugo, lesões em alvo, acometimento de mucosa oral, ocular e genital
(FOSTER et al, 2015; LISSIA et al., 2010).
4.3 EPIDEMIOLOGIA
A SSJ e NET constituem patologias raras (OLIVEIRA; SANCHES; SELORES,
2011). A NET tem uma incidência estimada de 0,4 a 1,9 casos por milhão de pessoas
anualmente em todo o Mundo. A SSJ tem uma incidência anual de 1,2 a 6 casos por milhão de
pessoas, cerca do triplo da incidência relativamente à NET. A incidência combinada de SSJ,
síndrome de sobreposição SSJ/NET e NET estima-se em cerca de 2 a 7 casos por milhão de
pessoas por ano (SCHWARTZ; MCDONOUGH; LEE, 2013).
20
A SSJ e NET podem afetar tanto crianças como adultos, embora sejam mais frequentes
nos extremos etários, ou seja, antes dos 5 anos de idade e após os 64 anos. A distribuição por
gênero privilegia o sexo feminino havendo, no caso da síndrome de sobreposição SSJ/NET,
uma preponderância de cerca de 65%, (MOCKENHAUPT, 2011) e no caso da NET uma razão
mulher/homem de 3:2 ou mesmo de 2:1 (CABRAL et al., 2004). Pelo contrário, o SSJ
predomina no sexo masculino (OLIVEIRA; SANCHES; SELORES, 2011). Não estão descritas
variações de acordo com a raça (CABRAL et al., 2004).
Estudos demonstram que em indivíduos infectados pelo vírus da imunodeficiência
humana (HIV), a incidência de SSJ e NET é muito maior, acontecendo em cerca de 1 em cada
1000 doentes. Esta situação reflete, entre outros aspectos, a elevada utilização de fármacos
antiretrovirais nesta população de doentes (SCHWARTZ; MCDONOUGH; LEE, 2013). Na
Europa, aproximadamente 5% dos doentes com SSJ/NET estão infectados pelo vírus HIV, mas
este número parece ter diminuído nas últimas décadas (MOCKENHAUPT, 2011). A
distribuição de idade e gênero difere entre indivíduos infectados e não infectados pelo HIV e
com SSJ/NET (MOCKENHAUPT, 2011).
A incidência de ambas as patologias aumenta com a idade, sexo feminino, indivíduos
com predisposição genética e em determinados grupos de risco, como doentes polimedicados,
acetiladores lentos, imunodeprimidos (nomeadamente nos indivíduos com o Síndrome de
Imunodeficiência Adquirida - SIDA, sendo que a infecção por HIV constitui um fator de risco
maior) e nos doentes com tumores cerebrais tratados concomitantemente com radioterapia e
anticonvulsivantes. Sabe-se que os doentes com Lúpus Eritematoso Sistêmico (LES) são
também um grupo de risco, muito embora se pense que este fato está relacionado com a
terapêutica que realizam e não com a sua doença de base. (OLIVEIRA; SANCHES; SELORES,
2011; CASTELAIN; HUMBERT, 2012).
A mortalidade da síndrome de Stevens-Johnson é estimada em 1% a 3%, em franco
contraste com a da NET, estimada em 30% a 50% (ROUJEAU, 1990).
4.4 ETIOLOGIA
Estima-se que a maioria dos casos de SSJ e NET se devam a uma reação de
hipersensibilidade à administração de um fármaco (uma resposta idiossincrática, independente
da dose utilizada) (CABRAL et al., 2004). Cerca de 90-95% dos casos de NET são induzidos
por fármacos. A porcentagem de casos atribuíveis a fármacos no caso da SSJ é inferior,
21
situando-se entre os 50 a 80% (OLIVEIRA; SANCHES; SELORES, 2011; KIM et al., 2012).
Globalmente os fármacos são identificados como agentes etiológicos em cerca de 75% dos
casos de SSJ e NET, enquanto cerca de 25% dos casos não se relacionam com o uso de um
fármaco. Várias infecções têm sido identificadas como o agente etiológico, outros casos
permanecem como idiopáticos (MOCKENHAUPT, 2011). Dentre as infecções destacam-se,
como mais frequentes, as infecções bacterianas por Mycoplasma pneumoniae (M. pneumoniae)
e infecções virais por vírus herpes simples (KIM et al., 2012). Também o vírus da hepatite A,
o vírus Epstein-Barr e o HIV podem estar implicados (OLIVEIRA; SANCHES; SELORES,
2011; CABRAL et al., 2004; GERULL; NELLE; SCHAIBLE, 2011).
A SSJ induzido por M. pneumoniae afeta mais crianças e jovens adultos, e tem
manifestações e complicações menos severas do que o induzido por fármacos (WETTER;
CAMILLERI, 2010). Pensa-se que pode haver uma sobrevalorização destas causas em oposição
às causas farmacológicas, pelo fato de, anteriormente à classificação de 1993 os casos de SSJ
serem classificados como eritemas multiforme major, cuja etiologia é fundamentalmente
infecciosa (OLIVEIRA; SANCHES; SELORES, 2011).
Outros autores defendem ainda a associação com situações não infecciosas como
vacinação, nomeadamente do tétano e da varíola (OLIVEIRA; SANCHES; SELORES, 2011),
leucemias, linfomas, colite ulcerosa, doença de Crohn (CABRAL et al., 2004), doenças imunoinflamatórias crônicas do colágeno (LES) (CABRAL et al., 2004; GERULL; NELLE;
SCHAIBLE, 2011), dermatomiosite e poliartrite nodosa), e o tratamento com radioterapia
(GERULL; NELLE; SCHAIBLE, 2011).
Estudos recentes revelam que a maioria dos doentes que desenvolvem SSJ/NET
durante radioterapia estão também sob terapêutica medicamentosa concomitante. A
mortalidade é mais elevada para aqueles medicados com anticonvulsivantes. O segundo
medicamento mais associado com a radioterapia é a amifostina usada para proteção contra a
xerostomia, imediata e tardia, relacionada com a radioterapia convencional fracionada, em
tratamentos de cancro na cabeça e pescoço, não tendo sido relatadas mortes de doentes com
SSJ/NET e medicados com amifostina (VERN-GROSS; KOWAL-VERN, 2014).
Em termos de estimativa do risco de fármacos como agentes causais de SSJ/NET, dois
estudos do tipo caso-controle foram levados a cabo na Europa nos últimos 20 anos. O primeiro
foi o estudo internacional SCAR (sigla inglesa para reações cutâneas severas adversas a
fármacos) executado em vários países europeus entre 1989 e 1995. Para os fármacos utilizados
em curtos períodos de tempo, são considerados fármacos de elevado risco de provocar SSJ/NET
22
o cotrimoxazol e outros antibióticos do grupo das sulfonamidas, aminopenicilinas, quinolonas,
cefalosporinas, e também o relaxante muscular clormezanona. Para os fármacos utilizados por
longos períodos de tempo, aqueles que demonstraram elevado risco foram o alopurinol,
carbamazepina, fenobarbital, fenitoína e anti-inflamatórios não esteroidais (AINE) do grupo
dos oxicam. Esse risco torna-se mais significativo nos dois primeiros meses de utilização. O
segundo estudo foi o estudo EuroSCAR que utilizou casos e controles dos mesmos e outros
países europeus do estudo SCAR, no período de 1997 a 2001. Os fármacos foram agrupados
por categorias de acordo com o risco de provocarem SSJ/NET: fármacos de alto risco, fármacos
de moderado risco (risco menor que os anteriores mas ainda assim significante) e fármacos sem
aumento do risco (MOCKENHAUPT, 2011; PAPAY et al., 2012). Este estudo forneceu dados
mais atualizados revelando que fármacos mais recentes como a lamotrigina (anti-epiléptico) e
a nevirapina (antiretroviral) estavam fortemente associados a SSJ/NET. Estes dois fármacos
foram classificados como “altamente suspeitos/fortemente associados” a SSJ/NET.
Assim, confirmou-se elevado risco para todos os fármacos já referidos como suspeitos
pelo estudo SCAR, sendo que o risco para o alopurinol tem vindo a aumentar, constituindo
atualmente a principal causa de SSJ/NET na Europa e em Israel, (MOCKENHAUPT, 2011) e
maioritariamente em doentes que tomam doses diárias de pelo menos 200 mg (HARR;
FRENCH, 2010). Os fármacos do grupo das penicilinas, que anteriormente tinham sido
imputados como causa de SSJ/NET, não demonstraram aumento do risco, enquanto outros
antibióticos como cefalosporinas, macrolídeos, quinolonas e tetraciclinas demonstraram risco
moderado. Também os AINE derivados do ácido acético (por exemplo diclofenaco) revelaram
risco moderado. Muitos fármacos de utilização comum não foram associados a risco detectável
de induzir SSJ/NET como ilustra a Tabela 1.
Uma análise retrospectiva baseada na revisão dos processos clínicos dos doentes com
o diagnóstico de SSJ e NET hospitalizados no Serviço de Dermatologia dos Hospitais da
Universidade de Coimbra, durante um período de 10 anos, revelou que o alopurinol é a principal
causa de SSJ/NET, estando em concordância com os dados europeus (BRINCA et al., 2011).
23
Tabela 1- Fármacos associados a risco de SSJ/NET de acordo com o estudo EuroSCAR.
Fonte: Adaptado (MOCKENHAUPT, 2011; DOWNEY et al., 2012).
Papay et al. (2012) realizaram um estudo mais recente comparando a informação da
base de dados do Sistema de Informação de reações adversas da Administração dos alimentos
e medicamentos dos Estados Unidos da América (sigla inglesa US FDA AERS) com a
informação do estudo EuroSCAR havendo boa correlação entre os estudos. Um total de 12
medicamentos foi classificado de altamente suspeito: alopurinol, nevirapina, piroxicam, os
fármacos
antiepilépticos
carbamazepina,
oxcarbamazepina,
fenitoína,
fosfenitoína,
fenobarbital, e lamotrigina, e os antibióticos do grupo das sulfonamidas, sulfassalazina,
sulfisoxazole, e sulfametoxazol/trimetoprim (cotrimoxazol). Apenas o meloxicam (AINE
oxicam) classificado como altamente suspeito no estudo EuroSCAR não demonstrou essa
relação neste estudo.
Para clarificar a etiologia da SSJ ou NET, e para prevenir eventuais erros que possam
decorrer da não identificação dessa etiologia, deve ser executada uma história clínica completa
e cuidada, com principal atenção à data de início da toma do fármaco e início da sintomatologia
prodrômica (KIM et al., 2012).
Estudos em diferentes populações indicam que o risco de desenvolver SSJ/NET é
maior quanto mais recente for a introdução do fármaco, declinando abruptamente após as oito
semanas de administração (OLIVEIRA; SANCHES; SELORES, 2011). Curiosamente o uso
crônico de glicocorticoides para várias doenças não altera a incidência de SSJ/NET para
determinados fármacos causais, mas em doentes sob corticoterapia crônica parece haver um
aumento do intervalo de tempo entre o início da toma do fármaco e o início da SSJ/NET
24
(HARR; FRENCH, 2010). Estudos recentes em crianças revelam que os fármacos implicados
são maioritariamente os mesmos que em adultos, possivelmente havendo um aumento da
susceptibilidade ao paracetamol em crianças (HARR; FRENCH, 2010; KOH; TAY, 2009).
4.5 FISIOPATOLOGIA E IMUNOPATOGENIA
Pouco ainda se conhece dos mecanismos celulares e moleculares que desencadeiam
estas toxidermias, embora se saiba que são mediadas por linfócitos T citotóxicos CD8+
específicos para determinados antígenos dos fármacos. A ativação do receptor membranar Fas
(presente na membrana celular dos queratinócitos) pelo seu ligando FasL, induz a apoptose dos
queratinócitos através da ativação de enzimas específicas denominadas caspases. Ambos estão
aumentados nestas patologias (FRENCH; PRINS, 2008; BORCHERS et al., 2008).
O mecanismo fisiopatológico inerente ao espectro SSJ-NET ainda não está claramente
esclarecido. Pensa-se que os fenômenos subjacentes a estas patologias correspondam a uma
reação de hipersensibilidade retardada. A apoiar este fato, existem relatos de doentes com SSJ
e NET que foram posteriormente medicados com o fármaco implicado e desenvolveram
sintomas semelhantes num espaço de tempo mais curto, o que sugere uma sensibilização prévia
(BORCHERS et al., 2008).
Há indivíduos com uma maior predisposição genética para desenvolver estas
patologias, nomeadamente aqueles que são acetiladores lentos, os que apresentam deficiência
de glutationa transferase (com uma incidência de cerca de 50% na população geral) e de outras
enzimas responsáveis pela destruição dos metabólitos tóxicos dos fármacos (BORCHERS et
al., 2008; BULISANI et al., 2006; OLIVEIRA, A.; SANCHES, M.; SELORES, M., 2011).
Recentemente tem-se verificado uma associação genética entre determinados alelos do
complexo major de histocompatibilidade HLA (Human Leukocyte Antigen system) e o
desenvolvimento de reações adversas a fármacos graves, nomeadamente SSJ e NET (CHUNG;
HUNG, 2010; KIM et al., 2010; OLIVEIRA; SANCHES; SELORES, 2011). Estas associações
parecem ser específicas do fármaco, do padrão de toxidermia e de determinados grupos étnicos,
como é o caso da relação entre o alelo HLA-B*1502 e o desenvolvimento de SSJ e NET
induzidos pela carbamazepina na população chinesa (CHUNG; HUNG, 2010; KIM et al., 2010;
FERNANDO; BROADFOOT, 2010).
A associação genética mais impressionante foi detectada em Taiwan num grupo de
Chineses Han, em que o alelo HLA-B*1502 foi encontrado em 100% do grupo de indivíduos
25
que desenvolveram SSJ/NET induzido pela carbamazepina, sendo que apenas 3% dos
indivíduos do grupo eram tolerantes a este fármaco. Contudo, esta associação não foi
encontrada na população japonesa ou europeia, revelando que o alelo apenas é relevante num
contexto de etnia. São dadas várias hipóteses para explicar este fato: o alelo HLA-B*1502 tem
uma baixa prevalência entre a população caucasiana, a SSJ/NET é uma doença poligênica com
vários alelos protetores e de susceptibilidade entre os genes envolvidos na patogênese da
doença, ou existem fenômenos de desequilíbrio de ligação durante a divisão celular
(FERNANDO; BROADFOOT, 2010). No entanto, estudos adicionais são necessários para
clarificar este aspecto.
Na população caucasiana esta relação foi estudada e não se verificou associação entre
a positividade para este alelo e o desenvolvimento de reações adversas graves à carbamazepina
(ALFIREVIC et al., 2006). Pelo contrário, Alfirevic et al (2006) concluíram que o alelo HLAB*0702 tem um potencial efeito protetor no desenvolvimento de reações adversas graves à
carbamazepina na população caucasiana. Outro alelo que se sabe estar relacionado com o
desenvolvimento de SSJ e NET em indivíduos medicados em diversas populações,
nomeadamente Japoneses, Europeus e Chineses Han com alopurinol é o HLA-B*5801
(BULISANI et al., 2006; CHUNG; HUNG, 2010; FERNANDO; BROADFOOT, 2010; CAO
et al, 2012). A associação é mais forte para os Chineses Han do que para os Europeus
(GONÇALO, 2013).
O HLA-A*3101, associado a SSJ/NET causado pela carbamazepina, foi identificado
em Japoneses e Europeus não sendo no entanto específico da SSJ/NET, podendo também
associar-se a DRESS ou erupção maculopapular. A verdadeira utilidade do marcador HLAA*3101 para a prevenção de SSJ/NET causado pela carbamazepina não é consensual (CHUNG;
HUNG, 2012). A Tabela 2 resume os principais alelos HLA associados a predisposição genética
para SSJ/NET. Muitos outros encontram-se em estudo.
26
Tabela 2 – Principais alelos HLA associados a predisposição genética para SSJ/NET
segundo grupo populacional.
Fonte: Adaptado de (CHUNG; HUNG, 2012; PAVLOS; MALLAL; PHILLIPS, 2012).
Foram descritos também, como relacionados com a patogênese da doença,
polimorfismos nos genes pró-apoptótico FasL, TLR-3 e via sinalizadora receptor IL-4/IL-13.
Os resultados são variáveis para diferentes populações (FERNANDO; BROADFOOT, 2010).
Os receptores específicos dos linfócitos T (TCR) reconhecem os antígenos do fármaco
apresentados por alelos HLA específicos da célula apresentadora de antígenos (APC) ou célula
dendrítica que leva à ativação dos linfócitos T citotóxicos e expressão dos mediadores
citotóxicos (CHUNG; HUNG, 2012; GONÇALO; BRUYNZEEL, 2012).
Várias hipóteses têm sido propostas para explicar a interação do HLA, antígeno do
fármaco, e TCR nos mecanismos de hipersensibilidade a fármacos. A teoria do
hapteno/próhapteno postula que um fármaco ou seu metabólito podem formar uma ligação
covalente com um peptídeo transportador, sendo depois o complexo apresentado pelo HLA ao
TCR. A teoria da interação farmacológica com receptores imunes (conceito p-i) propõe que o
fármaco ou seu metabólito podem interagir diretamente com o TCR ou um peptídeo ligado ao
HLA. Embora a interação entre o fármaco e os receptores imunes, como os TCR ou moléculas
HLA, possa ser reversível e fraca, ela é capaz de estimular as células efetoras T nas reações
farmacológicas de hipersensibilidade retardada. (PAVLOS; MALLAL; PHILLIPS, 2012).
O fármaco combinado com o HLA nas células alvo (queratinócito) pode também ser
reconhecido pelas células T citotóxica que desta forma, e por contato direto entre
HLAfármaco/TCR, leva a apoptose das células alvo (Figura 2).
27
Figura 2 – Modelo da apresentação antigénica das APC ao linfócito T citotóxico e da apoptose
dos queratinócitos induzida pela interação fármaco-HLA-TCR na SSJ/NET.
Como ilustrado, a resposta imunológica é ativada pela ligação do fármaco ao queratinócito, que é a principal célula
alvo na SSJ/NET (por exemplo, ligação da carbamazepina ao alelo HLA-B*1502). Os TCR dos linfócitos T CD8+
reconhecem o complexo fármaco-HLA. Os linfócitos T citotóxicos ou células NK produzem citocinas e proteínas
citotóxicas, como a granulisina, que levam à extensa apoptose dos queratinócitos.
Fonte: Adaptado de (CHUNG; HUNG, 2010).
Para além das células existentes permanente ou temporariamente no tegumento
cutâneo (queratinócitos, células dendríticas, macrófagos, células NK), as células T específicas
(CD4+, CD8+, Th1, Th2, Th17) orquestram a resposta efetora e produzem o fenótipo final da
SSJ/NET (GONÇALO, M., 2013). Os linfócitos T citotóxicos e células NK são as principais
células envolvidas nas lesões mucocutâneas características da SSJ/NET. Por outro lado, parece
haver uma diminuição da função dos linfócitos T reguladores (Treg) na fase aguda da NET
relacionando-se com maior severidade do dano epidérmico (TOHYAMA; HASHIMOTO,
2012).
28
As três principais classes de mediadores citotóxicos produzidos por estas células e que
participam na extensa necrose epidérmica característica da SSJ/NET são a Granulisina, a
perforina/granzima B e a Interação Fas-FasL.
Viard et al (apud CHUNG; HUNG, 2012) propuseram que a interação entre o receptor
transmembranar Fas (CD95) e o seu ligando FasL (CD95L) resulta na apoptose dos
queratinócitos. O complexo Fas-FasL recruta o FADD (Fas-associated death domain protein)
que se liga ao complexo Fas-FasL e à procaspase 8. O FADD reúne múltiplas cópias da
procaspase 8 que se unem para formar a caspase 8, ativando a via das capases resultando na
degradação do DNA intracelular. O FasL, produzido sobretudo por linfócitos T citotóxicos e
células NK, distribui-se pela superfície celular dos queratinócitos, enquanto o seu homólogo
solúvel (sFasL) apresenta-se em concentrações elevadas no plasma de doentes com NET.
Outros estudos questionam este papel do FasL na indução da apoptose dos queratinócitos na
SSJ/NET. Recentemente, um estudo refere o TNF-α e IFN-γ, produzidos pelos linfócitos T,
como potenciais indutores da apoptose dos queratinócitos mediada pelo Fas através da indução
da sintetase do óxido nítrico na NET.
Outra hipótese sugere que é a perforina/granzima B que tem um papel importante na
indução da apoptose dos queratinócitos. Nassif et al (2004 apud CHUNG; HUNG, 2012)
mostraram que o efeito citotóxico dos linfócitos do líquido das vesículas de doentes com NET
sobre os queratinócitos pode ser atenuado pela inibição da expressão da perforina/granzima B,
mas não pelo anticorpo monoclonal anti-Fas. Os linfócitos T citotóxicos ativados e as células
NK produzem perforina, que se liga e abre canais através da membrana celular da célula alvo
promovendo a entrada de granzima B nos queratinócitos. Uma vez dentro da célula a granzima
B ativa a via das caspases e portanto induz a apoptose dos queratinócitos. Níveis elevados de
perforina, granzima B, TNF-α e FasL associam-se a maior severidade da doença.
Como já referido, dos vários tipos de células T envolvidas no processo, os linfócitos T
citotóxicos CD8+ ou células NK (nomeadamente NKp46+), (SCHLAPBACH et al, 2011)
produtores de granulisina têm um importante papel na necrose epidérmica (Figura 3). A
granulisina é atualmente considerada o mediador citotóxico mais importante na indução de
apoptose dos queratinócitos (CHUNG; HUNG, 2012; CHUNG, 2008).
A granulisina é uma proteína catiônica citolítica, sendo considerada também um
marcador sorológico de imunidade mediada por células (promove o recrutamento de APC e
leucócitos, ativa respostas imunitárias especificas e atua como alarmina). As alarminas, como
a granulisina e a proteína HMGB1, são moléculas libertadas por células danificadas capazes de
29
iniciar respostas imunes em vários órgãos após interação com vários tipos de receptores.
(CHUNG; HUNG, 2012; HASHIZUME, 2012).
A granulisina é dividida em duas isoformas de 9-kDa e 15-kDa. A granulisina de 9kDa é a molécula citotóxica por excelência sendo considerada a molécula crucial para a
apoptose dos queratinócitos. A granulisina de 15-kDa, de menor efeito citotóxico, foi
recentemente aceite como alarmina, ativando monócitos e células dendríticas, através da
ligação ao TLR-4/Myd88, levando à diferenciação e proliferação dos linfócitos Th17.
(HASHIZUME, 2012). A sua concentração no fluído das bolhas epidérmicas dos doentes com
SSJ/NET é várias ordens de grandeza superior à de outros mediadores como perforina,
granzima B ou FasL. Este aspecto parece explicar a histopatologia da doença, na qual um
infiltrado mononuclear ligeiro na derme pode associar-se a extensa necrose epidérmica
(CHUNG; HUNG, 2012). Além disso, a concentração sérica de granulisina correlaciona-se
positivamente com maior severidade da doença (CHUNG, 2008).
A granulisina não é só um mediador citotóxico, mas também tem um efeito
quimiotático na atração de linfócitos T, monócitos e outras células inflamatórias. É também
capaz de ativar várias citocinas pró-inflamatórias como o CCL5/RANTES, CCL3/MIP-1α,
CCL2/MCP-1, MCP-3, IL-10, IL-1, IL-6 e IFN-α. Estudos recentes demonstram que a
granulisina estimula a expressão de CCL20 em monócitos. Um estudo in vitro mostra que a
indução da expressão de granulisina por parte dos linfócitos T citotóxicos CD8+ é regulada
pelas IL-21 e IL-15. (CHUNG; HUNG, 2012).
30
Figura 3 - Patogênese da necrose epidérmica e apoptose disseminada de queratinócitos na
SSJ/NET.
Devido à ativação imunitária, os linfócitos T citotóxicos e células NK migram para a epiderme. Estes libertam
grande quantidade de imunomediadores (por exemplo, sFasL, perforina, granzima B, e granulisina) para o espaço
extracelular. Estas substâncias têm efeito citotóxico e provocam a extensa necrose epidérmica e formação de
bolhas. Os queratinócitos são assim danificados, ativando a via sinalizadora das caspases, levando à apoptose da
célula.
Fonte: Adaptado de (CHUNG; HUNG, 2010).
Inúmeros estudos têm-se debruçado sobre os mecanismos imunopatológicos
subjacentes à SSJ/NET demonstrando níveis elevados de inúmeras citocinas nas lesões
cutâneas, conteúdo líquido das bolhas e plasma dos doentes (CHUNG; HUNG, 2012). Pensase que os monócitos/macrófagos possam também participar nos mecanismos de lesão
epidérmica pela produção de TNF-α, TRAIL e TWEAK (TOHYAMA; HASHIMOTO, 2012).
Outras citocinas e quimiocinas encontradas em elevadas quantidades incluem IFN-γ, IL-2, IL5, IL-6, IL-10, IL-12, IL-13, IL-15, IL-18, e várias quimiocinas CCL20, CCL22 e CCL27. Estas
citocinas parecem ser responsáveis pela mobilidade, proliferação, regulação e ativação das
células T e outros leucócitos que participam na amplificação do fenômeno inflamatório e
citotóxico na fisiopatologia da SSJ/NET (CHUNG; HUNG, 2012).
31
Várias estratégias terapêuticas derivam dos conhecimentos fisiopatológicos da
SSJ/NET.
4.6 QUADRO CLÍNICO
Quando relacionados com fármacos, tanto a SSJ como a NET surgem em média 7 a
21 dias após o início do fármaco responsável (BOLOGNIA; JORIZZO; RAPINI, 2003). Ambas
as patologias são frequentemente precedidas de uma fase prodrômica caracterizada por
sintomas gerais: febre, mal-estar, mialgias, artralgias e tosse, com intensidade e duração
variáveis, persistindo, em geral, não mais do que uma semana. Após estes sintomas surge uma
erupção cutânea, geralmente não pruriginosa e que se caracteriza por máculas eritematosas ou
eritematovioláceas, com áreas de confluência, principalmente ao nível do tronco. Por vezes
surgem lesões em alvo atípicas, assim chamadas por não apresentarem o aspecto de três anéis
concêntricos, como as lesões em alvo do eritema multiforme (HARR; FRENCH, 2010).
A erupção cutânea tem geralmente início no tronco, com posterior generalização,
sendo as palmas e as plantas frequentemente poupadas. Em horas ou dias o quadro progride,
com descolamento da epiderme. As máculas eritematosas tornam-se violáceas, a epiderme
destaca-se da derme, dando origem a bolhas flácidas, que confluem e que facilmente se
rompem, deixando áreas erosionadas de extensão variável. A epiderme adquire o aspecto de
papel de cigarro molhado e é destacada em grandes retalhos ao mínimo traumatismo, razão pela
qual estes doentes devem ser manuseados com extremo cuidado. A pele perilesional apresenta
sinal de Nikolsky positivo, traduzido pelo descolamento da epiderme quando se exerce uma
pressão digital tangencial (HARR; FRENCH, 2010).
Há atingimento das mucosas em cerca de 90% dos casos em ambas as patologias,
principalmente da mucosa oral, ocular e genital (LEBARGY et al., 1997; REVUZ et al., 1987).
As lesões mucosas habitualmente surgem antes da necrose epidérmica, caracterizandose por erosão e descamação das mucosas conjuntival, orofaríngea, nasal, esofágica, uretral, anal,
vaginal e perineal, (MOCKENHAUPT, 2011; CABRAL et al, 2004) o que demonstra uma
predileção especial pelo epitélio pavimentoso estratificado. A extensão e localização destas
lesões varia de doente para doente, sendo as lesões conjuntivais, orofaríngeas e uretrais as mais
frequentes. Estas lesões são muito dolorosas, condicionando estomatite, balanite, uretrite,
podendo levar a uma retenção urinária, blefarite, hiperemia conjuntival ligeira a conjuntivite
purulenta, (MOCKENHAUPT, 2011; CABRAL et al, 2004) queratite supurativa ou
32
endoftalmite (GERULL; NELLE; SCHAIBLE, 2011). Também a traqueia, brônquios, sistema
gastrointestinal e rim podem ser afetados (SCHWARTZ; MCDONOUGH; LEE, 2013).
A SSJ e a NET distinguem-se clinicamente pela porcentagem de área erosionada ou
passível de erosão (com sinal de Nikolsky positivo), calculada em termos de superfície corporal.
Assim, nos casos em que a área envolvida é inferior a 10% da superfície corporal (SC) estamos
perante uma SSJ, quando a área é superior a 30% classifica-se como NET; quando a área
envolvida corresponde a uma percentagem entre 10 e 30% da SC considera-se uma
sobreposição entre as duas patologias (ROUJEAU, 2005; BASTUJI-GARIN, 1993).
A perda de integridade da epiderme condiciona a manutenção da homeostasia,
nomeadamente do equilíbrio termorregulador e hidroeletrolítico. A função barreira da epiderme
contra agentes patogênicos encontra-se também comprometida. Estes doentes estão, assim,
particularmente sujeitos a infecções bacterianas. Cerca de um terço dos doentes com NET
morre, a maioria por sepse (BORCHERS et al., 2008).
São vários os fatores que condicionam um mau prognóstico nos doentes com NET.
Bastuji-Garin et al (2000) elaboraram um score de severidade (SCORTEN) que compreende
sete parâmetros considerados importantes no prognóstico da NET (Tabela 3).
Tabela 3 – SCORTEN: critérios de gravidade e respectiva mortalidade
Fonte: BASTUJI-GARIN et al, 2000.
4.7 DIAGNÓSTICO
O diagnóstico destas entidades é clínico, baseado numa anamnese exaustiva, com
especial ênfase para o início recente de fármacos ou infecção prévia, e no exame físico. A
confirmação do diagnóstico passa pela realização de biópsia cutânea que, classicamente
mostra apoptose dos queratinócitos e necrose de toda a epiderme, que se encontra destacada
da derme (HARR; FRENCH, 2010), podendo ser visualizados na figura abaixo (Figura 4).
33
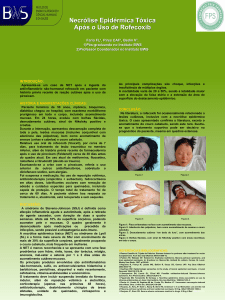
Figura 4 – Histopatologia NET.
Necrose de quase toda a espessura da epiderme e vacuolização dos queratinócitos da camada basal (*). Edema da
derme e discreto infiltrado linfo-mononuclear, com presença de eosinófilos intravasculares (seta).
Fonte: (Cortesia serviço de dermatologia e venereologia, HUC).
Atualmente não existe nenhum teste laboratorial específico que confirme o diagnóstico
de SSJ e NET (KOH; TAY, 2009). Cresce o interesse na utilização de marcadores sorológicos
para a detecção precoce de SSJ e NET sendo que a granulisina e a proteína HMGB1 poderão
ter aplicação em testes utilizados no futuro adicionando importante informação diagnóstica
(SCHWARTZ; MCDONOUGH; LEE, 2013).
As recomendações para o diagnóstico de SSJ e NET incluem a: colheita de história
clínica completa, dando especial atenção a exposição medicamentosa recente com o objetivo
34
da identificação do fármaco causal potencial do quadro clínico; Exame físico minucioso para
avaliação do tipo de lesões cutâneas, determinação da área cutânea atingida e avaliação do
envolvimento das mucosas; Para confirmação do diagnóstico e exclusão de outra doença,
realização de biópsia cutânea para estudo histopatológico; Numa abordagem inicial, é
necessário avaliação dos sinais vitais (Tensão Arterial, Frequência Cardíaca, Frequência
Respiratória, Temperatura Corporal), realização de gasometria, hemograma com plaquetas,
função renal e função hepática, ionograma, marcadores inflamatórios VHS e PCR, e
eletroforese das proteínas plasmáticas (DUARTE, 2010; CABRAL, 2004; WETTER;
CAMILLERI, 2010).
Em casos de SSJ com suspeita de etiologia não farmacológica pode ser necessário
realização de estudos sorológicos (IgG e IgM) e radiografia torácica para pesquisa de infecção
por M. pneumoniae, e/ou culturas de zaragatoas das mucosas para pesquisa de infecção pelo
vírus herpes simplex 1 e 2. Numa fase secundária, pode considerar-se sorologias da hepatite B
e C, HIV, citomegalovírus (CMV), vírus Epstein-Barr (EBV), parvovírus B19 e vírus
Coxsackie A16. Igualmente poder-se-á considerar estudo da função tiroideia, marcadores
tumorais e pesquisa de auto anticorpos e a realização de genotipagem HLA (DUARTE, 2010;
CABRAL, 2004; WETTER; CAMILLERI, 2010).
4.8 DIAGNÓSTICO DIFERENCIAL
Os diagnósticos diferenciais que podem eventualmente ser considerados são: eritema
multiforme, pustulose exantemática aguda generalizada, a Síndrome DRESS, síndrome da pele
escaldada estafilocócica, pênfigo paraneoplásico, doença de enxerto contra hospedeiro
(GVHD) aguda e queimaduras.
Como mencionado, apenas em 1993 o eritema multiforme (EM) passou a ser
considerado como não fazendo parte do espectro clínico da SSJ/NET, assumindo-se hoje que
existem diferenças clínicas, laboratoriais e histopatológicas entre o EM e a SSJ/NET
(WATANABE, 2011). O EM deve ser considerado quando há aparecimento de lesões em alvo
típicas e atingimento das mucosas após infecção ou introdução recente de um fármaco. Surge,
em cerca de 90% dos casos, após infecção, maioritariamente por Herpes (simples ou zoster) ou
por Mycoplasma. Em menos de 10% dos casos o agente responsável é um fármaco.
Clinicamente manifesta-se por lesões em alvo típicas, ou seja, com três anéis
concêntricos (OLIVEIRA; SANCHES; SELORES, 2011). O EM pode ocorrer numa forma
35
minor com lesões dispersas perifericamente nos membros e face, estando este padrão
habitualmente associado à infecção pelo vírus herpes simples (ARDERN-JONES;
FRIEDMANN, 2011). O EM major caracteriza-se por um exantema mais extenso associado a
bolhas e atingimento das mucosas (OLIVEIRA; SANCHES; SELORES, 2011; ARDERNJONES; FRIEDMANN, 2011). Na SSJ/NET existe maior envolvimento das mucosas, níveis
maiores de proteína C reativa (PCR) e, eventualmente, maior disfunção hepática relativamente
aos doentes com EM. Em termos histopatológicos no EM existe pouca necrose epidérmica, e
significativo infiltrado inflamatório na derme, enquanto que no SSJ/NET existe extensa necrose
epidérmica e escasso infiltrado inflamatório na derme (WATANABE, 2011). O EM é uma
doença autolimitada, sem risco de progressão para NET, cujo tratamento é maioritariamente
sintomático ou dirigido à infecção concomitante (OLIVEIRA; SANCHES; SELORES, 2011).
A síndrome da pele escaldada estafilocócica é uma doença mediada por exotoxinas de
uma determinada estirpe de Staphylococcus aureus (fago II). Esta síndrome ocorre sobretudo
em recém-nascidos e na primeira infância, podendo em raras situações surgir em adultos
imunocomprometidos (OLIVEIRA; SANCHES; SELORES, 2011). No passado este constituía
um dos principais diagnósticos diferenciais, mas atualmente a incidência é baixa com apenas
0.09 a 0,13 casos anuais por milhão de pessoas (HARR; FRENCH, 2010). Caracteriza-se
clinicamente por eritema e formação de bolhas flácidas, com posterior descamação em grandes
retalhos. Esta descamação não dá origem a exulcerações, como acontece na SSJ e na NET, uma
vez que, nesta patologia, a necrose epidérmica é apenas superficial com clivagem sub córnea,
a nível do estrato granuloso, e não ao nível da junção dermo-epidérmica como acontece na
SSJ/NET. O atingimento das mucosas é pouco comum (OLIVEIRA; SANCHES; SELORES,
2011; CABRAL, 2004). Habitualmente esta doença tem um curso benigno associando-se a
baixa mortalidade.
O pênfigo paraneoplásico (PPN), descrito por Anhalt em 1990, é uma dermatose
bolhosa auto-imune, caracterizada por lesões de pele e erosões mucosas graves, associadas a
neoplasias linfoproliferativas (KAPLAN et al, 2004). Os auto-anticorpos contra a epiderme são
aparentemente produzidos diretamente pelas células tumorais (ZHANG et al, 2006). As lesões
mucosas são geralmente as primeiras a surgir no PPN. Na mucosa oral habitualmente se
observam bolhas, erosões, úlceras extensas e dolorosas e lesões líquen plano-símiles, que
podem afetar toda a cavidade oral, língua (principalmente nas porções laterais) e lábios (úlceras
e crostas). As mucosas da faringe, laringe, esôfago, olhos, nariz e genital também podem
apresentar lesões (NGUYEN et al, 2001). As lesões de pele do PPN são polimórficas e
36
habitualmente surgem pós o início das lesões orais. As lesões podem assemelhar-se às do
pênfigo vulgar, pênfigo foliáceo, líquen plano, GVHD, eritema multiforme e síndrome de
Stevens-Johnson. As bolhas geralmente surgem no tronco superior, cabeça, pescoço e porção
proximal dos membros. Rompem-se rapidamente, dando lugar a erosões dolorosas. Bolhas
tensas rodeadas por eritema são habitualmente vistas nas extremidades (ZHU; ZHANG, 2007).
A doença de enxerto-contra-hospedeiro aguda resulta de interações complexas entre
as respostas imunitárias inatas e adquiridas do dador e receptor. Esta doença continua a ser
prevalente em alguns grupos de doentes susceptíveis como acontece em cerca de metade dos
receptores de transplantes halogênicos de células estaminais (PIÉRARD, 2013). Inicia-se como
um exantema morbiliforme súbito, muitas vezes acompanhado de febre. Nas formas mais
graves a erupção progride para um eritema difuso, com formação de bolhas flácidas que
facilmente se rompem. O sinal de Nikolsky pode ser positivo. Uma anamnese cuidada, aliada
ao estudo anatomopatológico, fazem o diagnóstico. No que respeita à histopatologia, o aspecto
da necrose de toda a espessura da epiderme é idêntico ao descrito para a SSJ/NET,
nomeadamente no grau IV da doença (SCHWARTZ; MCDONOUGH; LEE, 2013; PIÉRARD,
2013). O diagnóstico de queimadura é facilmente excluído com base na anamnese (OLIVEIRA;
SANCHES; SELORES, 2011).
A pustulose exantemática aguda generalizada (PEAG) enquadra-se, tal como a SSJ e
a NET, nas reações adversas a fármacos graves, associadas a mecanismos imunológicos de
hipersensibilidade retardada. O início da reação cutânea depois da toma do fármaco é muito
mais precoce relativamente ao que acontece na SSJ/NET e DRESS. É caracterizada pelo
aparecimento de múltiplas pústulas milimétricas e não foliculares sobre base eritematosa, com
início frequente nas regiões intertriginosas do pescoço, virilhas e axilas e que posteriormente
se tornam mais disseminadas evoluindo para descamação em grandes retalhos. Associa-se
muito frequentemente a febre (39-40ºC) e a leucocitose (neutrofilia com ou sem eosinofilia
ligeira) (PIRMOHAMED, 2011). O sinal de Nikolsky pode ser positivo. O atingimento das
mucosas não é frequente, ocorrendo em cerca de 20% dos casos. A histologia é
caracteristicamente diferente da observada na SSJ e na NET, na medida em que se observam
pústulas intraepidérmicas e subcórneas e um infiltrado dérmico rico em PMN, assim como
ausência de necrose dos queratinócitos (OLIVEIRA; SANCHES; SELORES, 2011). A reação
cutânea é clínica e histopatologicamente idêntica à psoríase pustulosa. Os testes epicutâneos
identificam o fármaco responsável pela reação cutânea em cerca de 50% dos casos
(PIRMOHAMED, 2011). A PEAG associa-se a menor morbimortalidade relativamente à SSJ
37
e NET pelo facto de constituir uma reação cutânea mais superficial e o envolvimento das
mucosas estar raramente associado (TREAT, 2012).
A Síndrome DRESS, reação cutânea com eosinofilia e sintomas sistêmicos, é também
conhecida por múltiplas designações, como síndrome de hipersensibilidade a fármacos,
síndrome da sulfona, síndrome dos anticonvulsivantes, síndrome mononucleose like, entre
outros. Os doentes tipicamente apresentam um exantema máculo-papuloso acompanhado de
febre, edema facial, linfadenopatia e por vezes hepatoesplenomegalia. O exantema inicial pode
evoluir para um rash eritematoso e dermatite esfoliativa. As alterações hematológicas incluem
eosinofilia e linfocitose atípica. O envolvimento sistêmico tipicamente manifesta-se por
hepatite, nefrite, pneumonite intersticial ou miocardite (BOUVRESSE, 2012). A Síndrome
DRESS tipicamente é causada por fármacos iniciados 2-6 semanas antes da erupção cutânea,
ou mais cedo. Recentemente, o vírus herpes humano 6 (HHV-6) tem sido imputado como
possível agente etiológico. Não se sabe se o vírus constitui efetivamente uma causa ou é apenas
reativado no decurso da doença (TREAT, 2012). A análise histopatológica não é específica
(DIAZ; CIUREA, 2012). Bouvresse et al (2012) analisaram casos das diferentes toxidermias
graves (SSJ/NET, PEAG e DRESS) e, apesar de algumas ambiguidades que possam existir no
diagnóstico das diferentes toxidermias nomeadamente nos estadios iniciais da doença, os casos
confirmados de sobreposição são raros. Os casos de sobreposição, ou fenótipos intermédios,
são definidos como situações que preenchem os critérios de diagnóstico definitivo ou provável
de pelo menos duas toxidermias graves. Apesar disto as SSJ/NET, PEAG e DRESS são
entidades distintas e não há evidência da existência de um espectro patológico entre elas.
4.9 TRATAMENTO
Tendo em conta que os fármacos constituem a principal causa destas patologias, a
primeira medida a implementar será a suspensão do fármaco implicado, embora nem sempre
seja fácil atribuir imputabilidade a um fármaco, nomeadamente em doentes polimedicados
(GARCIA-DOVAL et al., 2000). Assim, quando o fármaco responsável é desconhecido, todos
os fármacos não essenciais à manutenção da vida do doente devem ser suspensos.
Os doentes com grandes áreas de pele erosionadas e atingimento das mucosas devem
ser considerados grandes queimados e tratados em Unidades de Queimados ou Unidades de
Cuidados Intensivos. A manutenção da temperatura corporal, a minimização das perdas de
fluido transdérmicas e a prevenção da sobreinfecção secundária são primordiais e estes doentes
38
devem ser cuidadosamente monitorizados nesse sentido. O tratamento de suporte é semelhante
ao realizado nos doentes submetidos a queimaduras extensas e inclui a manutenção da via aérea,
a reposição de fluidos e eletrólitos, a minimização das queixas álgicas, a prevenção de infecção
secundária com roupa e lençóis esterilizados e o controle da temperatura ambiental
(ROUJEAU; STRN, 1994). Os banhos devem ser curtos, usando água tépida e prescindindo do
uso de agentes de limpeza. A alimentação deve ser realizada parentericamente apenas quando
há lesões extensas e dolorosas da mucosa oral e esofágica que impeçam a nutrição por via oral,
que deve ser retomada logo que possível (BULISANI et al, 2016; LISSIA et al, 2009). A
prevenção de úlcera de stress com inibidor da bomba de prótons é altamente recomendável
assim como a prevenção primária de eventos trombóticos.
O uso profilático de antibióticos não é recomendado devido à indução de resistências
(HARR; FRENCH, 2010). A antibioticoterapia deve ser instituída apenas quando há suspeita
de infecção bacteriana. Apesar de na literatura existirem vários casos de SSJ e NET tratados
com sucesso com corticoterapia oral, imunossupressores (ciclosporina, ciclofosfamida),
agentes anti-TNF, plasmaférese e imunoglobulinas IV, ainda não existe um tratamento
consensual para estas patologias. O estudo retrospectivo de 513 doentes levado a cabo por
Schneck et al (2008) mostrou que não há evidência de que qualquer tratamento farmacológico
beneficie estes doentes.
Os corticóides foram durante muito tempo considerados como o tratamento de eleição
para estes casos. Hoje em dia o seu uso é controverso (LISSIA et al, 2009; GHISLAIN;
ROUJEAU, 2002), nomeadamente após as primeiras 48 horas, na medida em que compromete
a cicatrização e contribui para um estado de imunossupressão que facilita a infecção bacteriana
secundária.
Apesar de alguns relatos do uso com sucesso dos imunossupressores, a sua utilidade
não está bem definida e o seu uso não é considerado como standard para o tratamento destas
patologias. O infliximab tem sido também utilizado em alguns destes doentes com benefício
(HUNGER et al, 2005; FISCHER et al, 2002), embora não existam ainda estudos randomizados
que provem a sua utilidade.
A plasmaférese tem mostrado, em alguns doentes, ser uma intervenção segura e eficaz,
contribuindo para a redução da mortalidade (EGAN et al, 1999). Há, no entanto, relatos de
séries de doentes não respondedores, deixando em aberto a verdadeira utilidade deste método
(EGAN et al., 1999). Desconhece-se se o seu benefício terapêutico se deve à remoção sérica
39
dos agentes que medeiam a inflamação ou a uma depuração mais rápida do fármaco responsável
pela dermatose (LISSIA et al., 2009).
As imunoglobulinas IV constituem atualmente o fármaco mais consensual para o
tratamento destes doentes. Atuam ao nível do receptor Fas e do seu ligando (Fas-L),
responsáveis pela apoptose dos queratinócitos, intervindo, assim, na patogênese da SSJ e da
NET. Reduzem a mortalidade em cerca de 12% dos casos, impedem a progressão da necrose
epidérmica e aceleram a reepitelização (PAQUET et al., 2001). A dose e a duração do
tratamento não estão ainda bem definidas, variando entre 1,6g/kg/dia, 3g/kg/dia e 5g/kg/dia,
com duração variável entre três e cinco dias (LISSIA et al., 2009; PAQUET et al., 2001; PRINS
et al., 2003). Há ainda quem defenda o seu uso associado a bólus de metilprednisolona nas
primeiras 48h (VIARD et al., 1998) ou em associação com a plasmaférese. Esta última
associação é bastante promissora, na medida em que parece contribuir para a redução da
mortalidade (LISSIA; FIGUS; RUBINO, 2005).
4.10 PROGNÓSTICO
A mortalidade é cerca de 10% para os doentes com SSJ, aproximadamente 30 % para
os doentes com síndrome de sobreposição SSJ e NET e cerca de 50% para os doentes com NET.
Em conjunto a taxa de mortalidade é cerca de 25% para estas toxidermias, sendo que a taxa de
mortalidade a curto prazo é de 22% (HADDAD et al, 2013). As taxas de mortalidade nas
crianças são inferiores às verificadas nos adultos (KOH; TAY, 2009; FINKELSTEIN et al,
2011). Estima-se que a SSJ/NET é responsável por cerca de 200 mortes por ano na Comunidade
Europeia (HADDAD et al, 2013). A sepse constitui a principal causa de morte na NET, sendo
responsável por mais de 50% dos casos fatais (CABRAL et al, 2004).
Como já referido, o prognóstico, bem como a severidade da doença, é calculado
através da aplicação do SCORTEN no 1º e 3º dias de internamento. Esta escala de gravidade
mostrou correlação com a mortalidade geralmente observada nesta patologia. Quanto mais
elevado o valor do score, pior é o prognóstico. Outros sistemas de cálculo de score têm sido
propostos, mas o SCORTEN é atualmente o mais consensual e mais utilizado (HARR;
FRENCH, 2010).
A suspensão imediata do fármaco suspeito é a principal medida a tomar. Estima-se
uma diminuição da mortalidade em cerca de 30% por cada dia a menos de toma de fármaco,
sobretudo nos fármacos de meia vida curta. Assim, o diagnóstico precoce, a identificação
40
correta e eliminação do(s) fármacos responsáveis e a instituição atempada de medidas
terapêuticas são fundamentais (DUARTE et al, 2010).
A neutropenia associa-se a pior prognóstico em doentes com NET, pois além de haver
uma quebra na resposta antimicrobiana, os neutrófilos ativados são responsáveis pela expressão
de genes que influenciam a reparação da epiderme. Ang e Tay (2011) sugerem que a
administração de fator estimulador das colônias de granulócitos (G-CSF) em doentes com
neutropenia febril no decurso da NET acelera a reepitelização pelo aumento de neutrófilos, mas
também pela mobilização de células estaminais da medula óssea para repovoamento e
regeneração da epiderme.
Mais recentemente, o nível de bicarbonato sérico (presente no SCORTEN) foi
identificado como um dos marcadores de prognóstico mais importante em doentes com NET.
Um estudo revelou uma taxa de mortalidade 40 vezes superior para os doentes com bicarbonato
sérico inferior a 20 mmol/L (SCHWARTZ; MCDONOUGH; LEE, 2013).
Comumente, existem uma série de fatores clínicos e laboratoriais habitualmente
associados a um pior prognóstico nos doentes com SSJ/NET. Entre os primeiros, o atingimento
de áreas cutâneas extensas, idade acima de 40 anos, presença de comorbidades múltiplas,
incluindo patologia maligna, mas também síndrome metabólica e/ou gota, (FIROZ et al, 2012)
bem como um mau estado geral prévio, doentes polimedicados e, ainda, um tempo de
reepitelização alargado das zonas afetadas (mais de nove dias). Das provas laboratoriais, a que
está mais consistentemente associada a mortalidade é a neutropenia persistente e a diminuição
dos valores de bicarbonato. Também associa-se a maior morbimortalidade o atraso (mais de 48
horas) na transferência destes doentes para uma UCI ou Unidade de Queimados, nos casos que
assim o exigem (CABRAL et al, 2004). Um score entre 3-6 calculado através do SCORTEN e
um atraso superior a 5 dias antes da admissão numa UCI ou Unidade de Queimados foram
identificados como preditores independentes de mortalidade (SCHWARTZ; MCDONOUGH;
LEE, 2013).
Os doentes que sofreram uma toxidermia grave, têm um risco acrescido de recorrência,
quer com o indutor inicial, quer com fármacos da mesma família que apresentam reação
cruzada. De igual modo, os familiares de doentes com SSJ ou NET devem ser alertados para o
risco de toxidermia com os mesmos fármacos, pois parece existir uma predisposição genética,
que se reflete, sobretudo, em familiares de primeiro grau (DUARTE et al, 2010).
41
5 METODOLOGIA
5.1 TIPO DE PESQUISA
Trata-se de pesquisa exploratória, delineada pelo estudo de caso da síndrome de
Stevens-Johnson e necrólise epidérmica tóxica, fundamentada pela revisão bibliográfica sobre
a temática.
Para a organização teórica, foi utilizada a revisão crítica da literatura, “conhecida como
estudos de revisão passiva [...], nos quais os autores resumem, analisam e sintetizam as
informações disponibilizadas na literatura, mas não seguem necessariamente uma metodologia
pré-definida” (MANCINI; SAMPAIO, p. 0). Esse tipo de investigação apresenta a vantagem
de cobrir uma variedade de fenômenos em um nível mais amplo do que aquele que poderia
ocorrer em um cenário de pesquisa direta, realizada pelo pesquisador (GIL, 2002). Além disso,
foi desenvolvida com base em material já elaborado, constituído principalmente de livros e
artigos científicos sobre o tema.
Quanto ao tipo de pesquisa, optou-se pela investigação etiológica e etiopatogênica, por
meio do estudo de caso, que corresponde à descrição de aspectos que remontam ao interesse de
um único paciente, mediante dados da história e antecendentes pré-mórbidos, dados do exame
físico, evolução, resultados dos exames complementares e terapêutica (CAMPANA, 1999).
Dessa forma, mediante esse delineamento, buscou-se explorar uma situação da vida
real, com a preservação do caráter unitário do objeto estudado, com a situação do contexto em
que foi realizada a investigação; formulando hipóteses e explicando as variáveis causais de
determinado fenômeno em circunstâncias que não possibilitavam levantamentos e
experimentos (GIL, 2002).
5.2 LOCAL DO ESTUDO
O estudo foi desenvolvido no Hospital Geral de Roraima (HGR), localizado na Avenida
Brigadeiro Eduardo Gomes, 1364 - Aeroporto, Boa Vista – RR.
42
5.3 MÉTODO
5.3.1 Revisão de Prontuário
Realizou-se uma revisão de prontuário para elaboração do relato de caso. O prontuário
não precisou ser resgatado no Serviço de Arquivo Médico e Estatística (SAME) do Hospital
Geral de Roraima, pois o acompanhamos durante todo o período de internação.
5.3.2 Pesquisa Bibliográfica
Realizou-se uma pesquisa bibliográfica da literatura nacional e internacional,
abrangendo relatos de caso, estudos de casos e artigos originais escritos nas línguas inglesa,
portuguesa e espanhola.
5.3.3 Critérios de Inclusão e Exclusão
Os critérios utilizados durante a seleção bibliográfica foram: relevância, atualidade,
publicação em revistas conhecidas e confiáveis. Foram descartados, após a leitura, os artigos
que não apresentarem metodologia adequada ou não abordarem a área de interesse.
5.4 MATERIAL E FONTE DE COLETA DE DADOS
Para a revisão de Literatura, foram realizadas buscas nas seguintes bases de dados:
MEDLINE®, PubMed®, LILACS®, Scientific Electronic Library Online (SCIELO®),
Biblioteca Digital Brasileira de Teses e Dissertações (BDBTD), além de livros sobre o tema.
Ao término da pesquisa em cada base, os artigos publicados em língua inglesa, e portuguesa
foram selecionados, lidos, submetidos ao fichamento e à organização lógica do assunto, com
posterior redação do texto.
Devido aos problemas de indexação nas bases de dados bibliográficas, optou-se pela
busca por termos livres, sem o uso de vocabulário controlado (descritores), uma vez que com
essa estratégia, houve uma recuperação maior de referências, garantindo o encontro da maioria
de investigações publicadas dentro dos critérios de inclusão pré-estabelecidos.
43
Durante a fase de levantamento de dados, foram utilizadas informações a partir do
prontuário do paciente. Nesse contexto, os dados foram coletados mediante os documentos de
assistência em saúde hospitalar.
5.5 CRITÉRIOS E PROCEDIMENTOS DE ANÁLISE DOS DADOS
Após a coleta de dados no Serviço de Arquivo Médico e Estatística (SAME) do
Hospital Geral de Roraima, as informações obtidas, mediante a revisão de prontuário sobre a
admissão hospitalar, história clínica, exame físico, dados laboratoriais e microbiológicos,
exames de imagem, biópsias, terapêutica, complicações e condições de alta hospitalar, foram
analisadas predominantemente segundo a natureza qualitativa, preservando-se a totalidade da
unidade social. Ademais, a pesquisadora realizou a organização do prontuário, segundo a
evolução histórica do paciente, desde a data de admissão até a de sua alta, para que a narrativa
científica fosse fiel à propedêutica realizada até o desfecho do caso.
5.6 FORMAS DE APRESENTAÇÃO DOS RESULTADOS
“Considerando que o estudo de caso é um delineamento mais flexível que os demais,
é natural que a elaboração do relatório possa ser caracterizada por um grau de formalidade
menor que o requerido em relação a outras pesquisas” (GIL, 2002, p. 142). Assim, o relatório
referente ao estudo constituído de um único caso foi elaborado sob a forma de relato científico
com os seguintes itens: anamnese (identificação, queixa principal, história da moléstia atual,
história patológica pregressa, hábitos de vida, história epidemiológica e profissional), exame
físico, exames de imagem (radiografia, tomografia computadorizada), exames laboratoriais e
microbiológicos, diagnóstico, terapêutica, complicações, além da condição de alta hospitalar,
obtendo-se a ordem cronológica da conduta e a manutenção coerente e verossímil do caso.
5.7 ASPECTOS ÉTICOS
Este estudo foi submetido ao Comitê de Ética em Pesquisa (CEP) da Universidade
Federal de Roraima e à Comissão de Pesquisa Científica do Hospital Geral de Roraima,
44
mediante Carta de Anuência para Autorização de Pesquisa, a fim de que possa ser realizado
com o prontuário do sujeito da investigação. Além disso, a pesquisadora anexou o Termo de
Compromisso para Utilização de Dados de Prontuários Médicos, a fim de que as informações
coletadas sejam utilizadas exclusivamente para o propósito científico.
5.7.1 Análise crítica de desconfortos e riscos previsíveis
A coleta de dados foi realizada em prontuário do Serviço de Arquivo Médico e
Estatística do HGR. Nestes termos, a pesquisa implicou em risco mínimo para o participante e,
por se tratar de estudo retrospectivo, não foram realizadas intervenções ou modificações
intencionais nas variáveis fisiológicas, psicológicas ou sociais do sujeito da investigação.
Portanto, apesar de haver o risco de que informações coletadas em prontuário, tais como
anamnese, dados clínicos, exames de imagem e laboratoriais, fossem divulgadas meramente
para fins científicos, a garantia do anonimato das informações, sem a identificação do
participante, como medida de proteção ou minimização dos riscos foi mantida.
5.7.2 Análise crítica de benefícios esperados
Os benefícios do estudo foram a maior compreensão da síndrome de Stevens-Johnson
e necrólise epidérmica tóxica em paciente jovem, especialmente no estado de Roraima, na
construção de hipóteses e reflexões sobre os fatores etiopatogênicos e epidemiológicos,
determinantes para o surgimento dessa emergência dermatológica. Além disso, o melhor
entendimento sobre o tratamento da doença, as possibilidades terapêuticas disponíveis e o
levantamento de discussões futuras, para suscitar novos trabalhos versando sobre a mesma
temática.
5.7.3 Monitoramento da coleta de dados e proteção à confidencialidade
Para a realização da coleta de dados, foi solicitada dispensa da utilização do Termo de
Consentimento Livre Esclarecido (TCLE), tendo em vista que a pesquisa utilizou somente
45
dados secundários, obtidos a partir do estudo de material já coletado para fins diagnósticos e da
revisão de prontuário, com as informações referentes ao paciente. Nestes termos, todas as
diretrizes e normas reguladoras descritas na Resolução CNS 466-12/dezembro /2012, foram
cumpridas.
Com o intuito de manter a privacidade e a proteção à confidencialidade, foi mantido o
anonimato do sujeito, cujas informações obtidas a partir dos documentos hospitalares, foram
mantidas em sigilo na utilização de dados do paciente.
5.8 NORMAS ADOTADAS
Este trabalho foi realizado segundo as normas da Associação Brasileira de Normas
Técnicas (ABNT) para apresentação de manuscritos.
46
6 RELATO DE CASO
R. D, masculino, 24 anos, pardo, solteiro, natural e procedente de Santa Elena –
Venezuela, foi admitido no Hospital Geral de Roraima (HGR), município de Boa Vista, com
quadro de lesões cutâneas com eritema violáceo confluente e bolhas disseminadas pelo tronco,
extremidades inferiores e superiores, face (exceto couro cabeludo) e lesões vesículo-bolhosas
ulcerativas na cavidade bucal, especialmente lábios, com acometimento ocular bilateral e
genitália externa (fotografia 1), associados a dor intensa generalizada, febre (T=40,3ºC),
dificuldade para verbalizar, deglutir e manter o decúbito dorsal.
Fotografia 1
Lesões cutâneas eritemato-bolhosas em tronco, membros inferiores e superiores; lesões vesículo-bolhosas
ulcerativas na cavidade bucal e acometimento ocular bilateral, no primeiro dia de internação no HGR.
Fonte: Retirada pela autora (2016).
Negou tabagismo, etilismo e procedimentos cirúrgicos pregressos. Relato de
esquizofrenia há 1 ano, sendo tratado com lamotrigina e há 15 dias estava fazendo uso de
carbamazepina. Sem outras comorbidades.
47
Quanto ao histórico de exposição ocupacional, relatou nunca ter trabalhado, ocupa-se
com os afazeres do lar. Quanto ao histórico familiar pais hígidos e não soube informar sobre os
avós.
Reside em casa de alvenaria, 3 cômodos, com água encanada, porém, não filtrada; sem
animais domésticos no peridomicílio. Grupo familiar composto pelos pais e um irmão, com
renda familiar de um salário mínimo.
Ao exame físico apresentava-se em ruim estado geral, eutrófico, lúcido e orientado,
hipocorado (+/4), hidratado, eupneico, anictérico, acianótico. Aparelho respiratório:
expansibilidade torácica simétrica, murmúrio vesicular presente bilateralmente, sem ruídos
adventícios, FR = 20 irpm e SaO2 = 99% em ar ambiente. À ausculta cardíaca, bulhas
normorrítmicas e normofonéticas em dois tempos, sem sopros, FC = 72 bpm. Abdômen plano,
normotimpânico, flácido, indolor à palpação, sem visceromegalias e ruídos hidroaéreos
presentes. No exame das extremidades, boa perfusão periférica (< 2 segundos), pulsos amplos
e cheios, sem edema. Pele apresentando lesões cutâneas com eritema violáceo confluente e
bolhas disseminadas pelo tronco, extremidades inferiores e superiores, face (exceto couro
cabeludo) e lesões vesículo-bolhosas ulcerativas na cavidade bucal, especialmente nos lábios,
acometimento ocular bilateral e genitália externa.
Na admissão do setor de emergência (GT/área amarela), recebeu o atendimento inicial
com analgesia, alimentação via sonda nasogástrica (SNG), diurese por sonda vesical de demora
(SVD) e iniciada investigação diagnóstica e laboratorial: hemograma sem leucocitose, anemia
ou plaquetopenia. Escórias nitrogenadas normais, transaminases pouco elevadas (TGO 107 e
TGP 140), VDRL e HIV não reagentes. Sorologias (teste rápido) para hepatites B e C não
reagentes e para TORCHES, em andamento. Nas hemoculturas não houve crescimento
microbiano.
Ressaltamos que o paciente apresentou sinal de Nikolski positivo e envolvimento
cutâneo superior a 30% da superfície corporal (fotografia 2), sugestivo para a hipótese de
Necrólise Epidérmica Toxica (NET). Evoluiu com descamação das lesões (fotografia 3) e
evidência de solução de continuidade importante pelo corpo.
48
Fotografia 2
Lesões cutâneas crostosas em face, conjuntivite e envolvimento cutâneo superior a 30% da superfície corporal,
sugestivo de NET, no décimo dia de internação no HGR.
Fonte: Retirada pela autora (2016).
Fotografia 3
Lesões cutâneas descamativas, no vigésimo sexto dia de internação no HGR.
Fonte: Retirada pela autora (2016).
49
Durante o período de internação e, antes da confirmação etiológica do quadro, foram
utilizados os seguintes antibióticos: Cefalotina (na admissão) e posteriormente teicoplanina,
Cefepime, Ceftazidima, e Meropenem. Devido a cultura em ponta de cateter ter crescido
Klebsiella pneumoniae e Acinetobacter baumanni foi acrescentado o Meropenem. Devido ao
quadro de conjuntivite, usou vigadexa colírio (cloridrato de moxifloxacino + fosfato dissódico
de dexametasona), juntamente com o epitezan pomada (acetato de retinol + aminoácidos +
metionina + clorafenicol), sob orientação do oftalmologista. Também usou haldol e
clonazepam, após avaliação do psiquiatra.
Visando à diagnose específica, no 1º dia de internação, o paciente foi submetido à
biópsia de lesão cutânea da região coxofemoral esquerda e o histopatológico evidenciou: pele
apresentando discreto exsudato linfocítico ao redor do plexo vascular superficial e na junção
dermo-epidérmica com exocitose intraepidérmica relacionada a necrose confluente de toda a
espessura da epiderme e, nas áreas ainda viáveis, a intensa apoptose de queratinócitos, o que
caracteriza Necrólise Epidérmica Tóxica (síndrome de Lyell) (fotografia 4). O raio-x de tórax
da internação sem alteração parenquimatosa (fotografia 5).
Fotografia 4. Biópsia de lesão cutânea da região coxofemoral esquerda.
Pele apresentando discreto exsudato linfocítico ao redor do plexo vascular superficial e na junção dermoepidérmica com exocitose intraepidérmica relacionada a necrose confluente de toda a espessura da epiderme e,
nas áreas ainda viáveis, a intensa apoptose de queratinócitos, o que caracteriza Necrólise Epidérmica Tóxica
(síndrome de Lyell).
Fonte: Retirada pela autora (2016).
50
Fotografia 5. Raio-X de tórax
Imagem sem alteração parenquimatosa, no sexto dia de internação no HGR.
Fonte: SAME 2016. Retirada pela autora.
De imediato, realizou-se a interrupção da utilização da carbamazepina, que foi
considerado o provável causador da enfermidade. Para as lesões cutâneas, foi utilizado o
curativo diário somente com água destilada.
Permaneceu internado por 30 dias. Evoluiu com melhora das lesões cutaneomucosas,
reepitelização das regiões corporais afetadas e sem complicações oftalmológicas. No entanto,
segue com máculas residuais de distribuição difusa (fotografia 6), em zona de pele integra e
não afetada pela NET.
51
Figura 6
Lesões maculares de distribuição difusa, no trigésimo dia de internação no HGR (alta hospitalar).
Fonte: Retirada pela autora (2016).
52
7 DISCUSSÃO
A síndrome de Stevens-Johnson e a NET correspondem a diferentes níveis de
gravidade de um mesmo processo fisiopatológico, no qual há intensa apoptose dos
queratinócitos, clivagem subepidérmica e destacamento da epiderme, provocando a formação
de bolhas e de erosões, além de ulcerações nas mucosas conjuntivais, oral, nasal e genital
(AUQUIER-DUNANT, 2002).
Por definição, na síndrome de Stevens-Johnson, o acometimento não ultrapassa 10%
da superfície corpórea e as lesões são máculas purpúricas ou em formato de alvo plano,
enquanto na NET, há mais de 30% da superfície corpórea afetada. Os casos com
comprometimento cutâneo entre 10% e 30% da superfície corporal são considerados como
quadros de superposição entre síndrome de Stevens-Johnson e NET (BASTUJI-GARIN, 1993).
Nesse estudo, houve acometimento da pele em mais de 30% da superfície corporal, fato que
nos faz pensar em NET.
A incidência anual de NET é estimada em 0,4 a 1,9 casos por milhão de habitantes ao
redor do mundo (LISSIA et al, 2010; RZANY et al, 1999; LA GRENADE et al, 2005), já a de
Stevens-Johnson, em 1,2 a 6 casos por milhão (FRENCH; PRINS, 2003). A distribuição entre
os gêneros é semelhante em crianças, enquanto em adultos, as mulheres são mais afetadas
(aproximadamente 3 mulheres para cada 2 homens). A incidência de ambas as doenças é 1.000
vezes maior em portadores de HIV, passando para 1 caso a cada 1.000 portadores
(MITTMANN et al, 2012). Essa incidência superior parece estar relacionado ao uso de drogas
antirretrovirais (SAKA et al, 2013). Notou-se que, neste relato, o paciente não é portador do
vírus HIV e pertence ao gênero masculino, o que é menos frequente, conforme as citações dos
autores acima.
A ocorrência da SSJ é extremamente rara, ocorre em todas as idades, em todas as raças
e gêneros com incidência de 0,4-1,2 casos por milhão de pessoas/ano (ROUJEAL; STERN,
1994), ou, ainda, há relatos de 1,2-6 casos por milhão de pessoas/ano (WOLKENSTEIN;
REVUZ, 1995). O pico de ocorrência, segundo Neville et al (2009) é durante a segunda e a
terceira década de vida (BASTUJI-GARIN, 1993), convergindo com o caso descrito.
Embora a NET já tenha sido relatada após vacina tríplice viral (FRITSCH;
SIDOROFF, 2000), infecção por Mycoplasma pneumoniae (FOURNIER, 1995), dengue
(GRIEB, 2010), citomegalovírus (KHALAF, 2011) e após a administração de contraste
53
(BALDWIN, 2010), 80 a 95% dos casos são desencadeados por hipersensibilidade a drogas. O
grupo europeu de estudo das reações cutâneas adversas graves classificou algumas drogas como
sendo de alto risco para o desenvolvimento de NET, tais como: nevirapina, lamotrigina,
carbamazepina, fenitoína, fenobarbital, sulfonamidas, sulfasalazina, alopurinol, e antiinflamatórios não esteroidais do tipo oxicam (MOCKENHAUPT, 2008).
Embora a etiopatogenia seja incerta e provavelmente é um processo mediado
imunologicamente, uma das causas seja a exposição a drogas e medicamentos (NEVILLE et al,
2009), ratificando com o trabalho de Brinca et al (2011), no qual, afirmam que os principais
fármacos desencadeantes da SSJ e NET, são: o alopurinol, os antibióticos, anticonvulsivantes,
os anti-inflamatórios esteroidais e não-esteroidais, nevirapina, analgésicos opióides, a
trastuzumab e a sulfassalazina. O paciente em questão fazia uso de: carbamazepina, o que
corrobora as citações dos autores acima.
A NET é mediada principalmente por linfócitos TCD8+, encontrados no líquido das
bolhas e na superfície da derme, os quais, juntamente com os linfócitos natural killer, são os
responsáveis pela indução da apoptose dos queratinócitos, via interação Fas-FasL (NASSIF,
2004). Há duas teorias que buscam explicar o ainda incerto mecanismo de ativação das células
T: a teoria da interação farmacológica das drogas com o sistema imune e a do pró-hapteno. A
primeira propõe que a droga pode ativar o sistema imune se ligando diretamente ao receptor do
complexo principal de histocompatibilidade do tipo 1 (MHC I). Já a do pró-hapteno sugere que
os metabólitos das drogas se ligam covalentemente a peptídeos celulares, criando moléculas
imunogênicas (SCHWARTZ; MCDONOUGH; LEE, 2013).
Alguns fenótipos do MHC são associados a um maior risco para o desenvolvimento
de NET, tais como o alelo HLA-B*1502, que predispõe a reações adversas a fármacos
anticonvulsivantes, como a carbamazepina (HUNG, 2010), sugerindo que alótipos como esse
estão envolvidos na patogênese da doença (YANG, 2007). Fato que pode explicar a reação
farmacodérmica do paciente à carbamazepina.
A hipótese diagnóstica de NET se confirma com achados clínicos e histopatológicos.
Sintomas prodrômicos de tosse, coriza, febre, anorexia e mal-estar generalizado precedem as
manifestações mucocutâneas (DOWNEY, 2012). Os principais achados ao exame
dermatológico incluem eritema, máculas eritemato-violáceas, um exantema inicialmente
inespecífico, o qual rapidamente adquire a tonalidade violácea, formação de bolhas flácidas de
conteúdo sero-hemorrágico, e destacamento epidérmico, inicialmente na face e tronco e com
progressão simétrica para as extremidades (GARDEZI, 2013). Como no presente caso clínico,
54
o envolvimento das mucosas oral, ocular e/ou genital é frequente. As erosões mucocutâneas
têm forma e tamanho irregulares e são dolorosas (SCHWARTZ; MCDONOUGH; LEE, 2013).
Os sinais de Nikolsy e Asboe-Hansen são positivos (FRENCH; PRINS, 2003).
Na SSJ o descolamento epidérmico é inferior a 10% da área de superfície corporal,
enquanto que na NET o descolamento epidérmico atinge pelo menos 30% da área de superfície
corporal, configurando uma situação mais severa. Entre estes dois limites são consideradas
formas intermediárias ou síndrome de sobreposição SSJ e NET (CASTELAIN; HUMBERT,
2012). As características como sintomas prodrômicos, máculas eritemato-violáceas que
rapidamente adquire a tonalidade violácea, formação de bolhas flácidas de conteúdo serohemorrágico, e descolamento epidérmico maior que 30% da superfície corporal, condizem com
o caso clínico, pois o paciente diagnosticado com NET, teve febre, anorexia, mal-estar
generalizado, lesões cutâneas típicas com eritema violáceo confluente e bolhas disseminadas
pelo tronco, extremidades inferiores e superiores, face (exceto couro cabeludo) e lesões
vesículo-bolhosas ulcerativas na cavidade bucal, especialmente lábios superiores e inferiores,
com acometimento ocular bilateral e genitália externa.
As mucosas internas, tais como as dos tratos digestivo, respiratório e urinário também
são afetadas, produzindo diarreia, dor abdominal, lesão hepática, síndrome da angústia
respiratória do adulto, hipoxemia, insuficiência renal aguda, anemia, hipovolemia, miocardite
e choque (SCHWARTZ; MCDONOUGH; LEE, 2013). Fato não evidenciado no presente
estudo.
A gravidade do quadro, seu prognóstico e o risco de morte do paciente acometido
podem ser determinados pelo escore denominado Severity Illness Score for Toxic Epidermal
Necrolysis (SCORTEN) (BASTUJI-GARIN, 2000) (Tabela 2), o qual atribui 1 ponto para cada
uma das suas 7 variáveis: (1) idade maior que 40 anos; (2) frequência cardíaca maior que 120
bpm; (3) malignidade concomitante; (4) destacamento de mais de 10% da superfície corpórea
no primeiro dia; (5) concentração de ureia maior que 28 mg/dl; (6) glicose sérica maior que 252
mg/dl; e (7) concentração de bicarbonato menor que 20 mg/dl. Ao analisar a taxa de mortalidade
conforme os critérios de SCORTEN, esta foi de 12,1%. Pontuou-se o destacamento de mais de
10% da superfície corpórea no primeiro dia e a concentração de ureia maior que 28mg/dL.
As sequelas mais comuns da NET são lesões oculares (MAGINA et al, 2003),
incluindo a síndrome do olho seco, fotofobia, e sensação de corpo estranho no olho. Outras
complicações correspondem a cicatrizes cutâneas; nevos melanocíticos eruptivos (GOERZ;
TSAMBAOS, 1978); estenose vulvovaginal (MENEUX, 1997) com subsequente dispareunia;
55
despigmentação ou hiperpigmentação cutânea (SEKULA, 2013); xerostomia; fimose (REVUZ,
1987); bronquiectasia, bronquite, bronquiolite obliterante, obstrução do trato respiratório,
estenose esofágica e fibrose oral grave (KIM, 2005). Nenhuma sequela foi observada no caso
descrito.
A análise histopatológica é característica da doença, e corresponde a necrose de toda
a espessura da epiderme, clivagem subepidérmica, e um escasso infiltrado inflamatório na
junção dermo-epidérmica, composto
predominantemente por linfócitos
(GERSON;
SRIGANESHAN; ALEXIS, 2008). Na fase inicial, há grande semelhança histológica entre
NET e eritema multiforme major (SCHWARTZ; MCDONOUGH; LEE, 2013). Evidenciou-se
no histopatológico do paciente relatado, pele com discreto exudato linfocítico ao redor do plexo
vascular superficial e na junção dermo-epidérmica com exocitose intraepidérmica relacionada
a necrose confluente de toda a espessura da epiderme e, nas áreas ainda viáveis, a intensa
apoptose de queratinócitos, o que caracteriza Necrólise Epidérmica Tóxica (síndrome de Lyell),
descrição que retifica a análise histopatológica da citação feita em 2008 pelos autores acima.
O interesse em encontrar marcadores sorológicos precoces para a detecção de NET
incentivou estudos com ligante de Fas solúvel (MURATA; ABE; SHIMIZU, 2008),
perforina/granzima B (POSADAS, 2002) e granulisina (ABE, 2009), com resultados
promissores para esta última.
O tratamento primário da NET consiste na suspensão imediata da medicação suspeita
juntamente com a transferência para UTI e medidas de suporte. A minimização do tempo entre
o início dos sintomas cutâneos e a transferência para a UTI é crucial para melhorar o potencial
de sobrevivência (SCHWARTZ; MCDONOUGH; LEE, 2013). A cobertura da pele desnuda
pode ser feita com uma membrana bilaminar sintética, a qual mostra melhores resultados em
relação ao uso de solução antisséptica e troca diária dos curativos no que diz respeito à perda
proteica, dor e retorno à movimentação (BOORBOOR et al, 2008). O uso de sulfadiazina de
prata (Silvadene®, Flammazine®), de sulfadiazina de prata em associação com nitrato de cério
(Flammacerium®) e de acetato de mafenide (Sulfamylon®) está contraindicado nestes doentes,
não só por provocarem atrasos na reepitelização, mas fundamentalmente porque as
sulfonamidas são dos principais agentes causais deste síndrome (ROUJEAU et al, 1990;
TAYLOR et al, 1989), além de terem tendência a induzir leucopenia (DOLAN et al, 1989).
Nesse contexto, no caso descrito, o paciente fez curativos diários apenas com água destilada. A
antibioticoterapia profilática não é recomendada (GHISLAIN; ROUJEAU, 2002), mas nesse
56
estudo optou-se por usar, haja vista presença de grande área cutânea exposta e período de
internação prolongada, visando prevenir infecções secundárias e consequentemente, sepse.
O uso de corticosteroides intravenosos já foi relatado como um fator de risco
independente para o aumento da mortalidade (KELEMEN et al, 1995), e também como um
fator protetor (KARDAUN; JONKMAN, 2007), benéfico principalmente quando utilizado na
forma de pulsos. Dessa forma, não há consenso quanto ao seu uso para o tratamento da NET.
A mesma incerteza ocorre quando se analisam os resultados da terapia com imunoglobulina
intravenosa, que mostra alguns benefícios, como a redução do tempo de hospitalização, mas a
redução da taxa de mortalidade não é estatisticamente significativa (YANG et al, 2009;
HUANG; LI; CHEN, 2012). A utilização de ciclosporina, entretanto, tem mostrado rápida
interrupção da progressão da doença e redução da mortalidade (VALEYRIE-ALLANORE,
2010; ARÉVALO et al, 2000; KIRCHHOF, 2014), mas ainda faltam estudos definitivos para
validar sua utilização. Outras drogas, como inibidores de fator de necrose tumoral alfa (TNFα), N-acetilcisteína e fator estimulante de colônias de granulócitos, também têm mostrado
resultados promissores, mas ainda não confirmados (SCHWARTZ; MCDONOUGH; LEE,
2013).
No caso reportado, a região ocular e genitália também foram afetadas, corroborando
com o trabalho de Vanfleteren et al. (2003), que afirmam que o quadro ocular é caracterizado
por uma conjuntivite purulenta bilateral, membranosa ou pseudomembranosa, com adesão das
pálpebras. Quando ocorre grave envolvimento ocular, podem desenvolver cicatrizes
(NEVILLE et al, 2009), fato que retifica o caso em questão. A lubrificação dos olhos associada
a antibióticos tópicos pode prevenir danos oculares (SCHWARTZ; MCDONOUGH; LEE,
2013). Então, prescreveu-se vigadexa (cloridrato de moxifloxacino + fosfato dissódico de
dexametasona) e epitezan pomada (acetato de retinol + aminoácidos + metionina + clorafenicol)
no relato descrito.
Ainda se pode observar lesões e crostas hemorrágicas evidentes no vermelhão dos
lábios e mucosa bucal, condizendo com o trabalho de Lebargy et al (1997) e Revuz et al (1987),
que afirmam que em 90% dos casos da SSJ/NET a mucosa oral, ocular e genital são atingidas.
Acrescenta-se ainda que o desenvolvimento primariamente das lesões ulcerativas seja em
mucosa bucal (NEVILLE et al, 2009) condizente com as manifestações do paciente relatado.
Trabalhos consultados relataram que a eliminação do agente causador deve ser
realizada o mais breve possível (PETER, 2006; CZUBKOWSKA, 2000). Neville et al (2009)
afirma que devemos optar por encaminhar esses pacientes à unidade de queimados a fim de
57
prevenir infecções secundárias, pois a sepse tem sido relatada como uma das principais causas
de óbito dessa doença dermatológica. O Estado de Roraima ainda não dispõe de unidade de
queimados, mas utilizou-se dos recursos necessários e disponíveis para o caso relatado.
58
8 CONSIDERAÇÕES FINAIS
Atualmente não foi identificado nenhum tratamento específico capaz de alterar a
progressão do descolamento epidérmico, entretanto, o tratamento de suporte torna-se crucial na
melhora clínica. Além disso, verifica-se que o esclarecimento da fisiopatologia poderá trazer
indicações importantes para melhor tratamento específico, e o rastreio farmacogenético de
indivíduos susceptíveis permitirá a prevenção de alguns casos de doença no futuro e,
eventualmente, utilização de agentes imunomoduladores.
A abordagem dos doentes com Síndrome de Stevens-Johnson e Necrólise Epidérmica
Tóxica NET exige diagnóstico rápido, identificação e suspensão do fármaco suspeito, avaliação
do prognóstico, terapêutica de suporte, abordagem multidisciplinar e o seguimento
ambulatorial. Assim, o reconhecimento é fundamental para uma intervenção precoce, visando
diminuir a elevada morbimortalidade.
O relato de caso mostra, que o uso de fármaco necessita ser cada vez mais pensado
enquanto agente causador de uma emergência dermatológica, diante de um paciente com lesões
cutâneas graves.
59
REFERÊNCIAS
ABE, R. et al. Granulysin as a marker for early diagnosis of the Stevens-Johnson syndrome.
Ann Intern Med., v. 151, n. 7, p. 514-515, 2009.
ALFIREVIC, A. et al. HLA-B locus in caucasian patients with carbamazepinehypersensitivity.
Pharmacogenomics., v. 7, n. 6, p. 813-818, Sep 2006.
ALFIREVIC, A. et al: Serious carbamazepine-induced hypersensitivity reactions associated
with the HSP70 gene cluster. Pharmacogenet Genomics., v. 16, n. 4, p. 287-296, Apr 2006.
ANG, C.; TAY, Y. Hematological abnormalities and the use of granulocyte-colonystimulating
factor in patients with Stevens – Johnson syndrome and toxic epidermal necrolysis.
Pharmacology and therapeutics., v. 50, n. , p. 1570-1578, 2011.
ANHALT, G. J. et al. Paraneoplastic pemphigus. An autoimune mucocutaneous disease
associated with neoplasia. N Engl J Med., v. 323, n. , p. 1729-1735, 1990.
ARDERN-JONES, M. R.; FRIEDMANN, P. S. Skin manifestations of drug allergy. British
jornal of clinical pharmacology., v. 71, n. 5, p. 672-683, 2011 May.
ARÉVALO, J. M. et al. Treatment of toxic epidermal necrolysis with cyclosporine A. J
Trauma., v. 48, n. 3, p. 473-478, 2000.
AUQUIER-DUNANT, A. et al. Correlations between clinical patterns and causes of erythema
multiforme majus, Stevens-Johnson syndrome, and toxic epidermal necrolysis: results of an
international prospective study. Arch Dermatol., v. 138, n. 8, p. 1019-1024, 2002.
BALDWIN, B. T. et al. Case of fatal toxic epidermal necrolysis due to cardiac catheterization
dye.J Drugs Dermatol., v. 9, n. 7, p. 837-840, 2010.
BALL, R. et al. Stevens-Johnson syndrome and toxic epidermal necrolysis after vaccination:
reports to the vaccine adverse event reporting system. Pediatr Infect Dis J., v. 20, n. 2, p. 219223, 2001.
60
BASTUJI-GARIN, S. et al. Clinical classification of cases of toxic epidermal necrolysis,
Stevens Johnson syndrome, and erythema multiforme. Arch Dermatol., v. 129, n. 1 , p. 92-96,
Jan 1993.
BASTUJI-GARIN, S. et al. SCORTEN: a severity-of-illness score for toxic epidermal
necrolysis. J Invest Dermatol., v. 115, n. 2 , p. 149-153, Aug 2000.
BŁASZCZYK, B. et al. Single centre 20 year survey of antiepileptic drug-induced
hypersensitivity reactions. Pharmacological reports., v. 65, n. 2, p. 399–409, Jan 2013.
BOORBOOR, P. et al. Toxic epidermal necrolysis: use of Biobrane or skin coverage reduces
pain, improves mobilization and decreases infection in elderly patients. Burns., v. 34, n. 4, p.
487-492, 2008.
BOLOGNIA J, JORIZZO JL, RAPINI RP, eds: Dermatology 2nd edition. Toronto: Mosby
2003;1:287J Bolognia, JL Jorizzo, RP Rapini, 2nd editionJ Bolognia, JL Jorizzo, RP Rapini,
2nd editionJ Bolognia, JL Jorizzo, RP Rapini, 2nd edition.
BORCHERS, A. T. et al: Stevens-Johnson syndrome and toxic epidermal necrolysis.
Autoimmun Rev., v. 7, n. 8 , p. 598-605, Sep 2008.
BOUVRESSE, S. et al. Toxic epidermal necrolysis, DRESS, AGEP: do overlap cases exist?
Orphanet journal of rare diseases., v. 7, n. 1, p. 72, 2012 Jan.
BRINCA, A. et al. Síndrome de Stevens-Johnson e necrólise epidérmica tóxica – casuística de
10 anos. Revista da SPDV., v. 69, n. 3, p. 403-411, 2011.
BULISANI, A. C. et al: Síndrome de Stevens-Johnson e necrólise epidérmica tóxica em
medicina intensiva. Rev Bras Ter Intensiva., v. 18, n. 3, p. 292-297, 2006.
CABRAL, L. et al. Necrólise epidérmica tóxica (síndrome de Lyell): uma patologia para as
unidades de queimados. Acta Médica Portuguesa., v. 17, n. , p. 129-140, 2004.
CAO, Z. et al. HLA-B*58:01 allele is associated with augmented risk for both mild and severe
cutaneous adverse reactions induced by allopurinol in Han Chinese. Pharmacogenomics., v.
13, n. 10, p. 1193-1201, 2012.
CAMPANA, A. O. Metodologia da investigação científica aplicada à área biomédica:
investigações na área médica. J. Pneumol., v. 25, n. 2, 1999, p. 84-93.
61
CASTELAIN, F.; HUMBERT, P. Toxic epidermal necrolysis. Current Drug Safety., v. 7, n.
5, p. 332–338, 2012.
CHAVE, T. A. et al. Toxic epidermal necrolysis: current evidence, practical management and
future directions. Br J Dermatol., v. 153, n. 2, p. 241-253, 2005.
CHOPRA, A. et al. Stevens-Johnson syndrome after immunization with smallpox, anthrax, and
tetanus vaccines. Mayo Clin Proc., v. 79, n. 9, p. 1193-1196, 2004.
CHUNG, W. H.; HUNG, S. I. Genetic markers and danger signals in Stevens - Johnson
syndrome and toxic epidermal necrolysis. Allergol Int., v. 59, n. 4 , p. 325-332, Dec 2010.
CHUNG, W-H.; HUNG, S-I. Recent advances in the genetics and immunology of StevensJohnson syndrome and toxic epidermal necrosis. Journal of dermatological science., v. 66, n.
3, p. 190-196, 2012 Jun.
CHUNG, W. et al. Granulysin is a key mediator for disseminated keratinocyte death in StevensJohnson syndrome and toxic epidermal necrolysis. Nature Medicine., v. 14, n. 12, p. 13431350, 2008.
COCKEY et al. Stevens Johnson syndrome resulting from whole-brain radiation and phenytoin.
Am J Clin Oncol., v. 19, n. 1, p. 32-34, 1996.
CZUBKOWSKA, I. et al. Erythema multiforme in children versus Stevens-Johnson syndrome.
WiadLek., v. 53, n. 1-2, p. 43-48, 2000.
DIAZ, L.; CIUREA, A. M. Cutaneous and systemic adverse reactions to antibiotics.
Dermatologic Therapy., v. 25, n. 4, p. 12-22, 2012.
DOLAN, P. A. et al. Toxic epidermal necrolysis. J Emerg Med., v. 7, n. 1, p. 65-69, 1989.
DOWNEY, A. et al. Toxic epidermal necrolysis: review of pathogenesis and management.
Journal of the American Academy of Dermatology., v. 66, n. 6, p. 995-1003, 2012 Jun.
DUARTE, A. F. et al. Toxidermia à carbamazepina apresentação invulgar. Acta Med Port., v.
23, n. 2, p. 267-272, 2010.
62
EGAN, C. A. et al. Plasmapheresis as na adjunct treatment in toxic epidermal necrolysis. J Am
Acad Dermatol., v. 40, n. , p. 458-461, 1999.
FERNANDO, S. L.; BROADFOOT, A. J. Prevention of severe cutaneous adverse drug
reactions:the emerging value of pharmacogenetic screening. CMAJ : Canadian Medical
Association journal., v. 182, n. 5, p. 476-480, 2010 Mar.
FINKELSTEIN, Y. et al. Recurrence and outcomes of Stevens-Johnson syndrome and toxic
epidermal necrolysis in children. Pediatrics., v. 128, n. 4, p. 723-728, 2011 Oct.
FISCHER, M. et al. Antitumor necrosis factor-alpha antibodies (Infliximab) in the treatment of
a patient with toxic epidermal necrolysis. Br J Dermatol., v. 146, n. , p. 707-709, 2002.
FIROZ, B. F. et al. Toxic epidermal necrolysis: five years of treatment experience from a burn
unit. Journal of the American Academy of Dermatology. American Academy of
Dermatology., v. 67, n. 4, p. 630-635, 2012 Oct.
FORMAN, R.; KOREN, G.; SHEAR, N. H. Erythema multiforme, Stevens-Johnson syndrome
and toxic epidermal necrolysis in children: a review of 10 years experience. Drug Saf., v. 25,
n. , p. 965-972, 2002.
FOURNIER, S. et al: Toxic epidermal necrolysis associated with Mycoplasma pneumoniae
infection. Eur J Clin Microbiol Infect Dis., v. 14, n. 6, p. 558-559, Jun 1995.
FRENCH L, PRINS C: Erythema multiforme, Stevens-Johnson syndrome and toxic epidermal
necrolysis. In: Bolognia, J. L.; Jorizzo, J. L.; Rapini, R. L. et al. Dermatology. Mosby Elsevier.,
2nd ed, p. 287-300, 2008.
FRENCH, L. E.; PRINS, C. Toxic epidermal necrolysis. In: Bolognia JL, Jorizzo JL, Rapini
RP, editors. Dermatology. Edinburgh: Mosby; 2003. p. 323-31.
FRITSCH, P. O.; SIDOROFF, A. Drug-induced Stevens-Johnson syndrome/toxic epidermal
necrolysis. Am J Clin Dermatol., v. 1, n. 6, p. 349-360, 2000.
GARCIA-DOVAL, I. et al. Toxic epidermal necrolysis and Stevens-Johnson syndrome: does
early withdrawal of causative drugs decrease the risk of death? Arch Dermatol., v. 136, n. 3,
p. 323-327, Mar 2000.
63
GARDEZI, S. A. A. et al. A clinicetiological study of Stevens-Johnson syndrome and toxic
epidermal necrolysis. Journal of Parkistan Association of Dermatologists., v. 23, n. 1, p. 513, 2013.
GERSON, D.; SRIGANESHAN, V.; ALEXIS, J. B. Cutaneous drug eruptions: a 5-year
experience. J Am Acad Dermatol., v. 59, n. 6, p.995-999, 2008.
GERULL, R.; NELLE, M.; SCHAIBLE, T. Toxic epidermal necrolysis and Stevens-Johnson
syndrome: a review. Critical Care Medicine., v. 39, n. 6, p. 1521-1532, Jun 2011.
GIL, A. C. Como elaborar projetos de pesquisa. São Paulo: Atlas. 4 ed., 2002, 175 p.
GHISLAIN, P. D.; ROUJEAU, J. C. Treatment of severe drug reactions: Stevens-Johnson
syndrome, toxic epidermal necrolysis and hypersensitivity syndrome. Dermatol Online J., v.
8, n. 1, p. 1087-1108, Jun 2002.
GOERZ, G.; TSAMBAOS, D. Eruptive nevocytic nevi after Lyell’s syndrome. Arch
Dermatol., v. 114, n. 9, p. 1400-1401, 1978.
GONÇALO, M. et al. HLA-B*58:01 is a risk factor for allopurinol-induced DRESS and
Stevens-Johnsonsyndrome/toxic epidermal necrolysis in a Portuguese population. The British
Journal of Dermatology., v. 169, n. 3, p.660-665, 2013 Sep.
GONÇALO, M.; BRUYNZEEL, D. P. Mechanisms in cutaneous drug hypersensitivity
reactions (cp 9). Wihelmk-P, Zhai H, Maibach HI (Eds). Dermatoxicology. 8th Ed. CRC Press.
Boca Raton, 2012. p. 78-92.
GRIEB, G. et al. A rare case of toxic epidermal necrolysis with unexpected Fever resulting
from dengue virus. Case Rep Dermatol., v. 2, n. 3, p. 189-194, 2010.
HADDAD, C. et al. Stevens–Johnson Syndrome/Toxic Epidermal Necrolysis: Are Drug
Dictionaries Correctly Informing Physicians Regarding the Risk? Drug Safety., v. 36, n. 8, p.
681-686, 2013 Jun.
HALEVY, S. et al: Allopurinol is the most common cause of Stevens-Johnson syndrome and
toxic epidermal necrolysis in Europe and Israel. J Am Acad Dermatol., v. 58, n. 1, p. 25-32,
Jan 2008.
64
HARR, T.; FRENCH, L. E. Toxic epidermal necrolysis and Stevens-Johnson syndrome.
Orphanet Journal of Rare Diseases., v. 5, n. 1, p. 39, Jan 2010.
HASHIZUME, H. Recent progress of elucidating the mechanisms of drug hypersensitivity.
Asia Pacific allergy., v. , n. 2, p. 203-209, 2012.
HUANG, Y. C.; LI, Y. C.; CHEN, T. J. The efficacy of intravenous immunoglobulin for the
treatment of toxic epidermal necrolysis: a systemic review and meta-analysis. Br J Dermatol.,
v. 167, n. 2, p.424-432, 2012.
HUNG, S. I. et al. Common risk allele in aromatic antiepileptic-drug induced Stevens-Johnson
syndrome and toxic epidermal necrolysis in Han Chinese. Pharmacogenomics., v. 11, n. 3, p.
349-356, 2010.
HUNGER, R. E. et al. Rapid resolution of toxic epidermal necrolysis with anti-TNF-α
treatment. J Allergy Clin Immunol., v. 116 , n. 4 , p. 923-924, 2005.
KAPLAN, I. et al. Neolpasms associated with paraneoplastic pemphigus: a review with
emphasis on non-hematologic melignancy and oral mucosasl manifestations. Oral Oncol. v.
40, n. , p. 553-562, 2004.
KARDAUN, S. H.; JONKMAN, M. F. Dexamethasone pulse therapy for Stevens-Johnson
syndrome/toxic epidermal necrolysis. Acta Derm Venereol., v. 87, n.2, p. 144-148, 2007.
KELEMEN, J. J. et al. Burn center care for patients with toxic epidermal necrolysis. J Am Coll
Surg., v. 180, n. 3, p. 273-278, 1995.
KHALAF, D. et al. Toxic epidermal necrolysis associated with severe cytomegalovirus
infection in a patient on regular hemodialysis. Mediterr J Hematol Infect Dis., v. 3, n. 1, p. ,
2011.
KIM, K. J. et al. Toxic epidermal necrolysis: analysis of clinical course and SCORTEN-based
comparison of mortality rate and treatment modalities in Korean patients. Acta Derm
Venereol., v. 85, n. 6, p. 497-502, 2005.
65
KIM, H. I. et al. Causes and treatment outcomes of Stevens-Johnson syndrome and toxic
epidermal necrolysis in 82 adult patients. The Korean Journal of Internal Medicine., v. 27,
n. 2, p. 203-210, Jun 2012.
KIM, S. H. et al: Genetic and ethnic risk factors associated with drug hypersensitivity. Curr
Opin Allergy Clin Immunol., v. 10, n. 4, p. 280-290, 2010.
KIRCHHOF, M. G. et al. Retrospective review of Stevens-Johnson syndrome/toxic epidermal
necrolysis treatment comparing intravenous immunoglobulin with cyclosporine. J Am Acad
Dermatol., v. 71, n. 5, p. 941-947, 2014.
KOH, M. J-A.; TAY, Y-K. An update on Stevens-Johnson syndrome and toxic epidermal
necrolysis in children. Current opinion in pediatrics., v. 21, n. 4, p. 505-510, Aug 2009.
LA GRENADE, L. et al. Comparison of reporting of Stevens-Johnson syndrome and toxic
epidermal necrolysis in association with selective COX-2 inhibitors. Drug Saf., v. 28, n. 10, p.
917-924, 2005.
LEBARGY, F. et al: Pulmonary complications in toxic epidermal necrolysis: a prospective
clinical study. Intensive Care Med., v. 23, n. 12, p. 1237-1244, Dec 1997.
LISSIA, M. et al. Toxic epidermal necrolysis (Lyell’s disease). Burns., v., n. , p. 1-12, 2009.
LISSIA, M. et al. Toxic epidermal necrolysis (Lyell’s disease). Burns., v. 36, n. 2, p. 152-163,
2010.
LISSIA, M.; FIGUS, A.; RUBINO, C. Intravenous immunoglobulins and plasmapheresis
combined treatment in patients with severe toxic epidermal necrolysis: preliminary report. Br
J Plast Surg., v. 58, n. 4 , p. 504-510, 2005.
LYELL, A. Toxic epidermal necrolysis: an eruption resembling scalding of the skin. Br J
Dermatol., v. 68, n. 11, p. 355-361, 1956.
MAGINA, S. et al. Dermatological and ophthalmological sequels in toxic epidermal necrolysis.
Dermatology., v. 207, n. 1, p. 33-36, 2003.
MANCINI, M. C.; SAMPAIO, R. F. Quando o objeto de estudo é a literatura: estudos de
66
revisão. Rev. Bras. Fisioter., v.10, n. 4, 2006, p.0-0.
MENEUX, E. et al. Vulvovaginal sequelae in toxic epidermal necrolysis. J Reprod Med., v.
42, n. 3, p. 153-156, 1997.
MITTMANN, N. et al. Incidence of toxic epidermal necrolysis and Stevens-Johnson syndrome
in an HIV cohort: an observational, retrospective case series study. Am J Clin Dermatol., v.
13, n. 1, p. 49-54, 2012.
MOCKENHAUPT, M. et al: StevensJohnson syndrome and toxic epidermal necrolysis:
assessment of medication risks with emphasis on recently marketed drugs. TheEuroSCARstudy. J Invest Dermatol., v. 128, n. 1, p. 35-44, Jan 2008.
MOCKENHAUPT, M. The current understanding of Stevens-Johnson syndrome and toxic
epidermal necrolysis. Expert review of clinical immunology., v. 7, n. 6, p. 803-813, Nov 2011.
MURATA, J.; ABE, R.; SHIMIZU, H. Increased soluble Fas ligand levels in patients with
Stevens-Johnson syndrome and toxic epidermal necrolysis preceding skin detachment. J
Allergy Clin Immunol., v. 122, n. 5, p. 992-1000, 2008.
NASSIF, A. et al. Toxic epidermal necrolysis: effector cells are drug-specific cytotoxic T cells.
J Allergy Clin Immunol., v. 114, n. 5, p. 1209-1215, 2004.
NEVILLE, B. W. et al. Doenças dermatológicas. In: Patologia Oral e Maxilofacial. 3ed. [S.L.]
Elsevier, 2009.p. 778 a 781.
NGUYEN, V. T.et al. Cclinical manifestations, and immunopathological mechanisms of the
epithelial variant of paraneoplastic autoimmune multiorgan syndrome:a reappraisal of
paraneoplastic pemphigus. Arch Dermatol., v. 137, n. , p. 193-206, 2001.
OLIVEIRA, A.; SANCHES, M.; SELORES, M. O Espectro clínico síndrome de StevensJohnson e necrólise epidérmica tóxica. Acta Med Port., v. 24, n. 4, p. 995–1002, 2011.
PAPAY, J. et al. Spontaneous adverse event reports of Stevens – Johnson syndrome / toxic
epidermal necrolysis: detecting associations with medications. Pharmacoepidemiology and
Drug Safety., v. 21, n. 3 , p. 289-296, 2012.
PAQUET, P. et al. Treatment of drug-induced toxic epidermal necrolysis (Lyell’s syndrome)
with intravenous human immunoglobulins. Burns., v. 27, n. 6 , p. 652-655, 2001.
67
PAVLOS, R.; MALLAL, S.; PHILLIPS, E. HLA and pharmacogenetics of drug
hypersensitivity. Pharmacogenomics., v. 13, n. 11, p. 1285-1306, 2012 Aug.
PETER, A. W. Imunopatologia. In: RUBIN E. Patologia: Bases Clinicopatológicas da
medicina. 4.ed. [S.L.] Guanabara Koogan, 2006. p. 123 a 168.
PIÉRARD, G. E. et al. Toxic Epidermal Necrolysis and Graft-versus-Host Reaction: Revisiting
a Puzzling Similarity. ISRN dermatology., v. , n. , p. , 2013 Jan.
PIRMOHAMED, M. et al. Phenotype standardization for immune-mediated drug-induced skin
injury. Clinical pharmacology and therapeutics. Nature Publishing Group., v. 89, n. 6, p. 896901, 2011 Jun.
POSADAS, S. J. et al. Delayed reactions to drugs show levels of perforin, granzyme B, and
Fas-L to be related to disease severity. J Allergy Clin Immunol., v. 109, n. 1, p. 155-161, 2002.
PRINS C, KERDEL FA, PADILLA RS et al: Treatment of toxic epidermal necrolysis with
high-dose intravenous immunoglobulins: multicenter retrospective analysis of 48 consecutive
cases. Arch Dermatol., v. 139, n. 1, p. 26-32, 2003.
REVUZ, J. et al: Toxic epidermal necrolysis. Clinical findings and prognosis factors in 87
patients. Arch Dermatol., v. 123, n. 9 , p. 1160-1165, Sep 1987.
ROUJEAL, J. C.; STERN, R. S. Severe adverse cutaneous reactions to drugs. N Engl J Med.,
v. 331, n. 19, p. 1272-1285, 1994.
ROUJEAU, J. C. et al. Toxic epidermal necrolysis (Lyell syndrome). J Am Acad Dermatol.,
v. 23, n. 6, p.1039-1058, 1990.
ROUJEAU, J. C. Clinical heterogeneity of drug hypersensitivity. Toxicology., v. 209, n. 2 , p.
123-129, 2005.
ROUJEAU, J. C. et al. Medication use and the risk of Stevens-Johnson syndrome or toxic
epidermal necrolysis. N Engl J Med., v. 333, n. 24, p. 1600-1607, 1995.
68
RZANY, B. et al. Risk of Stevens Johnson syndrome and toxic epidermal necrolysis during
first weeks of antiepileptic therapy: a case-control study. Study group of the international case
control study on severe cutaneous adverse reactions. Lancet., v. 353, n. 9171 , p. 2190-2194,
Jun 1999.
SAKA, B. et al. Stevens-Johnson syndrome and toxic epidermal necrolysis in sub-Saharan
Africa: a multicentric study in four countries. Int J Dermatol., v. 52, n. 5, p. 575-579, 2013.
SCHALOCK, P. C.; DINULOS, J. G. Mycoplasma pneumonia-induced Stevens-Johnson
syndrome without skin lesions: fact or fiction? J Am Acad Dermatol., v. 52, n. 2, p. 312-315,
Feb 2005.
SCHLAPBACH, C. et al. NKp46+ cells express granulysin in multiple cutaneous adverse drug
reactions. Allergy., v. 66, n. 11, p. 1469-1476, 2011 Nov.
SCHNECK, J. et al. Effects of treatments on the mortality of Stevens-Johnson syndrome and
toxic epidermal necrolysis: a retrospective study on patients included in the prospective
EuroSCAR Study. J Am Acad Dermatol., v. 58, n. 1 , p. 33-40, 2008.
SCHWARTZ, R. A.; MCDONOUGH, P. H.; LEE, B. W. Toxic epidermal necrolysis: Part I.
Introduction, history, classification, clinical features, systemic manifestations, etiology, and
immunopathogenesis. Journal of the American Academy of Dermatology., v. 69, n. 2, p.
173, Aug 2013.
SCHWARTZ, R. A.; MCDONOUGH, P. H.; LEE, B.W. Toxic epidermal necrolysis: Part II.
Prognosis, sequelae, diagnosis, differential diagnosis, prevention, and treatment. Journal of
the American Academy of Dermatology., v. 69, n. 2, p. 187. e 1-16, 2013 Aug.
SEKULA, P. et al. Comprehensive survival analysis of a cohort of patients with StevensJohnson syndrome and toxic epidermal necrolysis. J Invest Dermatol., v. 133, n. 5, p. 11971204, 2013.
TENNIS, P.; STERN, R. S. Risk of serious cutaneous disorders after initiation of use of
phenytoin, carbamazepine, or sodium valproate: a record linkage study. Neurology., v. 49, n.
2, p. 542-546, Aug 1997.
TOHYAMA, M.; HASHIMOTO, K. Immunological mechanisms of epidermal damage in toxic
epidermal necrolysis. Current opinion in allergy and clinical immunology., v. 12, n. 4, p.
376-382, 2012 Aug.
69
TREAT, J. R. Skin signs of severe systemic medication reactions. Current problems in
pediatric and adolescent health care., v. 42, n. 8, p. 193-197, 2012 Sep.
TAYLOR, J. A. et al. Toxic epidermal necrolysis – a comprehensive approach. Clin Ped., v.
28, n. 9, p. 404-407, 1989.
VALEYRIE-ALLANORE, L. et al. Open trial of ciclosporin treatment for Stevens-Johnson
syndrome and toxic epidermal necrolysis. Br J Dermatol., v. 163, n. 4, p. 847-853, 2010.
VANFLETEREN, I.; GYSEL, D. V.; DE BRANDT, C. Stevens-Johnson Syndrome: a
diagnostic challenge in the absence of skin lesions. Pediatr Dermatol., v. 20, n. 1, p. 32-34,
2003.
VERN-GROSS, T. Z.; KOWAL-VERN, A. Erythema multiforme, Stevens Johnson syndrome,
and toxic epidermal necrolysis syndrome in patients undergoing radiation therapy: a literature
review. American Journal of Clinical Oncology., v. 37, n. 5, p. 506-513, Oct 2014.
VIARD, I. et al: Inhibition of toxic epidermal necrolysis by blockade of CD95 with human
intravenous immunoglobulin. Science., v. 282, n. 5388 , p. 490-493, 1998.
VIARD-LEVEUGLE, I. et al. TNF-α and IFN-γ are potential inducers of Fas-mediated
keratinocyte apoptosis through activation of inducible nitric oxide synthase in toxic epidermal
necrolysis. The Journal of investigative dermatology., v. 133, n. 2, p. 489-498, 2013 Feb.
WATANABE, R. et al. Critical factors differentiating erythema multiforme majus from
Stevens-Johnson syndrome (SJS)/toxic epidermal necrolysis (TEN). European journal of
dermatology: EJD., v. 21, n. 6, p. 889-894, 2011.
WETTER, D. A; CAMILLERI, M. J. Clinical, etiologic, and histopathologic features of
Stevens-Johnson syndrome during an 8-year period at Mayo Clinic. Mayo Clinic proceedings.,
v. 85, n. 2, p. 131-138, Feb 2010.
WOLKENSTEIN, P.; REVUZ, J. Drug-induced severe skin reactions. Incidence, management
and preventions. Drug saf., v. 13, n. 1, p. 56-58, 1995.
70
YANG, C. W. et al. HLA-B*1502-bound peptides: implications for the pathogenesis of
carbamazepine-induced Stevens-Johnson syndrome. J Allergy Clin Immunol., v. 120, n. 4, p.
870-877, 2007.
YANG, Y. et al. Combination therapy of intravenous immunoglobulin and corticosteroid in the
treatment of toxic epidermal necrolysis and Stevens-Johnson syndrome: a retrospective
comparative study in China. Int J Dermatol., v. 48, n. 10, p. 1122-1128, 2009.
ZHANG, B. et al. Epitopes in the linker subdomain region of envoplakin recognized by
autoantibodies in paraneoplastic pemphigus patients. J Invest Dermatol. v. 126, n. , p. 832840, 2006.
ZHU, X.; ZHANG, B. Paraneoplastic pemphigus. J Dermatol., v. 34, n. , p. 503-511, 2007.
71
ANEXOS
ANEXO A
Quadro 1. Hemograma, gasometria venosa, eletrólitos, bioquímica, função renal,
função hepática, provas de atividade inflamatória, coagulograma, enzimas cardíacas.
72
ANEXO B
TERMO DE COMPROMISSO PARA UTILIZAÇÃO DE DADOS
DE PRONTUÁRIOS MÉDICOS
O pesquisador abaixo assinado, responsável e colaborador do Projeto de pesquisa
intitulado “Síndrome de Stevens-Johnson e Necrólise Epidérmica Tóxica – Emergência
Dermatológica: Relato de Caso e Revisão de Literatura”, compromete-se a garantir e
preservar as informações do prontuário, base de dados do Serviço de Arquivo Médico e
Estatística (SAME) do Hospital Geral de Roraima, garantindo a plena confidencialidade do
mesmo e da identidade do paciente.
Concorda, igualmente, que as informações coletadas serão utilizadas única e
exclusivamente para execução do projeto acima descrito. As informações somente poderão ser
divulgadas de forma anônima.
Boa Vista, RR, ______ de ________________ de _________.
Nome do Pesquisador
Assinatura
JUCINEIDE VIEIRA ARAÚJO
Concordância do Responsável pelo Serviço de Arquivo Médico
73
ANEXO C
CARTA DE ANUÊNCIA PARA AUTORIZAÇÃO DE PESQUISA
AO COMITÊ DE ÉTICA E PESQUISA – CEP
Eu, Kelly Karine Fraga Vieira, acadêmica do 6° ano do curso de Medicina da UFRR,
venho pelo presente, solicitar, através do ÓRGÃO, autorização para realizar pesquisa no
Hospital Geral de Roraima, para o projeto de Monografia intitulado “Síndrome de StevensJohnson e Necrólise Epidérmica Tóxica – Emergência Dermatológica: Relato de Caso e
Revisão de Literatura”, que tem como objetivo “Relatar um caso de síndrome de StevensJohnson em um paciente jovem no Hospital Geral de Roraima (HGR)”, orientado pela
professora MSc. Jucineide Vieira Araújo, pesquisadora principal do estudo.
Após a aprovação do Comitê de Ética em Pesquisa, a coleta de dados deste projeto
será iniciada, atendendo todas as solicitações administrativas dessa Gerência.
Contanto com a autorização desta instituição, coloco-me à disposição para qualquer
esclarecimento.
Pesquisador principal/Orientador (a): Jucineide Vieira de Araújo (95) 98114-6503
– [email protected]
Pesquisador
assistente:
Kelly
Karine
Fraga
Vieira
(79)
999021755
–
[email protected]
Jucineide Vieira Araújo - Orientadora
Professora Efetiva do curso de Medicina da UFRR
( ) Concordamos com a solicitação
( ) Não concordamos com a solicitação
Responsável pela autorização
Universidade Federal de Roraima
74
ANEXO D
SOLICITAÇÃO DE DISPENSA DO TERMO DE CONSENTIMENTO LIVRE E
ESCLARECIDO
Eu, Jucineide Vieira Araújo, pesquisadora responsável pelo projeto “Síndrome de
Stevens-Johnson e Necrólise Epidérmica Tóxica – Emergência Dermatológica: Relato de Caso
e Revisão de Literatura”, solicito perante este Comitê de Ética em Pesquisa a dispensa da
utilização do TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO para realização
deste projeto. Justifica-se a solicitação uma vez que o paciente foi atendido há muito tempo e o
endereço e telefone já não são os mesmos, dificultando a localização do sujeito do estudo.
Nestes termos, me comprometo a cumprir todas as diretrizes e normas reguladoras descritas na
Resolução CNS 466-12/dezembro/2012, referentes às informações obtidas com Projeto.
75
ANEXO D - PARECER SUBSTANCIADO DO CEP
76
77
78
79
80