A contracção muscular
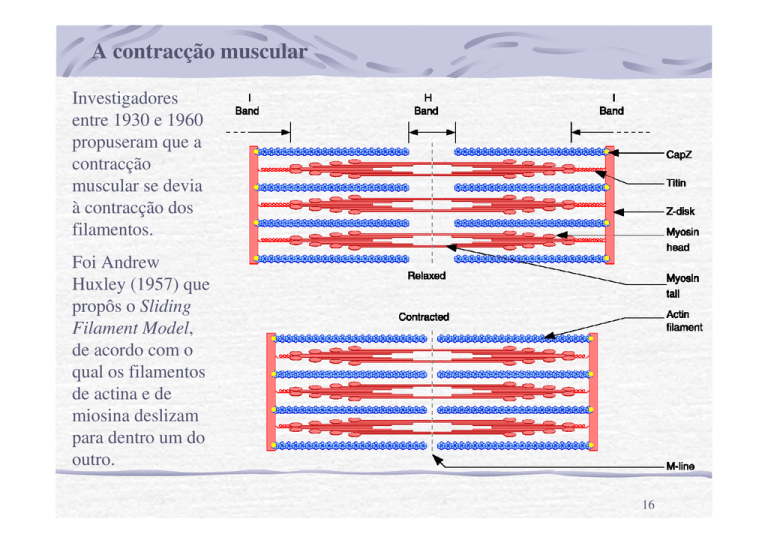
Investigadores
entre 1930 e 1960
propuseram que a
contracção
muscular se devia
à contracção dos
filamentos.
Foi Andrew
Huxley (1957) que
propôs o Sliding
Filament Model,
de acordo com o
qual os filamentos
de actina e de
miosina deslizam
para dentro um do
outro.
16
A contracção muscular
A teoria “walk-along” descreve como é
que a contracção muscular pode ocorrer
através dum movimento cíclico de
ligação e desprendimento das cabeças de
miosina à actina.
• A chegada dum impulso nervoso à
junção neuromuscular conduz à
libertação de acetilcolina na fenda
sináptica. A acetilcolina abre canais
catiónicos que conduzem um fluxo
despolarizante de Na+ para o interior do
sarcoplasma (via túbulos T).
http://www.unmc.edu/Physiology/Mann/mann14.html
• A acção despolarizante do Na+
conduz à abertura de canais de Ca2+
no retículo sarcoplasmático, que
saem para o sarcoplasma onde se
encontram as miofibrilhas.
17
A contracção muscular
Os iões
ligam-se à troponina no
filamento de actina (Fase 1 da figura).
Ocorre uma alteração conformacional no
complexo de troponina, que faz com que a
tropomiosina se desloque sobre a actina,
deixando a descoberto os locais activos
sobre a molécula de actina. As cabeças de
miosina ligam-se a estes locais activos.
Ca2+
Ca2+
Ca2+
Ca2+
Ca2+
Ca2+
Ca2+
Ca2+
Ca2+
18
A contracção muscular
Quando uma cabeça de miosina se liga a um sítio
activo na actina, ocorrem alterações nas forças
intramoleculares entre a cabeça de miosina e o
braço da ponte cruzada, que faz com que a cabeça
da miosina se incline na direcção do braço,
puxando o filamento de actina (fica a 450).
Esta inclinação súbita das cabeças de miosina
(resultante de alterações do seu estado
conformacional) dá origem à força de deslocamento
e só é possível graças à libertação da energia
previamente armazenada na miosina.
Ao curvar-se, ocorre a libertação do ADP e Pi que
estavam ligados à cabeça de miosina (Fase 2 da
figura).
19
A contracção muscular
Liga-se uma molécula de ATP na zona da cabeça de miosina de onde se
libertou a molécula de ADP. Isto conduz à libertação da cabeça de miosina do
sitio activo da actina (Fase 3 da figura).
20
Rigor mortis
Algumas horas após a morte, todos os músculos do corpo ficam num estado de
contracção designado rigor mortis; os músculos contraem e ficam rígidos, mesmo
sem quaisquer potenciais de acção.
Esta rigidez deve-se à perda de ATP, que é necessário para promover a separação da
actina da miosina. Os músculos permanecem em rigor mortis até à deterioração das
proteínas musculares, cerca de 15 a 25 horas depois da morte.
21
A contracção muscular
A acção ATPásica da cabeça de miosina
conduz à hidrólise das moléculas de ATP em
ADP e Pi.
A energia resultante da degradação conduz à
alteração conformacional da cabeça de
miosina, que passa a estar novamente a um
ângulo de 900 em relação à actina (Fase 4 da
figura).
Nesta posição, pode combinar-se com um novo
sitio activo da actina (mais adiante), e todo o
ciclo se repete mais uma vez.
Desta forma os filamentos de actina são
empurrados na direcção do centro do sarcómero.
Cada uma das ponte cruzadas actua
independentemente com a actina. Quanto maior
o número de ponte cruzadas maior a força da
contracção.
22
A contracção muscular: o ciclo das pontes cruzadas
23
Término da contracção muscular
• O ciclo das pontes cruzadas continuará a processar-se enquanto o Ca2+ se
mantiver ligado à troponina C. O complexo de troponina interage com a
tropomiosina, e os locais activos da actina ficam expostos permitindo a
interacção actomiosínica.
• O relaxamento da fibra ocorre quando cessam os impulsos do motoneurónio e,
consequentemente, quando termina a libertação de acetilcolina na placa motora.
Parte da acetilcolina é degradada a colina e acetato pela acetilcolinesterase que está
ligada à fina camada de tecido conectivo que preenche a fenda sináptica. A outra
parte difunde-se para o exterior da fenda sináptica.
• O Ca2+ é reincorporado activamente no retículo sarcoplasmático, libertando-se da
troponina.
• A tropomiosina modifica a sua posição relativamente às subunidades de actina,
inibindo a interacção entre a actina e a ponte cruzada.
24
Junção neuromuscular
As fibras musculares esqueléticas são
inervadas por fibras nervosas
mielinizadas que tem origem nos
corpos dos neurónios motores
situados nos cornos anteriores (ou
ventrais) da medula espinal.
Junto aos músculos, a fibra nervosa
ramifica e estimula de 100 a 1000
fibras musculares esqueléticas (em
média) (Kandel et al, 2000, Principles of Neuroscience).
Cada terminação nervosa realiza uma junção com
uma zona especializada da fibra muscular: a placa
motora (motor end-plate).
Ao conjunto da terminação nervosa, fenda
sináptica e placa motora chama-se junção
neuromuscular.
http://www.mc.ntu.edu.tw/department/anatomy/Histology/skeletal.html
25
Junção neuromuscular
O potencial de acção
gerado em cada
junção
neuromuscular viaja
em ambas as
direcções até ao fim
da fibra muscular.
Em geral, existe
somente uma junção
por fibra muscular.
• Na zona da junção neuromuscular a membrana invagina, formando o botão
sináptico ou goteira.
• O espaço entre a terminação nervosa e a membrana da fibra muscular é a fenda
sináptica (cerca de 70 nm de largura em MacIntosh et al, 2006, Skeletal Muscle, Human Kinetics).
• No botão sináptico, a membrana muscular forma inúmeras invaginações para o
interior designadas por fendas subneurais (subneural clefts), que aumentam
26
consideravelmente a área em que o neurotransmissor (a acetilcolina) pode actuar.
Libertação das vesículas com acetilcolina
Guyton & Hall, 2005, Textbook of Medical Physiology.
Em condições de repouso, uma vesícula de
acetilcolina pode ocasionalmente fundir-se com
a membrana do terminal nervoso e libertar o seu
conteúdo para a fenda sináptica. Quando isso
ocorre dá-se um mini potencial da placa
motora. Este tem de cerca de 0.5 mV e dura
alguns ms (Kandel et al, 2000, Principles of Neuroscience).
Quando um potencial de acção chega à
terminação nervosa conduz à abertura de canais
de Ca2+ dependentes da voltagem. O Ca2+
difunde-se da fenda sináptica para o interior da
terminação nervosa. Como resultado a
concentração de Ca2+ aumenta cerca de 100×.
O Ca2+ estímula a fusão das vesículas de acetilcolina com a membrana neuronal. A
velocidade de fusão das vesículas de acetilcolina aumenta 10,000×. Estas fundem-se
com a membrana e libertam o seu conteúdo molecular, de acetilcolina, para a fenda
sináptica – um processo designado por exocitose. Quando chega um impulso nervoso à
junção neuromuscular, são libertadas cerca de 125 vesículas de acetilcolina na fenda
sináptica.
27
Geração do potencial de acção na fibra muscular
Após o terminal do neurónio motor libertar acetilcolina, a membrana da placa
motora despolariza rapidamente. Este potencial pós-sináptico excitatório é o
potencial da placa motora (end-plate-potential).
O variação do potencial da placa motora é de cerca de +70 mV (na área adjacente
à membrana o potencial do músculo passa rapidamente de – 90 mV a – 20 mV).
Esta variação rápida de potencial deveu-se à abertura dos receptores nicotínicos
(canais catiónicos permeáveis ao Na+, K+ e Ca2+).
1) Entra Na+ e sai K+ através dos
canais catiónicos que abrem sob acção
da acetilcolina.
2) A despolarização local origina a
abertura de canais de Na+ dependentes
da voltagem.
Gera-se um potencial de acção que se
propaga ao longo do músculo!
Kandel et al, 2000, Principles of Neuroscience, NY: MacGraw-Hill.
28
O potencial de acção na fibra muscular
O potencial de acção dura de 1 a 5 ms.
A velocidade de condução é de 3 a 5
m/s).
De maneira a promover a contracção
muscular os potenciais de acção têm de
penetrar profundamente no interior da
fibra muscular. Fazem-no através do
sistema de túbulos T, que penetra até
ao interior da fibra. A despolarização
conduz então à libertação de iões Ca2+
pelo retículo sarcoplasmático.
Os canais de Ca2+ permanecem abertos durante alguns ms,
libertando o Ca2+ no sarcoplasma que rodeia as miofibrilhas.
A concentração de Ca2+ pode aumentar até 2 × 10-4 M, 500×
mais do que no repouso (< 10-7 M), isto é 10× mais do que
o necessário para promover máxima contracção muscular.
Este ao ligar-se à troponina C começa o processo de
contracção muscular (Guyton & Hall, 2005).
29
O potencial de acção na fibra muscular
Widmaier et al, 2006, Vander´s Human Physiology: The Mechanisms of Body Funcion, McGraw-Hill.
Os túbulos T estão em
contacto com as paredes
laterais das cisternas do
retículo sarcoplasmático
através de estruturas
designadas por pés de
junção.
Os pés de junção são
constituídos por
proteínas integrais de
membrana. Ligada ao Túbulo-T encontra-se uma modificação do canal de Ca2+
sensível à voltagem conhecido por receptor de dihidropiridina (DHP) (pelo facto de se
ligar a uma classe de drogas conhecidas por dihidropiridinas). O papel principal do
receptor DHP é funcionar como sensor de voltagem.
Ligado à membrana da cisterna do RS encontra-se o receptor de rianodina. Esta
proteína forma um canal de Ca2+. A chegada dum potencial de acção aos Túbulos-T
induz uma alteração de conformação no receptor DHP, que é transmitida ao receptor de
rianodina, abrindo o canal catiónico que permite a saída de iões Ca2+ para o
30
sarcoplasma.
Depleção do Ca2+ do citosol
A contracção
muscular continua
enquanto as
concentrações
citosólicas de Ca2+
estiverem
elevadas (pulso de
Ca2+ dura ~0.05
ms).
Em repouso, a concentração citosólica de Ca2+ é aproximadamente 10-7 M, podendo
subir até cerca dos 10-4 M quando o músculo é excitado. O Ca2+ é activamente
bombeado para o exterior do citosol por vários transportadores:
• 90% do Ca2+ é bombeado para o interior do SR pela Ca2+ ATPase (SERCA).
• O Ca2+ é bombeado para o exterior da fibra muscular por transportadores
existentes na membrana celular: Ca2+ ATPase, trocador Na+/ Ca2+ (3:1).
• O Ca2+ é bombeado para o interior dos mitocôndrios através dum trocador Na+/
Ca2+ (2:1) e de um uniporter de Ca2+.
31
Tipos de contracção muscular
A força exercida num objecto por um músculo em
contracção chama-se tensão muscular.
A força exercida num músculo por um objecto
(habitualmente o seu peso) designa-se carga.
A tensão muscular e a carga são forças opostas. A
variação do comprimento da fibra muscular vai
depender da magnitude relativa da tensão e da
carga.
Na contracção isométrica ou estática o músculo desenvolve tensão mas não varia de
comprimento. Ocorrem, por exemplo, quando o músculo sustenta um peso. Este tipo
de contracção é particularmente útil para medir a força da contracção muscular.
Na contracção dinâmica o músculo varia de comprimento durante a contracção. Na
contracção concêntrica ou miométrica o músculo diminui de comprimento. Nesta
situação a carga é inferior à tensão muscular. Se a carga for superior à tensão
desenvolvida pelo músculo, então ocorre uma contracção de alongamento designada
por excêntrica ou pliométrica.
32
A relação comprimento-tensão no sarcómero
Gordon et al, 1966, J Physiol, 184:170-192.
A relação comprimento-tensão representa a força (tensão) que uma fibra muscular
gera quando estimulada em diferentes comprimentos (estes diferentes comprimentos
são controlados experimentalmente).
No ponto A, o filamento de actina está completamente afastado do filamento de
miosina, não havendo qualquer sobreposição entre os dois (estado 1 da Figura 14).
Neste ponto, a tensão desenvolvida pelo músculo é nula.
À medida que o sarcómero diminui de tamanho, o filamento de actina começa a
sobrepor-se ao filamento de miosina e a tensão muscular gerada pela fibra aumenta
(estamos a ir do ponto A → B, e do estado 1→ 2 na Figura 14).
33
A relação comprimento-tensão no sarcómero
Gordon et al, 1966, J Physiol, 184:170-192.
Entre os 2.2 µm e os 2 µm o sarcómero produz a sua tensão máxima (entre os estados
2 e 3). Aos 2.2 µ m os filamentos de actina sobrepuseram-se completamente a todas as
cabeças de miosina, mas ainda não chegaram ao centro do filamento de miosina
(estado 2).
A tensão produzida pelo músculo diminui à medida que o sarcómero encolhe porque
começa a dar-se sobreposição dos filamentos de actina (estamos a ir do ponto C → D ,
e estado 3 → 5).
À medida que a compressão continua, os filamentos de miosina são esmagados, e
como é natural a força de contracção diminui rapidamente.
34
A relação comprimento-tensão no músculo inteiro
Neste gráfico encontra-se representada a tensão
muscular em função do estiramento muscular.
Existem duas curvas de tensão:
- A de cima indica a tensão muscular, em função
do estiramento muscular, quando o músculo se
encontra contraído.
- A debaixo indica a tensão muscular, em função
do estiramento muscular, quando o músculo não
está contraído (no músculo relaxado).
Guyton & Hall, 2005, Textbook of Medical Physiology.
Como se pode observar, mesmo no músculo relaxado, o estiramento muscular conduz
ao aumento da tensão muscular. Esta tensão resulta das forças elásticas exercidas pelo
tecido conectivo, o sarcolema, os vasos sanguíneos, nervos e aí por diante.
Assim, para um dado estiramento muscular o aumento de tensão provocado pela
contracção muscular (aquele que é associado só à tensão gerada pelo músculo) é uma
subtracção entre a curva superior e a curva inferior (que acomoda o aumento de tensão
não associado à contracção muscular).
35
A relação comprimento-tensão no músculo inteiro
Quando o músculo se encontra no seu estado
de repouso normal, os seus sarcómeros têm
cerca de 2 µm.
Nestas condições o músculo ao contrair-se
encontra-se no seu máximo de força de
contracção.
Guyton & Hall, 2005, Textbook of Medical Physiology,
Pennsylvania: Elsevier
À medida que o estiramento muscular aumenta,
a tensão activa (diferença entre as duas curvas)
diminui.
O músculo esquelético contraí-se muito
rapidamente quando nenhuma força se opõem à
sua contracção (em média uma contracção
completa demora cerca de 0.1 s).
À medida que a força que se opõem à contracção
aumenta, a velocidade de contracção do músculo
diminui.
36
Fontes de energia para a contracção muscular
A contracção muscular
depende de energia (sob a
forma de ATP). O ATP é
utilizado:
• Actomiosina ATPase;
• Ca2+ ATPase;
• Na+-K+ ATPase
(membrana celular).
A concentração de ATP no sarcoplasma é de cerca de 4 mM, o suficiente para manter
a contracção muscular durante 1 a 2 seg. A refosforilação do ADP é necessária ao
funcionamento do músculo.
Existem três fontes de energia para a contracção muscular:
• A creatina é convertida numa molécula chamada fosfocreatina que funciona como
um reservatório de energia rápida (concentração 4 a 8× maior do que a do ATP).
37
Fontes de energia para a contracção muscular
A energia combinada do
ATP e da fosfocreatina é
capaz de manter a
contracção muscular
durante 5 a 8 seg (Guyton &
Hall, 2005, Medical Physiology).
• A glicólise liberta
energia que é
convertida em ATP
(2.5× mais rápida na
produção de ATP que o
Ciclo de Krebs). O ATP é usado directamente na contracção muscular ou para sintetizar
fosfocreatina. As reacção glicolíticas podem ocorrer na ausência de O2, de tal maneira
que a contracção muscular consegue suster-se durante mais de 1 min na ausência de O2.
• Metabolismo oxidativo. Isto significa que o O2 combina-se com os produtos finais da
glicólise gerando mais ATP (o ácido pirúvico entra no ciclo do ácido cítrico ou ciclo de
Krebs, que conduz à produção final de água e CO2). Mais de 95% da energia usada
pelos músculos provém desta fonte. São consumidos glicídos, lipídos e proteínas.
38
Tipos de fibras musculares
As fibras musculares esqueléticas não tem todas as mesmas características
mecânicas e metabólicas. Diferentes tipos de fibras podem ser identificadas com
base:
• Na velocidade máxima de contracção – rápida ou lenta.
• Na via preferencial que utilizam para produzir ATP – glicólise anaeróbia ou ciclo
de Krebs.
As fibras lentas e as fibras rápidas contêm formas de miosina com diferentes
velocidades máximas de degradação do ATP.
As fibras que contém miosina com baixa actividade ATPásica designam-se fibras
lentas (também conhecidas por fibras do tipo I).
As fibras que contém miosina com elevada actividade ATPásica designam-se fibras
rápidas (também conhecidas por fibras do tipo II).
A velocidade do ciclo das cabeças de miosina é cerca de quatro vezes maior nas fibras
rápidas do que nas fibras lentas. No entanto, a força exercida por ambos os tipos de
fibras é idêntica.
39
Tipos de fibras musculares
O segundo tipo de classificação das fibras do músculo esquelético depende do tipo
de maquinaria enzimática utilizada na síntese do ATP.
Algumas fibras contém inúmeros mitocôndrios e
por isso têm uma elevada capacidade de
fosforilação oxidativa. Estas fibras são
conhecidas como fibras oxidativas.
Estas fibras estão rodeadas por inúmeros vasos
sanguíneos que lhes fornecem o oxigénio e os
nutrientes necessários à oxidação. Também
contêm mioglobina que armazena oxigénio e
aumenta a velocidade de difusão do oxigénio para
o interior da fibra.
As grandes quantidades de mioglobina nas fibras
oxidativas dão um aspecto de vermelho escuro a estes
músculos, que são conhecidos por fibras musculares
vermelhas.
40
Tipos de fibras musculares
As fibras glicolíticas têm poucos mitocôndrios e possuem uma elevada
concentração de enzimas glicolíticas e de glicogénio. Estas fibras estão rodeadas por
um número reduzido de vasos sanguíneos e contêm pouca mioglobina.
A falta de mioglobina é responsável pelo aspecto pálido destes músculos e pela sua
designação por fibras musculares brancas.
Com base nestas características podem-se distinguir três tipos de músculo
esquelético:
1) Fibras oxidativas lentas que combinam baixa actividade ATPásica da miosina
com elevada capacidade oxidativa (tipo I).
2) Fibras oxidativas rápidas que combinam elevada capacidade ATPásica da
miosina com elevada capacidade oxidativa e intermediária capacidade glicolítica
(tipo IIa).
3) Fibras glicolíticas rápidas que combinam elevada capacidade ATPásica da
miosina com elevada capacidade glicolítica (tipo IIb).
O quarto tipo de fibras, fibras glicolíticas lentas, não é encontrado.
41
Mais diferenças entre as fibras oxidativas e glicolíticas
As fibras glicolíticas têm geralmente diâmetros maiores que as
fibras oxidativas. O número de filamentos grossos e finos por
unidade de secção recta da fibra muscular é mais ou menos o
mesmo para todo o tipo de fibras musculares esqueléticas.
Assim, quanto maior o diâmetro da fibra muscular, maior o
número de fibras finas e grossas a actuar em paralelo para
produzir força, e assim maior a tensão máxima produzida pelo
músculo. Portanto, a fibra glicolítica média desenvolve mais
tensão quando contrai do que a fibra oxidativa média.
As fibras glicolíticas rápidas são pouco resistente à fadiga,
enquanto que as fibras oxidativas lentas são muito
resistentes à fadiga, o que lhes
permite manter a actividade
contráctil durante longos períodos de
tempo sem perda de tensão. As fibras
oxidativas rápidas tem uma
capacidade intermédia de resistência
à fadiga.
42
Tipos de fibras musculares
Widmaier et al, 2006, Vander´s Human Physiology: The Mechanisms of Body Funcion, McGraw-Hill
43
Tipos de fibras musculares
Nos seres humanos, muitos músculos
são combinações dos vários tipos de
fibras musculares, em proporções
variáveis dependendo da acção do
músculo. A proporção dos diferentes
tipos de fibra musculares varia de pessoa
para pessoa. A tabela 20.2 indica, em
quatro estudos com atletas de endurance,
que a incidência de fibras tipo I é mais
elevada, e que a incidência de fibras de
tipo II é mais baixa, nos atletas do que
nos controlos.
A tabela 20.3 indica, num estudo
longitudinal em que pessoas não
treinadas (b) são sujeitas a treinos de
endurance (a), que há conversão de
fibras do tipo II em fibras do tipo I, e
fibras do tipo IIb em IIa (em MacIntosh et al,
2006, Skeletal Muscle, Human Kinetics).
44
Alterações musculares
Todos os músculos do corpo estão continuamente a ser alterados para se
adequarem às funções que lhes são pedidas. Ocorrem alterações no seu diâmetro,
comprimento, força, irrigação, e até tipo de fibras musculares que o compõem
(mas só ligeiramente).
O aumento de massa muscular resulta dum aumento do número de filamentos de
actina e de miosina em cada fibra muscular, provocando um aumento das fibras
musculares individuais. Isto normalmente ocorre como resultado de se ter contraído
o músculo até próximo da sua força máxima ou à sua força máxima. Paralelamente,
ocorre também um aumento dos sistemas enzimáticos que fornecem energia ao
músculo.
O aumento do comprimento do músculo é motivado por estiramento do mesmo
acima do seu comprimento normal. Nestas condições, são adicionados novos
sarcómeros às extremidades das fibras musculares, onde estas se ligam aos
tendões.
Os processos de hipotrofia são opostos, com degradação dos filamentos, sistemas
enzimáticos e sarcómeros entretanto críados.
45
A mecânica da contracção muscular
Cada neurónio motor inerva várias
fibras musculares, o número de
fibras inervadas depende do tipo de
músculo. O neurónio motor mais as
fibras musculares que inerva
constituem uma unidade motora.
No músculo, as fibras musculares de
diferentes unidades motoras, estão
misturadas umas com as outras (em
conjuntos de 3 a 15 fibras). Isto
permite que a contracção muscular se
dê com ajuda de várias unidades motoras.
As fibras musculares duma unidade motora
pertencem ao mesmo tipo de fibra. Em geral,
pequenos músculos que agem rapidamente e com
elevado controlo têm poucas fibras musculares por
unidade motora. Por outro lado, os músculos que
requerem pouco controlo, podem ter centenas de
fibras musculares por unidade motora.
Olho
Rosto e pescoço
Pé
Braço
Perna
em MacIntosh et al, 2006, Skeletal Muscle, Human
Kinetics
46
Somatório de contracções musculares
As diferentes unidades motoras podem operar de
maneira a aumentar a intensidade da contracção
muscular.
O somatório ocorre de duas maneiras:
(1) aumento do número de unidades motoras que
se contraem simultaneamente - somatório de
unidade motoras múltiplas ou somatório
espacial.
(2) aumento da frequência da contracção somatório de onda ou somatório temporal.
Widmaier et al, 2006, Vander´s Human Physiology:
The Mechanisms of Body Funcion, McGraw-Hill.
47
Somatório de unidades motoras múltiplas (ou somatório espacial)
A contracção dum músculo implica a excitação de uma ou mais unidades motoras. O
mesmo músculo irá conter unidades motoras de diferentes tamanhos (com mais ou
menos fibras musculares por unidade), com as unidades maiores a fornecerem 50×
mais força de contracção do que as unidades mais pequenas.
As unidades motoras menores são excitadas com muito mais facilidade do que as
maiores porque são inervadas por fibras nervosas menores, cujos corpos celulares
na medula apresentam uma maior excitabilidade.
As gradações de força muscular durante contracções fracas ocorrem a intervalos
muito pequenos, mas os intervalos tornam-se progressivamente maiores com o
aumento da intensidade de contracção, devido à entrada em funcionamento das
unidades motoras maiores.
O principal mecanismo através do qual o córtex motor promove o aumento da força
(tensão) em determinado grupo muscular, é precisamente recrutando mais unidades
motoras, efeito que é designado por somatório de unidades motoras múltiplas.
Guyton & Hall, 2005, Human Physiology.
48
Somatório de onda (ou somatório temporal)
No músculo esquelético a duração do período de contracção é muito superior à
duração do potencial de acção que o desencadeia (tempo contracção (~100 ms)
/tempo potencial acção (1-2 ms) >>1).
Assim, o potencial de acção termina durante a fase inicial do período de contracção.
Deste modo, se o motoneurónio for estimulado repetidamente, e se o segundo impulso
atingir o músculo antes de ocorrer o relaxamento completo após o primeiro impulso,
este tende a contrair-se ainda mais.
Como o músculo ainda se encontra
num estado de contracção parcial
quando se inicia a segunda
contracção, o grau de encurtamento
final será ligeiramente superior ao
que cada um dos impulsos
isoladamente geraria (nível superior
de tensão).
49
Somatório de onda (ou somatório temporal)
O fenómeno de somatório de
onda começa a ocorrer quando a
frequência de estimulação
ultrapassa ~10 impulsos por
segundo (Heckamn et al., 2008, in Conn (ed).
Neuroscience in Medicine, Humana Press, Cap 19).
Se o músculo for estimulado
com frequências
progressivamente maiores,
atinge-se finalmente uma
frequência em que as
contracções sucessivas se
fundem e não são distinguidas
umas das outras.
Este estado denomina-se por tetanização e a frequência mais baixa em que ocorre é
conhecida como frequência crítica. Na tetanização um número suficiente de iões Ca2+
é mantido no sarcoplasma, mesmo entre potenciais de acção, de tal maneira que o
estado contráctil é mantido sem relaxação entre potenciais de acção.
50
Receptores de propriocepção
Existem duas modalidades de propriocepção:
• Sensibilidade em relação à posição estacionária dos membros (sentido de
posição).
• Sensibilidade em relação ao movimento dos membros (cinestesia).
Estas sensações são importantes para controlar os movimentos dos membros,
manipular objectos com diferentes massas e formatos, e para a manutenção da
postura vertical.
Dois tipos principais de mecanoreceptores nos
músculos esqueléticos:
• Fuso neuromuscular (muscle spindle)
• Orgãos tendinosos de Golgi (Golgi tendon
organ)
51
Fuso neuromuscular
• Os fusos neuromusculares são
receptores sensoriais encapsulados.
Têm um formato de fuso (80 a 250
µm de diâmetro máximo, até 10 mm
de comprimento) e encontram-se no
interior dos músculos esqueléticos
(MacIntosh et al, 2006, Skeletal Muscle).
• Assinalam alterações no
comprimento do músculo, e
indirectamente alterações nos
ângulos realizados entre os
músculos.
http://www.ucl.ac.uk/~sjjgsca/MuscleSpindle.gif
• Cada fuso tem três componentes:
1. Fibra muscular intrafusal – constituída por uma zona central não contráctil, à
qual se enrolam as fibras sensoriais, e por zonas polares contrácteis, à qual se
enrolam os motoneurónios gama.
2. Terminações nervosas sensoriais mielinizadas (de grande diâmetro).
3. Terminações nervosas motoras mielinizadas (de pequeno diâmetro).
52
Fuso neuromuscular
• Quando as fibras
intrafusais são
esticadas, as
terminações sensoriais
são esticadas,
aumentando a sua
velocidade de disparo.
• Como as fibras
intrafusais estão
dispostas
paralelamente às fibras
http://www.unmc.edu/Physiology/Mann/pix_4b/musclespindle2.gif
extrafusais (o restante
músculo), quando o músculo estica, as fibras intrafusais também esticam.
• Quando os motoneurónios gama excitam as regiões polares das fibras intrafusais,
estas contraem-se e a zona central do fuso alonga. Isto aumenta a velocidade de
disparo do receptor sensorial e aumenta a probabilidade de que um estiramento do
músculo active o receptor sensorial. Ou seja, ajusta a sensibilidade do fuso
neuromuscular.
53
Fuso neuromuscular
http://education.vetmed.vt.edu/Curriculum/VM8054/Labs/Lab10/lab10.htm
• Quando o músculo é esticado, existem duas fases no processo: (1) fase dinâmica
de aumento do comprimento; (2) fase estática de estabilização no novo
comprimento. O fuso neuromuscular sinaliza ambas as partes.
54
Fuso neuromuscular
• Existem dois tipos de fibras musculares intrafusais:
1. Fibras de Saco Nuclear;
2. Fibras de Cadeia Nuclear.
Um fuso neuromuscular típico contém 2 a 3 fibras de
saco nuclear e um número variável de fibras de cadeia
nuclear, normalmente 5.
• Existem dois tipos de fibras sensoriais:
1. Primárias (Ia) - Uma única fibra do tipo Ia termina
na zona central do fuso, recebendo informação de todas
as fibras intrafusais.
2. Secundárias (II) - Número variável (até 8) de fibras
do tipo II. Recebem informação das fibras de cadeia
nuclear e de saco nuclear estática.
• Existem dois tipos de fibras motoras gama:
1. Estáticas – inervam a fibra de saco nuclear estática e as
fibras de cadeia nuclear.
2. Dinâmicas – inervam a fibra de saco nuclear dinâmica.
Kandel et al, 2000, Principles of Neuroscience, NY:
MacGraw-Hill.
55
Fuso neuromuscular
• As fibras Ia codificam a velocidade de alteração do comprimento do músculo e o
seu comprimento. As fibras II são particularmente sensíveis ao comprimento do
músculo.
56
Orgãos tendinosos de Golgi
• Os orgãos tendinosos de Golgi
estão localizados nas junções entre
os músculos e os tendões.
• Estruturas encapsuladas com cerca
de 1 mm de comprimento e 0.1 mm
de diâmetro.
• Cada orgão é inervado por um
único neurónio aferente (Ib), que
perde a sua camada de mielina
quando entra na cápsula. Este
ramifica, inervando toda a estrutura.
• O orgão é constituído por inúmeras fibras de
colagéneo, que quando esticadas comprimem as
terminações nervosas, promovendo o disparo do
neurónio.
• O orgão tendinoso de Golgi é especialmente
sensível a alterações na tensão muscular.
57
Orgãos tendinosos de Golgi
Os órgãos tendinosos de Golgi são
preferencialmente activados pela contracção
das fibras muscular ligadas aos feixes de
fibras de colagéneo que contêm o receptor.
O nível médio de actividade dos órgãos
tendinosos de Golgi num músculo dá uma
medida da força total do músculo contraído.
Ao lado, encontra-se a representação
gráfica das respostas de órgãos tendinosos
de Golgi do músculo anterior da tíbia de
gatos (Schäfer et al, 1999, Brain Research, 846: 210–218).
O paradigma experimental designa-se
ramp-and-hold stretch. Aumenta-se a
tensão muscular por distensão do músculo,
uma vez chegada à tensão desejada o
comprimento do músculo é mantido
constante, depois regressa ao estado inícial.
58
Bibliografia
• Kandel et al., 2000, Principles of Neuroscience, NY: MacGraw-Hill.
• Guyton & Hall, 2005, Textbook of Medical Physiology, Pennsylvania: Elsevier.
• Widmaier et al., 2006, Vander´s Human Physiology: The Mechanisms of Body
Funcion, NY: McGraw-Hill.
59