QUÍMICA na abordagem do cotidiano
Tema
28
• TITO CANTO
Equilíbrio químico e
Princípio de Le Chatelier
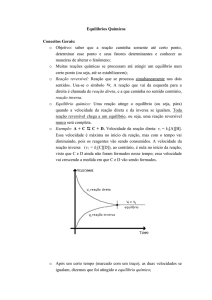
Equilíbrio químico é a situação na qual as concentrações dos participantes da reação não se alteram,
pois as reações direta e inversa estão se processando com velocidades iguais.
• O valor da constante de equilíbrio (Kc ou Kp) é característico da reação e da temperatura.
• O valor da constante de equilíbrio (Kc ou Kp) para uma reação, numa certa temperatura, não depende
das concentrações iniciais de reagentes e de produtos.
Expressão matemática da constante de equilíbrio em função das concentrações (Kc)
aA ⫹ bB
F
Reagentes
Kc ⫽
cC ⫹ dD
Produtos
[C]c 䡠 [D]d
[A]a 䡠 [B]b
Expressão matemática da constante de equilíbrio em função das pressões parciais (Kp)
aA (g) ⫹ bB (g) F
Kp ⫽
cC (g) ⫹ dD (g)
(PC )c 䡠 (PD )d
(PA )a 䡠 (PB )b
Grau de equilíbrio (α)
α⫽
quantidade, em mols, que reagiu até atingir o equilíbrio
quantidade, em mols, inicial de reagente
Espontaneidade de uma reação e valor de Kc
2 SO2 (g) ⫹ O2 (g) F 2 SO3 (g) Kc⫽ 9,9 䡠 10⫹25
N2 (g) ⫹ O2 (g) F 2 NO (g) Kc⫽ 1,0 䡠 10⫺30
Valor relativamente alto
O numerador é 9,9 䡠 10
vezes maior que o
denominador.
No equilíbrio há mais
produto do que reagente.
25
Valor relativamente baixo
O denominador é 1,0 䡠 10
vezes maior que o
numerador.
No equilíbrio há mais
reagente do que produto.
30
[SO 3 ]2
⫽ 9,9 䡠 10⫹25
[SO 2]2 䡠 [O 2]
[NO]2
⫽ 1,0 䡠 10⫺30
[N2] 䡠 [O 2]
Uma reação é tanto mais favorecida (mais espontânea) a uma certa temperatura quanto maior for o
valor de sua constante de equilíbrio nessa temperatura.
Princípio de Le Chatelier
Quando um sistema em equilíbrio químico é perturbado por uma ação externa, o próprio sistema tende
a contrariar a ação que o perturbou, a fim de restabelecer a situação de equilíbrio.
Perturbação externa
Desloca no sentido de
Altera o valor de K?
Aumento da concentração da substância
Diminuição da concentração da substância
Aumento da pressão
Diminuição da pressão
Aumento da temperatura
Diminuição da temperatura
Presença de catalisador
Consumo dessa substância
Formação dessa substância
Menor volume gasoso
Maior volume gasoso
Absorção de calor (endotérmico)
Liberação de calor (exotérmico)
Não desloca
Não
Não
Não
Não
Sim
Sim
Não
1