MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA
QUANTITATIVA
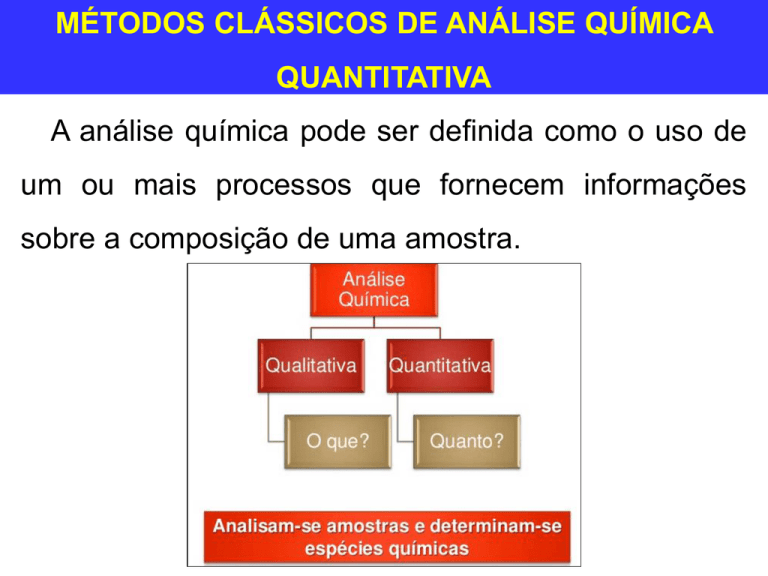
A análise química pode ser definida como o uso de
um ou mais processos que fornecem informações
sobre a composição de uma amostra.
Método: é a aplicação de uma técnica para a determinação de
um analito específico em uma matriz específica.
Exemplo: Determinação do teor de vitamina C em suplementos
vitamínicos por titulometria de oxi-redução.
Para cada método devem ser verificadas todas as variáveis
que afetam a análise.
Analitos: são os constituintes de interesse na amostra.
Matriz: Todos os constituintes da amostra com exceção dos
analitos.
Classificação e vantagens dos métodos analíticos
1) Métodos clássicos: - Titrimetria ou volumetria; - Gravimetria
2) Métodos instrumentais: - Elétricos; -Óticos
3) Cromatografia: Separação e determinação
Titulação em Química Analítica Quantitativa
Titulação, Titulometria ou Titrimetria
Procedimento
analítico,
no
qual
a
quantidade
desconhecida de um composto é determinada através da
reação deste com um reagente padrão ou padronizado.
Definição dos termos
Titulante: Reagente ou solução, cuja concentração é
exatamente conhecida (padrão).
Titulado: Composto ou solução, cuja concentração é
desconhecida.
Titulação volumétrica
É um método quantitativo de medida do volume
de uma solução de concentração conhecida,
necessário para reagir completamente com o
analito.
A técnica de análise é realizada com o
uso de vidraria volumétrica bureta.
Princípios da titulação
O ponto estequiométrico, de equivalência ou
final teórico de uma titulação é aquele calculado
com base na estequiometria da reação envolvida
na titulação. É ainda, o ponto da titulação em que, a
quantidade
de
solução
padrão
adicionada
é
quimicamente equivalente à substância com a qual
reage. Não é determinado experimentalmente.
Princípios da titulação
O ponto final de uma titulação é aquele
determinado
experimentalmente,
por
meio
das
alterações físicas na solução.
Erro de titulação - Diferença de volume entre o
Ponto de Equivalência e o Ponto Final. Ocorre
devido a dificuldades de observação das alterações
físicas da solução.
Etitulação = Vponto equivalência – Vponto
final
Princípios da titulação
Principais reações empregadas em titulação
Neutralização ou Ácido-base
H3O+ + OH- ↔ 2H2O
Complexação
Y4- + Ca2+ ↔ CaY2-
(EDTA)
Precipitação
Ag+ + Cl- ↔ AgCl(s)
Oxidação-redução
Fe2+ + Ce4+ ↔ Fe3+ + Ce3+
Requisitos de uma reação empregada em titulação
- Reação simples e com estequiometria conhecida .
- Apresentar mudanças químicas ou físicas (pH,
temperatura,
condutividade),
principalmente
no
ponto de equivalência.
- Deve-se dispor de um indicador capaz de definir
claramente, pela mudança
física
de uma
propriedade
(cor ou formação de precipitado)
final da reação
- Reação rápida.
o ponto
Vantagens do método
- Precisão de 0,1%.
- Baixo custo.
- Utilizados como referência para calibrar ou
validar outra metodologia.
- Indicada para pequeno número de amostras.
- Não requer constantes calibrações.
- Pode ser automatizado.
Reagente padrão primário
O
padrão
primário
é
um
composto
suficientemente puro e estável que, permite
preparar uma solução padrão (primária) por
pesagem direta do composto e diluição até um
determinado volume de solução.
Requisitos de um padrão primário
- Alta massa molar: erro relativo associado a
pesagens é minimizado.
- Solubilidade no meio de titulação.
- Disponível, custo acessível.
- Composição não deve variar com umidade.
- Ausência de água de hidratação.
- Estabilidade ao ar.
- Alta pureza.
Substâncias empregadas como padrão primário
Reagente padrão secundário
Um reagente padrão secundário é um
composto que permite preparar uma solução
titulante,
porém
determinada
sua
através
concentração
da
é
comparação
(padronização) contra um padrão primário.
Determinação do ponto final de uma titulação
- Indicadores Visuais
Causam mudança de cor próximo ao ponto de
equivalência.
- Métodos Instrumentais
Medida de pH, condutividade, potencial,
corrente, temperatura, etc.
Indicadores
Os “Indicadores”, são espécies químicas
freqüentemente adicionadas à solução titulada.
Visa propiciar algum tipo de mudança física ou
química do meio (ponto final) no ponto exato do fim
da reação com o titulante.
Indicadores
Mudanças típicas de características são:
- O aparecimento e desaparecimento de cor;
- Mudança de cor;
- Aparecimento ou desaparecimento de turbidez em
uma solução;
- Mudança de cor de um precipitado por adsorção de
substâncias, entre outras.
Volumetria de neutralização
O método de titulação ácido - base (ou
neutralização) engloba todas as determinações
baseadas na reação:
H3O+(aq) + OH–(aq) → 2H2O
Acidimetria
Titulação de bases livres, ou bases formadas na
hidrólise de ácidos fracos, por ma solução padrão
ácida.
Alcalimetria
Titulação de um ácidos livres, ou ácidos formados na
hidrólise de bases fracas, por uma solução padrão
básica.
Curvas de titulação
1- Ácido forte – base forte
Titulante – Solução aquosa de NaOH 0,1 mol/mL.
Titulado – Solução aquosa de HCl de concentração
desconhecida. Volume de HCl = 10 mL
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
O pH de equivalência = 7,0
Curvas de titulação
É a representação do pH do titulado à medida que se
adiciona o titulante.
pH inicial
Zona de
variação
brusca de pH
Ponto de
equivalência
Volume de titulante gasto
até ao ponto de equivalência
A curva de titulação permite:
• identificar a titulação;
• identificar titulante/titulado;
• ler o volume de titulante gasto até ao ponto de equivalência.
Identificação da titulação
As titulações ácido base podem ser de três tipos:
1. ácido forte - base forte (ou fracos)
2. ácido fraco- base forte
3. ácido forte – base fraca
e distinguem -se pelo pH no ponto de equivalência.
1) Titulação ácido forte-base forte (ou fracos)
Volume do titulante (mL)
O ponto de equivalência ocorre quando o
pH = 7
pH no ponto final da
titulação = 8,3 aos 3 min
Volume de base gasto =
8,911 mL
Tempo (min.)
1a derivada
pH
Titulação ácido forte-base fortes
Concentração do ácido?
HCl(aq)
10 mL
+
NaOH(aq)
8,911 mL
0,1 mol/L
→ NaCl(aq)
C HCl = 0,08911mol/L
+
H2O(l)
2) Ácido fraco-base forte
Titulação de um ácido monoprótico fraco
com uma base forte
3)Titulação Ácido forte-base fraca
Titulação de uma monobase fraca com um ácido forte
Identificação do titulante/titulado
pH inicial
>7
Titulante
Ácido
<7
Titulado
Base
Titulante
Base
Titulado
Ácido
Diferenças entre as curvas de titulação entre
ácidos fortes e fracos
Indicador ácido/base
Indicadores ácido-base são substâncias orgânicas
de elevada massa molecular que, em água ou outros
solventes,comportam-se como ácidos fracos ou bases fracas
e mudam gradualmente de coloração dentro de uma faixa
relativamente estreita de pH, chamada zona de viragem.
HIn +
cor ácida
H2O
In - + H3O+
cor básica
E o indicador do tipo:
In +
cor básica
H2O
InH+ + OHcor ácida
Indicadores Ácido - Base
Alaranjado de metila
Azul de bromotimol
Fenolftaleína
Vermelho de metila
Indicadores
Alaranjado de metila
Azul de bromotimol
Faixa de transição
3,1 - 4,4
6,0 -7,6
Fenolftaleína
Vermelho de metila
8,0 - 9,8
4,4 - 6,2
FENOLFTALEÍNA
VERMELHO DE METILA
ALARANJADO DE METILA
Indicadores
Quanto mais estreita for a zona de viragem de um indicador,
mais adequada é a sua utilização.
Quanto mais abrupta a zona de salto de pH na curva de
titulação, mais fácil se torna a escolha do indicador.
Escolha de um indicador:
a) Fenolftaleína - zona de viragem: 8,0 – 9,8
b) Azul de bromotimol - zona de viragem: 6,0 - 7,6
c) Alaranjado de metila - zona de viragem: 3,1 - 4,4
Exemplos:
1) Titulação entre um ácido forte e uma base forte.
Qual dos três indicadores deverá ser usado?
2) Titulação entre um ácido fraco e uma base forte.
Qual dos três indicadores deverá ser usado?
3) Titulação entre um ácido forte e uma base fraca.
Qual dos três indicadores deverá ser usado?
Cores do Indicador: Extrato do repolho roxo
ácido
neutro
básico












