QUÍMICA
PRÉ-VESTIBULAR
LIVRO DO PROFESSOR
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
© 2006-2008 – IESDE Brasil S.A. É proibida a reprodução, mesmo parcial, por qualquer processo, sem autorização por escrito dos autores e do
detentor dos direitos autorais.
I229
IESDE Brasil S.A. / Pré-vestibular / IESDE Brasil S.A. —
Curitiba : IESDE Brasil S.A., 2008. [Livro do Professor]
832 p.
ISBN: 978-85-387-0577-2
1. Pré-vestibular. 2. Educação. 3. Estudo e Ensino. I. Título.
CDD 370.71
Disciplinas
Autores
Língua Portuguesa
Literatura
Matemática
Física
Química
Biologia
História
Geografia
Francis Madeira da S. Sales
Márcio F. Santiago Calixto
Rita de Fátima Bezerra
Fábio D’Ávila
Danton Pedro dos Santos
Feres Fares
Haroldo Costa Silva Filho
Jayme Andrade Neto
Renato Caldas Madeira
Rodrigo Piracicaba Costa
Cleber Ribeiro
Marco Antonio Noronha
Vitor M. Saquette
Edson Costa P. da Cruz
Fernanda Barbosa
Fernando Pimentel
Hélio Apostolo
Rogério Fernandes
Jefferson dos Santos da Silva
Marcelo Piccinini
Rafael F. de Menezes
Rogério de Sousa Gonçalves
Vanessa Silva
Duarte A. R. Vieira
Enilson F. Venâncio
Felipe Silveira de Souza
Fernando Mousquer
Produção
Projeto e
Desenvolvimento Pedagógico
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
Reações de adição
H
⇒ ξex. H– C
Ni
C–H+H–H
H
H– C = C – H
etino ou acetileno
eteno ou etileno
Alcino + 2 H
Cat
Alcano
Reações de adição
Essas reações se caracterizam pela quebra de
ligações entre carbonos.
Nos hidrocarbonetos ocorrerá a quebra da ligação mais fraca entre carbonos (ligações do tipo ) e a
formação de duas novas ligações sigma ( ).
B
C=C
+A–B
1 H– C
+ AB
B
–C–C–C–
etino
H
Hidrogenação catalítica ou
processo de Sabatier - Senderes
Essa reação ocorre entre os hidrocarbonetos
alquenos, alquinos e dienos e o gás hidrogênio na
presença de catalisadores metálicos apropriados,
como níquel (Ni), platina (Pt) e paládio (Pd). Veja a
seguir algumas dessas reações.
a)Hidrogenação de dienos
Como o dieno apresenta duas ligações por
moléculas, sua hidrogenação parcial produz um
alqueno, enquanto sua hidrogenação total produz
um alcano:
hidrogenação parcial
EM_V_QUI_035
Ni
propeno
propadieno
H H H
Cat
2 H2
Ni
H2C – C – CH2
H
propano
b)As reações de hidrogenação são denominadas reações de redução, pois o Nox do
carbono envolvido na reação diminui:
H +1 H
H – C = C – H + H2
+1
Cat
H–C–C–H
+1
H +1 H
H +1 H
redução
-3
HC – CH
gás
hidrogênio
Alcino + H
1 H2
H H
H2C = C – CH2
Ni
H2C = C = CH2 +
-2
Alcano
⇒ εξex. HC = CH + H – H
eteno ou
etileno
H
etano
hidrogenação total
Cat
H
1 H– C – C – H
–C–C–
A
Alceno + H
Ni
C–H+2H–H
A
Os hidrocarbonetos das classes alquenos,
alquinos e dienos apresentam, como reações características, as reações de adição.
Os ciclanos de três ou quatro carbonos, por
apresentarem anéis instáveis, também sofrem esse
tipo de reação, devido à quebra de uma ligação sigma
( ) entre carbonos do anel, originando compostos de
cadeia aberta.
C
C ––– C
H
⇒ ξex.
Alceno
etano
Halogenação
de X2
A halogenação ocorre entre os hidrocarbonetos cicloalcanos (com 3 ou 4 carbonos), alquenos,
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
1
alquinos e dienos e as substâncias simples dos
halogênicos (F2, Cl2, Br2 e l2), de modo semelhante à
hidrogenação. Observe alguns exemplos:
C C
H2C = CH – CH2 + C
H2C – CH – CH3
2
C
HC ≡ C – CH3 + C
2
C
C
HC = C – CH3
+
C
C
C C
H2C = C = CH2 – C
2
C
H2C – C = CH2
+
C
C
HC – C – CH3
2
2
C
C
C
H2C – C – CH2
X
X
– C – (CH2)n – C –
Onde n é maior ou igual a l.
b)O teste mais comum para verificar se uma
cadeia alifática é insaturada consiste na
reação com água de bromo [Br2(aq)] ou uma
solução de bromo em tetracloreto de carbono
(Br2/CCl4). Esses sistemas apresentam uma
coloração castanha. Se a cadeia for insaturada, nota-se uma descoloração pela presença
do bromo (Br2).
C
H2
C
H2C ––– CH2 + C
C
Br Br
– C = C – + Br2
C
–C–C–
4
castanho
H2C – CH2 – CH2
2
CC
incolor
Essa reação, nessas condições, não irá ocorrer
com cadeias saturadas.
X2 representa genericamente um halogênico
(Cl2, Br2, I2). A reatividade decresce do Cl2 para o
I2: Cl2 > Br2 > I2.
A adição do Br2, ou I2, em solução (por exemplo,
dissolvidos em clorofórmio) provoca o descoramento da solução de Br2 e de I2.
Observe alguns exemplos:
Cl Cl
H
H2C = C – CH3 + Cl2
H2C – C – CH3
H
propeno
alceno
Adição de HX adição de
hidretos ametálicos
Essa reação de adição ocorre entre os hidrocarbonetos alquenos, alquinos, dienos e cicloalcanos
(com 3 ou 4 carbonos) e os hidretos dos halogênios
(HCl, HBr, Hl).
Br
CH2 = CH2 + HBr
H3C – CH2
1,2 - dicloropropano
derivado halogenado
Cl Cl
H–C=C–H
Cl
alcino
Cl
di-haleto(vicinal)
+ Cl2
H–C–C–H
Cl Cl
tetra-haleto orgânico
Br2 ou I2 dissolvidos em solvente orgânico prendem a cor ao serem adicionados a insaturações.
a)Na reação de 1 mol de X (halogênio) com 1 mol
de alquenos, alquinos e alguns dienos, teremos como produto 1 mol di-haleto vicinal, o
que significa que os dois átomos do halogênio estão ligados a carbonos vizinhos.
–C–C–
X
2
X
O produto obtido na reação de adição de
1 mol de halogênio com 1 mol de ciclano é
classificado como di-haleto isolado.
Quando a molécula do eteno é simétrica, nessa
reação obteremos um único produto.
Quando se considera um hidrocarboneto insaturado assimétrico tem-se teoricamente a possibilidade
de formação de dois produtos diferentes:
Cl
H
H3C – CH – CH2
2 - cloro - propano
H3C – CH = CH2 + HCl
propeno
H
Cl
H3C – CH – CH2
1 - cloro - propano
Na prática, só se obtém a formação de 2-cloropropano, pois 1-cloro-propano não ocorre ou
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_V_QUI_035
H–C C–H
+ Cl2
ocorre em quantidades desprezíveis. Esse fato foi
observado pela primeira vez em 1808 pelo químico
russo Markovnikov, que, mesmo sem conhecer o
mecanismo da reação, formulou uma regra empírica
que permite prever em qual carbono da molécula
do hidrocarboneto ocorre a adição do hidrogênio,
provavelmente do HX.
Hidratação do propino (Alcino)
Essa reação ocorre entre 1 mol de água e 1
mol de alquino, originando um composto instável
<enol>, que irá originar, espontaneamente, um aldeído ou uma cetona. Essa transformação recebe o
nome de tautomeria (isomeria dinâmica).
H3C – C ≡ CH + HOH
Regra de Markovnikov: o hidrogênio do
HX adiciona-se ao carbono da dupla ou tripla
ligação mais hidrogenado.
Essa regra revelou-se muito útil e tem sido usada rotineiramente pelos químicos.
``
Exemplos:
Cl
H3C – C ≡ CH + 1 HCl
propino
carbono mais
h i d ro g e n a d o
da insaturação
H
H3C – C = CH
H2C = C = CH2 + 1 HBr
propadieno
carbono mais
h i d ro g e n a d o
da insaturação
CH2
H2C ––– CH2 + 1 HBr
ciclopropano
H2C = C – CH2
2-bromo-propeno
Br
H
H2C – CH2 – CH2
1-bromo-propano ou
brometo de propila
Essas reações consistem na adição de água
(H2O ou HOH), na presença de catalisadores e em
meio ácido, aos hidrocarbonetos alquenos e alquinos
e também obedece à regra de Markovnikov. Assim,
nas reações de hidratação desses compostos, um
hidrogênio (H) proveniente de água adiciona-se ao
carbono hidrogenado da insaturação, enquanto o
grupo hidroxila (OH) se adiciona ao outro carbono
da insaturação.
Hidratação do propeno ou propileno (Alceno)
EM_V_QUI_035
meio ácido
carbono mais
h i d ro g e n a d o
da insaturação
isopropenol
propanona (acetona)
Se o grupo OH presente no enol estiver situado
em carbono secundário, haverá a formação de uma
cetona; se o grupo OH estiver situado em carbono,
irá formar-se um aldeído.
Adição de
ácido sulfúrico (H2SO4)
O
H2SO4=HO – S – OH
O
A dupla ligação
H
O
H
catalizador
H OH
H2C – CH – CH3
H H
H–C–C–H
H OSO3H
O
etileno ou eteno
higrogeno-sulfato
(Alceno) de etila
Se o hidrogeno sulfato de alquila for hidrolisado, poderão ser obtidos álcoois, conforme vimos na
adição de água.
H H
H
H – C – C – H + H2O
H – C – CH3 + H2SO4
OH
H OSO3H
hidrogênio-sulfato
de etila
etanol
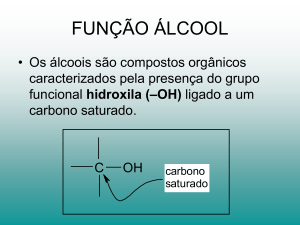
ÁLCOOL
Esse tipo de adição acontece sempre que hidrolisado à formação de álcoois.
Reações de polimerização
Vamos avaliar o caso em que moléculas iguais
se reúnem para originar uma molécula “múltipla” de
substância-origem.
•• em compostos com dupla ligação:
2 - propanol
propeno
H
H
propino
H
H3C – C – C – H
H–C=C–H +H–O–S–O–H
Adição de água (H2O em
presença de meio ácido)
H2C = CH – CH3 + HOH
H3C – C = CH
2-cloro-propeno
Br H
O
OH
n H2C = CH2
Calor
p
eteno
(– CH2– CH2–)n
polietileno
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
3
n CH2 = CH
Calor
... – CH2– CH– CH2– CH– ...
C
C
cloreto de vinila
C
cloreto de polivinila
(PVC)
H
H–C C–H+H–C C–H
etino
etino
(dimerização do acetileno)
R – C – OMgX
R1
H2O
aldeído
•• em compostos com tripla ligação:
Cat.
H
O
R – C + R1 – MgX
H
H2O
H
H
OH
R – C – OH + Mg
X
R1
(álcool secundário)
H–C=C–C C–H
vinil-acetileno
(matéria-prima do neopreno)
(borracha sintética)
O
R – C – R + R – MgX
1
Cetona
3 HC CH
H2O
acetileno
benzeno
(trimerização de acetileno)
R
R – C – OMgX
R1
H2O
R
R – C – OH + Mg(OH)X
R1
(álcool terciário)
Reação de adição de
compostos de Grignard (em
presença de água)
Observação importante:
Analogamente, aos aldeídos e cetonas, o
gás carbônico é capaz de adicionar compostos de
Grignard. Essa reação é útil na obtenção de ácidos
carboxílicos.
A adição de compostos de Grignard a aldeídos e
cetonas pode ser usada como método de preparação
de álcoois, desde que se submeta o produto obtido
à posterior reação de hidrólise:
... – C =O + R MgX
O = C = O + RMgX
O=C
... – C OMgX
R
álcool
H – C =O + R MgX
O
OH
ácido carboxílico
Mg(OH)Cl + HCl
hidroxi-cloreto
magnésio
H2O + MgCl2
cloreto de
magnésio
R
fórmico
H
H – C – O MgX + HOH
Adição de água a nitrilos –
hidratação de nitrilos
H – C – OH + Mg(OH)X
R
álcool
primário
R–C
nitrilo
N + H – OH
R–C=N–H
OH
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
R – C – NH2
O
amida
EM_V_QUI_035
H
4
Mg(OH)X + R – C
Exemplo:
H
H – C – O MgX
aldeído
R
R
Mg (OH)X é um hidroxi-sal. Devido à presença
do grupo (OH), ele é capaz de reagir com ácido, resultando sais normais.
Por isso, a hidrólise em meio ácido origina sal
normal em vez de hidroxi-sal.
``
Observe o exemplo:
H
OMgX
+ HOH
R
Mg(OH)X + ...– C – OH
R
OMgX
gás carbônico
R
...– C – O MgX + HOH
O=C
R – C – NH2 + H2O
O
1– hexano
O
amida
sal amônio
O sal de amônio em meio ácido origina ácido
carboxílico.
R – C
H3C – CH2 – CH2 – CH2 – CH2– CH3
R – C – ONH4
O
+ HCl
ONH4
sal amônio
O
R – C + NH4Cl
OH
O cicloexano, além de ser saturado, é bastante estável,
não sofrendo adição do gás hidrogênio (H2).
2. Complete as reações a seguir e indique o nome do
produto formado:
ácido carboxílico
Em meio básico, este sal de amônio origina outro
sal carboxílico.
O
R – C
+NaOH
ONH4
sal amônio
Ni
a) H3C – CH = CH2 + 1 H2
b) H3C – C ≡ CH+ 1 H2
Ni
c) H3C – C ≡ CH+ 2 H2
Ni
A
B
C
d) H2C = CH – CH2 – CH = CH2+ 1 H2
O
R – C + NH3 + H2O
ONa
e) H2C = CH – CH2 – CH = CH2+ 2 H2
f) H2C – CH2 + 1 H2
sal sódio
Ni
Ni
Ni
D
E
F
CH
g)
1. (Fuvest) Duas substâncias diferentes têm fórmulas
molecular C6H12.
Uma delas, quando submetida à atmosfera de
hidrogênio, na presença de um catalisador, reage com
o gás e a outra não.
a) Qual a reação dessa diferença de comportamento?
HC
``
1- hexeno
e) H3C – CH2 – CH2– CH2– CH3; pentano.
f) H3C – CH2 – CH3; propano.
g)
; cicloexano.
3. Equacione as reações a seguir indicando a fórmula
estrutural de cada substância da reação.
a) 1 mol de propeno + 1 mol de cloro.
b) 1 mol de propeno + 1 mol de bromo.
H2
C
H2C
CH2
H2C
CH2
c) 1 mol de propino + 2 mols de cloro.
cicloexano
``
Solução:
a) H2C = CH – CH3 + 1 C
a) Considerando os exemplos mencionados no item b,
o único composto que reage com gás hidrogênio
(H2) é o alqueno, através da reação de adição.
EM_V_QUI_035
Solução:
d) H3C – CH2 – CH2 – CH3; 1 – penteno.
Já um cicloalcano com a mesma fórmula pode ser o:
C
H2
1 alta
c) H3C – CH2 – CH3; propano.
A fórmula C6H12 pode pertencer aos alquenos ou aos
cicloalcanos, pois ambos apresentam fórmula geral
CnH2n.
H2C = CH – CH2 – CH2 – CH2 – CH3
CH
+ 3 H catalizador
G
P
b) H3C – CH = CH2; propeno.
Solução:
b)Um exemplo de alqueno com fórmula C6H12 é o:
C
H
CH
a) H3C – CH2 – CH3; propano.
b) Escreva uma fórmula estrutural possível para cada
uma dessas substâncias.
``
HC
H
C
H2C = CH – CH2 – CH2 – CH2 – CH3 + H2
1 - hexeno
2
C C
H2C – CH – CH3
Br Br
b) H2C = CH – CH3 + 1 Br2
cat.
c) HC C – CH3 + 2 C
2
H2C – CH – CH3
C C
HC – C – CH3
C C
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
5
Mecanismo de adição
De uma maneira geral, as reações de adição
podem ser explicadas de acordo com o seguinte
mecanismo:
1.ª etapa: cisão heterolítica do reagente nãoorgânico.
B
CH3 – (CH2)7 – CH = CH – (CH2)7 – C
ácido oleico
A+ + :B–
íons
– C+ – C – + B–
CH3 – (CH2)16 – C
do
ácido esteárico
b) o composto que apresenta a isomeria espacial.
B A
–C–C–
c) o tipo de isomeria espacial.
d) o tipo de reação que ocorre.
Esse mecanismo justifica a regra de Markovnikov.
``
Solução:
No entanto, nas reações de adição com o composto
HBr na presença de peróxido ocorre um mecanismo
diferente do apresentado. Nesse caso, a adição de
hidrogênio ocorre no carbono menos hidrogenado
da dupla, contrariando a regra de Markovnikov.
Essa reação, em particular, acontece por meio de
um mecanismo de radicais livres em cadeia e as
adições, muitas vezes, são chamadas de adições
anti- Markovnikov ou adições de Karasch,
em referência ao seu descobridor.
5. Faça as reações de hidratação do acetileno e do propino.
1.ª etapa: cisão homolítica do peróxido:
``
R–O
O–R
2R–O
a)Ácido carboxílico – C
b)Ácido oleico.
R–O +H
B
R–O
Solução:
+
+2
(instável)
enol
H + Br
H3C – CH – CH2
4.ª etapa: ataque radical orgânico a molécula do
HBr:
Br
H3C – CH – CH2 + H Br
Br
CH3 – CH – CH2 + Br
H
H–C=C–H
H 3C – C – H
H OH
acetileno
alcino
3.ª etapa: adição do radical Br ao hidrocarboneto:
H3C – CH – CH2 + Br
.
OH
d)Adição.
H – C C – H + HOH HgH
Br
O
c)Isomeria geométrica.
2.ª etapa: cisão homolítica do HBr:
6
OH
Nesta reação, um dos compostos apresenta isomeria
espacial, identifique:
a) o grupamento funcional presente nos compostos citados.
A
– C+ – C –
3.ª etapa: ataque de ânion (B-) ao carbono C+.
A
+
OH
O
+ H2
2.ª etapa: ataque do cátion (A+) à ligação
hidrocarboneto:
– C+ – C – + A+
O
O
etanal
aldeído
OH
HC – C
C – H + HOH
propino
alcino
H+
Hg +2
H3C – C = C – H
H
(instável)
enol
H3C – C – CH3
O
propanona
cetona
6. (Unicamp). A reação do propino (HC≡ C–CH), com
bromo (Br) pode produzir dois isômeros cis-trans que
contêm uma dupla ligação e dois átomos de bromo nas
respectivas moléculas.
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_V_QUI_035
A
A seguir, ocorre a repetição da 3.ª etapa e novamente
a 4.ª etapa, e a reação contínua em cadeia.
4. (ENCE-UERJ) – A reação abaixo é de grande importância industrial, pois permite a conversão de óleos
em gorduras plásticas para a produção de margarinas e de outras gorduras compostas. É, também,
utilizada para melhorar a firmeza de gorduras ou para
reduzir a suscetibilidade destas à rancidez.
a) Escreva a equação dessa reação química entre propino e bromo.
b) Escreva a fórmula estrutural de cada um dos isômeros cis-trans.
``
Solução:
Br Br
H3C – C = CH
a) H3C C CH + Br2
b)
H
H
Br
H3C
C
Br
C
C
Br
Br
1,2 - dibromo-propeno
(cis)
C
CH3
1,2 - dibromo-propeno
(trans)
7. (Vimesp) Um óleo vegetal combina-se com um certo
elemento em presença de níquel finamente dividido (catalisador) e converte-se em gordura sólida
(margarina). Qual é o elemento que reage com óleo
e como se denomina a reação? Escrever a equação
química geral do processo.
``
Solução:
Amazônia é bastante preocupante. No entanto, o
primeiro desastre ambiental com o mercúrio foi o da
baía de Minamata, no Japão, percebido em 1956.
Como começou o problema de Minamata? No início
do século XX uma indústria química instalou-se na
cidade, expandiu-se, e em 1935 já produzia 50% de
todo o etanol e derivados do ácido acético do Japão.
A partir da década de 1940, essa indústria passou
também a produzir cloreto de vinila, garantindo
uma base sólida para a indústria japonesa durante
a Segunda Guerra Mundial.
Nesse processo produtivo, essa companhia japonesa
utilizava como catalisador sulfato de mercúrio e
grandes quantidades de íons desse metal foram
lançadas nos efluentes da fábrica, contaminando a
baía de Minamata.
Na época, pouco se sabia sobre a toxidez de
mercúrio e sobre o problema de seu acúmulo na
cadeia alimentar. Em 1956 começaram a aparecer
vários casos que evidenciaram o maior desastre
ambiental envolvendo a intoxicação humana por um
metal pesado.
O quadro abaixo resume a participação do mercúrio
nos processos químicos de adição que acabamos
de examinar.
+HCl / HgCl2
cloreto de
vinila
CH2 = CHCl
polimeração
É o hidrogênio e a reação é a de hidrogenação
catalítica.
óleo + nH
Ni
carbeto + H2O
acetileno
HC ≡ CH
+H2O / HgSO4
gordura
(margarina)
acetaldeído
CH3CHO
cloreto de
polivinila (PVC)
(CH2CHCl)n
ácido acético
CH3COOH
oxidação
O
mercúrio
orgânico
HgCH3+
H2C – O – C – ... – C = C – ...
O
HC – O – C – ... – C = C – ... + 3H2
O
derivados:
acetona
acetato de etila
octanol
acetato de vinila
(Ciência Hoje, v. 23, n.o 133, nov. 1997. Adaptado.)
H2C – O – C – ... – C = C – ...
O
EM_V_QUI_035
H H
H2C – O – C – ... – C – C – ...
O
H H
HC – O – C – ... – C – C – ...
O
H H
H2C – O – C – ... – C – C – ...
Você já teve várias oportunidades de aprender a
respeito de contaminação ambiental por mercúrio.
Atualmente, o problema de contaminação na
1. Escreva a equação química correspondente à reação de
1–buteno com:
a) H2O
b) HC
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
7
2. Qual o produto da reação de:
a)
a) H2C = CH2­+ Br2
b) HC ≡ CH + 2 H2
b)
Ni
3. Complete a sequência reacional:
c)
d)
e)
4. (Cesgranrio) Quando se faz borbulhar acetileno em
solução de H2SO4 (em presença de sulfato de mercúrio
como catalisador), esse hidrocarboneto adiciona uma
molécula de água como formação de hidroxieteno (álcool
vinílico) que imediatamente tautomeriza, dando:
10. A reação de uma cetona com um reagente de Grignard,
­seguida por hidrólise, fornece um:
a) éter e um álcool.
b) álcool secundário.
a) ácido etanoico.
c) éster e um álcool.
b) etanal.
d) álcool terciário.
c) etanol.
e) álcool primário.
d) etano.
11. (Elite) Dê o produto das reações a seguir:
e) etileno.
a) H2C = CH2 + H2O
5. Qual o principal produto da reação?
H+
b) H2C = CH2 + HC O
c) H2C = CH2 + H2SO4
6. A reação completa de hidrogenação de um benzeno
produz?
a) ciclohexano.
a) H3C – CH2 – C
C – Na + H3C – Br
b) H3C – C – C – H3C + 2 Zn álcool
b) 1, 3-ciclohexeno.
c) H3C – C
c) hexano.
Equacione as reações abaixo:
a)
+ H2
C – CH3 + H2O H SO
2
4
13. (UFRJ) A equação abaixo ilustra a hidrogenação do álcool
insaturado e oticamente ativo A, de massa molecular m,
que fornece um outro álcool B, de massa molecular m
+ 2, porém sem atividade ótica.
d) ciclopropano.
7.
12. (Elite) Complete as reações abaixo:
Ni
200oC
b)
+ 3 Cl2
8. Completar:
u.v
luz
Forneça a nomenclatura IUPAC e a estrutura em bastão
de B.
14. (UFRJ) X, Y, Z são 3 hidrocarbonetos de mesmo número
de átomos de carbono, a respeito dos quais sabe-se
que “x” não reage com a água em meio ácido, mas que
y reage, formando etanal.
9. Observe a reação:
a)
8
Podemos afirmar que y é:
15. (Cesgranrio) As células do corpo humano eliminam
amônia e gás carbônico no sangue. Essas substâncias
são levadas até o fígado, onde são transformadas em
ureia, sendo esta menos tóxica que a amônia. A ureia
chega aos rins pelas artérias renais. Os pacientes que
apresentam doenças renais têm índices elevados de
ureia no sangue.
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_V_QUI_035
a) Escreva a equação que representa a reação de Z
com o HC.
A reação abaixo indica a síntese de ureia no fígado:
2 NH3 + CO2 → (NH2)2CO + H2O
Assinale a opção que corresponde à função orgânica a
que pertence a molecular de ureia.
a) álcool.
c) dióxido de carbono.
d) ácido metonoico.
e) metano.
2.
b) cetona.
c) amida.
d) aldeído.
e) amina.
16. A fórmula do cloreto de vinila é H2C = CHC e a do
ácido acético, CH3COOH. Logo a fórmula do acetato
de vinila deve ser:
a) CH3COOCH = CH2
b) CH3COOCH2CH3
c) CH3COCH3
A equação acima representa a preparação de um
éter difenílico bromado que é utilizado no combate a
incêndios.
A partir dessas informações, responda:
a) Qual é o nome da reação representada?
b) Qual é a fórmula da substância A?
d) CH3COCH = CH2
3. Considere a estrtura da vitamina A, mostrada a seguir.
e) CH3COOCH3
17. (UFF) Um produto natural extraído do cravo da índia, conhecido por eugenol apresenta a seguinte estrutura:
Vitamina A
a) Para hidrogenar catalicamente todas as ligações
duplas C = C de 1 mol de vitamina A, quantos mols
de gás hidrogênio seriam consumidos?
Os grupos funcionais em destaque na molécula do
eugenol são:
I
II
III
b) Escreva a fórmula estrutural do produto dessa hidrogenação.
4. (UFPR) O propanal reage com o cloreto de metilmagnésio dando um produto de adição, o qual, por hidrólise,
produz o composto orgânico A.
a)
alceno
éter
fenol
b)
fenol
éter
alceno
c)
éter
alceno
fenol
a) Dê a reação citada.
d)
alceno
fenol
éter
b) Dê o nome do composto A, a função à qual pertence e, se for o caso, sua classificação quanto à
posição do grupo funcional na cadeia carbônica.
18. (Unicamp) Um mol de hidrocarboneto cíclico insaturado, de fórmula C6H10, reage com um mol de bromo
(Br2), dando um único produto. Represente, por meio
de fórmulas estruturais, o hidrocarboneto e o produto
obtido na reação citada.
5. Qual o produto da reação do alceno C3H6 com brometo
de hidrogênio na presença de um peróxido?
6. Observe:
I. H2C = CH – CH3 + HBr
II. H−CHO. + CH3 – Mg – Cl H O
EM_V_QUI_035
2
1. Indique, entre as alternativas abaixo, qual o composto
que reage com o CH3CH2 CH2CH2MgBr e cujo produto
ao ser hidrolisado forma o 1 – pentanol.
Quais os produtos das reações, respectivamente?
a) 1-bromo etano e etanol.
b) 2-bromo propano e etanol.
a) metanol.
c) etanoico e 1-bromopropeno.
b) metanal.
d) 2-bromopropeno e etanal.
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
9
(UFRN) A adição de brometo de hidrogênio a 3-4 dimetil - 2 penteno produz:
a) 2-bromo-3, 4-dimetilpentano.
b) 2-bromo-3, 4-metilpenteno-2.
c) 2, 3-dibromo-3, 4-dimetil pentano.
d) 3-bromo-2, 3-dimetil pentano.
e) 4-bromo-3, 4-dimetilpenteno-2.
8. Complete as equações:
a)
+ 2 HI
b)
+ H2
c)
d)
e)
Ni
+ H2
+ HCl
+ HBr
peroxido
9. Em uma república, próxima à UFRJ, moram 3 amigos.
Sabe-se que eles gastam 1 botijão de gás butano de
13kg por mês (30 dias) preparando tudo que comem.
a) Calcule o número de mols de butano gasto por dia,
por pessoa.
b) Quais os produtos da reação de combustão do butano?
10. (UFRJ) O ácido ascórbico (vitamina C) pode ser obtido de
frutas cítricas, do tomate, do morango e de outras fontes
naturais e é facilmente oxidado quando exposto ao ar,
perdendo as propriedades terapêuticas a ele atribuídas.
A estrutura do ácido ascórbico é a seguinte:
a) Calcule a massa molecular do ácido ascórbico.
b) Explique por que uma solução de bromo em água
(Br2 / H2P) é descorada quando misturada com
uma solução de ácido ascórbico.
Reação I: haleto + sódio → haleto de sódio +
alcano.
Reação II: alceno + água → álcool.
a) Qual dos 4 isômeros de n – hexano pode ser obtido, como único produto orgânico, da reação I?
b) Qual a fórmula estrutural e o nome do composto formado na reação do propeno com água, em meio ácido?
13. (Unirio) Um hidrocarboneto A insaturado e ramificado,
por reação de ozonólise, produz compostos B e C.
O composto C, inicialmente tratado pelo Composto
Grignard, produz o composto intermediário D, que,
por hidrólise produz E. O composto E, em presença de
KMnO4, ou K2Cr2O7, não é oxidado e, por conseguinte,
a reação não se realiza. Com base nessas informações,
podemos afirmar que o composto E é um:
a) aldeído.
b) éter.
c) cetona.
d) álcool.
e) ácido carboxílico.
14. (UFRJ) A crise do petróleo faz ressurgir o interesse
pela produção de hidrocarbonetos a partir de álcool,
que pode ser produzido por fonte de matéria-prima
renovável. O etanol, por exemplo, no Brasil é largamente
produzido a partir da cana-de-açúcar.
a) Escreva a equação da reação utilizada para transformar etanol em eteno.
b) O eteno, produto dessa reação, pode ser utilizado
para a produção de diversos compostos orgânicos
da cadeia petroquímica. Qual é o produto da reação
do eteno com o hidrogênio?
15. (Cesgranrio) Dê as fórmulas estruturais de dois isômeros
de fórmula molecular C3H4, A e B, que apresentam as
seguintes características:
1. um deles é cíclico.
2. um deles possui um grupamento metila.
11. (UFRJ) Os alcenos, devido à presença de insaturação,
são muito mais reativos do que os alcanos. Eles reagem,
por exemplo, com haletos de hidrogênio tornando-se
assim compostos saturados.
3. em presença de paládio finamente dividido, os dois
isômeros reagem com gás hidrogênio; usando-se
quantidades iguais de A e B, o isômero B consome
o dobro de hidrogênio do que A.
a) Classifique a reação entre um alceno e um haleto
de hidrogênio.
16. (Cesgranrio) A respeito dos hidrocarbonetos a seguir,
assinale a opção falsa:
b) Apresente a fórmula estrutural do produto principal
obtido pela reação do HC com um alceno de fórmula
molecular C6H12 que possui um carbono quaternário.
1.
12. (UFRJ) Para a obtenção de alcanos e álcoois, pode-se
fazer uso das seguintes reações genéricas:
10
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_V_QUI_035
7.
2.
d)
CH3 – C – O – C – CH3
O
O
e)
CH3 – C = O
3.
NH2
f)
CH2 – CH2 = NH2
OH
4.
18. No processo de amadurecimento de frutas, uma determinada substância é liberada. Essa substância, que
também é respon­sável pela aceleração do processo, é
um gás cujas moléculas são constituídas apenas por
átomos de hidrogênio e de carbono, numa proporção
de 2:1. Além disso, essa substância é a primeira de uma
série homóloga de compostos orgânicos.
5.
a) Em face das informações acima, é possível explicar
o hábito que algumas pessoas têm de embrulhar
frutas ainda verdes para que amadureçam mais depressa? Justifique.
b) Qual é a fórmula molecular e o nome do gás que
desempenha esse importante papel no amadurecimento das frutas?
a) são todos aromáticos.
b) pertencem todos à mesma série homóloga.
c) suas propriedades físicas variam de forma previsível.
d) são chamados respectivamente: benzeno,; metilbenzeno; 1, 2 dimetil benzeno; 1, 3, 5 trimetil benzeno; 1, 2, 3, 4 tetrametil benzeno.
19. Bodes e cabras possuem um odor muito desagradável.
Os responsáveis por isso são três ácidos, que, quando
descobertos, receberam os nomes de caproico, caprílico e cáprico. Os nomes oficiais desses ácidos
são, respectivamente, haxanoico, octanoico e decanoico.
Escreva as fórmulas estruturais de cada um deles.
e) Possuem a mesma fórmula mínima (CH)n.
17. A quais funções pertencem os seguintes compostos?
a)
O
CH3 – CH2 – C
CH3
b)
EM_V_QUI_035
c)
O
CH3 – CH2 – C
CH3
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
11
B⇒
C⇒
1.
C
4. B
a)
5.
b)
6. A
7.
2.
a)
a)
b)
b) H3C – CH3
3.
A ⇒ H3C – CH2 – CH = CH2
12
A ⇒ H3C – CH2 – CH2 – CH3
B ⇒ H2C = CH – CH2 – CH3
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_V_QUI_035
8.
a) C ⇒
1. B
2.
b) D ⇒
a) Substituição.
b) HBr – ácido bromídrico.
9. C
3.
10. D
a) 5 mols de H2 afim de hidrogenar todas as duplas.
11.
b)
a)
H2C – CH2
H
OH
b)
H2C – CH2
4.
a)
OH
C
c)
H2C – CH2
H
OSO3H
b) nome: 2-butanol.
função: álcool.
12.
a) H3C – CH2 – C
b) H3C – C
C – CH3 + NaBr
C – CH3 + 2 ZnI2
classificação: álcool secundário.
5.
c) H3C – CH2 – CO – CH3
13. 3-pentanol.
14. H2C = CH2 + HC → H3C – CH2 – C
Ar – OH ⇒ fenol
15. C
7.
D
8.
a)
b)
17.
I. OH ⇒ fenol (aromático – OH)
c)
II. éter ⇒ aromático – O – CH3
d)
III. alqueno ⇒ CH2 = CH – CH2
(dupla ligação)
e)
9.
a) butano: C4H10 ⇒ mol = 58g
13 000g
EM_V_QUI_035
Br
6. B
A ureia é a principal amida que existe.
16. A
18.
-
R OOR
+ HBr —
x
30 dias
1 dia
x = 433, 33g/dia
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
13
18.
por pessoa:
1 mol
y
a) Sim, pois embrulhando as frutas, o gás produzido,
fica em maior contato com a fruta, acelerando o
processo de amadurecimento.
58g
144,44g
y = 2, 49mol/dia ⇒ por pessoa
13
O → 4 CO2 + 5 H2O
b) C4H10 +
2 2
b) Trata-se do gás etileno ou eteno, de fórmula molecular C2H4.
10.
19.
Ácido hexanoico ou caproico →
a) massa molecular: C6H8O6 = 176g
b) Porque o bromo ao ser adicionado ao ácido ascórbico quebra a sua dupla ligação descorando assim
a solução.
11.
Ácido octanoico ou caprílico →
Ácido decanoico ou cáprico →
a) Reação de Adição.
b)
12.
a) 2,3-dimetil-butano.
b) (Figura) 2-propanol.
13. D
Pois o álcool terciário não sofre oxidação.
14.
a) Ocorre uma desidratação intramolecular.
H2SO4
H3C – CH2 – OH 170 H2C = CH2 + H2O
b) H2C = CH2 + H2 → H3C – CH3 ⇒ etano
O
15.
A→
B → HC
16. E
C – CH3
17.
a) cetona.
b) fenol.
c) cetona.
d) anidrido.
f) álcool e amina.
14
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_V_QUI_035
e) amida.
EM_V_QUI_035
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
15
EM_V_QUI_035
16
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br