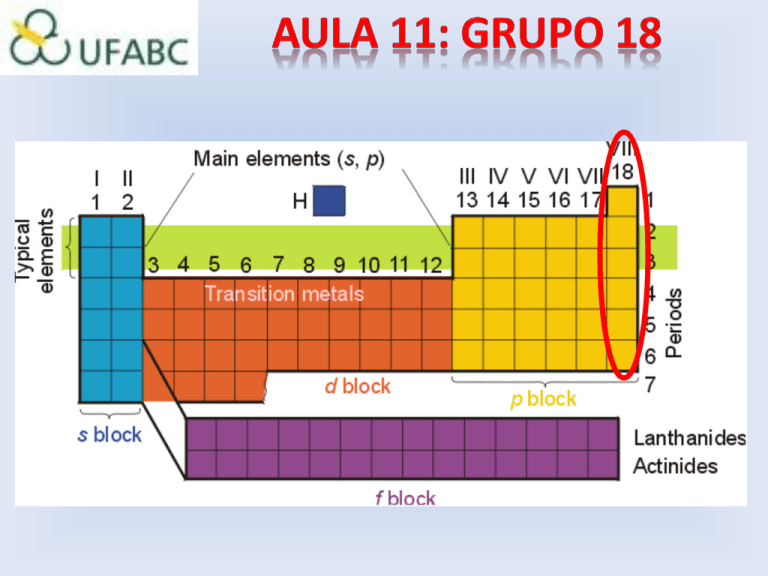
GASES NOBRES
Configuração Eletrônica
He
1s2
Ne
[He] 2s2 2p6
Ar
[Ne] 3s2 3p6
Kr
[Ar] 3d10 4s2 4p6
Xe
[Kr] 4d10 5s2 5p6
Rn
[Xe] 4f14 5d10 6s2 6p6
Z = 10
Propriedades Atômicas
•O raio atômico de todos os elementos é muito pequeno e
aumenta com o aumento do número atômico.
•Todos apresentam afinidade eletrônica próxima de zero
E (g) + e- E- (g)
•As energias de ionização são mais altas que de qualquer outro
E (g) E+ (g) + eelemento
Propriedades Atômicas
• Como a AE e EI são extremas, eles não tendem a formar ligações por
ganho ou perda de elétrons, ocorrendo portanto, como átomos
isolados (monoatômicos).
• As únicas forças que aparecem entre seus átomos são forças de Van
der Waals, muito fracas.
• Com um aumento do raio atômico, a energia de ionização diminui
• Devido a isto, os principais compostos conhecidos dos gases
nobres são formados pelo Xenônio com átomos bastante
eletronegativos, como F e O.
Propriedades Atômicas
• Em condições normais não existem compostos de He, Ne e Ar. O
kriptônio forma somente uma molécula estável, o KrF2.
• Quando excitados por corrente elétrica, os gases nobres emitem luz
em comprimentos de ondas visíveis:
- O Ne emite luz vermelha
- Quando Ne é misturado com Ar, emite azul-esverdeado
- O Kr emite luz branca intensa, usada em sinalização de aeroportos
- O Xe é usado em lâmpadas de halogênio para faróis de carros e flash
de máquinas fotográficas
Ocorrência, Obtenção e Uso
• o mais abundante e mais barato é o Ar (1% da atm)
• o Ar pode ser obtido pela destilação fracionado do
ar líquido ou pela reação de decaimento pelo
potássio
40 K
19
40 Ar
18
+
• He é obtido a partir de depósito de gases naturais
depois de liquefazer os hidrocarbonetos
• Todos os gases nobres não radioativos podem ser
obtidos pela destilação fracionado do ar líquido
•o Rn é radioativo e é obtido pelo decaimento de Ra
e do Th. O isótopos mais estável é o
emissor e tem meia vida de 3,8 dias
222Rn
que é um
Abundância dos gases
nobres na crosta
terrestre, log10
(partes por milhão
atmosféricas em
volume).
• Ar e o He são utilizados para manter uma atmosfera inerte na
soldagem de aços: Ti, Mg e Al ou em reações sensíveis ao ar
• Ar é usado no preenchimento de lâmpadas incandescentes,
lâmpadas fluorescentes, válvulas eletrônicas e contadores GeigerMuller
• He é usado no preenchimento de balões meteorológicos (mais leve
que o ar e não inflamável), dirigíveis e em mistura com O2 compondo
o ar que é respirado pelos mergulhadores em altas profundidades.
• He é utilizado em criogenia (temperaturas extremamente baixa)
• He é utilizado c/o atmosfera inerte no crescimento de cristais de
semicondutores como o de silício
• os gases nobres são usados em luminosos.
• passa para o estado sólido somente quando submetido a
um aumento de pressão
• tem o ponto de ebulição mais baixo de todos os
elementos : 4,2 K
no estado líquido se apresenta em duas
formas:
- hélio I – líquido normal
- hélio II – é um superfluido, ou seja,
um líquido com propriedades de um gás
(capaz de fluir sem viscosidade)
Ocorre quando é resfriado abaixo de 2,1 K
• sua energia é tão baixa que já não existe movimento
térmico dos átomos, mas as forças de interatômicas são
suficientes para formar um líquido
• quando o He-I se converte em He-II ( 2,2 K) suas propriedades
mudam bruscamente:
condutividade elétrica passa a ser 800 vezes maior que a do
cobre, passando a ser um supercondutor
viscosidade passa a ser 1/100 da do hidrogênio gasoso e o
líquido escoa pelas bordas do recipiente
o calor específico, a tensão superficial e a compressibilidade
também são anômalos
Até 1962 não eram conhecidos compostos verdadeiros dos gases
nobres
O primeiro composto de Xe foi sintetizado (Barlett e Lohman) pela
reação com o hexafluoreto de platina:
Xe PtF6
Xe [ PtF6 ]
25o C
• O hexafluoreto de platina é capaz de oxidar também o oxigênio:
PtF6 O2 O2 [PtF6 ]
• desde então vários compostos de Xe com Flúor e Oxigênio tem
sido sintetizados e alguns compostos com ligações Xe-N e Xe-C
tem sido relatados
Principais Compostos
Fluoretos de Xenônio
A estequiometria do composto depende da proporção entre Xe e F2
utilizada:
Xe( g ) F2 ( g ) XeFn ( g )
400o C
1 : 2 XeF2 número de oxidação +2
1 : 5 XeF4 nox +4 (necessário 6 atm de pressão)
1 : 20 XeF6 nox +6 (necessário 60 atm de pressão)
Todos são sólidos de cor branca, sublimam a temperatura ambiente e
são estáveis quando armazenados em recipientes fechados de níquel.
Esses fluoretos reagem com H2 produzindo HF e Xe puro:
XeF4( g ) 2 H 2( g ) 4 HF( g ) Xe( g )
Estrutura eletrônica e ligação nos compostos de xenônio
5s
5p
5d
5s
5p
5d
5s
5p
5d
5s
5p
5d
5s
5p
5d
conf. eletr. do Xe estado
fund.
Configuração eletrônica do
Xe estados excitados
Mas alguns compostos e estruturas são melhor explicadas pela teoria do
orbital molecular
• Os fluoretos de Xe podem ser usados para introduzir outros
compostos de flúor
XeF4 2SF2 Xe SF6
XeF4 Pt Xe PtF4
XeF4 2C6H6 Xe 2C6H5F 2HF
• forte poder oxidante
• Os fluoretos de Xe são usados para produzir os óxidos de
Xenônio
6 XeF4(g) 12 H 2O(l) 4 Xe(g) 2XeO3(g) 24 HF(g) 3 O2(g)
Os fluoretos de xenônio são mais estáveis do que os óxidos e do que
os oxifluoretos
• Altamente explosivo
• Ag. Oxidante muito
forte em meio ácido
E(XeO3, Xe) = +2,10 V
• Os fluoretos de xenônio são compostos de partida na preparação
de compostos de gases nobres com outros elementos além de flúor
e oxigênio
6 XeF2 HN(SO2 F)2 FXeN(SO2 F)2 HF
Bibliografia
• Atkins, P., Jones, L., Princípios de Química - Questionando a Vida Moderna e o Meio Ambiente, 3
ed., Porto Alegre: Bookman, 2006.
•Shriver, D. F., Atkins, P., Química Inorgânica, Ed Artmed, 2003 .
• Lee, J. D., Química Inorgânica Não Tão Concisa. Edgard Blucher Ltda, 3’ ed., São Paulo, 1980