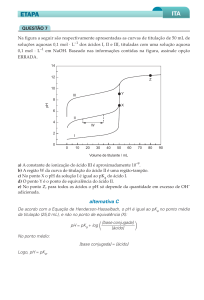
QUÍMICA – 11º ANO- TURMA A 2014/2015
FICHA INFORMATIVA/FORMATIVA SOBRE TITULAÇÕES DE ÁCIDO-BASE E
DE EFEITO TAMPÃO
NOME:____________________________________________________________TURMA__ Nº: ___
Titulações de ácido- base
Nas titulações de ácido –base, as reacções que ocorrem entre entre o ácido e a base designam-se por reacções de
neutralização e conduzem sempre a uma solução de um sal. A palavra neutralização (não significa que a solução
obtida seja necessariamente neutra) usa-se não pelo pH ser 7 ( 25ºC) no ponto de equivalência, mas por aí existir
uma neutralização no sentido em que não há excesso de ácido nem de base: há apenas a solução de sal resultante.
O pH para titulações de ácido forte – base forte é 7, para titulações de ácido forte – base fraca é inferior a 7, para
titulações de ácido fraco – base forte é superior a 7, isto porque os sais podem ser neutros, ácidos ou básicos, como
nos exº:
•
HCl (aq) + NaHO (aq) → Na Cl (aq) + H2O (l)
Na Cl (aq) : pH = 7
A mistura de HCl (aq) com NaHO (aq) resulta numa reacção de neutralização:
H3O+ (aq) + HO-(aq ) → H2 O (l) reacção está que é muito extensa ( K= 1014), dado que é a inversa da autoionização da água.
•
NH3 (aq) + HCl (aq ) → NH4 Cl (aq)
•
CH3COOH (aq) + NaHO (aq) → NaCH3COO (aq) + H2O (l)
NH4 Cl (aq) : pH ˂ 7
NaCH3COO (aq) : pH ˃ 7
As soluções de:
- cloreto de sódio são neutras porque nenhum dos seus iões constituintes ( Na+ ; Cl_) reagem com a
água ( ou seus iões), ou seja não há reacção de hidrólise;
- cloreto de amónio são ácidas porque apenas os seus iões amónio ( N H4+ ) reagem com a água , ou seja
sofrem hidrólise, como ácido ( NH 4+ (aq) + H2O(l) ⇄ NH3 (aq) + H 3 O + (aq) ), contribuindo para o aumento
da concentração dos iões H3O+ na solução.
- acetato de sódio são básicas porque só os seus iões acetato (CH3COO- ) experimentam hidrólise, como
base (CH3COO- (aq) + H2O(l) ⇄ CH3COOH (aq) + HO − (aq) ), contribuindo para o aumento da concentração
dos iões HO- na solução.
Curvas de titulação
Durante a realização de uma titulação, o pH da mistura vai-se alterando. Chama-se curva de titulação à
representação gráfica dos valores de pH do titulado em função do volume de titulante adicionado, como se
esquematiza na FIGURA1.
O ponto de equivalência é o ponto em que o ácido e base estão nas proporções estequiométricas da
reacção e corresponde ao ponto de inflexão da curva de titulação, isto é, é o ponto em que a inclinação da curva
1
passa de crescente a decrescente (ou vice-versa]. O ponto de equivalência é definido por duas coordenadas: o
volume equivalente lido no eixo das abcissas, Ve, e o pH equivalente lido no eixo das ordenadas, pHe.
•
Titulação Ácido Forte – Base Forte
Na titulação de um ácido forte com uma base forte, o pH começa por um valor baixo, subindo
lentamente enquanto a solução é ácida. Até próximo do ponto de equivalência a subida do pH é
pequena mas aumenta significativamente (forma de degrau) na passagem pelo ponto de
equivalência, isto é, uma gota da solução de titulante é suficiente para que o pH passe de 3-4
para cerca de 10. Imediatamente depois, o pH sobe lentamente devido ao excesso da base, mas
uma vez mais ligeiramente, dado que a função pH é uma função logarítmica.
Na figura 1 apresenta-se uma "curva de titulação" de uma solução de HCl com NaHO, isto é, uma curva em que
se representa a variação do pH da solução de HCl em função do volume de NaHO adicionado da bureta. Como se
pode observar, o pH vai subindo com a adição de base, até se atingir um ponto em que o pH é igual a 7, o chamado
"ponto de equivalência". Neste ponto, a quantidade de base adicionada é igual à quantidade de ácido que existia
inicialmente na solução. O pH no ponto de equivalência só é igual a 7 se as espécies que reagem forem ambas fortes.
Quando se troca a localização das soluções, ou seja, quando se usa a solução ácida como titulante e a solução
básica como titulado, a variação de pH durante a titulação é ao contrário (figura 2).
Figura 1
•
Figura 2
Titulação de uma base fraca com um ácido forte
Quando se passa a titular uma base fraca com um ácido forte, a curva
adquire um perfil como o da fig 3, sendo o pH no ponto de equivalência inferior
a
7. Até lá, o pH resulta quer da presença de base por titular quer do sal da
solução (entretanto formado).
Titulação do amoníaco com ácido clorídrico.
NH3 (aq) + HCl (aq) → NH 4+ (aq) + Cl-(aq)
Figura 3
2
No ponto de equivalência a solução vai ter carácter ácido, uma vez que o catião amónio, NH 4+ , é um ácido e o
anião cloreto é uma espécie neutra.
NH 4+ (aq) + H2O(l) ⇄ NH3 (aq) + H 3 O + (aq)
No caso de uma titulação de um ácido forte com uma base fraca, a curva de
titulação é similar; agora o pH vai aumentando (figura 4).
Titulação de um ácido fraco com uma base forte
Figura 4
Consideremos, por exemplo, a titulação do ácido acético com hidróxido de
sódio:
CH3COOH (aq) + NaHO (aq) → CH3COO- (aq) + Na+ (aq) + H2O (l)
Se a quantidade de hidróxido de sódio adicionado for igual à de ácido
acético (isto é, no ponto de equivalência), a solução vai ter um carácter básico, uma
vez que o anião acetato que se formou é uma base e o catião sódio é uma espécie
neutra.
Figura 5
-
-
CH3COO (aq) + H2O (l) ⇄ CH3COOH (aq) + HO (aq)
A forma como o pH varia no decurso da titulação pode ser observada
na figura 5. No caso de uma titulação de uma base forte com um ácido fraco, a
curva de titulação é similar; agora o pH vai diminuindo (figura 6).
Em todos os casos, na prática, o que se determina de facto é o chamado "ponto
final" da titulação que deve ser praticamente coincidente com o ponto de
Figura 6
•
equivalência.
Efeito tampão
Nas titulações de ácido fraco-base forte ou de base fraca-ácido forte há uma fase, antes do ponto de
equivalência, em que acréscimos consideráveis de titulante provocam variações diminutas do pH. Este efeito
também se faz sentir em soluções muito ácidas ou muito alcalinas e designa-se por efeito tampão, uma vez que a
adição de um pouco de ácido a uma solução muito ácida pouca alteração de pH produz, tal como de um pouco de
base.
Soluções tampão-são soluções que resistem a variações bruscas de pH provocadas pela adição de ácidos
ou de bases.
Soluções tampão de pH intermédio exige a presença,simultânea e em quantidades apreciáveis de um ácido e
de uma base, necessariamente fracos. Estando o ácido, HA, em concentração apreciável, reage com a base que se
adicione (desde que não em demasia), sem praticamente alterar a sua concentração. Da mesma forma, a base, B,
3
por estar em apreciável concentração, reage com o ácido que se adicione (desde que não em demasia), sem
praticamente alterar a sua concentração.
As soluções tampão têm grande interesse laboratorial, ambiental e biológico.
Exemplos:
•
•
•
Nos laboratórios- soluções padrão para a calibração de medidores de pH;
Regulação do comportamento tampão da água do mar (pH=8) pelo par conjugado CO2/ HCO3−
Manutenção do pH do sangue arterial em 7,4 e do sangue venoso um pouco inferior, devido a maior
−
concentração de CO . Esta manutenção é igualmente devida à acção tampão do CO2/ HCO3 que
2
corresponde a o equilíbrio:
CO2 (aq) +2 H2O (l) ⇄ HCO3− (aq) + H3O+ (aq)
As concentrações de CO2 e de HCO3− são reguladas pelo sistema respiratório e pelo sistema urinário ( um
dos efeitos das grandes altitudes é a subida de pH devido à eliminação de CO2 pela respiração mais rápida)
Indicadores ácido-base
Numa titulação não é indiferente empregar um indicador qualquer. Analisando a tabela seguinte, podemos
verificar que os indicadores apresentam zonas de viragem com limites diferentes.
Indicador
Forma ácida
Zona de viragem
Forma básica
Azul de timol
vermelha
1,2 – 2,8
Amarela
Alaranjado de metilo
vermelha
3,1 – 4,5
amarela
Vermelho de metilo
vermelha
4,2 – 6,3
Amarela
Tornassol
vermelha
5,0 – 8,0
Azul
Azul de bromotimol
amarela
6,0 – 7,6
Azul
Fenolftaleína
incolor
8,3 – 10,0
Rosa carmim-Vermelha
Amarelo de alizarina
amarela
10,0 – 12,1
vermelha
Devemos procurar que o indicador mude de cor bruscamente e o mais próximo possível do pH
correspondente ao ponto de equivalência. O pHeq só é 7,0 para o caso de o ácido e a base serem ambos fortes.
Se a zona de viragem do indicador estiver contida na zona de variação brusca de pH e englobar o pH do
ponto de equivalência, poderemos detectar visualmente uma mudança súbita na cor da solução e o “ponto final”
será praticamente coincidente com o “ponto de equivalência”.
Como a curva de titulação é quase vertical nessa zona, a adição de
uma gota de titulante é suficiente para se observar uma mudança brusca de
cor ao passar de Vi para Vf (compare na FIGURA 7 as passagens de V1 para V2 e
de Vi para Vf, sendo Vf -Vi = V2 – V1).
A incerteza com que vem afectado o volume equivalente (Ve) é tanto mais
pequena quanto menor for a diferença entre Vi e Vf:
Vi < Ve < Vf
Figura 7
4
Para isso, é necessário que:
1. a variação do valor de pH na vizinhança de Ve seja abrupta;
2. a zona de viragem do indicador seja bastante estreita;
3. a zona de viragem esteja localizada na parte abrupta da curva de titulação;
4. a zona de viragem contenha o ponto de equivalência.
Exemplo
Considera uma titulação em que as coordenadas do ponto de equivalência são (25,00 ml; 7,00] e em que o
valor do pH da solução passa de 3,70 para 10,30 quando o volume de titulante adicionado passa de 24,90 ml para
25,10 ml. Que indicador escolherias de entre os listados na tabela?
Resolução:
Para uma pequena variação de volume [0,20 ml) na vizinhança do volume equivalente, há um grande salto
de pH (∆pH = 6,60) - a condição 1 é satisfeita.
Dos indicadores listados na tabela, há quatro que apresentam zona de viragem localizada entre os dois
valores de pH referentes ao salto abrupto [de 3,70 para 10,30) - satisfazem a condição 3:
•
o vermelho de metilo (4,2-6,3);
•
o tornassol (5,0-8,0);
•
o azul de bromotimol (6,0-7,6);
•
a fenolftaleína (8,3-10,0).
As zonas de viragem do azul de bromotimol e do tornassol contêm o ponto de equivalência da curva de
titulação (Figuras A e B) - ambos satisfazem a condição 4. Os outros dois indicadores não satisfazem a esta
condição (FIGURA C). O azul de bromotimol tem a vantagem de a sua zona de viragem (6,0-7,6) ser mais estreita
que a do tornassol (5,0-8,0), proporcionando uma mudança de cores mais nítidas - condição 2.
Conclusão: Optar-se-ia pelo azul de bromotimol como indicador nesta titulação de ácido forte por base forte .
Exercícios:
1.
O volume de solução de H2SO4 0,600 mol dm-3 que é necessário para neutralizar 20,0 ml de solução de
Ba(HO)2 0,300 mol dm-3 é:
(a) 10,00 ml
(b) 20,00 ml c) 30,00 ml (d) 40,0 ml
5
2. Para titular 10,00 ml de uma solução de HNO3 0,200 mol dm-3, pode utilizar-se:
(a) 20,00 ml de uma solução de NaHO 0,200 mol dm-3 .
(b) 10,00 ml de uma solução de KHO 0,200 mol dm-3 .
(c) 10,00 ml de uma solução de Ba(HO)2 0,100 mol dm-3.
(d) 5,00 ml de solução de NaHO 0,200 mol dm-3.
3.
A partir dos valores de Ka e de Kb para o HCO3− , respectivamente 4,7 x 10-11 e 2,2 x 10-8 , indique,
justificando, se as soluções de bicarbonato de sódio são ácidas, básicas ou neutras.
4.Em qualquer titulação ácido-base, pode determinar-se a variação de pH com a adição de titulante e, com esses,
valores, traçar a curva de titulação, que permite identificar o volume equivalente e o pH do ponto de
equivalência. Considera três titulações A, B e C.
A -HCl(aq) com NaHO (aq);
B - NH3(aq) com HBr(aq);
C - CH3COOH(aq) com NaHO(aq).
4.1. Associa às titulação, A e C, a curva de titulação, 1,2,3 ou 4, que melhor lhe corresponde.
4.2. Alguns dos gráficos anteriores apresentam incorreções. Identifica-os.
4.3.O ponto de equivalência pode ser detectado com um indicador ácido-base. Faz uma associação correcta entre
as titulações A, B e C e os indicadores ácido-base que constam da tabela.
5. Misturou-se, a temperatura de 25 °C, 20,0 ml de solução de NaHO, 0,200 mol dm-3 ,com 20,0 ml de solução de
HCl 0,100 mol dm-3. A solução resultante apresentará:
(a)[Na+] = 0,100 mol dm-3.
(b) [H3O+] = 0,100 mol dm-3.
(c) pH = 12,7.
(d) [HO-] = 0,0500 mol dm-3 .
6. O rotulo de um produto de limpeza indica que a concentracao massica de amoniaco (NH3) e de 9,5 g dm-3. Com
o intuito de verificar se a concentração de amoníaco corresponde a indicada no rotulo, titularam-se 5,00 ml desse
produto com acido clorídrico de concentração 0,100 mol dm-3; gastou-se o volume de 25,00 ml de ácido.
A concentração correcta da solução de amoníaco é:
(a) 0,12 mol dm-3
(b) 0,25 mol dm-3
(c) 0,20 mol dm-3
(d) 0,50 mol dm-3
7. Para titular 10,00 ml de uma solução de ácido metanóico, HCOOH (Ka = 1,8 x 10 -4, a 25 °C), gastou-se o volume
de 22,24 ml de uma solução de hidróxido de sódio, NaHO, de concentração molar 0,150 mol dm-3.
7.1. Escreve a equação química que traduz esta reacção.
7.2. Calcula a concentração molar da solução ácida. (solução : 0,334 mol/dm3)
7.3. Calcula o valor da constante de basicidade, Kb, do ião metanoato (HCOO-).(Solução: kb=5,6 x10-11)
7.4. No ponto de equivalência, o titulado apresenta características ácidas, neutras ou alcalinas? Justifique.
6
8.Titularam-se 20,00 ml de solução de HCl de concentração molar 0,100 mol dm-3, com uma solução de KHO de
concentração molar 0,100 mol dm-3, a 25 °C.
8.1. Calcula o volume de solução alcalina necessário para se atingir o ponto de equivalência. (Solução: 20,00 ml)
8.2.Determina o pH na solução inicial e no ponto de equivalência. (Solução: pH = 1,00; no ponto de equivalência, pH
= 7,0)
9.Durante uma titulação ácido-base, o pH do titulado varia à medida que se adiciona titulante. Numa determinada
experiência, o titulado é uma solução de NaHO de concentração molar 0,100 mol dm-3, com o volume de 20,00 ml, e
o titulante é uma solução de HCl de concentração molar 0,100 mol dm-3. Calcule o pH do titulado:
9.1 no início, antes da adição de titulante; (Solução: pH = 13,0)
9.2. após a adição de 5,00 ml de titulante; (Solução: pH = 12,8)
9.2 após a adição de 25,00 ml de titulante. (Solução: pH = 1,95)
10. Classifica em verdadeira (V) ou falsa (F) cada uma das seguintes afirmações.
(a) Numa titulação ácido-base, o pH do ponto de equivalência é sempre 7.
(b) A titulação de um volume V de solução de HCl 0,10 mol dm-3 ou de uma solução de HF (ácido fraco), também
0,10 mol dm-3, consome a mesma quantidade de base.
(c) O pH do ponto de equivalência de uma titulação ácido-base deve estar sempre contido na zona de viragem do
indicador utilizado.
(d) A zona de viragem de um indicador ácido-base corresponde ao intervalo de pH em que não é predominante
qualquer das cores desse indicador.
11 A figura mostra as curvas de titulação de 30,0 ml de diferentes ácidos monopróticos (I, II, III e IV), todos cuja
concentração molar é 0,100 mol dm-3, com uma solução aquosa de 0,100 mol dm-3 de NaHO.
As zonas de viragem dos indicadores fenolftaleína e vermelho de metilo são,
respetivamente, 8,3 < pH < 10,0 e 4,4 < pH < 6,2.
Classifica em verdadeira (V) ou falsa (F) cada uma das afirmações.
(a) O indicador vermelho de metilo e mais adequado do que a
fenolftaleína para ser utilizado na titulação do ácido IV.
(b) O indicador vermelho de metilo é mais adequado do que a
fenolftaleína para ser utilizado na titulação do ácido II.
(c) O ácido III e mais forte do que o ácido II.
(d) O ácido I e mais forte do que o ácido III.
(e) Os dois indicadores são adequados para a titulação do ácido I.
(f) Os dois indicadores são adequados para a titulação do ácido III.
(g) O volume equivalente e de 30,0 ml.
(h) Só existe uma titulação com pH = 7 no ponto de equivalência.
7