www.arquivosonline.com.br
Sociedade Brasileira de Cardiologia • ISSN-0066-782X • Volume 105, Nº 3, Setembro 2015
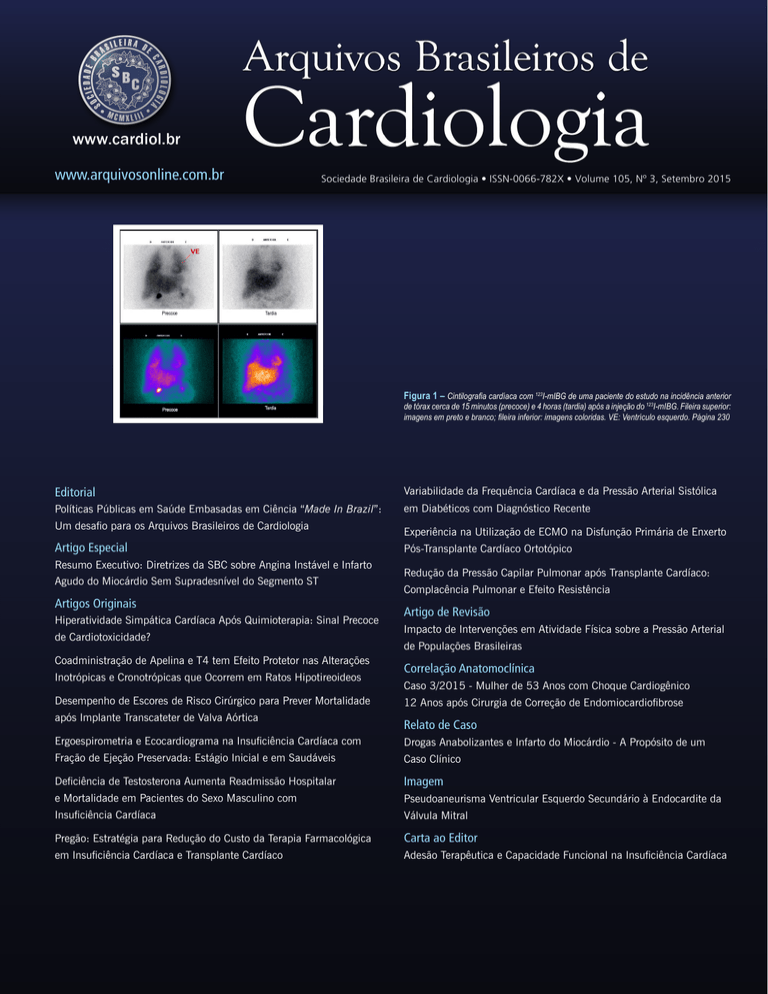
Figura 1 – Cintilografia cardíaca com 123I-mIBG de uma paciente do estudo na incidência anterior
de tórax cerca de 15 minutos (precoce) e 4 horas (tardia) após a injeção do 123I-mIBG. Fileira superior:
imagens em preto e branco; fileira inferior: imagens coloridas. VE: Ventrículo esquerdo. Página 230
Editorial
Variabilidade da Frequência Cardíaca e da Pressão Arterial Sistólica
Políticas Públicas em Saúde Embasadas em Ciência “Made In Brazil”:
em Diabéticos com Diagnóstico Recente
Um desafio para os Arquivos Brasileiros de Cardiologia
Artigo Especial
Resumo Executivo: Diretrizes da SBC sobre Angina Instável e Infarto
Agudo do Miocárdio Sem Supradesnível do Segmento ST
Artigos Originais
Hiperatividade Simpática Cardíaca Após Quimioterapia: Sinal Precoce
de Cardiotoxicidade?
Coadministração de Apelina e T4 tem Efeito Protetor nas Alterações
Inotrópicas e Cronotrópicas que Ocorrem em Ratos Hipotireoideos
Desempenho de Escores de Risco Cirúrgico para Prever Mortalidade
após Implante Transcateter de Valva Aórtica
Experiência na Utilização de ECMO na Disfunção Primária de Enxerto
Pós-Transplante Cardíaco Ortotópico
Redução da Pressão Capilar Pulmonar após Transplante Cardíaco:
Complacência Pulmonar e Efeito Resistência
Artigo de Revisão
Impacto de Intervenções em Atividade Física sobre a Pressão Arterial
de Populações Brasileiras
Correlação Anatomoclínica
Caso 3/2015 - Mulher de 53 Anos com Choque Cardiogênico
12 Anos após Cirurgia de Correção de Endomiocardiofibrose
Relato de Caso
Ergoespirometria e Ecocardiograma na Insuficiência Cardíaca com
Drogas Anabolizantes e Infarto do Miocárdio - A Propósito de um
Fração de Ejeção Preservada: Estágio Inicial e em Saudáveis
Caso Clínico
Deficiência de Testosterona Aumenta Readmissão Hospitalar
Imagem
e Mortalidade em Pacientes do Sexo Masculino com
Pseudoaneurisma Ventricular Esquerdo Secundário à Endocardite da
Insuficiência Cardíaca
Válvula Mitral
Pregão: Estratégia para Redução do Custo da Terapia Farmacológica
Carta ao Editor
em Insuficiência Cardíaca e Transplante Cardíaco
Adesão Terapêutica e Capacidade Funcional na Insuficiência Cardíaca
A experiência faz diferença
na escolha do tratamento do DM2 2,10
Primeiro inibidor de SGLT2 do Brasil12
Controle glicêmico com perda de peso1
Uma vez ao dia, sem titulação de dose1
ELIMINA
EM MÉDIA 70g DE GLICOSE POR DIA1,7-9
FORXIGA® (dapagliflozina) comprimidos revestidos. USO ORAL. USO ADULTO. Reg. MS - 1.0180.0404. FORXIGA® (dapagliflozina) é um inibidor do cotransportador sódio-glicose 2 (SGLT2) que melhora o controle glicêmico em pacientes com
diabetes mellitus tipo 2, através da redução da reabsorção renal de glicose e consequente excreção do excesso de glicose na urina. INDICAÇÕES: FORXIGA® é indicado como adjuvante a dieta e exercícios para melhora do controle glicêmico em pacientes
com diabetes mellitus tipo 2 em monoterapia ou em combinação com metformina, uma tiazolidinediona, uma sulfonilureia ou insulina (isolada ou com até duas medicações antidiabéticas orais), quando a terapia existente juntamente com dieta e exercícios
não proporciona controle glicêmico adequado. Indicado em combinação inicial com metformina quando ambas as terapias são apropriadas. CONTRAINDICAÇÕES: FORXIGA® é contraindicado a pacientes com conhecida hipersensibilidade a dapagliflozina
ou aos outros componentes da fórmula. ADVERTÊNCIAS E PRECAUÇÕES: FORXIGA® não é indicado para uso por pacientes com diabetes tipo 1 e não deve ser utilizado para o tratamento de cetoacidose diabética. FORXIGA® não deve ser usado
em pacientes com insuficiência renal moderada a grave (taxa de filtração glomerular estimada [TFGe] persistentemente < 45 mL/min/1,73m2 calculada pela fórmula de Modificação da Dieta na Doença Renal [MDRD da sigla em inglês] ou depuração
de creatinina [ClCr] persistentemente < 60 mL/min calculado pela fórmula de Cockcroft-Gault) ou doença renal em fase terminal (ESRD). Pacientes com diabetes e doença cardiovascular: o perfil de segurança de FORXIGA® em estudos nessa
população específica foi consistente com o de FORXIGA® na população dos estudos clínicos em geral. Pacientes com risco de depleção de volume: deve-se considerar a suspensão temporária de FORXIGA® em pacientes que desenvolverem depleção
de volume. Infecções do trato urinário: a excreção urinária de glicose pode estar associada com aumento no risco de infecções do trato urinário, portanto, a suspensão temporária de FORXIGA® deve ser considerada no tratamento de pielonefrite ou
sepse urinária. Uso com medicações conhecidas por causar hipoglicemia: uma dose menor de insulina ou de secretagogos de insulina pode ser necessária para reduzir o risco de hipoglicemia em combinação com FORXIGA®. Gravidez: não deve
ser usado no segundo e terceiro trimestres de gravidez. Não existem estudos adequados e bem controlados de FORXIGA® em mulheres grávidas. Quando a gravidez for detectada, FORXIGA® deve ser descontinuado. Categoria de risco na gravidez:
C - Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião dentista. Lactação: FORXIGA® não deve ser utilizado em mulheres que estejam amamentando. Uso pediátrico: segurança e
eficácia de FORXIGA® em pacientes pediátricos não foram estabelecidas. Uso geriátrico: não são recomendadas alterações de dose de FORXIGA® com base na idade. REAÇÕES ADVERSAS: a interrupção do tratamento devido a eventos adversos em
pacientes que receberam FORXIGA® 10 mg foi de 4,3% em comparação com 3,6% para o grupo placebo. Os eventos mais comuns foram: infecção genital, infecção do trato urinário, dor nas costas e poliúria. Verificar a bula completa do produto para
maiores informações. INTERAÇÕES MEDICAMENTOSAS: o metabolismo de dapagliflozina é mediado principalmente pela UGT1A9-dependente da conjugação glicuronídeo. Em estudos realizados em indivíduos sadios, a farmacocinética da dapagliflozina
não foi alterada pela metformina, pioglitazona, sitagliptina, glimepirida, voglibose, hidroclorotiazida, bumetanida, valsartana ou sinvastatina. Após o uso concomitante de dapagliflozina com rifampicina ou ácido mefenâmico, não houve qualquer efeito
clinicamente significativo na eliminação de glicose na urina em 24 horas. Em estudos conduzidos em indivíduos sadios, a dapagliflozina não alterou significativamente a farmacocinética da metformina, pioglitazona, sitagliptina, glimepirida, hidroclorotiazida,
bumetanida, valsartana, sinvastatina, digoxina ou varfarina. Outras interações: os efeitos da dieta, tabagismo, produtos à base de plantas e uso de álcool sobre a farmacocinética da dapagliflozina não foram especificamente estudados. POSOLOGIA: a
dose recomendada de FORXIGA®, em monoterapia ou terapia combinada, é 10 mg, uma vez ao dia, a qualquer hora do dia, independentemente das refeições. Para pacientes em risco de depleção de volume devido a condições coexistentes, uma dose inicial
de 5 mg de FORXIGA® pode ser apropriada. Não são necessários ajustes de dose de FORXIGA® com base na função renal ou hepática. Para maiores informações, consulte a bula completa do produto. FRX006_min.Rev0114. VENDA SOB PRESCRIÇÃO
MÉDICA. SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
Referências bibliográficas: 1. Forxiga® (dapagliflozina) comprimidos [bula do medicamento]. São Paulo, SP. Bristol-Myers Squibb Farmacêutica S.A.; 2014. 2. Garber AJ, Abrahamson MJ, Barzilay JI, Blonde L, Bloomgarden
ZT, Bush MA, Dagogo-Jack S, Davidson MB, Einhorn D, Garvey WT, Grunberger G, Handelsman Y, Hirsch IB, Jellinger PS, McGill JB, Mechanick JI, Rosenblit PD, Umpierrez G, Davidson MH; American Association of Clinical
Endocrinologists. AACE comprehensive diabetes management algorithm 2013. Endocr Pract. 2013;19(2):327-336. 3. IMS NPA Marketing Dinamics, October/2014. 4. Cegedim Estrategics Data Longitudinal Patients Databasis,
October/2014. 5. FDA. Dapagliflozin BMS-513148 Endocrinologic and Metabolic Drugs Advisory Committee Meeting. December 12, 2013. http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/
EndocrinologicandMetabolicDrugsAdvisoryCommittee/UCM379659.pdf. Acessado em 10 de Março 2014. 6. Del Prato S, Nauck MA, Durán-Garcia S, Rohwedder K, Theuerkauf A, Langkilde AM, Parikh SJ. Durability of Dapagliflozin
vs Glipizide as Add-on Therapies in T2DM Inadequately Controlled on Metformin: 4-year Data. [abstract no. 62-LB]. 73rd Scientific Sessions of the American Diabetes Association; 2013 June 21–25; Chicago, Illinois, USA. 7. Wright
EM. Renal Na(+)-glucose cotransporters. Am J Physiol Renal Physiol. 2001;280(1):F10-F18. 8. Lee YJ, Lee YJ, Han HJ. Regulatory mechanisms of Na(+)/glucose cotransporters in renal proximal tubule cells. Kidney Int Suppl.
2007;(106):S27-S35. 9. Hummel CS, Lu C, Loo DD, Hirayama BA, Voss AA, Wright EM. Glucose transport by human renal Na+/D-glucose cotransporters SGLT1 and SGLT2. Am J Physiol Cell Physiol. 2011;300(1):C14-21. 10. Garber
AJ, Abrahamson MJ, Barzilay JI, Blonde L, Bloomgarden ZT, Bush MA, Dagogo-Jack S, Davidson MB, Einhorn D, Garvey WT, Grunberger G, Handelsman Y, Hirsch IB, Jellinger PS, McGill JB, Mechanick JI, Rosenblit PD, Umpierrez GE,
Davidson MH. American Association of Clinical Endocrinologists’ comprehensive diabetes management algorithm 2013 consensus statement--executive summary. Endocr Pract. 2013;19(3):536-557. 11. ClinicalTrials.gov. Identifier:
NCT01730534. Acessado no dia 04 Novembro 2014 em: ClinicalTrials.gov. 12. Resolução - RE Nº- 2.234, de 28 de Junho de 2013. Dapagliflozina: registro de medicamento novo. Diário Oficial da União 2013; 124(Supl):pp18.
* Para pacientes com risco de depleção de volume devido a condições coexistentes, uma dose inicial de 5 mg de FORXIGA® pode ser apropriada.
** Pacientes em estudos concluídos5 e estudos em andamento.11
FOR.14.J.255 – Produzido em outubro/2014.
CONTRAINDICAÇÕES: FORXIGA® é contraindicado a pacientes com conhecida hipersensibilidade a dapagliflozina
ou aos outros componentes da fórmula. INTERAÇÕES MEDICAMENTOSAS: em estudos realizados em indivíduos
sadios, a farmacocinética da dapagliflozina não foi alterada pela metformina, pioglitazona, sitagliptina, glimepirida,
voglibose, hidroclorotiazida, bumetanida, valsartana ou sinvastatina.
Material destinado ao profissional de saúde.
www.unidiabetes.com.br
REVISTA DA SOCIEDADE BRASILEIRA DE CARDIOLOGIA - Publicada desde 1948
Sumário - Contents
Editorial
Políticas Públicas em Saúde Embasadas em Ciência “Made In Brazil”: Um desafio para os
Arquivos Brasileiros de Cardiologia
Public Health Policy Based on “Made-In-Brazil” Science: A Challenge for the Arquivos Brasileiros de Cardiologia
Jussiely Cunha Oliveira e José Augusto Barreto-Filho
..................................................................................................................................................................página 211
Artigo Especial - Special Article
Resumo Executivo: Diretrizes da SBC sobre Angina Instável e Infarto Agudo do Miocárdio Sem
Supradesnível do Segmento ST
SBC Guidelines on Unstable Angina and Non-ST-Elevation Myocardial Infarction: Executive Summary
Gilson Soares Feitosa-Filho, Luciano Moreira Baracioli, Carlos José Dornas G. Barbosa, André Franci, Ari
Timerman, Leopoldo Soares Piegas, José Antônio Marin-Neto, José Carlos Nicolau
..................................................................................................................................................................página 214
Artigos Originais - Original Articles
Cardiologia Nuclear e PET
Hiperatividade Simpática Cardíaca Após Quimioterapia: Sinal Precoce de Cardiotoxicidade?
Cardiac Sympathetic Hyperactivity after Chemotherapy: Early Sign of Cardiotoxicity?
Sarita Lígia Pessoa de Melo Machado Guimarães, Simone Cristina Soares Brandão, Luciana Raposo Andrade,
Rafael José Coelho Maia, Brivaldo Markman Filho
..................................................................................................................................................................página 228
Eletrofisiologia/Arritmias
Coadministração de Apelina e T4 tem Efeito Protetor nas Alterações Inotrópicas e Cronotrópicas
que Ocorrem em Ratos Hipotireoideos
Co-administration of Apelin and T4 Protects Inotropic and Chronotropic Changes Occurring in Hypothyroid Rats
Zahra Akhondali, Mohammad Badavi, Mahin Dianat, Farzaneh Faraji
..................................................................................................................................................................página 235
Hemodinâmica – Adultos
Desempenho de Escores de Risco Cirúrgico para Prever Mortalidade após Implante Transcateter
de Valva Aórtica
Performance of Surgical Risk Scores to Predict Mortality after Transcatheter Aortic Valve Implantation
Leonardo Sinnott Silva, Paulo Ricardo Avancini Caramori, Antonio Carlos Bacelar Nunes Filho, Marcelo Katz,
João Carlos Vieira da Costa Guaragna, Pedro Lemos, Valter Lima, Alexandre Abizaid, Flavio Tarasoutchi, Fabio
S. de Brito Jr
..................................................................................................................................................................página 241
Arquivos Brasileiros de Cardiologia - Volume 105, Nº 3, Setembro 2015
Insuficiência Cardíaca
Ergoespirometria e Ecocardiograma na Insuficiência Cardíaca com Fração de Ejeção Preservada:
Estágio Inicial e em Saudáveis
Ergospirometry and Echocardiography in Early Stage of Heart Failure with Preserved Ejection Fraction and in Healthy Individuals
Eduardo Lima Garcia, Márcio Garcia Menezes, Charles de Moraes Stefani, Luiz Cláudio Danzmann, Marco
Antonio Rodrigues Torres
..................................................................................................................................................................página 248
Deficiência de Testosterona Aumenta Readmissão Hospitalar e Mortalidade em Pacientes do
Sexo Masculino com Insuficiência Cardíaca
Testosterone Deficiency Increases Hospital Readmission and Mortality Rates in Male Patients with Heart Failure
Marcelo Rodrigues dos Santos, Ana Luiza Carrari Sayegh, Raphaela Vilar Ramalho Groehs, Guilherme Fonseca,
Ivani Credidio Trombetta, Antônio Carlos Pereira Barretto, Marco Antônio Arap, Carlos Eduardo Negrão, Holly
R. Middlekauff, Maria-Janieire de Nazaré Nunes Alves
..................................................................................................................................................................página 256
Pregão: Estratégia para Redução do Custo da Terapia Farmacológica em Insuficiência Cardíaca e
Transplante Cardíaco
Reverse Auction: A Potential Strategy for Reduction of Pharmacological Therapy Cost
Sara Michelly Gonçalves Brandão, Victor Sarli Issa, Silvia Moreira Ayub-Ferreira, Samantha Storer, Bianca Gigliotti
Gonçalves, Valter Garcia Santos, Nelson Carvas Junior, Guilherme Veiga Guimarães, Edimar Alcides Bocchi
..................................................................................................................................................................página 265
Outros Testes Diagnósticos (Não de Imagem)
Variabilidade da Frequência Cardíaca e da Pressão Arterial Sistólica em Diabéticos com
Diagnóstico Recente
Heart Rate and Systolic Blood Pressure Variability on Recently Diagnosed Diabetics
Anaclara Michel-Chávez, Bruno Estañol, José Antonio Gien-López, Adriana Robles-Cabrera, María Elena
Huitrado-Duarte, René Moreno-Morales, Brayans Becerra-Luna
..................................................................................................................................................................página 276
Transplante Cardíaco – Cirurgia
Experiência na Utilização de ECMO na Disfunção Primária de Enxerto Pós-Transplante Cardíaco Ortotópico
Experience of ECMO in Primary Graft Dysfunction after Orthotopic Heart Transplantation
Elson Borges Lima, Claudio Ribeiro da Cunha, Vitor Salvatore Barzilai, Marcelo Botelho Ulhoa, Maria Regina de
Barros, Camila Scatolin Moraes, Letycia Chagas Fortaleza, Nubia Wellerson Vieira, Fernando Antibas Atik
..................................................................................................................................................................página 285
Transplante Cardíaco – Clínico
Redução da Pressão Capilar Pulmonar após Transplante Cardíaco: Complacência Pulmonar e
Efeito Resistência
Lowering Pulmonary Wedge Pressure after Heart Transplant: Pulmonary Compliance and Resistance Effect
Nádia Moreira, Rui Baptista, Susana Costa, Fátima Franco, Mariano Pêgo, Manuel Antunes
..................................................................................................................................................................página 292
Arquivos Brasileiros de Cardiologia - Volume 105, Nº 3, Setembro 2015
Artigo de Revisão - Review Article
Impacto de Intervenções em Atividade Física sobre a Pressão Arterial de Populações Brasileiras
Impact of Physical Activity Interventions on Blood Pressure in Brazilian Populations
Vivian Freitas Rezende Bento, Flávia Barbizan Albino, Karen Fernandes de Moura, Gustavo Jorge Maftum,
Mauro de Castro dos Santos, Luiz César Guarita-Souza, José Rocha Faria Neto, Cristina Pellegrino Baena
..................................................................................................................................................................página 301
Correlação Anatomoclínica - Anatomopathological Session
Caso 3/2015 - Mulher de 53 Anos com Choque Cardiogênico 12 Anos após Cirurgia de Correção
de Endomiocardiofibrose
Case 3/2015 – 53-Year-Old Female with Cardiogenic Shock 12 Years after Surgical Correction of Endomyocardial Fibrosis
Michel Abi Kalansky Ponczek, Fernanda Seligmann Feitosa, Léa Maria Macruz Ferreira Demarchi
..................................................................................................................................................................página 309
Relato de Caso - Case Report
Drogas Anabolizantes e Infarto do Miocárdio - A Propósito de um Caso Clínico
Anabolic Drugs and Myocardial Infarction – A Clinical Case Report
Rui Pontes Santos, Adriana Pereira, Henrique Guedes, Carolina Lourenço, João Azevedo, Paula Pinto
..................................................................................................................................................................página 316
Imagem - Image
Pseudoaneurisma Ventricular Esquerdo Secundário à Endocardite da Válvula Mitral
Left Ventricular Pseudoaneurysm Secondary to Mitral Valve Endocarditis
Bruno Bochard-Villanueva e Jordi Estornell-Erill
..................................................................................................................................................................página 320
Carta ao Editor - Letter to the Editor
Adesão Terapêutica e Capacidade Funcional na Insuficiência Cardíaca
Therapeutic Adherence and Functional Capacity in Heart Failure
Márcia Maria Carneiro Oliveira, Elieusa e Silva Sampaio, Roque Aras Júnior
..................................................................................................................................................................página 322
Arquivos Brasileiros de Cardiologia - Volume 105, Nº 3, Setembro 2015
www.arquivosonline.com.br
Diretora Científica
Maria da Consolação V.
Moreira
Editor-Chefe
Luiz Felipe P. Moreira
REVISTA DA SOCIEDADE BRASILEIRA DE CARDIOLOGIA - Publicada desde 1948
Cardiologia Cirúrgica
Paulo Roberto B. Evora
Cardiologia Intervencionista
Pedro A. Lemos
Hipertensão Arterial
Paulo Cesar B. V. Jardim
Métodos
Diagnósticos
Não-Invasivos
Carlos E. Rochitte
Editores Associados
Cardiologia Pediátrica/
Congênitas
Antonio Augusto Lopes
Pesquisa Básica
ou Experimental
Leonardo A. M. Zornoff
Cardiologia Clínica
José Augusto Barreto-Filho
Arritmias/Marcapasso
Mauricio Scanavacca
Epidemiologia/Estatística
Lucia Campos Pellanda
Ergometria, Exercício
e Reabilitação
Cardíaca
Ricardo Stein
Primeiro Editor
(1948-1953)
† Jairo Ramos
Conselho Editorial
Brasil
Aguinaldo Figueiredo de Freitas Junior (GO)
Alfredo José Mansur (SP)
Aloir Queiroz de Araújo Sobrinho (ES)
Amanda G. M. R. Sousa (SP)
Ana Clara Tude Rodrigues (SP)
André Labrunie (PR)
Andrei Sposito (SP)
Angelo A. V. de Paola (SP)
Antonio Augusto Barbosa Lopes (SP)
Antonio Carlos C. Carvalho (SP)
Antônio Carlos Palandri Chagas (SP)
Antonio Carlos Pereira Barretto (SP)
Antonio Cláudio L. Nóbrega (RJ)
Antonio de Padua Mansur (SP)
Ari Timerman (SP)
Armênio Costa Guimarães (BA)
Ayrton Pires Brandão (RJ)
Beatriz Matsubara (SP)
Brivaldo Markman Filho (PE)
Bruno Caramelli (SP)
Carisi A. Polanczyk (RS)
Carlos Eduardo Rochitte (SP)
Carlos Eduardo Suaide Silva (SP)
Carlos Vicente Serrano Júnior (SP)
Celso Amodeo (SP)
Charles Mady (SP)
Claudio Gil Soares de Araujo (RJ)
Cláudio Tinoco Mesquita (RJ)
Cleonice Carvalho C. Mota (MG)
Clerio Francisco de Azevedo Filho (RJ)
Dalton Bertolim Précoma (PR)
Dário C. Sobral Filho (PE)
Décio Mion Junior (SP)
Denilson Campos de Albuquerque (RJ)
Djair Brindeiro Filho (PE)
Domingo M. Braile (SP)
Edmar Atik (SP)
Emilio Hideyuki Moriguchi (RS)
Enio Buffolo (SP)
Eulógio E. Martinez Filho (SP)
Evandro Tinoco Mesquita (RJ)
Expedito E. Ribeiro da Silva (SP)
Fábio Vilas-Boas (BA)
Fernando Bacal (SP)
Flávio D. Fuchs (RS)
Francisco Antonio Helfenstein Fonseca (SP)
Gilson Soares Feitosa (BA)
Glaucia Maria M. de Oliveira (RJ)
Hans Fernando R. Dohmann (RJ)
Humberto Villacorta Junior (RJ)
Ínes Lessa (BA)
Iran Castro (RS)
Jarbas Jakson Dinkhuysen (SP)
João Pimenta (SP)
Jorge Ilha Guimarães (RS)
José Antonio Franchini Ramires (SP)
José Augusto Soares Barreto Filho (SE)
José Carlos Nicolau (SP)
José Lázaro de Andrade (SP)
José Péricles Esteves (BA)
Leonardo A. M. Zornoff (SP)
Leopoldo Soares Piegas (SP)
Lucia Campos Pellanda (RS)
Luís Eduardo Rohde (RS)
Luís Cláudio Lemos Correia (BA)
Luiz A. Machado César (SP)
Luiz Alberto Piva e Mattos (SP)
Marcia Melo Barbosa (MG)
Maria da Consolação V. Moreira (MG)
Mario S. S. de Azeredo Coutinho (SC)
Maurício I. Scanavacca (SP)
Max Grinberg (SP)
Michel Batlouni (SP)
Murilo Foppa (RS)
Nadine O. Clausell (RS)
Orlando Campos Filho (SP)
Otávio Rizzi Coelho (SP)
Otoni Moreira Gomes (MG)
Paulo Andrade Lotufo (SP)
Paulo Cesar B. V. Jardim (GO)
Paulo J. F. Tucci (SP)
Paulo R. A. Caramori (RS)
Paulo Roberto B. Évora (SP)
Paulo Roberto S. Brofman (PR)
Pedro A. Lemos (SP)
Protásio Lemos da Luz (SP)
Reinaldo B. Bestetti (SP)
Renato A. K. Kalil (RS)
Ricardo Stein (RS)
Salvador Rassi (GO)
Sandra da Silva Mattos (PE)
Sandra Fuchs (RS)
Sergio Timerman (SP)
Silvio Henrique Barberato (PR)
Tales de Carvalho (SC)
Vera D. Aiello (SP)
Walter José Gomes (SP)
Weimar K. S. B. de Souza (GO)
William Azem Chalela (SP)
Wilson Mathias Junior (SP)
Exterior
Adelino F. Leite-Moreira (Portugal)
Alan Maisel (Estados Unidos)
Aldo P. Maggioni (Itália)
Cândida Fonseca (Portugal)
Fausto Pinto (Portugal)
Hugo Grancelli (Argentina)
James de Lemos (Estados Unidos)
João A. Lima (Estados Unidos)
John G. F. Cleland (Inglaterra)
Maria Pilar Tornos (Espanha)
Pedro Brugada (Bélgica)
Peter A. McCullough (Estados Unidos)
Peter Libby (Estados Unidos)
Piero Anversa (Itália)
Sociedade Brasileira de Cardiologia
Presidente
Angelo Amato V. de Paola
Diretora de Pesquisa
Fernanda Marciano Consolim Colombo
Vice-Presidente
Sergio Tavares Montenegro
Editor-Chefe dos Arquivos Brasileiros de
Cardiologia
Luiz Felipe P. Moreira
Presidente-Eleito
Marcus Vinícius Bolívar Malachias
Diretor Financeiro
Jacob Atié
Assessoria Especial da Presidência
Fábio Sândoli de Brito
Governador - ACC Brazil Chapter
Antonio Carlos de Camargo Carvalho
Diretora Científica
Maria da Consolação V. Moreira
Coordenadorias Adjuntas
Diretor Administrativo
Emilio Cesar Zilli
Editoria do Jornal SBC
Nabil Ghorayeb e Fernando Antonio Lucchese
Diretor de Qualidade Assistencial
Pedro Ferreira de Albuquerque
Diretor de Comunicação
Maurício Batista Nunes
Diretor de Tecnologia da Informação
José Carlos Moura Jorge
Diretor de Relações Governamentais
Luiz César Nazário Scala
Diretor de Relações com Estaduais e
Regionais
Abrahão Afiune Neto
Diretor de Promoção de Saúde
Cardiovascular – SBC/Funcor
Carlos Costa Magalhães
Diretor de Departamentos Especializados
Jorge Eduardo Assef
Coordenadoria de Educação Continuada
Estêvão Lanna Figueiredo
Coordenadoria de Normatizações e Diretrizes
Luiz Carlos Bodanese
Coordenadoria de Integração Governamental
Edna Maria Marques de Oliveira
Coordenadoria de Integração Regional
José Luis Aziz
SBC/DF - Wagner Pires de Oliveira Junior
SBC/ES - Marcio Augusto Silva
SBC/GO - Thiago de Souza Veiga Jardim
SBC/MA - Nilton Santana de Oliveira
SBC/MG - Odilon Gariglio Alvarenga de Freitas
SBC/MS - Mércule Pedro Paulista Cavalcante
SBC/MT - Julio César de Oliveira
SBC/NNE - Jose Itamar Abreu Costa
SBC/PA - Luiz Alberto Rolla Maneschy
SBC/PB - Helman Campos Martins
SBC/PE - Catarina Vasconcelos Cavalcanti
SBC/PI - João Francisco de Sousa
SBC/PR - Osni Moreira Filho
SBC/RJ - Olga Ferreira de Souza
SBC/RN - Rui Alberto de Faria Filho
Presidentes das Soc. Estaduais e Regionais
SBC/RO - João Roberto Gemelli
SBC/AL - Carlos Alberto Ramos Macias
SBC/RS - Carisi Anne Polanczyk
SBC/AM - Simão Gonçalves Maduro
SBC/SC - Marcos Venício Garcia Joaquim
SBC/BA - Mario de Seixas Rocha
SBC/SE - Fabio Serra Silveira
SBC/CE - Ana Lucia de Sá Leitão Ramos
SBC/SP - Francisco Antonio Helfenstein Fonseca
SBC/CO - Frederico Somaio Neto
SBC/TO - Hueverson Junqueira Neves
Presidentes dos Departamentos Especializados e Grupos de Estudos
SBC/DA - José Rocha Faria Neto
SBCCV - Marcelo Matos Cascudo
GECHOSP - Evandro Tinoco Mesquita
SBC/DECAGE - Josmar de Castro Alves
SBHCI - Hélio Roque Figueira
GECO - Roberto Kalil Filho
SBC/DCC - José Carlos Nicolau
SBC/DEIC - Dirceu Rodrigues Almeida
SBC/DCM - Maria Alayde Mendonça da Silva
GERTC - Clerio Francisco de Azevedo Filho
SBC/DCC/CP - Isabel Cristina Britto Guimarães
GAPO - Danielle Menosi Gualandro
SBC/DIC - Arnaldo Rabischoffsky
GEECG - Joel Alves Pinho Filho
SBC/DERC - Nabil Ghorayeb
GEECABE - Mario Sergio S. de Azeredo Coutinho
SBC/DFCVR - Ricardo Adala Benfatti
GECETI - Gilson Soares Feitosa Filho
SBC/DHA - Luiz Aparecido Bortolotto
GEMCA - Álvaro Avezum Junior
GEMIC - Félix José Alvarez Ramires
SOBRAC - Luiz Pereira de Magalhães
GECC - Mauricio Wajngarten
GEICPED - Estela Azeka
GECIP - Gisela Martina Bohns Meyer
GECESP - Ricardo Stein
GECN - Ronaldo de Souza Leão Lima
GERCPM - Artur Haddad Herdy
GETAC - João David de Souza Neto
Arquivos Brasileiros de Cardiologia
Volume 105, Nº 3, Setembro 2015
Indexação: ISI (Thomson Scientific), Cumulated Index Medicus (NLM),
SCOPUS, MEDLINE, EMBASE, LILACS, SciELO, PubMed
Av. Marechal Câmara, 160 - 3º andar - Sala 330
20020-907 • Centro • Rio de Janeiro, RJ • Brasil
Tel.: (21) 3478-2700
E-mail: [email protected]
www.arquivosonline.com.br
SciELO: www.scielo.br
Departamento Comercial
Telefone: (11) 3411-5500
e-mail: [email protected]
Produção Editorial
SBC - Tecnologia da Informação e
Comunicação
Núcleo Interno de Publicações
Produção Gráfica e Diagramação
SBC - Tecnologia da Informação e
Comunicação
Núcleo Interno de Design
Impressão
IMOS Editora e Gráfica
Tiragem
1.500
Os anúncios veiculados nesta edição são de exclusiva responsabilidade dos
anunciantes, assim como os conceitos emitidos em artigos assinados são de
exclusiva responsabilidade de seus autores, não refletindo necessariamente a
opinião da SBC.
Material de distribuição exclusiva à classe médica. Os Arquivos Brasileiros de
Cardiologia não se responsabilizam pelo acesso indevido a seu conteúdo e que
contrarie a determinação em atendimento à Resolução da Diretoria Colegiada
(RDC) nº 96/08 da Agência Nacional de Vigilância Sanitária (Anvisa), que atualiza
o regulamento técnico sobre Propaganda, Publicidade, Promoção e informação de
Medicamentos. Segundo o artigo 27 da insígnia, "a propaganda ou publicidade de
medicamentos de venda sob prescrição deve ser restrita, única e exclusivamente,
aos profissionais de saúde habilitados a prescrever ou dispensar tais produtos (...)".
Garantindo o acesso universal, o conteúdo científico do periódico continua
disponível para acesso gratuito e integral a todos os interessados no endereço:
www.arquivosonline.com.br.
Filiada à Associação
Médica Brasileira
APOIO
Voltar ao Índice da Capa
Editorial
Políticas Públicas em Saúde Embasadas em Ciência “Made In
Brazil”: Um desafio para os Arquivos Brasileiros de Cardiologia
Public Health Policy Based on “Made-In-Brazil” Science: A Challenge for the Arquivos Brasileiros de Cardiologia
Jussiely Cunha Oliveira1,2 e José Augusto Barreto-Filho1,3,4
Núcleo de Pós-graduação em Medicina – Universidade Federal de Sergipe1; Faculdade Estácio/Sergipe2; Divisão de Cardiologia – Hospital
Universitário – Universidade Federal de Sergipe3; Clínica e Hospital São Lucas4, Aracaju, SE – Brasil
Aumentar equanimemente a qualidade assistencial em
saúde, de forma sustentável, é um grande desafio do mundo
contemporâneo. As governanças dos países necessitam
buscar continuadamente soluções criativas e inteligentes para
que os múltiplos subsistemas de saúde se alinhem de forma
equilibrada com as necessidades e expectativas dos pacientes
e da coletividade, mas que, ao mesmo tempo, sejam viáveis
e sustentáveis. Países desenvolvidos utilizam ciência para
avaliar a qualidade assistencial em saúde que está sendo
oferecida e gerar informações que sirvam para melhorar
os resultados verificados1. Políticas públicas embasadas em
ciência é o paradigma corrente nesses países. No Brasil, a
visão ideológica ainda parece prevalecer.
Pesquisa de resultados (outcomes research), pesquisa
em sistemas de saúde (health service research) e ciência
de implementação (implementation science) abrigam parte
expressiva das temáticas relativas ao estudo científico da
qualidade assistencial e sua relação com o sistema de
saúde1, mas ainda necessitam de divulgação e incentivos
institucionais para frutificarem no Brasil. De maneira geral,
tais ramos dedicam-se a avaliar, de forma sistemática e
metódica, aspectos variados relativos à estruturação dos
sistemas de saúde, seus resultados finalísticos para pacientes
e coletividade, relação médico-paciente, como tais resultados
podem ser melhorados e como inovações devem ser
implementadas. Desses, a pesquisa de resultados destaca‑se
por investigar os resultados finalísticos da assistência em
saúde, focados pela perspectiva e pelo olhar dos resultados
que interessam diretamente aos pacientes e à sociedade1.
Escrutinização da qualidade do sistema de saúde brasileiro
A partir da Constituição Federal de 1998 (Constituição
Cidadã) e da criação do Sistema Único de Saúde (SUS), em
1990, ficou garantido, em Carta Magna, que todos os brasileiros
teriam direito ao acesso integral, universal e igualitário, além de
gratuito, a serviços de saúde de qualidade. A partir daquela data,
o Estado teria o dever de financiar, prover e operacionalizar
Palavras-chave
Doenças Cardiovasculares; Políticas; Avaliação de
Resultados (Cuidados de Saúde); Constituição e Estatutos;
Sistema Único de Saúde.
Correspondência: José Augusto Barreto-Filho •
Avenida Gonçalo Prado Rollemberg, 211, sala 202, CEP 49010-410,
Aracaju, SE – Brasil
E-mail: [email protected]
DOI: 10.5935/abc.20150120
a infraestrutura necessária para o cumprimento da Lei nº.
8.080/1990. O reconhecimento constitucional de que saúde
é um direito universal foi um avanço ideológico substancial.
No papel, o modelo de saúde pública idealizado para o
Brasil passou a ser um exemplo para o mundo. Estima-se que
aproximadamente 75% de brasileiros sejam dependentes do
SUS e o restante possui cobertura complementar privada.
Se o objetivo é o de gerar informação relevante para iluminar
a tomada de decisão referente às políticas públicas em saúde,
devemos nos dedicar de forma sistemática a avaliar, pelo método
científico, os resultados assistenciais do SUS. Entretanto, passados
25 anos da implantação do SUS, temos poucas evidências
científicas, especialmente que representem o país continental
que somos, quais são os resultados assistenciais finalísticos do
SUS. Por exemplo, não dispomos de dados representativos
sobre a mortalidade pós Infarto Agudo do Miocárdio, a taxa de
indivíduos submetidos a tratamento de reperfusão ou a taxa de
readmissão hospitalar em 30 dias. Mais ainda, sabemos muito
pouco sobre o grau de disparidade existente entre os resultados
assistenciais do SUS e da rede privada.
Escrutinizar o SUS e também o sistema complementar
brasileiro, em nível nacional, pela ótica científica, será
fundamental para a consolidação e construção de um sistema
de saúde equânime, seguro, responsivo, acessível e eficiente.
As iniciativas recentes da Sociedade Brasileira de Cardiologia
em incentivar os registros nacionais devem ser aplaudidas, mas
ainda são tímidas para transformar a saúde pública brasileira2.
O DATASUS poderia muito bem se prestar ao papel
de vigilância da qualidade dos resultados assistenciais dos
principais problemas nacionais de saúde. Contudo, de maneira
generalizada, a insatisfatória qualidade na alimentação de
dados e a falta de estudos que tenham validado o DATASUS,
em nível nacional, como banco de dados fidedigno, são fatores
que ainda limitam seu uso científico.
Nos EUA, dados administrativos do Medicare têm sido
utilizados em inúmeros estudos de monitorização e vigilância
dos macro-indicadores assistenciais nas principais entidades
nosológicas cardiovasculares3-5 e prestado grande serviço para
o conhecimento dos resultados assistenciais oferecidos aos
americanos com idade ≥ 65 anos.
Resultados assistenciais como temática científica
O conceito da necessidade imperativa de se avaliar
constantemente os desfechos da prática assistencial no mundo
real para promover melhoria contínua do sistema de saúde
foi cristalizado na ideia do resultado final (end-result idea)
por Ernst Codman (1910)6. Segundo Codman: “A ideia do
211
Oliveira e Barreto-Filho
Políticas públicas em saúde embasadas em ciência
Editorial
resultado final exige que os resultados sejam constantemente
analisados e que possíveis soluções para melhorá-los sejam
constantemente consideradas”.
avaliar a qualidade do estudo publicado e nem seu potencial
impacto em gerar recomendação de diretriz. Alguns estudos
serviram de exemplo a mais de uma categoria.
A base teórica da “outcomes research” foi posteriormente
refinada por Donabedian quando propôs um modelo
conceitual7 no qual a qualidade do sistema de saúde poderia ser
inferida pela abordagem de três domínios: estrutura, processo e
resultados. O domínio “resultado” é aquele que mais captura a
qualidade assistencial que interessa aos pacientes e à sociedade.
Embora não tenhamos realizado avaliação quantitativa
sistemática, de maneira geral, percebemos que há uma notória
escassez de investigações que abordem diretamente o tema
qualidade assistencial do sistema de saúde brasileiro.
Em 1998, o termo “outcomes research” entrou na
terminologia científica em publicação clássica na revista
Science. Como definido por Clancy e Eisenberg, “outcomes
research” investiga os efeitos das intervenções médicas e das
políticas sobre os resultados que interessam diretamente aos
indivíduos e à sociedade8.
Nosso levantamento, restrito aos Arquivos Brasileiros
de Cardiologia, sugere que o país necessita aumentar a
produção científica capaz de nortear políticas públicas na área
cardiovascular. Nessa temática, o uso de ciência importada
tem limitação crítica e pode enviesar a tomada de decisão.
Conhecer, de forma sistêmica, os resultados assistenciais
brasileiros será essencial na elaboração e priorização da
agenda de políticas públicas regionais e nacionais.
Dez anos mais tarde (2008), “outcomes research” foi
definitivamente reconhecida como uma área importante
de investigação cardiovascular, quando a American Heart
Association lançou a revista Circulation Cardiovascular
Quality and Outcomes, editada por Krumholz e associados,
endossando o emergente campo de pesquisa biomédica9.
Exemplos de estudos sobre qualidade assistencial
cardiológica nos Arquivos Brasileiros de Cardiologia
A revista Arquivos Brasileiros de Cardiologia é o principal
veículo da ciência cardiológica brasileira e representa a única
sociedade de cardiologia nacional. Revisamos artigos originais
publicados nos Arquivos Brasileiros de Cardiologia nos últimos
dois anos que abordaram o tema qualidade assistencial, com
o intuito de apresentar exemplos de estudos com o potencial
de contribuir e impactar os resultados assistenciais brasileiros.
Para tornar nossa investigação mais compreensiva,
subdividimos o tema qualidade assistencial em alguns
subtemas que interessam diretamente à pesquisa de resultados
e outros que interessam especificamente ao Brasil, como por
exemplo, foco no SUS1 (Tabela 1). Não houve pretensão em se
Desafios e oportunidades
Temos um longo caminho à frente e ao menos dois desafios
muito bem definidos se apostarmos no papel da ciência como
lastro da tomada de decisão referente às políticas públicas em
saúde, a saber: 1) produzir ciência nacional de alto nível que
represente a qualidade assistencial brasileira; e 2) convencer
as governanças em nível federal, estadual e municipal de que a
ciência é uma ferramenta fundamental para iluminar as tomadas
de decisão referentes à implantação de políticas públicas.
Isso exigirá investimentos substanciais: 1) na formação
intelectual de pesquisadores especializados; 2) na melhoria da
qualidade do DATASUS como banco de dados para pesquisas
em todos os estados brasileiros; 3) na criação, estruturação
e consolidação de grupos cooperativos de pesquisa; e 4) no
fomento contínuo da produção científica nacional.
Para a comunidade científica cardiovascular brasileira,
especialmente os pesquisadores mais jovens, essa lacuna da
ciência brasileira pode representar uma grande oportunidade
de abraçar uma linha de pesquisa que tem todo o potencial de
impactar e beneficiar substancialmente o Brasil e os brasileiros.
Tabela 1 – Artigos originais sobre qualidade assistencial nos ABC
Exemplos de estudos*
212
Segurança
Eficácia e Segurança de Stents Eluidores de Drogas no Mundo Real: Acompanhamento de 8 Anos10
Linha temporal do cuidado, acesso, responsividade
do sistema
Implantação da Linha de Cuidado do Infarto Agudo do Miocárdio no Município de Belo Horizonte11
Efetividade de um Protocolo Assistencial para Redução do Tempo Porta-Balão da Angioplastia Primária12
Variabilidade na prática assistencial
Nenhum
Efetividade
Estratégia Antitrombótica nos Três Meses Iniciais após Implante de Bioprótese Valvar Cardíaca13
Custo
Itinerário de Investigação do Paciente Coronariano do SUS em Curitiba, São Paulo e Incor – Estudo IMPACT14
Disparidade
Evolução de Indicadores Socioeconômicos e da Mortalidade Cardiovascular em três Estados do Brasil15
Assistência Centrada no Paciente /Autonomia /
Decisão Compartilhada
Nenhum
Resultados institucionais
Experiência Inicial de Dois Centros Nacionais no Implante de Prótese Aórtica Transcateter16
Registros sobre doença específica
Registro Brasileiro das Síndromes Coronárias Agudas (ACCEPT)2
Estudo BREATHE – I Registro Brasileiro de Insuficiência Cardíaca17
Comportamento da Síndrome Coronariana Aguda. Resultados de um Registro Brasileiro18
Foco no SUS
Itinerário de Investigação do Paciente Coronariano do SUS em Curitiba, São Paulo e Incor - Estudo IMPACT14
Arq Bras Cardiol. 2015; 105(3):211-213
Oliveira e Barreto-Filho
Políticas públicas em saúde embasadas em ciência
Editorial
Referências
1. Krumholz HM. Outcomes Research: generating evidence for best practice
and policies. Circulation. 2008;118(3):309-18.
2.
Piva e Mattos LA, Berwanger O, Santos ES, Reis HJ, Romano ER, Petriz JL, et
al. Clinical outcomes at 30 days in the Brazilian Registry of Acute Coronary
Syndromes (ACCEPT). Arq Bras Cardiol. 2013;100(1):6-13.
3.
Barreto-Filho JA, Wang Y, Dodson JA, Desai MM, Sugeng L, Geirsson A, et al.
Trends in aortic valve replacement for elderly patients in the United States,
1999-2011. JAMA. 2013;310(19):2078-85.
4.
Lampropulos JF, Kim N, Wang Y, Desai MM, Barreto-Filho JA, Dodson JA, et
al. Trends in left ventricular assist device use and outcomes among Medicare
beneficiaries, 2004-2011. Open Heart. 2014;1(1):e000109.
5.
Dharmarajan K, Hsieh AF, Lin Z, Bueno H, Ross JS, Horwitz LI, et al. Diagnoses
and timing of 30-day readmissions after hospitalization for heart failure, acute
myocardial infarction, or pneumonia. JAMA. 2013;309(4):355-63.
6. Schlaff AL. Boston’s Codman Square Community Partnership for Health
Promotion. Public Health Rep. 1991;106(2):186-91.
7. Donabedian A. The quality of care: how can it be assessed? JAMA.
1988;260(12):1743-8.
8.
Clancy CM, Eisenberg JM. Outcomes research: measuring the end results of
health care. Science. 1998;282(5387):245-6.
11. Marcolino MS, Brant LC, Araujo JG, Nascimento BR, Castro LR, Martins P,
et al. Implementation of the myocardial infarction system of care in city of
Belo Horizonte, Brazil. Arq Bras Cardiol. 2013;100(4):307-14. Erratum in:
Arq Bras Cardiol. 2013;100(4):313.
12. Correia LC, Brito M, Kalil F, Sabino M, Garcia G, Ferreira F, et al. Effectiveness
of a myocardial infarction protocol in reducing door-to-ballon time. Arq Bras
Cardiol. 2013;101(1):26-34.
13. Durães AR, Durães MA, Correia LC, Aras R. Antithrombotic strategy in the
three first months following bioprosthetic heart valve implantation. Arq Bras
Cardiol. 2013;101(5):466-472.
14. Cerci JJ, Trindade E, Preto D, Cerci RJ, Lemos PA, Cesar LA, et al. Investigation
route of the coronary patient in the public health system in Curitiba, São
Paulo and in InCor--IMPACT study. Arq Bras Cardiol. 2014;103(3):192-200.
15. Soares GP, Brum JD, Oliveira GM, Klein CH, Souza e Silva NA. Evolution of
socioeconomic indicators and cardiovascular mortality in three Brazilian
states. Arq Bras Cardiol. 2013;100(2):147-56.
16. Lluberas S, Abizaid A, Siqueira D, Ramos A, Costa Jr JR, Arrais M, et al.
Initial experience of two national centers in transcatheter aortic prosthesis
implantation. Arq Bras Cardiol. 2014;102(4):336-44.
9. Krumholz HM. Medicine in the era of outcomes measurement. Circ
Cardiovasc Qual Outcomes. 2009;2(3):141-3.
17. Rohde LE, Danzmann LC, Canesin MF, Hoffmann Filho CR, Fragata
Filho AA, Baruzzi A, et al; BREATHE investigators. Rationale and design:
BREATHE registry--I Brazilian Registry of Heart Failure. Arq Bras Cardiol.
2013;100(5):390-4.
10. Pellegrini DO, Gomes VO, Lasevitch R, Smidt L, Azeredo MA, Ledur P, et al.
Efficacy and safety of drug-eluting stents in the real world: 8-year follow-up.
Arq Bras Cardiol. 2014; 103(3):174-82.
18. Piegas LS, Avezum A, Guimarães HP, Muniz HJ, Reis HJ, Santos ES, et al.
Acute coronary syndrome behavior: results of a Brazilian registry. Arq Bras
Cardiol. 2013;100(6):502-510.
Arq Bras Cardiol. 2015; 105(3):211-213
213
Voltar ao Índice da Capa
Artigo Especial
Resumo Executivo: Diretrizes da SBC sobre Angina Instável e Infarto
Agudo do Miocárdio Sem Supradesnível do Segmento ST
SBC Guidelines on Unstable Angina and Non-ST-Elevation Myocardial Infarction: Executive Summary
Gilson Soares Feitosa-Filho1, Luciano Moreira Baracioli2, Carlos José Dornas G. Barbosa3, André Franci2, Ari
Timerman4, Leopoldo Soares Piegas4, José Antônio Marin-Neto5, José Carlos Nicolau2
Hospital Santa Izabel da Santa Casa de Misericórdia da Bahia – Escola Bahiana de Medicina e Saúde Publica1, Salvador, BA; Instituto do
Coração (InCor/HCFMUSP)2, São Paulo, SP; Hospital do Coração3, Brasília, DF; Instituto Dante Pazzanese de Cardiologia4, São Paulo, SP;
Faculdade de Medicina de Ribeirão Preto – USP5, Ribeirão Preto, SP – Brasil
Parte I – Estratificação de risco e condutas
nas primeiras 12 horas após a chegada do
paciente ao hospital
Introdução
A angina instável (AI) continua sendo uma das maiores
causas cardiovasculares de internação. E, durante a evolução,
uma parte desses pacientes desenvolve elevações nos
marcadores bioquímicos de dano miocárdico, configurando
o quadro de infarto agudo do miocárdio (IAM) sem
supradesnível do segmento ST. Essas duas entidades (AI e IAM),
quando em conjunto, compõem as síndromes isquêmicas
miocárdicas instáveis sem supradesnível do segmento ST
(SIMISSST), objeto desta diretriz.
História clínica, exame físico e escores de
risco
A história clínica e o exame físico apresentam papéis
fundamentais na estratificação de risco de pacientes com
SIMISSST A classificação proposta por Braunwald, assim
como sua atualização, incluindo a dosagem de troponina,
permitem uma abordagem rápida do risco dos pacientes para
desfechos isquêmicos maiores1. Ferramentas matemáticas
como os escores TIMI e GRACE podem fornecer informações
prognósticas e orientar o tipo de estratificação, assim como a
terapêutica antitrombótica2,3. (Figura 1 e Tabela 1)
A ocorrência de um sangramento maior em pacientes com
SIMISSST relaciona-se diretamente com eventos adversos
(incluindo mortalidade), sendo que o emprego de escores
de sangramento (CRUSADE e ACUITY/HORIZONS), que
estimam o risco de complicações hemorrágicas, permite
direcionar a terapêutica a fim de minimizar esses desfechos4,5.
(Tabelas 2 e 3)
Palavras-chave
Angina Instável / fisiopatologia; Infarto do Miocárdio /
mortalidade; Troponina / uso terapêutico.
Correspondência: Gilson Soares Feitosa-Filho •
Comissão de Ensino do Hospital Santa Izabel - Santa Casa de Misericórdia da
Bahia - Praça Cons Almeida Couto, 500, Nazaré. CEP 40050-410, Salvador,
BA – Brasil
E-mail: [email protected]
DOI: 10.5935/abc.20150118
214
Arq Bras Cardiol. 2015; [online].ahead print, PP.0-0
Eletrocardiograma
Apesar de sua baixa sensibilidade para descriminar um
IAM subendocárdico de um IAM transmural (através da onda
Q), o Eletrocardiograma (ECG) é fundamental no manejo
de pacientes com SIMISSST. Alterações transitórias do
segmento ST (depressão ou elevação), assim como inversões
da onda T, são importantes marcadores prognósticos para
ocorrência de morte ou infarto. No entanto, um ECG
normal não exclui o diagnóstico de SIMISSST. Tem grande
importância prognóstica, sendo que no estudo GUSTO II,
o ECG inicial teve relação com mortalidade precoce:
bloqueio de ramo esquerdo, hipertrofia ventricular esquerda
ou ritmo de marca-passo cursaram com mortalidade de
11,6%; depressão do segmento ST, com 8%; elevação do
segmento ST, com 7,4%; e inversão da onda T ou ECG
normal, com 1,2%6.
Marcadores bioquímicos de necrose miocárdica
Os marcadores bioquímicos modernos (troponina e
CK-MB massa) são importantes ferramentas no diagnóstico
e prognóstico dos pacientes com SIMISSST. Devem ser
interpretados em conjunto com o quadro clínico e o ECG
do paciente, visto que diversas situações não coronarianas
podem levar à sua elevação7.
Os níveis dos marcadores de necrose após uma intervenção
coronária percutânea (ICP) ou cirurgia de revascularização
miocárdica (CRM) indicarão IAM quando corresponderem a
uma elevação de 5x e 10x o valor de referência (pós-ICP e
pós-CRM, respectivamente), interpretados em conjunto com
os sintomas, alterações do ECG e/ou exames de imagem8.
A mioglobina e as troponinas-US, devido ao seu elevado
valor preditivo negativo após a sexta hora dos sintomas,
podem ser consideradas em protocolos de descarte precoce
no pronto-socorro9.
Eletrocardiograma de esforço
Os objetivos do teste ergométrico (TE) nas SIMISSST são:
identificar eventual isquemia miocárdica, estimar prognóstico
e orientar decisões clínicas adequadas, incluindo estratégias de
tratamento. É recomendado nos pacientes de baixo risco como
exame de primeira escolha por ser um procedimento de baixo
custo, ter larga disponibilidade e apresentar muito baixo risco.
O TE negativo, corretamente indicado em um paciente com
boa capacidade funcional, permite a alta hospitalar imediata,
pois tem alto valor preditivo negativo10.
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
Idade > 65 anos
1
≥ 3 fatores de risco
1
Lesão coronariana ≥ 50%
1
Uso de AAS < 7 dias
1
2 crises de angina < 24 horas
1
Desvio de ST ≥ 0,5 mm
1
↑ marcador de necrose
1
% (óbito/IAM/RM de urgência – 14 dias)
Estraticação de risco
0–7
50
Baixo
Alto
Intermediário
40,9
40
30
26,2
19,9
20
13,2
10
8,3
4,7
0
2,9
2,9
4,7
6,7
11,5
19,4
0/1
2
3
4
5
6/7
Óbito + IAM
Óbito + IAM + RM
Figura 1 – AAS: Ácido acetilsalicílico; IAM: Infarto agudo do miocárdio; RM: Revascularização miocárdica.
Tabela 1 – Escore GRACE
Estratificação de risco
Idade (anos)
– 0-100
Frequência cardíaca
– 0-46
Pressão arterial sistólica (mmHg)
– 58-0
Risco
Pontos
% Morte hospitalar
Creatinina (mg/dL)
– 1-28
Baixo
1-108
<1
ICC (killip)
– 0-59
Intermediário
109-140
1-3
> 140
>3
Parada cardiorrespiratória na admissão
Desvio de ST
Elevação dos marcadores de necrose
– 39
Alto
– 28
1 - 372
ICC: Insuficiência cardíaca crônica.
Ecocardiografia
Apresenta grande utilidade nos pacientes com SIMISSST11.
A detecção de alterações da contração segmentar é um
forte indicativo de doença arterial coronariana (DAC), pois
pode simbolizar infarto, isquemia ou ambos. Também tem
importante papel no diagnóstico diferencial da dor torácica
(dissecção de aorta, estenose aórtica, embolia pulmonar,
miocardiopatia hipertrófica e doença pericárdica) e na
avaliação prognóstica através da avaliação da fração de ejeção
do ventrículo esquerdo (FEVE).
Cardiologia nuclear
Em pacientes com SIMISSST as informações obtidas
através da cintilografia (perfusão miocárdica e função
ventricular) já têm seu papel prognóstico bem estabelecido.
A cintilografia miocárdica com estresse físico ou farmacológico
é realizada em pacientes com SIMI de risco baixo ou
intermediário após estabilização do quadro agudo (após
48/72 horas). No contexto de sala de emergência ou de dor
aguda, a injeção do radiofármaco deve ser realizada apenas
no repouso, enquanto o paciente está ainda sintomático
(excepcionalmente após o término dos sintomas), devendo as
imagens ser obtidas em até 6 horas. Se considerada de baixo
risco, determina uma probabilidade de eventos cardíacos
subsequentes bastante reduzida12,13.
Angiografia por tomografia computadorizada das artérias
coronárias
Trata-se de uma importante ferramenta na avaliação de
pacientes com dor torácica aguda, especialmente nos indivíduos
de risco baixo e intermediário, sendo um método seguro para
o diagnóstico de SIMISSST, capaz de reduzir a duração da
internação hospitalar e, eventualmente, o custo global.
Critérios de alta para pacientes de baixo risco nas
primeiras 12 horas de estratificação
Ausência de dor, estabilidade clínica, ECG normal ou
sem alterações agudas, marcadores bioquímicos de necrose
miocárdica normais, e teste provocativo de isquemia, se
realizado, negativo.
Arq Bras Cardiol. 2015; 105(3):214-227
215
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
Tabela 2 – Escore CRUSADE
Fator prognóstico
Escores
Hematócrito basal (%)
< 31
9
31-33,9
7
34-36,9
3
37-39,9
2
> 40
0
Clearence de creatinina (ml/min)
< 15
39
16-30
35
31-60
28
61-90
17
91-120
7
> 120
0
Frequência cardíaca (bpm)
< 70
0
71-80
1
81-90
3
91-100
6
101-110
8
111-120
10
> 120
11
Sexo
Masculino
0
Feminino
8
Sinais de IC na apresentação
Não
0
Sim
7
Doença vascular prévia
Não
0
Sim
6
Diabetes melito
Não
0
Sim
6
Pressão arterial sistólica (mmHg)
< 90
10
91-100
8
101-120
5
121-180
1
181-200
3
> 200
5
CRUSADE: Can Rapid risk stratification of Unstable angina patients
Supress ADverse outcomes with Early implementation of the
AmericanCollege of Cardiology/guidelines; IC: insuficiência cardíaca.
1-20 risco muito baixo (3,1%); 21-30 risco baixo (5,5%); 31-40 risco
moderado (8,6%); 41-50 risco alto (11,9%); 51-91 risco muito alto (19,5%).
216
Arq Bras Cardiol. 2015; 105(3):214-227
Parte II – Condutas nos pacientes de risco
intermediário e alto
Internação e alta da unidade coronária de
terapia intensiva
Todos os pacientes com SIMI de risco intermediário e
alto devem ser internados em unidade coronária de terapia
intensiva (UCO) sempre que possível. Aqueles submetidos à ICP
devem voltar à UCO após o procedimento; caso não ocorram
complicações, devem receber alta da UCO no dia seguinte.
Quando a opção de tratamento for CRM, o paciente deve
idealmente permanecer na UCO até o momento da cirurgia.
Os casos de tratamento clínico medicamentoso isolado devem
receber alta da UCO no dia seguinte ao da tomada dessa decisão,
desde que estável e sem necessidade de medicação intravenosa.
Oxigenoterapia
Evidência limitada e antiga sugere que a administração de
oxigênio seja capaz de limitar a extensão da lesão isquêmica
aguda14. Habitualmente a suplementação de oxigênio é
mantida por até 4 horas após o desaparecimento da dor.
Naquelas situações em que houver hipoxemia persistente
comprovada, essa será mantida conforme a necessidade clínica.
A administração desnecessária de oxigênio por tempo prolongado
pode causar vasoconstrição sistêmica e mesmo ser prejudicial.
Analgesia e sedação
A dor precordial e a ansiedade presentes nas SIMI
geralmente levam a hiperatividade do sistema nervoso
simpático. Esse estado hiperadrenérgico, além de aumentar o
consumo miocárdico de oxigênio, predispõe ao aparecimento
de taquiarritmias atriais e ventriculares. Assim, recomenda‑se
a utilização de analgésicos potentes a pacientes com dor
isquêmica intensa, refratários à terapêutica antianginosa15.
O sulfato de morfina é o analgésico de eleição, sendo
administrado por via intravenosa, na dose de 2 a 4 mg
diluídos a cada 5 minutos até, no máximo, 25 mg, quando a
dor não for aliviada com o uso de nitrato sublingual, ou nos
casos de recorrência da dor apesar da adequada terapêutica
anti‑isquêmica, monitorando‑se a pressão arterial.
Nitratos
O emprego de nitratos fundamenta-se em seu mecanismo de
ação e na experiência clínica de muitos anos de uso. Não existem
estudos clínicos controlados que tenham testado os efeitos dos
nitratos em desfechos clínicos e mortalidade na AI, embora seu
uso seja universalmente aceito16,17. O tratamento é iniciado na
sala de emergência, administrando‑se o nitrato por via sublingual.
Caso não haja alívio rápido da dor, esses pacientes podem
se beneficiar da administração intravenosa de nitroglicerina.
Os nitratos estão contraindicados na presença de hipotensão
arterial importante (pressão arterial sistólica < 100 mmHg) ou
uso prévio de sildenafil nas últimas 24 horas. O tratamento
intravenoso deverá ser mantido por 24‑48 horas após a última
dor anginosa, devendo ser suspenso de forma gradual.
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
Tabela 3 – Escore ACUITY/HORIZONS
Soma
Homens
0
Sexo
50-69
+3
Mulheres
+8
Idade (anos)
< 50
0
Creatinina sérica (mg/dL)
<1
0
1+2
1,2+3
1,4+5
1,6+6
1,8+8
≥2
+10
Leucócitos totais (giga/ml)
< 10
0
10+2
12+3
14+5
16+6
18+8
≥ 20
+10
Não
0
Anemia
Apresentação da SCA
60-69
+6
≥ 80
+12
Sim
+6
IAM com supra
+6
Medicações antitrombóticas
70-79
+9
IAM sem supra
+2
Angina instável
0
Heparina + IGP IIb/IIIa Bivalirudina
0
5
Valor total
IGP: Inibidor de glicoproteína. Algoritmo usado para determinar o escore de risco para sangramento: < 10 risco baixo (1,9%); 10-14 risco moderado (3,6%); 15-19
alto (6,0%); > 20 muito alto (13%). SCA: Síndrome coronariana aguda; IAM: Infarto agudo do miocárdio
Betabloqueadores adrenérgicos
Os betabloqueadores, ao reduzir a frequência cardíaca,
a pressão arterial e a contratilidade miocárdica, provocam
redução do consumo miocárdio de oxigênio. Apesar da
inexistência de estudos randomizados em larga escala
avaliando a ação sobre desfechos clínicos maiores,
como mortalidade, esses fármacos, juntamente com os
nitratos, são considerados agentes de primeira escolha
no tratamento das SIMI18.
Devem ser iniciados na formulação oral, para pacientes
sem contraindicação e estáveis, em doses pequenas, que
devem ser gradualmente aumentadas para se manter a
frequência cardíaca ao redor de 60 bpm. No caso de o
paciente apresentar dor isquêmica persistente e/ou taquicardia
(não compensatória de um quadro de insuficiência cardíaca),
pode-se utilizar a formulação venosa.
Antagonistas dos canais de cálcio
Os efeitos benéficos dos bloqueadores dos canais
de cálcio nas SIMISSST devem-se a uma combinação
das suas ações, diminuindo o consumo miocárdico de
oxigênio, a pós-carga, a contratilidade e a frequência
cardíaca, além de aumentarem a oferta de oxigênio ao
miocárdio pela vasodilatação coronária que promovem.
Podem ser usados para tentar controlar sintomas
isquêmicos refratários em pacientes já em uso de nitratos
e betabloqueadores em doses adequadas, ou naqueles que
não toleram o uso desses medicamentos (principalmente
nos casos de contraindicação), ou, ainda, naqueles com
angina variante (síndrome de Prinzmetal). Em pacientes
com comprometimento da função ventricular esquerda
e/ou alterações na condução atrioventricular, esses
medicamentos devem ser evitados19.
Inibidores do sistema renina-angiotensina-aldosterona
Não há evidências conclusivas de benefícios quando
da utilização precoce dos mesmos em pacientes com
SIMISSST, mas alguns estudos sugerem que possam ser
úteis na fase crônica20.
Agentes antiplaquetários
Ácido acetilsalicílico
A trombose coronária tem papel de destaque no
desencadeamento e na progressão dos quadros de SIMI,
sendo essencial o emprego de antitrombóticos no tratamento
de pacientes com tais síndromes. O ácido acetilsalicílico
(AAS) é o antiplaquetário de excelência, devendo ser sempre
prescrito, exceto nos raros casos de reação alérgica grave
previamente conhecida e na vigência de sangramentos
digestivos ativos21.
Derivados tienopiridínicos
São fármacos antagonistas da ativação plaquetária mediada
pelo difosfato de adenosina (ADP), que agem bloqueando o
receptor P2Y12 na plaqueta.
O clopidogrel está relacionado à redução de 20% no
risco de óbito cardiovascular, IAM ou acidente vascular
cerebral (AVC) quando utilizado em associação ao AAS na
SIMISSST de risco intermediário e alto22. Quando testado
em dose dobrada (600 mg de ataque, seguidos por 150 mg
ao dia por 6 dias) foi associado à redução de 14% no
risco de óbito cardiovascular, IAM ou AVC em pacientes
submetidos a ICP (NNT 167). No entanto, houve aumento
de 41% na ocorrência de sangramentos graves (NNH 200)23.
Como o número necessário de pacientes tratados para evitar
Arq Bras Cardiol. 2015; 105(3):214-227
217
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
a ocorrência de um evento isquêmico é semelhante ao
número de pacientes tratados que apresentarão um evento
hemorrágico grave, recomendamos uma avaliação cautelosa
e individualizada de cada caso.
A inibição da agregação plaquetária de pacientes em
uso de clopidogrel tem mostrado grande variação intra- e
interindividual. “Má resposta” e “resistência” ao clopidogrel
são termos utilizados para caracterizar os pacientes que
não atingem o nível de inibição plaquetária esperado.
Dados consistentes associam a má resposta ao clopidogrel
à maior incidência de eventos trombóticos, principalmente
em pacientes submetidos a ICP com implante de stent.
Diversas estratégias foram testadas na tentativa de reduzir
a resistência ao clopidogrel, porém sem impacto positivo
significativo na redução de eventos clínicos24.
A associação de clopidogrel com inibidores de
bomba de prótons (IBP), notadamente o omeprazol, tem
sido relacionada à maior incidência de resistência ao
clopidogrel. Apesar de dados conflitantes, sugere-se evitar
o uso rotineiro de IBP e dar preferência aos inibidores dos
receptores H2 de histamina25.
O prasugrel é um tienopiridínico de geração mais recente,
que atinge níveis de inibição da agregação plaquetária maiores
e mais consistentes. Quando comparado ao clopidogrel em
pacientes com síndrome coronariana aguda (SCA) de alto risco
submetidos à ICP, o prasugrel foi associado a uma redução
de 19% na ocorrência de morte cardiovascular, IAM ou AVC.
No entanto, o uso de prasugrel foi associado a um aumento
de 32% na ocorrência de sangramentos graves. O prasugrel
não deve ser prescrito para pacientes com ataque isquêmico
transitório ou AVC prévios. O uso em pacientes > 75 anos
ou < 60 kg deve ser individualizado26.
Nos pacientes que serão submetidos a CRM, o clopidogrel
deve ser suspenso pelo menos 5 dias antes do procedimento
e o prasugrel 7 dias antes.
Derivados da ciclopentiltriazolopirimidina
O ticagrelor é uma ciclopentiltriazolopirimidina (CPTP)
com meia-vida de 12 horas e que, ao contrário dos
tienopiridínicos, exerce bloqueio reversível dos receptores
P2Y12 e não depende da metabolização hepática para o
início de sua ação. Com essas características, o ticagrelor
exerce efeito antiagregante plaquetário mais intenso, rápido
e consistente em relação ao clopidogrel. Quando comparado
ao clopidogrel em pacientes com SCA de risco intermediário
e alto, o ticagrelor foi associado à redução significativa
de 16% na ocorrência do desfecho composto de morte
vascular, IAM ou AVC. Adicionalmente, houve redução de
21% na ocorrência de óbitos por causas vasculares e 22%
na mortalidade por todas as causas. Não houve aumento
significativo de eventos hemorrágicos maiores, sangramentos
fatais ou necessidade de transfusão com o ticagrelor, porém
ocorreu aumento de sangramentos maiores não relacionados
à CRM. O uso do ticagrelor também foi associado à maior
incidência de dispneia e pausas ventriculares transitórias,
além do aumento dos níveis de creatinina e ácido úrico.
Nos pacientes que serão submetidos a CRM, o ticagrelor
deverá ser suspenso 5 dias antes do procedimento27.
218
Arq Bras Cardiol. 2015; 105(3):214-227
Antagonistas dos receptores da glicoproteína IIb/IIIa
Essa classe de medicamentos bloqueia a via final
comum da agregação plaquetária, independentemente
do estímulo inicial. Por meio do bloqueio dos receptores
da glicoproteína (GP) IIb/IIIa presentes na superfície da
plaqueta, impedem a ligação do fibrinogênio aos receptores
ativados, bloqueando o processo de agregação plaquetária
e a formação do trombo plaquetário.
No contexto de pacientes com SIMISSST submetidos à
estratégia essencialmente “conservadora”, os bloqueadores
GP IIb/IIIa tiveram seu uso fundamentado em estudos que
utilizavam heparinização mais AAS28,29. Embora os resultados
desses estudos tenham sido bastante heterogêneos (de modo
geral sugerindo benefício com o uso dos bloqueadores GP
IIb/IIIa de pequena molécula, mas não com o abxicimabe),
uma meta-análise30 demonstrou redução de apenas 9% no
risco relativo de óbito ou infarto aos 30 dias de seguimento
(p = 0,015), sendo o benefício restrito aos pacientes de maior
risco (troponina elevada e/ou com depressão do segmento ST
e/ou submetidos a ICP).
Nos pacientes em uso de dupla antiagregação plaquetária
oral conduzidos por estratégia invasiva precoce, a utilização
dos inibidores da GP IIb/IIIa pode ser iniciada na sala
de hemodinâmica, frente à ICP de alta complexidade,
presença de alta carga trombótica, fenômeno de
no‑reflow ou múltiplos sítios de instabilidade de placas
ateroscleróticas. O uso dos inibidores da GP IIb/IIIa deve
ser sempre individualizado e não rotineiro.
Antitrombínicos
A terapia antitrombínica deve ser administrada em todos
os pacientes com SIMI de moderado e alto risco, salvo
contraindicações. As heparinas de baixo peso molecular
(HBPM) de uma forma geral são pelo menos tão eficazes quanto
a heparina não fracionada (HNF), entretanto, a enoxaparina
aparentemente é superior à HNF31,32. Nos pacientes que
receberam enoxaparina para tratamento de SIMISSST e enviados
para ICP em até 8 horas após a última dose subcutânea, não
há necessidade de anticoagulação adicional. Naqueles que
vão à ICP entre 8 e 12 horas, uma dose adicional de 0,3 mg/kg
intravenosa deve ser administrada logo antes do procedimento.
Por fim, sugere‑se manter a heparina inicialmente utilizada
durante todo o período de heparinização, evitando‑se o
uso de HBPM e HNF concomitante ou alternadamente.
O fondaparinux mostrou-se equivalente à enoxaparina na
redução de eventos isquêmicos, estando associado, porém, a
uma importante redução de sangramentos graves33.
Diagnóstico e estratificação de risco com
métodos complementares
A estratificação de risco deve ser um processo contínuo,
desde a avaliação clínica inicial, passando pelos exames
subsidiários já discutidos nesta diretriz, e culminando com
os métodos complementares expostos a seguir.
Existem, hoje, evidências consistentes do benefício
da estratégia “intervencionista” ou “invasiva” precoce
nas SIMISSST, na qual objetiva-se a realização do exame
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
cineangiocoronariográfico habitualmente nas primeiras
24 horas da admissão do paciente34. Vale assinalar que o
benefício observado com a estratégia “intervencionista” tende
a ser maior no seguimento de longo prazo, quando comparado
à fase inicial, na qual, paradoxalmente, o risco com o emprego
dessa estratégia pode ser maior35. Também demonstra maior
benefício quanto maior seja o risco de eventos isquêmicos
do paciente. Ademais, adequado regime antitrombótico
com antiplaquetários e antitrombínicos é fundamental para
o sucesso dessa abordagem.
Estudo hemodinâmico e cineangiocardiográfico
Em essência, permite a visualização direta da luz coronária,
com avaliação da extensão e gravidade das obstruções, e
análise das funções ventriculares sistólica e diastólica, globais e
regionais. O exame pode ainda incluir avaliação do significado
funcional das lesões anatomicamente detectadas, por
mensuração direta da reserva fracionada de fluxo coronário
(FFR). Entretanto, é importante ressaltar que, no contexto
de SIMI, esse método complementar de avaliação é de
aplicabilidade limitada, em face da mutabilidade intrínseca das
obstruções (placas ateroscleróticas frequentemente ulceradas,
complexas e com alta carga trombótica), não tendo sido ainda
devidamente validado por estudos adequados.
Teste ergométrico
O TE pode constituir a abordagem de estratificação de
risco inicial em pacientes com SIMI quando outros recursos
não invasivos não estiverem disponíveis, nem houver
indicação para a estratégia invasiva. Além de oferecer
subsídios diagnósticos, tem reconhecido valor prognóstico.
Testes positivos associam-se a maior incidência de eventos
coronários em um ano, quando em comparação com testes
negativos. É um procedimento econômico, seguro e de fácil
aplicação. Seu valor preditivo negativo é muito elevado, de
98% a 100%, embora com valor preditivo positivo modesto,
de aproximadamente 50%. O TE, com objetivo de estimar
o prognóstico e auxiliar na decisão clínica, é indicado
principalmente em pacientes de risco intermediário, nos
quais pode ser realizado de 24 a 48 horas após completa
estabilização clínica (estabilidade hemodinâmica, ausência de
isquemia ativa clínica ou eletrocardiográfica, de novas ondas
Q, de sinais clínicos de insuficiência cardíaca e marcadores
de necrose miocárdica normais) e desde que haja capacidade
para o exercício. Os testes devem ser realizados em esteira
ou bicicleta ergométrica, em ambiente hospitalar e sempre
limitados por sintomas36.
Exames ecocardiográficos
Ecocardiografia com estresse
O ecocardiograma sob estresse permite a verificação
das anormalidades regionais transitórias da contração,
indicativas de isquemia induzida. O estresse farmacológico
com dobutamina é seguro e eficaz nesse contexto, além
de propiciar informações prognósticas. Aplicam-se,
entretanto, a esse método as mesmas restrições de cautela
e contraindicações expostas para o TE. São consideradas
respostas indicativas de maior risco: incapacidade de
aumentar a FE ou a diminuição da mesma > 5% ao esforço
e defeitos regionais de contração durante o estresse.
Respostas de melhora de contração segmentar em áreas
dissinérgicas, com doses iniciais de dobutamina (5 a
10 mg/kg/min), identificam viabilidade miocárdica nessas
regiões “atordoadas” pela isquemia pregressa.
Estudos com avaliação da perfusão miocárdica
O desenvolvimento de contrastes contendo microbolhas
de menor diâmetro e maior estabilidade, associado a avanços
tecnológicos, como a imagem harmônica intermitente e a
imagem com baixo índice mecânico, permitiu o estudo da
perfusão miocárdica pela ecocardiografia. O uso de contrastes
ecocardiográficos durante a ecocardiografia sob estresse pela
dobutamina com análise de imagem em tempo real permite
uma avaliação simultânea da perfusão miocárdica e das
alterações de motilidade segmentar.
Métodos de medicina nuclear
Cintilografia miocárdica de perfusão
A cintilografia miocárdica de perfusão (CMP) e a
ventriculografia nuclear têm um grande valor diagnóstico e
prognóstico nas coronariopatias agudas. A CMP é indicada
fundamentalmente nos casos de impossibilidade de realização
do TE e em pacientes nos quais há dificuldades para a
interpretação adequada do ECG de esforço. Pacientes com
diagnóstico de SIMI, que apresentam cintilografia normal
durante o estresse, pertencem a um subgrupo com risco
notadamente reduzido de eventos graves, de cerca de 1% em
um ano, enquanto a detecção de defeitos reversíveis expressa
prognóstico desfavorável, com taxa de eventos da ordem de
20% para o mesmo prazo de seguimento.
Angiocardiografia nuclear
Obtida por meio da sincronização do estudo cintilográfico
tomográfico com o ECG (gated SPECT). Assim, é possível
avaliar a função sistólica regional e estimar a FE ventricular,
agregando mais informações diagnósticas e prognósticas.
Ressonância magnética cardiovascular
A ressonância magnética cardiovascular (RMC) é
capaz de fornecer informações precisas sobre os aspectos
morfológicos do coração, a quantificação dos volumes,
a massa e a função ventricular global e regional; pode
promover avaliação de isquemia miocárdica (pela análise
da contratilidade segmentar sob estresse com dobutamina e
sem uso de contraste ou pela técnica de perfusão miocárdica
sob estresse com vasodilatadores como o dipiridamol ou
a adenosina e com uso de gadolínio) e a avaliação da
fibrose/necrose miocárdica pela técnica do realce tardio
miocárdico. A técnica do realce tardio também permite a
detecção de áreas de hipossinal (áreas escuras) no meio da
área de hipersinal (infarto), o que se relaciona com áreas
de obstrução microvascular (no-reflow phenomenon) e
Arq Bras Cardiol. 2015; 105(3):214-227
219
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
também acrescenta informação prognóstica nessa população.
Além dessas aplicações, a RMC é bastante útil na diferenciação
das miocardiopatias isquêmicas das não isquêmicas, sendo
utilizada para o diagnóstico de miocardite e Takotsubo.
Ademais, na situação de elevação de marcadores de necrose
miocárdica e cateterismo “normal”, a RMC pode confirmar
a presença do infarto, que poderia estar relacionado com
espasmo ou síndromes trombofílicas, entre outros37.
Revascularização miocárdica
A estratégia de revascularização (cirurgia ou angioplastia)
segue recomendações similares às dos pacientes com DAC
estável. A principal diferença na abordagem dos pacientes
com AI ou IAM sem supradesnível do seguimento ST ocorre
em relação ao maior benefício da revascularização precoce
naqueles com maior risco para desfechos isquêmicos.
Os pacientes com SIMI, em especial os classificados no
segundo tercil do SYNTAX Score, devem ser avaliados pelo
“Heart Team”, e a decisão sobre o tipo de revascularização,
ou mesmo o tratamento clínico isolado, deve ainda considerar
fatores circunstanciais relativos à experiência de cada centro.
Cirurgia de revascularização miocárdica
Apresenta maior possibilidade de se obter uma
revascularização completa quando comparada à angioplastia.
Seu benefício merece destaque nos subgrupos de pacientes
diabéticos ou com disfunção ventricular.
Recentemente desenvolvido, o SYNTAX Score é
uma ferramenta que auxilia na escolha da estratégia
de revascularização, pois pacientes que apresentam
SYNTAX Score > 22 apresentam melhores resultados ao
longo prazo quando submetidos a CRM em detrimento
da angioplastia38.
Intervenção coronária percutânea
Nas últimas décadas, a ICP apresentou evolução em
diversos aspectos: maior experiência dos cardiologistas
intervencionistas, melhor qualidade dos equipamentos
utilizados (catéteres, stents, balões) e medicações adjuvantes
(antiagregantes e anticoagulantes) mais eficazes e seguras.
Tais avanços permitiram contínuo e intenso crescimento
numérico das indicações de ICP, promovendo assim seu
emprego em situações de maior complexidade (lesões de
tronco da coronária esquerda, pacientes multiarteriais e com
disfunção do VE).
As principais recomendações e respectivos níveis de
evidência na estratificação de risco e condutas nas primeiras
220
Arq Bras Cardiol. 2015; 105(3):214-227
12 horas após a chegada do paciente ao hospital estão
dispostas nas tabelas 4 a 9.
Contribuição dos autores
Concepção e desenho da pesquisa, Obtenção de dados,
Redação do manuscrito e Revisão crítica do manuscrito quanto
ao conteúdo intelectual importante: Feitosa-Filho GS, Baracioli
LM, Barbosa CJDG, Franci A, Timerman A, Piegas LS, MarinNeto JA, Nicolau JC.
Potencial conflito de interesse
Dr. Gilson Soares Feitosa-Filho foi palestrante em eventos
ou atividades patrocinadas pela Sanofi Aventis, Daiichi Sankyo
e Astra Zeneca.
Dr. Luciano Moreira Baracioli participou de estudos
clínicos e/ou experimentais subvencionados pelo InCor,
Daiichi Sankyo, Lilly, Astra Zeneca e Bayer; Foi palestrante
em eventos ou atividades patrocinadas pela Astra Zeneca e
Daiichi Sankyo; Elaborou textos científicos em periódicos
patrocinados pela Sanofi e Astra Zeneca.
Dr. Ari Timerman participou de estudos clínicos e/ou
experimentais subvencionados pela Sanofi, Daiichi Sankyo
e Bayer.
Dr. Leopoldo Soares Piegas recebeu auxílio pessoal ou
institucional da Boehringer Ingelheim; Elaborou textos
científicos em periódicos patrocinados pela Astra Zeneca.
Dr. José Carlos Nicolau participou de estudos clínicos
e/ou experimentais subvencionados pela Lilly, AMGEN,
Daiichi Sankyo, Bayer, Sanofi, AstraZeneca, GSK, Novartis,
Roche, MSD; Foi palestrante em eventos ou atividades
patrocinadas pela Astra Zeneca, Sanofi, Bayer, Daiichi
Sankyo; Foi (é) membro do conselho consultivo ou diretivo
da Astra Zeneca, Sanofi, Bayer; Participou de comitês
normativos de estudos científicos patrocinados pela Lilly,
AMGEN, Daiichi Sankyo, Bayer, Sanofi, Astra Zeneca,
GSK, Novartis, Roche, MSD; Recebeu auxílio pessoal ou
institucional da Astra Zeneca, Sanofi, Bayer; Elaborou
textos científicos em periódicos patrocinados pela Astra
Zeneca, Sanofi.
Fontes de financiamento
O presente estudo não teve fontes de financiamento
externas.
Vinculação acadêmica
Não há vinculação deste estudo a programas de pós‑graduação.
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
Tabela 4 – Estratificação de risco e condutas nas primeiras 12 horas após a chegada do paciente ao hospital
Estratificação clínica
I (B)
Todos os pacientes devem ser avaliados e classificados em probabilidade alta,
intermediária ou baixa de apresentarem SIMISSST
I (B)
Todos os pacientes com SIMISSST devem ser estratificados e classificados em
risco alto, intermediário ou baixo de desenvolverem eventos cardíacos maiores. É
recomendável a classificação por mais de um método, e o pior cenário deve ser
levado em conta nas decisões quanto a condutas
I (B)
Todos os pacientes com SIMISSST devem ser estratificados e classificados em risco
alto, intermediário ou baixo de desenvolverem sangramento
Eletrocardiograma
I (C)
Todos os pacientes com SIMI ou suspeita de SIMI devem realizar ECG. Idealmente o
ECG deve ser realizado em até 10 minutos após a chegada do paciente ao hospital
(nível de evidência: B). O ECG deve ser repetido nos casos não diagnósticos, pelo
menos uma vez, em até 6 horas
Marcadores bioquímicos de necrose
I (B)
Marcadores bioquímicos de necrose miocárdica devem ser mensurados em todos os
pacientes com suspeita de SIMI. Os marcadores devem ser medidos na admissão e
repetidos pelo menos uma vez, 6-9 horas após (preferencialmente 9-12 horas após o
início dos sintomas), caso a primeira dosagem seja normal ou discretamente elevada
IIb (B)
CK-MB atividade isolada ou em associação a CK total
pode ser utilizada se CK-MB massa ou troponina não
estiverem disponíveis
IIb (B)
Para pacientes que chegam precocemente à emergência
(antes de 6 horas do início dos sintomas), mioglobina
e troponina ultrassensível podem ser consideradas em
adição a um marcador mais tardio (CK-MB ou troponina)
III (B)
Utilização de LDH, aspartato aminotransferase (TGO) ou
BNP/pró-BNP para detecção de necrose miocárdica em
pacientes com suspeita de SIMI
I (A)
CK-MB massa e troponinas são os marcadores bioquímicos de escolha
I (B)
Pacientes de risco baixo (clínica e ECG) e com marcadores bioquímicos normais
devem ser encaminhados para TE após 9 horas, idealmente até 12 horas, em
regime ambulatorial
I (B)
Na impossibilidade de realização do TE ou nos casos de ECG não interpretável, o
paciente pode ser estratificado com teste provocativo de isquemia com imagem
I (B)
Protocolos em esteira rolante ou cicloergômetro devem ser adaptados às condições
clínicas e biomecânicas de cada paciente
I (C)
O ecocardiograma transtorácico deve ser realizado no diagnóstico diferencial com
outras doenças, quando houver suspeita clínica de doenças de aorta, doenças do
pericárdio, embolia pulmonar e valvopatias
IIa (B)
Pacientes em vigência de dor torácica podem ser
avaliados por ecocardiograma em repouso para
determinar a origem isquêmica ou não da dor
I (C)
Nos casos de complicações decorrentes de SIMI, como comunicação interventricular
e insuficiência mitral.
IIa (B)
Pacientes com infarto não complicado de parede anterior
a fim de determinar o tamanho exato da injúria isquêmica
I (B)
Ecocardiografia de estresse é uma alternativa para os pacientes com impossibilidade
de realizarem o TE
IIa (A)
Pacientes em vigência de dor torácica podem ser avaliados
pela cintilografia miocárdica de perfusão em repouso para
determinar a origem isquêmica ou não da dor
Teste ergométrico
Ecocardiograma
Cintilografia de perfusão miocárdica
I (C)
Cintilografia de perfusão miocárdica em estresse e repouso é uma alternativa ao TE
nos pacientes com impossibilidade para o mesmo
Angiografia por tomografia computadorizada das artérias coronárias
I (A)
Em pacientes com dor torácica aguda de risco baixo a intermediário, com ECG não
diagnóstico e marcadores de necrose miocárdica negativos
SIMISSST: Síndromes isquêmicas miocárdicas instáveis sem supradesnível do segmento ST; ECG: Eletrocardiograma; TE: Teste ergométrico.
Arq Bras Cardiol. 2015; 105(3):214-227
221
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
Tabela 5 – Terapêutica inicial nos pacientes de risco intermediário e alto
Internação em unidade coronária de terapia intensiva
I (C)
Todos os pacientes com SIMI de risco intermediário e alto devem ser internados em
unidade coronária de terapia intensiva até que a conduta definitiva para o seu caso
seja tomada
Oxigenoterapia
I (C)
Oxigenoterapia em pacientes com risco intermediário e alto (2 a 4 l/min) por 4 horas,
ou por tempos maiores na presença de dessaturação < 90%
Analgesia e sedação
I (C)
Administrar sulfato de morfina a pacientes de risco intermediário e alto
I (C)
Administrar benzodiazepínicos a pacientes de alto risco
IIa (C)
Administrar benzodiazepínicos a pacientes de
risco intermediário
IIb (B)
Administrar betabloqueadores IV a pacientes de risco
intermediário e alto
IIa (B)
Diidropiridínicos de ação prolongada na presença de
isquemia refratária para pacientes em uso adequado de
nitratos e betabloqueadores e sem disfunção ventricular
IIb (B)
Derivados não diidropiridínicos de ação prolongada
como substitutos dos betabloqueadores e derivados
diidropiridínicos de início de ação rápido para pacientes de
alto risco já em uso adequado de betabloqueadores
III (B)
Derivados diidropiridínicos de início de ação rápido em
pacientes sem uso adequado de betabloqueadores
IIb (B)
IECA a todos os pacientes de risco intermediário e alto
Nitratos
I (C)
Uso de nitrato em pacientes com risco intermediário e alto
Betabloqueadores adrenérgicos
I (B)
Administrar betabloqueadores VO a pacientes de risco intermediário e alto
Antagonistas dos canais de cálcio
I (B)
Pacientes com risco intermediário e alto. Uso de derivado não-diidropiridínico em
casos de contraindicação aos betabloqueadores
Inibidores do sistema renina-angiotensina-aldosterona
I (A)
IECA para pacientes de risco intermediário e alto com disfunção ventricular esquerda,
hipertensão ou diabetes mellitus
I (C)
Bloqueadores dos receptores da angiotensina para pacientes de risco intermediário e
alto com contraindicação a IECA
SIMI: Síndromes isquêmicas miocárdicas instáveis; IECA: Inibidores da enzima conversora da angiotensina.
222
Arq Bras Cardiol. 2015; 105(3):214-227
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
Tabela 6 – Antiagregação e anticoagulação nos pacientes de risco intermediário e alto
Antiagregantes plaquetários orais
I (A)
AAS, (162-300 mg em dose de ataque, com dose de manutenção de 81-100 mg/dia)
em todos os pacientes, salvo contraindicações, independentemente da estratégia de
tratamento, por tempo indeterminado
I (B)
Tienopiridínicos em pacientes com contraindicação ao AAS
I (B)
Uso de terapia antiplaquetária dupla por 12 meses após o evento agudo, salvo
contraindicações
I (A)
Clopidogrel (300 mg em dose de ataque, com dose de manutenção de 75 mg/dia)
em adição ao AAS, em pacientes portadores de SIMISSST de risco intermediário ou
alto por 12 meses
IIa (B)
Clopidogrel (600 mg em dose de ataque seguidos por
150 mg/dia por 7 dias e dose posterior de 75 mg/dia), em
adição ao AAS, em pacientes submetidos a ICP com alto
risco de eventos isquêmicos e baixo risco de sangramento
I (B)
Ticagrelor (180 mg em dose de ataque seguidos por 90 mg duas vezes ao dia) em
pacientes portadores de SIMISSST de risco intermediário ou alto, independente da
estratégia de tratamento posterior (clínico, cirúrgico ou percutâneo), por 12 meses
IIa (B)
Reinício de ticagrelor, prasugrel ou clopidogrel após cirurgia
de revascularização miocárdica, assim que seguro
I (B)
Prasugrel (60 mg em dose de ataque seguidos por 10 mg ao dia) em pacientes
portadores de SIMISSST de risco moderado ou alto, com anatomia coronária
conhecida, tratados com ICP e sem fatores de risco para sangramento
[idade ≥ 75 anos; com < 60 kg; AVC ou ataque isquêmico transitório prévios]
IIb (B)
Uso de testes de agregabilidade plaquetária ou testes
genéticos (genotipagem) em casos selecionados
III (C)
Combinação de AAS com outros anti-inflamatórios
não‑esteroidais
III (A)
Uso rotineiro dos inibidores da GP IIb/IIIa em pacientes
em uso de dupla antiagregação plaquetária antes
do cateterismo
IIa (B)
Tirofiban em pacientes de alto risco quando se opta por não
administrar tienopiridínico
IIa (C)
Adição de inibidores da GP IIb/IIIa em pacientes que
apresentam recorrência de sintomas isquêmicos na vigência
de dupla antiagregação plaquetária oral e anticoagulação
III (B)
Uso de abciximabe de rotina em pacientes de alto risco
III (A)
Uso rotineiro dos inibidores da GP IIb/IIIa em pacientes sob
uso de dupla antiagregação plaquetária antes do cateterismo
Antagonistas da glicoproteína IIb/IIIa – estratégia intervencionista precoce
I (A)
Abciximabe ou tirofiban em pacientes de alto risco quando se opta por não
ministrar tienopiridínicos
I (B)
Adição de um inibidor da glicoproteína (GP) IIb/IIIa em pacientes com baixo risco
hemorrágico, sob dupla antiagregação plaquetária, submetidos à ICP de alto risco
(presença de trombos, complicações trombóticas da ICP)
Antagonistas da glicoproteína IIb/IIIa – estratégia conservadora
Antitrombínicos
I (A)
HNF em todos os pacientes
I (A)
Uso de heparina de baixo peso molecular em todos os pacientes
IIa (A)
Uso de enoxaparina, preferencialmente à HNF, a não
ser que cirurgia de revascularização miocárdica esteja
planejada para as próximas 24 horas
I (B)
Uso de fondaparinux 2,5 mg SC uma vez ao dia por 8 dias ou até a alta hospitalar
IIa (C)
Considerar interrupção da anticoagulação após a ICP,
exceto se houver outra indicação para mantê-la
I (B)
Nos pacientes em uso de fondaparinux, administrar HNF 85 UI/kg EV, no momento da
ICP, ou 60 UI/kg àqueles que estiverem recebendo inibidores da GP IIb/IIIa
III (B)
Troca de heparinas (HNF e enoxaparina)
AAS: Uso de ácido acetilsalicílico; SIMISSST: Síndromes isquêmicas miocárdicas instáveis sem supradesnível do segmento ST; ICP: Intervenção coronariana
percutânea; AVC: Acidente vascular cerebral; HNF: Uso de heparina não fracionada.
Arq Bras Cardiol. 2015; 105(3):214-227
223
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
Tabela 7 – Estratificação de risco com métodos complementares nos pacientes de risco intermediário e alto
Estudo hemodinâmico e angiocardiográfico
III (C)
Não se deve indicar a angiografia coronária de rotina – mesmo
para pacientes com risco intermediário/alto – nas seguintes
situações: pacientes com comorbidade importante e reduzida
expectativa de vida, ou sem perspectiva de tratamento por
revascularização miocárdica
IIb (C)
Realização de TE em pacientes de alto risco após 48 horas
III (C)
Realização de TE em pacientes de alto risco antes de 48 horas
IIa (B)
Ecocardiografia de estresse como alternativa ao TE
III (C)
Ecocardiografia de estresse em pacientes de alto risco
IIa (B)
Ecocardiografia transtorácica contrastada para melhora do sinal
Doppler em pacientes com imagem subótima ou ecocardiografia
transtorácica contrastada para delineamento de margens
endocárdicas durante a ecocardiografia de estresse em pacientes
com imagens subótimas em repouso
IIb (B)
Ecocardiografia de estresse com microbolhas em pacientes com risco
intermediário nos quais persistem dúvidas após a realização de TE
III (B)
Ecocardiografia de estresse com microbolhas em pacientes com
alto risco
I (B)
Em pacientes com risco intermediário nos quais persistem dúvidas após a
realização de TE, ou impossibilitados de submeter-se ao TE
IIb (B)
Em pacientes com risco intermediário como primeira opção
de estratificação
I (B)
Para identificação da presença/extensão de isquemia em pacientes que
não podem realizar cateterismo, ou quando os resultados desse não são
suficientes para o estabelecimento de condutas
III (C)
Em pacientes de alto risco antes das primeiras 48 horas de
estabilização
I (A)
Após o cateterismo, para identificação da artéria relacionada com o evento
(região a ser revascularizada), e/ou estratificação complementar de risco
I (A)
Em pacientes com regiões ventriculares discinéticas, em que se torna
necessário comprovar ou excluir a presença de miocárdio viável para
guiar a conduta terapêutica
I (A)
Em pacientes de risco intermediário e alto para avaliar as funções
ventriculares esquerda e direita
IIa (C)
Em pacientes de risco intermediário e alto para identificação de
envolvimento do ventrículo direito
I (A)
Realização precoce de estudo hemodinâmico e cineangiocardiográfico de
contraste radiológico em pacientes com risco intermediário e alto
I (B)
Realização de TE em pacientes de risco intermediário
Teste ergométrico
Ecocardiografia de estresse
I (B)
Ecocardiografia de estresse em pacientes nos quais persistem dúvidas após
serem submetidos a TE
Ecocardiografia com avaliação da perfusão
Cintilografia miocárdica de perfusão
Ventriculografia radioisotópica
Ressonância nuclear magnética cardiovascular
I (A)
Na avaliação da função ventricular, da presença/extensão da área de
necrose e viabilidade
IIa (B)
No diagnóstico diferencial de pacientes que apresentam quadro
clínico compatível com coronariopatia aguda, porém com ECG
apresentando alterações inespecíficas e marcadores bioquímicos de
necrose negativos
I (A)
Na pesquisa de eventuais alterações mecânicas
IIb (B)
Como adjuvante no diagnóstico de SIMI, principalmente nos
pacientes com probabilidade intermediária ou alta
TE: Teste ergométrico; ECG: Eletrocardiograma; SIMI: Síndromes isquêmicas miocárdicas instáveis.
224
Arq Bras Cardiol. 2015; 105(3):214-227
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
Tabela 8 – Revascularização miocárdica
Doença arterial coronária complexa
I (C)
Equipe cardiológica multidisciplinar (heart team – clínico, cirurgião e hemodinamicista)
I (B)
Conhecimento do risco cirúrgico do paciente (escore próprio da instituição e/ou STS
Score e/ou Euroscore)
I (B)
Conhecimento da anatomia coronária (SYNTAX Score)
Lesão de tronco da coronária esquerda
I (B)
CRM
IIa (B)
Angioplastia: se paciente com alto risco para cirurgia ou
se com angina instável ou infarto agudo do miocárdio sem
supradesnível de ST e não candidato à cirurgia
IIa (B)
Cirurgia tem maior benefício do que angioplastia, se
SYNTAX Score > 22
IIb (B)
Angioplastia
IIa (B)
Angioplastia
IIa (B)
CRM com uso da artéria torácica interna
IIa (B)
Angioplastia
III ( )
CRM
IIa ( )
Cirurgia preferível em relação à angioplastia em pacientes
com doença multiarterial complexa com ou sem DA proximal
(SYNTAX Score > 22)
III ( )
Coronárias sem condições anatômicas para
revascularização ou ausência de isquemia
Triarterial c/ ou s/ lesão em DA
I (B)
CRM
Biarterial com lesão proximal em DA
I (B)
CRM
Biarterial sem lesão proximal em DA
Uniarterial sem lesão em DA proximal
I()
Angioplastia com grande área de miocárdio em risco
Estratégia de revascularização para alívio de angina
I()
Angioplastia ou CRM no caso de um ou mais vasos comprometidos e persistência da
angina apesar do tratamento clínico otimizado
CRM: Cirurgia de revascularização miocárdica; DA: Descendente anterior; IAM: Infarto agudo do miocárdio.
Tabela 9 – Prevenção secundária
Orientações gerais
I (C)
Instruções detalhadas devem ser fornecidas aos pacientes com SIMISSST e incluir educação sobre medicamentos, dieta, esforço físico, retorno às
atividades laborativas e encaminhamento para unidade de reabilitação cardíaca/programa de prevenção secundária. Pacientes tratados clinicamente de
baixo risco e revascularizados devem ter seu primeiro retorno em 2 a 6 semanas, e aqueles de maior risco devem retornar dentro de 14 dias
Cessação do tabagismo
I (B)
Recomendam-se a cessação do tabagismo e não exposição a ambientes com fumantes, tanto no trabalho quanto no lar. Acompanhamento no longo
prazo, encaminhamento a programas específicos ou farmacoterapia (incluindo reposição de nicotina) são úteis quando associados às clássicas
estratégias não farmacológicas
Abordagem lipídica
I (C)
A abordagem terapêutica lipídica deve incluir a avaliação de perfil lipídico em jejum de todos os pacientes ainda nas primeiras 24 horas de hospitalização
I (A)
Para pacientes com SIMISSST e LDL-C ≥ 100 mg/dL, as estatinas devem ser utilizadas na ausência de contraindicações, visando alcançar uma meta de
LDL-C < 70 mg/dL
SIMISSST: Síndromes isquêmicas miocárdicas instáveis sem supradesnível do segmento ST.
Arq Bras Cardiol. 2015; 105(3):214-227
225
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
Referências
1.
Braunwald E. Unstable angina: a classification. Circulation. 1989;80(2):410-4.
2. Antman EM, Cohen M, Bernink PJ, McCabe CH, Horacek T, Papuchis
G, et al. The TIMI risk score for unstable angina/non-ST elevation MI:
a method for prognostication and therapeutic decision making. JAMA.
2000;284(7):835-42.
3. Fox KA, Dabbous OH, Goldberg RJ, Pieper KS, Eagle KA, Van de Werf F, et
al. Prediction of risk of death and myocardial infarction in the six months
after presentation with acute coronary syndrome: prospective multinational
observational study (GRACE). BMJ. 2006;333(7578):1091.
4.
Subherwal S, Bach RG, Chen AY, Gage BF, Rao SV, Newby LK, et al. Baseline
risk of major bleeding in non-ST-segment-elevation myocardial infarction:
the CRUSADE (Can Rapid risk stratification of Unstable angina patients
Suppress ADverse outcomes with Early implementation of the ACC/AHA
Guidelines) Bleeding Score. Circulation. 2009;119(14):1873-82.
5.
Mehran R, Pocock SJ, Nikolsky E, Clayton T, Dangas GD, Kirtane AJ, et al. A
risk score to predict bleeding in patients with acute coronary syndromes. J
Am Coll Cardiol. 2010;55(23):2556-66.
6. Armstrong PW, Fu Y, Chang WC, Topol EJ, Granger CB, Betriu A, et al.
Acute coronary syndromes in the GUSTO-IIb trial: prognostic insights and
impact of recurrent ischemia. The GUSTO-IIb Investigators. Circulation.
1998;98(18):1860-8.
7. Galvani M, Ottani F, Ferrini D, Ladenson JH, Destro A, Baccos D, et al.
Prognostic influence of elevated values of cardiac troponin I in patients with
unstable angina. Circulation. 1997;95(8):2053-9.
8. Thygesen K, Alpert S, Jaffe AS, Simoons ML, Chaitman BR, White HD, et
al; Joint ESC/ACCF/AHA/WHF Task Force for the Universal Definition of
Myocardial. Third universal definition of myocardial infarction. Eur Heart J.
2012;33(20):2551-67.
9.
Giannitsis E, Kurz K, Hallermayer K, Jarausch J, Jaffe AS, Katus HA. Analytical
validation of a high-sensitivity cardiac troponin T assay. Clin Chem.
2010;56(2):254-61.
10. Gomez MA, Anderson JL, Karagounis LA, Muhlestein JB, Mooers FB. An
emergency department-based protocol for rapidly ruling out myocardial
ischemia reduces hospital time and expense: results of a randomized study
(ROMIO). J Am Coll Cardiol. 1996;28(1):25-33.
11. Sabia P, Afrookteh A, Touchstone DA, Keller MW, Esquivel L, Kaul S. Value
of regional wall motion abnormality in the emergency room diagnosis of
acute myocardial infarction: a prospective study using two-dimensional
echocardiography. Circulation. 1991;84(3 Suppl):I85-92.
19. Held PH, Yusuf S, Furberg CD. Calcium channel blockers in acute myocardial
infarction and unstable angina: an overview. BMJ. 1989;299(6709):1187-92.
20. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Effects of an
angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events
in high-risk patients. The Heart Outcomes Prevention Evaluation Study
Investigators. N Engl J Med. 2000;342(3):145-53. Erratum in: N Engl J Med.
2000;342(10):748, N Engl J Med. 2000;342(18):1376.
21. Theroux P, Ouimet H, McCans J, Latour JG, Joly P, Levy G, et al.
Aspirin, heparin, or both to treat acute unstable angina. N Engl J Med.
1988;319(17):1105-11.
22. Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK; Clopidogrel
in Unstable Angina to Prevent Recurrent Events Trial Investigators. Effects of
clopidogrel in addition to aspirin in patients with acute coronary syndromes
without ST-segment elevation. N Engl J Med. 2001;345(7):494- 502. Erratum
in: N Engl J Med. 2001;345(20):1506, N Engl J Med. 2001;345(23):1716.
23. Mehta SR, Bassand JP, Chrolavicius S, Diaz R, Eikelboom JW, Fox KA, et al;
CURRENT-OASIS 7 Investigators. Dose comparisons of clopidogrel and
aspirin in acute coronary syndromes. N Engl J Med. 2010;363(10):930-42.
Erratum in: N Engl J Med. 2010;363(16):1585.
24. Breet NJ, van Werkum JW, Bouman HJ, Kelder JC, Ruven HJ, Bal ET, et al.
Comparison of platelet function tests in predicting clinical outcome in
patients undergoing coronary stent implantation. JAMA. 2010;303(8):75462. Erratum in: JAMA. 2010;303(13):1257. JAMA. 2011;305(21):2174.
JAMA. 2011;305(21):2172-3.
25. Ho PM, Maddox TM, Wang L, Fihn SD, Jesse RL, Peterson ED, et al. Risk of adverse
outcomes associated with concomitant use of clopidogrel and proton pump
inhibitors following acute coronary syndrome. JAMA. 2009;301(9):937-44.
26. Wiviott SD, Braunwald E, McCabe CH, Montalescot G, Ruzyllo W, Gottlieb S,
et al; TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients
with acute coronary syndromes. N Engl J Med. 2007,15;357(20):2001-15.
27. Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, et
al. PLATO Investigators. Ticagrelor versus clopidogrel in patients with acute
coronary syndromes. N Engl J Med. 2009;361(11):1045-57.
28. A comparison of aspirin plus tirofiban with aspirin plus heparin for unstable
angina. Platelet Receptor Inhibition in Ischemic Syndrome Management
(PRISM) Study Investigators. N Engl J Med. 1998;338(21):1498-505.
12. Better N, Karthikeyan G, Vitola J, Fatima A, Peix A, Novak MD, et al.
Performance of rest myocardial perfusion imaging in the management of
acute chest pain in the emergency room in developing nations (PREMIER
trial). J Nucl Cardiol. 2012;19(6):1146-53.
29. Simoons ML; GUSTO IV-ACS Investigators. Effect of glycoprotein IIb/IIIa
receptor blocker abciximab on outcome in patients with acute coronary
syndromes without early coronary revascularization: the GUSTO IV-ACS
randomised trial. Lancet. 2001;357(9272):1915-24.
13. Hoffmann U, Truong QA, Schoenfeld DA, Chou ET, Woodard
PK, Nagurney JT, et al; ROMICAT-II Investigators. Coronary CT
angiography versus standard evaluation in acute chest pain. N Engl J
Med. 2012;367(4):299-308.
30. Boersma E, Harrington RA, Moliterno DJ, White H, Theroux P, Van de Werf F, et
al. Platelet glycoprotein IIb/IIIa inhibitors in acute coronary syndromes: a metaanalysis of all major randomised clinical trials. Lancet. 2002;359(9302):189-98.
14. Maroko PR, Radvany P, Braunwald E, Hale SL. Reduction of infarct size
by oxygen inhalation following acute coronary occlusion. Circulation.
1975;52(3):360-8.
15. Braunwald E, Jones RH, Mark DB, Brown J, Brown L, Cheitlin MD, et al.
Diagnosing and managing unstable angina. Agency for Health Care Policy
and Research. Circulation. 1994;90(1):613-22.
16. DePace NL, Herling IM, Kotler MN, Hakki AH, Spielman SR, Segal BL.
Intravenous nitroglycerin for rest angina: potential pathophysiologic
mechanisms of action. Arch Intern Med. 1982;142(10):1806-9.
17. Curfman GD, Heinsimer JA, Lozner EC, Fung HL. Intravenous nitroglycerin
in the treatment of spontaneous angina pectoris: a prospective, randomized
trial. Circulation. 1983;67(2):276-82.
226
18. Yusuf S, Wittes J, Friedman L. Overview of results of randomized clinical trials
in heart disease. II. Unstable angina, heart failure, primary prevention with
aspirin, and risk factor modification. JAMA. 1988;260(15):2259-63.
Arq Bras Cardiol. 2015; 105(3):214-227
31. Cohen M, Demers C, Gurfinkel EP, Turpie AG, Fromell GJ, Goodman S, et al.
A comparison of low-molecular-weight heparin with unfractionated heparin
for unstable coronary artery disease: efficacy and Safety of Subcutaneous
Enoxaparin in Non-Q-Wave Coronary Events Study Group. N Engl J Med.
1997;337(7):447-52.
32. Ferguson JJ, Califf RM, Antman EM, Cohen M, Grines CL, Goodman S, et
al; SYNERGY Trial Investigators. Enoxaparin vs unfractionated heparin in
high-risk patients with non-ST-segment elevation acute coronary syndromes
managed with an intended early invasive strategy: primary results of the
SYNERGY randomized trial. JAMA. 2004;292(1):45-54.
33. Mehta SR, Granger CB, Eikelboom JW, Bassand JP, Wallentin L, Faxon DP,
et al. Efficacy and safety of fondaparinux versus enoxaparin in patients with
acute coronary syndromes undergoing percutaneous coronary intervention:
results from the OASIS-5 trial. J Am Coll Cardiol. 2007;50(18):1742-51.
Feitosa-Filho e cols.
Angina Instável e IAM sem supra-ST
Artigo Especial
34. Mehta SR, Granger CB, Boden WE, Steg PG, Bassand JP, Faxon DP, et al;
TIMACS Investigators. Early versus delayed invasive intervention in acute
coronary syndromes. N Engl J Med. 2009;360(21):2165-75.
35. Bavry AA, Kumbhani DJ, Rassi AN, Bhatt DL, Askari AT. Benefit of early invasive
therapy in acute coronary syndromes: a meta-analysis of contemporary
randomized clinical trials. J Am Coll Cardiol. 2006;48(7):1319-25.
36. Meneghelo RS, Araújo CG, Stein R, Mastrocolla LE, Albuquerque PF, Serra SM,
et al; Sociedade Brasileira de Cardiologia. [III Guidelines of Sociedade Brasileira
de Cardiologia on the exercise test]. Arq Bras Cardiol. 2010;95(5 supl.1):1-26.
37. Sara L, Szarf G, Tachibana A, Shiozaki AA, Villa AV, de Oliveira AC, et al;
II Diretriz de Ressonância Magnética e Tomografia Computadorizada
Cardiovascular da Sociedade Brasileira de Cardiologia e do Colégio
Brasileiro de Radiologia. Arq Bras Cardiol. 2014;103(6 Suppl 3):1-86.
38. Mohr FW, Morice MC, Kappetein AP, Feldman TE, Ståhle E, Colombo A,
et al. Coronary artery bypass graft surgery versus percutaneous coronary
intervention in patients with three-vessel disease and left main coronary
disease: 5-year follow-up of the randomised, clinical SYNTAX trial. Lancet.
2013;381(9867):629-38.
Arq Bras Cardiol. 2015; 105(3):214-227
227
Voltar ao Índice da Capa
Artigo Original
Hiperatividade Simpática Cardíaca Após Quimioterapia: Sinal
Precoce de Cardiotoxicidade?
Cardiac Sympathetic Hyperactivity after Chemotherapy: Early Sign of Cardiotoxicity?
Sarita Lígia Pessoa de Melo Machado Guimarães1,2, Simone Cristina Soares Brandão1, Luciana Raposo Andrade3,
Rafael José Coelho Maia1,2, Brivaldo Markman Filho1
Pós-Graduação em Ciências da Saúde da Universidade Federal de Pernambuco (PGCS-UFPE)1, Hospital Agamenon Magalhães (HAM)2,
Hospital Santa Joana3, Recife, PE – Brasil
Resumo
Fundamento: A quimioterapia com antracíclicos e trastuzumabe pode causar cardiotoxicidade. A alteração da função
adrenérgica cardíaca, avaliada pela metaiodobenzilguanidina marcada com iodo-123 (123I-mIBG), parece preceder a
queda da fração de ejeção do ventrículo esquerdo.
Objetivo: Avaliar e comparar a presença de alterações cardiovasculares entre pacientes com câncer de mama submetidas
à quimioterapia com antracíclicos e trastuzumabe e apenas a antracíclico.
Métodos: Foram analisadas variáveis clínicas, laboratoriais, eletro e ecocardiográficas, além de atividade simpática
cardíaca. Nas imagens cintilográficas, foram calculadas a relação da captação do 123I-mIBG entre o coração e o mediastino,
e a taxa de clareamento. As variáveis foram comparadas entre os pacientes que receberam antracíclicos e trastuzumabe
(Grupo 1) e apenas antracíclicos (Grupo 2).
Resultados: Vinte pacientes, com idade média 57 ± 14 anos, participaram deste estudo. A fração de ejeção do ventrículo
esquerdo média pelo ecocardiograma foi 67,8 ± 4,0%. A taxa de clareamento média foi 28,39 ± 9,23%, e a relação da
captação do 123I-mIBG entre o coração e o mediastino foi de 2,07 ± 0,28. Dentre as pacientes, 82% mostraram taxa de
clareamento aumentada e 25%, uma relação da captação do 123I-mIBG entre o coração e o mediastino diminuída. Em relação
aos grupos, a média da taxa de clareamento no Grupo 1 foi de 32,68 ± 9,30% e, no Grupo 2, de 24,56 ± 7,72% (p = 0,06).
A relação da captação do 123I-mIBG entre o coração e o mediastino foi normal em todas as pacientes do Grupo 2, entretanto,
no Grupo 1, 50% mostraram relação da captação do 123I-mIBG entre o coração e o mediastino ≤ 1,8 (p = 0,02).
Conclusão: Em mulheres com câncer de mama submetidas à quimioterapia, a avaliação da atividade simpática cardíaca
com 123I-mIBG pode ser um marcador precoce de cardiotoxicidade. A associação de quimioterápicos proporcionou
maior risco de hiperatividade adrenérgica cardíaca. (Arq Bras Cardiol. 2015; 105(3):228-234)
Palavras-chave: Quimioterapia; Efeitos Colaterais e Reações Adversas Relacionadas a Medicamentos; Sistema Nervoso
Simpático; Neoplasias da Mama.
Abstract
Background: Chemotherapy with anthracyclines and trastuzumab can cause cardiotoxicity. Alteration of cardiac adrenergic function assessed by
metaiodobenzylguanidine labeled with iodine-123 (123I-mIBG) seems to precede the drop in left ventricular ejection fraction.
Objective: To evaluate and to compare the presence of cardiovascular abnormalities among patients with breast cancer undergoing
chemotherapy with anthracyclines and trastuzumab, and only with anthracycline.
Methods: Patients with breast cancer were analyzed clinical, laboratory, electrocardiographic and echocardiographic and cardiac sympathetic
activity. In scintigraphic images, the ratio of 123I-mIBG uptake between the heart and mediastinum, and the washout rate were calculated.
The variables were compared between patients who received anthracyclines and trastuzumab (Group 1) and only anthracyclines (Group 2).
Results: Twenty patients, with mean age 57 ± 14 years, were studied. The mean left ventricular ejection fraction by echocardiography was 67.8 ± 4.0%.
Mean washout rate was 28.39 ± 9.23% and the ratio of 123I-mIBG uptake between the heart and mediastinum was 2.07 ± 0.28. Of the patients, 82%
showed an increased in washout rate, and the ratio of 123I-mIBG uptake between the heart and mediastinum decreased in 25%. Concerning the groups,
the mean washout rate of Group 1 was 32.68 ± 9.30% and of Group 2 was 24.56 ± 7.72% (p = 0,06). The ratio of 123I-mIBG uptake between the
heart and mediastinum was normal in all patients in Group 2, however, the Group 1, showed 50% the ratio of 123I-mIBG uptake between the heart
and mediastinum ≤ 1.8 (p = 0.02).
Conclusion: In women with breast cancer undergoing chemotherapy, assessment of cardiac sympathetic activity with 123I-mIBG appears to be
an early marker of cardiotoxicity. The combination of chemotherapy showed higher risk of cardiac adrenergic hyperactivity. (Arq Bras Cardiol.
2015; 105(3):228-234)
Keywords: Drug Therapy; Drug-Related Side Effects and Adverse Reactions; Sympathetic Nervous System; Breast Neoplasms.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Simone Cristina Soares Brandão •
Av. Prof. Moraes Rêgo, s/n – Prédio das Pós-Graduações/2º andar – CCS – Cidade Universitária. CEP 50670-901, Recife, PE – Brasil.
E-mail: [email protected]; [email protected]
Artigo recebido em 04/05/2014; revisado em 14/10/2014; aceito em 21/11/2014.
DOI: 10.5935/abc.20150075
228
Guimarães e cols.
Cintilografia com 123I-mIBG e cardiotoxicidade
Artigo Original
Introdução
Em mulheres, o câncer de mama é a neoplasia mais comum,
e sua incidência vem aumentando. Com o envelhecimento da
população, devem ser agregados fatores de risco adicionais,
como as doenças cardiovasculares1,2.
A quimioterapia, que melhora a sobrevida, é fundamental
para o tratamento de diversos tipos de câncer, porém
traz potenciais riscos de toxicidade3. Por vários anos, os
antracíclicos têm sido utilizados no tratamento do câncer
de mama em seus diversos estágios4. Sua utilização tem se
demonstrado bastante vantajosa5,6.
Aproximadamente 20 a 30% dos pacientes com câncer de
mama têm tumores com amplificação do gene HER2/neu7,
cuja expressão proporciona menor resposta ao quimioterápico,
devido à acelerada taxa de crescimento de suas células
malignas6,7. Entretanto, o câncer de mama HER2 positivo
responde favoravelmente ao trastuzumabe, um anticorpo
monoclonal que tem como alvo esse receptor8.
Tanto os antracíclicos como o trastuzumabe estão
associados com injúria miocárdica1,3. A cardiotoxicidade é
uma complicação clinicamente silenciosa, que pode ocorrer
em até 27% das pacientes submetidas à quimioterapia9.
A avaliação cardiológica rotineira em usuários de
quimioterápicos é pelo rastreio de sintomas e pela
realização de eletrocardiograma e ecocardiograma seriados.
Uma vez detectado decréscimo na função ventricular,
medidas terapêuticas podem ser necessárias, inclusive a
suspensão do quimioterápico1.
A inervação autonômica desempenha um papel
fundamental na regulação da frequência cardíaca, na função
miocárdica e no fluxo sanguíneo miocárdico. Sua deficiência
geralmente significa doença e pode preceder alterações na
contratilidade miocárdica e também refletir a gravidade de
doença10. A avaliação da função autonômica cardíaca pode
ser realizada de forma não invasiva por meio de imagem
cintilográfica com radiotraçadores específicos.
Identificar novas formas de avaliação precoce de risco
cardiovascular em pacientes em tratamento com drogas
de potencial cardiotoxicidade é um desafio. O intuito é
evitar que os quimioterápicos sejam suspensos e que drogas
cardioprotetoras, como betabloqueadores e inibidores da
angiotensina, sejam iniciadas precocemente, evitando, assim,
mais dano e maior progressão de lesão ao miócito.
O objetivo deste estudo foi avaliar e comparar a presença
de alterações cardiovasculares entre pacientes com câncer
de mama, submetidas à quimioterapia com antracíclicos e
trastuzumabe, e apenas a antracíclicos.
Métodos
População do estudo
Estudo tipo série de casos tendo sido incluídos, de forma
consecutiva, 20 pacientes com câncer de mama (amostra por
conveniência), do sexo feminino e com idade ≥ 18 anos.
As pacientes foram posteriormente divididas em dois grupos:
Grupo 1, de pacientes que usaram antracíclicos associados
ao trastuzumabe; e Grupo 2, para pacientes que usaram
apenas antracíclicos. Pacientes sabidamente cardiopatas
ou com sintomas de insuficiência cardíaca foram excluídas
do estudo. Nenhuma paciente poderia ter doença de
Parkinson ou qualquer outra doença neurológica conhecida,
considerando que essas patologias podem causar alterações
na atividade simpática cardíaca com 123I-mIBG11.
As pacientes do Grupo 2 foram estudadas ao término do
tratamento com antracíclicos e as do Grupo 1, ao término
do tratamento com antracíclicos e durante tratamento com
trastuzumabe, já tendo recebido, no mínimo, duas infusões.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa
(protocolo número CAAE-0001.0.236.000-11). Todas as
pacientes concordaram em participar do estudo e assinaram
o Termo de Consentimento Livre e Esclarecido.
Local do estudo
Estudo de base hospitalar, realizado no período
de novembro de 2010 a maio de 2012, onde foram
selecionadas as pacientes encaminhadas da oncologia
ao ambulatório de cardiologia, para avaliação de risco
cardiovascular. Aquelas que preenchessem os critérios de
inclusão foram convidadas a participar deste estudo.
Variáveis do estudo
Todas as pacientes foram submetidas a: anamnese, exame
físico, eletrocardiograma, ecodopplercardiograma e cintilografia
cardíaca com 123I-mIBG. Os dados clínicos e laboratoriais,
como idade, peso, altura, índice de massa corporal, medida de
pressão arterial, medicações em uso, diabetes, fumo, colesterol
total, lipoproteína de alta densidade-colesterol (HDL-c) e
escore de risco de Framingham, foram obtidos e registrados
em formulário específico.
O escore de risco de Framingham foi calculado
considerando dados da anamnese (idade em anos, sexo
feminino, reconhecidamente diabético e fumante), do
exame físico (pressão arterial sistólica em repouso medida
em mmHg) e laboratoriais (valores das dosagens de colesterol
total, HDL-c e glicemia)12.
O eletrocardiograma foi considerado normal ou alterado,
seguindo as Diretrizes da Sociedade Brasileira de Cardiologia
sobre Análise e Emissão de Laudos Eletrocardiográficos13.
O ecodopplercardiograma foi realizado em aparelho
da marca Philips HD7, número de série CI51100623,
manufaturado em setembro de 2010 (Diagnostic Ultrasound
System, Bothell, Washington, Estados Unidos). A fração de
ejeção do ventrículo esquerdo (FEVE) foi calculada pelo
método de Teichholz. Os exames foram realizados conforme
orientação do Departamento de Imagem Cardiovascular da
Sociedade Brasileira de Cardiologia14.
Para a cintilografia cardíaca com 123I-mIBG, foram obtidas
imagens planas de tórax, cerca de 15 minutos (imagens
precoces) e 4 horas (imagens tardias) após a injeção
endovenosa, de 185 MBq (5 mCi) de 123I-mIBG (Figura 1).
As imagens foram adquiridas em gama-câmara tomográfica
com dois detectores, modelo Infinia Hawkeye-4 (General
Eletric Medical Systems, Milwaukee, Wisconsin, Estados
Unidos), com colimador para baixa energia e alta resolução.
Arq Bras Cardiol. 2015; 105(3):228-234
229
Guimarães e cols.
Cintilografia com 123I-mIBG e cardiotoxicidade
Voltar ao Índice da Capa
Artigo Original
Figura 1 – Cintilografia cardíaca com 123I-mIBG de uma paciente do estudo na incidência anterior de tórax cerca de 15 minutos (precoce) e 4 horas (tardia) após a injeção
do 123I-mIBG. Fileira superior: imagens em preto e branco; fileira inferior: imagens coloridas. VE: Ventrículo esquerdo.
O fotopico de energia foi centrado em 159 KeV, com uma
janela de 20% e matriz de 128 x 128. Aquisição estática
de 10 minutos foi realizada na projeção anterior de tórax,
nas fases precoce e tardia, após a injeção do radioisótopo.
Uma região de interesse (ROI) foi desenhada manualmente
sobre o coração (C) e sobre uma área de nove pixels no
mediastino superior (M), sendo obtida a média de contagens
de cada uma dessas regiões. A relação coração/mediastino
(RC/M) e a taxa de clareamento (washout) em percentual
(TW) foram calculadas usando as imagens precoces e tardias.
A TW foi considerada como a percentagem de diminuição
da atividade cardíaca entre as imagens precoce e tardia
dentro da área do ventrículo esquerdo. Os valores de
RC/M ≤ 1,8 e de TW > 19% foram considerados anormais,
ou seja, indicativos de hiperatividade adrenérgica15. Em duas
pacientes do Grupo 1 e uma do Grupo 2, não foi possível
calcular a TW por problemas técnicos no dia da obtenção
das imagens.
Todas as pacientes receberam xarope de iodeto de potássio
(500 mg), por via oral, cerca de 1 hora antes da administração
do 123I-mIBG, para o bloqueio da glândula tireoide.
230
Arq Bras Cardiol. 2015; 105(3):228-234
Análise estatística
As variáveis quantitativas contínuas foram expressas
pela média e desvio padrão. Para comparação das variáveis
contínuas entre os dois grupos independentes, usou-se o
teste U de Mann-Whitney. As variáveis categóricas foram
expressas pelas frequências e percentuais. Para comparação
entre os grupos, das variáveis expressas em percentual,
usou‑se o teste canônico. Correlação de Spearman foi usada
no Grupo 1 para avaliar a correlação entre o número de
ciclos de trastuzumabe e as variáveis da cintilografia com
mIBG. Foi considerado um nível de significância estatística
de 5% (p < 0,05). O software usado foi o Statistical Package
for Social Science (SPSS), versão 13.0 (SPSS Inc., Chicago,
Illinois, Estados Unidos).
Resultados
Características clínicas, eletro e ecocardiográficas
A média de idade das 20 pacientes foi de 57,3 ± 13,8 anos.
O índice de massa corporal foi de 27,9 ± 4,0, que indica
Guimarães e cols.
Cintilografia com 123I-mIBG e cardiotoxicidade
Artigo Original
sobrepeso da população. O escore de risco de Framingham
médio foi de 5,7%, o que caracteriza um subgrupo de baixo
risco de eventos coronarianos em 10 anos. Em relação aos
grupos, não foram observadas diferenças significativas entre as
variáveis clínicas.
uma RC/M precoce diminuída, isto é, ≤ 1,8. Entretanto, no
Grupo 1, a TW foi normal em apenas uma paciente e, em
cinco, esse índice esteve > 30%, Tabela 2. Já no Grupo 2, 44%
das pacientes mostraram TW normal ou levemente alterada
e, em apenas duas, a TW foi > 30% (Tabela 3). A RC/M foi
normal em todas as pacientes do Grupo 2, entretanto, no
Grupo 1, 50% mostraram RC/M reduzida (p = 0,02).
Apenas duas pacientes apresentaram alterações
eletrocardiográficas na repolarização ventricular.
Ao ecocardiograma, a média de fração de ejeção foi
67,8 ± 4,0%. Todas as pacientes tinham FEVE > 55%, ou
seja, apresentavam função ventricular normal (Tabela 1).
Os diâmetros cavitários do átrio esquerdo e ventrículo
esquerdo estavam dentro dos parâmetros da normalidade.
Não foram observadas diferenças significativas entre as
variáveis ecocardiográficas entre os grupos.
Correlação entre o número de ciclos de trastuzumabe e a
atividade simpática cardíaca
Levando em consideração a variável número de ciclos
de trastuzumabe administrados nas pacientes do Grupo 1,
realizamos uma análise entre as medidas da cintilografia nas
pacientes que realizaram menos de oito ciclos (Rho) e as
que fizeram mais de oito ciclos (R2). Parece haver correlação
positiva entre a TW e o número de ciclos (rho = 0,47;
p = 0,06) e negativa entre a RC/M precoce e o número de
ciclos de trastuzumabe (rho = -0,40; p = 0,08).
Avaliação da atividade simpática cardíaca
Em relação à avaliação da atividade simpática cardíaca,
a média da TW, no Grupo 1, foi de 32,68 ± 9,30% e, no
Grupo 2, de 24,56 ± 7,72%, com p = 0,06 (Figura 1).
A RC/M precoce média foi de 1,94 ± 0,28, no Grupo 1, e de
2,20 ± 0,23, no Grupo 2 (p = 0,03).
Discussão
Este foi o primeiro estudo brasileiro em que foi utilizada
a cintilografia cardíaca com 123I-mIBG, com o intuito
de identificar lesão cardíaca precoce, após tratamento
Cerca de 82% das pacientes estudadas mostraram uma
TW aumentada (valor normal < 19%) e 25% apresentaram
Tabela 1 – Estatística descritiva das medidas do ecodopplercardiograma dos 20 pacientes
Variável
Média
DP
Mínimo
Máximo
AE (cm)
3,180
0,3365
2,60
3,80
DDVE (cm)
4,670
0,3342
4,00
5,60
DSVE (cm)
2,945
0,3137
2,60
3,90
E/A
1,049
0,3960
0,50
1,68
FEVE
67,850
4,0167
57,00
75,00
DP: Desvio padrão; AE: Átrio esquerdo; DDVE: Diâmetro diastólico do ventrículo esquerdo; DSVE: Diâmetro sistólico do ventrículo esquerdo; E/A: Relação entre as
velocidades das ondas E e A máximas por Doppler espectral transmitral; FEVE: Fração de ejeção do ventrículo esquerdo.
Tabela 2 – Características clínicas e os resultados dos exames dos pacientes do grupo 1 tratados com antraciclinas e trastuzumabe
Paciente
1
Idade (anos)
Ciclos
Risco Framingham (%)
HAS
DM
ECG
DD
IECA/Bbloq
TW (%)
RC/M
68
2
4
-
-
-
Sim
-
28
2,3
2
58
8
8
-
-
-
-
-
32,6
1,7
3
44
6
1
-
-
-
-
-
30,4
2,0
4
67
14
2
-
-
-
-
-
15,7
1,7
5
51
17
1
-
-
-
Sim
-
39,9
2,3
6
80
7
8
Sim
Sim
-
Sim
Sim
46,5
1,7
7
76
18
17
Sim
-
-
-
Sim
38,8
1,6
8
34
10
1
-
-
-
-
-
29,6
2,3
9
42
3
4
-
-
-
-
-
*
1,8
32
12
1
-
-
-
-
-
*
2,0
10
* Problemas técnicos impediram o cálculo da TW em duas pacientes. HAS: Hipertensão arterial sistêmica; DM: Diabetes melito; ECG: Eletrocardiograma;
DD: Disfunção diastólica verificada pelo ecodopplercardiograma; IECA: Inibidores da enzima conversora da angiotensina; Bbloq: Betabloqueador; TW: Taxa de
clareamento do mIBG; RC/M: Relação coração/mediastino do mIBG.
Arq Bras Cardiol. 2015; 105(3):228-234
231
Guimarães e cols.
Cintilografia com 123I-mIBG e cardiotoxicidade
Artigo Original
Tabela 3 – Características clínicas e resultados dos exames dos pacientes do grupo 2 tratados apenas com antraciclinas
Paciente
1
Idade (anos)
Risco Framingham (%)
44
<1
HAS
DM
ECG
DD
IECA/Bbloq
TW (%)
RC/M
25,9
2,0
2
63
1
21,2
2,0
3
50
1
27,5
2,2
34,1
2,3
*
2,1
4
60
1
5
77
22
Sim
Sim
6
65
11
Sim
7
61
11
Sim
8
53
3
9
69
13
52
7
10
Sim
Sim
Sim
19,3
2,2
Sim
Outro
29,8
2,2
14,7
2,4
34,6
1,9
14,0
2,7
Sim
Sim
Sim
Sim
Sim
* Problemas técnicos impediram o cálculo da TW em duas pacientes. HAS: Hipertensão arterial sistêmica; DM: Diabetes melito; ECG: Eletrocardiograma;
DD: Disfunção diastólica verificada pelo ecodopplercardiograma; IECA: Inibidores da enzima conversora da angiotensina; Bbloq: Betabloqueador; TW: Taxa de
clareamento do mIBG; RC/M: Relação coração/mediastino do mIBG.
quimioterápico, já que a disfunção autonômica pode preceder
a disfunção ventricular e, consequentemente, a queda da
fração de ejeção15.
A redução do débito cardíaco na insuficiência cardíaca
(IC) ativa uma série de adaptações na tentativa de manter
a homeostasia cardiovascular. Uma das mais importantes é
a ativação do sistema nervoso simpático (adrenérgico), que
ocorre no início da IC16. Os resultados deste estudo sugeriram
uma associação entre o uso de antracíclico e o aumento
da atividade simpática cardíaca; a adição do trastuzumabe
proporcionou uma hiperatividade adrenérgica ainda maior.
Vale ressaltar, como já apresentado, que todas essas pacientes
não apresentavam sinais clínicos e/ou ecocardiográficos clássicos
de IC e apenas duas tinham alterações eletrocardiográficas.
Assim, a alteração na atividade simpática cardíaca avaliada pela
cintilografia com 123I-mIBG pareceu preceder sinais clínicos
de IC e a queda na FEVE. Ela pode ser o gatilho inicial para
o desenvolvimento de IC sintomática, caso essa disfunção
neurormonal progrida ou piore.
Quando analisamos nossos resultados, notamos que, em
ambos os grupos, a maioria dos pacientes apresentou uma
taxa de clareamento acelerada de 123I-mIBG, isto é, > 19%.
A média da TW foi estatisticamente maior no Grupo 1 em
relação ao Grupo 2. Quando analisamos a RC/M precoce,
no Grupo 1, cinco pacientes (50%) apresentaram esse
índice ≤ 1,8 enquanto que, no Grupo 2, nenhuma paciente
apresentou esse índice diminuído. Além do mais, a média
da relação C/M foi estatisticamente inferior no Grupo 1.
Outro resultado interessante foi o da correlação entre o
número de ciclos de trastuzumabe e os índices de avaliação
da atividade simpática cardíaca. Uma tendência à correlação
positiva entre o valor da TW e negativa entre a RC/M e o
número de ciclos recebidos foram observadas. Isso sugere
que quanto mais ciclos recebidos, parece haver uma maior
alteração na inervação e na atividade simpática cardíaca.
Carrió e cols. 17 identificaram captação anormal de
I-mIBG em pacientes que usaram antracíclicos e, também,
123
232
Arq Bras Cardiol. 2015; 105(3):228-234
a RC/M foi mais baixa à medida que a dose cumulativa
dessa medicação progrediu. Jacobson e cols.18 identificaram
que pacientes portadores de IC com relação C/M < 1,6
apresentavam risco cardiovascular aumentado.
A disfunção sistólica, após exposição aos agentes
cardiotóxicos, é usualmente irreversível, progressiva e
letal 19. O desenvolvimento de IC ocorre em até 27%
das mulheres que usam a associação antraciclina com
trastuzumabe e, por isso, é preconizado um cuidadoso
controle clínico para essas pacientes 5. Novas modalidades
ecocardiográficas, como o uso do Doppler tecidual, strain
regional e strain rate, podem aumentar a sensibilidade
desse método em detectar disfunção ventricular
subclínica, como também novos marcadores bioquímicos,
como troponinas e peptídeo natriurético cerebral (BNP) 19.
Estudo brasileiro recente20, que incluiu 51 pacientes em
tratamento com trastuzumabe para câncer de mama
HER2-positivo avançado, mostrou que, ao terceiro mês
de tratamento, os dados clínicos e bioquímicos (dosagens
de troponina e Nt-proBNP) não foram estatisticamente
diferentes no início e após 3 meses com trastuzumabe.
Entretanto, observou-se diferença estatisticamente
significativa entre a relação E/e’ do início e ao terceiro mês
de seguimento, que foi estritamente relacionada a uma
redução na velocidade e’ miocárdica, conforme avaliado
por Doppler tecidual ao ecocardiograma.
Neste estudo, não fez parte dos nossos objetivos realizar
uma análise mais refinada da função diastólica pelo Doppler
tecidual. A análise da função diastólica foi obtida na nossa
casuística pelo ecocardiograma, por meio da relação das
velocidades A e E máximas por Doppler espectral transmitral,
e a avaliação foi feita apenas ao término do tratamento
quimioterápico com antracíclico e durante o tratamento com
trastuzumabe. Assim, não houve diferenças entre os grupos
em relação à frequência de disfunção diastólica. Três pacientes
do Grupo 1 e quatro do Grupo 2 apresentaram alteração no
relaxamento miocárdico, mas não houve relação com o grau
de hiperatividade adrenérgica cardíaca pelo 123I-mIBG.
Guimarães e cols.
Cintilografia com 123I-mIBG e cardiotoxicidade
Artigo Original
Estudos com maior número de pacientes utilizando esses
métodos mais sensíveis, juntamente de dados da cintilografia
cardíaca com 123I-mIBG, são úteis para melhor esclarecer
os resultados encontrados neste estudo, assim como o
acompanhamento em longo prazo desses pacientes com
atividade simpática cardíaca exacerbada.
Limitações do estudo
Importante ressaltar que as pacientes idosas, hipertensas
e/ou diabéticas podem ter disfunção simpática cardíaca
como parte da doença de base. Por outro lado, pacientes
em uso de drogas com potencial de cardioproteção, como
Inibidores da Enzima Conversora da Angiotensina (IECA) e
betabloqueadores, podem evoluir com melhora da função
simpática cardíaca e da disfunção sistólica7,21. Neste estudo,
quatro pacientes do Grupo 2 eram hipertensas e três pacientes
estavam em uso de drogas cardioprotetoras. No Grupo 1, duas
pacientes eram hipertensas, uma era diabética e duas estavam
em uso de medicações cardioprotetoras. Esses fatores devem
ter influenciado a avaliação da atividade simpática, porém,
como não foram estatisticamente diferentes entre os grupos,
a análise comparativa da atividade simpática cardíaca não
parece ter sofrido interferência.
Outra limitação deste estudo foi o pequeno tamanho
amostral. Apesar do tempo de coleta ter sido relativamente
grande, os oncologistas ainda não tinham a prática
de encaminhar pacientes para avaliação cardiológica.
Essa interação entre estas duas especialidades deve
ser encorajada, considerando o potencial cardiotóxico
desses medicamentos e o aumento da sobrevida dos
pacientes oncológicos, que podem vir a se curar ou a
conviver pacificamente com seu câncer, porém podem
morrer precocemente de cardiopatia secundária ao
tratamento oncológico, caso não seja diagnosticado e
tratado precocemente. A falta da inclusão de um grupo
controle também diminui a certeza destes resultados.
Entretanto, este estudo parece corroborar achados de
outro estudo já publicado6 e ressaltar a necessidade de
se confirmar com estudos maiores o valor da avaliação
da atividade simpática cardíaca com 123 I-mIBG no
acompanhamento de pacientes submetidos à quimioterapia
com drogas potencialmente cardiotóxicas.
Conclusão
Em mulheres portadoras de câncer de mama, submetidas
à quimioterapia com drogas potencialmente cardiotóxicas, a
avaliação da atividade simpática cardíaca com 123I-mIBG pode
ser um marcador inicial de lesão cardíaca. O uso de derivados
das antraciclinas com o tratuzumabe proporcionou maior
frequência e intensidade de hiperatividade adrenérgica cardíaca.
Estudos com maior casuística e comparando a avaliação da
atividade simpática cardíaca com mIBG antes e após tratamento
precisam ser feitos para maior certeza desses achados.
Contribuição dos autores
Concepção e desenho da pesquisa: Guimarães SLPMM,
Brandão SCS, Markman Filho B. Obtenção de dados: Guimarães
SLPMM, Brandão SCS, Andrade LR, Maia RJC, Markman Filho
B. Análise e interpretação dos dados: Guimarães SLPMM,
Brandão SCS, Andrade LR, Maia RJC, Markman Filho B. Análise
estatística: Guimarães SLPMM, Brandão SCS, Markman Filho B.
Redação do manuscrito: Guimarães SLPMM, Brandão SCS, Maia
RJC, Markman Filho B. Revisão crítica do manuscrito quanto ao
conteúdo intelectual importante:Brandão SCS, Markman Filho B.
Potencial Conflito de Interesse
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo não teve fontes de financiamento externas.
Vinculação Acadêmica
Este artigo é parte de dissertação de Mestrado de Sarita
Lígia Pessoa de Melo Machado Guimarães pelo Centro de
Ciências da Saúde da Universidade Federal de Pernambuco.
Referências
1. Kalil Filho R, Hajjar LA, Bacal F, Hoff PM, Diz Mdel P, Galas FR, et al.
1 a Diretriz brasileira de cardio-oncologiada Sociedade Brasileira de
Cardiologia. Arq Bras Cardiol. 2011;96(2 Supl.1):1-52.
5.
2.
6. Takeishi Y, Sukekawa H, Sakurai T, Saito H, Nishimura S, Shibu T, et al.
Noninvasive identification of anthracycline cardiotoxicity: comparison of
123I-MIBG and 123I-BMIPP imaging. Ann Nucl Med. 1994;8(3):177-82.
American Cancer Society. Patient navigator program helps guide, support,
and inform thousands of cancer patients through every step of their
journey. [Accessed in 2011 Nov 25]. Available from: http://www.cancer.
org/treatment/
3. Lee BL, Liedke PE, Barrios CH, Simon SD, Finkelstein DM, Goss PE.
Breast cancer in Brazil: present status and future goals. Lancet Oncol.
2012;13(3):e95-102.
4. Klein PM, Dybdal N. Trastuzumab and cardiac dysfunction: update on
preclinical studies. Semin Oncol. 2003;30(5 Suppl 16):49-53.
Feldman AM, Lorell BH, Reis SE. Trastuzumab in the treatment of metastatic
breast cancer: anticancer therapy versus cardiotoxicity. Circulation.
2000;102(3):272-4.
7. Kalay N, Basar E, Ozdogru I, Er O, Cetinkaya Y, Dogan A, et al. Protective
effects of carvedilol against anthracycline-induced cardiomyopathy. J Am
Coll Cardiol. 2006;48(11):2258-62.
8. Baselga J. Herceptin alone or in combination with chemotherapy in
the treatment of HER2- positive metastatic breast cancer: pivotal trials.
Oncology. 2001;61 Suppl 2:14-21.
Arq Bras Cardiol. 2015; 105(3):228-234
233
Guimarães e cols.
Cintilografia com 123I-mIBG e cardiotoxicidade
Artigo Original
9. Seidman A, Hudis C, Pierri MK, Shak S, Paton V, Ashby M, et al. Cardiac
dysfunction in the trastuzumab clinical trials experience. J Clin Oncol.
2002;20(5):1215-21.
16. Floras JS. Sympathetic activation in human heart failure: diverse
mechanisms, therapeutic opportunities. Acta Physiol Scand.
2003;177(3):391-8.
10.D’Alto M, Maurea S, Basso A, Varrella P, Polverino W, Bianchi U, et al. [The
heterogeneity of myocardial sympathetic innervation in normal subjects:
an assessment by iodine-123 metaiodobenzylguanidine scintigraphy].
Cardiologia. 1998;43(11):1231-6.
17. Carrió I, Cowie MR, Yamazaki J, Udelson J, Camici PG. Cardiac
sympathetic imaging with mIBG in heart failure. JACC Cardiovasc Imaging.
2010;3(1):92-100.
11. O r i m o S , O z a w a E , N a k a d e S , S u g i m o t o T, M i z u s a w a H .
123I-metaiodobenzylguanidine myocardial scintigraphy in Parkinson’s
disease. J Neurol Neurosurg Psychiatry. 1999;67(2):189-94.
12. Xavier HT. (editor). Risco cardiovascular na mulher. São Paulo: BBS editora;
2005:(3)48-50.
13. Pastore CA, Pinho C, Germiniani H, Samesima N, Mano R. Sociedade
Brasileira de Cardiologia. Diretrizes da Sociedade Brasileira de Cardiologia
sobre Análise e Emissão de Laudos Eletrocardiográficos (2009). Arq Bras
Cardiol. 2009;93(3 supl.2):1-19.
14. Campos Filho O, Zielinsky P, Ortiz J, Maciel BC, Andrade JL, Mathias W Jr, et
al. Diretriz para indicações e utilização da ecocardiografia na prática clínica.
Arq Bras Cardiol. 2004;82 supl 2:11-34.
15. Ji SY, Travin MI. Radionuclide imaging of cardiac autonomic innervation. J
Nucl Cardiol 2010;17:655-66.
234
Arq Bras Cardiol. 2015; 105(3):228-234
18. Jacobson AF, Senior R, Cerqueira MD, Wong ND, Thomas GS, Lopez
VA, et al; ADMIRE- HF Investigators. Myocardial iodine-123 metaiodobenzylguanidine imaging and cardiac events in heart failure. Results
of the prospective ADMIRE-HF (AdreView Myocardial Imaging for Risk
Evaluation in Heart Failure) study. J Am Coll Cardiol. 2010;55(20):2212-21.
19. Dolci A, Dominici R, Cardinale D, Sandri MT, Panteghini M. Biochemical markers
for prediction of chemotherapy-induced cardiotoxicity: systematic review of the
literature and recommendations for use. Am J Clin Pathol. 2008;130(5):688-95.
20. Dores H, Abecasis J, Correia MJ, Gândara F, Fonseca C, Azevedo J, et al.
Detection of early sub-clinical trastuzumab-induced cardiotoxicity in breast
cancer patients. Arq Bras Cardiol. 2013;100(4):328-32.
21. Cardinale D, Colombo A, Sandri MT, Lamantia G, Colombo N, Civelli M,
et al. Prevention of high-dose chemotherapy-induced cardiotoxicity in
high-risk patients by angiotensin-converting enzyme inhibition. Circulation.
2006;114(23):2474-81.
Voltar ao Índice da Capa
Artigo Original
Coadministração de Apelina e T4 tem Efeito Protetor nas Alterações
Inotrópicas e Cronotrópicas que Ocorrem em Ratos Hipotireoideos
Co-administration of Apelin and T4 Protects Inotropic and Chronotropic Changes Occurring in Hypothyroid Rats
Zahra Akhondali, Mohammad Badavi, Mahin Dianat, Farzaneh Faraji
Physiology Research Center and Department of Physiology, Faculty of Medicine, Ahvaz Jundishapur University of Medical Sciences, Ahvaz – Iran
Resumo
Fundamento: O sistema cardiovascular é um dos alvos mais importantes dos hormônios tireoidianos. As seguintes
alterações hemodinâmicas foram observadas em pacientes com hipotireoidismo: redução da frequência cardíaca
(FC) de repouso, da contratilidade miocárdica e do débito cardíaco; e aumento da pressão diastólica e da resistência
vascular sistêmica. Além disso, tais pacientes apresentam alterações eletrocardiográficas, como bradicardia sinusal e
baixa voltagem dos complexos (ondas P e complexos QRS).
Objetivo: Avaliar o efeito profilático da apelina nas alterações de FC e voltagem de QRS que ocorrem em ratos com
hipotireoidismo induzido por propiltiouracil (PTU).
Método: Este estudo dividiu de maneira aleatória 48 ratos Wistar machos adultos, pesando 170-235 g, em seis grupos: grupo
controle (CO), injeção intraperitoneal (ip) de solução salina + água potável gavagem; grupo hipotireoideo (P), PTU 0,05% em
água potável; grupo A, apelina ip (200 μg.kg-1.dia-1); grupo PA, coadministração de PTU e apelina; grupo PT, coadministração
de PTU e T4, 0.2 mg/g por dia por gavagem; e grupo PAT, coadministração de PTU, apelina e T4. Todos os experimentos
foram realizados durante 28 dias consecutivos, sendo então os animais anestesiados com injeção ip de cetamina (80 mg/kg)
e xilazina (12 mg/kg). Utilizou-se o registro do ECG na derivação DII para calcular a FC e a voltagem do QRS.
Resultados: Houve aumento mais significativo da FC e da voltagem do QRS no grupo hipotireoideo que recebeu apelina
e T4 (201 ± 4 bpm, 0,71 ± 0,02mV) do que no hipotireoideo (145 ± 9 bpm, 0,563 ± 0,015 mV), respectivamente.
Conclusão: A coadministração de apelina e T4 mostrou efeito protetor na voltagem do QRS e FC em ratos com
hipotireoidismo induzido por PTU. (Arq Bras Cardiol. 2015; 105(3):235-240)
Palavras-chave: Hipotireoidismo / sangue; Hormônios Tireóideos / sangue; Tiroxina / uso terapêutico; Cardiotônicos; Ratos.
Abstract
Background: One of the most important thyroid hormone targets is the cardiovascular system. Hemodynamic changes, such as decreased resting
heart rate (HR), myocardial contractility, and cardiac output, and increased diastolic pressure and systemic vascular resistance, have been observed
in hypothyroid patients. Moreover, in these patients, ECG changes include sinus bradycardia and low voltage complexes (P waves or QRS complexes).
Objective: This study aimed at evaluating the prophylactic effect of apelin on HR changes and QRS voltage that occur in propylthiouracil
(PTU)-induced hypothyroid rats.
Method: In this study, 48 adult male Wistar rats weighing 170-235 g were randomly divided into 6 groups: Control group (normal saline ip
injection + tap water gavage); P group (PTU 0.05%, in drinking water); A group (apelin 200 μg.kg-1.day-1, ip); PA group [co-administration
of PTU and apelin]; PT group [co-administration of PTU + T4 (0.2 mg/g per day, gavage)]; and PAT group (co-administration of PTU, apelin
and T4). All experiments were performed for 28 consecutive days, and then the animals were anesthetized with an ip injection of ketamine
(80 mg/kg) and xylazine (12 mg/kg). Lead II electrocardiogram was recorded to calculate HR and QRS voltage.
Results: Heart rate and QRS voltage increased more significantly in the hypothyroid group that consumed both apelin and T4 (201 ±4 beat/min,
0.71 ± 0.02mv vs. hypothyroid 145 ± 9 beat/min, 0.563 ± 0.015 mv; respectively).
Conclusion: The co-administration of apelin and T4 showed a protective effect on QRS voltage and HR in PTU-induced hypothyroid rats.
(Arq Bras Cardiol. 2015; 105(3):235-240)
Keywords: Hypothyroidism / blood; Thyroid Hormones / blood; Thyroxine / therapeutic use; Cardiotonic Agents; Rats.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Mahin Dianat •
Ahvaz Jundishapur University of Medical Sciences. Khouzestan. Physiology Research Center and Department of Physiology, Faculty of Medicine, Ahvaz
Jundishapur University of Medical Sciences. Postal Code 61335, Ahvaz – Iran
E-mail: [email protected], [email protected]
Artigo recebido em 25/11/14; revisado em 28/04/15; aceito em 30/04/15
DOI: 10.5935/abc.20150086
235
Akhondali e cols.
Proteção da apelina em ratos hipotireoideos induzidos por PTU
Artigo Original
Introdução
Os hormônios tireoidianos são necessários à regulação
da taxa metabólica1, também exercendo efeito na função
cardiovascular: uma mínima redução de seus níveis circulantes
pode causar disfunção cardiovascular2. Em pacientes com
hipotireoidismo franco, a falta de feedback de tiroxina (T4) leva a
níveis mais altos de TSH do que aqueles de indivíduos saudáveis;
no hipotireoidismo mais brando ou subclínico, os níveis de T4
e de triiodotironina (T3) são normais, mas os de TSH são mais
elevados do que os da população saudável3. Como resultado
da falta dos hormônios tireoidianos, ocorrem algumas alterações
estruturais e morfológicas nas células cardíacas, causando
alterações nas características hemodinâmicas do coração.
Identificaram-se, no hipotireoidismo, redução na frequência
cardíaca (FC) de repouso, no débito cardíaco, na contratilidade
cardíaca e no volume sistólico, e elevação da resistência vascular
sistêmica e da pressão diastólica. Também foram observados
bradicardia, pressão de pulso mais estreita, redução da
voltagem e bloqueio cardíaco4-6. Variabilidade da frequência
cardíaca e turbulência da frequência cardíaca são os critérios de
função autônoma cardiovascular que se alteram em pacientes
hipotireoideos5,7. Um dos critérios de contratilidade cardíaca é
a amplitude do QRS.
As seguintes manifestações eletrocardiográficas foram
observadas em pacientes hipotireoideos: bradicardia sinusal,
baixa voltagem dos complexos (pequenas ondas P ou
pequenos complexos QRS), intervalos PR e QT prolongados,
e achatamento ou inversão das ondas T8. Além disso, derrame
pericárdico, que pode afetar o eletrocardiograma (ECG),
foi evidenciado em até 30% dos pacientes hipotireoideos8.
Além disso, angina e infarto miocárdico foram observados
em cerca de 1% da população geral, sendo que 4% dos
indivíduos com 60 anos ou mais têm prescrição de T4
de longo prazo9,10.
A apelina é um ligante endógeno expresso em vários tecidos,
como coração, cérebro, fígado, músculo esquelético e rim.
A apelina atua através do receptor APJ, um receptor acoplado
à proteína G, e apresenta semelhança com a via angiotensina
II-receptor tipo 1 de angiotensina II11,12. A apelina causa
vasodilatação dependente do endotélio através da ativação de
eNOS, e promove liberação de NO. Além disso, a apelina e
o receptor APJ desempenham um papel no desenvolvimento
das células cardíacas13. Esse ligante endógeno, que afeta as
células miocárdicas, causa aumento da contração cardíaca14,15.
A apelina mostrou ter um efeito inotrópico no coração16.
Como a contração do músculo cardíaco está associada
à voltagem do QRS, e considerando que essa voltagem e a
FC estão reduzidas nos pacientes hipotireoideos, o presente
estudo teve por objetivo avaliar o efeito protetor da apelina
nas alterações inotrópicas e cronotrópicas que ocorrem na
ausência dos hormônios tireoidianos.
Métodos
Materiais
Cetamina e xilazina foram compradas de Alfas Co (Holanda).
Propiltiouracil (PTU) e T4 foram obtidos com Sigma-Aldrich Co
236
Arq Bras Cardiol. 2015; 105(3):235-240
(EUA), e apelina, de Cayman Chemical Co (EUA). O PTU foi
dissolvido em água potável (0,05%), tendo a apelina, na dose
de 200 μg.kg-1.dia-1, sido dissolvida em solução salina e injetada
intraperitonealmente (ip). O T4 foi dissolvido primeiro em
solução 0,1 normal de NaOH e, então, diluído com água
potável até a concentração de 0,2 mg/g por dia.
Tratamento dos animais
Os 48 ratos machos Wistar (170-235 g) foram alojados em
condições padrão (22+2°C, ciclos claro/escuro de 12 horas)
com acesso livre a dieta para ratos (Pars Co. IR) e água
potável. Todos os procedimentos foram realizados conforme
os padrões de cuidado animal estabelecidos e aprovados
pelo Comitê de Ética e Pesquisa da Universidade de Ciências
Médicas Ahwaz Jundishapour, Ahwaz, Irã.
Os ratos foram divididos em seis grupos de oito animais
cada: grupo controle; grupo hipotireoideo (P), tratado
com PTU (0,05%); grupo A, tratado com apelina ip
(200 μg.kg -1.dia-1); grupo PA, coadministração de PTU e
apelina; grupo PT, coadministração de PTU e T4, gavagem;
e grupo PAT, coadministração de PTU, apelina e T417-19.
O período de tratamento em cada experimento foi de
quatro semanas.
O peso corporal foi avaliado toda semana e os
níveis séricos de T4 e TSH foram avaliados no final dos
experimentos. Após os procedimentos, os animais foram
anestesiados com injeção ip de cetamina (80 mg/kg) e
xilazina (12 mg/kg). A temperatura retal foi continuamente
monitorada e mantida em 37-38°C, usando-se almofada
aquecida e lâmpada de aquecimento. Utilizou-se o registro
do ECG na derivação DII para calcular a FC e a voltagem do
QRS (PowerLab, ADInstruments, Austrália) como se segue:
eletrodos consistindo de agulhas calibre 26 foram inseridas
subcutaneamente por 1 cm na cartilagem xifoide (eletrodo
positivo), ombro direito (negativo) e ombro esquerdo
(referência). Os eletrodos foram conectados a um amplificador
Bioamp (ADInstruments, Austrália) e digitalizados com um
conversor A/D PowerLab 8sp (ADInstruments, Austrália).
Os registros digitais foram analisados com o programa Chart
para Windows 7 (ADInstruments, Austrália). Os eventos
foram registrados 4 K/s e filtrados para 60 Hz20. O ECG foi
calibrado para 25 mm/s com uma sensibilidade de 10 mm
= 10 mV. Os registros do ECG foram obtidos durante cinco
minutos. A voltagem do complexo QRS (em mV), para avaliar
as alterações inotrópicas, foi medida manualmente como a
soma das voltagens absolutas de qualquer deflexão positiva
ou negativa. Todos os cálculos foram feitos com a média
dos cinco complexos QRS. A FC, para avaliar as alterações
cronotrópicas, foi derivada do sinal eletrocardiográfico.
Análise estatística
A análise estatística foi realizada usando-se o programa
SPSS, sendo os dados expressos como média ± erro padrão
da média (EPM). As comparações foram feitas usando-se
análise de variância (ANOVA) de uma via, seguida pelo
teste de diferença mínima significativa. Adotou-se o nível de
significado estatístico de p < 0,05.
Akhondali e cols.
Proteção da apelina em ratos hipotireoideos induzidos por PTU
Artigo Original
Resultados
Níveis séricos de TSH e T4
Nos ratos hipotireoideos, os níveis séricos de TSH
subiram, enquanto os de T4 diminuíram significativamente
quando comparados àqueles do grupo controle (p < 0,01,
Tabela 1). Tais valores indicam que a indução de
hipotireoidismo com PTU teve sucesso. A administração
de apelina junto com PTU evitou a elevação dos níveis
de TSH e T4. Além disso, níveis aumentados de T4 e
reduzidos de TSH foram observados no grupo PT em
comparação aos do grupo hipotireoideo (p < 0,01).
Embora a coadministração dessas três drogas tenha evitado
a elevação dos níveis de TSH e o declínio dos níveis de T4,
observou-se significativa diferença em relação ao grupo
controle (p < 0,01).
Peso corporal
Como esperado, o peso corporal no grupo controle
aumentou significativamente. Entretanto, no grupo
hipotireoideo, houve redução durante as quatro semanas de
administração de PTU (p < 0,01; Tabela 2). Por outro lado,
em ratos eutireoideos, a administração de apelina levou a
significativo aumento do peso corporal (p < 0,01). Além disso,
em comparação aos grupos controle e hipotireoideo, a
coadministração de PTU e apelina reduziu o peso corporal
nos animais intatos (p < 0,01, p < 0,05). Embora a reposição
hormonal com T4 e apelina nesses ratos possa ter evitado
a perda de peso, ainda houve uma significativa diferença
em relação ao grupo controle (p < 0,05). Entretanto,
a combinação dessas três drogas pôde fazer o ganho de peso
equiparar-se ao do grupo controle. Com relação às mudanças
de peso cardíaco, deve-se mencionar que, embora a razão
entre peso cardíaco e peso corporal não tenha se alterado
no grupo hipotireoideo, foi melhorada pela apelina no grupo
eutireoideo (p < 0,01). Além disso, essa razão não se alterou
nos demais grupos (Tabela 2).
Frequência cardíaca
Nos animais hipotireoideos, a FC diminuiu
significativamente em comparação àquela do grupo controle
(145 ± 9,5 vs. 227 ± 7,8 bpm, p < 0,001, Figura 1).
Além disso, a administração de apelina por quatro
semanas elevou a FC de ratos normais (270 ± 11,6 bpm).
A administração de apelina com PTU não conseguiu alterar
a FC, em oposição ao ocorrido no grupo hipotireoideo
Tabela 1 – Comparação dos níveis dos hormônios T4 e TSH nos diferentes grupos
Grupos
CO
T4 (nmol/l)
TSH (μUI/ml)
76,75 ± 5
1,32 ± 0,3
12,02 ± 2,8**
P
24,49 ± 3,1
A
87,59 ± 5,27
0,84 ± 0,3††
PA
16,49 ± 2,14**€€
5,09 ± 0,57††
PT
95,50 ± 0,25
8,78 ± 1,56**
PAT
50,26 ± 0,11**††
**
††
**††€€
9,49 ± 1,88**
CO: Grupo controle; P: Grupo tratado com propiltiouracil (PTU); A: Grupo de animais intactos que receberam apelina; PA: Grupo recebendo PTU e apelina ao mesmo
tempo; PT: Grupo recebendo PTU e T4 ao mesmo tempo; PAT: Grupo recebendo PTU, apelina e T4 ao mesmo tempo; **p < 0,01 comparado ao grupo controle;
††p < 0,01 comparado ao grupo P; €€p < 0,01 comparado ao grupo PAT (média ± EPM, n = 8, ANOVA de uma via seguida de teste de diferença mínima significativa).
Tabela 2 – Comparação do peso corporal e peso cardíaco nos diferentes grupos
Grupos
W1 (g)
W2 (g)
PC (g)
Ganho (g)
CO
232 ± 5
248 ± 5
0,82 ± 0,04
P
224 ± 7
219 ± 6
0,75 ± 0,03
A
169 ± 3
200 ± 5
0,80 ± 0,03
PA
169 ± 4
156 ± 3
0,51 ± 0,01
PT
206 ± 4
209 ± 6
0,72 ± 0,02
PAT
176 ± 5
183 ± 7
0,62 ± 0,03**††
**††€
**€
% alteraçõesa
PC/W (g)
16 ± 2
7
0,32 ± 0,01
-5 ± 3**
-2**
0,35 ± 0,01
**††
0,39 ± 0,01**†
**†€€
0,33 ± 0,01
3±3
1
*
0,34 ± 0,01
11 ± 4††
6††
0,35 ± 0,01
31 ± 3
**††
-13 ± 3
**†€€
*
19
-7
CO: Grupo controle; P: Grupo tratado com propiltiouracil (PTU); A: Grupo de animais intactos que receberam apelina; PA: Grupo recebendo PTU e apelina ao mesmo
tempo; PT: Grupo recebendo PTU e T4 ao mesmo tempo; PAT: Grupo recebendo PTU, apelina e T4 ao mesmo tempo.
W1: Peso corporal no início do experimento; W2: Peso corporal no final do experimento; PC: Peso do coração; PC/W: Razão entre peso do coração e peso corporal.
a: percentagem de variação comparada ao peso corporal inicial.
*p < 0,05;**p < 0,01 comparado ao grupo controle; †p < 0,05, ††p < 0,01 comparado ao grupo P; € p < 0,05; €€ p < 0,01 comparado ao grupo PAT (média ± EPM,
n = 8, ANOVA de uma via seguida de teste de diferença mínima significativa).
Arq Bras Cardiol. 2015; 105(3):235-240
237
Akhondali e cols.
Proteção da apelina em ratos hipotireoideos induzidos por PTU
Artigo Original
(157 ± 16,4 vs. 145 ± 9,5 bpm). Entretanto, a administração
de T4 com PTU conseguiu evitar significativamente a redução
da FC (180 ± 4 vs. 145 ± 9,5 bpm, p < 0,05), mas a
coadministração de apelina e T4 com PTU foi mais eficiente
para elevar a FC (201 ± 4,3 vs. 145 ± 9,5 bpm, p < 0,001).
Voltagem do QRS
Houve redução significativa da voltagem do QRS nos
grupos que receberam PTU em comparação ao grupo
controle (0,563 ± 0,015 vs. 0,72 ± 0,02 mV, p < 0,001;
Figura 2). Entretanto, a administração de apelina para
animais normais aumentou significativamente a voltagem
do QRS (0,844 ± 0,022 mV, p < 0,001). Embora a
administração de apelina (0,646 ± 0,026 mV, p < 0,05)
ou de T4 (0,661 ± 0,032 mV, p < 0,01) juntamente
com PTU tenha podido alterar a voltagem do QRS,
a coadministração dessas três drogas juntas foi mais
eficiente (0,708 ± 0,02 mV, p < 0,001).
Figura 1 – Comparação da frequência cardíaca em vários grupos. Dados expressos como média ± EPM e analisados usando-se ANOVA de uma via seguida do teste
de diferença mínima significativa. **p < 0,01, ***p < 0,001 comparado ao grupo controle; †p < 0,05, †††p < 0,001 comparado ao grupo com hipotireoidismo; €€ p < 0,01
comparado ao grupo PAT.
CO: Grupo controle; P: Grupo tratado com propiltiouracil (PTU); A: Grupo de animais intactos que receberam apelina; PA: Grupo recebendo PTU e apelina ao mesmo
tempo; PT: Grupo recebendo PTU e T4 ao mesmo tempo; PAT: Grupo recebendo PTU, apelina e T4 ao mesmo tempo.
Figura 2 – Comparação da voltagem do QRS em vários grupos. Dados expressos como média ± EPM e analisados usando-se ANOVA de uma via seguida do teste
de diferença mínima significativa. **p < 0,01, ***p < 0,001 comparado ao grupo controle; †p < 0,05, ††p < 0,01, †††p < 0,001 comparado ao grupo com hipotireoidismo.
CO: Grupo controle; P: Grupo tratado com propiltiouracil (PTU); A: Grupo de animais intactos que receberam apelina; PA: Grupo recebendo PTU e apelina ao mesmo
tempo; PT: Grupo recebendo PTU e T4 ao mesmo tempo; PAT: Grupo recebendo PTU, apelina e T4 ao mesmo tempo.
238
Arq Bras Cardiol. 2015; 105(3):235-240
Akhondali e cols.
Proteção da apelina em ratos hipotireoideos induzidos por PTU
Artigo Original
Discussão
Este estudo mostrou que a administração isolada de
apelina a ratos normais ou em combinação com T4 para
ratos com hipotireoidismo induzido por PTU diminuiu os
níveis séricos de TSH e aumentou os de T4.
Ta h e r i e c o l . r e l a t a r a m q u e a a d m i n i s t r a ç ã o
intracerebroventricular de piroglutamil apelina-13 (10 nmol)
diminuiu os níveis de TSH, embora tal redução não tenha sido
significativa21. Pan e cols.18 mostraram que a terapia com T4
reduziu o nível de TSH durante 28 dias após hipotireoidismo
induzido com PTU. Tais achados sugerem que a apelina possa
ter um efeito na regulação endócrina e na circulação de alguns
hormônios. Entretanto, o efeito regulador da apelina no eixo
hipotálamo-hipófise-tireoide e na sinalização celular requer
estudos adicionais.
A comparação dos resultados de ECG obtidos neste estudo
mostra que houve redução da FC e da voltagem do QRS no
grupo hipotireoideo em relação àqueles do grupo controle.
Por outro lado, a administração de apelina elevou a FC e a
voltagem do QRS em ratos normais.
Os hormônios tireoidianos têm um papel na regulação
da expressão de alguns genes relacionados às células
marca‑passo; portanto, a deficiência de hormônios
tireoidianos causa diminuição da função do nó
sinoatrial22,23. Da mesma forma, Joppet e col. relataram
que a infusão intravenosa de apelina em seres humanos
aumenta a FC e o débito cardíaco 24 . Outro estudo
mostrou que a apelina tem efeito cronotrópico positivo
no miocárdio através do aumento da excitabilidade
cardíaca devido à modulação de I Na gating e amplitude 25,
que pode ser uma das razões para o aumento da FC pela
apelina. Nosso estudo mostrou que a coadministração
de T4 e apelina ao grupo PAT evita o declínio da FC e da
voltagem do QRS em ratos com hipotireoidismo induzido
por PTU. Embora a administração de cada uma dessas duas
drogas melhore a FC e a voltagem do QRS, elas diferiram
significativamente do grupo controle. Relatou-se melhora
da anormalidade das funções ventriculares sistólica e
diastólica no hipotireoidismo com T4 10 . Além disso,
demonstrou-se que a variação de hormônios tireoidianos
poderia alterar a expressão das seguintes proteínas de
genes: Ca 2+-ATPase; fosfolambam; miosina; receptores
beta-adrenérgicos; adenilato ciclase; proteínas ligadoras
de nucleotídeo guanina; trocador Na + /Ca 2+ ; Na + /K +
ATPase; e canais de potássio voltage-gated3. A diminuição
da contração cardíaca no hipotireoidismo relaciona-se à
diminuição da expressão do gene de uma Ca2+-ATPase
no retículo sarcoplasmático e aumento de fosfolambam3.
Berry e cols.26 relataram que a apelina tem um efeito
inotrópico ao aumentar o débito cardíaco sem alterar o
volume diastólico final. Os peptídeos da apelina estão
entre os mais potentes agentes endógenos inotrópicos
positivos27. O efeito inotrópico da apelina mediado pela
G-proteína acoplada ao receptor APJ ativa a proteína
quinase C, que afeta o trocador Na+/H+; entretanto, isso
promove alcalinização celular interna e sensibilização dos
miofilamentos ao Ca2+. Por outro lado, afeta o trocador
Na+/Ca2+ e aumenta o Ca2+ citoplasmático11,14,24. Wang e
cols.28 mostraram que T4 aumenta a expressão do gene
da isoforma de miosina de cadeia pesada da alfa (αMHC),
que melhora o potencial de contração cardíaca. Isso sugere
que a coadministração de T4 e apelina deva regular a
expressão dos genes das proteínas de contração e aumente
a sensibilidade dos miofilamentos ao cálcio24.
De acordo com estudos prévios e os achados deste estudo,
sugere-se que a apelina deva desempenhar um papel na
contratilidade cardíaca ao alterar a fosfolipase C, a proteína
quinase C, o trocador Na+/H+ e a expressão do gene do
trocador Na+/Ca2+ no sarcolema de ratos hipotireoideos.
Conclusão
Embora a apelina aumente a voltagem cardíaca na ausência
do hormônio tireoidiano, tal mecanismo da apelina é mais
eficiente na presença do hormônio tireoidiano.
Agradecimentos
A fonte dos dados usados neste manuscrito foi a dissertação
de mestrado de Zahra Akhondali, estudante da Universidade
de Ciências Médicas Ahwaz Jundishapour. Os autores
agradecem o suporte financeiro do Centro de Pesquisa
em Fisiologia da Universidade de Ciências Médicas Ahwaz
Jundishapour (bolsa No. PRC-152).
Contribuição dos autores
Concepção e desenho da pesquisa: Badavi M, Dianat M,
Faraji F; Obtenção de dados: Akhondali Z, Dianat M; Análise
e interpretação dos dados: Akhondali Z; Análise estatística:
Akhondali Z, Faraji F; Obtenção de financiamento: Badavi
M; Redação do manuscrito: Dianat M, Faraji F; Revisão
crítica do manuscrito quanto ao conteúdo intelectual
importante: Dianat M.
Potencial conflito de interesse
Declaro não haver conflito de interesses pertinentes.
Fontes de financiamento
O presente estudo foi financiado por Physiology Research
Center of Ahvaz Jundishapur University of Medical Sciences.
Vinculação acadêmica
Este artigo é parte de dissertação de Mestrado de Mahin
Dianat pela Ahvaz Jundishapur University of Medical Sciences.
Arq Bras Cardiol. 2015; 105(3):235-240
239
Akhondali e cols.
Proteção da apelina em ratos hipotireoideos induzidos por PTU
Artigo Original
Referências
McAninch EA, Bianco AC. Thyroid hormone signaling in energy homeostasis
and energy metabolism. Ann N Y Acad Sci. 2014;1311:77-87.
perturbations in response to hypothyroidism induced by propylthiouracil
in rats. J Pharm Biomed Anal. 2013;72:109-14.
2. Coceani M. Heart disease in patients with thyroid dysfunction:
hyperthyroidism, hypothyroidism and beyond. Anadolu Kardiyol Derg.
2013;13(1):62-6.
17. Falcão-Pires I, Gonçalves N, Henriques-Coelho T, Moreira-Gonçalves
D, Roncon-Albuquerque R Jr, Leite-Moreira AF. Apelin decreases
myocardial injury and improves right ventricular function in
monocrotaline‑induced pulmonary hypertension. Am J Physiol Heart
Circ Physiol. 2009;296(6):H2007-14.
1.
3. Klein I, Danzi S. Thyroid disease and the heart. Circulation.
2007;116(15):1725-35. Erratum in: Circulation. 2008;117(3):e18.
4. Biondi B. Mechanisms in endocrinology: heart failure and thyroid
dysfunction. Eur J Endocrinol. 2012;167(5):609-18.
5. Celik A, Aytan P, Dursun H, Koc F, Ozbek K, Sagcan M, et al. Heart rate
variability and heart rate turbulence in hypothyroidism before and after
treatment. Ann Noninvasive Electrocardiol. 2011;16(4):344-50.
6. Rhee SS, Pearce EN. Update: Systemic Diseases and the Cardiovascular
System (II). The endocrine system and the heart: a review. Rev Esp Cardiol.
2011;64(3):220-31.
7. Galetta F, Franzoni F, Fallahi P, Tocchini L, Braccini L, Santoro G, et al.
Changes in heart rate variability and QT dispersion in patients with overt
hypothyroidism. Eur J Endocrinol. 2008;158(1):85-90.
8. Wald DA. ECG Manifestations of selected metabolic and endocrine
disorders. Emerg Med Clin North Am. 2006;24(1):145-57.
9. Ching GW, Franklyn JA, Stallard TJ, Daykin J, Sheppard MC, Gammage
MD. Cardiac hypertrophy as a result of long-term thyroxine therapy and
thyrotoxicosis. Heart. 1996;75(4):363-8.
10. Gammage M, Franklyn J. Hypothyroidism, thyroxine treatment, and the
heart. Heart. 1997;77(3):189-90.
11. Chandrasekaran B, Dar O, McDonagh T. The role of apelin in cardiovascular
function and heart failure. Eur J Heart Fail. 2008;10(8):725-32.
12. De Falco M, De Luca L, Onori N, Cavallotti I, Artigiano F, Esposito V, et al.
Apelin expression in normal human tissues. In Vivo. 2002;16(5):333-6.
13. Kursunluoglu-Akcilar R, Kilic-Toprak E, Kilic-Erkek O, Turgut S,
Bor‑Kucukatay M. Apelin-induced hemorheological alterations
i n D O C A- s a l t h y p e r t e n s i v e r a t s . C l i n H e m o r h e o l M i c r o c i r c .
2014;56(1):75-82.
14. Ladeiras-Lopes R, Ferreira-Martins J, Leite-Moreira AF. The apelinergic
system: the role played in human physiology and pathology and potential
therapeutic applications. Arq Bras Cardiol. 2008;90(5):343-9.
15. Tatemoto K, Takayama K, Zou MX, Kumaki I, Zhang W, Kumano K, et al.
The novel peptide apelin lowers blood pressure via a nitric oxide-dependent
mechanism. Regul Pept. 2001;99(2-3):87-92.
16. Wu S, Gao Y, Dong X, Tan G, Li W, Lou Z, et al. Serum metabonomics
coupled with Ingenuity Pathway Analysis characterizes metabolic
240
Arq Bras Cardiol. 2015; 105(3):235-240
18. Pan T, Zhong M, Zhong X, Zhang Y, Zhu D. Levothyroxine replacement
therapy with vitamin E supplementation prevents oxidative stress
and cognitive deficit in experimental hypothyroidism. Endocrine.
2013;43(2):434-9.
19. Vetter R, Rehfeld U, Reissfelder C, Fechner H, Seppet E, Kreutz R. Decreased
cardiac SERCA2 expression, SR Ca uptake, and contractile function in
hypothyroidism are attenuated in SERCA2 overexpressing transgenic rats.
Am J Physiol Heart Circ Physiol. 2011;300(3):H943-50.
20. Rodriguez-Angulo H, Garcia O, Castillo E, Cardenas E, Marques J, Mijares
A. Etanercept induces low QRS voltage and autonomic dysfunction in mice
with experimental Chagas disease. Arq Bras Cardiol. 2013;101(3):205-10.
21. Taheri S, Murphy K, Cohen M, Sujkovic E, Kennedy A, Dhillo W, et al.
The effects of centrally administered apelin-13 on food intake, water
intake and pituitary hormone release in rats. Biochem Biophys Res
Commun. 2002;291(5):1208-12.
22. Pachucki J, Burmeister LA, Larsen PR. Thyroid hormone regulates
hyperpolarization-activated cyclic nucleotide-gated channel (HCN2) mRNA
in the rat heart. Circ Res. 1999;85(6):498-503.
23. Paslawska U, Noszczyk-Nowak A, Kungl K, Bioly K, Popiel J, Nicpon J.
Thyroid hormones concentrations and ECG picture in the dog. Pol J Vet Sci.
2006;9(4):253-7.
24. Japp AG, Cruden NL, Barnes G, van Gemeren N, Mathews J, Adamson J,
et al. Acute cardiovascular effects of apelin in humans: potential role in
patients with chronic heart failure. Circulation. 2010;121(16):1818-27.
25. Chamberland C, Barajas-Martinez H, Haufe V, Fecteau MH, Delabre JF,
Burashnikov A, et al. Modulation of canine cardiac sodium current by Apelin.
J Mol Cell Cardiol. 2010;48(4):694-701.
26. Berry MF, Pirolli TJ, Jayasankar V, Burdick J, Morine KJ, Gardner TJ, et al.
Apelin has in vivo inotropic effects on normal and failing hearts. Circulation.
2004;110(11 Suppl 1):II187-93.
27. Maguire JJ, Kleinz MJ, Pitkin SL, Davenport AP. [Pyr1]apelin-13 identified as
the predominant apelin isoform in the human heart: vasoactive mechanisms
and inotropic action in disease. Hypertension. 2009;54(3):598-604.
28. Wang YY, Jiao B, Guo WG, Che HL, Yu ZB. Excessive thyroxine enhances
susceptibility to apoptosis and decreases contractility of cardiomyocytes.
Mol Cell Endocrinol. 2010;320(1-2):67-75.
Voltar ao Índice da Capa
Artigo Original
Desempenho de Escores de Risco Cirúrgico para Prever Mortalidade
após Implante Transcateter de Valva Aórtica
Performance of Surgical Risk Scores to Predict Mortality after Transcatheter Aortic Valve Implantation
Leonardo Sinnott Silva1,4, Paulo Ricardo Avancini Caramori1, Antonio Carlos Bacelar Nunes Filho2, Marcelo
Katz2, João Carlos Vieira da Costa Guaragna1, Pedro Lemos3, Valter Lima4, Alexandre Abizaid5, Flavio
Tarasoutchi2,3, Fabio S. de Brito Jr2
Pontifícia Universidade Católica1, Porto Alegre, RS; Hospital Israelita Albert Einstein2, São Paulo, SP; Instituto do Coração3, São Paulo, SP;
Hospital Santa Casa de Misericórdia4, Porto Alegre, RS; Instituto Dante Pazzanese de Cardiologia5, São Paulo, SP - Brasil
Resumo
Fundamento: Ainda é desafiador prever a mortalidade de pacientes que se submetem ao TAVI (sigla do inglês
Transcatheter Aortic Valve Implantation).
Objetivos: Avaliar o desempenho de cinco escores de risco para cirurgia cardíaca em prever mortalidade em 30 dias de
pacientes inscritos no Registro Brasileiro de TAVI.
Métodos: O Registro Multicêntrico Brasileiro inscreveu prospectivamente 418 pacientes submetidos ao TAVI em
18 centros entre 2008 e 2013. Os seguintes escores cirúrgicos foram usados para calcular o risco de mortalidade no
período de 30 dias: EuroSCORE I (ESI) logístico, EuroSCORE II (ESII), STS Score (STS), Ambler Score (AS) e Guaragna
Score (GS). O desempenho dos escores de risco foram avaliados através de sua calibração (teste Hosmer-Lemeshow) e
discriminação [área sob a curva (AUC) do inglês receiver-operating characteristic curve)].
Resultados: A idade média foi de 81,5 ± 7,7 anos. A prótese aórtica CoreValve (Medtronic) foi usada em 86,1% da coorte
e a abordagem transfemural usada em 96,2%. A mortalidade observada no período de 30 dias foi de 9,1%. A mortalidade
no período de 30 dias prevista pelos escores foi: ESI, 20,2 ± 13,8%; ESII, 6,5 ± 13,8%; STS, 14,7 ± 4,4%; AS, 7,0 ± 3,8%;
GS, 17,3 ± 10,8%. Nenhum dos escores testados com a AUC foi capaz de prever a mortalidade no período de 30 dias de
forma precisa. As AUC para os escores foram: 0,58 [95% de intervalo de confiança (IC): 0,49 a 0,68, p = 0,09] para ESI;
0,54 (IC de 95%: 0,44 a 0,64, p = 0,42) para ESII; 0,57 (IC de 95%: 0,47 a 0,67, p = 0,16) para AS; 0,48 (IC de 95%: 0,38
a 0,57, p = 0,68) para STS e 0,52 (IC de 95%: 0,42 a 0,62, p = 0,64) para GS. O teste Hosmer-Lemeshow indicou uma
calibração aceitável para todos os escores (p > 0,05).
Conclusões: Neste registro brasileiro de mundo real, os escores de risco cirúrgico foram imprecisos para prever a
mortalidade após o TAVI. São necessários modelos de risco desenvolvidos especificamente para o TAVI. (Arq Bras Cardiol.
2015; 105(3):241-247)
Palavras-chave: Fatores de Risco; Probabilidade; Estenose da Valva Aórtica / cirurgia; Substituição da Valva Aórtica Transcateter.
Abstract
Background: Predicting mortality in patients undergoing transcatheter aortic valve implantation (TAVI) remains a challenge.
Objectives: To evaluate the performance of 5 risk scores for cardiac surgery in predicting the 30-day mortality among patients of the Brazilian
Registry of TAVI.
Methods: The Brazilian Multicenter Registry prospectively enrolled 418 patients undergoing TAVI in 18 centers between 2008 and 2013.
The 30-day mortality risk was calculated using the following surgical scores: the logistic EuroSCORE I (ESI), EuroSCORE II (ESII), Society of
Thoracic Surgeons (STS) score, Ambler score (AS) and Guaragna score (GS). The performance of the risk scores was evaluated in terms of their
calibration (Hosmer–Lemeshow test) and discrimination [area under the receiver–operating characteristic curve (AUC)].
Results: The mean age was 81.5 ± 7.7 years. The CoreValve (Medtronic) was used in 86.1% of the cohort, and the transfemoral approach was used in
96.2%. The observed 30-day mortality was 9.1%. The 30-day mortality predicted by the scores was as follows: ESI, 20.2 ± 13.8%; ESII, 6.5 ± 13.8%;
STS score, 14.7 ± 4.4%; AS, 7.0 ± 3.8%; GS, 17.3 ± 10.8%. Using AUC, none of the tested scores could accurately predict the 30-day mortality.
AUC for the scores was as follows: 0.58 [95% confidence interval (CI): 0.49 to 0.68, p = 0.09] for ESI; 0.54 (95% CI: 0.44 to 0.64, p = 0.42) for ESII;
0.57 (95% CI: 0.47 to 0.67, p = 0.16) for AS; 0.48 (95% IC: 0.38 to 0.57, p = 0.68) for STS score; and 0.52 (95% CI: 0.42 to 0.62, p = 0.64) for GS.
The Hosmer–Lemeshow test indicated acceptable calibration for all scores (p > 0.05).
Conclusions: In this real world Brazilian registry, the surgical risk scores were inaccurate in predicting mortality after TAVI. Risk models specifically
developed for TAVI are required. (Arq Bras Cardiol. 2015; 105(3):241-247)
Keywords: Risk Factors; Probability; Aortic Valve Stenosis / surgery; Transcatheter Aortic Valve Replacement.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Leonardo Sinnott Silva •
Hospital São Lucas –PUCRS. Avenida Ipiranga 6690, 3. Andar – CDTI. Bairro Jardim Botânico. CEP 90610-000. Porto Alegre, RS – Brasil.
E-mail: [email protected]
Artigo recebido em 16/03/2015; revisado em 10/05/2015; aceito em 11/05/2015.
DOI: 10.5935/abc.20150084
241
Sinnott Silva e cols.
Desempenho de escores de risco para mortalidade após o Tavi
Artigo Original
Introdução
A estenose aórtica é a doença valvar adquirida mais
frequente e está presente em 4,5% da população acima
de 75 anos1. Para pacientes com estenose aórtica severa
sintomática, a cirurgia de troca valvar aórtica (SAVR) é
considerada a terapia de primeira escolha2. O implante
transcateter de valva aórtica (TAVI) tem se consolidado ao
longo dos últimos anos 3. Introduzido inicialmente para
pacientes considerados inoperáveis 4,5, o TAVI tem sido
usado amplamente como uma alternativa de tratamento
para pacientes de alto risco cirúrgico6. A avaliação do risco
cirúrgico em pacientes com estenose aórtica severa tem um
papel importante na seleção da melhor estratégia terapêutica.
A mortalidade associada a SAVR pode ser prevista pelos escores
que levam em consideração as características pré‑operatórias dos
pacientes. O EuroSCORE7,8 e o escore9 da Society of Thoracic
Surgeons (STS) são os escores mais comumente usados com este
objetivo e tem sido extensivamente validados. Outros escores
têm sido usados para prever especificamente a mortalidade
em decorrência da cirurgia cardíaca valvar, tais como o Ambler
score10 e o Guaragna score11.
Os escores de risco atualmente disponíveis foram
desenhados e validados em populações submetidas a troca
valvar cirúrgica, cirurgia de revascularização miocárdica
(CABG) ou ambas combinadas. Pouco se conhece sobre
a utilidade destes escores para prever a mortalidade de
pacientes submetidos ao TAVI. Até o momento, não há um
escore de risco específico, bem estabelecido, para prever a
mortalidade de pacientes submetidos ao TAVI.
Portanto, o objetivo do presente estudo é avaliar o poder
de predição de mortalidade dos escores de risco cirúrgico
estabelecidos, nos pacientes participantes de um registro
de TAVI de mundo real (Registro Brasileiro de Implante de
Bioprótese Aórtica por Cateter)12.
Métodos
Em um registro conduzido em todo país pela Sociedade
Brasileira de Cardiologia Intervencionista, os centros com ≥ 3
implantes de válvula (18 centros) foram convidados a participar.
De janeiro de 2008 a janeiro de 2013, um total de 418 pacientes
consecutivos que se submeteram ao TAVI foram incluídos
O EuroSCORE I logístico 7 (http://www.euroscore.org/
calcold.html) e o STS score11 (http://riskcalc.sts.org/de.aspx)
foram prospectivamente calculados no momento da inclusão
do paciente, enquanto o EuroSCORE II 8 (http://www.
euroscore.org/calc.html), o Ambler score10 (http://www.ucl.
ac.uk/statistics/research/riskmodel/index.html) e o Guaragna
score11 foram calculados baseados em dados coletados
durante o estudo. Todos os escores foram desenvolvidos como
preditores de mortalidade ocorrida durante hospitalização.
Os desfechos clínicos do estudo foram definidos pelos
critérios da Valve Academic Research Consortium‑II (VARC‑II)13.
Nesta análise, os seguintes desfechos foram avaliados:
mortalidade no período de 30 dias, mortalidade cirúrgica
imediata (resultado de eventos peri-cirúrgica levando à
morte em intervalo de 72 horas após o procedimento), e
mortalidade cirúrgica (todas causas de mortalidade ocorridas
242
Arq Bras Cardiol. 2015; 105(3):241-247
dentro de 30 dias ou durante a permanência hospitalar, caso a
permanência pós operatória fosse superior a 30 dias).
O registro foi aprovado pelos Comitês de Ética de todos
os centros que tiveram participação e o consentimento
informado obtido de todos os pacientes.
Gerenciamento e monitoramento dos dados e adjudicação
Os formulários de registro de caso foram enviados para
um banco de dados central via internet. O monitoramento
dos dados foi feito eletronicamente em 100% dos casos para
corrigir a informação faltante e inconsistente. A verificação dos
documentos feita no local foi realizada aleatoriamente em 20%
de todos os casos incluídos.
Um comitê independente composto de 5 cardiologistas
e 1 neurologista adjudicaram todos os eventos adversos.
Análise Estatística
As variáveis contínuas foram expressas como média e
desvios padrão e as variáveis categóricas foram expressas
como porcentagens. O desempenho dos escores de risco para
prever o desfecho primário foi analisado através da capacidade
discriminativa (estatística C) e a calibração (comparação de
taxas de mortalidade previstas e observadas). A capacidade
para discriminar sobreviventes de pacientes não sobreviventes
foi determinada pelo uso da área sob a curva (ROC) do
inglês receiver-operating characteristic curve e a calibração foi
realizada através do teste Hosmer-Lemeshow. Também foram
apresentados plots de distribuição de quartis para mortalidade
observada e esperada para todos os escores.
O software estatístico SPSS versão 15.0 foi utilizado
na análise.
Resultados
Um total de 418 pacientes foi incluído no registro com
idade média de 81,5 ± 7,7 anos. O tempo médio de
acompanhamento foi de 343,5 dias (variação interquartil
de 74,3 a 721,5). As características clínicas dos pacientes
são mostradas na Tabela 1. Na população estudada, 31,8%
eram diabéticos, 78% tinham índices de filtração glomerular
(IFGs) < 60 mL/min e 57,9% apresentavam doença arterial
coronariana. O acompanhamento clínico completo foi obtido
de 416 (99,5%) pacientes.
O TAVI foi realizado na maioria dos pacientes (96,2%)
pelo acesso transfemural; a CoreValve (Medtronic) foi o
dispositivo mais amplamente usado (86,1%). O procedimento
foi realizado com sucesso em 76,3% dos casos de acordo
com a definição de VARC (Tabela 2). As principais razões
para insucesso foram a presença de regurgitação aórtica
moderada a severa (9,2%), gradiente aórtico residual médio
≥ 20mmHg (4,4%) e a necessidade de implante de uma
segunda prótese (5,5%).
A mortalidade no período de 30 dias observada foi
de 9,1%, a mortalidade cirúrgica imediata foi de 5% e a
mortalidade cirúrgica foi de 11,7%. Os índices de mortalidade
previstos pelos escores foram como a seguir: EuroSCORE
I logístico, 20,2 ± 13,8%; EuroSCORE II, 6,5 ± 13,8%;
Sinnott Silva e cols.
Desempenho de escores de risco para mortalidade após o Tavi
Artigo Original
Tabela 1 – Caracterísiticas clínicas basais
Características
Tabela 2 – Características do procedimento
n = 418
Idade (anos)
81,5 ± 7,7
Caracteristicas
n = 418
Acesso
Masculino
200 (47,8%)
Transfemural
Classe funcional III ou IV
348 (83,2%)
Trans-subclávia
09 (2,2%)
Diabetes
133 (31,8%)
Transaórtica
06 (1,4%)
402 (96,2%)
GFRa < 60 mL/min
313 (78%)
DPOCb
73 (17,5%)
Doença arterial coronariana
242 (57,9%)
CoreValve
360 (86,1%)
ICP prévia
142 (34%)
Sapien XT
58 (13,9%)
CABGd prévio
72 (17,2%)
Procedimento bem-sucedido
319 (76,3%)
Valvoplastia aórtica prévia
33 (7,9%)
Insucesso do procedimento
99 (23,7%)
AVE prévio
31 (7,4%)
c
Mortalidade prevista no período de 30 dias
Transcarótida
Regurgitação da aórtica de moderada a severa
35/379 (9,2%)
Gradiente Médio ≥ 20mmHg
16/366 (4,4%)
Euroscore I logístico
20,2 ± 13,75%
Prótese adicional
Euroscore II
6,45 ± 13,75%
Conversão para Cirurgia
STS Score
14,7 ± 4,38%
Má posição da prótese
Ambler Score
6,99 ± 3,79%
Guaragna Score
23 (5,5%)
4 (1%)
26 (6,2%)
17,34 ± 10,83%
GFR : Taxa de Filtração Glomerular; DPOC : Doença Pulmonar Obstrutiva
Crônica; ICPc: Intervenção Coronariana Percutânea; CABGd: Cirurgia de
Revascularização Miocárdica; AVE: Acidente vascular encefálico.
a
01 (0,2%)
Bioprótese
b
STS score, 14,7 ± 4,4%; Ambler score, 7,0 ± 3,8%; e
Guaragna score, 17,3 ± 10,8%. A capacidade de predição
da mortalidade pelos escores analisados está representada
na Figura 1. Nenhum dos escores foi capaz de prever, de
forma precisa, a mortalidade dos pacientes submetidos ao
TAVI durante o período de 30 dias. As áreas sob as curvas
ROC foram como a seguir: 0,58 [intervalo de confiança (IC)
de 95%: 0,49 a 0,68, p = 0,09] para EuroSCORE I logístico,
0,54 (IC de 95%: 0,44 a 0,64, p = 0,42) para EuroSCORE II,
0,57 (IC de 95%: 0,47 a 0,67, p = 0,16) para Ambler score,
0,48 (IC de 95%: 0,38 a 0,57, p = 0,68) para STS score,
e 0,52 (IC de 95%: 0,42 a 0,62, p = 0,64) para Guaragna
score (Tabela 3). Os escores foram também inadequados para
discriminar a ocorrência de mortalidade cirúrgica imediata e
mortalidade cirúrgica (Figura 1).
Todos os escores exibiram boas calibrações (p > 0,05) no
teste Hosmer-Lemeshow. Entretanto, o EuroSCORE I logístico
superestimou a mortalidade em todos quartis quando a
distribuição de quartis dos índices de mortalidade observada e
esperada foi analisada. O EuroSCORE II subestimou a mortalidade
no primeiro e no segundo quartis e superestimou a mortalidade
no último quartil, embora tenha exibido uma boa calibração no
terceiro quartil. O Ambler score subestimou a mortalidade no
primeiro e no terceiro quartis e superestimou a mortalidade no
último quartil, embora tenha exibido boa calibragem no segundo
quartil. O STS score subestimou a mortalidade no primeiro e
segundo quartis e superestimou a mortalidade no terceiro e
quarto quartis. Finalmente, o Guaragna score superestimou a
mortalidade em todos os quartis de risco (Figura 2).
Discussão
Nosso estudo demonstrou que cinco escores diferentes
desenvolvidos para avaliação de risco de pacientes submetidos
à SAVR foram incapazes de prever a mortalidade no período
de 30 dias após o TAVI.
O EuroSCORE I logístico superestimou a mortalidade
real para o grupo TAVI no registro GARY14, registro alemão
que inscreveu 3875 pacientes submetidos ao TAVI. A baixa
precisão do EuroSCORE I logístico e do STS score para prever
a mortalidade a curto prazo após o TAVI foi demonstrada em
dois outros registros multicêntricos: um estudo canadense
envolvendo 399 pacientes15 e outro estudo italiano que avaliou
663 pacientes16. Em um estudo francês17, o EuroSCORE II
também demonstrou baixa precisão para prever a mortalidade
de 435 pacientes submetidos ao TAVI no período de 30 dias.
No estudo PARTNER, Kodali e cols.18 mostraram que o STS
score foi um preditor independente de mortalidade após a
SAVR, mas não após o TAVI. Até o presente momento, este
é o primeiro estudo que avaliou o desempenho dos escores
Ambler e Guaragna para prever a mortalidade de pacientes
submetidos ao TAVI.
Ao contrário do que foi demonstrado no presente estudo,
Hemmann e cols.19, através da análise de 426 pacientes incluídos
em um registro envolvendo dois centros na Alemanha, mostraram
que o STS score foi um bom preditor da mortalidade no período
de 30 dias após o TAVI. Para esse desfecho, os autores encontraram
um Hazard Ratio de 1,06 (IC 95%: 1,03 a 1,1) por cada ponto
somado no STS score. Importante ressaltar que, na população do
referido estudo, 36% dos implantes ocorreram via transapiacal.
A predição de desfechos após o TAVI é uma tarefa
complexa. Alguns fatores clínicos têm sido destacados
como marcadores de pior prognóstico como presença
de disfunção ventricular, doença pulmonar obstrutiva
Arq Bras Cardiol. 2015; 105(3):241-247
243
Sinnott Silva e cols.
Desempenho de escores de risco para mortalidade após o Tavi
Artigo Original
Figura 1 – Curvas ROC para resultados avaliados usando diferentes escores de risco cirúrgico.
Tablela 3 – Mortalidade no período de 30 dias
Escore
AUC
IC de 95%
Valor de p
EuroSCORE I Logístico
0,58
0,49-0,68
0,09
EuroSCORE II
0,54
0,44-0,64
0,42
Ambler Score
0,57
0,47-0,67
0,16
STS Score
0,48
0,38-0,57
0,68
Guaragna Score
0,52
0,42-0,62
0,64
crônica (DPOC), doença cerebrovascular, insuficiência renal
crônica, hipertensão pulmonar e síndrome de fragilidade,
do inglês frailty20-22. Uma poulação de pacientes submetidos
ao TAVI teve seu status de fragilidade avaliado através de um
sistema de pontuação que levou em conta características
244
Arq Bras Cardiol. 2015; 105(3):241-247
como fraqueza, má nutrição, velocidade ao andar e grau de
inatividade. Escores mais altos de frailty foram mais associados
à mortalidade ocorrida no período de 1 ano após implante da
prótese23. Os escores cirúrgicos disponíveis atualmente não
contemplam alguns destes fatores.
Sinnott Silva e cols.
Desempenho de escores de risco para mortalidade após o Tavi
Artigo Original
Figura 2 – Distribuições dos quartis de taxas de mortalidade observada e prevista de acordo com diferentes escores de risco cirúrgico.
A: EuroSCORE I logístico (Q1: < 10,1%; Q2 ≥ 10,1% e < 16,7%; Q3: ≥ 16,7% e < 27,6%; Q4: ≥ 27,6%); B: EuroSCORE II (Q1: < 3,4%; Q2 ≥ 3,4% e < 5,3%; Q3: ≥
5,3% e < 8,5%; Q4: ≥ 8,5%); C: Ambler Score (Q1: < 4,1%; Q2 ≥ 4,1% e < 5,5%; Q3: ≥ 5,5% e < 9,3%; Q4: ≥ 9,3%); D: STS score (Q1: < 5,0%; Q2 ≥ 5,0% e < 10,8%;
Q3: ≥ 10,8% e < 19,7%; Q4: ≥ 19,7%); E: Guaragna Score (Q1: < 16,0%; Q2 = 16,0%; Q3: > 16% e < 22,0%; Q4: > 22,0%)
Os escores de risco cirúrgico têm limitações até em
pacientes submetidos à SAVR. Isto provavelmente acontece
porque, num grupo de idade avançada, as características
e as comorbidades que podem contribuir para a crescente
mortalidade e que não são capturadas pelos escores são
numerosas. Entre tais características, destacam-se os preditores
independentes de mortalidade operatória: síndrome frailty,
hipoalbuminemia, má nutrição24 e radioterapia prévia para
tratar tumores na cavidade toráxica25.
Outra explicação para o baixo desempenho dos
escores de risco cirúrgico para a população TAVI refere‑se
aos procedimentos que são, de fato, completamente
diferentes. Os escores foram criados e validados para
procedimentos grandes que envolvem toracotomia,
cardioplegia e circulação extracorpórea com repercussões
sistêmicas significativas. Assim, as características clínicas
que reduziriam a chance de sobrevivência do paciente após
a cirurgia convencional de substituição de válvula podem
Arq Bras Cardiol. 2015; 105(3):241-247
245
Sinnott Silva e cols.
Desempenho de escores de risco para mortalidade após o Tavi
Artigo Original
não ter qualquer impacto nos resultados após o TAVI.
Desta forma, os escores podem superestimar a mortalidade
do paciente para este procedimento.
Makkar et al.25, em análise feita com os pacientes do
estudo PARTNER que eram considerados inoperáveis (coorte
B), compararam a influência de aspectos técnicos com a de
variáveis clínicas sobre os desfechos após o TAVI. Os autores
demonstraram que pacientes inoperáveis em função de
aspectos técnicos que resultam em piores desfechos após
troca valvar cirúrgica, tais como aorta em porcelana, história
de radioterapia para tumores de mediastino, deformidades
de tórax e presença de enxertos coronarianos ligados à
parede torácica apresentam melhores desfechos após serem
submetidos à técnica percutânea, quando comparados com
aqueles inoperáveis em virtude de variáveis clínicas.
Kotting et al.26 desenvolveram na Alemanha um escore
específico para predizer mortalidade intra-hospitalar em
pacientes submetidos a procedimentos de troca valvar
aórtica cirúrgica ou percutânea, conhecido como German
AV Score. Esse escore foi desenvolvido com base na análise
de uma coorte de 11794 pacientes, apresentando um bom
poder discriminatório, com uma área sob a curva ROC de
0,8. A grande limitação deste escore para uso em pacientes
submetidos implante de bioprótese aórtica por cateter é que
apenas 5,1% da população original foi intervida dessa forma.
Em nosso estudo, estimamos a calibração da mortalidade
observada e prevista usando dois métodos diferentes.
No teste Hosmer-Lemeshow, todos os escores apresentaram boa
calibração. Entretanto, ao observar os plots das distribuições dos
quartis das taxas de mortalidade observada e prevista, nota‑se
que eles possuíam uma calibração pobre. Estudos recentes
sugeriram que o teste Hosmer-Lemenshow é imperfeito e
fraco, especialmente quando usado para analisar a calibração
em amostras de tamanho pequeno28-30.
A recomendação atual é que os escores devem ser usados
para identificar o paciente que, devido ao risco cirúrgico,
pode ser melhor beneficiado com a terapia percutânea.
Uma melhor performance para prever a mortalidade após
o TAVI ainda depende do desenvolvimento de escores
específicos para este propósito31. Pesquisadores com bancos
de dados poderosos já procuraram desenvolver escores de
risco específicos para TAVI. Entretanto, a acurácia obtida foi
modesta, variando de 0,59 a 0,71 (coortes de validação)32-34.
Este estudo apresenta algumas limitações. Em primeiro
lugar, os dados foram auto reportados e a inclusão do
paciente foi parcialmente retrospectiva. Consequentemente,
alguns eventos adversos podem ter sido negligenciados.
Entretanto, o acompanhamento clínico completo foi obtido
em 99,5% dos pacientes e todos os eventos adversos foram
independentemente adjudicados. Assim, os dados sobre
sobrevivência são bastante robustos. Além disso, o tamanho
da amostra relativamente pequeno pode ter impossibilitado a
detecção de relevância estatística.
Conclusões
Neste registro de mundo real, os escores de risco cirúrgico
foram imprecisos para prever a mortalidade após o TAVI.
Modelos de risco, especificamente desenvolvidos para TAVI,
são necessários.
Contribuição dos autores
Concepção e desenho da pesquisa: Silva LS, Caramori PRA,
Brito Jr FS; Obtenção de dados, Análise e interpretação dos
dados, Redação do manuscrito e Revisão crítica do manuscrito
quanto ao conteúdo intelectual importante: Silva LS, Caramori
PRA, Nunes Filho ACB, Katz M, Guaragna JCVC, Lemos P,
Lima V, Abizaid A, Tarasoutchi F, Brito Jr FS; Análise estatística:
Silva LS,Caramori PRA, Nunes Filho ACB, Katz M, Brito Jr FS;
Obtenção de financiamento: Brito Jr FS.
Potencial conflito de interesse
O autor Dr. Pedro Lemos possui potencial conflito de
interesse por ser proctor para Medtronic. O autor Dr. Fábio
S. de Brito Jr possui potencial conflito de interesses por ser
proctor para Edwards LifeSciences e para Medtronic.
Fontes de financiamento
O presente estudo foi financiado pela Sociedade Brasileira
de Hemodinâmica e Cardiologia Intervencionista (SBHCI)
Vinculação acadêmica
Não há vinculação deste estudo a programas de
pós‑graduação.
Referências
1. Freeman RV, Otto CM. Spectrum of calcific aortic valve disease:
pathogenesis, disease progression, and treatment strategies. Circulation.
2005;111(24):3316-26.
2. Vahanian A, Alfieri O, Al-Attar N, Antunes M, Bax J, Cormier B, et al.
Transcatheter valve implantation for patients with aortic stenosis: a position
statement from the European Association of Cardio-Thoracic Surgery
(EACTS) and the European Society of Cardiology (ESC), in collaboration
with the European Association of Percutaneous Cardiovascular Interventions
(EAPCI). Eurointervention. 2008;4(2):193-9.
246
Arq Bras Cardiol. 2015; 105(3):241-247
3. Andersen HR, Knudsen LL, Hasenkam JM. Transluminal implantation of
artificial heart valves: description of a new expandable aortic valve and
initial results with implantation by catheter technique in closed chest pigs.
Eur Heart J. 1992;13(5):704-8.
4. Cribier A, Eltchaninoff H, Bash A, Borenstein N, Tron C, Bauer F, et al.
Percutaneous transcatheter implantation of an aortic valve prosthesis
for calcific aortic stenosis: first human case description. Circulation.
2002;106(24):3006-8.
Sinnott Silva e cols.
Desempenho de escores de risco para mortalidade após o Tavi
Artigo Original
5. Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, et al;
PARTNER Trial Investigators. Transcatheter aortic-valve implantation for
aortic stenosis in patients who cannot undergo surgery. N Engl J Med.
2010;363(17):1597-607.
20. Fraccaro C, Al-Lamee R, Tarantini G, Maisano F, Napodano M, Montorfano
M, et al. Transcatheter aortic valve implantation in patients with severe left
ventricular dysfunction: immediate and mid-term results, a multicenter
study. Circ Cardiovasc Interv. 2012;5(2):253-60.
6. Smith CR, Leon MB, Mack MJ, Miller C, Moses JW, Svensson LG, et al;
PARTNER Trial Investigators. Transcatheter versus surgical aortic valve
replacement in high risk patients. N Engl J Med. 2011;364(23):2187‑98.
21. Pilgrim T, Kalesan B, Wenaweser P, Huber C, Stortecky S, Buellesfeld
L, et al. Predictors of clinical outcomes in patients with severe aortic
stenosis undergoing TAVI: a multistate analysis. Circ Cardiovasc Interv.
2012;5(6):856-61.
7.
Roques F, Michel P, Goldstone AR, Nashef SA. The logistic EuroSCORE. Eur
Heart J. 2003;24(9):881-2.
8. Nashef SA, Roques F, Sharples LD, Nilsson J, Smith C, Goldstone AR, et al.
EuroSCORE II. Eur J Cardiothorac Surg. 2012;41(4):734-44.
9. Anderson RP. First publications from the Society of Thoracic Surgeons
National Database. Ann Thorac Surg. 1994;57(1):6-7.
10. Ambler G, Omar RZ, Royston P, Kinsman R, Keogh BE, Taylor KM. Generic,
simple risk stratification model for heart valve surgery. Circulation.
2005;112(2):224-31.
11. Guaragna JC, Bodanese LC, Bueno FL, Goldani MA. [Proposed preoperative
risk score for patients candidate to cardiac valve surgery]. Arq Bras Cardiol.
2010;94(4):541-8.
12. de Brito FS Jr, Carvalho LA, Sarmento-Leite R, Mangione JA, Lemos P,
Siciliano A, et al; Brazilian TAVI Registry investigators. Outcomes and
predictors of mortality after transcatheter aortic valve implantation: results
of the Brazilian registry. Catheter Cardiovasc Interv. 2015;85(5):E153-62.
13. Kappetein AP, Head SJ, Généreux P, Piazza N, van Mieghem NM, Blackstone
EH, et al; Valve Academic Research Consortium-2. Updated standardized
endpoint definitions for transcatheter aortic valve implantation: the
Valve Academic Research Consortium-2 consensus document. J Thorac
Cardiovasc Surg. 2013;145(1):6-23.
14. Hamm CW, Möllmann H, Holzhey D, Beckmann A, Veit C, Figulla HR, et
al; GARY-Executive Board. The German Aortic Valve Registry (GARY): inhospital outcome. Eur Heart J. 2014;35(24):1588-98.
15. Rodés-Cabau J, Webb JG, Cheung A, Ye J, Dumont E, Osten M, et al.
Long-term outcomes after transcatheter aortic valve implantation: insights
on prognostic factors and valve durability from the Canadian multicenter
experience. J Am Coll Cardiol. 2012;60(19):1864-75.
16. Tamburino C, Capodanno D, Ramondo A, Petronio AS, Ettori F, Santoro G,
et al. Incidence and predictors of early and late mortality after transcatheter
aortic valve implantation in 663 patients with severe aortic stenosis.
Circulation. 2011;123(3):299-308.
17. Watanabe Y, Hayashida K, Lefèvre T, Chevalier B, Hovasse T, Romano
M, et al. Is EuroSCORE II better than EuroSCORE in predicting mortality
after transcatheter aortic valve implantation? Catheter Cardiovasc Interv.
2013;81(6):1053-60.
18. Kodali SK, Williams MR, Smith CR, Svensson LG, Webb JG, Makkar RR, et
al; PARTNER Trial Investigators. Two-year outcomes after transcatheter or
surgical aortic-valve replacement. N Engl J Med. 2012;366(18):1686-95.
19. Hemmann K, Sirotina M, De Rosa S, Ehrlich JR, Fox H, Weber J, et al.
The STS score is the strongest predictor of long-term survival following
transcatheter aortic valve implantation, whereas access route (transapical
versus transfemoral) has no predictive value beyond the periprocedural
phase. Interact Cardiovasc Thorac Surg. 2013;17(2):359-64.
22. Gilard M, Eltchaninoff H, Iung B, Donzeau-Gouge P, Chevreul K, Fajadet
J, et al; FRANCE 2 Investigators. Registry of transcatheter aortic-valve
implantation in high-risk patients. N Engl J Med. 2012;366(18):1705-15.
23. Green P, Woglom AE, Genereux P, Daneault B, Paradis JM, Schnell S, et
al. The impact of frailty status on survival after transcatheter aortic valve
replacement in older adults with severe aortic stenosis: a single-center
experience. JACC Cardiovasc Interv. 2012;5(9):974-81.
24. Engleman DT, Adams DH, Byrne JG, Aranki SF, Collins JJ Jr, Couper GS, et
al. Impact of body mass index and albumin on morbidity and mortality after
cardiac surgery. J Thorac Cardiovasc Surg. 1999;118(5):866-73.
25. Chang A, Smedira N, Chang C, Benavides MM, Myhre U, Feng J, et al.
Cardiac surgery after mediastinal radiation: extent of exposure influences
outcomes. J Thorac Cardiovasc Surg. 2007;133(2):404-13.
26. Makkar RR, Jilaihawi H, Mack M, Chakravarty T, Cohen DJ, Cheng W, et
al. Stratification of outcomes after transcatheter aortic valve replacement
according to surgical inoperability for technical versus clinical reasons. J Am
Coll Cardiol. 2014;63(9):901-11.
27. Kötting J, Schiller W, Beckmann A, Schäfer E, Döbler K, Hamm C, et al. German
Aortic Valve Score: a new scoring system for prediction of mortality related to
aortic valve procedures in adults. Eur J Cardiothorac Surg. 2013;43(5):971-7.
28. Nezic D, Borzanovic M, Spasic T, Vukovic P. Calibration of the EuroSCORE
II risk stratification model: is the Hosmer-Lemeshow test acceptable any
more? Eur J Cardiothorac Surg. 2012;43(1):206.
29. Sergeant P, Meuris B, Pettinari M. EuroSCORE II, illum qui est gravitates magni
observe. Eur J Cardiothorac Surg. 2012;41(4):729-31.
30. Durand E, Borz B, Godin M, Tron C, Litzler PY, Bessou JP, et al. Performance
analysis of EuroSCORE II compared to the original logistic EuroSCORE and
STS scores for predicting 30-day mortality after transcatheter aortic valve
replacement. Am J Cardiol. 2013;111(6):891-7.
31. Vahanian A, Alfieri O, Andreotti F, Antunes MJ, Barón-Esquivias G,
Baumgartner H, et al. Guidelines on the management of valvular heart
disease (version 2012). Eur Heart J. 2012;33(19):2451-96.
32. Seiffert M, Sinning JM, Meyer A, Wilde S, Conradi L, Vasa- Nicotera M, et
al. Development of a risk score for outcome after transcatheter aortic valve
implantation. Clin Res Cardiol. 2014;103(8):631-40.
33. Iung B, Laouenan C, Himbert D, Eltchaninoff H, Chevreul K, DonzeauGouge P, et al; FRANCE 2 Investigators. Predictive factors of early mortality
after transcatheter aortic valve implantation: individual risk assessment using
a simple score. Heart. 2014;100(13):1016-23.
34. Capodanno D, Barbanti M, Tamburino C, D’Errigo P, Ranucci M, Santoro
G, et al; OBSERVANT Research Group. A simple risk tool (the OBSERVANT
score) for prediction of 30-day mortality after transcatheter aortic valve
replacement. Am J Cardiol. 2014;113(11):1851-8
Arq Bras Cardiol. 2015; 105(3):241-247
247
Voltar ao Índice da Capa
Artigo Original
Ergoespirometria e Ecocardiograma na Insuficiência Cardíaca com
Fração de Ejeção Preservada: Estágio Inicial e em Saudáveis
Ergospirometry and Echocardiography in Early Stage of Heart Failure with Preserved Ejection Fraction and in
Healthy Individuals
Eduardo Lima Garcia1, Márcio Garcia Menezes1, Charles de Moraes Stefani1, Luiz Cláudio Danzmann3, Marco
Antonio Rodrigues Torres1,2
Universidade Federal do Rio Grande do Sul1; Hospital de Clínicas de Porto Alegre2, Porto Alegre, RS; Universidade Luterana do Brasil3,
Canoas, RS – Brasil
Resumo
Fundamento: Insuficiência cardíaca com fração de ejeção preservada é uma síndrome caracterizada por alterações da
função diastólica mais prevalente em idosos, mulheres e portadores de hipertensão arterial sistêmica (HAS) e diabete
melito. No início, entretanto, não revela sinais de congestão, identificando-se por remodelamento adverso, diminuição
da capacidade de exercício e disfunção diastólica nos exames.
Objetivo: Comparar variáveis ecocardiográficas e de doppler (Eco) e do teste cardiopulmonar de exercício (TCPE) –
ergoespirométricas – entre duas amostras populacionais: indivíduos portadores dessa síndrome em estágio inicial e outra
de saudáveis.
Métodos: Vinte e oito pacientes ambulatoriais com diagnóstico de insuficiência cardíaca por critérios de Framingham,
fração de ejeção > 50% e disfunção diastólica segundo a European Society of Cardiology (ESC), e 24 indivíduos saudáveis
realizaram estudos de Eco e TCPE.
Resultados: O grupo de pacientes apresentou volume atrial e massa ventricular esquerda indexadas, bem como as
razões E/E’ e VAEi/A´ significativamente maiores, além de significativa redução do consumo máximo de oxigênio e
incremento da inclinação da variável VE/VCO2, mesmo com semelhantes dimensões do ventrículo esquerdo, quando
comparados à amostra dos saudáveis.
Conclusão: Há diferenças significativas entre variáveis estruturais e funcionais analisadas nos estudos ao Eco e ao TCPE,
comparando-se duas amostras populacionais: pacientes com estágio inicial de insuficiência cardíaca com fração de
ejeção maior ou igual a 50% e outra de indivíduos saudáveis. (Arq Bras Cardiol. 2015; 105(3):248-255)
Palavras-chave: Espirometria; Ecocardiografia; Insuficiência Cardíaca; Volume Sistólico; Pacientes Ambulatoriais.
Abstract
Background: Heart failure with preserved ejection fraction is a syndrome characterized by changes in diastolic function; it is more prevalent
among the elderly, women, and individuals with systemic hypertension (SH) and diabetes mellitus. However, in its early stages, there are no signs
of congestion and it is identified in tests by adverse remodeling, decreased exercise capacity and diastolic dysfunction.
Objective: To compare doppler, echocardiographic (Echo), and cardiopulmonary exercise test (CPET) variables – ergospirometry variables –
between two population samples: one of individuals in the early stage of this syndrome, and the other of healthy individuals.
Methods: Twenty eight outpatients diagnosed with heart failure according to Framingham’s criteria, ejection fraction > 50% and diastolic
dysfunction according to the european dociety of cardiology (ESC), and 24 healthy individuals underwent Echo and CPET.
Results: The group of patients showed indexed atrial volume and left ventricular mass as well as E/E’ and ILAV/A´ ratios significantly higher,
in addition to a significant reduction in peak oxygen consumption and increased VE/VCO2 slope, even having similar left ventricular sizes in
comparison to those of the sample of healthy individuals.
Conclusion: There are significant differences between the structural and functional variables analyzed by Echo and CPET when comparing two
population samples: one of patients in the early stage of heart failure with ejection fraction greater than or equal to 50% and another of healthy
individuals. (Arq Bras Cardiol. 2015; 105(3):248-255)
Keywords: Spirometry; Echocardiography; Heart Failure, Stroke Volume; Outpatients.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Marco Antonio Rodrigues Torres •
Hospital de Clínicas de Porto Alegre – Serviço de Cardiologia - Rua Ramiro Barcelos, 2350 sala 2060, Rio Branco. CEP 90.035-003, Porto Alegre, RS – Brasil
E-mail: [email protected]
Artigo recebido em 24/09/14; revisado em 14/11/2014; aceito em 26/02/15.
DOI: 10.5935/abc.20150085
248
Garcia e cols.
Fase inicial da ICFEP: alterações morfofuncionais
Artigo Original
Introdução
Insuficiência cardíaca com fração de ejeção preservada
(ICFEP) tem quadro clínico de insuficiência cardíaca
(IC) e função sistólica global normal ou pouco alterada,
remodelamento adverso e disfunção diastólica do ventrículo
esquerdo (VE). Sua característica é intolerância ao exercício
com graus variáveis de congestão pulmonar/sistêmica1.
Constitui 30%-50% dos casos de IC, prevalecendo em
mulheres, idosos, hipertensos e diabéticos2,3. São vários
os critérios diagnósticos propostos, sendo amplamente
utilizado o da ESC (ESC, 2007)4, com pontos de corte para
clínica e índices estruturais cardíacos e hemodinâmicos,
privilegiando pacientes com estágios mais avançados, não
levando em consideração o amplo e heterogêneo espectro
fenotípico dela, se associando a diferentes etiologias
e mecanismos fisiopatológicos e, consequentemente,
diferentes prognósticos 5. A apresentação clínica com
sintomas leves parece ser mais frequente, com sintomas
esforço-dependentes e sinais de congestão sistêmica
mais exacerbadamente presentes na (des)compensação
da IC. Esse grupo tem sido denominado “mild” na
literatura estrangeira e nós a chamaremos de em estágio
inicial6. Incluem-se aqui hipertensos não adequadamente
controlados, obesos, diabéticos, com uma fração de ejeção
(calculada pelo método biplano de Simpson) do VE (FEVE)
ao Eco ≥ 50%, com o índice ecocardiográfico descritor da
pressão de enchimento (E/E’) entre 10-15 e capacidade
funcional diminuída aos grandes/médios esforços.
A forma “estágio inicial” tem melhor prognóstico no seu
aspecto de médio prazo e pior resposta às medicações,
segundo ensaios clínicos7,8. Aqueles com estágio inicial
são, habitualmente, submetidos à avaliação estrutural/
funcional cardíaca por ecocardiograma com doppler,
ecoDopplercardiograma (Eco) 9, porém a compreensão
da redução da capacidade funcional e dos mecanismos
de intolerância ao exercício nos diferentes estágios
requer mais exames 10 . O teste cardiopulmonar de
exercício (TCPE), ou seja, a ergoespirometria, permite
entendimento da fisiologia do esforço relacionando
características hemodinâmicas com as ventilatórias 11-13.
Diferenciação diagnóstica da ICFEP com sintomas leves
dos indivíduos com fatores de risco cardiovasculares,
pouca disfunção diastólica VE e intolerância ao esforço por
(des)condicionamento físico é muitas vezes difícil de ser
realizada com exames convencionais, e, sem diagnóstico,
mesmo com o prognóstico adverso subestimado que têm,
passariam a ser pacientes com manejo clínico inadequado.
Compreendermos a extensão das diferenças estruturais e
funcionais cardíacas basais/exercício poderia objetivar o
seu manejo, por isso focamos um estudo inicial com um
desenho para uma abordagem primeira dessa amostra
populacional, comparando suas variáveis ao Eco e ao TCPE
com aquela de uma amostra de voluntários saudáveis.
Métodos
O projeto foi aprovado no Comitê de Ética Institucional e
todos os participantes assinaram um termo de consentimento
livre e esclarecido (TCLE).
Foram selecionados pacientes oriundos de um ambulatório
assistencial de IC, adultos, com idade > 45 anos, e
apresentando critérios de Framingham para IC; fração de
ejeção do ventrículo esquerdo (FEVE) ≥ 50%; evidências
ecocardiográficas de disfunção diastólica e de não dilatação
do VE: uma relação E/E’ > 8, VAE-i ≥ 30 mL/m² e um volume
diastólico final do VE < 97 mL/m² 14. Foram selecionados
voluntários saudáveis sem doença cardiovascular ou fatores
de risco pareados pela idade e sexo da comunidade em que
vivem os pesquisadores e de diversos níveis de escolarização.
Foram utilizados como critérios de exclusão na amostra de
pacientes com ICFEP os portadores de diabete melito com
glicemia não controlada segundo critérios da American
Diabetes Association15, síndrome coronariana aguda nos
últimos três meses, insuficiência valvular de grau ≥ 2, uso
de marca-passo artificial, fibrilação atrial, insuficiência renal
em tratamento com qualquer método dialítico, HAS não
controlada, limitações osteomusculares graves, doença
vascular periférica, decréscimo significativo da acuidade
sensorial ou doença vascular encefálica que impedisse a
realização do TCPE, além de alterações do estado mental.
Os dados demográficos e clínicos, incluindo idade, sexo,
história de tabagismo, comorbidades e tempo da doença,
foram obtidos a partir das consultas regulares no referido
ambulatório com os pacientes e a mesma e detalhada
anamnese e exame físico foram feitos nos voluntários
saudáveis que ficaram a par da oferta por um anúncio
na página da instituição. Evento cardiovascular prévio
foi definido como história pregressa de doença arterial
coronariana (DAC), acidente vascular encefálico (AVE)
isquêmico ou hemorrágico e necessidade de procedimentos
de revascularização miocárdica.
Antes da realização de cada Eco, efetuou-se numa consulta
ambulatorial a aferição da pressão arterial e a obtenção de
medidas antropométricas (peso, altura, área de superfície
corpórea (ASC), índice de massa corpórea, mensuradas
conforme técnicas padronizadas e utilizando-se materiais
adequados. O índice de massa corpórea (IMC) foi calculado
pela divisão do peso (kg) pelo quadrado da altura (m),
considerando-se sobrepeso quando > 30 kg/m2. A ASC foi
obtida pela fórmula de DuBois e DuBois16.
Teste Cardiopulmonar de Exercício (TCPE)
Todos os testes foram realizados pelo mesmo médico
treinado e habilitado pelo Departamento de Ecocardiografia
e Imagens (DIC) da Sociedade Brasileira de Cardiologia (SBC).
Foi utilizado eletrocardiograma (ECG) de 12 derivações
monitorizado pelo sistema Elite (Micromed-Biotecnologia,
Brasília, Brasil). Os testes foram realizados em esteira rolante
Imbramed (TK10200 Porto Alegre, Brasil), com protocolo
de rampa individualizado, programado para durar de 8 a
12 minutos, com medidas de pressão arterial a cada 3 minutos.
A análise de gases foi realizada a cada ciclo respiratório pelo
sistema Córtex (Metalyzer 3B, Sistema de CPX, Córtex, Leipzig,
Alemanha), que foi calibrado (o gás e o volume) antes de
cada TCPE. Foi realizada a média a cada 30 segundos dos
dados ventilatórios para a análise. As variáveis do TCPE foram
calculadas como descrito previamente17. O consumo máximo
de oxigênio no pico do teste (VO2 pico) foi definido como o
Arq Bras Cardiol. 2015; 105(3):248-255
249
Garcia e cols.
Fase inicial da ICFEP: alterações morfofuncionais
Artigo Original
mais alto valor alcançado durante o teste por 20 segundos, e
a potência circulatória de pico foi calculada como produto do
VO2 pico e pressão sistólica de pico. A inclinação da ventilação
(VE) e a produção de dióxido de carbono (VE/ CO2-inclinação)
foram obtidas através do modelo de regressão linear, usando
os dados obtidos durante todo o teste e a amplitude relativa
da oscilação na E foi calculada a cada 20 segundos como a
razão entre a amplitude e a média respectiva durante todo
o teste. A eficiência da inclinação de consumo de oxigênio
(OUES) foi calculada como a inclinação da linha de regressão
linear entre a VO2 e o logaritmo da E18. O primeiro limiar
ventilatório (também referido como o limiar anaeróbio) foi
determinado pela revisão das curvas de trocas gasosas como
a frequência cardíaca em que o equivalente ventilatório para
o oxigênio aumenta sistematicamente sem um aumento no
equivalente ventilatório para o dióxido de carbono. A cinética
de recuperação do consumo de oxigênio foi avaliada como
o tempo requerido para 50% de decréscimo a partir do
VO2 pico (T1/2 O2) e calculado usando o modelo matemático
do quadrado mínimo. Foram utilizados como critérios de
interrupção do teste: a pressão arterial sistólica > 260 mmHg
e/ou a diastólica > 140 mmHg, queda da pressão sistólica
> 20 mmHg, depressão do segmento ST > 2,0 mm, inversão
de onda T e surgimento de onda Q, taquicardia supraventricular
ou ventricular sustentada, dor torácica significativa, bem como
pré-síncope, síncope, dispneia intolerável, palidez e sudorese
e desorientação e perda da coordenação.
Ecocardiograma transtorácico com o Doppler tissular
Os exames foram realizados na unidade de métodos
não invasivos de um hospital universitário. Todos os
exames foram realizados pelo mesmo médico com
experiência e habilitação pelo (DIC) da (SBC). As imagens
foram arquivadas no disco rígido do aparelho. Eco foi
realizado com ecocardiógrafos que fazem parte do acervo
desse setor: GE Healthcare, General Electric Company,
modelos Vivid 7 System (USA) com transdutores de
3-7 mHz e com recursos para obtenção das modalidades
de Eco modo M, bidimensional e Doppler (pulsátil,
continuo, colorido e tissular).
Os exames foram realizados no período de descanso, pela
manhã, em repouso e na posição de decúbito lateral esquerdo.
As medidas ecocardiográficas seguiram as recomendações da
American Society of Echocardiography (ASE)19,20 e, para cada
variável, pelo menos três ciclos foram analisados. Todos os
exames incluíram as imagens do eixo longo e do eixo curto
parasternal e apicais, 2, 3, 4 e 5-câmaras. A avaliação da
estrutura e da função cardíaca foi obtida a partir do modo M
guiado pela imagem bidimensional sendo obtidas as seguintes
variáveis: espessura diastólica final do septo (EDS), espessura
diastólica final da parede posterior (EDP), diâmetro e volume
diastólico final do ventrículo esquerdo (DDVE), diâmetro
e volume sistólico final do ventrículo esquerdo (DSVE) e
diâmetro sistólico final anteroposterior e volume do átrio
esquerdo (DAPAE). Os volumes do AE e do VE foram indexados
posteriormente pela área da superfície corporal (VAEi) e o
volume do AE foi também indexado por esta e dividido pelo
velocidade A’ (VAEi/A´).
250
Arq Bras Cardiol. 2015; 105(3):248-255
Hipertrofia do verntrículo esquerdo (HVE) foi diagnosticada
quando o índice de massa do VE (IMVE) foi > 122 g/m2 para
os homens (♂) e >99g/m2 para as mulheres (♀).
Definiu-se dilatação do átrio esquerdo (AE) na presença
de diâmetro anteroposterior do AE > 4,0 cm para homens
e > 3,8 cm para mulheres, enquanto dilatação do VE
definiu‑se quando o diâmetro diastólico VE foi > 5,6 cm.
O método volumétrico de Simpson disponibilizado no
programa do equipamento permitiu os cálculos dos volumes
atriais esquerdos e do VE.
Definiu-se como ponto de corte necessário para o
diagnóstico de ICFEP o valor do VAEi ≥ 30ml/m² (para o AE)
e um VDF < 97 ml/m² para o VE22.
O fluxo mitral foi avaliado no corte apical de quatro
câmaras pelo Doppler pulsátil. A amostra foi posicionada
entre as extremidades distais dos folhetos da válvula mitral
e, então, foram obtidas as seguintes variáveis: velocidades
diastólicas precoces: (E) e tardia (A) transmitral, relação E/A
e intervalo de tempo de desaceleração da onda E (TDE).
O Doppler tissular foi realizado no corte apical de quatro
câmaras para obtenção das velocidades do anel mitral.
A amostra foi colocada na junção da parede lateral do VE
com o anel mitral e na junção do septo interventricular
posterior com o anel mitral23, sendo, então, determinadas
as velocidades diastólicas precoces (E’) e tardias
(A’) do anel mitral, além das relações (E’/A’) e (E/E’).
Ainda, segundo sugestão da ESC, foi considerado como
de valor para a confirmação diagnóstica de ICFEP um
achado de Eco com um E/A < 0,5 e TD > 280 ms e,
principalmente, um valor de E/E’ > 8. e a disfunção
sistólica foi razão para exclusão e foi admitida quando a
FE pelo método de Simpson foi < que 50%.
A variabilidade inter e intraobservadora já publicada na
literatura para o diagnóstico de IC, levando-se em consideração
os achados do Eco, é reportada entre 0,81 e 0,96 e a
variabilidade intraobservador varia entre 0,83 e 0,98. Os autores
salientam que a aparente elevada variabilidade não inclui o
estudo das variáveis aqui abordadas, mas que é alta para a
análise de dados da velocidade de propagação do fluxo mitral
ao Doppler a cores (Vp), que não foi utilizada neste estudo23.
Análise Estatística
As variáveis quantitativas foram expressas sob a forma de
média ± desvio padrão, a normalidade dos dados amostrais
foi testada e o teste T de Student não pareado foi utilizado.
O coeficiente de correlação de Pearson foi usado para avaliar
a presença de associação entre as variáveis do Eco e do
TCPE. Os dados foram armazenados em planilhas do Excel
e analisados no pacote estatístico SPSS versão do programa
número 21,0 disponível na instituição onde foram analisados
os dados coletados. Um valor de P bicaudal inferior < 0,05 foi
considerado estatisticamente significativo.
Resultados
Foram selecionados 28 pacientes ambulatoriais com ICFEP
e 24 indivíduos saudáveis. A tabela 1 descreve as características
clínicas dos pacientes com ICFEP e dos indivíduos do grupo
Garcia e cols.
Fase inicial da ICFEP: alterações morfofuncionais
Artigo Original
Tabela 1 – Características clínicas e medicações dos pacientes do presente estudo
Características
Idade (anos)
Sexo
ICFEP (n = 28)
Controles (n = 24)
Valor p
60 ± 2
57 ± 3
p = 0,05
20/8
13/11
p = 0,05
31 ± 5
25,8 ± 4
p = 0,14
Circunferência da cintura (cm)
96,6 ± 2,1
87,6 ± 1,4
p = 0,01
Relação cintura/quadril
0,92 ± 2,0
0,87 ± 2,3
p = 0,01
Relação cintura/altura
0,60 ± 1,6
0,50 ± 1,4
p = 0,93
Hipertensão arterial sistêmica (%)
24 (90%)
-
-
Diabete melito
11 (40%)
-
-
Tabagismo
6 (20%)
-
-
Betabloqueadores
25 (89%)
-
-
Inibidores da ECA
25 (90 %)
-
-
IMC (kg/m2)
Diuréticos
25 (89%)
-
-
15 (53,5%)
-
-
Anticoagulantes
1 (3,5%)
-
-
Antiagregantes plaquetários
7 (25%)
-
-
Hipoglicemiantes orais
10 (36%)
-
-
Bloqueadores do canal de Ca++
ECA: Enzima conversora de angiotensina; IMC: Índice de massa corpórea; ICFEP: Insuficiência cardíaca com fração de ejeção preservada; Valor p: Significância estatística.
controle. Os pacientes tinham marcadores de gordura
central significativamente maior que os saudáveis. As demais
características foram semelhantes entre os grupos.
A tabela 2 descreve as variáveis ecocardiográficas
estudadas nos pacientes com ICFEP e nos controles.
Os pacientes com ICFEP apresentaram volume de átrio
esquerdo indexado (32,6 ± 12 X 18,8 ± 6,8, p = 0,04) e
relação E/E’ maiores que os controles (12,3 ± 3,6 X 7,8 ± 2,
p = 0,001) embora as dimensões ventriculares fossem
semelhantes. Pacientes também tinham aumento da massa
ventricular (108,3 ± 39 X 93,4 ± 34, p < 0,001) quando
comparados aos controles.
A tabela 3 apresenta a análise das variáveis do
TCPE do grupo ICFEP. Quando comparado com as dos
controles saudáveis demonstrou-se um menor valor do
VO2 (17,0 ± 4,4 ml.kg.min X 28,8 ± 6,4 mL.kg.min, p < 0,01),
do VO2/FC (11,0 ± 3,0 ml/bpm X 13,2 ± 4,5 mL/bpm,
p < 0,05) e um valor maior da FCR 1 minuto (14,2 ± 3,2 bpm
X 26,3 ± 10, p < 0,01).
Discussão
O presente estudo comparou características de uma amostra
populacional de pacientes com síndrome de ICFEP em estágio
inicial com voluntários saudáveis pareados por sexo e idade.
O perfil epidemiológico demonstrou que a amostra de ICFEP
apresentou alto teor de portadores de hipertensão arterial
sistêmica, diabete melito, com diferenças antropométricas
tipicamente observadas em outros estudos com populações
de ICFEP24, como uma maior cintura abdominal e relação da
relação cintura para o quadril. Esses fatores combinados são
fontes geradoras de transformações metabólicas, promovendo
estresse oxidativo e inflamação. Segundo a proposição de Senni
e cols.25 para um novo paradigma fisiopatológico na ICFEP,
a HAS, o DM, a doença pulmonar obstrutiva, a deficiência
de ferro são comorbidades e, também a obesidade, seriam
potenciais indutores de um estado inflamatório tecidual e
fontes de estresse oxidativo. Essa inflamação atua no endotélio
microvascular coronariano e sistêmico, determinando menor
biodisponibilidade do óxido nítrico, reduzindo a reserva arterial
aos aumentos da demanda gerados pelo exercício. Esse processo
fisiopatológico poderia explicar um perfil de estabilidade
clínica aos pequenos esforços ou em repouso, porém com um
significativo pior desempenho durante o exercício, próprio dos
pacientes com esse estágio de ICFEP26. Em relação à estrutura
VE, uma característica bastante reconhecida dos pacientes
com ICFEP é o perfil fenotípico de não dilatação significativa
do VE4. Os achados do presente estudo constituem ausência
de diferenças nos diâmetros diastólicos do VE entre os grupos,
mas o índice de massa VE foi significativamente maior no grupo
ICFEP, o que tipifica esse subtipo de pacientes com estágio inicial
de ICFEP, como já citado na literatura em importantes estudos
com amostras populacionais de características semelhantes6,27.
O volume do átrio esquerdo indexado pela área da
superfície corporal (VAEi) nos pacientes com ICFEP parece
ser uma importante variável e que atualmente é cada vez
mais valorizada, uma vez que em muitos estudos ela se
mostrou fator de predição independente da capacidade
de exercício28. Os presentes resultados vêm demonstrar
diferenças significativas entre as amostras populacionais de
ICFEP e saudáveis. A cronicidade da síndrome de ICFEP gera
importantes alterações na pressão e tamanho do AE, redução
do gradiente atrioventricular, menor ejeção VE e consequente
incapacidade de elevação do débito cardíaco29.
Arq Bras Cardiol. 2015; 105(3):248-255
251
Garcia e cols.
Fase inicial da ICFEP: alterações morfofuncionais
Artigo Original
Tabela 2 – Variáveis ecocardiográficas estruturais e funcionais nos dois grupos
Variáveis ecocardiográficas
ICFEP (n = 28)
Controles (n = 24)
Valor p
3,8 ± 5
3,1 ± 0,5
p = 0,28
VAEI (ml/m²)
32,6 ± 12
18,8 ± 6,8
p = 0,04
DSVE (mm)
29 ± 0,4
28 ± 0,3
p = 0,39
DDVE (mm)
46 ± 0,6
47 ± 0,4
p = 0,61
FEVE (%)
65 ± 0,8
69 ± 0,4
p = 0,03
Onda A (cm/s)
83 ± 0,2
72 ± 0,1
p = 0,97
Onda E (cm/s)
81 ± 0,3
71 ± 0,1
p = 0,58
E/A
0,97 ± 2
0,98 ± 0,29
p = 0,53
Velocidade E’(cm/s)
6,6 ± 1,4
9,1 ± 4,6
p = 0,34
Velocidade A’(cm/s)
3,9 ± 1,1
2,4 ± 1,3
p = 0,61
E/E’
12,3 ± 3,6
7,8 ± 2,1
p = 0,001
AE (cm)
VAEI/A’
2,7 ± 1,1
1,9 ± 0,68
p = 0,02
IMVE (g/m²)
108,3 ± 39
93,4 ± 34
p = 0,001
MVE/Alt2. 7 (g/m2.7)
40 ± 19,2
21,5 ± 15,7
p = 0,001
AE: Átrio esquerdo; VAEI: Volume do átrio esquerdo indexado pela superfície corporal; VAEI/A’: Volume do átrio esquerdo indexado pela superfície corporal dividido
pela onda de deslocamento miocárdico tardio; DSVE: Diâmetro sistólico do ventrículo esquerdo; DDVE: Diâmetro diastólico do ventrículo esquerdo; FEVE: Fração
de ejeção do ventrículo esquerdo; Onda A: Onda de fluxo de enchimento tardio do ventrículo esquerdo; onda E: Onda de fluxo de enchimento precoce do ventrículo
esquerdo; E/A: Razão entre as velocidades E e A; velocidade E’: Onda de deslocamento miocárdico diastólico precoce; Velocidade A’: Onda de deslocamento
miocárdico diastólico tardio; E/E’: Razão entre as ondas E e E’; ICFEP: Insuficiência cardíaca com fração de ejeção preservada; IMVE: Índice de massa do ventrículo
esquerdo indexado pela superfície corporal; MVE/alt2. 7: Massa do ventrículo esquerdo dividido pela altura em gramas por metro.
Tabela 3 – Análise das variáveis do TCPE do grupo ICFEP
ICFEP (n = 28)
Controles (n = 24)
Valor p
Tempo exercício - min
Variáveis
7,1 ± 2,1
12,1 ± 1,4
p = 0,01
FC (bpm) no pico
102 ± 22
112 ± 20
p = 0,05
Troca respiratória (R)
1,0 ± 0,5
1,1 ± 0,7
p = 0,01
VO FC
11,0 ± 3,0
13,2 ± 4,5
p = 0,04
VE/VCO²
33,5 ± 5,2
30,4 ± 3,1
p = 0,01
VE/VCO²-inclinação
35,9 ± 5,0
30,6 ± 4,5
p = 0,05
VO² (mL/kg/min)
17,0 ± 4,4
28,8 ± 6,4
p = 0,04
PETCO (mmHg)
34,3 ± 3,3
34,4 ± 4,0
p/NS
FCR1 (bpm)
14,2 ± 3,2
26,3 ± 10
p = 0,01
²
²
VE/VCO²: Inclinação; dióxido de carbono inclinação; VE/VCO²: Equivalente ventilatório de dióxido de carbono; VO²: Consumo máximo de oxigênio; VO2FC: Consumo
de oxigênio por batimento cardíaco; PETCO²: Pressão tidal de CO²; FRCR1: Frequência cardíaca de recuperação após primeiro minuto de exercício máximo;
FC: Frequência cardíaca; R: Troca ou permuta respiratória entre oxigênio e CO²; ICFEP: Insuficiência cardíaca com fração de ejeção preservada.
Adicionalmente, ainda sob o ponto de vista do crescimento
do AE, observou-se que o VAEI corrigido pela onda de
deslocamento diastólica tardia do miocárdio (VAEI/A’)
apresentou valores mais elevados nos com ICFEP. Esse índice
tem sido discutido como potencial indicador do fenômeno
diastólico e fator de predição de eventos cardiovasculares, visto
que agrega uma informação sobre remodelamento AE e de
relaxamento miocárdico. Park e cols.30 estudaram 395 pacientes
hospitalizados por dispneia, avaliados por Eco, dosagem dos
níveis do peptídeo natriurético (BNP) e o VAEi/A’ = 4,0,
252
Arq Bras Cardiol. 2015; 105(3):248-255
como ponto de corte. Os resultados demonstraram que,
quando testado para o diagnóstico da disfunção diastólica
avançada em pacientes com dispneia, com fração de ejeção
maior > 50% e a relação E/E’ entre 8-15 (zona cinzenta), o
VAEi/A’ demonstrou uma área sob a curva ROC comparável
à do BNP (0,94 X 0,93, p = 0,084) e razão E/E’ (0,94 X 0,93,
p = 0,61) e superior à do VAEi (0,94 X 0,87, p = 0,014).
Adicionalmente, foi um fator de predição independente de
desfechos cardiovasculares combinados, com uma razão de
chances igual a 3,24 (1,38 - 7,59, p = 0,07).
Garcia e cols.
Fase inicial da ICFEP: alterações morfofuncionais
Artigo Original
Em relação aos achados da função VE, os índices de
função sistólica e as velocidades de fluxo de enchimento
ventricular foram semelhantes, não se estabelecendo
diferença estatística, mas as de relaxamento precoce
do miocárdio apresentaram diferenças significativas nos
com ICFEP. Um importante componente do enchimento
VE, com poder de estimar as pressões de enchimento
de forma não invasiva, é a razão E/E´. Nagueh e cols.31
avaliaram 100 pacientes com ICFEP de forma simultânea,
com cateterismo cardíaco, e não invasivamente com Eco,
descrevendo uma correlação positiva entre pressão capilar
pulmonar e razão E/E´ (r = 086, p < 0,01). Os pacientes
do Ambulatório com ICFEP apresentaram diferença
significativa nesse índice em relação aos saudáveis.
(12,3 ± 3,6 X 7,8 ± 2,1, p < 0,001), sugerindo pressões
diastólicas mais altas, porém sem alcançar o ponto de
corte > 15, considerado como de melhor desempenho
diagnóstico para as pressões diastólicas elevadas4.
Diversos estudos que buscaram comparar a capacidade
funcional com padrões de enchimento ventricular em
pacientes com ICFEP correlacionando-as com achados
dos indivíduos saudáveis convergiram seu referencial
teórico na busca do entendimento da intolerância ao
exercício32-35. No presente estudo, as amostras populacionais
exibem importantes diferenças nas variáveis do TCPE e
nos parâmetros de enchimento do VE segundo avaliação
pelo Eco, o que requer considerações sobre os diversos
mecanismos de intolerância ao exercício nos pacientes com
ICFEP. A avaliação da capacidade funcional na ICFEP pode
ser realizada pela análise clínica, através da classificação da
NYHA e de medidas submáximas como o teste de caminhada
de seis minutos ou com a acurácia e reprodutibilidade mais
avançadas e melhor definidas que o TCPE oferece, já que o
último avalia diretamente o consumo de O2.
Algumas importantes características, como intolerância ao
exercício nos pacientes da amostra populacional em apreço,
como os valores de consumo máximo de O2 reduzido nesta
em comparação à amostra de indivíduos saudáveis, parecem
ter uma relação direta com a incapacidade de elevação
do volume sistólico pelo mecanismo de Frank-Starling, no
qual, quanto maior a distensibilidade da câmara cardíaca,
maior é seu volume de ejeção, maior sendo o potencial
de incremento do débito cardíaco quando necessário.
A inabilidade de utilização adequada do mecanismo de
Frank-Starling36 pode ser um fator determinante do menor
volume sistólico e tempo de diástole, associadas à já descrita
incapacidade de elevação da frequência cardíaca gerando
importante redução no débito cardíaco.
A resposta da frequência cardíaca de recuperação no
estudo foi um achado interessante, por demonstrar tanto a
incapacidade quanto a redução em direção aos valores de
repouso após o primeiro minuto de recuperação do teste
máximo. Algumas publicações comentam a importante
relação dos pontos de corte de redução de batimentos
cardíacos no primeiro minuto após exercício com maiores
graus de comprometimento no enchimento VE pela relação
E/E’, no qual, quanto menos batimentos são reduzidos após
o primeiro minuto de exercício máximo, maiores os valores
da relação E/E’37,38.
A relação entre a ventilação e a diferença arteriovenosa
de O2 é passível de ser investigada quando são analisados
achados dos pacientes com ICFEP aqui apresentados, os quais
tiveram um valor da variável VE/VCO2 significativamente
aumentada em relação à amostra de saudáveis, fato que
determina um pior prognóstico nos pacientes com ICFEP
como demonstrado por Guazzi e cols.39. Nesse cenário,
o VE, por trabalhar com pressões de enchimento mais
elevadas (relação E/E’ variando entre 10 e 15) estimula os
receptores J dos pulmões causando hiperventilação reflexa
e sua elevação e a consequente hipóxia arterial, assim
contribuindo para menores níveis do débito cardíaco e
reduzida diferença arteriovenosa de O2.
Hiperventilação causando hipoxemia
O índice VE/VCO2-inclinação não apresentou valores
estatisticamente aumentados nessa amostra populacional
com ICFEP. A literatura destaca que a elevação das
pressões de enchimento parece ter importante interação
com a ventilação, como sugerido por Tumminelo e
cols. 40 . Esses autores sugerem que os equivalentes
ventilatórios aumentados na ICFEP são oriundos de
quatro centros integrados: o pulmonar, representado pelas
limitações de redução alvéolo-capilar; o hemodinâmico,
representado pela redução do débito cardíaco e a FC; o
metabólico, representado pela predominância das fibras de
contração rápida; e o controle respiratório, representado
pelos reguladores periféricos e centrais (ergorreflexo
e quimiorreceptores). Nesse contexto, a atividade dos
reguladores periféricos e centrais tem importante correlação
com o VE/VCO 2 slope, e as alterações da perfusão
pulmonar geram aumentos da pressão capilar pulmonares
já identificadas em estudos clínicos pelos valores da relação
E/E’ maiores que 15.
O tempo total de exercício foi outro importante variável
onde os pacientes com a ICFEP demonstraram redução da
capacidade funcional. Achados de diversas investigações
convergem para questões metabólicas relacionadas às
enzimas aeróbias de ressíntese de ATP, bem como para
questões do sistema musculoesquelético, como limitantes à
capacidade de elevação do débito cardíaco. Wassermann e
cols.18, em uma revisão dos fatores metabólicos relacionados
à intolerância ao exercício em pacientes com IC, sugerem
a ocorrência de alterações mitocondriais na atividade da
Citocromo C–oxidase, creatinoquinase e outras enzimas
oxidativas, bem como o remodelamento das fibras de
contração rápida em detrimento das fibras de contração
lenta. Essas alterações fisiológicas nos pacientes com ICFEP
acarretam o início precoce do metabolismo anaeróbio com
o exercício, aumento da acidose metabólica, estimulação
de centros de controle respiratório, elevando a ventilação
minuto e fadiga precoce em baixas cargas de exercício.
Limitações do estudo
Embora o presente estudo tenha sido feito a partir de uma
amostra populacional inequívoca de pacientes com ICFEP
e representativa do grande contingente dos acometidos da
síndrome de IC, os indivíduos da outra amostra também são
Arq Bras Cardiol. 2015; 105(3):248-255
253
Garcia e cols.
Fase inicial da ICFEP: alterações morfofuncionais
Artigo Original
representantes legítimos de uma amostra populacional de
saudáveis, não tinham quaisquer doenças, nem Eco e TCPE
anormais, o limitado número deste estudo inicial é uma
limitação que tem que ser apontada.
Estudos futuros
Os próximos passos que permitam a avaliação dinâmica
do Eco, com caracterização de índices que avaliam a função
de enchimento do ventrículo esquerdo, são desejáveis e,
finalmente, estudos de coorte observacional unicêntricos
e multicêntricos e randomizados com as intervenções
terapêuticas que visem alterar a sobrevida populacional têm
que ser conduzidos no estágio inicial da ICFEP.
Conclusão
Há diferenças significativas entre variáveis estruturais
e funcionais analisadas nos estudos ao Eco e ao TCPE,
comparando-se duas amostras populacionais: uma com
estágio inicial de insuficiência cardíaca com fração de ejeção
preservada e outra de indivíduos saudáveis.
Contribuição dos autores
Concepção e desenho da pesquisa, Obtenção de
financiamento E Revisão crítica do manuscrito quanto ao
conteúdo intelectual importante: Torres MAR; Obtenção de
dados, Análise estatística E Redação do manuscrito: Garcia
EL, Menezes MG, Stefani CM, Danzmann LC, Torres MAR;
Análise e interpretação dos dados: Danzmann LC, Torres MAR.
Potencial conflito de interesse
Declaro não haver conflito de interesses pertinentes.
Fontes de financiamento
O presente estudo foi financiado pelo CNPq e Fundo de
incentivo à pesquisa HCPA.
Vinculação acadêmica
Este artigo é parte de dissertação de Mestrado de Eduardo
Lima Garcia pela Universidade Federal do Rio Grande do Sul.
Referências
1. Phan T, Shivu GN, Abozguia K, Sanderson JE, Frenneaux M. The
pathophysiology of heart failure with preserved ejection fraction:
from molecular mechanisms to exercise hemodynamic. Int J Cardiol.
2012;158(3):337-43.
9. Danzmann LC, Bodanese LC, Köhler I, Torres MR. Left atrioventricular
remodeling in the assessment of the left ventricle diastolic function in patients
with heart failure: a review of the currently studied echocardiography
variables. Cardiovasc Ultrasound. 2008;6:56.
2. Owan TE, Hodge DO, Herges RM, Jacobsen SJ, Roger VL, Redfield MM.
Trends in prevalence and outcome of heart failure with preserved ejection
fraction. N Engl J Med. 2006;355(3):251-9.
10. Borlaug BA. Mechanisms of exercise intolerance in heart failure with
preserved ejection fraction. Circ J. 2014;78(1):20-32.
3.
Bhatia RS, Tu JV, Lee DS, Austin PC, Fang J, Haouzi A, et al. Outcome of heart
failure with preserved ejection fraction in a population-based study. N Engl
J Med. 2006;355(3):260-9.
4. Paulus WJ, Tschope C, Sanderson JE, Rusconi C, Flachskampf FA,
Rademakers FE, et al. How to diagnose diastolic heart failure: a
consensus statement on the diagnosis of heart failure with normal left
ventricular ejection fraction by the Heart Failure and Echocardiography
Associations of the European Society of Cardiology. Eur Heart J.
2007;28(20):2539-50.
5. Katz DH, Beussink L, Sauer AJ, Freed BH, Burke MA, Shah SJ. Prevalence,
clinical characteristics, and outcomes associated with eccentric versus
concentric left ventricular hypertrophy in heart failure with preserved
ejection fraction. Am J Cardiol. 2013;112(20):1158-64.
6. Bhuiyan T, Maurer MS. Heart failure with preserved ejection fraction:
persistent diagnosis, therapeutic enigma. Curr Cardiovasc Risk Rep.
2011;5(5):440-9.
7. Edelmann F, Wachter R, Schmidt AG, Krainer EK, Colantonio C, Kamke W,
et al. Effect of spironolactone on diastolic function and exercise capacity in
patients with heart failure with preserved ejection fraction: the Aldo-DHF
randomized controlled trial. JAMA. 2013;309(8):781-91.
8.
254
Solomon SD, Zile M, Pieske B, Voors A, Shah A, Krainer EK, et al; Prospective
comparison of ARNI with ARB on Management Of heart failUre with
preserved ejectioN fracTion (PARAMOUNT) Investigators. The angiotensin
receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection
fraction: a phase 2 double-blind randomized controlled trial. Lancet.
2012;380(9851):1387-95.
Arq Bras Cardiol. 2015; 105(3):248-255
11. Bhella PS, Prasad A, Heinicke K, Hastings JL, Arbab-Zadeh A, Adams-Huet
B, et al. Abnormal hemodynamic response to exercise in heart failure with
preserved ejection fraction. Eur J Heart Fail. 2011;13(12):1296-304.
12. Guazzi M, Myers J, Puberty MA, Bensimhon D, Chase P, Arena R.
Cardiopulmonary exercise testing variables reflect the degree of diastolic
dysfunction in patients with heart failure normal ejection fraction. J
Cardiopulm Rehabil Prev. 2010;30(3):165-72.
13. Skaluba SJ, Litwin SE. Mechanisms of exercise intolerance: insights from
tissue Doppler imaging. Circulation. 2004;109(8):972-7.
14. Vasan RS, Levy D. Defining diastolic heart failure: a call for standardized
diagnostic criteria. Circulation. 2000;101(17):2118-21.
15. American Diabetes Association. Standards of medical care in diabetes -2013. Diabetes Care. 2013;36 Suppl 1:S11-66.
16. DuBois D, DuBois EF. A formula to estimate the approximate surface area if
height and weight be known. 1916. Nutrition. 1989;5(5):303-11.
17. American Thoracic Society, American College of Chest Physicians. ATS/ACCP
statement on cardiopulmonary exercise testing. Am J Rev Respir Crit Care
Med. 2003;167(2):211-77.
18. Wasserman K, Whipp BJ, Koyl SN, Beaver WL. Anaerobic threshold and
respiratory gas exchange during exercise. J Appl Physiol. 1973;35(2):236-43.
19. Gardin JM, Adams DB, Douglas PS, Feigenbaum H, Forst DH, Fraser AG,
et al; American Society of Echocardiography. Recommendations for a
standardized report for adult transthoracic echocardiography: a report from
the American Society of Echocardiography’s Nomenclature and Standards
Committee and Task Force for a Standardized Echocardiography Report. J
Am Soc Echocardiogr. 2002;15(3):275-90.
Garcia e cols.
Fase inicial da ICFEP: alterações morfofuncionais
Artigo Original
20. Kasner M, Wassermann D, Steendijk P, Gaub R, Wilkenshoff U, Weitmann K,
et al. Utility of Doppler echocardiography and tissue Doppler imaging in the
estimation of diastolic function in heart failure with normal ejection fraction:
a comparative Doppler-conductance catheterization study. Circulation.
2007;116(6):637-47.
21. Devereux RB, Alonso DR, Lutas EM, Gottlieb GJ, Campo E, Sachs I, et al.
Echocardiography assessment of left ventricular hypertrophy: comparison
to necropsy findings. Am J Cardiol. 1986;57(6):450-8.
22. Nagueh SF, Appleton CP, Gillebert TC, Marino PN, Oh JK, Smiseth OA,
et al. Recommendations EAE/ASE - for the evaluation of left ventricular
diastolic function by echocardiography. J Am Soc Echocardiogr.
2009;22(2):107-33
23. Wenzelburger FW, Tan YT, Choudhary FJ, Lee ES, Leyva F, Sanderson JE.
Mitral annular plane systolic excursion on exercise: a simple diagnostic
tool for heart failure with preserved ejection fraction. Eur J Heart Fail.
2011;13(9):953-60.
24. Edelmann F, Gelbrich G, Düngen HD, Fröhling S, Wachter R, Stahrenberg R,
et al. Exercise training improves exercise capacity and diastolic function in
patients with heart failure with preserved ejection fraction. J Am Coll Cardiol.
2011;58(17):1780-91.
25. Senni M, Paulus WJ, Gavazzi A, Fraser AG, Díez J, Solomon SD, et al.
New strategies for heart failure with preserved ejection fraction: the
importance of targeted therapies for heart failure phenotypes. Eur Heart J.
2014;35(40)2797-815.
26. Borlaug BA, Olson TP, Lam CS, Flood KS, Lerman A, Johnson BD, et al. Global
cardiovascular reserve dysfunction in heart failure with preserved ejection
fraction. J Am Coll Cardiol. 2010;56(11):845-54.
27. Jung P, Huber T, Müller M, König A, Krötz F, Sohn HY. [Prognostic impact of
heart failure with preserved versus reduced ejection fraction in patients with
mild symptoms]. Dtsch Med Wochenschr. 2012;137(14):706-10.
28. Ratanasit N, Karaketklang K, Chirakarnjanakorn S, Krittayaphong R,
Jakrapanichakul D. Left atrial volume as an independent predictor of
exercise capacity in patients with isolated diastolic dysfunction presented
with exertional dyspnea. Cardiovasc Ultrasound. 2014;12:19.
29. Jorge AL, Ribeiro L, Rosa MG, Licio FV, Fernandes LM, Lanzieri PG, et al.
Medida do átrio esquerdo em pacientes com suspeita de insuficiência cardíaca
com fração de ejeção normal. Arq Bras Cardiol. 2012;98(2):175-81.
30. Park HJ, Junk OH, Min J, Park MW, Park CS, Shin D, et al. Left atrial volume
index over late diastolic mitral annulus velocity is a useful echo index to
indetify advanced diastolic dysfunction and predict clinical outcomes. Clin
Cardiol. 2011;34(2):124-30.
31. Nagueh SF, Mikati I, Kopelen HA, Middleton KJ, Quiñones MA, Zoghbi
WA, et al. Doppler estimation of left ventricular filling pressure in sinus
tachycardia. A new application of tissue Doppler imaging. Circulation.
1998;98(16):1644-50.
32. Otto EB, Pereira MM, Beck AS, Milani M. Correlação da função diastólica
com a capacidade máxima de exercício ao teste ergométrico. Arq Bras
Cardiol. 2011;96(2):107-13.
33. Kitzman DW. Exercise intolerance. Prog Cardiovasc Dis. 2005;47(6):367-79.
34. Eroğlu S, Sade LE, Aydinalp A, Yildirir A, Bozbaş H, Ulubay G, et al. Association
between cardiac functional capacity and parameters of tissue Doppler imaging
in patients with normal ejection fraction. Acta Cardiol. 2011;66(2):181-7.
35. Guazzi M, Myers J, Peberdy MA, Bensimhon D, Chase P, Arena R, et al.
Maximal dyspnea on exertion during cardiopulmonary exercise testing is
related to poor prognosis and echocardiography with tissue Doppler imaging
in heart failure. Congest Heart Fail. 2009;15(6):277-83.
36. Kitzman DW, Higginbotham MB, Cobb FR, Sheikh KH, Sullivan MJ.
Exercise Intolerance in patients with heart failure and preserved left
ventricular systolic function: failure of the Frank-Starling Mechanism. J Am
Coll Cardiol. 1991;17(5):1065-72.
37. Phan TT, Shivu GN, Abozguia K, Davies C, Nassimizade HM, Jimenez D,
et al. Impaired heart rate recovery and chronotropic incompetence in
patients with heart failure with preserved ejection fraction. Circ Heart Fail.
2010;3(1):29-34.
38. Edelmann F, Gelbrich G, Duvinage A, Stahrenberg R, Behrens A, Prettin C,
et al. Differential interaction of clinical characteristics with key functional
parameters in heart failure with preserved ejection fraction--results of the
Aldo-DHF trial. Int J Cardiol. 2013;169(6):408-17.
39. Guazzi M, Myers J, Peberdy MA, Bensimhon D, Chase P, Pinkstaff S, et al.
Heart rate recovery and tissue Doppler echocardiography in heart failure.
Clin Cardiol. 2010;33(2):E61-4.
40. Tumminello G, Guazzi M, Lancellotti P. Exercise ventilation inefficiency
in heart failure pathophysiological and clinical significance. Eur Heart J.
2007;28(6):673-8.
Arq Bras Cardiol. 2015; 105(3):248-255
255
Voltar ao Índice da Capa
Artigo Original
Deficiência de Testosterona Aumenta Readmissão Hospitalar e
Mortalidade em Pacientes do Sexo Masculino com Insuficiência Cardíaca
Testosterone Deficiency Increases Hospital Readmission and Mortality Rates in Male Patients with Heart Failure
Marcelo Rodrigues dos Santos1, Ana Luiza Carrari Sayegh1, Raphaela Vilar Ramalho Groehs1, Guilherme Fonseca1,
Ivani Credidio Trombetta1,2, Antônio Carlos Pereira Barretto1, Marco Antônio Arap3, Carlos Eduardo Negrão1,4,
Holly R. Middlekauff5, Maria-Janieire de Nazaré Nunes Alves1
Instituto do Coração (InCor) – Faculdade de Medicina da Universidade de São Paulo1; Universidade Nove de Julho (UNINOVE)2; Faculdade
de Medicina da Universidade de São Paulo – Urologia3; Escola de Educação Física e Esporte da Universidade de São Paulo4, São Paulo, SP –
Brasil; Division of Cardiology - David Geffen School of Medicine - University of California5 – USA
Resumo
Fundamento: A deficiência de testosterona na insuficiência cardíaca (IC) está associada à diminuição da capacidade
de exercício e mortalidade, mas o seu impacto sobre as readmissões é incerto. Além disso, sua relação com a ativação
simpática é desconhecida.
Objetivo: O presente estudo investigou o papel dos níveis de testosterona nas reinternações hospitalares, na mortalidade
e na atividade nervosa simpática em pacientes com IC.
Métodos: A testosterona total (TT) e a testosterona livre (TL) foram medidas em 110 pacientes do sexo masculino
hospitalizados, com fração de ejeção < 45% e classificação funcional da New York Heart Association (NYHA) IV, qualificados
em dois grupos: 66 com baixos níveis de testosterona (BT) e 44 com testosterona normal (TN). Hipogonadismo foi definido
como TT < 300 ng/dL e TL < 131 pmol/L. A atividade nervosa simpática muscular (ANSM) foi gravada por microneurografia
em uma subpopulação de 27 pacientes.
Resultados: O tempo de permanência hospitalar foi maior em pacientes BT em comparação com pacientes TN (37 ± 4 vs.
25 ± 4 dias; p = 0,008). Da mesma forma, o risco cumulativo de readmissão no período de um ano foi maior em pacientes
BT (44% vs. 22%, p = 0,001). Na análise de uma única variável preditora, a testosterona total (HR = 2,77, IC 95% 1,58-4,85,
p = 0,02) previu readmissão hospitalar no prazo de 90 dias. Na análise de uma única variável preditora, testosterona total
(HR = 4,65, IC 95% 2,67-8,10, p = 0,009) e readmissão dentro de 90 dias (HR = 3,27, IC 95% 1,23‑8,69, p = 0,02) previram
aumento de mortalidade. Ativação neuro-humoral, estimada pela ANSM, foi significativamente maior nos pacientes BT em
comparação aos do grupo TN (65 ± 3 vs. 51 ± 4 disparos/100BC; p < 0,001).
Conclusão: Estes resultados sustentam o conceito de que BT é um fator de risco independente para a readmissão
hospitalar dentro de 90 dias e para aumento de mortalidade em pacientes com IC. Além disso, observou-se aumento da
ANSM em pacientes com baixos níveis de testosterona. (Arq Bras Cardiol. 2015; 105(3):256-264)
Palavras-chave: Insuficiência Cardíaca / mortalidade; Testosterona / deficiência; Readmissão do Paciente; Homens.
Abstract
Background: Testosterone deficiency in patients with heart failure (HF) is associated with decreased exercise capacity and mortality; however, its impact
on hospital readmission rate is uncertain. Furthermore, the relationship between testosterone deficiency and sympathetic activation is unknown.
Objective: We investigated the role of testosterone level on hospital readmission and mortality rates as well as sympathetic nerve activity in
patients with HF.
Methods: Total testosterone (TT) and free testosterone (FT) were measured in 110 hospitalized male patients with a left ventricular ejection
fraction < 45% and New York Heart Association classification IV. The patients were placed into low testosterone (LT; n = 66) and normal
testosterone (NT; n = 44) groups. Hypogonadism was defined as TT < 300 ng/dL and FT < 131 pmol/L. Muscle sympathetic nerve activity
(MSNA) was recorded by microneurography in a subpopulation of 27 patients.
Results: Length of hospital stay was longer in the LT group than that in the NT group (37 ± 4 vs. 25 ± 4 days; p = 0.008). Similarly, the cumulative
hazard of readmission within 1 year was greater in the LT group than that in the NT group (44% vs. 22%, p = 0.001). In the single‑predictor
analysis, TT (hazard ratio [HR], 2.77; 95% confidence interval [CI], 1.58–4.85; p = 0.02) predicted hospital readmission within 90 days.
In addition, TT (HR, 4.65; 95% CI, 2.67–8.10; p = 0.009) and readmission within 90 days (HR, 3.27; 95% CI, 1.23–8.69; p = 0.02) predicted
increased mortality. Neurohumoral activation, as estimated by MSNA, was significantly higher in the LT group than that in the NT group (65 ± 3
vs. 51 ± 4 bursts/100 heart beats; p < 0.001).
Conclusion: These results support the concept that LT is an independent risk factor for hospital readmission within 90 days and increased mortality
in patients with HF. Furthermore, increased MSNA was observed in patients with LT. (Arq Bras Cardiol. 2015; 105(3):256-264)
Keywords: Heart Failure / mortality; Testosterone / deficiency; Patient Readmission; Men.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Maria Janieire de Nazaré Nunes Alves •
Instituto do Coração (InCor) HC-FMUSP. Av. Dr. Eneas de Carvalho Aguiar, 44 Bloco II, Andar -1, Cerqueira César. CEP 05403-900, São Paulo, SP – Brasil
E-mail: [email protected], [email protected]
Artigo recebido em 13/02/15; revisado em 14/05/15; aceito em 15/05/15.
256
DOI: 10.5935/abc.20150078
Santos e cols.
Deficiência de testosterona na insuficiência cardíaca
Artigo Original
Introdução
Sintomas atribuíveis à insuficiência cardíaca (IC),
incluindo dispneia, fadiga e fraqueza muscular, levam a
mais de um milhão de internações por ano nos Estados
Unidos e no Brasil1, com taxas de readmissão no prazo de
90 dias que se aproximam de 50%2,3. Embora a importância
dos custos relacionados à IC seja reconhecida como um
dos principais contribuintes para a crise de gastos com
saúde, mais de 20 ensaios farmacológicos em todo o
mundo, com foco na mortalidade como desfecho, foram
negativos 2. Considerando que uma grande proporção
de pacientes com IC trocaria maior tempo de vida por
melhor qualidade de vida (QV) 4, que está diretamente
relacionada à capacidade de exercitar-se5, no contexto
desses 20 ensaios de sobrevivência negativos, seria razoável
reorientar os alvos terapêuticos na IC para melhoras da
capacidade funcional e de exercício.
A deficiência de testosterona está presente em um grande
número de pacientes do sexo masculino com IC avançada,
correlacionando-se à redução da classe funcional, da capacidade
de exercício e da força muscular6-8 e, em alguns9, porém não
em todos os estudos10, ao aumento da mortalidade. A terapia de
testosterona é recomendada para o aumento da capacidade de
exercício em pacientes do sexo masculino com deficiência de
testosterona e sintomas de hipogonadismo; em pacientes com
IC, a terapia de testosterona, em comparação com o placebo,
está associada a um aumento da tolerância ao exercício, não
justificado pelo comprometimento da função cardíaca8,11-14.
Mesmo considerando que a terapia de testosterona não
melhore a função cardíaca, diante da crescente aceitação
da “hipótese muscular”, que argumenta que a limitação
ao exercício em pacientes com IC crônica está focada em
características periféricas, incluindo anormalidades dos reflexos
ativados durante o exercício15,16, a terapia de testosterona
pode ter efeitos benéficos sobre o estado neuro-humoral na
IC. De fato, diminuição da sensibilidade dos barorreceptores
e variabilidade da frequência cardíaca (VFC) foram relatadas
em pacientes com deficiência de testosterona17.
O objetivo deste estudo foi testar a hipótese de que a
deficiência de testosterona está associada a risco aumentado para
subsequentes reinternações com 30, 60 e 90 dias. Além disso,
avaliou-se a mortalidade em pacientes do sexo masculino com
IC, internados por IC descompensada. Adicionalmente, para dar
início à compreensão dos mecanismos inerentes a essa relação
potencialmente inversa, testamos a hipótese de que pacientes
com IC com deficiência de testosterona têm maior ativação
neuro-humoral, isto é, aumento dos níveis de atividade nervosa
simpática muscular, em comparação com pacientes com IC com
níveis normais de testosterona.
Métodos
População do estudo
Foram avaliados, prospectivamente, 110 pacientes do
sexo masculino com IC, hospitalizados consecutivos, com
descompensação de IC aguda, de classe funcional IV, que
preenchiam os critérios estabelecidos e que concordaram
em participar do estudo. Os critérios de inclusão foram:
1) idade entre 18 e 65 anos 2) diagnóstico de IC > 6 meses
e 3) fração de ejeção (FEVE) <45%. Os critérios de exclusão
foram: 1) história de revascularização coronária ou enfarte do
miocárdio <6 meses antes do estudo, 2) qualquer tratamento
hormonal, incluindo a terapia de testosterona exógena, antes
ou durante o protocolo, 3) doença renal avançada, doença
hepática ou diabetes, 4) obesidade (IMC > 30 kg/m2),
5) câncer de próstata ou hiperplasia prostática benigna, com
ou sem terapia anti-androgênica (finasterida, doxazosina ou
tansulosina). O termo de consentimento livre e esclarecido
obtido para este estudo foi aprovado pelo comitê de ética
local e está registrado nos Ensaios Clínicos (NCT01852994).
Medições laboratoriais
Todos os pacientes tiveram sangue coletado para dosagem
de andrógenos na manhã da internação hospitalar. No caso
do paciente seradmitido à tarde ou à noite, a dosagem de
andrógenos era feita no dia seguinte. No laboratório de análises
clínicas do Hospital das Clínicas da Faculdade de Medicina da
Universidade de São Paulo, os níveis séricos de testosterona
total (faixa normal 300‑965 ng/dL, CV intra-ensaio ≤ 7,5% e
CV inter-ensaio ≤ 5,4%) e de globulina ligadora do hormônio
sexual (SHBG, faixa normal de 12-75 nmol/L, CV intra-ensaio
≤ 2,3%, e CV inter-ensaio ≤ 6%) foram determinados de
acordo com técnicas laboratoriais padrão. A testosterona livre
(faixa normal 131-640 pmol/L) foi calculada usando SHBG e
testosterona total na fórmula proposta por Vermeulen e cols.18.
Hipogonadismo foi definido no laboratório considerando
ambas, testosterona total < 300 ng/dL e testosterona livre
< 131 pmol/L19,20. Na manhã do dia da internação hospitalar,
foram dosados também peptídeo natriurético de tipo B
(BNP), proteína C-reativa (PCR), hemoglobina, nitrogênio
ureico sanguíneo (BUN), creatinina, sódio, potássio e glicose
em jejum. A taxa de filtração glomerular (TFG) foi calculada
utilizando a equação da Modificação da Dieta em Doença
Renal (MDRD) recomendada pelo programa educacional
americano de doença renal (National Kidney Disease Education
Program, NKDEP).
Atividade do nervo simpático muscular (ANSM)
Todos os pacientes, uma vez estabilizados em terapia oral,
foram convidados a realizar a gravação microneurográfica
da atividade nervosa simpática muscular (ANSM).
Conforme relatos anteriores, a microneurografia do nervo
fibularé uma técnica segura, precisa e direta para registrar a
ANSM21. O registro da ANSM foi feito em uma subpopulação
de 27 pacientes durante a internação. Resumidamente, um
microeletrodo de tungstênio foi colocado no nervo fibular
e o neurograma simpático foi registrado. Sinais nervosos
foram amplificados por um fator de 50.000 a 100.000 e
filtrado em filtro passa-faixa (700 a 2000 Hz). Para registro
e análise, a atividade do nervo foi retificada e integrada
(tempo constante 0,1 s) para obter uma exibição de tensão
média. Disparos simpáticos musculares foram identificados
por inspeção visual pelo M.R.S. cego ao protocolo de
estudo. A ANSM foi expressa como frequência de disparos
(disparos por minuto) e incidência de disparos (disparos por
100 batimentos cardíacos).
Arq Bras Cardiol. 2015; 105(3):256-264
257
Santos e cols.
Deficiência de testosterona na insuficiência cardíaca
Artigo Original
Ecocardiografia
A fração de ejeção do ventrículo esquerdo foi avaliada
(Teicholz) a partir de imagens 2-D, de acordo com
métodos padrão22.
Acompanhamento
Após a alta, todos os pacientes foram acompanhados por
uma enfermeira dedicada à pesquisa, por meio do registro
eletrônico de saúde e por telefonemas periódicos.
Análise Estatística
O teste de Kolmogorov-Smirnov foi utilizado para
verificar todos os dados quanto à distribuição normal.
O teste t de Student e o de Mann-Whitney foram
utilizados, respectivamente, para dados paramétricos e
não‑paramétricos. O teste Qui-quadrado (X2) foi utilizado
para medicamentos e etiologia da insuficiência cardíaca.
Riscos proporcionais de Cox foram utilizados para
testar as associações entre as variáveis analisadas e os
desfechos (reinternações dentro de 30, 60, 90 dias e
mortalidade). Na análise de uma única variável preditora
de reinternação, incluímos: tempo de permanência na
primeira internação, idade, FEVE, presença ou ausência de
doença arterial coronariana (DAC), BNP, PCR, hemoglobina,
ureia, creatinina, TFG, sódio, potássio, glicose de jejum,
testosterona total, testosterona livre e SHBG. Na análise
de uma única variável preditora de mortalidade, incluímos
as mesmas variáveis acima, bem como reinternações nos
períodos de 30, 60 e 90 dias após a alta. Uma análise de
modelo multivariado (de stepwise forward e backward, com
p = 0,10) foi realizada para avaliar quais fatores previriam,
de forma independente, reinternações e mortalidade, na
análise de uma única variável preditora.
A sobrevivência foi avaliada por análise de Kaplan-Meier,
com intervalos de confiança de 95%, entre testosterona total
e mortalidade no prazo de um ano. Além disso, a análise
de Kaplan-Meier foi avaliada entre testosterona total e
reinternações no período de um ano. O teste de log-rank
Cox-Mantel foi utilizado para as diferenças nas taxas de
sobrevivência e readmissões.
Os valores de p < 0,05 foram considerados estatisticamente
significativos.
Resultados
Durante a internação, sessenta e seis pacientes foram
classificados como com baixos níveis de testosterona (BT)
e 44 foram classificados como testosterona normal (TN).
A Tabela 1 mostra a comparação das características entre
os grupos BT e TN. Os grupos BT e TN não diferiram
quanto à idade, etiologia da IC, fração de ejeção ou
medicamentos, porém BNP, PCR, ureia, creatinina e
glicemia de jejum foram significativamente maiores no
grupo BT em comparação com o grupo TN. Em contraste,
hemoglobina, TFG, sódio, e como esperado, os níveis de
testosterona total e livre, foram significativamente menores
no grupo BT em relação ao grupo TN.
258
Arq Bras Cardiol. 2015; 105(3):256-264
Tempo de internação hospitalar durante a primeira
admissão
O grupo BT apresentou tempo de internação hospitalar
significativamente maior quando comparado ao grupo
TN (37 ± 4 vs. 25 ± 4 dias, respectivamente) (Figura 1;
p = 0,008). Mesmo quando valores discrepantes
(valores > 2 DP) foram excluídos, essa relação persistiu.
Durante essa primeira internação, 6 pacientes foram a óbito
no grupo BT contra 2 no grupo TN.
Reinternações após a primeira admissão
No momento da alta, os medicamentos não foram
diferentes entre os grupos BT e TN (Tabela 2). O tempo
médio para a primeira reinternação foi de 94 dias (grupo
BT) e 137 dias (grupo TN). A taxa de reinternação,
medida a cada momento clínico avaliado (30, 60 ou
90 dias),foi maior em pacientes BT em comparação com
pacientes TN. No entanto, as reinternações dentro dos
períodos de 30 e 60 dias não se correlacionaram com
nenhuma das variáveis testadas na regressão de Cox.
Na análise de uma única variável preditora de reinternação
dentro de 90 dias, a testosterona total foi a única
variável relacionada a esse mau prognóstico (HR = 2,77,
IC 95% 1,58‑4,85, p = 0,02, Tabela 3). Em modelos
multivariados de riscos proporcionais de Cox, foram incluídas
todas as variáveis que se relacionaram à reinternação dentro
de 90 dias na análise de única variável preditora. Quando as
análises de stepwise forward e backward foram realizadas,
o modelo final foi composto apenas por testosterona total
(forward: HR = 2,49, IC 95% 1,33-4,65, p = 0,04 e
backward: HR = 2,48, IC 95% 1,33-4,65, p = 0,004) para a
readmissão dentro de 90 dias. Além disso, o risco cumulativo
para readmissão foi maior no grupo BT quando comparado
com o grupo TN [Figura 2 (n = 102); p = 0,001)], após um
ano de acompanhamento.
Mortalidade em um ano de acompanhamento
Após a primeira alta, o grupo BT apresentou mortalidade
significativamente maior quando comparado ao grupo
TN [Figura 3 (n = 102); p = 0,001],em um ano de
acompanhamento: 24 pacientes no grupo BT e 7 pacientes
no grupo TN foram a óbito, no período de um ano após
a alta hospitalar. Na análise de única variável preditora,
a testosterona total (HR = 4,65, IC 95% 2,67‑8,10,
p = 0,009, Tabela 3) e a reinternação no prazo de 90 dias
(HR = 3,27, IC 95% 1,23-8,69, p = 0,02, Tabela 3) foram
preditores de mortalidade. Em modelos multivariados
de riscos proporcionais de Cox, foram incluídas todas as
variáveis que se relacionaram à mortalidade na análise de
única variável preditora. Quando a análise de stepwise
(forward) foi realizada, o modelo final consistiu na
testosterona total (forward: HR = 3,86, IC 95% 2,06‑7,21,
p < 0,001) e na reinternação total dentro de 90 dias
(forward: HR = 3,08, IC 95% 1,57 -6,04, p = 0,001) para
a mortalidade. O stepwise backward para a mortalidade
foi relacionado a quatro preditores independentes:
testosterona total (HR = 3,86, IC 95% 2,06‑7,21,
p < 0,0001), TFG (HR = 0,97, IC 95% 0,95‑0,99,
Santos e cols.
Deficiência de testosterona na insuficiência cardíaca
Artigo Original
Tabela 1 – Características físicas, clínicas e hormonais de pacientes do sexo masculino com insuficiência cardíaca na primeira internação
Variáveis
Baixos níveis de testosterona (n = 66)
Níveis normais de testosterona (n = 44)
Valor de p
52 ± 1
51 ± 2
0,70
Idade, a
Peso, kg
72 ± 2
71 ± 2
0,52
Altura, m
1,70 ± 0,01
1,69 ± 0,01
0,78
IMC, kg/m2
25 ± 1
24 ± 1
0,54
FEVE, %
25 ± 1
27 ± 1
0,24
TT, ng/dL
237 ± 11
652 ± 41
< 0,001
TL, pmol/L
124 ± 9
323 ± 21
< 0,001
SHBG, nmol/L
60 ± 3
73 ± 5
0,037
Etiologia da IC
0,81
Com DAC
17 (26%)
9 (20%)
Sem DAC
49 (74%)
35 (80%)
Chagásica
17
14
Hipertensiva
3
3
Idiopática
29
18
29 (44%)
24 (55%)
Tratamento, N (%)
IECA/ARB
0,28
Bloqueadores β
51 (77%)
26 (59%)
0,04
Diuréticos
57 (86%)
33 (75%)
0,13
Digoxina
13 (20%)
10 (23%)
0,70
Estatina
18 (27%)
8 (18%)
0,27
Aspirina
26 (39%)
11 (25%)
0,12
BNP, pg/mL
1725 ± 153
804 ± 112
0,006
PCR, mg/L
35 ± 6
15 ± 3
0,007
Biomarcadores
BUN, mg/L
Creatinina, mg/L
Glicose de jejum, mg/L
Hemoglobina, g/dL
70 ± 4
56 ± 4
0,04
1,66 ± 0,10
1,32 ± 0,05
0,02
114 ± 3
94 ± 2
0,01
12,30 ± 0,26
13,57 ± 0,30
0,007
TFG, mL·min-1·1,73 m-2
49 ± 2
55 ± 1
0,03
Sódio, mEq/L
135 ± 1
137 ± 0,4
0,04
4,38 ± 0,07
4,51 ± 0,08
0,29
Potássio, mEq/L
Durante essa primeira internação, 6 pacientes do grupo com baixos níveis de testosterona e dois pacientes do grupo com testosterona normal foram a óbito e foram
excluídos da análise subsequente. IMC: Índice de Massa Corporal; FEVE: fração de ejeção do ventrículo esquerdo; TT: Testosterona total; TL: Testosterona livre;
SHBG: Globulina de ligação do hormônio sexual; DAC: Doença arterial coronariana; IECA/ARB: Inibidores da enzima conversora de angiotensina e bloqueadores dos
receptores da angiotensina; BNP: Peptídeo natriurético tipo B; PCR: Proteína C-reativa sérica; BUN: Nitrogênio ureico sanguíneo; TFG: taxa de filtração glomerular
p = 0,034), reinternação dentro de 90 dias (HR = 2,39,
IC 95% 1,05-5,45, p = 0,038) e reinternação dentro de
60 dias (HR = 2,96, IC 95% 1,01‑8,67, p = 0,047).
Atividade nervosa simpática muscular (ANSM)
A ANSM foi significativamente maior no grupo BT
contra o grupo TN, quando calculada como disparos por
100 batimentos cardíacos (65 ± 3 vs. 51 ± 4 disparos/100HB,
p < 0,001). A ANSM também tendeu a ser mais elevada no
grupo BT em comparação com o grupo TN, quando calculada
como disparos/minuto (47 ± 3 vs. 43 ± 4 disparos/min,
p = NS), mas não alcançou significância estatística.
Discussão
Embora associada à doença cardíaca e à mortalidade
elevada23, a deficiência de testosterona não é normalmente
utilizada na prática clínica para avaliar a gravidade e o
prognóstico da IC. Nossos achados, demonstrando que
baixos níveis de testosterona estão associados ao aumento
da mortalidade em uma coorte com IC, corraboram com o
conceito de que baixos níveis de testosterona estão associados
ao aumento do risco cardíaco. Além disso, a deficiência de
testosterona total foi um fator de risco independente para o
aumento da morbidade, conforme evidenciado pelo aumento
de reinternações hospitalares no período de 90 dias.
Arq Bras Cardiol. 2015; 105(3):256-264
259
Santos e cols.
Deficiência de testosterona na insuficiência cardíaca
Artigo Original
Figura 1 – Tempo de internação hospitalar em pacientes com IC com baixos níveis de testosterona (n = 66) e níveis normais de testosterona (n = 44). Note-se que o
grupo BT apresentou maior tempo de internação em relação ao grupo TN na primeira internação. *=Diferença entre os grupos, p = 0,008.
Tabela 2 – Medicamentos e dose diária na alta (primeira internação) em pacientes do sexo masculino com insuficiência cardíaca
Variáveis
Baixos níveis de testosterona (n = 60)
Níveis normais de testosterona (n = 42)
Valor de p
Bloqueador β
52 (87%)
39 (93%)
NS
IECA/ARB
41 (68%)
36 (86%)
NS
Espironolactona
25 (42%)
19 (45%)
NS
Diuréticos
43 (72%)
34 (81%)
NS
Digoxina
10 (17%)
15 (36%)
NS
Hidralazina
36 (60%)
20 (48%)
NS
Estatina
22 (37%)
8 (19%)
NS
Aspirina
19 (32%)
10 (24%)
NS
Tratamento, N (%)
Note-se que, na primeira internação, 6 pacientes do grupo com baixos níveis de testosterona e 2 pacientes do grupo com níveis normais de testosterona foram a
óbito. IECA/ARB: Inibidores da enzima conversora de angiotensina e bloqueadores dos receptores da angiotensina; NS: Não significativo.
Em nosso estudo, a análise stepwise para a mortalidade
associou-se fortemente à reinternação dentro de 90 dias
(forward) e à reinternação dentro de 60 dias (backward),
bem como à testosterona total e TFG. Em um artigo de
revisão, a reinternação hospitalar tardia (> 30 dias) foi
relatada como associada à insuficiência renal e a BNP
elevado2. Curiosamente, não observamos uma associação
com reinternações precoces (dentro de 30 dias) em pacientes
com deficiência de testosterona. Esse resultado é consistente
com o conceito de que a reinternação em 30 dias pode
estar mais relacionada à baixa assistência social e baixo nível
socioeconômico, do que a um aumento de comorbidades
clínicas 2. De fato, em nosso estudo, a deficiência de
testosterona foi associada àmaior ativação simpática, que é
260
Arq Bras Cardiol. 2015; 105(3):256-264
sabidamente um fator de risco para aumento de mortalidade
na IC24. A maior ativação simpática pode proporcionar um
mecanismo potencial, que será discutido abaixo.
Estudos anteriores relataram associações inconsistentes
entre níveis de testosterona e mortalidade na IC. No primeiro
relato explorando a relação entre baixos níveis de testosterona
e mortalidade na IC, Jankowska e cols.9 relataram que baixos
níveis de testosterona total estavam associados ao aumento
da mortalidade. Em contraste, Guder e cols.10 observaram
que baixos níveis de testosterona não constituíram um fator
de risco independente para a diminuição da sobrevivência
de seus pacientes com IC. Esses resultados díspares podem
ser explicados pelas diferenças nas populações com IC
estudadas. Em contraste com os pacientes com IC incluídos
Santos e cols.
Deficiência de testosterona na insuficiência cardíaca
Artigo Original
Tabela 3 – Modelos de uma única variável preditora da análise de risco proporcional de Cox para a reinternação no prazo de 90 dias e
mortalidade. Grupo com baixos níveis de testosterona (n = 60) e grupo com níveis normais de testosterona (n = 42)
Reinternação dentro de 90 dias
Testosterona total, ng/dL
Razão de risco
IC 95%
Valor de p
2,77
1,58-4,85
0,02
Mortalidade
Razão de risco
IC 95%
Valor de p
Sódio, mEq/L
0,89
0,81-0,97
0,01
Testosterona total, ng/dL
4,65
2,67-8,10
0,009
Reinternação - 90 dias
3,27
1,23-8,69
0,02
Note-se que 6 pacientes do grupo de baixos níveis de testosterona e dois pacientes do grupo de testosterona normal foram a óbito e foram excluídos da análise
subsequente. IC: intervalo de confiança.
Figura 2 – Reinternações de Kaplan-Meier em pacientes com IC, no período de um ano de acompanhamento. Note-se que o grupo BT mostrou reinternações cumulativas
mais elevadas em relação ao grupo NT no período de um ano (p = 0,001). Note-se que o acompanhamento de um ano teve início com a alta hospitalar (tempo zero).
por Jankowska e cols.9, a população estudada por Guder e
cols.10 incluiu uma grande proporção (~50%) de pacientes
com IC com fração de ejeção preservada. Além disso,
esses autores especularam que as diferenças entre seus
resultados e os de Jankowska e cols.9 seriam atribuíveis
à inclusão de variáveis prognósticas adicionais, como o
uso de medicamentos, marcadores inflamatórios e outros.
É importante ressaltar que, no presente estudo, apesar da
inclusão das variáveis adicionais incluídas por Guder e cols.10
e de várias outras, baixo nível de testosterona permaneceu
ainda um preditor independente de aumento de mortalidade
em pacientes com IC avançada com disfunção sistólica.
Em nosso estudo, observamos que a testosterona total, mas
não a testosterona livre, estava associada a um pior prognóstico.
A testosterona total consiste no somatório da testosterona livre
com a testosterona ligada a SHBG e albumina; a testosterona
livre é a fração ativa. Em uma meta-análise, diminuição da
testosterona total foi associada a aumentos de 35 e 25% do risco
de mortalidade por todas as causas e por doença cardiovascular,
respectivamente, em pacientes do sexo masculino25. Um estudo
interessante com pacientes com IC mostrou que a deficiência de
SHBG estava associada a um maior risco de morte cardíaca26.
Em contraste, sabe‑se que níveis elevados de SHBG levam
a uma menor biodisponibilidade de testosterona livre e são
associados à mortalidade em pacientes do sexo masculino27.
Embora, em nosso estudo, tenha havido uma diferença
significativa nos níveis de SHBG entre o grupo com baixos níveis
de testosterona e o grupo com níveis normais de testosterona
(60 ± 3 vs. 73 ± 5 p = 0,037, respectivamente), o resultado
permaneceu dentro da faixa considerada de normalidade
Arq Bras Cardiol. 2015; 105(3):256-264
261
Santos e cols.
Deficiência de testosterona na insuficiência cardíaca
Artigo Original
Figura 3 – Sobrevivência de Kaplan-Meier em pacientes com IC, no período de um ano de acompanhamento. Note-se que o grupo BT mostrou maior taxa de
mortalidade em relação ao grupo TN no período de um ano (p = 0,001). Note-se que o acompanhamento de um ano teve início com a alta hospitalar (tempo zero).
em nosso laboratório (20,6‑76,7 nmol/L). Os níveis de SHBG
podem ser alterados por medicamentos não cardíacos, dieta e
doenças específicas, mas a importância relativa desses fatores
não era conhecida para nossos pacientes.
Embora a deficiência androgênica tenha sido associada
ao aumento da morbidade, especialmente à diminuição
da capacidade de exercício, nosso estudo é o primeiro a
examinar a associação entre baixos níveis de testosterona
e reinternações hospitalares, um resultado criticamente
importante nessa era de aumento dos custos médicos.
Pacientes com IC com baixos níveis de testosterona
apresentavam fração de ejeção, classe funcional de NYHA,
etiologia da IC e tratamento medicamentoso semelhantes às
dos pacientes com IC com níveis normais de testosterona.
Curiosamente, baixos níveis de testosterona estavam
acompanhados de vários marcadores de aumento da
gravidade da IC, incluindo BNP e CRP mais elevados,
disfunção renal mais grave e anemia, mas a deficiência de
testosterona ainda permaneceu um preditor independente
da reinternação no prazo de 90 dias após a alta hospitalar.
Não se sabe se a deficiência de testosterona é apenas um
forte marcador de mau prognóstico na IC ou se os baixos
níveis de testosterona contribuem diretamente para o aumento
da morbidade e mortalidade. A deficiência de testosterona
está associada a vários sinais e sintomas, muitos dos quais
indistinguíveis do processo normal de envelhecimento,
incluindo diminuição da libido, aumento da gordura corporal,
osteoporose, anemia leve, depressão e fadiga28. A manifestação
mais facilmente reconhecível da deficiência de testosterona é
uma diminuição da força e da massa muscular, associada a
uma diminição da capacidade de exercício28. A testosterona
exógena é conhecida por melhorar a capacidade de exercício
na saúde e na doença29,30. Em 5 pequenos ensaios controlados
de tratamento com testosterona em pacientes com IC, incluindo
262
Arq Bras Cardiol. 2015; 105(3):256-264
pacientes com baixos níveis de testosterona, alguns com
testosterona normais, e até mesmo um ensaio com mulheres
com IC, os níveis basais de testosterona estavam diretamente
relacionados à capacidade de exercício. Além disso, a terapia
de testosterona por até três meses, em comparação com
placebo, foi associada ao aumento da capacidade de exercício
em todos estudos8,11-14. Como as internações por IC são
frequentemente devidasao aumento da fadiga e da dispneia, e
como o mecanismo subjacente a esses sintomas é variável31-33,
e inclui também fraqueza muscular progressiva, é possível
especular que a deficiência de testosterona seja um importante
contribuinte para a diminuição muscular periférica contínua e,
portanto, um contribuinte direto para o risco de reinternação.
Um estudo controlado de terapia de testosterona em pacientes
com IC avançada esclareceria esta questão.
De acordo com a hipótese muscular, a limitação ao
exercício na IC reside na periferia, especificamente, nos
músculos esqueléticos15,16,34,35. Além disso, anormalidades dos
músculos esqueléticos na IC podem contribuir para a ativação
neuro‑humoral anormal na IC, incluindo aumentos exagerados
na atividade do nervo simpático35-38. Em um estudo com ratos
machos com IC, a castração foi associada a alterações na
atividade nervosa simpática cardíaca e a aumento dos níveis de
noradrenalina plasmática39. Essa simpato-excitação foi revertida
pela terapia de testosterona, como observado pela diminuição
da noradrenalina plasmática, aumento da noradrenalina do
miocárdio e densidade de fibras nervosas marcadas por proteína
tirosina-hidroxilase (TH), bem como por uma expressão regulada
positivamente de proteína TH do miocárdio. Em um estudo
recente de pacientes com IC leve, Rydlewska e cols.17 observaram
que a deficiência de testosterona estava diretamente relacionada
à menor sensibilidade dos barorreceptores e variabilidade da
frequência cardíaca. Da mesma forma, a castração em ratos
causou atenuação significativa do controle de barorreceptores
Santos e cols.
Deficiência de testosterona na insuficiência cardíaca
Artigo Original
da bradicardia reflexa em comparação com nenhum efeito
na taquicardia reflexa. A reposição de testosterona aumentou
a sensibilidade do barorreflexo e restaurou as respostas de
bradicardia reflexa40. Em nosso estudo, a ANSM de repouso foi
maior em pacientes com baixos níveis de testosterona. É intrigante
especular que a testosterona pode ter um efeito modulador
sobre a ativação simpática na IC, que pode ser mediada pela
melhora dos reflexos anormais que se originaram em músculos
periféricos e/ou, eventualmente, por meio de um efeito sobre
os próprios barorreceptores.
Limitações
Os níveis de andrógenos só foram dosados em um
momento durante a internação inicial por IC descompensada.
Não se sabe se os níveis de andrógenos flutuam em função do
estado clínico do indivíduo com IC. Todos os pacientes com
IC estavam descompensados no momento em que os níveis
de testosterona foram dosados. Não se sabe se a testosterona
fornece informações de prognóstico similarmente importantes
em pacientes com IC de menor gravidade.
O registro de ANSM em 25% dos pacientes durante a
internação foi feito após a establização dos pacientes, uma
vez que a realização do procedimento não seria possível
durante a descompensação aguda. Os níveis de ANSM são
representativos apenas de um pequeno subgrupo de pacientes
e os resultados precisam ser confirmados em um grupo maior.
Não obtivemos dados sobre o exercício desses pacientes;
sabe-se que o pico de VO 2 fornece informações de
prognóstico importantes na IC avançada. Por outro lado,
todos os pacientes estavam descompensados no momento
do estudo para realizarem o teste cardiopulmonar o Teste
cardiopulmonar (TECP), um sinal prognóstico uniformemente
ruim. É importante ressaltar que, dentro desse grupo de
pacientes com IC, cuja condição clínica não permitia a
obtenção de dados sobre exercícios, os níveis de testosterona
foram capazes de fornecer informações prognósticas
importantes. A incidência de apneia do sono, que é outro
fator de risco importante, não foi avaliada nesse grupo de
pacientes; esse fator deve ser avaliado no futuro.
Finalmente, o presente estudo foi realizado em uma única
instituição (Instituto do Coração da Universidade de São
Paulo, Brasil) e incluiu apenas pacientes do sexo masculino.
Conclusões
Os resultados do presente estudo apoiam o conceito de
que baixos níveis de testosterona constituem um fator de
risco independente para reinternação hospitalar no prazo de
90 dias e para aumento de mortalidade em pacientes com
IC. Além disso, observou-se um possível efeito modulador
sobre a ativação simpática da IC associada com baixos níveis
de testosterona.
Financiamento e Agradecimentos
Este estudo foi apoiado pela Fundação de Amparo à Pesquisa
do Estado de São Paulo (FAPESP nº 2010/50048‑1). MRS e RVRG
receberam apoio da Coordenação de Aperfeiçoamento de
Pessoal de Nível Superior (CAPES). ALCS e CEN receberam apoio
do Conselho Nacional de Pesquisa (CNPq nº 141856/2012-2
e nº 301867/2010-0, respectivamente). Todas as fundações
pertencem ao estado de São Paulo-SP, Brasil. Os autores
sinceramente agradecem ao Laboratório de hormônios e genética
molecular (Endocrinologia - Hospital das Clínicas, Universidade
de São Paulo) pela realização das dosagens de testosterona.
Não há relações com o setor indústrial.
Contribuição dos autores
Concepção e desenho da pesquisa: Santos MR, Fonseca G,
Middlekauff HR, Alves MJNN. Obtenção de dados: Santos MR,
Sayegh ALC, Groehs RVR, Fonseca G, Trombetta IC, Barreto
ACP, Arap MA, Alves MJNN. Análise e interpretação dos dados:
Santos MR, Sayegh ALC, Groehs RVR, Fonseca G, Trombetta IC,
Middlekauff HR, Alves MJNN. Análise estatística: Santos MR,
Sayegh ALC, Fonseca G, Middlekauff HR, Alves MJNN. Obtenção
de financiamento: Santos MR, Negrão CE, Alves MJNN. Redação
do manuscrito: Santos MR, Sayegh ALC, Trombetta IC, Barreto
ACP, Arap MA, Negrão CE, Middlekauff HR, Alves MJNN.
Revisão crítica do manuscrito quanto ao conteúdo intelectual
importante:Santos MR, Groehs RVR, Trombetta IC, Barreto ACP,
Arap MA, Middlekauff HR, Alves MJNN.
Potencial Conflito de Interesse
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo foi financiado por FAPESP (2010/50048‑1)
e Capes.
Vinculação Acadêmica
Este artigo é parte de tese de Doutorado de Marcelo
Rodrigues dos Santos pela Faculdade de Medicina da
Universidade de São Paulo.
Referências
1. Rohde LE, Clausell N, Ribeiro JP, Goldraich L, Netto R, William Dec G,
et al. Health outcomes in decompensated congestive heart failure: a
comparison of tertiary hospitals in Brazil and United States. Int J Cardiol.
2005;102(1):71-7.
2.
Butler J, Fonarow GC, Gheorghiade M. Strategies and opportunities for drug
development in heart failure. JAMA. 2013;309(15):1593-4.
3. Ghe orghiade M, Vaduganathan M, Fonarow GC, Bo n o w R O.
Rehospitalization for heart failure: problems and perspectives. J Am Coll
Cardiol. 2013;61(4):391-403.
4.
Stevenson LW, Hellkamp AS, Leier CV, Sopko G, Koelling T, Warnica JW, et
al. Changing preferences for survival after hospitalization with advanced
heart failure. J Am Coll Cardiol. 2008;52(21):1702-8.
Arq Bras Cardiol. 2015; 105(3):256-264
263
Santos e cols.
Deficiência de testosterona na insuficiência cardíaca
Artigo Original
5. Dracup K, Walden JA, Stevenson LW, Brecht ML. Quality of life in patients
with advanced heart failure. J Heart Lung Transplant. 1992;11(2 Pt 1):273-9.
6.
7.
8.
Agapitou V, Dimopoulos S, Kapelios C, Karatzanos E, Manetos C, Georgantas
A, et al. Hormonal imbalance in relation to exercise intolerance and
ventilatory inefficiency in chronic heart failure. J Heart Lung Transplant.
2013;32(4):431-6.
Jankowska EA, Filippatos G, Ponikowska B, Borodulin-Nadzieja L, Anker SD,
Banasiak W, et al. Reduction in circulating testosterone relates to exercise
capacity in men with chronic heart failure. J Card Fail. 2009;15(5):442-50.
Malkin CJ, Pugh PJ, West JN, van Beek EJ, Jones TH, Channer KS. Testosterone
therapy in men with moderate severity heart failure: a double-blind
randomized placebo controlled trial. Eur Heart J. 2006;27(1):57-64.
9. Jankowska EA, Biel B, Majda J, Szklarska A, Lopuszanska M, Medras M, et
al. Anabolic deficiency in men with chronic heart failure: prevalence and
detrimental impact on survival. Circulation. 2006;114(17):1829-37.
10. Guder G, Frantz S, Bauersachs J, Allolio B, Ertl G, Angermann CE, et
al. Low circulating androgens and mortality risk in heart failure. Heart.
2010;96(7):504-9.
11. Caminiti G, Volterrani M, Iellamo F, Marazzi G, Massaro R, Miceli
M, et al. Effect of long-acting testosterone treatment on functional
exercise capacity, skeletal muscle performance, insulin resistance, and
baroreflex sensitivity in elderly patients with chronic heart failure a
double-blind, placebo-controlled, randomized study. J Am Coll Cardiol.
2009;54(10):919-27.
12. Iellamo F, Volterrani M, Caminiti G, Karam R, Massaro R, Fini M, et
al. Testosterone therapy in women with chronic heart failure: a pilot
double-blind, randomized, placebo-controlled study. J Am Coll Cardiol.
2010;56(16):1310-6.
13. Pugh PJ, Jones RD, West JN, Jones TH, Channer KS. Testosterone treatment
for men with chronic heart failure. Heart. 2004;90(4):446-7.
14. Stout M, Tew GA, Doll H, Zwierska I, Woodroofe N, Channer KS, et al.
Testosterone therapy during exercise rehabilitation in male patients with
chronic heart failure who have low testosterone status: a double-blind
randomized controlled feasibility study. Am Heart J. 2012;164(6):893-901.
15. Coats AJ, Clark AL, Piepoli M, Volterrani M, Poole-Wilson PA. Symptoms and
quality of life in heart failure: the muscle hypothesis. Br Heart J. 1994;72(2
Suppl):S36-9.
16. Middlekauff HR. Making the case for skeletal myopathy as the
major limitation of exercise capacity in heart failure. Circ Heart Fail.
2010;3(4):537-46.
17. Rydlewska A, Maj J, Katkowski B, Biel B, Ponikowska B, Banasiak W, et al.
Circulating testosterone and estradiol, autonomic balance and baroreflex
sensitivity in middle-aged and elderly men with heart failure. Aging Male.
2013;16(2):58-66.
18. Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of simple
methods for the estimation of free testosterone in serum. J Clin Endocrinol
Metab. 1999;84(10):3666-72.
19. Huhtaniemi IT, Tajar A, Lee DM, O’Neill TW, Finn JD, Bartfai G, et
al; EMAS Group. Comparison of serum testosterone and estradiol
measurements in 3174 European men using platform immunoassay
and mass spectrometry; relevance for the diagnostics in aging men. Eur J
Endocrinol. 2012;166(6):983-91.
20. Wang C, Catlin DH, Demers LM, Starcevic B, Swerdloff RS. Measurement
of total serum testosterone in adult men: comparison of current laboratory
methods versus liquid chromatography-tandem mass spectrometry. J Clin
Endocrinol Metab. 2004;89(2):534-43.
21. Fagius J, Wallin BG. Long-term variability and reproducibility of resting
human muscle nerve sympathetic activity at rest, as reassessed after a
decade. Clin Auton Res. 1993;3(3):201-5.
264
Arq Bras Cardiol. 2015; 105(3):256-264
22. Schiller NB, Shah PM, Crawford M, DeMaria A, Devereux R, Feigenbaum
H, et al. Recommendations for quantitation of the left ventricle by twodimensional echocardiography. American Society of Echocardiography
Committee on Standards, Subcommittee on Quantitation of TwoDimensional Echocardiograms. J Am Soc Echocardiogr. 1989;2(5):358-67.
23. Tirabassi G, Gioia A, Giovannini L, Boscaro M, Corona G, Carpi A, et al.
Testosterone and cardiovascular risk. Intern Emerg Med. 2013;8 Suppl 1:S65-9.
24. Barretto AC, Santos AC, Munhoz R, Rondon MU, Franco FG, Trombetta IC,
et al. Increased muscle sympathetic nerve activity predicts mortality in heart
failure patients. Int J Cardiol. 2009;135(3):302-7.
25. Araujo AB, Dixon JM, Suarez EA, Murad MH, Guey LT, Wittert GA. Clinical
review: Endogenous testosterone and mortality in men: a systematic review
and meta-analysis. J Clin Endocrinol Metab. 2011;96(10):3007-19.
26. Pascual-Figal DA, Tornel PL, Nicolas F, Sanchez-Mas J, Martinez MD,
Gracia MR, et al. Sex hormone-binding globulin: a new marker of disease
severity and prognosis in men with chronic heart failure. Rev Esp Cardiol.
2009;62(12):1381-7.
27. Wehr E, Pilz S, Boehm BO, Marz W, Grammer TB, Obermayer-Pietsch B.
Sex steroids and mortality in men referred for coronary angiography. Clin
Endocrinol (Oxf). 2010;73(5):613-21.
28. Bassil N, Alkaade S, Morley JE. The benefits and risks of testosterone
replacement therapy: a review. Ther Clin Risk Manag. 2009;5(3):427-48.
29. Harman SM, Blackman MR. The effects of growth hormone and sex steroid on
lean body mass, fat mass, muscle strength, cardiovascular endurance and adverse
events in healthy elderly women and men. Horm Res. 2003;60(Suppl 1):121-4.
30. Urban RJ, Bodenburg YH, Gilkison C, Foxworth J, Coggan AR, Wolfe RR,
et al. Testosterone administration to elderly men increases skeletal muscle
strength and protein synthesis. Am J Physiol. 1995;269(5 Pt 1):E820-6.
31. Mancini DM, Henson D, LaManca J, Levine S. Respiratory muscle function
and dyspnea in patients with chronic congestive heart failure. Circulation.
1992;86(3):909-18.
32. Mancini DM, Walter G, Reichek N, Lenkinski R, McCully KK, Mullen JL, et al.
Contribution of skeletal muscle atrophy to exercise intolerance and altered
muscle metabolism in heart failure. Circulation. 1992;85(4):1364-73.
33. Witte KK, Clark AL. Why does chronic heart failure cause breathlessness and
fatigue? Prog Cardiovasc Dis. 2007;49(5):366-84.
34. Coats AJ. Origin of symptoms in patients with cachexia with special reference
to weakness and shortness of breath. Int J Cardiol. 2002;85(1):133-9.
35. Piepoli M, Ponikowski P, Clark AL, Banasiak W, Capucci A, Coats AJ. A neural
link to explain the “muscle hypothesis” of exercise intolerance in chronic
heart failure. Am Heart J. 1999;137(6):1050-6.
36. Middlekauff HR, Chiu J, Hamilton MA, Fonarow GC, Maclellan WR, Hage
A, et al. Muscle mechanoreceptor sensitivity in heart failure. Am J Physiol
Heart Circ Physiol. 2004;287(5):H1937-43.
37. Middlekauff HR, Chiu J, Hamilton MA, Fonarow GC, Maclellan WR, Hage
A, et al. Cyclooxygenase products sensitize muscle mechanoreceptors
in humans with heart failure. Am J Physiol Heart Circ Physiol.
2008;294(4):H1956-62.
38. Middlekauff HR, Sinoway LI. Increased mechanoreceptor stimulation
explains the exaggerated exercise pressor reflex seen in heart failure. J Appl
Physiol (1985). 2007;102(1):492-4.
39. Han Y, Fu L, Sun W, Cao J, Xie R, Zhou P, et al. Neuroprotective effects of
testosterone upon cardiac sympathetic function in rats with induced heart
failure. Eur J Pharmacol. 2009;619(1-3):68-74.
40. El-Mas MM, Afify EA, Mohy El-Din MM, Omar AG, Sharabi FM. Testosterone
facilitates the baroreceptor control of reflex bradycardia: role of cardiac
sympathetic and parasympathetic components. J Cardiovasc Pharmacol.
2001;38(5):754-63.
Voltar ao Índice da Capa
Artigo Original
Pregão: Estratégia para Redução do Custo da Terapia Farmacológica
em Insuficiência Cardíaca e Transplante Cardíaco
Reverse Auction: A Potential Strategy for Reduction of Pharmacological Therapy Cost
Sara Michelly Gonçalves Brandão, Victor Sarli Issa, Silvia Moreira Ayub-Ferreira, Samantha Storer, Bianca Gigliotti
Gonçalves, Valter Garcia Santos, Nelson Carvas Junior, Guilherme Veiga Guimarães, Edimar Alcides Bocchi
Instituto do Coração do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, SP - Brasil
Resumo
Fundamento: A polifarmácia tem um significativo peso econômico.
Objetivo: Testar se o uso de pregão em comparação ao de farmácias comerciais (FC) para a compra de medicamentos
reduz o custo do tratamento de pacientes ambulatoriais de insuficiência cardíaca (IC) e transplante cardíaco (TC).
Métodos: Comparação dos custos do tratamento através de pregão versus FC em pacientes de IC (808) e TC (147)
acompanhados de 2009 a 2011, avaliando-se a influência de variáveis clínicas e demográficas no custo.
Resultados: Os custos mensais por paciente para medicamentos de IC adquiridos através de pregão e através de FC
foram $10,15 (IQ 3,51-40,22) e $161,76 (IQ 86,05-340,15), respectivamente. Para TC, aqueles custos foram $393,08 (IQ
124,74-774,76) e $1.207,70 (IQ 604,48-2.499,97), respectivamente.
Conclusões: O pregão pode reduzir o custo dos medicamentos prescritos para IC e TC, podendo tornar o tratamento
de IC mais acessível. As características clínicas podem influenciar o custo e os benefícios do pregão, que pode ser uma
nova estratégia de política de saúde para baixar os custos dos medicamentos prescritos para IC e TC, diminuindo o peso
econômico do tratamento. (Arq Bras Cardiol. 2015; 105(3):265-275)
Palavras-chave: Insuficiência Cardíaca; Preparações Farmacêuticas / economia; Proposta de Concorrência / economia;
Orçamentos; Redução de Custos; Transplante de Coração.
Abstract
Background: Polypharmacy is a significant economic burden.
Objective: We tested whether using reverse auction (RA) as compared with commercial pharmacy (CP) to purchase medicine results in lower
pharmaceutical costs for heart failure (HF) and heart transplantation (HT) outpatients.
Methods: We compared the costs via RA versus CP in 808 HF and 147 HT patients followed from 2009 through 2011, and evaluated the
influence of clinical and demographic variables on cost.
Results: The monthly cost per patient for HF drugs acquired via RA was $10.15 (IQ 3.51-40.22) versus $161.76 (IQ 86.05-340.15) via CP; for
HT, those costs were $393.08 (IQ 124.74-774.76) and $1,207.70 (IQ 604.48-2,499.97), respectively.
Conclusions: RA may reduce the cost of prescription drugs for HF and HT, potentially making HF treatment more accessible. Clinical characteristics
can influence the cost and benefits of RA. RA may be a new health policy strategy to reduce costs of prescribed medications for HF and HT patients,
reducing the economic burden of treatment.(Arq Bras Cardiol. 2015; 105(3):265-275)
Keywords: Heart Failure; Pharmaceutical Preparations / economics; Competitive Bidding / economics; Budgets; Cost Savings; Heart
Transplantation.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Sara Michelly Gonçalves Brandão •
Av. Brigadeiro Luís Antônio, 1195 Ap 22, Bela Vista. CEP 01317001, São Paulo, SP – Brasil.
E-mail: [email protected]
Artigo recebido em 23/01/2015; revisado em 04/03/2015; aceito em 06/04/2015.
DOI: 10.5935/abc.20150076
265
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
Introdução
O número estimado de pacientes com insuficiência cardíaca
(IC) nos Estados Unidos da América (EUA) é de 5,1 milhões1 e,
no Brasil, 6,4 milhões2. A IC foi a causa única mais frequente de
hospitalização na população idosa no Brasil2. A observância das
diretrizes de terapia farmacológica para IC reduz a progressão
da doença, sua morbimortalidade e hospitalização3,4. Os gastos
públicos e privados com medicamentos são responsáveis por
uma substancial fração do total de despesas com cuidados
de saúde nos países desenvolvidos e em desenvolvimento5.
Nos EUA, estima-se para 2015 um custo de $32,4 bilhões para
a IC, uma doença cardiovascular6. Cerca de 3% do custo total
com IC deu-se com medicamentos, somando aproximadamente
$1,11 bilhão em 20097. É de surpreender que, a despeito do
impacto nos gastos com IC, poucos estudos tenham examinado
seus custos farmacológicos e a influência de características
demográficas e clínicas8-12. Além disso, esse limitado número de
estudos não reflete a prática contemporânea. Nenhum estudo
prévio examinou a influência de procedimentos adicionais, como
o transplante cardíaco (TC).
Os recursos em saúde são escassos, ainda que as
necessidades na área sejam ilimitadas. É importante ressaltar
que estratégias para a redução do custo do tratamento
farmacológico na IC não foram testadas, a despeito do impacto
tanto do custo dos medicamentos nos orçamentos do governo
quanto da não observância do uso dos medicamentos.
Estudos concernentes a tratamentos farmacológicos e seus
custos podem fornecer uma base lógica para que políticas
governamentais planejem fontes de financiamento, sendo
essenciais para a farmacoeconomia em saúde pública.
Portanto, este estudo teve por objetivo comparar os custos
do tratamento farmacológico para IC e TC através de pregões
com aqueles estimados nas farmácias comerciais (FC).
Métodos
População do estudo
Foram obtidos retrospectivamente os dados clínicos,
demográficos e de tratamento farmacológico de todos os
pacientes com diagnóstico de IC ou dos receptores de TC
consecutivamente atendidos no Ambulatório de Insuficiência
Cardíaca do Instituto do Coração no Brasil. Os dados
demográficos incluíram etnia descrita em estudo anterior13,
idade, sexo, comorbidade e causa de IC descritos em estudo
anterior13, fração de ejeção ventricular esquerda (FEVE), número
de consultas ambulatoriais, medicamentos e os estágios de
IC mais comuns durante o período estudado. Obteve‑se a
FEVE usando-se um dos seguintes métodos: ecocardiografia,
ventriculografia radioisotópica, ressonância magnética cardíaca
ou ventriculografia por cateterização cardíaca. Considerou‑se a
primeira FEVE de cada paciente no período estudado.
Os pacientes foram atendidos por médicos e uma equipe
multidisciplinar especializada em IC e TC de janeiro de 2009 a
abril de 2011. Incluíram-se os pacientes com mais de 16 anos
e em acompanhamento ambulatorial, exceto um de TC com
9 anos. Excluíram-se os pacientes com informação incompleta
clínica ou de custo e que tenham recebido a prescrição de
qualquer medicamento durante hospitalização.
266
Arq Bras Cardiol. 2015; 105(3):265-275
Delineamento do estudo
Os dados concernentes às consultas ambulatoriais foram
armazenados em registros eletrônicos, de modo a gerar
automaticamente uma prescrição médica eletrônica a partir
da entrada dos dados. Os medicamentos foram dispensados
mensalmente aos pacientes de acordo com a última prescrição
médica validada. Obtivemos informação a respeito de todos
os medicamentos que cada paciente recebeu, tendo os
investigadores revisado tal informação para garantir consistência.
Na nossa instituição, que é pública, os medicamentos são
comprados através de pregões. Trata-se de mecanismo através
do qual, uma vez consolidada a demanda das entidades
participantes e estabelecidas as características técnicas dos
produtos a serem comprados, aqueles com o melhor preço são
selecionados através de lances eletrônicos pelo menor valor.
Isso garante uma competição justa e transparente, e ainda os
menores preços de mercado, especialmente nos países da
América Latina, como o Brasil. As compras são financiadas
por um orçamento anual destinado a cada instituição pública
através de fundos públicos de saúde. Nos pregões para
aquisição de medicamentos, os fornecedores propõem um
contrato bastante detalhado de suprimento, especificando o
medicamento, sua quantidade e local e programa de entrega14.
O contrato de aquisição especifica detalhadamente o
medicamento a ser fornecido, que é uma combinação única
de princípio ativo, forma, concentração, número de unidades
e embalagem. As instituições públicas são proibidas de adquirir
um medicamento de uma marca específica. São obrigadas
a adquiri-lo do fornecedor de menor preço, podendo, em
princípio, ser genérico ou de marca14.
Os medicamentos são dispensados gratuitamente para os
pacientes tratados em hospital público conforme a prescrição.
Comparamos o tratamento farmacológico da IC e do TC
comprado através de pregão com os custos estimados no
mercado privado de FC. O preço de FC foi definido usando-se
o Guia Farmacêutico Brasíndice, um índice federal oficial que
regula o mercado de medicamentosno Brasil (custo privado):
o governo brasileiro estabelece o preço de varejo máximo
praticado pelas farmácias. O custo de cada comprimido foi
baseado na última compra institucional em 2011 para evitar
diferenças de preço entre períodos de tempo. O valor de
custo foi convertido em dólares americanos de acordo com
a cotação de 12 de abril de 2013 a uma taxa de câmbio de
$0,50815 para estabelecer os valores em uma moeda estável.
Calculou-se o custo mensal por paciente.
Os medicamentos incluídos foram betabloqueadores,
diuréticos, bloqueadores dos canais de cálcio (BCC), inibidores
da enzima de conversão da angiotensina (IECA), bloqueadores
do receptor de angiotensina (BRA), outros medicamentos
cardiovasculares (OMC), hipolipemiantes, antiagregantes
plaquetários, antiarrítmicos, nitratos, anticoagulantes
(ACG) ou inibidores do receptor adenosina difosfato
plaquetário (IPADPR), digitálicos, imunossupressores e
outros medicamentos não cardiovasculares (OMNC).
Os medicamentos tipicamente usados para tratamentos curtos,
como antibióticos, ou aqueles de uso conforme necessidade
para alívio de sintomas, como analgésicos ou nitroglicerina
sublingual, também foram incluídos.
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
Analisamos ainda os custos conforme as variáveis
clínicas e demográficas. O protocolo de estudo foi
aprovado pelo Comitê de Ética do Instituto do Coração
de São Paulo (registro 22831813.2.0000.0068), tendo-se
dispensado o termo de consentimento, pois não houve
identificação da informação dos participantes.
Análise estatística
As medidas foram expressas como média ± desvio
padrão (DP) para as variáveis com distribuição normal, e
como mediana e intervalo interquartil (IQ) para aquelas
sem distribuição normal, ou ainda como frequências
em percentagens para todas as variáveis categóricas.
Realizou‑se análise univariada com o teste do qui‑quadrado
ou exato de Fisher para comparar as variáveis categóricas.
As contínuas com distribuição normal foram comparadas
usando-se o teste t de Student, e, para avaliar as diferenças
entre aquelas sem distribuição normal, usou-se o teste de
Kruskal-Wallis. A significância dos resultados do teste de
Kruskal-Wallis foi analisada usando-se o teste da diferença
mínima significativa (DMS) com múltiplas comparações
post hoc. Para determinar a correlação entre as variáveis
contínuas, aplicou-se o teste de correlação conforme a
distribuição de normalidade (r). A FEVE foi analisada em
coortes estratificadas em ≤ 40% e > 40%.
O custo mensal por paciente foi submetido a transformação
logarítmica. Realizou-se análise multivariada com equações
de estimação generalizada (GEE), sendo os resultados
expressos como coeficientes não padronizados (β). As GEE
foram aplicadas, usando-se as variáveis contínuas (idade,
FEVE e consulta ambulatorial) e a variável categórica ‘causa
de IC’ como efeitos fixos. Comorbidades, classe funcional,
etnia e sexo foram usados como efeitos randômicos.
A vantagem dessa abordagem foi ter utilizado todos os
dados disponíveis e resultados baseados em correlações
entre desfechos e variáveis preditivas. Usou‑se o teste do
qui-quadrado de Wald para escolher a melhor estrutura a
ser adotada no modelo em questão. Usou‑se ainda o teste
de quase-verossimilhança para comparar modelos ajustados.
O programa SPSS 17.0 foi utilizado para a análise
estatística. Os valores de p < 0,05 foram considerados
significativos, e aqueles < 0,10, uma tendência.
Resultados
Características basais (Tabela 1)
No grupo IC, o tempo médio de seguimento no estudo foi
de 16,7 ± 8,8 meses, com uma mediana de oito consultas
ambulatoriais por paciente, enquanto no grupo TC o tempo
médio de seguimento foi de 23,1 ± 5,8 meses, com uma
mediana de 16 consultas ambulatoriais por paciente.
O total de prescrições médicas analisadas no grupo IC foi
de 8.448, e, no grupo TC, 3.217. Informação completa de
custo não pôde ser obtida em 82 (10,1%) pacientes com IC,
e em 1 (0,7%) receptor de TC, tendo esses pacientes sido
excluídos. As consultas ambulatoriais foram mais frequentes
entre pacientes com classe funcional de IC III e IV do que
entre aqueles com classe funcional I e II. Os pacientes com
classe funcional III e IV apresentaram as seguintes causas
de IC: chagásica, 26,8%; isquêmica, 34,1%; e outras, 39%.
Para aqueles com classe funcional I e II, as proporções
foram 12,9%, 29,6% e 57,5%, respectivamente (p = 0,003).
Medicamentos prescritos para IC
Os medicamentos mais frequentemente prescritos
em ordem decrescente foram betabloqueadores,
diuréticos, OMNC, hipolipemiantes, IECA-BRA (Tabela 1).
Observou‑se uma diferença quanto aos medicamentos
prescritos para pacientes com FEVE ≤ 40% e para
aqueles com FEVE > 40%. Betabloqueadores, diuréticos,
antiagregantes plaquetários, antiarrítmicos e nitratos foram
mais frequentemente prescritos para pacientes com IC e
FEVE ≤ 40%, enquanto BCC foram mais frequentemente
prescritos para pacientes com IC e FEVE > 40% (Tabela 2).
Betabloqueadores (75,9%, p = 0,009), diuréticos
(75,9%, p = 0,009), IECA-BRA (76,6%, p = 0,034),
nitrato (61,9%, p = 0,001) e OMC (68,8%, p = 0,036)
foram mais frequentemente prescritos para pacientes
com classe funcional de IC I e II. Pacientes de etnia
branca e amarela receberam mais frequentemente OMC
(74,1%, p = 0,015) e antiagregantes plaquetários (82,2%,
p = 0,018). Os BCC (60.3%, p < 0.001) e hipolipemiantes
(47%, p < 0,001) foram mais frequentemente prescritos
para outras causas, enquanto antiagregantes plaquetários
(53,3%, p < 0,001) e nitratos (43%, p < 0,001) foram mais
frequentemente prescritos para pacientes isquêmicos, e
antiarrítmicos (41%, p < 0,001) para pacientes chagásicos.
Os IECA‑BRA (33,3%, p = 0,001), OMC (42,1%,
p = 0,013), antiagregantes plaquetários (31,4%,
p = 0,003) e OMNC (40,2%, p = 0,001) foram prescritos
com menos frequência para mulheres.
No grupo IC, os homens consumiram doses mais
baixas de atenolol, captopril, losartana, espironolactona
e isossorbida, e mais altas de carvedilol e hidralazina,
mas doses iguais de enalapril, embora as doses dos
medicamentos de uso diária não tenham apresentado
diferença estatisticamente significativa entre os sexos.
Com relação à classe funcional, as medianas das doses de
enalapril para as classes funcionais III e IV e ainda para I
e II foram 30,28 mg/dia (IQ 14,12‑35,79) e 33,85 mg/dia
(IQ 22,00-38,67), respectivamente (p = 0,014).
As medianas das doses de captopril foram 39,58 mg/dia
(IQ 13,54‑107,29) e 77,52 mg/dia (IQ 43,23‑146,42),
respectivamente (p = 0,059). Com relação à etnia,
negros e pardos usaram mais enalapril (35,42 mg/dia,
IQ 23,61‑39,27) do que brancos e amarelos (32,93 mg/dia,
IQ 18,33-37,78) (p = 0,039). Com relação à idade, pacientes
com IC entre 41 e 65 anos receberam com mais frequência
enalapril (34,29 mg/dia, IQ 20,21‑38,65, p = 0,019)
e espironolactona (25,93 mg/dia, IQ 24,24‑30,56,
p = 0,049), e tenderam a maiores doses de carvedilol
(48,08 mg/dia, IQ 35,04-62,50, p = 0,076) e captopril
(93,05 mg/dia, IQ 66,67-145,4, p = 0,087). Com relação
à causa, menores doses de carvedilol (42,11 mg/dia,
IQ 25,00-50,00, p < 0,001) e de enalapril (23,33 mg/dia,
IQ 14,44-32,22, p < 0,001) foram administradas a
pacientes chagásicos em comparação a isquêmicos e com
Arq Bras Cardiol. 2015; 105(3):265-275
267
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
Tabela 1 – Características basais da população do estudo
Características
IC n = 808
n (%)
TC n = 147
n (%)
Idade, anos
56,5 ± 12,2
49,9 ± 16,6
< 20
5 (0,6)
9 (6,1)
20 - 40
80 (9,9)
37 (25,2)
41 - 65
427 (52,8)
57 (11,8)
≥ 66
296 (36,6)
44 (29,9)
<5
250 (30,9)
16 (10,9)
6 - 10
302 (37,4)
17 (11,6)
11 - 15
127 (15,7)
42 (28,6)
Consulta ambulatorial
16 - 20
48 (5,9)
28 (19,0)
≥ 21
81 (10,0)
44 (29,9)
Branca e amarela
619 (78,3)
127 (86,4)
Negra e parda
172 (21,7)
20 (13,6)
Isquêmica
141 (30,7)
18 (12,9)
Outras
232 (50,5)
73 (52,5)
Chagásica
86 (18,7)
48 (34,5)
Masculino
508 (62,9)
101 (68,7)
Feminino
300 (37,1)
46 (31,3)
Hipertensão
157 (19,5)
40 (27,2)
Diabetes
150 (18,6)
30 (20,4)
Etnia
Causas
Sexo
Comorbidades
Acidente vascular cerebral
31 (3,9)
5 (3,4)
Insuficiência renal
56 (7,0)
18 (12,2)
DPOC
13 (1,6)
2 (1,4)
Revascularização miocárdica
20 (2,5)
0 (0,0)
Angioplastia coronariana
9 (1,1)
2 (1,4)
Infarto do miocárdio
56 (7,0)
4 (2,7)
Betabloqueador
703 (87,1)
40 (27,2)
Diurético
703 (87,1)
54 (36,7)
BCC
205 (25,4)
114 (77,6)
IECA, BRA
573 (71,0)
54 (36,7)
Hipolipemiante
595 (73,7)
117 (79,6)
Antiagregante plaquetário
354 (43,9)
30 (20,4)
ACG ou IPADPR
212 (26,3)
20 (13,6)
Antiarrítmicos
85 (10,5)
4 (2,7)
Digitálico
309 (38,3)
15 (10,2)
Nitrato
197 (24,4)
11 (7,5)
OMC
330 (40,9)
47 (32,0)
Medicamento cardiovascular prescrito
Medicamento não cardiovascular prescrito
Antibiótico
Imunossupressor
OMNC
42 (5,2)
68 (46,3)
0 (0)
147 (100)
630 (78,1)
147 (100)
IC: Insuficiência cardíaca; TC: Transplante cardíaco; DPOC: Doença pulmonar obstrutiva crônica; ACG: Anticoagulante; IPADPR: Inibidor do receptor ADP plaquetário;
OMNC: Outros medicamentos não cardiovasculares; betabloqueador (atenolol, bisoprolol, metoprolol, carvedilol, propranolol, sotalol); diurético (furosemida,
hidroclorotiazida, clortalidona, espironolactona); BCC: Bloqueador do canal de cálcio (diltiazem, verapamil, anlodipino, nifedipina, losartana); IECA: Inibidor da enzima
de conversão da angiotensina (captopril, enalapril, lisinopril); BRA: Bloqueador do receptor da angiotensina, hipolipemiante (atorvastatina, ciprofibrato, ezetimiba,
rosuvastatina, sinvastatina); antiagregante plaquetário (aspirina); ACG ou IPADPR (enoxaparina, varfarina, clopidogrel); antiarrítmicos (amiodarona, propafenona);
digitálico (digoxina); nitrato (isossorbida, propatilnitrato); OMC: Outros medicamentos cardiovasculares (clonidina, doxazosina, hidralazina, metildopa).
268
Arq Bras Cardiol. 2015; 105(3):265-275
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
Tabela 2 – Perfil do medicamento prescrito de acordo com a fração de ejeção ventricular esquerda (FEVE)
IC
Medicamento prescrito
FEVE ≤ 40% (n = 321)
n (%)
TC
FEVE > 40% (n = 134)
n (%)
p
FEVE ≤ 40% (n = 10)
n(%)
FEVE > 40% (n = 126)
n (%)
p
Betabloqueador
287 (89,4)
109(81,3)
0,020
5 (50,0)
32 (25,4)
0,13
Diurético
287(89,4)
109(81,3)
0,020
4(40,0)
48(38,1)
1,00
BCC
67(20,9)
43(32,1)
0,011
7(70,0)
102(81,0)
0,41
IECA, BRA
221(68,8)
90(67,2)
0,72
6(60,0)
46(36,5)
0,18
OCD
153(47,7)
55(41,0)
0,19
5(50,0)
41(32,5)
0,30
Hipolipemiante
241(75,1)
89(27,0)
0,059
7(70,0)
106(84,1)
0,37
Antiagregante plaquetário
154(48,0)
44(32,8)
0,003
3(30,0)
24(19,0)
0,41
ACG ou IPADPR
93(29,0)
39(29,1)
0,97
1(10,0)
19(15,1)
1,00
Antiarrítmicos
44(13,7)
9(6,7)
0,034
0(0,0)
3(100)
NP
Digitálico
127(39,6)
44(32,8)
0,17
0(0,0)
15(11,9)
NP
Nitrato
104(32,4)
24(17,9)
0,002
3(30,0)
7(5,6)
0,026
25(7,8)
7(5,2)
0,33
5(50,0)
62(49,2)
1,00
Antibiótico
HF: Insuficiência cardíaca; HT: Transplante cardíaco; NP: Não possível; ACG: Anticoagulante; IPADPR: Inibidor do receptor adenosina difosfato plaquetário;
betabloqueador (atenolol, bisoprolol, metoprolol, carvedilol, propranolol, sotalol); diurético (furosemida, hidroclorotiazida, clortalidona, espironolactona);
BCC: Bloqueador do canal de cálcio (diltiazem, verapamil, anlodipino, nifedipina, losartana); IECA: Inibidor da enzima de conversão da angiotensina (captopril,
enalapril, lisinopril); BRA: Bloqueador do receptor da angiotensina; OMC: outros medicamentos cardiovasculares (clonidina, doxazosina, hidralazina, metildopa);
hipolipemiante (atorvastatina, ciprofibrato, ezetimiba, rosuvastatina, sinvastatina); antiagregante plaquetário (aspirina); ACG ou IPADPR (enoxaparina, varfarina,
clopidogrel); antiarrítmicos (amiodarona, propafenona); digitálico (digoxina); nitrato (isossorbida, propatilnitrato).
cardiopatias por outras causas. Menores doses de losartana
(85,55 mg/dia, IQ 52,77-100,00, p = 0,021) foram
administradas a chagásicos e isquêmicos em comparação
àqueles com cardiopatia por outras causas. As correlações
entre consumo diário de carvedilol e FEVE foram fracas
(r = 0,125, p = 0,017).
No grupo TC, os medicamentos mais frequentemente
prescritos foram imunossupressores, OMNC, hipolipemiantes
e BCC (Tabela 1). Além disso, houve diferença quanto ao uso
de nitratos entre pacientes com FEVE ≤ 40% e aqueles com
FEVE > 40% (p = 0,026) (Tabela 2). Pacientes de etnia branca
e amarela receberam mais antibióticos (77,9%, p = 0,006).
No que se refere à causa, os medicamentos usados não
apresentaram diferenças estatisticamente significativas.
Com relação a sexo, os antibióticos foram mais frequentemente
usados por homens do que por mulheres (58,8%, p = 0,016).
A Figura 1 mostra a magnitude da redução de custo para
medicamentos comprados através do pregão.
Custo do tratamento farmacológico através de pregão
Em pacientes com IC, o custo total foi de $534.010,20
(n = 726), sendo a mediana do custo mensal por paciente
de $10,15 (IQ 3,51-40,22). As classes mais caras de
medicamentos em valores decrescentes usados para IC
foram OMNC, hipolipemiantes e OMC (Tabela 3).
Por outro lado, o custo total para receptores de TC foi
de $1.787.462,17 (n = 146), sendo a mediana do custo
mensal por paciente de $393,08 (IQ 124,74-774,76).
As classes mais caras de medicamentos nesse grupo foram
imunossupressores e OMNC (Tabela 3).
Custo do tratamento farmacológico no mercado privado
Em pacientes com IC, o custo total estimado foi de
$3.991.176,38 (n = 726), sendo a mediana do custo mensal
por paciente de $161,76 (IQ 86,05-340,15). As classes
mais caras de medicamentos em ordem decrescente de
valor para IC foram OMNC e betabloqueadores (Tabela 3).
O custo total para receptores de TC foi de $5.725.965,20
(n = 146), sendo a mediana do custo mensal por paciente
de $1.207,70 (IQ 604,48-2.499,97). As classes mais caras
de medicamentos pata TC foram imunossupressores e
OMNC (Tabela 3).
Custo do tratamento farmacológico através de pregão de
acordo com análises de subgrupo
A mediana do custo mensal por paciente com IC
foi $9,74 (IQ 3,48-33,65, n = 453) para homens e
$12,24 (IQ 3,57‑44,01, n = 273) para mulheres (p = 0,127).
Observou-se um incremento na mediana do custo mensal
para IC com hipertensão (p < 0,001) e diabetes (p < 0,001).
Hipertensão foi responsável por aumento de custo de
$8,02 (48% maior) (p < 0,001) e diabetes, por aumento
de custo de $24,35 (76% maior) (p < 0,001). O custo
para miocardiopatia isquêmica ($16,84, IQ 6,32-16,84)
foi significativamente maior do que aquele para doença de
Chagas ($8,53, IQ 2,98-26,52, p < 0,001) e outras causas
($6,79, IQ 3,21-18,58, p < 0,001). É possível que o custo
mais baixo para doença de Chagas deva-se ao fato de que
pacientes chagásicos podem não tolerar doses completas e
de que os médicos não são encorajados a usar doses altas
devido à ausência de ensaio clínico em doença de Chagas.
Arq Bras Cardiol. 2015; 105(3):265-275
269
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
Insuficiência cardíaca
0
-10
-20
-30
-40
%
-50
-60
-70
-80
-90
-100
Transplante cardíaco
0
-10
-20
-30
-40
%
-50
-60
-70
-80
-90
-100
Antibióticos
Nitratos
Digitálicos
Antiarrítmicos
AGC-IPADPR
Antiagregante
Hipolipemiantes
OMC
ECA-BRA
BCC
Diuréticos
Betabloqueadores
OMNC
Imunossup
Figura 1 – Redução do custo (percentagem) dos medicamentos prescritos e dispensados, comprados por pregão em comparação aos custos no mercado privado
de acordo com cada grupo de medicamento para insuficiência cardíaca (superior) e transplante cardíaco (inferior). Imunossup: imunossupressores; OMNC: Outros
medicamentos não cardiovasculares; BCC: Bloqueadores do canal de cálcio; IECA: Inibidores da enzima de conversão da angiotensina; BRA: Bloqueadores do receptor
da angiotensina; OMC: Outros medicamentos cardiovasculares; antiagregantes plaquetários; ACG: Anticoagulantes; IPADPR: Inibidores do receptor ADP plaquetário.
270
Arq Bras Cardiol. 2015; 105(3):265-275
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
Tabela 3 – Custo total em dólares dos medicamentos prescritos para populações de estudo sobre insuficiência cardíaca e transplante cardíaco
IC
Pregão
TC
Medicamento prescrito
Pregão
Privado
Privado
Pregão
Pregão
Privado
Privado
Total
%
Total
%
Total
%
Total
%
Betabloqueador
5.587,37
1,05
594.268,42
14,89
600,39
0,03
13.832,19
0,24
Diurético
7.656,28
1,43
146.626,03
3,67
368,85
0,02
8.441,09
0,15
BCC
1.212,11
0,23
58.448,57
1,46
6.847,05
0,38
51.373,17
0,90
IECA, BRA
16.905,47
3,16
209.315,46
5,24
2.102,12
0,12
15.675,55
0,27
OCD
24.174,38
4,52
162.075,63
4,06
4.846,76
0,27
15.933,67
0,28
Hipolipemiante
79.108,02
14,80
196.806,89
4,93
6.267,88
0,35
66.905,15
1,17
566,45
0,11
19.825,63
0,50
67,07
0,00
2.347,49
0,04
Antiagregante plaquetário
ACG ou IPADPR
7.911,35
0,15
58.458,19
1,46
662,50
0,04
9.667,25
0,17
Antiarrítmicos
1.993,28
0,37
17.018,91
0,43
40,55
0,00
729,86
0,01
Digitálico
672,34
0,13
15.980,01
0,40
18,70
0,00
336,58
0,01
5.300,55
0,99
37.563,87
0,94
559,03
0,03
1.799,95
0,03
217,40
0,04
5.880,07
0,15
6.647,44
0,37
199.964,37
3,49
-
-
-
-
1.540.724,53
86,20
4.159.017,41
72,63
ONCD
390.244,35
73,02
2.468.908,68
61,86
217.709,30
12,18
1.179.687,44
20,60
TOTAL
534.428,49
100
3.991.176,38
100
1.787.462,17
100
5.725.965,20
100
Nitrato
Antibiótico
Imunossupressor
HF: Insuficiência cardíaca; HT: Transplante cardíaco; ACG: Anticoagulante; IPADPR: Inibidor do receptor adenosina difosfato plaquetário; OMNC: Outro
medicamento não cardiovascular; betabloqueador (atenolol, bisoprolol, metoprolol, carvedilol, propranolol, sotalol); diurético (furosemida, hidroclorotiazida,
clortalidona, espironolactona); BCC: Bloqueador do canal de cálcio (diltiazem, verapamil, anlodipino, nifedipina, losartana); IECA: Inibidor da enzima de conversão
da angiotensina (captopril, enalapril, lisinopril); BRA: Bloqueador do receptor da angiotensina; hipolipemiante (atorvastatina, ciprofibrato, ezetimiba, rosuvastatina,
sinvastatina); antiagregante plaquetário (aspirina); ACG ou IPADPR (enoxaparina, varfarina, clopidogrel); antiarrítmicos (amiodarona, propafenona); digitálico
(digoxina); nitrato (isossorbida, propatilnitrato). OMC: Outros medicamentos cardiovasculares (clonidina, doxazosina, hidralazina, metildopa)
Na análise multivariada, indivíduos mais idosos com IC
tiveram custos significativamente mais altos (β = 0,021,
p < 0,001), tendo pacientes sem hipertensão e sem diabetes
custos significativamente menores (β = -0,517, p < 0,001;
β = -0,979, p < 0,001). A magnitude da redução de custo
por pregão foi maior em diabetes e hipertensão (Figura 2).
No grupo TC, a mediana do custo mensal por paciente
foi $365,17 (IQ 100,83-683,59, n = 101) para homens
e $435,58 (IQ 248,40-920,86, n = 45) para mulheres
(p = 0,268). Nenhuma comorbidade causou aumento de
custo. Observou‑se diferença estatisticamente significativa entre
os custos de pacientes com história prévia de miocardiopatia
chagásica ($271,71, IQ 66,49-568,54) e de outras causas
($472,40, IQ 182,05‑888,53, p = 0,009). A Tabela 4 apresenta
outras comparações entre as variáveis clínicas e a mediana de
custo para os dois grupos. Na análise multivariada, pacientes
de TC sem hipertensão apresentaram menor custo (β = -0,324,
p < 0,001). Nesse modelo, outras variáveis não apresentaram
significado estatístico para prever custo. A magnitude da
redução de custo através pregão foi maior na presença de
diabetes e de hipertensão (Figura 2).
Custo do tratamento farmacológico na farmácia
comercial de acordo com análises de subgrupo
No grupo IC, a mediana de custo mensal para homens
foi $155,34 (IQ 91,30-314,85) e para mulheres foi $175,21
(IQ 80,68-415,44) (p = 0,412). Com relação a comorbidades,
houve um aumento na mediana de custo mensal associado
a hipertensão (p < 0,001) e diabetes (p < 0,001).
Hipertensão foi responsável por incremento de custo de
$60,35 (28% maior) (p = 0,005), e diabetes, por incremento
de custo de $130,19 (48% maior) (p < 0,001). O custo da
miocardiopatia isquêmica ($200,96, IQ 113,73-447,87)
foi significativamente maior do que o da miocardiopatia
chagásica ($138,85, IQ 19,03‑303,53, p = 0,003) o de
outras causas ($139,82, IQ 84,39-274,33, p = 0,004).
Na análise multivariada, observou‑se uma significativa
interação entre custo e idade para pacientes com IC, tendo
indivíduos mais idosos apresentado custos significativamente
maiores (β = 0,018, p < 0,001). Homens (β = -0,165,
p < 0,001) e indivíduos não diabéticos apresentaram custos
significativamente menores (β = 0,568, p = 0,003).
No grupo TC, a mediana de custo mensal dos
medicamentos prescritos apresentou tendência a ser menor
para homens ($1.056,83, IQ 532,31-2.325,00) do que para
mulheres ($1.313,48, IQ 907,33-3.011,20) (p = 0,069).
No entanto, diabetes foi a única comorbidade responsável
por aumento de custo ($795,99, 40% maior) (p = 0,045).
Não houve diferença de custo entre as causas. A Tabela 4
apresenta comparações adicionais entre as variáveis clínicas e
a mediana do custo mensal para os dois grupos. No grupo TC,
a análise multivariada mostrou significativa interação entre
custo e ausência de hipertensão (β = -0,218, p < 0,001).
A ausência de hipertensão resultou em menores custos
no sistema privado. Nesse modelo, não houve diferenças
estatisticamente significativas para outras variáveis.
Arq Bras Cardiol. 2015; 105(3):265-275
271
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
INSUFICIÊNCIA CARDÍACA
1829
Dólar americano
1626
1422
1219
1016
813
609
406
203
0
pregão
FC
Sem hipertensão
pregão
FC
Hipertensão
pregão
FC
Sem diabetes
pregão
FC
Diabetes
TRANSPLANTE CARDÍACO
4827
Dólar americano
4319
3811
3302
2794
2286
1778
1270
762
254
0
pregão
FC
Sem hipertensão
pregão
FC
Hipertensão
pregão
FC
Sem diabetes
pregão
FC
Diabetes
Figura 2 – Custo dos medicamentos prescritos dispensados comprados por pregão em comparação aos de farmácia comercial (FC) de acordo com o diagnóstico de
hipertensão arterial sistêmica e diabetes mellitus em insuficiência cardíaca e transplante cardíaco.
Discussão
Até onde sabemos, este é o primeiro estudo a demonstrar
que o custo da dispensação de medicamentos prescritos
para pacientes com IC e TC, comprados através de pregão,
é substancialmente inferior ao estimado no mercado
privado para a prática clínica. Nessa comparação, a compra
através de pregão para IC seguida por dispensação aos
pacientes chega a ser uma barganha. A idade mais avançada
272
Arq Bras Cardiol. 2015; 105(3):265-275
associou‑se a custos mais altos, e a ausência de diabetes, a
custos mais baixos em pacientes com IC nos dois sistemas de
compra. A magnitude da redução de custo através do pregão
foi maior na presença de diabetes e de hipertensão (Figura 2).
Nosso custo para o tratamento farmacológico da IC foi
significativamente menor quando comparado ao relatado
previamente, variando de $261 a $438 por mês por
paciente 9,10. O custo dos medicamentos comprados no
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
Tabela 4 – Custo mensal por pregão ou mercado privado de medicamentos prescritos para populações de estudo em insuficiência cardíaca e
transplante cardíaco de acordo com variáveis clínicas e demográficas
IC
Características
TC
n
Mediana do
custo
n
Mediana do
custo
IQ 25%-75%
IQ 25%-75%
5
3,16
2,87-24,39
9
732,48
493,62-1.026,12
20 - 40
68
41 - 65
380
4,35
2,07-15,63
37
410,07
239,07-844,68
9,8
3,20-45,88
57
365,19
≥ 65
97,16-619,52
273
13,46
4,80-52,75
43
245,93
90,60-1.021,26
132
16,84
6,32-16,84
18
402,49
77,07-932,54
Chagásica
76
8,53
2,98-26,52
48
271,71
66,49-568,54
Outras
217
6,79
3,21-18,58
73
472,40
182,05-888,53
<5
192
10,84
2,88-39,19
16
576,34
292,84-1.396,98
6 - 10
286
8,09
3,07-30,27
16
512,22
149,78-1.062,56
11 - 15
124
15,13
5,23-70,22
42
227,05
73,86-607,01
16 - 20
46
6,55
2,91-54,35
28
273,05
61,67-654,69
≥ 21
78
12,89
5,06-41,86
44
493,46
223,14-847,01
I e II
326
7,04
2,82-32,86
III e IV
101
16,47
5,43-67,55
Branca e amarela
564
10,07
3,59-10,07
126
390,47
118,43-737,32
Negra e parada
148
10,92
3,52-40,47
20
40,47
225,65-1.074,95
p
p
Custo do pregão em $
Idade, anos
≤ 19
< 0,001
Causas
Isquêmica
0,19
< 0,001
Consulta ambulatorial (número)
0,036
0,005
Classe funcional
0,016
< 0,001
Etnia
0,96
FEVE
0,34
0,43
0,97
≤ 40%
296
11,82
3,47-47,80
10
358,93
86,11-957,32
> 40%
119
9,46
3,72-27,61
126
390,47
124,75-740,92
5
105,45
52,69-520,48
09
1.851,58
1.284,76-2.755,11
Custo privado em $
Idade, anos
≤ 19
< 0,001
0,52
20 - 40
68
114,52
62,57-188,12
37
1.234,25
839,74-2.455,04
41 - 65
380
148,90
79,68-331,97
57
1.155,17
556,26-2.491,22
≥ 65
273
193,19
113,57-420,72
43
1.004,99
572,62-2.734,57
Causas
Isquêmica
0,004
132
0,14
200,96
113,73-447,87
18
1.581,77
554,10-3.141,53
Chagásica
76
138,85
19,03-303,53
48
1.024,00
355,21-1.553,49
Outras
217
139,82
84,39-274,33
73
1.378,35
784,73-2.485,21
67,85-321,16
16
1.507,97
984,70-3.821,39
Consulta ambulatorial (número)
0,002
0,009
<5
192
168,48
6 - 10
286
147,90
79,49-308,74
16
1.530,34
713,99-2.890,81
11 - 15
124
190,69
111,44-510,07
42
800,50
446,29-2.232,58
16 - 20
46
151,78
89,09-339,14
28
905,63
309,77-1.756,99
≥ 21
78
189,04
116,25-363,56
44
1.445,44
955,98-2.737,73
126
1.161,89
573,85-2.432,95
20
1.709,93
800,58-3.134,78
Classe funcional
0,010
I e II
326
134,27
72,15-278,23
III e IV
101
213,35
110,97-637,56
Branca e amarela
564
169,05
85,18-339,40
Negra e parda
148
157,10
86,02-391,50
Etnia
0,57
FEVE
0,15
0,92
0,32
≤ 40%
310
149,32
75,75-331,42
10
1.133,99
712,47-2.548,44
> 40%
129
136,30
72,65-286,64
126
1.203,64
583,40-2.487,27
Medidas apresentadas como mediana e intervalo interquartil. FEVE: Fração de ejeção ventricular esquerda; IC: Insuficiência cardíaca; TC: Transplante cardíaco.
Arq Bras Cardiol. 2015; 105(3):265-275
273
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
pregão no nosso estudo variou de 2,28% a 3,8% daqueles
publicados nos EUA, enquanto o estimado no mercado
privado variou de 37% a 62%. O sistema de saúde dos
EUA, conhecido como um dos mais dispendiosos no mundo
e com maiores preços para os medicamentos15, pode ter
contribuído para tais diferenças. Entretanto, a enorme
diferença de custo corroborou nossos achados da eficiência
do pregão em reduzir custos do tratamento de IC.
Com relação ao TC, a comparação com os dados
de apenas um estudo publicado analisando o custo de
imunossupressores até dois anos após transplante de órgãos
sólidos mostrou que o pregão pode ser proporcionalmente
menos eficiente em reduzir custos após TC. Naquele estudo,
os custos variaram de $448 a $1.321 por paciente por
mês16. Entretanto, o custo dos outros medicamentos não
foi considerado, o que poderia subestimar o custo total do
tratamento farmacológico.
Para explicar nossos resultados, especulamos que a
compra por pregão possa criar um ambiente competitivo para
muitas indústrias envolvidas na produção de medicamentos
para IC. A concorrência, ao invés de ser uma desvantagem
para a indústria, serviria para impulsionar os fabricantes de
medicamentos a melhorar seus processos de negócio para
manter o lucro ao mesmo tempo em que beneficiaria a
sociedade. Ao contrário, o pequeno número de indústrias
envolvidas na produção dos imunossupressores e o restrito
mercado podem impedir o desenvolvimento de um
ambiente competitivo e limitar a eficiência do pregão para
TC. Como resultado, a terapia farmacológica no transplante
tem alto custo se comparada àquela da IC16.
Como esperado e confirmando dados publicados, as
comorbidades associaram-se com maior custo8,9. O maior
custo para pacientes mais idosos poderia ser explicado pelo
fato de que o envelhecimento leva a um maior número
de comorbidades. Em geral, as comorbidades requerem
tratamento com polifarmácia; entretanto, é importante ressaltar
que diabetes se associou a maior aumento de custos na IC,
provavelmente como consequência do papel da diabetes no
desenvolvimento de muitas comorbidades9. O pregão, no
entanto, foi mais eficiente na diabetes (Figura 2).
Implicações clínicas e no sistema de saúde
Nossos achados sugerem que o pregão seja uma alternativa
positiva de apoio financeiro ao sistema de saúde e poderia
ser introduzido em sistema de saúde de outros países para
reduzir o custo do tratamento farmacológico da IC e após
TC. Os envolvidos em suprimento de medicamentos para IC
deveriam considerar a possibilidade de compra por pregão e
dispensação para os pacientes. O custo dos medicamentos
para pacientes não hospitalizados pode influenciar sua
adesão ao tratamento farmacológico recomendado 10.
O menor custo poderia resultar em maior acesso a esse
tratamento com maior adesão aos medicamentos prescritos,
melhor sobrevida e menos hospitalização. O uso do pregão
274
Arq Bras Cardiol. 2015; 105(3):265-275
mundo afora para políticas de saúde poderia beneficiar
muitos indivíduos em países desenvolvidos e principalmente
não desenvolvidos, reduzindo o custo da IC.
Limitações
Nosso estudo tem limitações. Avaliamos apenas
medicamentos prescritos e dispensados; consequentemente,
não pudemos verificar a adesão do paciente ao tratamento.
No entanto, é suficiente para demonstrar quanto de
terapia farmacológica ocorre na prática clínica. Os regimes
administrados foram baseados naqueles prescritos por
cardiologistas especializados em um centro terciário, podendo
não representar assistência primária em IC. Nosso estudo
unicêntrico não incluiu pacientes de múltiplas práticas nem
de diferentes regiões geográficas brasileiras; entretanto, em
geral, nessas condições o tratamento farmacológico não é
orientado por diretrizes. Por fim, nosso estudo foi uma revisão
retrospectiva de registros médicos, uma vez que um estudo
prospectivo demandaria mais tempo e recursos econômicos.
Conclusão
O presente estudo sobre prática contemporânea
demonstrou que o pregão pode ser importante para reduzir
o custo da terapia farmacológica em IC para pacientes
ambulatoriais ou após TC. Além disso, comorbidades e
idade avançada associaram-se a maior custo, o que deve
ser considerado quando do planejamento de estratégias de
saúde para IC. Da mesma forma, o principal achado é que o
pregão possa tornar-se estratégia governamental para expandir
o acesso dos menos privilegiados à terapia medicamentosa e
no melhor uso dos recursos públicos.
Contribuição dos autores
Concepção e desenho da pesquisa: Brandão SMG, Bocchi
EA. Obtenção de dados: Brandão SMG, Storer S, Gonçalves
BG, Santos VG. Análise e interpretação dos dados: Brandão
SMG. Análise estatística: Brandão SMG, Carvas Junior N.
Redação do manuscrito: Brandão SMG, Bocchi EA. Revisão
crítica do manuscrito quanto ao conteúdo intelectual
importante: Brandão SMG, Issa VS, Ayub-Ferreira SM,
Guimarães GV, Bocchi EA.
Potencial Conflito de Interesse
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo não teve fontes de financiamento externas.
Vinculação Acadêmica
Não há vinculação deste estudo a programas de pós-graduação.
Brandão e cols.
Custo farmacológico da insuficiência cardíaca
Artigo Original
Referências
1. Go AS, Mozaffarian D, Roger VL, Benjamin EJ, Berry JD, Borden WB, et
al; American Heart Association Statistics Committee and Stroke Statistics
Subcommittee. Heart disease and stroke statistics--2013 update: a report
from the American Heart Association. Circulation. 2013;127(1):e6-245.
Erratum in: Circulation. 2013;127(23):e841.
2. Bocchi EA, Arias A, Verdejo H, Diez M, Gómez E, Castro P; Interamerican
Society of Cardiology. The reality of heart failure in Latin America. J Am Coll
Cardiol. 2013;62(11):949-58.
3.
Bocchi EA, Marcondes-Braga FG, Ayub-Ferreira SM, Rohde LE, Oliveira WA,
Almeida DR, et al. Sociedade Brasileira de Cardiologia. III Diretriz Brasileira
de Insuficiência Cardíaca crônica. Arq Bras Cardiol. 2009;93(1 supl 1):1-71.
4. Chase SL, Pickworth KK. Clinical and economic implications of new
strategies for heart failure managed care setting. Pharmacotherapy.
2007;27(4 Pt 2):29S-32S.
5. World Health Organization (WHO). WHO. Global comparative
pharmaceutical expenditures with related reference information: health
economics and drugs series. No. 003. [Accessed 2014 Jan 4]. Available from:
http://apps.who.int/medicinedocs/documents/s18569en/s18569,
6. Heidenreich PA, Trogdon JG, Khavjou OA, Butler J, Dracup K, Ezekowitz
MD, et al; American Heart Association Advocacy Coordinating Committee;
Stroke Council; Council on Cardiovascular Radiology and Intervention;
Council on Clinical Cardiology; Council on Epidemiology and Prevention;
Council on Arteriosclerosis; Thrombosis and Vascular Biology; Council on
Cardiopulmonary; Critical Care; Perioperative and Resuscitation; Council on
Cardiovascular Nursing; Council on the Kidney in Cardiovascular Disease;
Council on Cardiovascular Surgery and Anesthesia, and Interdisciplinary
Council on Quality of Care and Outcomes Research. Forecasting the future
of cardiovascular disease in the United States: a policy statement from the
American Heart Association. Circulation. 2011;123(8):933-44.
7.
Stålhammar J, Stern L, Linder R, Sherman S, Parikh R, Ariely R, et al. Resource
utilization and cost of heart failure associated with reduced ejection fraction
in Swedish patients. J Med Econ. 2012;15:938-46.
8. Xuan J, Duong PT, Russo PA, Lacey MJ, Wong B. The economic burden of
congestive heart failure in a managed care population. Am J Manag Care.
2000;6(6):693-700.
9. Masoudi FA, Baillie CA, Wang Y, Bradford WD, Steiner JF, Havranek EP, et
al. The complexity and cost of drug regimens of older patients hospitalized
with heart failure in the United States, 1998-2001. Arch Intern Med.
2005;165(18):2069-76.
10. Hussey LC, Hardin S, Blanchette C. Outpatient costs of medications for
patients with chronic heart failure. Am J Crit Care. 2002;11(5):474-8.
11. Bocchi EA, Guimarães G, Tarasoutshi F, Spina G, Mangini S, Bacal F.
Cardiomyopathy, adult valve disease and heart failure in South America.
Heart. 2009;95(3):181-9.
12. Ayub-Ferreira SM, Mangini S, Issa VS, Cruz FD, Bacal F, Guimarães GV, et al.
Mode of death on Chagas heart disease: comparison with other etiologies.
a subanalysis of the REMADHE prospective trial. PLoS Negl Trop Dis.
2013;7(4):e2176.
13. Bocchi EA, Cruz F, Guimarães G, Pinho-Moreira LF, Issa VS, AyubFerreira SM, et al. A Long-term prospective randomized controlled study
using repetitive education at six-month intervals and monitoring for
adherence in heart failure outpatients: the REMADHE trial. Circ Heart
Fail. 2008;1(2):115-24.
14. Arvate PR, Barbosa KS, Gambardella D. Generic-branded drug competition
and the price for pharmaceuticals in procurement auctions. [Accessed
in 2014 Jan 28]. Available from: http://bibliotecadigital.fgv.br/dspace/
handle/10438/11322.
15. Squires DA. The U.S. health system in perspective: a comparison of twelve
industrialized nations. Issue Brief (Commonw Fund). 2011;16:1-14.
16. Levy AR, Sobolev B, James D, Barrable W, Clarke-Richardson P, Sullivan SD,
et al. The costs of change: direct medical costs of solid organ transplantation
in British Columbia, Canada, 1995-2003. Value Health. 2009;12(2):282-92.
Arq Bras Cardiol. 2015; 105(3):265-275
275
Voltar ao Índice da Capa
Artigo Original
Variabilidade da Frequência Cardíaca e da Pressão Arterial Sistólica
em Diabéticos com Diagnóstico Recente
Heart Rate and Systolic Blood Pressure Variability on Recently Diagnosed Diabetics
Anaclara Michel-Chávez, Bruno Estañol, José Antonio Gien-López, Adriana Robles-Cabrera, María Elena HuitradoDuarte, René Moreno-Morales, Brayans Becerra-Luna
Instituto Nacional de Ciencias Medicas y Nutrición Salvador Zubirán, México Distrito Federal – Mexico
Resumo
Fundamento: O diabetes afeta aproximadamente 250 milhões de pessoas no mundo. A neuropatia autonômica
cardiovascular é uma complicação comum do diabetes que leva à hipotensão postural grave, intolerância ao exercício
e aumento na incidência de infarto do miocárdio silencioso.
Objetivo: Determinar a variabilidade da frequência cardíaca (FC) e da pressão arterial sistólica (PAS) em pacientes
diabéticos com diagnóstico recente.
Métodos: O estudo incluiu 30 pacientes com diabetes tipo 2 diagnosticado há menos de 2 anos e 30 controles saudáveis.
Nós utilizamos o dispositivo Finapres® para medir durante cinco minutos a FC batimento-a-batimento e a pressão arterial
(PA) em três condições experimentais: posição supina, em pé e durante respiração rítmica na frequência de 0,1 Hz.
Os resultados foram analisados nos domínios do tempo e da frequência.
Resultados: Em relação à FC, foram encontradas diferenças estatisticamente significativas nos valores da análise do
domínio do tempo, especificamente em valores determinados a curto prazo, tais como o desvio-padrão dos intervalos NN
(DPNN), a raiz quadrada da média das diferenças sucessivas (RQMDS) para a FC e o número de pares de NNs sucessivos
que diferem em mais de 50 ms (pNN50). Não houve diferença significativa na análise da PA, mas houve uma dominância
simpática nas três condições. A sensibilidade do barorreflexo (SBR) esteve diminuída em pacientes com diabetes de início
recente, em comparação aos indivíduos saudáveis durante execução da manobra na posição ortostática.
Conclusões: Há uma diminuição na variabilidade da FC em pacientes com diabetes tipo 2 de início recente. Não foram
observadas alterações na análise da PA na posição supina, mas a SBR apresentou mudança com a manobra em pé,
provavelmente causada por hiperatividade simpática. (Arq Bras Cardiol. 2015; 105(3):276-284)
Palavras-chave: Frequência Cardíaca; Pressão Arterial; Diabetes Mellitus / diagnóstico; Complicações do Diabetes,
Neuropatias Diabéticas.
Abstract
Background: Diabetes affects approximately 250 million people in the world. Cardiovascular autonomic neuropathy is a common complication
of diabetes that leads to severe postural hypotension, exercise intolerance, and increased incidence of silent myocardial infarction.
Objective: To determine the variability of heart rate (HR) and systolic blood pressure (SBP) in recently diagnosed diabetic patients.
Methods: The study included 30 patients with a diagnosis of type 2 diabetes of less than 2 years and 30 healthy controls. We used a Finapres®
device to measure during five minutes beat-to-beat HR and blood pressure in three experimental conditions: supine position, standing position,
and rhythmic breathing at 0.1 Hz. The results were analyzed in the time and frequency domains.
Results: In the HR analysis, statistically significant differences were found in the time domain, specifically on short-term values such as standard
deviation of NN intervals (SDNN), root mean square of successive differences (RMSSD), and number of pairs of successive NNs that differ by more
than 50 ms (pNN50). In the BP analysis, there were no significant differences, but there was a sympathetic dominance in all three conditions.
The baroreflex sensitivity (BRS) decreased in patients with early diabetes compared with healthy subjects during the standing maneuver.
Conclusions: There is a decrease in HR variability in patients with early type 2 diabetes. No changes were observed in the BP analysis in the
supine position, but there were changes in BRS with the standing maneuver, probably due to sympathetic hyperactivity. (Arq Bras Cardiol. 2015;
105(3):276-284)
Keywords: Heart Rate; Arterial Pressure; Diabetes Mellitus / diagnosis; Diabetes Complications; Diabetic Neuropathies.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Bruno Estañol •
Vasco de Quiroga 15, Delegación Tlalpan, CEP 14000. México, D.F.
E-mail: [email protected]
Artigo recebido em 10/10/2014; revisado em 10/02/2015; aceito em 18/03/15.
DOI: 10.5935/abc.20150073
276
Michel-Chávez e cols.
Variabilidade cardiovascular no diabetes de diagnóstico recente
Artigo Original
Introdução
As doenças cardiovasculares e o diabetes mellitus (DM)
tipo 2 são as principais causas de morte no continente
americano e causas comuns de incapacidade, morte
prematura e gastos excessivos1.
A neuropatia autonômica cardiovascular (NAC) é uma
forma comum de disfunção autonômica em pacientes
com DM e está associada com anormalidades no controle
da frequência cardíaca (FC), perda na sua variabilidade,
redução na sensibilidade dos barorreceptores (SBR) e
alterações tardias na dinâmica vascular2,3. Em cerca de 7%
dos pacientes com DM de ambos os tipos (1 e 2), a NAC é
detectada no momento do diagnóstico. O aumento anual
na prevalência da NAC tem sido relatado em cerca de 6%
no DM tipo 24-7.
A prevalência de NAC confirmada (definida como
anormalidade em pelo menos dois resultados cardiovasculares
de FC) em estudos clínicos com populações não selecionadas,
incluindo pacientes com DM tipo 1 e 2, varia de 16,6 a
20%5,8. Essa prevalência pode aumentar para 65% com o
aumento da idade e duração do DM5,6. A NAC tem sido
associada à taquicardia de repouso, hipotensão ortostática,
intolerância ao exercício, aumento na incidência de isquemia
assintomática, infarto do miocárdio e diminuição na taxa de
sobrevida após infarto do miocárdio3.
Em indivíduos saudáveis, a FC tem uma alta variabilidade
no intervalo entre batimentos (IEB) que flutua com a
respiração, aumentando durante a inspiração e diminuindo
durante a expiração9. A variabilidade da FC (VFC) medida
pela variabilidade do IEB em registros a curto ou longo prazo
é representada, dependendo do tipo de processamento
matemático, pela análise da VFC no domínio do tempo e
da frequência (análise espectral)9,10.
Em registros realizados a curto prazo, componentes
espectrais diferentes podem ser identificados de acordo com
suas frequências em Hz. O componente de alta frequência
(AF) é considerado uma área de influência vagal, enquanto
que o de baixa frequência (BF) está sob influência do sistema
simpático e sob certa influência vagal, embora influências do
barorreceptor também tenham sido postuladas9.
Protocolos padronizados de estimulação autonômica
(respiração, teste ortoclinostático, teste de tilt) no exame da
análise espectral da VFC em registros obtidos a curto prazo
impõem elementos de estresse para avaliação do nível e da
reatividade dos sistemas simpático e parassimpático9.
O objetivo deste estudo foi determinar a FC batimentoa-batimento e a variabilidade da pressão arterial (PA) em
pacientes com DM tipo 2 com menos de dois anos de
diagnóstico e comparar os resultados com a variabilidade
desses parâmetros em indivíduos saudáveis.
Método
Estudo descritivo, transversal, proletivo, comparativo e
não randomizado, desenvolvido com indivíduos de ambos
os sexos, incluindo 30 diabéticos com menos de dois anos
de diagnóstico e 30 indivíduos saudáveis entre 30 e 60 anos.
Os indivíduos com DM foram identificados a partir de um
protocolo de acompanhamento de uma coorte de pacientes
com resistência à insulina. Durante o seguimento desses
pacientes, um teste oral de tolerância à glicose (75 gramas) era
realizado periodicamente, e quando os resultados confirmavam
o diagnóstico de DM, o paciente era convidado a participar
do estudo. Exames de urina foram realizados para descartar
proteinúria e dano renal, enquanto que testes de velocidade de
condução nervosa foram realizados para descartar neuropatia
periférica. Esses estudos foram realizados para avaliar os danos
a esses órgãos causados por hiperglicemia de longa evolução.
Por fim, os pacientes precisavam ter um exame de fundoscopia
normal realizado por um neurologista certificado para descartar
retinopatia diabética no momento do estudo. Essas variáveis
foram tomadas como parâmetros de controle para garantir que
o DM não era de longa evolução.
A doença aterosclerótica vascular periférica foi excluída
em todos os pacientes com base em uma espessura da
camada íntima-média da carótida abaixo de 0,685 mm
(0,659-0,691mm). Esse é o intervalo estabelecido pelo estudo
CARMELA (2011) para a idade máxima dos pacientes incluídos
em nosso estudo (60 anos)11.
O projeto foi aprovado pelo Comitê de Ética e Pesquisa
da instituição e esteve em conformidade com a declaração
de Helsinki. Antes da realização dos testes, cada participante
assinou um termo de consentimento informado.
Antes do estudo, os pacientes apresentavam nível de
glicemia capilar entre 60mg/dL e 200mg/dL. Solicitamos aos
participantes de ambos os grupos que evitassem qualquer
substância estimulante 24 horas antes do estudo e que
tivessem pelo menos 8 horas de sono na noite anterior.
Nós excluímos pacientes com doenças subjacentes com
componentes autonômicos ou de qualquer outra natureza
que pudessem alterar os resultados do teste.
Utilizamos o Finometer® (Finapres®, Holanda) para
medir as duas variáveis de interesse – PA e IEB – durante três
manobras registradas por cinco minutos cada uma:
1. Posição supina.
2. Levantar após um minuto de estabilização.
3. Respiração rítmica de 6 ciclos por minuto, com ritmo
determinado eletronicamente.
Os dados obtidos com a série temporal de IEB em
milissegundos e a PA sistólica (PAS) em mmHg (para cada
batimento do coração) nas três manobras foram analisados
por meio de diagrama temporal, histograma, autorregressão
automática e transformada rápida de Fourier.
Artefatos ou batimentos prematuros foram eliminados
manualmente da série de tempo e a análise estatística foi
realizada no domínio do tempo e da frequência com o
software SPSS. Obtivemos a média, desvio-padrão (DP), erro
padrão e coeficiente de variação para o domínio do tempo.
Com uso do Beatscope (programa próprio do Finometer®
para extrair as séries de tempo do IEB em ms e PA em
mmHg), as séries de tempo foram transferidas para o Excel
para avaliação estatística. Para a análise espectral, utilizamos
o SPSS, MatLab, Kubios e Nevrokard. O nível de significância
estatística foi fixado em p ≤ 0,05.
Arq Bras Cardiol. 2015; 105(3):276-284
277
Michel-Chávez e cols.
Variabilidade cardiovascular no diabetes de diagnóstico recente
Artigo Original
Resultados
Não houve diferenças significativas entre os dois grupos
em relação às variáveis idade, gênero, PAS e glicemia de
jejum (Tabela 1). O índice de massa corporal (IMC) foi
ligeiramente maior no grupo de pacientes diabéticos em
relação ao grupo controle.
Nenhum dos pacientes apresentou alteração nas velocidades
de condução de nervos periféricos motor ou sensorial, respostas
F ou reflexos H. Respostas simpáticas cutâneas estiveram
presentes com latências e amplitudes normais.
A primeira manobra consistiu em colocar o paciente
na posição supina durante 5 minutos após 1 minuto
de estabilização. Nos indivíduos saudáveis, a FC e a
PA apresentaram variabilidade relativamente baixa,
sem mudanças repentinas nas frequências (Figura 1A).
Isto ocorreu devido ao fato de que a variabilidade observada
nessa posição é atribuída exclusivamente à respiração.
Pacientes com DM inicial (Figura 1B) apresentaram uma
variabilidade da FC discretamente inferior em comparação
aos indivíduos do grupo controle. Além disso, a PA
relacionada às mudanças corporais durante a posição
supina esteve ligeiramente diminuída.
A segunda manobra consistiu em pedir aos participantes
que ficassem em pé após 5 minutos de repouso na
posição supina. Imediatamente após levantarem-se, a PA
diminuiu e a FC aumentou em consequência da ação
barorreceptora. Essas variáveis retornaram aos níveis basais
em aproximadamente 30 segundos, atingindo seu ponto mais
alto em 15 segundos. Isso foi documentado como a razão
15/30 ou escore de Ewing, um fenômeno fisiológico normal.
A respiração rítmica foi realizada com auxílio de
um metrônomo visual com inspiração de 5 segundos e
exalação de 5 segundos, durante 5 minutos de registro.
Essa manobra resultou em gráficos mais regulares com
variações mais amplas da PA e da FC, mostrando integridade
do barorreflexo em ambos os casos. No entanto, houve
novamente uma baixa variabilidade nos indivíduos
diabéticos em comparação aos saudáveis.
Ao realizarmos a análise numérica, obtivemos valores
pontuais que permitiram a comparação das variáveis
estabelecidas para os nossos objetivos.
Os valores da FC na posição supina estão resumidos
na Tabela 2.
Embora não tenha havido diferença na média da FC em
batimentos por minuto entre os dois grupos, houve diferenças
significativas no DP dessas médias, no DP dos intervalos NN
(DPNN), na raiz quadrada da média das diferenças sucessivas
(RQMDS) e na porcentagem de NN50 (pNN50). Em todos os
casos os valores foram maiores em indivíduos saudáveis em
comparação aos controles, refletindo uma maior variabilidade
no grupo controle. Quando a potência total (PT) e seus
componentes – BF e AF – foram analisados, os valores foram
significativamente mais elevados em indivíduos saudáveis,
com predominância de BFs. Após normalização desses dados,
nós não encontramos nenhuma diferença entre os grupos.
A Tabela 3 resume os dados obtidos para a FC na posição
em pé.
O estímulo da mudança de posição gerou alterações na
FC, com diferenças apenas no DP, DPNN, RQMDS e pNN50,
com valores mais altos para os indivíduos controle. Na PT,
observamos que as proporções mostradas Tabela anterior
foram mantidas. No entanto, ocorreram valores globais
ligeiramente superiores, com predomínio de BF tanto em
valores absolutos como em unidades normalizadas (un).
A Tabela 4 mostra a FC durante respiração rítmica de
6 ciclos por minuto. Durante essa manobra, repetiram‑se
os mesmos achados encontrados nas posições supina
e em pé, confirmando a diminuição nos valores do DP,
DPNN, RQMDS e pNN50 como resultado de uma menor
variabilidade a curto prazo em diabéticos.
Na análise espectral, encontramos uma PT significativamente
mais alta nos indivíduos saudáveis em comparação aos
diabéticos. Nota-se que as BFs foram superiores tanto em
valores pontuais em ms2 como em un, em comparação com
os obtidos nas posições em pé e supina. A análise espectral em
relação à predominância de BF ou AF sugere um predomínio
simpático ou parassimpático.
Tabela 1 – Variáveis demográficas
Variável
Diabéticos n = 30
Saudáveis n = 30
p
Idade
40,5 (38-48)
39 (35-42)
0,065
Mulher
14 (46%)
14 (46%)
1
IMC (kg/m²)
27,01 (25,8-29,38)
25,95 (24,5-27,36)
0,006
PAS (mmHg)
117 (109-120)
110 (110-120)
0,94
Glicemia de jejum (mg/dL)
99,33 (82-105)
79,12 (72-83)
0,66
Direita
0,56 (0,53-0,66)
-
-
Esquerda
0,57 (0,54-0,66)
-
-
10,8
-
-
Espessura da camada íntima-média (mm)
Meses do diagnóstico
Método de diagnóstico para o DM2 (TOTG)
30 (100%)
IMC: Índice de massa corporal; PAS: Pressão arterial sistólica; DM2: Diabetes mellitus tipo 2; TOTG: Teste oral de tolerância à glicose.
278
Arq Bras Cardiol. 2015; 105(3):276-284
Michel-Chávez e cols.
Variabilidade cardiovascular no diabetes de diagnóstico recente
Artigo Original
Figura 1 – Histograma na posição supina.
Tabela 2 – Frequência cardíaca na posição supina
Diabetes
Controle
p
FC (média)
67,3 ± 1,69
66,71 ± 1,77
0,82
FC (DP)
2,5 ± 0,15
3,61 ± 0,26
< 0,01
DPNN (ms)
28,9 (25,6-37,1)
43,6 (31,6-53,9)
< 0,01
RQMDS (ms)
24,55 (20-30,7)
24,3 (24,3-50,5)
0,03
pNN50 (%)
3,55 (0,7-11,2)
9,5 (1,3-33,5)
0,04
PT (ms2)
717 (530-1289)
1324,5 (803-2854)
< 0,01
BF (ms2)
175,5 (110-305)
302 (327-620)
0,01
AF (ms2)
215 (70-278)
299 (186-712)
0,01
BF (un)
58,8 ± 17,66
48,96 ± 18,35
0,31
AF (un)
46,2 ± 17,66
51,03 ± 18,41
0,31
FC: Frequência cardíaca; DP: Desvio-padrão; DPNN: Desvio-padrão de intervalos NN; RQMDS: Raiz quadrada da média de diferenças sucessivas; NN50: Número
de pares de NNs sucessivos que diferem em mais de 50 ms; pNN50: Proporção de NN50 dividido pelo número total de NNs; PT: Potência total; BF: Baixa frequência;
AF: Alta frequência; un: Unidades normalizadas.
Arq Bras Cardiol. 2015; 105(3):276-284
279
Michel-Chávez e cols.
Variabilidade cardiovascular no diabetes de diagnóstico recente
Artigo Original
Tabela 3 – Frequência cardíaca na posição em pé
FC (média)
FC (DP)
Diabetes
Controle
p
75,78 ± 11,41
78,5 ± 10,93
0,35
3,14 ± 0,93
5,22 ± 1,91
< 0,01
DPNN (ms)
31,25 (23,6-41,1)
47,05 (32,6-62)
< 0,01
RQMDS (ms)
20,5 (13,7-24,1)
26,05 (21,8-34,5)
< 0,01
1,55 (0-3,6)
5,25 (1,9-14,6)
< 0,01
PT (ms2)
785 (409-1270)
2030,5 (938-3026)
< 0,01
BF (ms2)
199 (122-388)
551,5 (357-1130)
< 0,01
AF (ms2)
124 (64-210)
322,5 (229-542)
< 0,01
BF (un)
63,27 ± 18,64
61,19 ± 20,59
0,69
AF (un)
36,77 ± 18,64
38,8 ± 20,59
0,69
pNN50 (%)
FC: Frequência cardíaca; DP: Desvio-padrão; DPNN: Desvio-padrão de intervalos NN; RQMDS: Raiz quadrada da média de diferenças sucessivas; NN50: Número
de pares de NNs sucessivos que diferem em mais de 50 ms; pNN50: Proporção de NN50 dividido pelo número total de NNs; PT: Potência total; BF: Baixa frequência;
AF: Alta frequência; un: Unidades normalizadas.
Tabela 4 – Frequência cardíaca durante respiração rítmica
Diabetes
Controle
FC (média)
70,51 ± 7,43
70,22 ± 10,31
0,91
FC (DP)
4,78 ± 1,82
7,44 ± 7,44
< 0,01
DPNN (ms)
54,7 (44,4-72,3)
86,65 (68-86,65)
< 0,01
RQMDS (ms)
28,45 (19,8-42,1)
51,5 (41,2-77,9)
< 0,01
pNN50 (%)
p
8,4 (1,2-20,2)
30 (16-46,5)
< 0,01
PT (ms2)
2966,5 (1510-4815)
7406 (3612-12.098)
< 0,01
BF (ms2)
2136,5 (963-3663)
6454 (2363-9527)
< 0,01
AF (ms2)
243 (65-431)
640 (320-1389)
< 0,01
BF (un)
90,7 (84,4-94,2)
88,05 (84-91,4)
0,379
AF (un)
9,3 (5,8-15,6)
11,95 (8,6-16)
0,340
FC: Frequência cardíaca; DP: Desvio-padrão; DPNN: Desvio-padrão de intervalos NN; RQMDS: Raiz quadrada da média de diferenças sucessivas; NN50: Número
de pares de NNs sucessivos que diferem em mais de 50 ms; pNN50: Proporção de NN50 dividido pelo número total de NNs; PT: Potência total; BF: Baixa frequência;
AF: Alta frequência; un: Unidades normalizadas.
Na posição supina, não encontramos diferenças nos
parâmetros da PAS (Tabela 5).
Durante a manobra em pé (Tabela 6), a média da PAS
e a razão máxima/mínima de pressão foram maiores nos
pacientes diabéticos quando comparados aos indivíduos
saudáveis. Não houve diferença no DP da PAS entre os
grupos. Apesar desse achado, a PT foi maior nos indivíduos
controle do que nos pacientes diabéticos, havendo
predominância de BF.
Os resultados da análise da PAS com a respiração rítmica
estão resumidos na Tabela 7. Nessa análise, persiste a
predominância de pressões mais elevadas em pacientes
diabéticos, assim como valores máximos e mínimos de
PAS. No entanto, e em contraste com a Tabela anterior,
não houve significância estatística para a PT e para seus
componentes BF e AF.
280
Arq Bras Cardiol. 2015; 105(3):276-284
A SBR expressa a sensibilidade na resposta do IEB ao
aumento ou redução da PAS. Observamos uma diferença
significativa na SBR na posição em pé, que foi menor no
grupo diabético comparado com o obtido no grupo controle.
Discussão
Durante a fase subclínica inicial, a NAC é detectada
através de anormalidades nos domínios da frequência e
do tempo da análise espectral da VFC e nos testes da SBR.
Essas anormalidades podem estar presentes no momento
do diagnóstico do DM12. A NAC progride e a desnervação
parassimpática é seguida por uma compensação simpática,
resultando em testes anormais de reflexo autonômico
cardíaco, seguido de NAC sintomática. Na fase de
desnervação simpática dos vasos sanguíneos, a disfunção
autonômica correlaciona clinicamente com hipotensão
Michel-Chávez e cols.
Variabilidade cardiovascular no diabetes de diagnóstico recente
Artigo Original
Tabela 5 – Pressão arterial sistólica na posição supina
Diabetes
Controle
p
PAS (média)
116,27 ± 22,01
107,79 ± 10,37
0,06
PAS (DP)
4,43 (3,50-5,95)
4,99 (3,46-5,80)
0,73
PAS (max)
130,83 ± 24,35
124,2 ± 15,48392
0,22
PAS (min)
105,2 ± 23
96,26667 ± 13,34924
0,09
PT (mmHg2)
4791,3 (3192-7207,5)
5920,8 (3074,9-8881,7)
0,44
BF (mmHg2)
1360,8 (1095,5-2724,7)
1971,65 (1006,1-3508,3)
0,45
AF (mmHg2)
216,31 (118,06-536,68)
310,069 (204,90-428,18)
0,38
PAS: Pressão arterial sistólica; DP: Desvio-padrão; PT: Potência total; BF: Baixa frequência; AF: Alta frequência.
Tabela 6 – Pressão arterial sistólica na posição em pé
Diabetes
Controle
p
PAS (média)
123,19 ± 30,09
107,84 ± 12,99
0,01
PAS (DP)
5,33 (4,25-6,53)
5,63 (4,42-7,14)
0,75
PAS (max)
140,2 ± 32,79
123,86 ± 4,79
0,01
PAS (min)
107,73 ± 29,45
92,33 ± 15,14
0,01
PT (mmHg2)
2966,5 (1510-4815)
7406 (3612-12.098)
< 0,01
BF (mmHg2)
2136,5
6454 (2363-9527)
< 0,01
AF (mmHg2)
243 (65-431)
640 (320-1389)
0,20
PAS: Pressão arterial sistólica; DP: Desvio-padrão; PT: Potência total; BF: Baixa frequência; AF: Alta frequência.
Tabela 7 – Pressão arterial sistólica com respiração rítmica
Diabetes
Controle
p
128,55 ± 27,98
113,83 ± 15,43
< 0,01
PAS (DP)
7,4 (5,8–8,2)
6,7 (5,82-7,53)
0,30
PAS (max)
147,16 ± 29,2
132 ± 16,87
< 0,01
PAS (média)
PAS (min)
108,8 ± 28,09
97 ± 16,26
0,04
PT (mmHg2)
11.244 ± 8.027,5
10.770 (7.890-14.281)
0,66
BF (mmHg2)
7.450,6 (4.607,2-12.095)
6.843,75 (4.662,3-9.817,4)
0,41
AF (mmHg2)
723,06 (301,28-907,92)
632,27 (414,05-883,69)
0,77
PAS: Pressão arterial sistólica; DP: Desvio-padrão; PT: Potência total; BF: Baixa frequência; AF: Alta frequência.
postural12. A progressão temporal é incerta, mas estima-se
que muitos pacientes com NAC subclínica desenvolvam
características de acometimento cardíaco no prazo de 5 anos
do desenvolvimento de anormalidades em parâmetros dos
domínios da frequência e do tempo13.
mortalidade de 2.900 indivíduos, o risco relativo de morte
em pacientes com DM e neuropatia autonômica foi de
2,14 (1,83–2,51; p < 0,0001)14. Esses dados são de grande
importância e sugerem que testes autonômicos devam ser
parte integral na abordagem de todos os diabéticos.
Ziegler e cols.14 mostraram em uma metanálise que há
um aumento da mortalidade entre pacientes diabéticos
com neuropatia autonômica em comparação àqueles sem
essa neuropatia. A taxa de risco para isquemia miocárdica
silenciosa no grupo com neuropatia autonômica foi de
1,96 (1,53–2,51; p < 0,001). Além disso, ao analisarem a
Embora esses estudos tenham sido conduzidos com
pacientes diabéticos, a maioria foi realizada em pacientes
com pelo menos 5 anos de evolução ou com doenças
crônicas tais como neuropatia periférica, nefropatia e
retinopatia 15. Tem sido sugerido que o indicador mais
precoce de neuropatia autonômica diabética é a NAC16.
Arq Bras Cardiol. 2015; 105(3):276-284
281
Michel-Chávez e cols.
Variabilidade cardiovascular no diabetes de diagnóstico recente
Artigo Original
A VFC tem sido analisada com frequência como parte
da avaliação da neuropatia autonômica cardíaca, mas a
variabilidade da PA tem sido muito menos estudada17.
Há poucos estudos conduzidos com análise específica dos
valores de VFC a curto prazo (variabilidade de batimentoa-batimento) no domínio do tempo, e também com análise
espectral da influência simpática ou parassimpática no
domínio da frequência.
Estudos exploratórios devem ser realizados em diferentes
estágios da doença para compreensão do seu curso natural.
Neste estudo, idade, sexo, PA basal e glicemia de jejum
foram estatisticamente semelhantes nos dois grupos, embora
tenha havido uma ligeira diferença no IMC que foi maior no
grupo diabético. Isso é explicado pela maior prevalência de
sobrepeso nos pacientes diabéticos do tipo 2 (Tabela 1).
Análise da frequência cardíaca
Com o paciente em posição supina, não há nenhum
estímulo que possa causar uma dominância simpática
sobre a parassimpática. Não há influência da gravidade
e a ativação barorreceptora só é determinada pelas
alterações na PA mediadas pelos movimentos respiratórios.
Nessa primeira manobra, uma diferença estatisticamente
significativa foi encontrada no DP da FC nos diabéticos
em relação aos indivíduos controle. Este é um indicador
de que a variabilidade nos pacientes com DM é menor do
que a registrada nos indivíduos saudáveis. Isso é confirmado
por uma análise do IEB (em ms) realizada a curto prazo
calculando o DP desse registro (DPNN), obtendo a raiz
quadrada da média das diferenças sucessivas (RQMDS),
o número de vezes que esse intervalo consecutivo de um
batimento cardíaco para outro excede 50 milissegundos
(NN50) e a percentagem desses eventos no que diz respeito
à série completa de batimentos cardíacos registrados
(pNN50). Nessa manobra há também uma maior PT
dominada pela BF sobre a AF. Ao se normalizar essas
unidades, elimina-se o viés produzido por frequências
muito baixas (FMB). Nenhum valor prático foi definido
para FMB 18. Não foi também encontrada significância
estatística entre un.
Na posição em pé, a gravidade exerce um desafio físico
que produz momentaneamente uma queda súbita na PA que
nunca excede 40 mmHg e uma taquicardia compensatória
que dura cerca de 15 segundos. Essa manobra ativa vias
simpáticas, portanto quando há dano em qualquer um
dos ramos autonômicos, um desequilíbrio é detectado
nas medidas descritas. Está estabelecido que em pacientes
diabéticos as fibras parassimpáticas para o coração são
as primeiras a sofrerem algum dano; portanto, é possível
encontrar taquicardia precoce em pacientes diabéticos
quando comparados a indivíduos saudáveis19.
Tanto em indivíduos diabéticos quanto saudáveis, não
encontramos nenhuma diferença na média das frequências.
No entanto, em todas as outras variáveis de curto prazo
como o DPNN, RQMDS e pNN50, encontramos valores mais
baixos no grupo diabético em relação ao grupo controle, o
que indica uma baixa VCF. Nessa manobra, e em ambos os
casos, houve predomínio simpático sobre o parassimpático,
282
Arq Bras Cardiol. 2015; 105(3):276-284
o que pode ser explicado pelo fato de que nas fases iniciais
da NAC ainda não há dano simpático importante que possa
causar um desequilíbrio simpático-vagal. Isso provavelmente
indica que a curto prazo os fatores de análise (DPNN,
RQMDS e pNN50) podem ser muito úteis para a triagem
inicial da NAC nesses pacientes, mesmo se o equilíbrio
regulador ou simpático-vagal estiver intacto. Isso sugere que
a perda da variabilidade em pacientes com DM possa ser a
manifestação mais precoce da NAC.
Durante respiração rítmica (a 0,1 Hz), houve predomínio
da BF (0,1–0,15 Hz), o que implica em um desafio simpático.
As diferenças estiveram presentes nos mesmos parâmetros
que a manobra anterior. No entanto, aqui houve um domínio
importante da BF sobre a AF, o que indica que o estímulo
da respiração rítmica confere essa propriedade simpática.
Não houve diferença entre os dois grupos em un.
Portanto, nós encontramos uma baixa VFC em pacientes
com DM de diagnóstico recente comparados com indivíduos
saudáveis, principalmente pelo dano parassimpático ao
coração, embora também haja dano simpático precoce, mas
em menor grau (Tabelas 2-4).
Análise da pressão arterial sistólica
A PA é determinada principalmente pelo débito cardíaco
multiplicado pela resistência periférica. A inervação simpática
do coração controla a FC, a contratilidade ventricular e o
volume sistólico. A inervação cardiovagal não influencia a
contratilidade e o volume de ejeção, mas tem uma forte
influência sobre a FC por produzir bradicardia ou taquicardia
transitória quando sua atividade é suspensa. Os vasos
sanguíneos apresentam vasomoção a aproximadamente
0,1 Hz (a cada 10 segundos), mediada exclusivamente
pela inervação simpática. A variabilidade na AF da PA é
provavelmente transmitida apenas pelo coração, enquanto
que a variabilidade na BF está relacionada à variabilidade
na BF do coração e variabilidade na BF devida à vasomoção
induzida pelo sistema nervoso simpático. Portanto, na análise
espectral da PA, a predominância é simpática ou de BF.
Essa influência é vista em pacientes com fibrilação atrial,
nos quais não há nenhuma VFC, tanto de AF quanto de BF,
enquanto que a variabilidade da BF é mantida pela PA20.
As pressões basais nos grupos experimental e controle
estiveram dentro da faixa normal e não diferiram
significativamente entre si.
Na posição supina, obtivemos com o Finapres® valores
para a PAS média, DP, pressões máxima e mínima, PT, e BF
e AF que não diferiram significativamente. É importante
notar que em uma primeira análise basal não há nenhuma
diferença entre os grupos, o que os torna comparáveis nos
desafios de estimulação simpática (em pé e respiração
rítmica). Deve-se mencionar que a PA foi ligeiramente
maior no grupo diabético do que no grupo controle devido
à dominância de controle simpático (BF).
Durante a manobra em pé, a PAS foi maior em pacientes
diabéticos, tanto nos valores médios quanto máximo e
mínimo. A dominância, no entanto, ainda respeitou o
fator simpático das BFs e essa resposta foi ainda maior no
grupo controle. Isso pode indicar que a resposta vascular
Michel-Chávez e cols.
Variabilidade cardiovascular no diabetes de diagnóstico recente
Artigo Original
está preservada no grupo controle, que tem melhores
mecanismos de regulação da PA, enquanto que nos pacientes
diabéticos, a hiperatividade simpática para a vasculatura não
é completamente equilibrada pelo reflexo barorreceptor.
Na manobra de respiração rítmica, observamos uma
oscilação sustentada na inspiração e expiração na qual
um estímulo simpático domina sobre o parassimpático,
não excluindo o controle desse último pelos mecanismos
de SBR. Nessa manobra, a única significância estatística
foi encontrada na média da PAS no grupo com DM sobre
o grupo controle, e foi causada predominantemente pelo
fato de que no grupo de diabéticos as pressões máximas
se encontravam mais elevadas do que no grupo controle.
No domínio da frequência, as PTs e seus componentes BF
e AF não diferiram significativamente entre os grupos. Isso
acontece quando a integridade simpática e parassimpática
é mantida e é considerada uma resposta normal.
Na posição supina, a única diferença foi para valores mais
baixos na BF em diabéticos em comparação a controles,
enquanto a mesma taxa BF/AF era mantida. Isso significa uma
resposta menor devido à ausência do estímulo gravitacional.
Conclusões
Há uma diminuição na VFC nas posições supina e em pé
e durante respiração rítmica em indivíduos diabéticos com
menos de 2 anos de diagnóstico em comparação a indivíduos
controle, determinada pelo DP e pela análise da variabilidade
a curto prazo [FC (DP), DPNN, pNN50 (%)], provavelmente
associada a uma falha parassimpática.
Com un, os valores espectrais da FC foram os mesmos em
ambos os grupos. Em valores-padrão (sem un), os resultados
foram significativos. É possível que essa perda de variabilidade
aconteça com um equilíbrio simpático relativamente normal, o
que sugere que as variáveis de curto prazo possam ser úteis para
a avaliação da variabilidade em condições de bom equilíbrio
autonômico. Portanto, sugere‑se que essas variáveis possam ser
as primeiras a se alterarem no espectro do DM.
Não houve nenhuma diferença significativa na PAS em
pacientes diabéticos com diagnóstico recente na análise dos
domínios do tempo e da frequência. No entanto, a PAS na
posição em pé apresentou uma tendência a ser mais elevada
em diabéticos em comparação a controles, embora sem atingir
valores patológicos.
Quando em pé, esse padrão permanece, não havendo
diferença entre a pressão e a variabilidade por DP.
Uma diferença significativa foi obtida na PT estabelecida
pela dominância de BFs, onde o grupo controle apresentou
valores superiores devido a melhores respostas. No entanto,
essa resposta normal à estimulação da dominância simpática
persistiu e não afetou os valores medidos em mmHg.
Durante ortostatismo, a SBR esteve discretamente
diminuída em indivíduos diabéticos com diagnóstico recente
em comparação aos controles. Isso contrasta com a posição
supina, na qual não houve nenhuma diferença, provavelmente
devido à ausência de estresse gravitacional.
Na respiração rítmica, o efeito do estímulo simpático
dominou sobre o efeito parassimpático, mas na mesma
proporção das duas manobras anteriores; isso, novamente,
não modificou a PA média nem o DP. O exposto acima
mostra que houve integridade no controle simpático-vagal
em ambos os grupos, com respostas mais amplas no domínio
da frequência no grupo controle em relação ao diabético.
A análise da VFC mostra que em pacientes com DM de
início recente a VFC está diminuída. Essa constatação é
relevante, pois poucos estudos sobre VFC foram realizados
em pacientes com DM de início recente e mostram que
a neuropatia autonômica cardíaca aparece no início da
doença. O controle da PA é mais complexo pois envolve
atividade vagal e simpática para o coração e atividade
simpática para os vasos de resistência. O dano simpático
aos vasos sanguíneos é provavelmente preservado nas
fases iniciais da doença e pode ser afetado apenas nas
fases finais. Portanto, mais estudos ou técnicas diferentes
são necessários para demonstrar alterações da PA através
da análise dos domínios do tempo ou da frequência em
DM de início recente. Parece haver uma hiperatividade
simpática para os vasos sanguíneos de resistência nas fases
iniciais do DM, como mostrado pelo aumento da PA na
posição em pé, porém mais estudos são necessários para
elucidar essa questão.
Análise da sensibilidade do barorreflexo
Como descrito anteriormente, a análise da SBR é
derivada do quociente entre o IEB (expresso em ms) e a PAS
(em mmHg). Essa é uma tradução da resposta cardíaca para
registros de mudanças de pressão e envolve tanto o controle
simpático para efeitos cronotrópicos positivos frente à
queda da PA, quanto efeitos cronotrópicos negativos
pela via parassimpática quando há um aumento da PA
e necessidade de prolongamento no IEB. É importante,
portanto, destacar a resposta em duas manobras principais:
nas posições supina e em pé.
Nossos resultados demonstram que não há diferença
nas medidas basais na posição supina, mas há diferença
na manobra em pé, onde o grupo controle mostra uma
maior sensibilidade em relação aos pacientes diabéticos.
Isso ocorre porque a PAS em diabéticos era superior, e
como ela funciona como um quociente, tende a um número
menor. Esses achados poderiam sugerir uma resposta
parassimpática discretamente inferior no grupo diabético
quando comparado ao controle.
Limitações do estudo
Contribuição dos autores
Concepção e desenho da pesquisa: Michel-Chávez A,
Estañol B, Gien-López JA. Obtenção de dados: MichelChávez A, Robles-Cabrera A, Moreno-Morales R, BecerraLuna B. Análise e interpretação dos dados: Michel-Chávez
A, Gien-López JA, Robles-Cabrera A, Huitrado-Duarte ME,
Becerra-Luna B. Análise estatística: Michel-Chávez A, GienLópez JA, Robles-Cabrera A, Moreno-Morales R. Redação
do manuscrito: Michel-Chávez A, Estañol B, Gien-López JA,
Arq Bras Cardiol. 2015; 105(3):276-284
283
Michel-Chávez e cols.
Variabilidade cardiovascular no diabetes de diagnóstico recente
Artigo Original
Huitrado-Duarte ME. Revisão crítica do manuscrito quanto ao
conteúdo intelectual importante: Estañol B, Gien-López JÁ.
Supervisão / como investigador principal: Estañol B.
Potencial Conflito de Interesse
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo não teve fontes de financiamento externas.
Vinculação Acadêmica
Não há vinculação deste estudo a programas de
pós‑graduação.
Referências
1. World Health Organization. (WHO). Diabetes. Geneva: Switzerland.
[Cited in 2013 Jul 13]. Available from: http://www.who.int/topics/diabetes_
mellitus/es/
10. Bernardi L, Spallone V, Stevens M, Hilsted J, Frontoni S, Pop-Busui R, et
al. Methods of investigation for cardiac autonomic dysfunction in human
research studies. Diabetes Metab Res Rev. 2011;27(7):654-64.
2. Poanta L, Porojan M, Dumitrascu DL. Heart rate variability and diastolic
dysfunction in patients with type 2 diabetes mellitus. Acta Diabetol.
2011;48(3):191-6.
11. Touboul PJ, Vicaut E, Labreuche J, Acevedo M, Torres V, Ramirez-Martinez,
et al. Common carotid artery intima-media thickness: the Cardiovascular
Risk Factor Multiple Evaluation in Latin America (CARMELA) study results.
Cerebrovasc Dis. 2011;31(1):43-50.
3. Vinik AI, Erbas T. Diabetic autonomic neuropathy. Handb Clin Neurol.
2013;117:279-94.
4. Jyotsna VP, Sahoo A, Sreenivas V, Deepak KK. Prevalence and pattern of
cardiac autonomic dysfunction in newly detected type 2 diabetes mellitus.
Diabetes Res Clin Pract. 2009;83(1):83-8.
5. Spallone V, Ziegler D, Freeman R, Bernardi L, Frontoni S, Pop-Busui R,
et al. Cardiovascular autonomic neuropathy in diabetes: clinical impact,
assessment, diagnosis, and management. Diabetes Metab Res Rev.
2011;27(7):639-53.
6. Karayannis G, Giamouzis G, Cokkinos DV, Skoularigis J, Triposkiadis F.
Diabetic cardiovascular autonomic neuropathy: clinical implications. Expert
Rev Cardiovasc Ther. 2012;10(6):747-65.
7. Pop-Busui R, Low PA, Waberski BH, Martin CL, Albers JW, Feldman
EL, et al. Effects of prior intensive insulin therapy on cardiac autonomic
nervous system function in type 1 diabetes mellitus: the diabetes control
and complications trial/epidemiology of diabetes interventions and
complications study (DCCT/EDIC). Circulation. 2009;119(22):2886-93.
8. Valensi P, Pariès J, Attali JR. French group for research and study of diabetic
neuropathy. Cardiac autonomic neuropathy in diabetic patients: influence
of diabetes duration, obesity, and microangiopathic complications – the
French multicenter study. Metabolism. 2003;52(7):815-20.
9.
284
Metelka R. Heart rate variability - current diagnosis of the cardiac autonomic
neuropathy. A review. Biomed Pap Med Fac Univ Palacky Olomouc Czech
Repub. 2014;158(3):327-38.
Arq Bras Cardiol. 2015; 105(3):276-284
12. Kuehl M, Stevens MJ. Cardiovascular autonomic neuropathies as
complications of diabetes mellitus. Nat Rev Endocrinol. 2012;8(7):405-16.
13. Dimitropoulos G, Tahrani AA, Stevens MJ. Cardiac autonomic neuropathy
in patients with diabetes mellitus. World J Diabetes. 2014;5(1):17-39.
14. Ziegler D, Gries FA, Spuler M, Lessmann F. The epidemiology of diabetic
neuropathy. Diabetic Cardiovascular Autonomic Neuropathy Multicenter
Study Group. J Diabetes Complications.1992;6(1):49-57.
15. Brock C, Graversen C, Frøkjaer JB, Søfteland E, Valeriani M, Drewes
AM. Peripheral and central nervous contribution to gastrointestinal
symptoms in diabetic patients with autonomic neuropathy. Eur J Pain.
2012;17(6):820-31.
16. Vinik AI, Maser RE, Mitchell BD, Freeman R. Diabetic autonomic
neuropathy. Diabetes Care. 2003;26(5):1553-79.
17. Pop-Busui R. Cardiac autonomic neuropathy in diabetes: a clinical
perspective. Diabetes Care. 2010;33(2):434-41.
18. Freeman R. Assessment of cardiovascular autonomic function.Clin
Neurophysiol. 2006;117(4):716-30.
19. Vinik AI, Ziegler D. Diabetic cardiovascular autonomic neuropathy.
Circulation. 2007;115(3):387-97.
20. Rizzo MR, Sasso FC, Marfella R, Siniscalchi M, Paolisso P, Carbonara O.
Autonomic dysfunction is associated with brief episodes of atrial fibrillation
in type 2 diabetes. J Diabetes Complications. 2015;29(1):88-92.
Voltar ao Índice da Capa
Artigo Original
Experiência na Utilização de ECMO na Disfunção Primária de Enxerto
Pós-Transplante Cardíaco Ortotópico
Experience of ECMO in Primary Graft Dysfunction after Orthotopic Heart Transplantation
Elson Borges Lima, Claudio Ribeiro da Cunha, Vitor Salvatore Barzilai, Marcelo Botelho Ulhoa, Maria Regina de
Barros, Camila Scatolin Moraes, Letycia Chagas Fortaleza, Nubia Wellerson Vieira, Fernando Antibas Atik
Instituto de Cardiologia do Distrito Federal, Brasília, DF – Brasil
Resumo
Fundamento: A disfunção primária de enxerto é a principal causa de mortalidade precoce após o transplante cardíaco.
O uso de assistência circulatória mecânica tem sido empregado no tratamento dessa síndrome.
Objetivo: Descrever a experiência com o uso de oxigenação por membrana extracorpórea para tratamento de disfunção
primária de enxerto pós-transplante cardíaco.
Métodos: Entre janeiro de 2007 e dezembro de 2013, foram realizados 71 transplantes cardíacos ortotópicos em
pacientes com insuficiência cardíaca avançada. Destes, 11 (15,5%) pacientes apresentaram disfunção primária de
enxerto, os quais constituíram a população deste estudo. As manifestações da disfunção primária de enxerto na
nossa população foram falência no desmame da circulação extracorpórea em seis (54,5%) pacientes, instabilidade
hemodinâmica grave no pós-operatório imediato com disfunção cardíaca acentuada em três (27,3%) e pós-parada
cardíaca em dois (18,2%). O tempo de isquemia médio foi 151 ± 82 minutos. Assim que o diagnóstico de disfunção
primária de enxerto foi estabelecido, procedeu-se à instalação de suporte circulatório mecânico para estabilização de
quadro hemodinâmico grave, e a evolução dos pacientes foi estudada temporalmente.
Resultados: A duração média de assistência em oxigenação por membrana extracorpórea foi 76 ± 47,4 horas (variação
de 32 a 144 horas). O desmame com recuperação cardíaca obteve sucesso em nove (81,8%) pacientes. No entanto,
dois pacientes, que tiveram recuperação cardíaca, não sobreviveram à alta hospitalar.
Conclusão: O uso de assistência circulatória mecânica por meio de oxigenação por membrana extracorpórea central
promoveu recuperação cardíaca em poucos dias na maioria dos pacientes. (Arq Bras Cardiol. 2015; 105(3):285-291)
Palavras-chave: Oxigenação por Membrana Extracorpórea / métodos; Transplante Cardíaco; Disfunção Primária do
Enxerto / fisiopatologia; Cuidados Pós-Operatórios.
Abstract
Background: Primary graft dysfunction is the main cause of early mortality after heart transplantation. Mechanical circulatory support has been
used to treat this syndrome.
Objective: Describe the experience with extracorporeal membrane oxygenation to treat post-transplant primary cardiac graft dysfunction.
Methods: Between January 2007 and December 2013, a total of 71 orthotopic heart transplantations were performed in patients with advanced
heart failure. Eleven (15.5%) of these patients who presented primary graft dysfunction constituted the population of this study. Primary graft
dysfunction manifested in our population as failure to wean from cardiopulmonary bypass in six (54.5%) patients, severe hemodynamic instability
in the immediate postoperative period with severe cardiac dysfunction in three (27.3%), and cardiac arrest (18.2%). The average ischemia time was
151 ± 82 minutes. Once the diagnosis of primary graft dysfunction was established, we installed a mechanical circulatory support to stabilize the
severe hemodynamic condition of the patients and followed their progression longitudinally.
Results: The average duration of extracorporeal membrane oxygenation support was 76 ± 47.4 hours (range 32 to 144 hours). Weaning with cardiac
recovery was successful in nine (81.8%) patients. However, two patients who presented cardiac recovery did not survive to hospital discharge.
Conclusion: Mechanical circulatory support with central extracorporeal membrane oxygenation promoted cardiac recovery within a few days
in most patients. (Arq Bras Cardiol. 2015; 105(3):285-291)
Keywords: Extracorporeal Membrane Oxygenation / methods; Heart Transplantation; Primary Graft Dysfunction / physiopathology; Postoperative Care.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Fernando Antibas Atik •
Instituto de Cardiologia do Distrito Federal. SQNW 110, bloco J, apto. 308, Noroeste. CEP 70686-550, Brasília, DF – Brasil
E-mail: [email protected]; [email protected]
Artigo recebido em 12/10/14; revisado em 24/3/15; aceito em 10/4/15.
DOI: 10.5935/abc.20150082
285
Lima e cols.
ECMO pós-transplante cardíaco
Artigo Original
Introdução
A disfunção primária de enxerto (DPE) é uma síndrome
de disfunção cardíaca que ocorre no período pós-operatório
imediato após o transplante cardíaco, sendo a principal causa
isolada de morte nos primeiros 30 dias após o transplante1.
A etiologia da DPE inclui fatores inerentes ao receptor,
ao doador e ao cuidado perioperatório, sendo muito difícil
o controle de todos os fatores que possam levar à essa
catastrófica complicação.
A prevalência de DPE varia de 2,3 a 28% quando
s e a n a l i s a m e x p e r i ê n c i a s d e c e n t r o s i s o l a d o s 2-4.
Essas diferenças na prevalência são devidas, em parte,
à falta de sistematização dos critérios de diagnóstico,
que são baseados em definições individuais de cada
centro transplantador. Os fatores mais controversos na
definição se relacionam ao tempo de aparecimento,
a achados ecocardiográficos, a medidas hemodinâmicas,
ao requerimento de suporte circulatório mecânico e
aos fatores de exclusão, como rejeição, por exemplo.
Baseado nessas dificuldades, foi organizado recentemente
pela International Society for Heart & Lung Transplantation
um consenso sobre DPE após o transplante cardíaco5, a fim
de normatizar definições de diagnóstico e tratamento.
O conhecimento dos prováveis fatores de risco da DPE
norteou o desenvolvimento de um escore de risco6, que tem
sido validado em outras populações para a estimativa
adequada da síndrome. Recomendações preventivas no
cuidado do doador e do período perioperatório foram
recentemente publicadas como consenso entre especialistas5,
a fim de minimizar a ocorrência da DPE.
O tratamento da DPE é inicialmente clínico; já o suporte
circulatório mecânico é recomendado precocemente nos
casos mais graves, e normalmente envolve o uso de
assistência circulatória, com oxigenação por membrana
extracorpórea (ECMO) ou dispositivo de assistência
ventricular. Experiências de diversos centros 7,8 sugerem
melhora da sobrevidas precoce e tardia com essa
estratégia. No nosso meio, o uso de ECMO como
ressuscitação de distúrbios hemodinâmicos graves tem
sido pouco empregado 9 , não se tendo descrição na
literatura nacional de seu uso no pós-operatório do
transplante cardíaco.
O objetivo deste trabalho foi descrever a experiência com o
uso de ECMO para tratamento de DPE pós‑transplante cardíaco.
Métodos
Entre janeiro de 2007 e dezembro de 2013, foram realizados
71 transplantes cardíacos em pacientes com insuficiência
cardíaca avançada. Destes, 11 (15,5%) pacientes apresentaram
DPE, os quais constituíram a população do nosso estudo.
A idade média foi de 33,8 ± 20,7 anos (variação de 16 a
63 anos) e 7 (63,6%) eram do sexo masculino.
A definição de DPE pós-transplante seguiu o recente
consenso da International Society for Heart & Lung
Transplantation5, que a determinou como qualquer disfunção
do enxerto que ocorre em até 24 horas após o transplante.
Foi também classificada em DPE do ventrículo esquerdo
(VE), que incluiu as biventriculares, com três graduações de
gravidade, e em DPE do ventrículo direito (VD). As definições
exatas estão expressas no quadro 1. As causas secundárias de
disfunção de enxerto foram excluídas da definição, como,
por exemplo, rejeição hiperaguda, hipertensão pulmonar ou
complicações cirúrgicas.
Na nossa casuística, os pacientes apresentaram
instabilidade hemodinâmica grave, que ocorreu nas
primeiras 24 horas de pós-operatório, e foi secundária
à disfunção cardíaca documentada ao ecocardiograma.
Obrigatoriamente, a instabilidade hemodinâmica foi
irresponsiva à reposição volêmica, ao controle do ritmo e ao
uso de dois inotrópicos, caracterizando-se por baixo débito
cardíaco (índice cardíaco < 2 L/min/m2), com elevação
de pressões de enchimento (pressão capilar pulmonar
> 20 mmHg ou pressão venosa central > 15 mmHg) na
ausência de hipertensão pulmonar com disfunção ventricular
direita isolada secundária. Desse modo, todos os pacientes se
enquadraram na classificação de DPE-VE grave (Quadro 1).
As características detalhadas dos receptores e dos
doadores estão na tabela 1. Todos os pacientes eram
portadores de insuficiência cardíaca avançada, sendo seis
Quadro 1 – Classificação da disfunção primária de enxerto após o transplante cardíaco5
DPE-VE
DPE-VD
Leve: um dos critérios
Ecocardiograma: FEVE < 40% OU
Hemodinâmica: PVC > 15 mmHg, PCP > 20 mmHg, IC < 2 L/min/m2 persistentes por 1 hora
requerendo baixa dose de inotrópicos
Moderada: um critério de 1 e outro de 2
1. Ecocardiograma: FEVE < 40% OU
Hemodinâmica: PVC > 15 mmHg, PCP > 20 mmHg, IC < 2 L/min/m2, hipotensão com PAM < 70 mmHg
2. Escore inotrópico > 10 ou balão intra-aórtico
Grave
Dependência de assistência circulatória mecânica, excluindo balão intra-aórtico
Inclui 1 + 2, ou 3 isolado
1. PVC > 15 mmHg, PCP < 15 mmHg, IC < 2 L/min/m2
2. GTP < 15 mmHg E/OU PAS < 50 mmHg
3. Necessidade de assistência circulatória direita
DPE-VE: Disfunção primária de enxerto de ventrículo esquerdo; FEVE: Fração de ejeção de ventrículo esquerdo; PVC: Pressão venosa central; PCP: Pressão
capilar pulmonar; IC: Índice cardíaco; PAM: Pressão arterial média; DPE-VD: Disfunção primária de enxerto de ventrículo direito; GTP: Gradiente transpulmonar;
PAS: Pressão arterial sistólica.
286
Arq Bras Cardiol. 2015; 105(3):285-291
Lima e cols.
ECMO pós-transplante cardíaco
Artigo Original
Tabela 1 – Características pré-operatórias dos receptores e doadores de pacientes que evoluíram com disfunção primária de enxerto
pós‑transplante cardíaco
Dados dos receptores
Idade (anos)
Sexo masculino, n (%)
Média e desvio padrão
33,8 ± 20,7
7 (63,6)
Peso (kg)
51,5 ± 17,7
Altura (cm)
157,8 ± 27,4
Raça, n (%)
Branca
7 (63,6)
Parda
3 (27,3)
Negra
1 (9,1)
Tipo sanguíneo, n (%)
O
6 (54,5)
A
3 (27,3)
AB
2 (18,2)
Classe funcional (NYHA)
III
6 (54,4)
IV
5 (45,5)
Cirurgia cardíaca prévia
1 (9,1)
Acidente vascular cerebral prévio
1 (9,1)
Hipertensão arterial sistêmica
1 (9,1)
Diabetes melito
2 (18,2)
Cardiodesfibrilador implantável
8 (72,7)
Dados ecocardiográficos
Fração de ejeção (%)
28,5 ± 14,5
Diâmetro diastólico do VE (mm)
61,3 ± 11,1
Diâmetro sistólico do VE (mm)
53,8 ± 13,1
Volume do átrio esquerdo (mL)
97,9 ± 53,3
Dados hemodinâmicos
Pressão sistólica pulmonar (mmHg)
44,6 ± 11,9
Resistência vascular pulmonar (Wood)
2,2 ± 1,45
Dados dos doadores
Idade (anos)
Sexo masculino
26,6 ± 12,4
7 (63,6)
Peso (kg)
60,3 ± 17
Altura (cm)
165,4 ± 19
Raça
Branca
8 (72,7)
Parda
3 (27,3)
Tipo sanguíneo
O
8 (72,7)
A
2 (18,2)
B
1 (9,1)
NYHA: New York Heart Association; VE: Ventrículo esquerdo.
Arq Bras Cardiol. 2015; 105(3):285-291
287
Lima e cols.
ECMO pós-transplante cardíaco
Artigo Original
em classe funcional III e cinco em classe IV. Dois (18,2%)
pacientes estavam em estado de prioridade antes do
transplante em uso de agentes inotrópicos venosos. No que
se refere à etiologia da miocardiopatia, cinco (45,4%) eram
portadores de doença de Chagas, três de miocardiopatia
dilatada idiopática, um de miocardiopatia valvar, um de
miocardiopatia restritiva e outro de miocardiopatia periparto.
Oito (72,7%) pacientes tinham cardiodesfibriladores
implantáveis antes do transplante para prevenção secundária
de morte súbita e um (9,1%) havia sido submetido à cirurgia
cardíaca no passado.
Ao ecocardiograma pré-operatório, a fração de ejeção
média era de 28,5 ± 14,5% (variação de 14 a 32%) e
o diâmetro diastólico do VE era de 61,3 ± 11,1 mm
(variação de 37 a 74 mm). O cateterismo cardíaco direito
revelou que a resistência vascular pulmonar média era de
2,2 ± 1,5 unidades Wood (variação de 0,5 a 4,6 unidades
Wood). Nenhum dos pacientes apresentava anticorpos
pré-formados com titulação > 10%.
Os doadores eram predominantemente do sexo masculino
(n = 7; 63,6%) e a idade média foi de 26,6 ± 12,3 anos
(variação de 15 a 48 anos). As causas de morte dos doadores
foram traumatismo craniano em sete (63,6%), acidente vascular
cerebral hemorrágico em três (27,3%) e tumor cerebral em um.
Sete (63,6%) estavam em uso de noradrenalina contínua com
infusão > 0,1 mcg/kg/min no momento da captação.
A captação foi realizada predominantemente no mesmo
hospital do implante em seis (54,5%) casos e à distância
nos cinco casos restantes. Esses últimos foram realizados
nos Estados de Goiás, Minas Gerais, São Paulo, Paraná e
Rio Grande do Sul.
A solução cardioplégica utilizada na proteção do coração do
doador foi a de St. Thomas. Os corações foram transportados
em sacos plásticos estéreis repletos de soro fisiológico gelado
e acondicionados em geladeira térmica contendo gelo no
interior. Os protocolos de manejo intra e pós-operatório
foram aqueles padronizados na nossa instituição, uniformes
para todos os pacientes. Os transplantes foram realizados após
esternotomia mediana, heparinização sistêmica e instalação de
circulação extracorpórea, que foi conduzida com hipotermia
leve com hemofiltração modificada. O implante ocorreu com
a técnica bicaval em todos os pacientes. A proteção miocárdica
foi promovida por infusão de solução de St. Thomas a 4°C
por via anterógrada a cada 15 minutos durante o implante.
O tempo de isquemia médio foi 151 ± 82 minutos (variação
de 73 a 270 minutos), tendo sido de 82,8 ± 14,2 minutos
nas captações locais e 233 ± 35,4 minutos nas captações à
distância (p < 0,0001). O “limite” de 4 horas de isquemia
fria foi excedido em dois (18,2%) pacientes.
Assim que o diagnóstico de DPE foi estabelecido,
procedeu-se à instalação de suporte circulatório mecânico
para estabilização de quadro hemodinâmico e/ou
respiratório grave.
A descrição dos materiais do circuito, dos modos de
introdução das cânulas e do protocolo de condução
da ECMO se deu conforme a literatura específica10,11.
Em resumo, o circuito de ECMO utilizado foi composto por
288
Arq Bras Cardiol. 2015; 105(3):285-291
oxigenador de membrana oca de polimetilpentano, bomba
centrífuga e tubos tratados com material antiagregante
plaquetário. Todos os pacientes foram submetidos ao
mesmo equipamento durante o período do estudo.
A introdução das cânulas foi preferencialmente central,
na aorta ascendente e no átrio direito em nove (81,8%)
pacientes. A canulação do átrio esquerdo foi indicada
quando não houvesse adequada descompressão das
câmaras esquerdas avaliada por ecocardiograma e medida
direta de pressão do átrio esquerdo. Essa necessidade
ocorreu em todos os pacientes submetidos à ECMO central.
Os dois pacientes restantes foram submetidos ao implante
de ECMO por meio dos vasos femorais.
Heparina foi administrada previamente ao implante das
cânulas e de forma contínua quando o tempo de coagulação
ativado atingiu 250 segundos, a fim de mantê-lo entre 150 e
200 segundos. Todos os pacientes foram mantidos sedados,
sob ventilação mecânica orotraqueal e com o esterno aberto,
sendo uma membrana de silicone suturada nos bordos da
ferida operatória ou fechada a pele somente. O uso de balão
intra-aórtico concomitante foi feito rotineiramente como
suporte hemodinâmico durante o período de desmame da
assistência, indicado assim que houvesse sinais de início
de recuperação de função ao ecocardiograma. Quando o
balão intra-aórtico já havia sido implantado previamente a
ECMO, o mesmo foi mantido durante o suporte. O suporte
cardiopulmonar foi mantido com a intenção de recuperação e
desmame, de acordo com critérios clínicos e ecocardiográficos
diários. O suporte foi descontinuado em pacientes em que
se determinaram incapacidade de recuperação e sobrevida
limitada, de acordo com julgamento multidisciplinar.
As manifestações da DPE na nossa população foram
falência no desmame da circulação extracorpórea em seis
(54,5%) pacientes, instabilidade hemodinâmica grave no
pós-operatório imediato com disfunção cardíaca acentuada
em três (27,3%) pacientes, e pós-parada cardíaca em dois
(18,2%) pacientes. Mais especificamente, os pacientes
com síndrome pós-cardiotomia apresentavam disfunção
biventricular grave ao ecocardiograma, estavam com
doses máximas de pelo menos dois agentes inotrópicos
positivos e uso de balão intra-aórtico. Não apresentavam
pressão de pulso nem curva de ejeção ventricular ao
ecocardiograma. Já os pacientes com instabilidade
hemodinâmica no pós‑operatório apresentavam dados de
macro‑hemodinâmica compatíveis com choque cardiogênico
(índice cardíaco < 2 L/min/m2, pressão capilar pulmonar
> 20 mmHg, pressão venosa central > 15 mmHg), apesar
de pelo menos dois agentes inotrópicos em doses máximas,
documentação ecocardiográfica de disfunção ventricular
sistólica (fração de ejeção do VE < 40%) e hipotensão arterial
com necessidade de vasopressores. Os dois pacientes em que
a ECMO foi instalada como ressuscitação cardiopulmonar
evoluíram nas horas subsequentes à parada cardíaca com
choque cardiogênico, em que a conduta foi conservadora
de início, mas se mostrou ineficaz.
As características pré, intra e pós - operatórias
dos pacientes foram coletadas prospectivamente e
armazenadas em banco de dados eletrônico. A evolução
Lima e cols.
ECMO pós-transplante cardíaco
Artigo Original
clínica dos pacientes foi acompanhada temporalmente.
O estudo foi aprovado pela Comissão de Ética e Pesquisa
(CAAE 27039514.5.0000.0026), de acordo com as normas
de Helsinki.
Análise estatística
As variáveis categóricas foram expressas por meio de
frequências e percentagens, e as contínuas por meio de médias
e desvio padrão. A comparação das variáveis categóricas foi
realizada por meio do teste qui quadrado e, das contínuas,
pelo teste t de Student. A sobrevida atuarial foi determinada
pelo método de Kaplan-Meier. O nível de significância
estatística considerado foi de 5%, e o programa estatístico
utilizado foi o JMP para SAS versão 9.
Resultados
A duração média de assistência em ECMO foi de
76 ± 47,4 horas (variação de 32 a 144 horas). O desmame
com recuperação cardíaca obteve sucesso em nove (81,8%)
pacientes. Entretanto, dois pacientes que tiveram recuperação
cardíaca não sobreviveram até a alta hospitalar. Um paciente
teve complicações relacionada a acidente vascular cerebral
hemorrágico e outro devido à insuficiência de múltiplos
órgãos. A mortalidade hospitalar foi de 36,4%.
As principais morbidades, com as suas respectivas
frequências, foram listadas na tabela 2. Os principais
problemas no cuidado pós-operatório desses pacientes
foram insuficiência renal aguda com necessidade de
hemodiálise, acidente vascular cerebral, revisão cirúrgica
de hemostasia e pneumonia. Dos quatro pacientes que
apresentaram acidente vascular cerebral, somente um
obteve alta hospitalar com sequela motora em membro
inferior, que recuperou 6 meses após com tratamento
fisioterápico especializado. Dos sete pacientes que
evoluíram com necessidade de hemodiálise, quatro
obtiveram alta hospitalar com normalização da função
renal, e os outros três evoluíram a óbito.
A imunossupressão foi diferenciada dos demais
pacientes que não apresentaram disfunção de enxerto.
Rotineiramente, os pacientes que estavam em ECMO
receberam terapia de indução com timoglobulina associada
a corticosteroides. Os demais foram tratados com esquema
tríplice composto por inibidor de calcineurina (ciclosporina
ou tacrolimos), micofenolato de mofetil e corticosteroides.
A biópisa endomiocárdica realizada rotineiramente no
sétimo dia de pós-operatório revelou que somente um
(9,1%) paciente evoluiu com rejeição celular maior que 2R,
o que excluiu a possibilidade de rejeição hiperaguda como
causa secundária de disfunção cardíaca. Nenhum paciente
foi submetido à plasmaferese, e a pesquisa de rejeição
humoral por meio de imunofluorescência com pesquisa
de fragmentos do sistema complemento foi negativa em
todos os pacientes.
A mortalidade em 30 dias do nosso serviço foi de 9,8%,
tendo sido maior nos que evoluíram com DPE (36,4%)
quando comparada à dos que não tiveram essa complicação
(5%; p = 0,02). Os sobreviventes até a alta hospitalar
não apresentaram mortalidade no seguimento tardio.
A sobrevida atuarial aos 3 meses, 2 e 3 anos foi de 72,7%,
60,6% e 60,6%, respectivamente.
Embora o denominador seja pequeno para essa
análise, o desmame de ECMO obteve sucesso em todos
pacientes cuja ECMO foi instalada em decorrência de
choque pós‑cardiotomia no centro cirúrgico e instabilidade
hemodinâmica no pós-operatório, ao contrário daqueles
em que ela foi instalada pós-parada cardíaca (p = 0,004).
Da mesma forma, a mortalidade hospitalar foi maior
naqueles pós-parada cardíaca (100%), com instabilidade
hemodinâmica no pós-operatório (66,7%) que nos
pós‑cardiotomia (0%), com p = 0,01.
Discussão
O presente estudo procurou estudar uma grave
complicação que ocorre após o transplante cardíaco: a DPE.
Embora possam existir questionamentos em relação à sua
Tabela 2 – Mortalidade e morbidade no pós-operatório de transplante cardíaco que evoluíram com disfunção primária de enxerto submetidos
a implante de oxigenação por membrana extracorpórea
n (%)
Mortalidade hospitalar
4 (36,4)
Acidente vascular cerebral
4 (36,4)
Revisão cirúrgica de hemostasia
4 (36,4)
Sepse
3 (27,3)
Insuficiência renal aguda
7 (63,6)
Ventilação mecânica prolongada
-
Mediastinite
-
Marca-passo definitivo
1 (9,1)
Tempo de terapia intensiva (dias)*
8,5 (5,25 - 10,75)
Tempo de internação (dias)*
22,5 (5,75 - 45,25)
* Mediana (intervalo de confiança de 95%)
Arq Bras Cardiol. 2015; 105(3):285-291
289
Lima e cols.
ECMO pós-transplante cardíaco
Artigo Original
exata definição12, utilizamos recente critério diagnóstico5,
sendo a prevalência de DPE na nossa população de 15,5%.
Essa taxa é concordante com a de outras séries da literatura,
que variam de 2 a 26%1,5,8. Apesar de tentativas de controle
de seus fatores de risco mais frequentes6, a ocorrência
de DPE permanece elevada após o transplante cardíaco.
No entanto, sustentam-se as estratégias preventivas, que têm
sido focadas em melhor manutenção e escolha dos doadores,
métodos de preservação do coração em captações de longa
distância com tempo de isquemia prolongados, e melhor
proteção miocárdica durante o implante, entre outras.
A DPE constitui a principal causa de mortalidade inicial
após o transplante. A deterioração hemodinâmica causada
pelo choque cardiogênico por falência de bomba que não
responde ao uso de inotrópicos tem evolução catastrófica,
senão corrigida a tempo. Por esse motivo, no nosso serviço, os
pacientes transplantados são rotineiramente monitorizados no
intra e no pós-operatório com cateter de Swan-Ganz de débito
contínuo, que fornece, assim, os parâmetros hemodinâmicos
necessários em tempo real para a melhor tomada de decisão
terapêutica, aliado a outras variáveis de perfusão tecidual.
O uso de ecocardiograma transesofágico intraoperatório é
rotina na saída de circulação extracorpórea, a fim de fornecer
dados de dimensões e função biventricular, auxiliar na
estimativa da volemia, identificar eventuais defeitos cirúrgicos
residuais e verificar a função das valvas cardíacas. Caso haja
dificuldade no diagnóstico do choque no pós-operatório, o
ecocardiograma à beira do leito é muito elucidativo e deve ser
utilizado sempre que necessário, principalmente na suspeita
de disfunção cardíaca com parâmetros hemodinâmicos
indicativos de choque cardiogênico.
Os casos de DPE grave, como os representados no
quadro 1, que não respondem ao uso de inotrópicos e
controle do ritmo cardíaco, na ausência de tamponamento
cardíaco, devem ser prontamente tratados com o uso de
assistência circulatória mecânica. A instalação de ECMO
deve ser precoce 13, antes que se instale a disfunção
multiorgânica ou previamente à parada cardíaca, conforme
destacado na literatura14. Conforme descrevemos na nossa
experiência, quanto mais precoce foi o implante (centro
cirúrgico) melhores foram os resultados de possibilidade
de desmame e sobrevida. Os pacientes em que a ECMO
foi instalada em decorrência de parada cardíaca tiveram
má evolução e, certamente, o tempo de indicação correta
foi negligenciado.
O objetivo da assistência circulatória na DPE é
sempre a recuperação cardíaca. Assim, as características
do dispositivo ideal devem respeitar os seguintes
preceitos: ser rapidamente instalado; permitir o rápido
reestabelecimento do débito cardíaco, a fim de manter
a perfusão tecidual adequada e reverter a disfunção
multiorgânica; reduzir as pressões de enchimento
ventricular; promover a proteção miocárdica com aumento
do fluxo coronariano e redução do consumo de oxigênio,
além de estar associado a baixo índice de complicações.
Para que haja sucesso na recuperação, é importante
que o coração esteja descomprimido, pois a hipertensão
intracavitária limita a perfusão coronariana subendocárdica.
Na maioria dos nossos pacientes, não havia atividade elétrica
290
Arq Bras Cardiol. 2015; 105(3):285-291
e nem contrátil suficiente para a descompressão adequada
do VE. Após a documentação de pressões elevadas em átrio
esquerdo com distensão do VE, inserimos uma outra cânula de
drenagem em átrio esquerdo, cujo fluxo foi controlado ou até
interrompido na dependência de recuperação da função do
VE. O uso de balão intra-aórtico tem benefício documentado
na redução da resistência vascular sistêmica, o que auxilia na
recuperação ventricular esquerda, além de ser rotineiro no
desmame da ECMO.
Na nossa experiência, o uso de ECMO atendeu aos objetivos
desejados, promovendo a recuperação cardíaca na maioria
dos casos descritos, com aceitável índice de complicações
diante da gravidade do quadro clínico dos pacientes.
Obtivemos sucesso na retirada de ECMO com recuperação
cardíaca em 81,8% dos pacientes após 76 horas em média;
resultados estes compatíveis com os de outros centros
internacionais8,14-16. Os principais problemas encontrados
no pós-operatório foram insuficiência renal aguda, acidente
vascular cerebral e revisão cirúrgica de hemostasia. A primeira
complicação é frequente14, secundária a múltiplos fatores
agressores (choque, drogas nefrotóxicas e congestão venosa
sistêmica), além da síndrome cardiorrenal pré-transplante.
Todos os pacientes recuperaram a função renal após algumas
sessões de hemodiálise, conforme já descrito por Listijono
e cols.15. As duas últimas complicações têm relação com a
necessidade de anticoagulação durante a ECMO, cujo controle
é por vezes difícil de ser alcançado. Fatores complicadores
são cirurgia cardíaca recente, presença de choque com
disfunção hepática concomitante e eventual coagulação
intravascular disseminada. O uso excessivo de hemoderivados
é um fator complicador na sensibilização imunológica,
congestão sistêmica incluindo o fígado com potencialização
do sangramento, além da indução de hipertensão pulmonar.
O uso de circuitos revestidos de heparina, antifibrinolíticos,
técnica cirúrgica cuidadosa, manutenção da estabilidade
hemodinâmica com descompressão venosa sistêmica e
derivados sintéticos dos fatores de coagulação é importante
na minimização dessas complicações. Tais medidas têm sido
empregadas rotineiramente no nosso serviço. Pacientes que
evoluíram com acidente vascular cerebral apresentaram
elevada mortalidade hospitalar. Aqueles que sobreviveram
apresentaram recuperação completa da atividade motora,
o que não limitou sua qualidade de vida.
A causa da DPE na nossa experiência não teve
relação com rejeição grave documentada por biópsia
endomiocárdica rotineira na primeira semana, sendo que
somente um paciente apresentou rejeição celular maior
que 2R. Independentemente da completa recuperação
cardíaca, que ocorreu nos que foram desmamados de
ECMO, estes pacientes são graves e o acometimento de
múltiplos órgãos está associado à elevada mortalidade,
conforme demonstrado na nossa experiência e de acordo
com outras experiências de pacientes tratados com choque
pós-cardiotomia16. Há, portanto, necessidade de intensificar
cuidados intensivos nessa população, focando no manejo
sistemático de órgãos e sistemas e combate a sepse.
Apesar da experiência com ECMO na DPE ser bem
descrita na literatura, alguns grupos 17,18 descrevem
dispositivos de assistência ventricular de curta duração
Lima e cols.
ECMO pós-transplante cardíaco
Artigo Original
como opção de tratamento. As vantagens da ECMO
seriam suporte biventricular em todos os casos, suporte
pulmonar, menores complicações tromboembólicas, e
maior facilidade e rapidez na instalação. Por último, mas
não menos importante especialmente no nosso meio, está
o custo da ECMO ser bem menor que de outros dispositivos
de assistência ventricular.
Este trabalho descritivo apresentou algumas limitações,
como o número limitado de pacientes do grupo de estudo
e a ausência de um controle. Entretanto, consideramos que
o estabelecimento de um grupo controle estivesse envolvido
com dilemas éticos importantes, já que não poderíamos
comparar com um grupo sem o uso de ECMO, pela elevada
mortalidade com o tratamento clínico. Até o momento, não
dispúnhamos de outros dispositivos de assistência ventricular
que pudessem ser comparados a ECMO. Não listamos nem
analisamos os fatores de risco de DPE após o transplante
cardíaco, o qual será objetivo de estudo futuro, assim
que obtivermos número mais expressivo de pacientes que
permita uma análise estatística mais robusta.
recuperação cardíaca em poucos dias na maioria dos pacientes
que apresentaram disfunção primária de enxerto após o
transplante cardíaco.
Contribuição dos autores
Concepção e desenho da pesquisa: Lima EB, Cunha CR,
Atik FA. Obtenção de dados: Lima EB, Barros MR, Moraes
CS, Fortaleza LC. Análise e interpretação dos dados: Lima EB,
Cunha CR, Barzilai VS, Ulhoa MB, Barros MR, Fortaleza LC,
Atik FA. Análise estatística: Moraes CS, Atik FA. Redação do
manuscrito: Lima EB, Atik FA. Revisão crítica do manuscrito
quanto ao conteúdo intelectual importante: Cunha CR, Barzilai
VS, Ulhoa MB, Barros MR, Fortaleza LC, Vieira NW, Atik FA.
Potencial Conflito de Interesse
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo não teve fontes de financiamento externas.
Conclusão
O uso de assistência circulatória mecânica por meio de
oxigenação por membrana extracorpórea central promoveu
Vinculação Acadêmica
Não há vinculação deste estudo a programas de pós‑graduação.
Referências
1.
Iyer A, Kumarasinghe G, Hicks M, Watson A, Gao L, Doyle A, et al. Primary
graft failure after heart transplantation. J Transplant. 2011;2011:175768.
10. Duncan BW. Mechanical support for cardiac and respiratory failure in
pediatric patients. New York (NY): Marcel Dekker, Inc; 2001.
2. Russo MJ, Iribarne A, Hong KN, Ramlawi B, Chen JM, Takayama H, et al.
Factors associated with primary graft failure after heart transplantation.
Transplantation. 2010;90(4):444-50.
11. Caneo LF. Condutas na ECMO. In: Auler Jr JO, Oliveira SA. Pós-operatório
de cirurgia torácica e cardiovascular. Porto Alegre: Artmed; 2004.
p. 280‑302.
3.
Lima B, Rajagopal K, Petersen RP, Shah AS, Soule B, Felker GM, et al. Marginal
cardiac allografts do not have increased primary graft dysfunction in alternate
list transplantation. Circulation. 2006;114(1 Suppl):I27-32.
12. Zuckermann A, Aliabadi A. Primary graft failure - the stepchild of cardiac
transplantation. Eur J Cardiothorac Surg. 2011;40(4):969-70.
4.
Ibrahim M, Hendry P, Masters R, Rubens F, Lam BK, Ruel M, et al. Management
of acute severe perioperative failure of cardiac allografts: a single-center
experience with a review of the literature. Can J Cardiol. 2007;23(5):363-7.
5. Kobashigawa J, Zuckermann A, Macdonald P, Leprince P, Esmailian F, Luu
M, et al. Report from a consensus conference on primary graft dysfunction
after cardiac transplantation. J Heart Lung Transplant. 2014;33(4):327-40.
6. Cosio Carmena MD, Gomez Bueno M, Almenar L, Delgado JF, Arizon JM,
Gonzalez Vilchez F, et al. Primary graft failure after heart transplantation:
characteristics in a contemporary cohort and performance of the RADIAL
risk score. J Heart Lung Transplant. 2013;32(12):1187-95.
7. Karavana M, Sinha P, Naka Y, Oz M, Edwards N. Mechanical circulatory
support: mechanical support for the failing cardiac allograft: a single center
experience. J Heart Lung Transplant. 2003;22(5):542-7.
8.
13. Marasco S, Esmore D, Negri J, Rowland M, Newcomb A, Rosenfeldt F, et
al. Early institution of mechanical support improves outcomes in primary
cardiac allograft failure. J Heart Lung Transplant. 2005;24(12):2037-42.
14. Kittleson M, Patel J, Moriguchi J, Kawano M, Davis S, Hage A, et al. Heart
transplant recipients supported with extracorporeal membrane oxygenation:
outcomes from a single-center experience. J Heart Lung Transplant.
2011;30(11):1250-6.
15. Listijono D, Watson A, Pye R, Keogh A, Kotlyar E, Spratt P, et al. Usefulness
of extracorporeal membrane oxygenation for early cardiac allograft
dysfunction. J Heart Lung Transplant. 2011;30(7):783-9.
16. Rastan AJ, Dege A, Mohr M, Doll N, Falk V, Walther T, et al. Early and late
outcomes of 517 consecutive adult patients treated with extracorporeal
membrane oxygenation for refractory postcardiotomy cardiogenic shock.
J Thorac Cardiovasc Surg. 2010;139(2):302-11.
D`Allessandro C, Aubert S, Golmard JL, Praschker B, Luyt C, Paive A, et al. Extracorporeal membrane oxygenation temporary support for early graft failure after
cardiac transplantation. Eur J Cardiothorac Surg. 2010;37(2):343-9.
17. Marasco S, Vale M, Pellegrino V, Preovolos A, Leet A, Kras A, et al.
Extracorporeal membrane oxygenation in primary graft failure after heart
transplantation. Ann Thorac Surg. 2010;90(5):1541-7.
9. Colafranceschi AS, Monteiro AJ, Canale LS, Campos LA, Montera MW,
Silva PR, et al. Assistência circulatória com oxigenação por membrana
extracorpórea (ECMO) no adulto: um conceito falido ou esquecido?
Arq Bras Cardiol. 2008;91(1):36-41.
18. Taghavi S, Zuckermann A, Ankersmit J, Wieselthaler G, Rajek A, Laufer G,
et al. Extracorporeal membrane oxygenation is superior to right ventricular
assist device for acute right ventricular failure after heart transplantation.
Ann Thorac Surg. 2004;78(5):1644-9.
Arq Bras Cardiol. 2015; 105(3):285-291
291
Voltar ao Índice da Capa
Artigo Original
Redução da Pressão Capilar Pulmonar após Transplante Cardíaco:
Complacência Pulmonar e Efeito Resistência
Lowering Pulmonary Wedge Pressure after Heart Transplant: Pulmonary Compliance and Resistance Effect
Nádia Moreira1, Rui Baptista2, Susana Costa1, Fátima Franco1, Mariano Pêgo1, Manuel Antunes2
Centro Hospitalar e Universitário de Coimbra - Hospitais da Universidade de Coimbra1, Faculdade de Medicina da Universidade de Coimbra2 – Portugal
Resumo
Fundamento: A pós-carga do ventrículo direito (VD) é um fator de risco importante para avaliar a mortalidade decorrente
de transplante cardíaco (HTx) e resulta da interação entre a resistência vascular pulmonar (RVP) e a complacência
pulmonar (CPA). Acredita-se que o produto da interação, o RC-time, seja constante. Entretanto, é exceção a hipertensão
pulmonar devido às elevadas pressões de preenchimento do ventrículo esquerdo (VE).
Objetivos: Ao utilizar o HTx como modelo para redução crônica das pressões de preenchimento do VE, nosso objetivo
foi avaliar as variações nos componentes pós-carga do VD após o transplante.
Métodos: Foram estudados, retrospectivamente, 159 pacientes com cateterismo cardíaco direito realizado antes e após
o HTx. O impacto do HTx nas variáveis hemodinâmicas foi avaliado.
Resultados: A maioria dos pacientes foi do sexo masculino (76%) e a média de idade foi 53 ± 12 anos. O HTx teve um efeito
significativo na hemodinâmica, com normalização do VE e das pressões de preenchimento de VD e no aumento significativo
do débito cardíaco e da freqüência cardíaca (FC). A RVP diminuiu 56% e a CPA aumentou 86%. Em vez de aumentar como
era esperado, o RC-time não alterou significativamente e teve papel secundário em relação à normalização da pressão capilar
pulmonar (PECP) após o HTx. O aumento esperado no RC time com PWP reduzido foi atenuado pelo aumento da FC (devido
à denervação autonômica do coração). Esse efeito ocorreu independentemente da diminuição da PCP.
Conclusões: O RC-time permaneceu inalterado após HTx, entretanto a PECP diminuiu significativamente. O aumento
da FC pode ter impacto importante no RC-time e na pós-carga do VD. O estudo dessas interações pode ser de grande
valor para avaliar os candidatos HTx e explicar a falência do VD ocorrida logo após o HTx. (Arq Bras Cardiol. 2015;
105(3):292-300)
Palavras-chave: Transplante de Coração; Pressão Propulsora Pulmonar / fisiologia; Complacência Pulmonar; Resistência Vascular.
Abstract
Background: Right ventricular (RV) afterload is an important risk factor for post-heart transplantation (HTx) mortality, and it results from the
interaction between pulmonary vascular resistance (PVR) and pulmonary compliance (CPA). Their product, the RC time, is believed to be
constant. An exception is observed in pulmonary hypertension because of elevated left ventricular (LV) filling pressures.
Objectives: Using HTx as a model for chronic lowering of LV filling pressures, our aim was to assess the variations in RV afterload components
after transplantation.
Methods: We retrospectively studied 159 patients with right heart catheterization before and after HTx. The effect of Htx on hemodynamic
variables was assessed.
Results: Most of the patients were male (76%), and the mean age was 53 ± 12 years. HTx had a significant effect on the hemodynamics,
with normalization of the LV and RV filling pressures and a significant increase in cardiac output and heart rate (HR). The PVR decreased by
56% and CPA increased by 86%. The RC time did not change significantly, instead of increasing secondary to pulmonary wedge pressure
(PWP) normalization after HTx as expected. The expected increase in RC time with PWP lowering was offset by the increase in HR (because of
autonomic denervation of the heart). This effect was independent from the decrease of PWP.
Conclusions: The RC time remained unchanged after HTx, notwithstanding the fact that pulmonary capillary wedge pressure significantly
decreased. An increased HR may have an important effect on RC time and RV afterload. Studying these interactions may be of value to the
assessment of HTx candidates and explaining early RV failure after HTx. (Arq Bras Cardiol. 2015; 105(3):292-300)
Keywords: Heart Transplantation; Pulmonary Wedge Pressure / physiology; Lung Compliance; Vascular Resistance.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Nádia Moreira •
Hospitais da Universidade de Coimbra. Rua Cidade de Santos, 66/67, 1º Dto, 3000-112 Coimbra, Monte Formoso. CEP 3000-112, Coimbra,
Beira Litoral – Portugal
E-mail: [email protected]
Artigo recebido em 22/12/14; revisado em 15/05/15; aceito em 18/05/15.
DOI: 10.5935/abc.20150083
292
Moreira e cols.
RC-time após transplante cardíaco
Artigo Original
Introdução
O transplante cardíaco (HTx) constitui o tratamento
de escolha para pacientes com insuficiência cardíaca em
fase terminal (IC)1. A elegibilidade do candidato para HTx
é fortemente determinada pela gravidade da hipertensão
pulmonar pré-existente (HP). A HP pode ser secundária
em relação à elevação das pressões de preenchimento do
ventrículo esquerdo (VE), mas também pode ser associada
com a presença de doença vascular pulmonar. Enquanto a
primeira é completamente reversível com o HTx, a última
pode ter um componente fixo e causar efeitos detrimentais
sobre a função do ventrículo direito do doador (VD).
De fato, o aumento da pós-carga no VD é provavelmente
o fator de risco mais importante para a morbidade precoce
ocorrida após o HTx2-5.
A pós-carga hidráulica no VD é o resultado dos efeitos
combinados de um componente fixo/estável, definido como
resistência vascular pulmonar (RVP), um componente pulsátil/
oscilatório, geralmente refletido pela complacência arterial
pulmonar (CPA)6. A interação dinâmica entre o RVP e a CPA
determina a pós-carga no VD e de seu produto (o RC time)
considerado como sendo constante tanto na saúde quanto na
doença, antes e após intervenções terapêuticas7-10.
Uma notável exceção dessa relação inversa constante
entre a CPA e a RVP é observada na HP devido às pressões de
preenchimento elevadas do VE11. Uma pressão capilar pulmonar
elevada (PECP) diminui o RC-time porque simultaneamente
(i) aumenta a rigidez arterial pulmonar (diminuindo, por
conseguinte, a CPA) e (ii) diminui o gradiente transpulmonar
(GTP) (portanto, reduzindo a RVP). Consequentemente, a
CPA diminui proporcionalmente mais do que o aumento
correspondente na RVP12. Tivemos como objetivo, neste estudo,
avaliar as variações de diversos componentes pós-carga no VD
(RVP, CPA e RC time) antes e após a cirurgia, usando o HTx
como modelo para redução crônica e definitiva das pressões
de preenchimento do VE.
Métodos
População de estudo
Este estudo foi aprovado pelo nosso conselho de revisão
institucional. Duas populações foram incluídas: uma
população grande, não selecionada, de pacientes submetidos
a cateterismo cardíaco direito (CCD), definida como coorte 1,
e uma população de pacientes HTx, definida como coorte 2.
O coorte 1 realizado em nosso hospital entre 2006 e
2011, incluiu um coorte retrospectivo de 1797 pacientes
consecutivos que receberam CCD por suspeita de HP ou por
serem portadores de doença valvar grave.
O coorte 2 incluiu todos os pacientes submetidos a
HTx em nosso centro, matriculados em um programa de
acompanhamento sistemático e prospectivo, que incluiu o
CCD realizado, pelo menos, 6 meses antes do HTx e 1 ano
após. O pré CCD para HTx avalia a elegibilidade e a ausência
de uma RVP alta que, em caso afirmativo, se opõe à prática
do HTx. Após 1 ano do HTx, o CCD é realizado durante
biópsia endomiocárdica programada (EMB) e de angiograma
coronário. Entre novembro de 2003 a agosto de 2013, um total
de 236 HTx foram realizados. Destes pacientes, 30 morreram
antes da EMB programada para o período de 1 ano e, portanto,
os dados do CCD não estiveram disponíveis. Dos 201 pacientes
restantes, 159 tiveram seus dados hemodinâmicos completos
com débito cardíaco disponíveis.
Procedimentos de cateterismo cardíaco direito
Todos os procedimentos para CCD foram realizados em
repouso, em decúbito dorsal, via veia femoral com uma
guia fluoroscópica executados por um cardiologista clínico
ou intervencionista especializado em IC. Todos os traçados
de pressão foram manualmente revisados por um clínico
com conhecimentos avançados em IC e um cirurgião.
Os pacientes encontravam-se em terapia médica ideal para
IC. As medições de pressão foram feitas com cateteres 7F
com a ponta equipada com balão preenchido com fluido no
final da expiração e registrado em uma estação de trabalho.
Os seguintes parâmetros hemodinâmicos foram medidos ou
calculados: PCP; média, pressão arterial pulmonar sistólica
e diastólica (PAPm, PAPs, PAPd) e pressão arterial sistêmica;
pressão diastólica final do VE; frequência cardíaca (FC);
pressão de pulso pulmonar (PP); CO (calculado pelo método
de Fick); volume sistólico (VS), (obtido através da divisão do
débito cardíaco pela FC); pressão atrial direita.
Resistência vascular pulmonar, Complacência e RC-time
A RVP foi calculada como [(PAPm - PECP) / CO] e expressa
em mmHg · s · mL-1. Quando os traçados da PECP eram de
má qualidade ou estavam ausentes, a pressão diastólica final
do VE foi utilizada em seu lugar. A CPA foi estimada dividindo
o VS pelo aumento correspondente na pressão da artéria
pulmonar (PP) = VS / PP, em mL · mm Hg-1. O RC-time é a
RVP · CPA, expresso em segundos.
Análise estatística
Os dados contínuos são apresentados como média
(desvio padrão). Todos os parâmetros hemodinâmicos
foram dicotomizados de acordo com dados da literatura.
Os ajustes de curva (linear ou não-linear) foram gerados
e análise estatística foi realizada por meio de regressão.
ANOVA foi utilizada para comparar os coortes diferentes;
comparações antes e depois de HTx foram realizadas
utilizando teste-t para amostras pareadas. A significância
estatística foi fixada no nível p < 0,05. Um software
estatístico, comercialmente disponível, foi utilizado (SPSS
13.0 e Stata 12.0). Os gráficos foram realizadas utilizando
GraphPad Prism 5.0 e STATA 12.0.
Resultados
Características dos pacientes
A população do nosso estudo consistiu de duas coortes.
Os dados demográficos e hemodinâmicos estão resumidos
na Tabela 1.
Arq Bras Cardiol. 2015; 105(3):292-300
293
Moreira e cols.
RC-time após transplante cardíaco
Artigo Original
Tabela 1 – Características demográficas e hemodinâmicas
Sexo masculino, n (%)
População Total (n = 1797)
Pre - HTx (n = 159)
Post - HTx (n = 159)
Valor de p
1063 (59,2)
121 (76,1)
-
-
Idade (anos)
61 (14)
53 (12)
-
-
FC (min-1)
77 (16)
75 (17)
84 (12)
< 0,001
PAPs(mmHg)
44 (20)
46 (16)
31 (8)
< 0,001
PAPd (mmHg)
17 (9)
20 (8)
11 (5)
< 0,001
PAPm (mmHg)
28 (13)
30 (10)
20 (5)
< 0,001
pressão de pulso PP (mmHg)
27 (14)
26 (10)
20 (6)
< 0,001
pressão arterial PA (mmHg)
8 (5)
8 (6)
6 (3)
< 0,001
Média da pressão PECP (mmHg)
17 (9)
20 (8)
11 (5)
< 0,001
Pressão diastólica final do VE (mmHg)
18 (8)
20 (9)
15 (5)
< 0,001
GTP (mmHg)
11 (9)
10 (5)
9 (4)
0,041
DC (L.min )
4,3 (1,6)
3,5 (1,0)
5,8 (1,8)
< 0,001
VS (mL)
57 (23)
48 (17)
70 (23)
< 0,001
PAS, média (mmHg)
89 (17)
75 (11)
98 (13)
< 0,001
Saturação venosa mixta (%)
67 (9)
61 (8)
71 (8)
< 0,001
0,19 (0,21)
0,18 (0,11)
0,10 (0,06)
< 0,001
-1
RVP (mmHg.S.mL-1)
CPA (mL.mmHg )
-1
RC time (segundos)
2,7 (2,2)
2,1 (1,2)
3,9 (1,9)
< 0,001
0,33 (0,18)
0,32 (0,17)
0,33 (0,14)
0,581
HTx: Transplante cardíaco; FC: Frequência cardíaca; PAPs: Pressão arterial pulmonar sistólica; PAPd: Pressão arterial pulmonar diastólica; PAPm: Pressão arterial
pulmonar média; AP: Artéria pulmonar; AD: Átrio direito; PECP: Pressão de encravamento capilar pulmonar; VE: Ventrículo esquerdo; GTP: Gradiente Transpulmonar;
DC: Déficit cardíaco; VS: Volume sistólico; PAS: Pressão arterial sistólica; RVP: Resistência vascular pulmonar; CPA: Complacência arterial pulmonar.
Coorte 1
Os pacientes que faziam parte do coorte 1 eram em sua
maioria homens (60%) e a média de idade foi de 61 (14) anos.
A maioria deles tinha HP [PAPm 28 (13) mmHg]. A média de
PVR foi de 0,19 (0,21) mm Hg · s · mL-1 e a média de CPA foi
de 2,7 (2,2) ml · mmHg-1. A média de RC time foi de 0,33 (0,18)
segundos. Encontramos uma relação inversa entre a RVP e a
CPA, conforme já esperado (Figura 1, painel esquerdo).
Acreditava-se que a idade tivesse efeito sobre a relação
RVP‑CPA, da mesma forma que os vasos poderiam tornar-se
menos complacentes, de forma semelhante à da circulação
sistêmica. No entanto, ao separar os pacientes de acordo com
a idade, descobrimos que a mesma não teve impacto sobre
a relação RVP-CPA (Figura 1, painel direito). Ao contrário, a
PCP teve efeito significativo sobre a relação RVP-CPA, com
maior PECP acarretando a diminuição de CPA para cada nível
de RVP (Figura 2).
Não só a PECP teve efeito no RCtime; a FC também pode
modular esta variável15. Encontramos um efeito contínuo
do RCtime na FC, um tempo menor de RC com uma FC
mais rápida, como era esperado (Figura 3, painel esquerdo).
Isto também é mostrado na Figura 3 (painel direito): a FC
mais baixa está também relacionada à alteração na relação
PAPs / PAP (Ksys) e PAPd / PAPm (Kdia). Um RC-time fixo produziria
uma relação fixa; como é mostrado na figura 3. Há uma
divergência entre as proporções Ksys e Kdia, quando a FC abaixa,
sinalizando uma mudança no RC-time em relação à FC. Se o RC
time for constante com variação na FC, as linhas seriam paralelas.
294
Arq Bras Cardiol. 2015; 105(3):292-300
Coorte 2
Os pacientes HTx tiveram uma média de idade de 53 (12) anos
e eram em sua maioria do sexo masculino. Como esperado, o
HTx teve um efeito muito significativo sobre a hemodinâmica.
A CO aumentou em mais de 2 L · min-1 e as pressões de
preenchimento do VD e do VE voltaram à normalidade. A RVP
diminuiu significativamente para 0,10 mm Hg · s · mL-1, ao passo
que, a CPA aumentou em cerca de 78% (para 3,9 mL · mm Hg-1).
A FC aumentou consideravelmente em cerca de 10 batimentos
por minuto, refletindo a denervação autonômica do coração
implantado (Tabela 1).
Em seguida, examinamos a relação entre RVP e CPA
antes e depois do HTx. O RC-time não foi alterado de forma
significativa (0,32 a 0,33 segundos, p = 0,581), apesar da PCP
cair de 20 para 11 mmHg (p < 0,001) (Figura 4).
Se o RC-time permaneceu constante após o HTx, então,
a proporção entre as pressões PAPs e PAPm (Ksys), e PAPd
e PAPm (Kdia) também deveriam ser mantidas. Na verdade,
como demonstramos na Figura 5, os declives de Ksys e Kdia
são semelhantes antes e depois do HTx, sugerindo, de
uma outra maneira, que o RC-time não alterasse com o
procedimento cirúrgico.
Se controlarmos a FC sobre o impacto do HTx no
RC-time, poderemos observar que, se a FC permanece
constante antes e depois do HTx, um aumento significativo
no RC -time poderia ocorrer (Figura 6). Ao avaliar
simultaneamente o efeito da PCP no RC-time e na FC,
observa-se que, à medida que a PECP e a FC diminuem, há
Moreira e cols.
RC-time após transplante cardíaco
Artigo Original
Figura 1 – Painel esquerdo. Há uma relação hiperbólica inversa entre a resistência vascular pulmonar (RVP) e a complacência arterial pulmonar (CPA) em pacientes do
coorte 1. Painel direito. Efeito da idade na relação entre log[resistência vascular pulmonar (RVP)] e log[complacência arterial pulmonar (CPA)] no coorte 1, com idade
dividida em três subgrupos. Não há diferença entre as inclinações das linhas de regressão (p = 0,996).
Figura 2 – Painel esquerdo superior. Efeito da pressão capilar pulmonar (PECP) sobre a relação entre a resistência vascular pulmonar (RVP) e a complacência arterial
pulmonar (CPA), com PECP agrupadas em três subgrupos, em pacientes do coorte 1. Painel superior direito. Log [RVP] versus log[CPA]. Há uma diferença significativa
entre as inclinações das linhas de regressão (p < 0,001).
um aumento do RC-time, como esperado. Tal achado pode
ser evidenciado através de dados obtidos pré HTx (linhas
pretas). Entretanto, o aumento do RC-time e a redução de
PCP ficam, de certa forma, anulados pelo aumento da FC
observada após HTx (Figura 7).
Discussão
Este estudo demonstra, pela primeira vez, que numa
população de HTx existe uma relação inversa entre CPA
e RVP. Sabe-se que as intervenções com o objetivo de
reduzir as pressões do VE deveriam aumentar o RC‑time.
No entanto, em nosso coorte de pacientes HTx, não
observamos qualquer variação no RC-time ocorrida antes ou
depois de HTx, portanto, não refletindo o efeito esperado
de uma diminuição das pressões de preenchimento do VE.
Esta variação neutra pode ser causada por uma perda de
complacência ao longo da extensão das artérias pulmonares
devido às pressões de preenchimento elevadas e prolongadas
no VE ou pode existir decorrente da elevada FC secundária
à denervação cardíaca após o transplante, resultando numa
carga maior no VD e uma PECP muito baixa.
Arq Bras Cardiol. 2015; 105(3):292-300
295
Moreira e cols.
RC-time após transplante cardíaco
Artigo Original
0,5
RC-time
0,4
0,3
0,2
0,1
0
0
50
100
150
200
Frequência cardíaca
Valores ajustados
95% IC
Índice Arterial
2
1.5
1
0.5
0
50
100
150
200
Frequência cardíaca
95% IC
Valores ajustados
Valores ajustados
Figura 3 – Painel esquerdo. Efeito da frequência cardíaca (em batimentos por minuto) no RC time (em segundos) no coorte 1, com intervalos de confiança de 95%.
Na regressão linear, há uma associação significativa entre o aumento da frequência cardíaca e a diminuição no RC time (p < 0,001). Painel direito. Efeito da frequência
cardíaca na relação entre as pressões sistólica e arterial pulmonar média (PAPs/PAPm – Ksys) (linha superior, em azul) e pressões diastólica e arterial pulmonar média
(PAPd/PAPm –Kdia) (linha inferior, em verde) em pacientes do coorte 1, com intervalos de confiança de 95%. A frequência cardíaca afeta claramente os índices de
pressão, demonstrando, portanto, que o RC-time não é constante quando a frequência cardíaca está mudando.
296
Arq Bras Cardiol. 2015; 105(3):292-300
Moreira e cols.
RC-time após transplante cardíaco
Artigo Original
Figura 4 – Efeito do transplante cardíaco na relação entre a resistência vascular pulmonar (RVP) e a complacência arterial pulmonar (CPA) antes (diamantes negros)
e após o transplante cardíaco (HTx) (pontos vermelhos). Painel esquerdo. RVP versus CPA. Painel direito. Log[RVP] versus log[CPA]. As inclinações das linhas de
regressão não são significativamente diferentes (p = 0,314).
Figura 5 – A relação entre as pressões sistólica e arterial pulmonar média (PAPs/PAPm – Ksys) (p = 0,103) e pressões diastólica e arterial pulmonar média (PAPd/PAPm – Kdia)
(p = 0,958) dos pacientes HTx antes (pré) e após a intervenção (pós) é proporcional, sugerindo que o RC ti RC-time me não sofre alteração com o procedimento.
A obstrução arterial pulmonar proximal tem sido conhecida
como fator responsável para o aumento da reflexão de onda,
o que aumenta a PP em qualquer nível de PAPm. O aumento
da reflexão de ondas com aumento desproporcionado da
PAPs em relação ao PAPm acrescentaria aos efeitos de rigidez
arterial pulmonar aumentada, uma diminuição da CPA e
do RC-time e, assim, aumentando a pós-carga no VD em
qualquer nível de RVP12.
que parecem aplicáveis a qualquer tipo de HP (base de Ksys e Kdia).
Entretanto, esta afirmação só é verdadeira se a CPA for previsível
em qualquer nível de RVP, necessitando, portanto, do RC-time
para permanecer constante13. Desta forma, se o RC-time altera
durante ou após uma intervenção, esta associação pode não se
manter fiel. Em nossa população não selecionada (coorte 1) houve
um efeito pequeno, embora significativo, da FC sobre Ksys e Kdia,
demonstrado quando o RC-time é diagramado versus a FC.
Por que o RC-time é constante?
Por que o RC-time tem variações alteradas na PCP?
A PAP sistólica, PAPd e PAPm estão fortemente correlacionados
através de fórmulas simples usadas para diferenciar uma da outra e
A relação RVP-CPA é sensível à pressão venosa pulmonar.
Este conceito foi mencionado pela primeira vez por Reuben e
Arq Bras Cardiol. 2015; 105(3):292-300
297
Moreira e cols.
RC-time após transplante cardíaco
Artigo Original
RC-time pré HTx
RC-time pós HTx
0,5
RC-time (s)
0,4
0,3
0,2
0,1
0,0
<60
60
75
90
105+
Frequência cardíaca (bpm)
Figura 6 – Com o aumento da frequência cardíaca, o RC-time é maior, embotando a redução esperada após o transplante cardíaco. A diferença entre os pacientes pré
e pacientes pós-transplante cardíaco é mais evidente com frequências cardíacas mais elevadas.
2,0
RC-time pré HTx
125
RC-time pós HTx
Frequência cardíaca pré HTx
Frequência cardíaca
RC-time (s)
75
1,0
50
0,0
RC-time
25+
Frequência cardíaca (bpm)
1,5
0,5
Frequência cardíaca pós HTx
100
25
20
15
10
<10
0
PECP (mmHg)
Figura 7 – Para os mesmos níveis de pressão capilar pulmonar (PECP), o RC-time (pontos, painel inferior) é sempre menor em pacientes pós transplante cardíaco
(HTx) (em vermelho). A frequência cardíaca (cruzes, painel superior) aumenta significativamente após o transplante cardíaco, mas não tem correlação com a pressão
de encravamento capilar pulmonar após o transplante cardíaco.
298
Arq Bras Cardiol. 2015; 105(3):292-300
Moreira e cols.
RC-time após transplante cardíaco
Artigo Original
cols.14 referindo-se ao aumento da pressão do átrio esquerdo
como secundário à estenose mitral grave. O autor sugeriu
que a redução desproporcional da CPA em relação à RVP
ocorreu devido ao aumento do tônus no músculo liso das
paredes arteriais pulmonares decorrente de pressão atrial
esquerda14 extremamente elevada. Tal ideia foi recentemente
revisitada por Tedford e cols.11 que estudou duas populações
com variações agudas das pressões de preenchimento no VE
(induzida por exercício) e crônicas (droga ou mediada por
HTx). Tedford e cols.11 concluíram que os níveis aumentados
de PECP tiveram um efeito de diminuição progressiva no
RC-time, e um aumento efetivo pulsátil no VD em relação
à carga resistiva, sugerindo que a PECP atua como pressão
a jusante que amplifica a reflexão das ondas do pulso
periférico. Isto aumentaria a PAPs (e PP), levando a uma CPA
mais baixa para um dado RVP, acarretando um aumento no
GTP. Como o GTP é calculado com PAPm, uma elevação
desproporcional da PAPs levará a um GTP elevado sem
vasoconstrição pulmonar ou remodelação.
Por que o RC-time não aumentou após HTx em nossa
população conforme esperado?
O resultado mais intrigante do nosso estudo foi o fato de
que, embora tenhamos observado uma diminuição significativa
das pressões de preenchimento do VE em receptores HTx, a
RVP diminuiu mais do que o aumento equivalente da CPA.
Portanto, o RC-time manteve-se constante, quando a variação
deveria aumentar.
No entanto, também observamos uma elevação na
FC, que tem um papel importante na proporcionalidade
das pressões na circulação pulmonar. Como Kind e cols.13
destacam que a FC tem influência sobre os índices de
pressão, da mesma forma que um aumento no FC aumenta
a PAPs e diminui a PAPd, consequentemente aumentando
a PP. Não somente a FC reduz o período de tempo do
coração como também acarreta um aumento da PP,
contribuindo, assim, para um RC-time menor. O RC time
menor, do que o esperado, após o HTx pode contribuir para
elucidar o motivo da existência de alargamento e algum
comprometimento da função do VD após o transplante,
mesmo em pacientes sem HP prévia significativa.
A única outra publicação que traz estas relações estudadas
já foi mencionada anteriormente por Tedford e cols.11, onde
207 pacientes com diagnóstico de IC com dois CCD disponíveis
em momentos distintos (um com PECP ≤ 10 mmHg e outro
com PECP ≥ 20 mmHg) foram avaliados. Os autores afirmam
que alguns dos CCD faziam parte de um programa de HTx,
pré ou pós-operatório, entretanto, não há informações sobre
o número preciso de pares antes e depois do transplante.
É importante ressaltar que a FC é a mesma (87 bpm) em "PECP
baixa" ou em coortes com "PECP alta", que podem indicar
uma pequena contribuição de pacientes HTx. Neste grupo, os
autores encontraram uma diminuição significativa no RC-time
quando o paciente teve PECP ≥ 20 mmHg11.
Pensava-se que a única exceção referente à constância
do RC-time era a HP secundária à insuficiência do VE.
Nestes pacientes, o RC-time diminuiu porque o aumento da
pressão venosa pulmonar provoca uma árvore arterial pulmonar
mais rígida. O aumento da PECP amplifica o reflexo de pulso
arterial pulmonar periférico, aumentando a PAPs. Assim, há
um declínio na CPA total11,13,15. Todavia, um estudo recente
realizado em um modelo animal de hipertensão pulmonar
tromboembólica crônica (CTEPH) demonstrou que a obstrução
proximal exclusiva é outra causa de diminuição do RC-time;
revelando também um aumento associado à PP e trabalho
hidráulico arterial oscilatório12. Ao contrário do que foi relatado
previamente por de Perrot e cols.16 em 34 pacientes, Mackenzie
Ross e cols.17 encontraram em 91 pacientes uma diminuição
significativa no RC-time após a endarterectomia pulmonar.
Os autores sugerem que a falta de normalização do RC-time
foi devida à intervenção na túnica íntima e na média da artéria
pulmonar, afetando as propriedades elásticas do vaso após a
cirurgia17. Sugerimos que os vasos pulmonares podem reter
algum tônus vascular (ou perda de CPA) após a exposição
prolongada a pressões de preenchimento elevadas no VE e,
portanto, alterar a relação resistência-complacência mesmo
após a normalização das pressões output com HTx.
O papel crítico na avaliação clínica dos componentes
pulsáteis da pós-carga no VD em pacientes com IC tem
ocupado lugar de destaque em vários relatórios. Em um estudo
recente, Pellegrini e cols.18 demonstraram que a CPA é o único
preditor mais importante de mortalidade cardiovascular em
um coorte de pacientes com IC, independentemente da da
PVR apresentada por eles.
Limitações
A natureza retrospectiva deste estudo pode ter limitado
o nosso acesso aos dados clínicos. Nós utilizamos cateteres
normais com fluido para avaliação de pressão (e não pressão
de alta fidelidade e medições de fluxo); contudo, este é
o sistema usado atualmente na maioria dos laboratórios
hemodinâmicos e tem sido extensivamente testado em
outros relatórios.
Conclusões
Em nossa população de pacientes HTx, e, ao contrário
do que era esperado, o RC-time não foi alterado a partir
dos valores pré HTx, embora uma variação negativa
muito significativa nas pressões de preenchimento no
VE foi observada após a cirurgia. Acreditamos que a FC
maior observada após o transplante pode ser, em parte,
responsável por este achado que pode ter impacto na
avaliação de pós-carga no VD destes pacientes.
Contribuição dos autores
Concepção e desenho da pesquisa, Obtenção de dados,
Análise e interpretação dos dados, Análise estatística,
Obtenção de financiamento, Redação do manuscrito e
Revisão crítica do manuscrito quanto ao conteúdo intelectual
importante: Moreira N, Baptista R, Costa S, Franco F, Pêgo
M, Antunes M.
Potencial conflito de interesse
Declaro não haver conflito de interesses pertinentes.
Arq Bras Cardiol. 2015; 105(3):292-300
299
Moreira e cols.
RC-time após transplante cardíaco
Artigo Original
Fontes de financiamento
Vinculação acadêmica
O presente estudo não teve fontes de financiamento externas.
Não há vinculação deste estudo a programas de pós-graduação.
Referências
1. Bacal F, Neto JD, Fiorelli AI, Mejia J, Marcondes-Braga FG, Mangini S,
et al; Sociedade Brasileira de Cardiologia. Brazilian guidelines for heart
transplantation. Arq Bras Cardiol. 2010;94(1 Suppl):e16-76.
2.
Kirklin JK, Naftel DC, Kirklin JW, Blackstone EH, White-Williams C, Bourge
RC. Pulmonary vascular resistance and the risk of heart transplantation. J
Heart Transplant. 1988;7(5):331-6.
3. Erickson KW, Costanzo-Nordin MR, O’Sullivan EJ, Johnson MR, Zucker
MJ, Pifarré R, et al. Influence of preoperative transpulmonary gradient on
late mortality after orthotropic heart transplantation. J Heart Transplant.
1990;9(5):526-37.
4.
Bourge RC, Naftel DC, Costanzo-Nordin MR, Kirklin JK, Young JB, Kubo SH,
et al. Pretransplantation risk factors for death after heart transplantation: a
multiinstitutional study. The Transplant Cardiologists Research Database
Group. J Heart Lung Transplant. 1993;12(4):549-62.
5.
Gajarski RJ, Towbin JA, Bricker JT, Radovancevic B, Frazier OH, Price JK, et al.
Intermediate follow-up of pediatric heart transplant recipients with elevated
pulmonary vascular resistance index. J Am Coll Cardiol. 1994;23(7):1682-7.
11. Tedford RJ, Hassoun PM, Mathai SC, Girgis RE, Russell SD, Thiemann DR, et
al. Pulmonary capillary wedge pressure augments right ventricular pulsatile
loading. Circulation. 2012;125(2):289-97.
12. Pagnamenta A, Vanderpool R, Brimioulle S, Naeije R. Proximal pulmonary
arterial obstruction decreases the time constant of the pulmonary
circulation and increases right ventricular afterload. J Appl Physiol (1985).
2013;114(11):1586-92.
13. Kind T, Faes TJ, Vonk-Noordegraaf A, Westerhof N. Proportional relations
between systolic, diastolic and mean pulmonary artery pressure are
explained by vascular properties. Cardiovasc Eng Technol. 2011;2(1):15-23.
14. Reuben SR. Compliance of the human pulmonary arterial system in disease.
Circ Res. 1971;29(1):40-50.
Saouti N, Westerhof N, Postmus PE, Vonk-Noordegraaf A. The arterial load
in pulmonary hypertension. Eur Respir Rev. 2010;19(117):197-203.
15. Bonderman D, Martischnig AM, Vonbank K, Nikfardjam M, Meyer B, Heinz
G, et al. Right ventricular load at exercise is a cause of persistent exercise
limitation in patients with normal resting pulmonary vascular resistance after
pulmonary endarterectomy. Chest. 2011;139(1):122-7.
7. Lankhaar J, Westerhof N, Faes TJ, Marques KM, Marcus JT, Postmus
PE, et al. Quantification of right ventricular afterload in patients with
and without pulmonary hypertension. Am J Physiol Heart Circ Physiol.
2006;291(4):H1731-7.
16. de Perrot M, McRae K, Shargall Y, Thenganatt J, Moric J, Mak S, et al. Early
postoperative pulmonary vascular compliance predicts outcome after
pulmonary endarterectomy for chronic thromboembolic pulmonary
hypertension. Chest. 2011;140(1):34-41.
8.
Lankhaar JW, Westerhof N, Faes TJ, Gan CT, Marques KM, Boonstra A, et al.
Pulmonary vascular resistance and compliance stay inversely related during
treatment of pulmonary hypertension. Eur Heart J. 2008;29(13):1688-95.
9.
Saouti N, Westerhof N, Helderman F, Marcus JT, Stergiopulos N, Westerhof
BE, et al. RC time constant of single lung equals that of both lungs together:
a study in chronic thromboembolic pulmonary hypertension. Am J Physiol
Heart Circ Physiol. 2009; 297(6):H2154-60.
17. Mackenzie Ross RV, Toshner MR, Soon E, Naeije R, Pepke-Zaba J.
Decreased time constant of the pulmonary circulation in chronic
thromboembolic pulmonary hypertension. Am J Physiol Heart Circ Physiol.
2013;305(2):H259-64.
6.
300
10. Syyed R, Reeves JT, Welsh D, Raeside D, Johnson MK, Peacock AJ. The
relationship between the components of pulmonary artery pressure
remains constant under all conditions in both health and disease. Chest.
2008;133(3):633-9.
Arq Bras Cardiol. 2015; 105(3):292-300
18. Pellegrini P, Rossi A, Pasotti M, Raineri C, Cicoira M, Bonapace S, et al.
Prognostic relevance of pulmonary arterial compliance in patients with
chronic heart failure. Chest. 2014;145(5):1064-70
Voltar ao Índice da Capa
Artigo de Revisão
Impacto de Intervenções em Atividade Física sobre a Pressão
Arterial de Populações Brasileiras
Impact of Physical Activity Interventions on Blood Pressure in Brazilian Populations
Vivian Freitas Rezende Bento, Flávia Barbizan Albino, Karen Fernandes de Moura, Gustavo Jorge Maftum, Mauro
de Castro dos Santos, Luiz César Guarita-Souza, José Rocha Faria Neto, Cristina Pellegrino Baena
Pontifícia Universidade Católica do Paraná, Curitiba, PR – Brasil
Resumo
Fundamento: A pressão arterial elevada está associada com a doença cardiovascular, que é a principal causa de
mortalidade na população brasileira. Modificações no estilo de vida, incluindo a atividade física, são importantes para
a redução dos níveis pressóricos e diminuição dos gastos decorrentes de desfechos.
Objetivo: Avaliar o impacto de intervenções em atividade física sobre a pressão arterial de brasileiros.
Métodos: Metanálise feita por meio de revisão sistemática, utilizando várias bases de dados em ciências da saúde
publicados até maio/2014. Foram utilizados sete estudos e uma amostra de 493 participantes. Foram incluídos estudos
paralelos de intervenções em atividade física em populações adultas brasileiras que possuíam descrição de pressão
arterial (mmHg) antes e após a intervenção em grupos controle e intervenção.
Resultados: Dos 390 estudos encontrados, oito atingiram os critérios de inclusão propostos para a revisão sistemática e sete
ensaios clínicos randomizados foram incluídos para a meta-análise. Dentre esses, intervenções com atividade física variaram
entre exercícios de resistência e aeróbico. Houve redução da pressão arterial sistólica -10.09 (IC 95%: - 18.76 a -1.43 mmHg)
e da pressão arterial diastólica -7,47 (IC 95%: -11.30 a -3.63 mmHg).
Conclusões: A evidência disponível sobre os efeitos da atividade física na pressão arterial da população brasileira indica um
efeito homogêneo e significativo para pressão arterial sistólica e para pressão arterial diastólica, porém a força dos estudos
sintetizados é baixa e a qualidade metodológica, baixa e/ou regular. Estudos maiores e com maior rigor metodológico são
necessários para construção de evidência robusta. (Arq Bras Cardiol. 2015; 105(3):301-308)
Palavras-chave: Atividade Motora; Avaliação do Impacto na Saúde; Pressão Arterial; Epidemiologia.
Abstract
Background: High blood pressure is associated with cardiovascular disease, which is the leading cause of mortality in the Brazilian population.
Lifestyle changes, including physical activity, are important for lowering blood pressure levels and decreasing the costs associated with outcomes.
Objective: Assess the impact of physical activity interventions on blood pressure in Brazilian individuals.
Methods: Meta-analysis and systematic review of studies published until May 2014, retrieved from several health sciences databases. Seven
studies with 493 participants were included. The analysis included parallel studies of physical activity interventions in adult populations in Brazil
with a description of blood pressure (mmHg) before and after the intervention in the control and intervention groups.
Results: Of 390 retrieved studies, eight matched the proposed inclusion criteria for the systematic review and seven randomized clinical
trials were included in the meta-analysis. Physical activity interventions included aerobic and resistance exercises. There was a reduction of
-10.09 (95% CI: -18.76 to -1.43 mmHg) in the systolic and -7.47 (95% CI: -11.30 to -3.63 mmHg) in the diastolic blood pressure.
Conclusions: Available evidence on the effects of physical activity on blood pressure in the Brazilian population shows a homogeneous and
significant effect at both systolic and diastolic blood pressures. However, the strength of the included studies was low and the methodological
quality was also low and/or regular. Larger studies with more rigorous methodology are necessary to build robust evidence. (Arq Bras Cardiol.
2015; 105(3):301-308)
Keywords: Motor Activity; Assessment of Health Impact; Blood Pressure; Epidemiology.
Full texts in English - http://www.arquivosonline.com.br
Correspondência: Cristina Pellegrino Baena •
Pontifícia Universidade Católica do Paraná – Rua Imaculada Conceição, 1155, Prado Velho. Bloco, CCBS. CEP 80215-901. Curitiba, PR – Brasil
E-mail: [email protected]
Artigo recebido em 25/11/14; revisado em 23/02/15; aceito em 24/02/15.
DOI: 10.5935/abc.20150048
301
Albino e cols.
Atividade física e seu impacto na pressão arterial
Artigo de Revisão
Introdução
No Brasil, as doenças cardiovasculares são a principal
causa de morte, gerando custos médicos e socioeconômicos
bastante elevados 1 . A hipertensão arterial sistêmica
(HAS) é um fator de risco altamente prevalente em nosso
meio, responsável por aproximadamente 45% dos casos
de doenças cardíacas isquêmicas, e 51% das doenças
cerebrovasculares2,3. As modificações do estilo de vida,
em especial atividade física e modificações dietéticas, são
a base do tratamento do paciente hipertenso, em nível
primário e secundário4.
A atividade física reduz a incidência de HAS em indivíduos
pré-hipertensos, reduzindo também a mortalidade e o risco de
desenvolvimento de doenças cardiovasculares4. Estudos em
populações estrangeiras demonstram que a atividade física
pode reduzir a pressão arterial e também reduzir a prevalência
e incidência de hipertensão independente dos fatores de risco
associados5, além de promover redução de pressão arterial
em hipertensos resistentes6.
Estudos de análise dos efeitos da atividade física nos
níveis de pressão arterial da população brasileira ainda são
escassos7. Nesse sentido, o objetivo deste estudo é analisar
sistematicamente a evidência do papel da atividade física na
pressão arterial da população brasileira.
Métodos
Estratégia de busca
As buscas nas bases de dados eletrônicas em ciências da
saúde – Medline (Medical Literature Analysis and Retrieval
System Online), PubMed (Public Medline), Embase (Excerpta
Medica dataBase), The Cochrane Library, CINAHL, Web
of Science, SciVerse Scopus, SciELO (Scientific Electronic
Library Online), LILACS (Literatura Latino – Americana e
do Caribe em Ciências da Saúde) and Biblioteca Virtual em
Saúde (BVS) – foram realizadas por meio de combinação
de descritores, incluindo termos MeSH (Medical Subject
Headings) da US National Library of Medicine (NLM),
descritores do texto e contrações de descritores.
Para realização da revisão sistemática e análise da
qualidade metodológica dos estudos foram utilizados
como guia o PRISMA (Preferred Reporting Items for
Systematic Reviews and Meta-Analyses) e uma extensão
do Consolidated Standards of Reporting Trials Statement.
Foram avaliados 27 itens descritos necessários para serem
reportados na revisão sistemática8,9.
Os termos usados para a busca estavam relacionados
à população analisada, por exemplo (Brazil* [mesh] OR
South America [mesh] OR South America*[tiab] OR Latin
American*[tw]), às intervenções com atividade física,
combinadas com os achados finais referentes a pressão
arterial e hipertensão, como (“life style” OR “lifestyle” OR
“weight loss” OR “losing weight” OR “weight reduction” OR
“disease management” OR “exercise” OR “exercise therapy”
OR “exercise test” OR “exercise movement techniques” OR
“kinesiotherapy” OR “physical endurance” OR “anaerobic”
OR “aerobic” OR “exercise” OR “resistance training” OR
302
Arq Bras Cardiol. 2015; 105(3):301-308
“motor activity*” OR “physical activity*” OR “locomotor
activity” OR “social support” OR “social network” OR
“tobacco use cessation” OR “smoking cessation” OR “alcohol
drink” OR “alcohol consum*” OR “drinking alcohol” OR
“alcoholi*” OR “non-pharmacol*”) AND (“blood pressure”
OR “hypertension”), e tipo de estudos selecionados
(“randomized” OR “placebo” OR “randomly” OR “trial”
OR “groups” OR “comparative” OR “evaluation” OR
“effectiveness” OR “utility” OR “validation” OR “reliability”).
Referências presentes nos artigos identificados pela estratégia
de busca também foram procuradas manualmente, a fim de
somarem-se ao trabalho e à revisão da literatura. As buscas
foram realizadas até o dia 14 de maio de 2014.
Critérios de inclusão e exclusão
Para inclusão, seguiram-se os seguintes critérios: quanto ao
desenho do estudo, ensaios clínicos randomizados, ensaios
clínicos, ensaios comunitários nos quais um grupo intervenção
é comparado a um grupo controle; estudos conduzidos
entre adultos; estudos que reportam, na mesma amostra, os
níveis de pressão arterial (sistólica e diastólica) antes e após a
intervenção, tanto no grupo controle quanto na intervenção;
estudos que analisam o efeito de intervenções da atividade
física na pressão arterial.
Para exclusão: estudos/relatórios desenvolvidos fora
do Brasil; estudos cujas intervenções envolveram terapia
medicamentosa; estudos envolvendo mulheres em período
gestacional; estudos em animais; intervenções com
duração inferior a oito semanas; letters, resumos, anais de
conferências, estudos observacionais, estudos crossover e
de conglomerados.
Identificação e seleção dos estudos
Duas duplas de autores, independentes, separadamente
fizeram a leitura dos títulos e resumos de cada trabalho
pré‑selecionado, a fim de identificar somente os estudos
que preenchiam corretamente os critérios de inclusão.
Seguiu‑se a leitura dos artigos, separadamente, por quatro
autores, a fim de assegurar os critérios da revisão sistemática.
Quaisquer divergências entre os autores foram resolvidas
por discussão e diálogo, na presença de um quinto autor.
Foi finalizada a seleção dos estudos incluídos na revisão
sistemática e identificados, entre eles, aqueles que preenchiam
os critérios para a metanálise (Figura 1 - fluxograma).
Extração de dados
Dois autores coletaram os dados, através de um formulário
de coleta predefinido. Um terceiro autor, independente,
revisou os dados extraídos. As características dos estudos
extraídos incluíram: data de publicação, título, definição
do estudo, duração da intervenção, tipo de intervenção,
supervisão, entre outras. Registraram‑se dados sobre os
participantes de cada trabalho, número de participantes,
inclusive o número total incluído na análise, sexo, idade,
região de residência (urbano, rural), uso de medicamentos,
comorbidades. E por fim, com relação aos resultados, foram
coletados aqueles referentes a pressão arterial antes e depois
da intervenção, com as respectivas variâncias.
Albino e cols.
Atividade física e seu impacto na pressão arterial
Artigo de Revisão
Artigos identificados através de
pesquisa em bancos de dados
(n = 390)
Incluídos
Eligibilidade
Triagem
Identificação
Resultados
Artigos adicionais identificados
através de outras fontes
(n = 2)
Artigos selecionados após
a conferência de
duplicidade (n = 380)
Artigos completos
avaliados para eligibilidade
(n = 14)
Estudos incluídos na
sintese qualitativa
(n = 8)
Artigos excluídos (n = 366)
2 estudos com experimentos em animais
1 sem relato de pressão arterial
5 por intervenções farmacológicas
1 mulheres grávidas
21 população abaixo de 18 anos
3 revisões
1 cartas ou editoriais
98 sem informações relevantes nos
resultados e exposições
4 sem grupo controle
191 outros países
37 Cross sectional
3 observacionais
Artigos completos excluídos (n = 7)
5 sem grupo controle
1 apenas atividade educativa
Estudos incluídos na
sintese quantitativa
(meta-análise)
(n = 7)
Figura 1 – Fluxograma do processo de seleção dos estudos.
A qualidade de cada estudo foi avaliada pela Ferramenta
Cochrane para Avaliar Risco de Viés 10, que contém os
seguintes critérios: geração de sequência; ocultação da
alocação; cegueira dos participantes, cegueira de avaliação
dos resultados, dos avaliadores do desfecho; integridade
dos resultados, dados incompletos; relatórios seletivos dos
resultados; e outras fontes de viés (por exemplo: número
de participantes).
Análise estatística
Tanto a pressão arterial sistólica quanto a diastólica foram
registradas como variáveis contínuas em mmHg. Os tamanhos
dos efeitos de cada estudo foram calculados como a diferença
da média entre as medidas pré e pós-intervenção do grupo
intervenção menos grupo controle. Quando ausentes, as
variâncias das diferenças pré e pós-intervenção dos grupos
intervenção e controle foram imputadas seguindo metodologia
descrita anteriormente11. Todas as análises foram realizadas por
meio do software Stata Corp LP, College Station, Texas, USA,
considerando o nível de significância de 5%.
Para meta-análise dos resultados utilizamos o efeito fixo e
random com 95% lC (intervalo de confiança). Para análise da
heterogeneidade entre os artigos foi empregado o I-square12.
O viés de publicação foi avaliado utilizando o funnel‑plot.
O efeito de pequenos estudos foi testado pelo teste de Egger12.
Resultados
A Identificação e seleção dos estudos
Das 390 referências reunidas pela estratégia de busca,
14 textos completos foram obtidos para leitura. Desses, cinco
estudos foram excluídos pela ausência de grupo controle;
outro, pela ausência de intervenção; e outro, por não
apresentar medidas de variância. Finalmente, oito atingiram
os critérios de inclusão propostos para a revisão sistemática e
sete, para a meta-análise (Figura 1 - fluxograma).
Características gerais dos estudos selecionados
As características principais dos estudos incluídos na
revisão sistemática estão relatadas na tabela 1. Considerando
apenas aqueles selecionados para a meta-análise, as amostras
variaram de 19 a 177 participantes (n total = 493), com
média de idade de 61,8 anos com desvio padrão 9,7 anos.
Dois estudos avaliaram exclusivamente mulheres13,14, o
restante incluiu indivíduos de ambos os gêneros e, dentre
esses, apenas um 15 relatou uma proporção maior de
homens, sendo os outros estudos com maior proporção
de mulheres. Quanto às comorbidades, três artigos não
reportaram presença de patologias associadas15-17, um dos
estudos avaliou unicamente pacientes com diabete melito
tipo 214, e outro reportou portadores de osteoporose 13.
Arq Bras Cardiol. 2015; 105(3):301-308
303
Albino e cols.
Atividade física e seu impacto na pressão arterial
Artigo de Revisão
atividade física (Figura 2). Foi observada heterogeneidade
entre os estudos tanto na avaliação da pressão arterial
sistólica (I² = 93.9%, p < 0,001) quanto na avaliação
da pressão arterial diastólica (I² = 91.8%, p < 0,001).
A avaliação do risco de viés está disposta na Figura 3 e
na Figura 4. O efeito de pequenos estudos foi observado,
avaliado pelo teste de Egger (p < 0,001).
Os demais ensaios consideraram indivíduos com síndrome
metabólica ou pelo menos um de seus componentes
(diabetes, hipertensão ou obesidade). A média de duração
das intervenções foi de 16,9 semanas com desvio padrão de
7,5 semanas. A qualidade dos estudos avaliada de acordo
com a ferramenta de Cochrane10 está relatada na tabela 2,
e nenhum dos artigos selecionados teve intenção de tratar.
Dentre os estudos incluídos, as intervenções com atividade
física variaram entre exercício resistido e aeróbico. O efeito
combinado desses estudos foi protetor, reduzindo tanto a
pressão arterial sistólica (efeito de intervenção = -10.09,
IC 95%: -18.76 a -1.43, I² = 93.9%, p < 0,001) quanto a
pressão arterial diastólica (efeito de intervenção = -7.47,
IC 95%: -11.30 a -3.63, I² = 91.8, p < 0,001).
Efeitos da atividade física na pressão arterial
Todos os estudos eram ensaios clínicos randomizados e
a avaliação do efeito das intervenções na pressão arterial
em mmHg foi feita avaliando a variação de pressão sistólica
e diastólica nos grupos controle e de intervenção com
Tabela 1 – Características dos ensaios clínicos randomizados presentes na revisão sistemática
Primeiro autor
Ano
Tamanho da
amostra
Média de idade
(anos), gênero
Comorbidades
Intervenção
Duração
(semanas)
Terra e cols. 13
2008
46
66.8, F
Diabetes,
osteoporose,
dislipidemia
Exercício resistido com 3 sessões
por semana
12
de Meirelles e cols.23
2009
19
49, FM
HAS, doença
cardiovascular,
diabetes
Exercícios com 60 minutos, 3 sessões
por semana
12
Bündchen e cols.24
2010
111
58, FM
IMC >30 (49,2%)
Exercícios aeróbico e resistido, com
3 sessões por semana.
12
Vianna e cols.16
2011
70
69.8, FM
Não
Caminhada, hidroginástica,
alongamento e exercício resistido,
com 3 sessões por semana.
16
Kanegusuku e cols.15
2011 24 63 M/F
Não
Exercício resistido com 2 sessões
por semana.
16
Barroso e cols.25
2008
24
66.5, M/F
HAS
Exercícios com duração de 60
minutos, 3 sessões por semana.
18
Monteiro e cols.14
2010
22
F
100% DM 2
Treinamento aeróbico de 50 minutos,
3 sessões por semana
13
Cezaretto e cols.17
2011
177
M/F
Não
150 minutos de exercícios por
semana de atividade física moderada.
36
Nota: M: masculino; F: feminino; HAS: hipertensão arterial sistêmica; DM2: diabete melito 2; IMC: índice de massa corpórea.
Tabela 2 – Características dos ensaios clínicos randomizados incluídos na revisão sistemática
Grupo Controle
Primeiro autor
n
Diastólica
Pós
Pré
Pós
145(6)
91,6 (-2)
95 (-2)
13
88,4
94,1
22
145,3
139,9
89,8
85,9
82,29 (7,70)
87,43 (9,50)
35
142,27 (18,32)
132,86 (14,47)
81,43 (6,01)
79,43 (6,39)
80,5 (9,9)
80 (8,2)
97
136,4 (17,7)
131 (17)
84 (10,7)
76,8 (12,5)
86,1 (9)
86 (-9)
57
145,2 (16)
127,7 (17)
89,3 (12)
81,2 (8)
74,2 (7,3)
73,3 (7,5)
26
125,2 (9,3)
114,7 (9,2)
72 (6,8)
71,04 (7,9)
77,5 (10,64)
69,1 (9,83)
11
140 (14,35)
124,5 (19)
75,4 (13,37)
54,4 (3,61)
73
15
120,8 (2,4)
117 (-4)
77,9 (1,5)
73 (-3)
Barroso e cols.25
13
141,7
147,5
Vianna e cols.16
35
141,14 (17,95)
142,57 (18,04)
Cezaretto e cols.17
80
135,8
136,2
Bündchen e cols.24
54
139,3 (14)
138,8 (15)
Terra e cols.
20
124,6 (10,1)
123,3 (13,5)
11
139,8 (19,53)
128,1 (25,92)
11
124,4 (2,1)
118 (3)
78,3 (1,2)
Kanegusuku e cols.
15
Diastólica
Pré
6
13
n
Sistólica
141,7 (6)
de Meirelles e cols.23
Monteiro e cols.14
Nota: Os resultados entre parênteses são desvios padrões (±DP).
304
Grupo Intervenção
Sistólica
Arq Bras Cardiol. 2015; 105(3):301-308
Pré
Pós
Pré
Pós
139
116
89
79(2)
Albino e cols.
Atividade física e seu impacto na pressão arterial
Artigo de Revisão
Pressão arterial sistólica
autho_le
Efeito (95% IC)
n_interv
n_contro
Terra, DF
26
20
-8,60 (-15,49, -1,71)
de Meirelies, LR
13
6
-29,00 (-33,92, -24,08)
Bündchen, DC
57
54
-11,10 (-17,06, -5,14)
Vianna, MVA
35
35
-9,71 (-17,37, -2,05)
Kanegusuku, H
15
11
-1,00 (-3,69, 1,69)
Cezaretto, A
97
80
-5,20 (-10,60, 0,20)
Monteiro, LZ
11
11
-3,60 (-22,59, 15,39)
-7,72 (-9,60, -5,84)
I-V Overall (I-squared = 93,9%, p < 0,001)
-10,09 (-18,76, -1,43)
D+L Overall
-10 -5
mm Hg
0
5
10
mm Hg
Pressão Arterial diastólica
autho_le
n_interv
Efeito (95% IC)
n_contro
Terra, DF
26
20
-3,16 (-7,57, 1,25)
de Meirelles, LR
13
3
-12,60 (-14,53, -10,67)
Bündchen, DC
57
54
-4,90 (-8,07, -1,73)
Vianna, MVA
35
35
-2,86 (-6,17, 0,45)
Kanegusuku, H
15
11
-5,30 (-6,98, -3,62)
Cezaretto, A
97
80
-3,70 (-7,00, -0,40)
Monteiro, LZ
11
11
-23,10 (-29,74, -16,46)
I-V Overall (I-squared = 91,8%, p < 0,001)
-7,17 (-8,18, -6,16)
D+L Overall
-7,47 (-11,30, -3,63)
mm Hg
-10
-5
0
2
mm Hg
Figura 2 – Meta-análise dos efeitos da intervenção com atividade física na pressão arterial sistólica e diastólica da população brasileira.
Discussão
Essa meta-análise feita por meio de uma revisão sistemática
de literatura, realizada com sete estudos, envolveu uma
amostra de 493 participantes (oito estudos foram utilizados
na revisão sistemática). Encontrou-se efeito heterogêneo de
intervenções com atividade física sobre a pressão arterial
realizadas nessa população.
Fatores relevantes para esse resultado são a presença
de diferentes comorbidades entre os estudos, assim como
diferentes tipos de intervenção, abrangendo desde exercício
resistido a exercícios aeróbicos.
A população envolvida nesse estudo apresentou uma
redução na pressão arterial, evidenciando uma diminuição
estatisticamente significativa tanto da pressão arterial sistólica
quanto da pressão arterial diastólica. Porém, como os estudos
selecionados possuem pequenos tamanhos amostrais, não
fica claro se, caso essas intervenções tivessem uma duração
maior, teriam o mesmo resultado. Resultados semelhantes
foram encontrados por Kelley e cols. e Cornelissen e cols.
onde foram avaliados a eficácia dos exercício isométrico de
pressão manual e exercício resistido na redução da pressão
arterial sistólica e diastólica. Nesse foram encontrados
reduções de pressão arterial sistólica e diastólica; entretanto,
Arq Bras Cardiol. 2015; 105(3):301-308
305
Albino e cols.
Atividade física e seu impacto na pressão arterial
Randomização (geração de sequência)
?
–
+
?
?
–
?
?
Avaliador cegado
?
–
–
?
–
–
?
+
Resultados incompletos
+
?
?
+
–
+
+
+
Resultados seletivos
+
+
–
+
?
–
+
+
Intenção de tratar
N
N
N
N
N
N
N
N
+
–
= Baixo risco de viés
= Risco de viés
?
= Não claro
Figura 3 – Avaliação de risco de viés de publicação – Ferramenta Cochrane (adaptada).
Gráfico de funil com intervalo de Confiança de 95%
Erro padrão do tamanho do efeito
0
1
2
3
4
-25
-20
-15
-10
Tamanho do efeito em mm Hg
Figura 4 – Funnel plot dos estudos incluídos na meta-análise.
306
Es
tud
o8
Es
tud
o7
Es
tud
o6
Es
tud
o5
Es
tud
o4
Es
tud
o3
Es
tud
o2
Es
tud
o1
Artigo de Revisão
Arq Bras Cardiol. 2015; 105(3):301-308
-5
0
Albino e cols.
Atividade física e seu impacto na pressão arterial
Artigo de Revisão
a generalização dos resultados foi limitada devido ao
pequeno número de estudos incluídos18,19.
Além disso, os estudos apresentados abrangem indivíduos
com e sem comorbidades; assim, não é evidente se o
efeito em populações específicas, como hipertensos,
seria semelhante ou mais protetor do que os resultados
apresentados nessa meta-análise.
Em relação a atividade física e efeitos na pressão arterial,
a magnitude de redução pressórica apresenta variação ao
analisar resultados de outras meta-análises, porém sempre
evidenciando efeito protetor de intervenção com atividade
física. Como exemplo, Hagberg e cols.20 evidenciaram uma
redução de 11 mmHg e 8 mmHg nas pressões arteriais
sistólica e diastólica, respectivamente. Já o estudo de Halbert
e cols.21 relatou que o treinamento físico aeróbico reduzia a
pressão arterial sistólica em 4.7 mmHg e a pressão arterial
diastólica em 3.1 mmHg. Finalmente, uma meta-análise de
Whelton e cols.22 analisou 54 estudos controlados e verificou
uma redução de 3.7 mmHg e 2.6 mmHg nas pressões
sistólica e diastólica.
A distribuição dos estudos no funnel-plot indicou risco
de viés de publicação no conjunto de trabalhos incluídos na
meta-análise. Quando avaliados separadamente por meio
da Ferramenta Cochrane, a maioria apresentou critérios
risco de viés alto ou não claro. Por outro lado, o emprego
do teste de Egger mostrou que houve efeito de estudos
pequenos nos resultados.
Algumas limitações dessa meta-análise devem ser
consideradas. A primeira é a qualidade dos estudos (Figura 3).
Além dos dados descritos na tabela Cochrane adaptada,
tivemos estudos que não reportaram dados básicos como
média de idade, variáveis socioeconômicas e presença ou
ausência de comorbidades. A segunda limitação é o tamanho
das amostras, que variaram de 19 a 177 participantes.
Como pontos fortes dessa meta-análise destacam-se a
inclusão de apenas ensaios clínicos randomizados, a ausência
de restrição de busca por publicações apenas em inglês e a
avaliação dos efeitos de cada intervenção com atividade física
independentemente dos seus resultados.
Esse estudo tem algumas implicações. A reunião de
evidência de estudos disponíveis permite a identificação de
novas oportunidades de pesquisa. Evidencia-se a necessidade
de novos trabalhos científicos envolvendo essas populações,
incluindo estudos de alta qualidade com maior número de
participantes e com duração superior a 16 semanas.
Conclusão
A meta-análise em questão reúne dados referentes
à população brasileira e evidencia que a realização de
atividades físicas pode reduzir os níveis de pressão arterial
da população estudada.
A união desses estudos apresentou uma diminuição
significativa de pressão arterial sistólica e diastólica com
as intervenções realizadas, porém a força dos estudos
apresentados é baixa e a qualidade metodológica, baixa
e/ou regular.
As alterações da pressão arterial promovidas por atividade
física têm sido amplamente estudadas; entretanto, são
ainda pouco exploradas em populações de países em
desenvolvimento como o Brasil. Essa lacuna apresentada
em nosso país, onde há alta prevalência de fatores de risco
para o desenvolvimento de DCV, possui como consequência
a elaboração de poucos programas focados na prevenção e
redução de fatores de risco.
A partir dos resultados obtidos nessa meta-análise,
evidencia-se a necessidade de avaliar a influência da
atividade física sob a pressão arterial com futuros estudos,
com manutenção de intervenção por períodos mais longos,
cuidados metodológicos relacionados a aleatorização de
grupos, cegamento de avaliador, e, assim, garantindo
trabalhos de maior força e melhor qualidade. Esses estudos
poderão fundamentar as políticas públicas de atenção
à saúde de pacientes hipertensos – atenção secundária,
bem como na prevenção primária da hipertensão arterial
em normotensos.
Contribuição dos autores
Concepção e desenho da pesquisa: Bento VFR, Albino
FB, Moura KF, Maftum GJ, Santos MC, Faria Neto JR, Baena
CP, Souza LCG. Obtenção de dados: Bento VFR, Albino
FB, Moura KF, Maftum GJ, Santos MC, Baena CP. Análise
e interpretação dos dados: Bento VFR, Albino FB, Moura
KF, Maftum GJ, Santos MC, Faria Neto JR, Baena CP, Souza
LCG. Análise estatística: Bento VFR, Baena CP. Redação do
manuscrito: Bento VFR, Albino FB, Moura KF, Maftum GJ,
Santos MC, Faria Neto JR, Baena CP, Souza LCG. Revisão
crítica do manuscrito quanto ao conteúdo intelectual
importante:Bento VFR, Faria Neto JR, Baena CP, Souza LCG.
Supervisão / como investigador principal: Baena CP.
Potencial Conflito de Interesse
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo não teve fontes de financiamento
externas.
Vinculação Acadêmica
Não há vinculação deste estudo a programas de
pós‑graduação.
Arq Bras Cardiol. 2015; 105(3):301-308
307
Albino e cols.
Atividade física e seu impacto na pressão arterial
Artigo de Revisão
Referências
1.
Sociedade Brasileira de Cardiologia; Sociedade Brasileira de Hipertensão;
Sociedade Brasileira de Nefrologia. VI Brazilian guidelines on hypertension.
Arq Bras Cardiol. 2010;95(1 Suppl):1-51.
14. Monteiro LZ, Fiani CR, Freitas MC, Zanetti ML, Foss MC. Redução da pressão
arterial, do IMC e da glicose após treinamento aeróbico em idosas com
diabete tipo 2. Arq Bras Cardiol. 2010;95(5):563-70.
2.
World Health Organization (WHO). Pan American Health Organization.
Regional strategy on an integrated approach to the prevention and control of
chronic diseases, including diet, physical activity, and health. Washington; 2006.
15. Kanegusuku H, Queiroz AC, Chehuen MR, Costa LA, Wallerstein LF,
Mello MT, et al. Strength and power training did not modify cardiovascular
responses to aerobic exercise in elderly subjects. Braz J Med Biol Res.
2011;44(9):864-70.
3. World Health Organization and the Food Standards Agency. Creating an
enabling environment for population-based salt (1)reduction strategies:
report of a joint technical meeting held by; Washington DC; 2010.
4. Organização Pan-Americana da Saúde. A hipertensão arterial como
problema de saúde comunitária: manual de normas operacionais para um
programa de controle nos diferentes níveis de atenção. Brasília: Ministério
da Saúde; 1986. (Série PALTEX no 3).
5.
Juraschek SP, Blaha MJ, Whelton SP, Blumenthal R, Jones SR, Keteyian SJ, et
al. Physical fitness and hypertension in a population at risk for cardiovascular
disease: the Henry Ford Exercise Testing (FIT) Project. J Am Heart Assoc.
2014;3(6):e001268.
6. Dimeo F, Pagonas N, Seibert F, Arndt R, Zidek W, Westhoff TH. Aerobic
exercise reduces blood pressure in resistant hypertension. Hypertension.
2012;60(3):653-8.
7.
Baena CP, Chowdhury R, Schio NA, Guarita-Souza LC, Olandoski M, Franco
OH, et al. Ischaemic heart disease deaths in Brazil: current trends, regional
disparities and future projections. Heart. 2013;99(18):1359-64.
8.
Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gotzsche PC, Ioannidis JP, et al.
The PRISMA statement for reporting systematic reviews and meta-analyses of
studies that evaluate health care interventions: explanation and elaboration.
Ann Intern Med. 2009;151(4):W65-94.
9.
Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gotzsche PC, Ioannidis JP, et al.
The PRISMA statement for reporting systematic reviews and meta-analyses of
studies that evaluate health care interventions: explanation and elaboration.
PLoS Med. 2009;6(7):e1000100.
10. Higgins JP, Altman DG, Gotzsche PC, Juni P, Moher D, Oxman AD, et al;
Cochrane Bias Methods Group;Cochrane Statistical Methods Group. The
Cochrane Collaboration’s tool for assessing risk of bias in randomised trials.
BMJ. 2011;343:d5928.
11. Follmann D, Elliott P, Suh I, Cutler J. Variance imputation for overviews of
clinical trials with continuous response. J Clin Epidemiol. 1992;45(7):769-73.
12. Egger M, Davey Smith G, Schneider M, Minder C. Bias in meta-analysis
detected by a simple, graphical test. BMJ. 1997;315(7109):629-34.
13. Terra DF, Mota MR, Rabelo HT, Bezerra LMA, Lima RM, Ribeiro AG, et al.
Redução da pressão arterial e do duplo produto de repouso após treinamento
resistido em idosas hipertensas. Arq Bras Cardiol. 2008;91(5):299-305.
308
Arq Bras Cardiol. 2015; 105(3):301-308
16. Vianna MV, Ali Cader S, Gomes AL, Guimaraes AC, Seixas-da-Silva IA, do
Rego AR, et al. Aerobic conditioning, blood pressure (BP) and body mass
index (BMI) of older participants of the Brazilian Family Health Program
(FHP) after 16 weeks of guided physical activity. Arch Gerontol Geriatr.
2012;54(1):210-3.
17. Cezaretto A, Siqueira-Catania A, de Barros CR, Salvador EP, Ferreira SR.
Benefits on quality of life concomitant to metabolic improvement in
intervention program for prevention of diabetes mellitus. Qual Life Res.
2012;21(1):105-13.
18. Kelley GA, Kelley KS. Isometric handgrip exercise and resting blood
pressure: a meta-analysis of randomized controlled trials. J Hypertens.
2010;28(3):411-8.
19. Cornelissen VA, Fagard RH, Coeckelberghs E, Vanhees L. Impact of resistance
training on blood pressure and other cardiovascular risk factors a metaanalysis of randomized, controlled trials. Hypertension. 2011;58(5):950-8.
20. Hagberg JM, Park JJ, Brown MD. The role of exercise training in the treatment
of hypertension: an update. Sports Med. 2000;30(3):193-206.
21. Halbert JA, Silagy CA, Finucane P, Withers RT, Hamdorf PA, Andrews GR. The
effectiveness of exercise training in lowering blood pressure: a meta-analysis
of randomised controlled trials of 4 weeks or longer. J Hum Hypertens.
1997;11(10):641-9.
22. Whelton SP, Chin A, Xin X, He J. Effect of aerobic exercise on blood
pressure: a meta-analysis of randomized, controlled trials. Ann Intern Med.
2002;136(7):493-503.
23. de Meirelles LR, Mendes-Ribeiro AC, Mendes MA, da Silva MN, Ellory JC,
Mann GE, et al. Chronic exercise reduces platelet activation in hypertension:
upregulation of the L-arginine-nitric oxide pathway. Scand J Med Sci Sports.
2009;19(1):67-74.
24. Bundchen DC, Panigas CF, Dipp T, Panigas TF, Richter CM, Belli KC, et al.
Ausência da influência da massa corporal na redução da pressão arterial
após exercício físico. Arq Bras Cardiol. 2010;94(5):678-83.
25. Barroso WK, Jardim PC, Vitorino PV, Bittencourt A, Miquetichuc F. A
influência da atividade física programada na pressão arterial de idosos
hipertensos sob tratamento não farmacológico. Rev Assoc Med Bras.
2008;54(4):328-33.
Voltar ao Índice da Capa
Correlação Anatomoclínica
Caso 3/2015 - Mulher de 53 Anos com Choque Cardiogênico
12 Anos após Cirurgia de Correção de Endomiocardiofibrose
Case 3/2015 – 53-Year-Old Female with Cardiogenic Shock 12 Years after Surgical Correction of
Endomyocardial Fibrosis
Michel Abi Kalansky Ponczek, Fernanda Seligmann Feitosa, Léa Maria Macruz Ferreira Demarchi
Instituto do Coração (InCor) – HC-FMUSP, São Paulo, SP – Brasil
Paciente feminina de 53 anos de idade, submetida a
tratamento cirúrgico de endomiocardiofibrose (EMF) há
12 anos, foi trazida ao hospital com hipotensão e bradicardia.
Queixava-se de palpitações desde os 29 anos de
idade. Os sintomas se intensificaram depois de 5 anos,
quando se somou dispneia desencadeada por esforços
moderados. Mais 5 anos se passaram e a dispneia passou a
ser desencadeada por mínimos esforços e com o decúbito.
Foi então encaminhada ao hospital.
O exame físico em 1994 revelou paciente com pulso
irregular, frequência cardíaca de 88 bpm, pressão arterial
de 104/80 mmHg e aumento da pressão venosa jugular.
A semiologia pulmonar foi normal. A semiologia cardíaca
revelou bulhas arrítmicas e sopro sistólico mitral (+/4).
O exame do abdome e dos membros foi normal.
O eletrocardiograma (ECG) (fevereiro 94) revelou fibrilação
atrial, bloqueio de ramo esquerdo e sobrecarga ventricular
esquerda (Figura 1).
As dimensões das câmaras cardíacas ao ecocardiograma
(1996) eram: átrio esquerdo, 57 mm; ventrículo esquerdo,
51 mm (diástole) e 33 mm (sístole). Foi identificada
obliteração da região apical de ambos os ventrículos, com
sinais sugestivos de calcificação. O aspecto morfológico
identificado foi considerado sugestivo de EMF.
As ventriculografias (1996) mostraram obliteração
da região apical do ventrículo esquerdo e do ventrículo
direito, além de insuficiência mitral de pequena magnitude.
Na cineangiocoronariografia, o ramo circunflexo da artéria
coronária esquerda originava-se da coronária direita. Não foram
identificadas obstruções nas artérias coronárias. O aspecto da
ventriculografia foi considerado sugestivo de EMF.
Foi indicado o tratamento cirúrgico.
Palavras-chave
A operação foi realizada (setembro 1996) com incisão
na região apical do ventrículo esquerdo e ressecção de
massa fibrosa e calcificada. Em seguida, através do septo
interatrial, foi feita anuloplastia com pericárdio bovino na
porção posterior do anel mitral e na porção anterior do
anel tricuspídeo.
A ventriculografia de controle um mês após a operação
revelou discreta hipocinesia de ventrículo esquerdo e
valvas competentes.
A paciente evoluiu com melhora da dispneia, mas
permaneceram as palpitações.
Em 2002, queixou-se de um episódio transitório de
dificuldade de fala e hemiparesia direita.
Voltou a apresentar dispneia desencadeada por esforços,
inicialmente moderados, e depois aos menores esforços.
Nova avaliação ecocardiográfica detectou insuficiência
tricúspide acentuada.
A medicação foi ajustada, com prescrição de varfarina
5 mg, losartana 50 mg, furosemida 80 mg, digoxina 0,25 mg
e diltiazem 180 mg.
Houve melhora dos sintomas. Apesar disso, ocorriam
episódios de piora.
Foi indicado novo estudo hemodinâmico, que revelou
(2005) hipertensão de câmaras direitas. Havia hipocinesia de
ventrículo esquerdo, de intensidade moderada nas paredes
inferior e apical e leve na parede anterior.
A paciente permaneceu em tratamento medicamentoso,
com ajustes feitos de acordo com os sintomas. Foi trazida
ao hospital após 24 horas de tonturas, mal-estar e dispneia.
O exame físico (13 novembro 2008) revelou pulso de
30 bpm, pressão arterial inaudível, estertores crepitantes em
bases pulmonares, ritmo cardíaco bradicárdico. O fígado
foi palpado a 7 cm do rebordo costal, havia ascite e edema
discreto de membros inferiores.
Choque Cardiogênico; Fibrose Endomiocárdica / cirurgia;
Arritmias Cardíacas; Marca-Passo Artificial.
O ECG mostrava fibrilação atrial, com alto bloqueio
atrioventricular e frequência ventricular de 30 bpm.
Editor da Seção: Alfredo José Mansur ([email protected])
A radiografia de tórax revelou aumento da área cardíaca
(+++/4+) sem sinais de congestão pulmonar.
Editores Associados: Desidério Favarato ([email protected])
Vera Demarchi Aiello ([email protected])
Correspondência: Vera Demarchi Aiello •
Avenida Dr. Enéas de Carvalho Aguiar, 44, subsolo, bloco I, Cerqueira César.
CEP 05403-000, São Paulo, SP – Brasil
E-mail: [email protected], [email protected]
DOI: 10.5935/abc.20150119
Os exames laboratoriais (13 novembro 2008) revelaram:
potássio, 4,4 mEq/L; sódio, 134 mEq/L; ureia, 100 mg/dL;
creatinina, 1,45 mg/L (filtração glomerular 40 mL/min/1,73m²);
INR, 2,6; BNP, 250 pg/mL; hemoglobina, 12,6 g/dL;
hematócrito, 40%; leucócitos/mm³, 7900 (78% neutrófilos, 10%
linfócitos e 12% monócitos); plaquetas/mm³, 183000; lactato
arterial, 11 mg/dL; e digoxinemia, 1,13 ng/mL.
309
Ponczek MAK e cols.
Choque cardiogênico tardiamente após cirurgia de endomiocardiofibrose
Correlação Anatomoclínica
Figura 1 – ECG: Ritmo de fibrilação atrial, bloqueio de ramo esquerdo e sobrecarga ventricular esquerda.
Foram administradas atropina e dopamina e feita
reposição volêmica sem que houvesse elevação da
frequência cardíaca, e depois, dobutamina, sem sucesso.
Foi implantado marca-passo cardíaco externo transvenoso
provisório. Depois dessa intervenção, houve elevação da
pressão arterial para 106/60 mmHg.
O marca-passo definitivo foi implantado em 19 de
novembro de 2008. Houve dificuldade técnica devido à
doença de base, sendo também colocado eletrodo em seio
coronário como reserva, para ocasional perda de comando
do eletrodo ventricular direito.
Os exame laboratoriais (19 novembro 2008) mostraram:
hemoglobina, 9 g/dL; leucócitos, 4700/mm³; plaquetas,
114000/mm³; ureia, 47 mg/dL; creatinina, 0,76 mg/dL;
potássio, 4,6 mEq/L; sódio, 133 mEqLl; glicemia, 122 mg/dL;
hemoglobina, 11,8 g/dL; hematócrito, 36%; e lactato; 7 mg/dL.
Seguiram-se oligúria e insuficiência renal.
A reavaliação laboratorial (4 dezembro 2008) revelou:
creatinina, 2,4 mg/dL; ureia, 105 mg/dL; potássio, 5,3 mEq/L;
sódio, 130 mEq/L; hemoglobina, 8,8 g/dL; hematócrito,
30%; leucócitos, 6200/mm³ (neutrófilos 86%, linfócitos 4%
e monócitos 10%); plaquetas, 99000/mm³.
A paciente apresentou parada cardíaca em fibrilação
ventricular não responsiva às manobras de ressuscitação e
faleceu (5 dezembro 2008).
Aspectos Clínicos
A paciente em discussão desenvolveu, aos 29 anos
de idade, queixa de palpitações, que, após 5 anos,
associou-se a dispneia aos esforços, com progressão
lenta até os 39 anos. Em pacientes jovens, as principais
causas de insuficiência cardíaca (IC) são a miocardiopatia
dilatada idiopática, as miocardites, a doença de Chagas,
miocardiopatia associada ao etilismo e mais raramente a
doença isquêmica do coração. Devemos também lembrar
das causas mais raras de IC, principalmente em pacientes
de regiões tropicais e subtropicais, como a EMF.
310
Arq Bras Cardiol. 2015; 105(3):309-315
Logo na primeira vez que a paciente procurou o
hospital já foi feito o diagnóstico de EMF, que é uma
endomiocardiopatia restritiva incomum, sendo responsável
no Brasil por 1,6% dos óbitos por doença cardíaca1. É mais
comum nas regiões leste e central da África. Há vários relatos
de casos também na América do Sul e Índia, e de casos
esporádicos ao redor do mundo. Em algumas localidades,
tem distribuição endêmica.
Sua etiologia não é completamente compreendida.
Acredita-se que uma série de fatores esteja envolvida em
sua patogênese, incluindo exposição ambiental, nutrição
e anormalidades imunológicas além de fatores genéticos.
Uma das hipóteses mais aceitas é que seja um espectro
mais avançado da doença de Loeffler, causada por
infiltração eosinofílica das diversas camadas do coração,
com inflamação crônica e posterior fibrose2-4. Esse processo
patogênico favorece também a trombose, geralmente no
ápice ventricular.
A doença é caracterizada pela deposição de tecido fibroso
no endocárdico e, em menor proporção, no miocárdio,
acometendo geralmente a região apical do ventrículo
direito ou esquerdo, ou ambos. Estudo prévio demonstrou
acometimento biventricular em cerca de 50% dos casos,
predominantemente do ventrículo esquerdo em 30% e do
ventrículo direito em 27%2. Em geral, acomete também a
via de entrada ventricular, os músculos papilares e o aparato
valvar, principalmente a valva mitral3.
A maioria dos pacientes, assim como no caso relatado,
inicia sintomatologia durante a adolescência, na segunda ou
terceira décadas de vida. Os sintomas iniciais são relacionados
à disfunção diastólica, sendo incomum a disfunção sistólica,
a não ser em fases avançadas da doença5. Pode haver ascite,
observada em cerca de 50% dos pacientes, geralmente
associada a fibrose importante de ventrículo direito, o que
confere um pior prognóstico6. A paciente em questão só
apresentou ascite na fase final da doença. É frequente também
a presença de arritmias supraventriculares, presentes em cerca
de 60% dos pacientes, sendo mais comum a fibrilação atrial,
como na doente relatada7.
Ponczek MAK e cols.
Choque cardiogênico tardiamente após cirurgia de endomiocardiofibrose
Correlação Anatomoclínica
O diagnóstico de EMF é feito com base nos achados
ecocardiográficos, que não se correlacionam com a gravidade
dos sintomas. As alterações mais comuns ao ecocardiograma
são alterações do relaxamento e da complacência da
câmara acometida, porém geralmente sem aumento dos
volumes ventriculares. Os átrios em geral são aumentados
e disfuncionais. É comum a insuficiência das valvas
atrioventriculares. O derrame pericárdico geralmente está
presente, sendo algumas vezes de grau importante.
O ecocardiograma da paciente foi compatível com
o diagnóstico de EMF, com aumento acentuado do
átrio esquerdo (57 mm) e preservação dos diâmetros
ventriculares. Havia comprometimento biventricular, com
sinais sugestivos de calcificação.
No caso relatado, realizou-se também ventriculografia, que
confirmou o acometimento biventricular com insuficiência
mitral discreta. Em geral, o estudo hemodinâmico de
pacientes com EMF revela elevação da pressão diastólica
final do ventrículo acometido, padrão restritivo nos traçados
de pressão ventricular e obliteração do ápice ventricular8,9.
O prognóstico da doença depende principalmente de
sua apresentação clínica. São considerados fatores de pior
prognóstico: comprometimento de ventrículo direito, presença
de ascite, fibrilação atrial e insuficiência mitral, além de aumento
das pressões atriais, da pressão diastólica final ventricular e da
pressão pulmonar (> 40 mmHg). O principal fator determinante
do prognóstico, entretanto, é a classe funcional (CF). Um estudo
avaliou a sobrevida dos pacientes de acordo com a classificação
funcional. Aqueles em CF I e II apresentaram sobrevida de
85% em dois anos8, enquanto aqueles em CF IV apresentaram
sobrevida de menos de 30% em dois anos10.
Dessa forma, o tratamento da EMF baseia-se nos
sintomas, sendo preconizado que os pacientes pouco
sintomáticos (CF I e II) recebam tratamento clínico11 e os
mais sintomáticos [IC congestiva (ICC) CF III e IV] recebam
tratamento cirúrgico12,13. Alguns especialistas advogam que,
na presença de fatores de pior prognóstico, a indicação
cirúrgica deva ser antecipada para a CF II.
O tratamento clínico é extrapolado a partir do tratamento
clínico da IC diastólica e baseia-se no uso de: diuréticos para
controle da volemia; betabloqueadores ou bloqueadores
de canal de cálcio para controle de frequência cardíaca em
pacientes com FA ou taquicardia atrial; e antagonistas da
vitamina K para pacientes com trombos intracardíacos.
A paciente em questão apresentava indicação para uso
de tais medicações, inclusive de anticoagulação, já que
apresentou um evento tromboembólico em 2002.
O tratamento cirúrgico consiste na ressecção da área de
fibrose endocárdica e na correção da insuficiência mitral ou
tricúspide, quando presentes, seja por troca ou reparo da valva.
A técnica cirúrgica inicial consistia em troca das valvas
por próteses quando houvesse comprometimento valvar.
Posteriormente, estudos mostraram que a plastia com preservação
da valva nativa relacionava-se a menor morbimortalidade.
A mortalidade relacionada com a cirurgia clássica é
bastante alta, entre 20% e 30%12,13, devendo-se sempre que
possível tentar preservar a valva nativa.
A cirurgia está relacionada à melhora importante dos
sintomas e de sobrevida em pacientes sintomáticos, devendo
sempre ser realizada nesses casos.
Trabalho publicado em 1999 por Moraes e cols.14 avaliou
83 pacientes submetidos à cirurgia de EMF e demonstrou
sobrevida de 55% em 17 anos, sendo que 45% desses
pacientes encontravam-se em ICC, CF I e II.
Recidiva de insuficiência valvar após o tratamento cirúrgico
não é rara, sendo que muitos pacientes podem necessitar de
nova cirurgia para correção do problema14.
Com relação à recidiva de fibrose, Moraes e cols. 15
avaliaram 107 pacientes submetidos à cirurgia e encontraram
uma incidência de 4,5%. A mortalidade cirúrgica relacionada
à reoperação desses casos foi extremamente elevada,
chegando a 50%15.
Em vista da alta mortalidade associada à reoperação,
fica a dúvida quanto ao melhor tratamento para esse grupo.
Um relato de caso publicado pela equipe de transplante cardíaco
do Instituto do Coração do Hospital das Clínicas da FMUSP
demonstrou boa evolução e sobrevida em um paciente com
EMF submetido previamente a cirurgia, mas com recorrência
da doença e sintomas importantes de IC. Foi aventada então a
possibilidade de que a realização de transplante cardíaco nesse
grupo seja mais benéfica que a reoperação16.
A paciente relatada foi submetida a cirurgia de ressecção
da fibrose endomiocárdica e plastia mitral e tricúspide devido
à presença de sintomas importantes de IC em 1996, quando
a mesma apresentava-se em CF III. A paciente evoluiu com
melhora inicial dos sintomas, corroborada pela ventriculografia
realizada um mês após a cirurgia, que mostrou valvas
competentes e discreta hipocinesia ventricular.
Alguns anos após a cirurgia, houve recidiva dos sintomas de
ICC e novo ecocardiograma mostrou insuficiência tricúspide
importante. Foi realizado novo estudo hemodinâmico
em 2005, que mostrou hipertensão de câmaras direitas e
hipocinesia moderada de ventrículo esquerdo, levantando
a suspeita de recidiva da doença. Na ocasião, optou-se
por tratamento clínico. Nessa ocasião, a realização de mais
exames, como ressonância cardíaca, poderia ter ajudado a
estabelecer o diagnóstico de recidiva da doença.
A presença de hipertensão de câmaras direitas poderia
estar relacionada à própria IC, a tromboembolismo pulmonar,
doença pulmonar obstrutiva crônica ou outras causas,
necessitando de mais investigação.
A paciente apresentou piora sintomática e procurou o
hospital (13 novembro de 2008) com quadro de choque
cardiogênico e bradicardia importante, necessitando de
passagem de marca-passo transvenoso. É provável que essa
bradicardia tenha sido causada pelo uso de medicações
para controle da frequência cardíaca, ou seja, diltiazem e
digoxina, já que o acometimento fibrótico do sistema de
condução é incomum na EMF.
Apesar de todo o suporte hemodinâmico e da melhora
inicial, a paciente evoluiu com piora da função renal,
fazendo-nos supor que a causa mais provável de óbito tenha
sido choque cardiogênico secundário à recidiva de EMF com
acometimento valvar.
Arq Bras Cardiol. 2015; 105(3):309-315
311
Ponczek MAK e cols.
Choque cardiogênico tardiamente após cirurgia de endomiocardiofibrose
Correlação Anatomoclínica
A análise retrospectiva do caso levanta a dúvida se a
realização de nova cirurgia ou transplante cardíaco em 2005,
quando a paciente voltou a ter sintomas de ICC, teria mudado
a evolução da paciente.
Ainda serão necessários estudos para que se possa decidir
sobre o melhor tratamento para a recidiva de EMF.
(Dr. Michel Abi Kalansky Ponczek e Dra. Fernanda
Seligmann Feitosa)
Hipótese diagnóstica: Endomiocardiofibrose
(Dr. Michel Abi Kalansky Ponczek e Dra. Fernanda
Seligmann Feitosa)
Necropsia
O coração pesou 652 g (normal: 200-300 g) e exibia
múltiplas aderências entre o pericárdio visceral e parietal.
Apresentava aumento de volume, em especial dos átrios,
cujo volume era proporcionalmente maior que o dos
ventrículos (Figura 2A). À abertura do coração, havia
dilatação atrial acentuada e espessamento endocárdico
moderado bilateral, e os anéis das valvas mitral e tricúspide
apresentavam suturas cirúrgicas de valvoplastias antigas,
junto à inserção das cúspides posteriores (Figura 2B). No teto
do átrio direito também havia uma sutura cirúrgica antiga.
Observou-se espessamento endocárdico bem mais intenso e
com áreas de calcificação na via de entrada e na ponta dos
ventrículos e, parcialmente, na via de saída do ventrículo
esquerdo, poupando a via de saída do ventrículo direito
(Figura 3). Havia acolamento das trabéculas miocárdicas
pelo espessamento endocárdico, que também envolvia
os músculos papilares das valvas mitral e tricúspide, com
redução acentuada das cavidades ventriculares e amputação
da ponta dos ventrículos (Figura 3). As cordas tendíneas
e as cúspides das valvas atrioventriculares não estavam
comprometidas pelo espessamento endocárdico; havia,
porém, retração moderada na borda livre das cúspides
e dilatação do anel valvar, bilateralmente. Eletrodos de
marca-passo cardíaco biventricular permanente estavam
implantados no endocárdio do ventrículo direito: um no
terço médio do septo ventricular e o outro na parede
anterolateral. Não havia trombos nos cabos ou nos locais
de implantação dos mesmos. Macroscopicamente não
foram encontrados trombos em cavidades cardíacas, nem
anormalidades nas valvas ventriculoarteriais. As artérias
coronárias epicárdicas não apresentavam alterações
obstrutivas importantes. O exame histológico mostrou
fibrose intensa e calcificação em endocárdio, com áreas
de neovascularização e de esparso infiltrado inflamatório
linfomononuclear, notando‑se expansão de traves fibrosas
irregulares para o miocárdio subjacente (Figura 4).
Não foram observados eosinófilos no infiltrado inflamatório
endocárdico ou em outros órgãos. Nos rins, havia infartos
cicatrizados corticais, múltiplos e extensos. Foram observadas
também alterações morfológicas decorrentes de ICC, tais
como: edema difuso de tecido subcutâneo, ascite (1500 ml
de líquido amarelo hialino) e congestão passiva crônica
em pulmões, fígado e baço. A causa do óbito foi baixo
débito secundário à ICC, histologicamente representado
por necrose tubular aguda e necrose hepática centrilobular.
(Dra. Léa Maria Macruz Ferrreira Demarchi)
Diagnósticos anatomopatológicos:
1) Endomiocardiofibrose biventricular, operada;
2) Insuficiência cardíaca congestiva; 3) Baixo débito.
(Dra. Léa Maria Macruz Ferrreira Demarchi)
Figura 2 – A - Coração, face diafragmática: O volume dos átrios é proporcionalmente maior que o dos ventrículos. No sulco atrioventricular encontra-se a artéria coronária
direita (**) e no sulco ventricular posterior, o ramo interventricular posterior da artéria coronária direita (*). B - Átrios esquerdo e direito: Espessamento endocárdico
bilateral e suturas cirúrgicas de valvoplastia antiga (setas) em cúspides posteriores (setas) das valvas mitral (M) e tricúspide (T). AE e AD: átrios esquerdo e direito,
respectivamente. VE e VD: ventrículos esquerdo e direito, respectivamente.
312
Arq Bras Cardiol. 2015; 105(3):309-315
Ponczek MAK e cols.
Choque cardiogênico tardiamente após cirurgia de endomiocardiofibrose
Correlação Anatomoclínica
Figura 3 – A e B - Vias de entrada e de saída do VD: Fibrose endocárdica na via de entrada (setas), com amputação da ponta ventricular (linha amarela tracejada) e
poupando a via de saída. C e D - Vias de entrada e de saída do VE: Fibrose endocárdica na via de entrada, com envolvimento dos músculos papilares da valva mitral
(setas), amputação da ponta do VE (linha amarela tracejada) e extensão para a via de saída ventricular, sem comprometer a valva aórtica (Ao).
Comentários
As lesões cardíacas observadas na necropsia dessa
paciente descrevem morfologicamente a EMF biventricular.
A característica principal da EMF é a fibrose endocárdica
espessa, focal ou difusa, que acomete preferencialmente
a via de entrada e a região apical de um ou de ambos
os ventrículos 17. Há acolamento fibroso das trabéculas
miocárdicas, que pode envolver a musculatura papilar,
cordas tendíneas e cúspides das valvas atrioventriculares,
causando insuficiência valvar. No caso em discussão, apesar
de a paciente já ter sido submetida a valvoplastia mitral
e tricúspide, tais valvas ainda apresentavam alterações
morfológicas de insuficiência, como dilatação do anel valvar
e retração na borda livre das cúspides. Histologicamente,
a EMF é representada por fibrose endocárdica densa
e colagênica, contendo fibras elásticas fragmentadas e
dispostas irregularmente, o que compromete também o
miocárdio subjacente, que exibe, em regiões próximas,
neoformação vascular e quantidade variável de infiltrado
inflamatório linfomonoplasmocitário, com ou sem
eosinófilos18. Embora nem sempre constantes, a presença
de eosinófilos nas lesões endocárdicas e o relato de
eosinofilia periférica, observados em diferentes estudos de
indivíduos com EMF, apontam eosinófilos/eosinofilia como
uma das prováveis causas da doença19, cuja etiopatogenia
ainda não está totalmente esclarecida 20. Muitos autores
propõem que a forma eosinofílica, também conhecida
como endocardite de Loeffler, e a EMF sem eosinófilos
representam diferentes fases de uma mesma doença,
pois as alterações morfológicas endocárdicas na fase
crônica são indistinguíveis entre os doentes com e sem
eosinofilia21,22. Isso pode ser comprovado nesta doente,
que não apresentava eosinófilos no infiltrado inflamatório
endomiocárdico nem em outros órgãos. À medida que a
EMF progride, a formação e a organização de trombose
endocárdica colaboram para a obliteração e a redução
da cavidade ventricular, sendo frequente, em casos mais
avançados, o achado de calcificação em meio à fibrose18.
Em geral, a dilatação atrial resulta da restrição ventricular
causada pela fibrose endomiocárdica e da insuficiência
das valvas mitral e tricúspide e também de alterações
vasculares pulmonares secundárias à congestão passiva
pulmonar, como observado nesta paciente. Os infartos
cicatrizados renais, muito provavelmente, foram causados
por embolia de trombose prévia no ventrículo esquerdo.
Arq Bras Cardiol. 2015; 105(3):309-315
313
Ponczek MAK e cols.
Choque cardiogênico tardiamente após cirurgia de endomiocardiofibrose
Correlação Anatomoclínica
Figura 4 – Fotomicrografias de endomiocárdio: A - Trombo em organização (tr) sobre endocárdio com fibrose intensa (f) (Hematoxilina-Eosina, 25x). B - Neovascularização
e infiltrado inflamatório linfomonoplasmocitário (entre setas) em fibrose endomiocárdica, com área de calcificação (ca); m- miocárdio (Hematoxilina-Eosina, 25x). C - Traves
irregulares de fibrose (azul) circundando cardiomiócitos (vermelho) em região subendocárdica (Tricrômico de Masson, 50x).
É importante ressaltar o tempo de sobrevida de 12 anos
dessa paciente, após a cirurgia, considerando-se a extensão
das lesões de EMF encontradas à necropsia. A probabilidade
de sobrevida dos pacientes com EMF submetidos a
cirurgia é de aproximadamente 70% após 10 anos de
cirurgia23,24. Muito provavelmente essas lesões representam
recidiva da doença, mas fica o questionamento se todo
o tecido comprometido pela doença foi removido pelo
procedimento cirúrgico.
(Dra. Léa Maria Macruz Ferrreira Demarchi)
Referências
1. Guimarães A. Natural history and current status in Brazil. In: Vatalian MS,
Sommers K, Kartha CC. (eds.). Endomyocardial fibrosis. Oxford: Oxford
University Press; 1993. p. 37-54.
7.
Barretto AC, Mady C, Nussbacher A, Ianni BM, Oliveira SA, Jatene A, et al.
Atrial fibrillation in endomyocardial fibrosis is a marker of worse prognosis.
Int J Cardiol. 1998;67(1):19-25.
2. Barretto AC, Mady C, Pileggi F. [Endomyocardial fibrosis. Longitudinal
follow-up of patients not treated with surgery]. Arq Bras Cardiol.
1996;67(4):285-8.
8.
Barretto AC, da Luz PL, de Oliveira SA, Stolf NA, Mady C, Bellotti G, et al.
Determinants of survival in endomyocardial fibrosis. Circulation. 1989;80(3
Pt 1):I177-82.
3. Wynne J, Braunwald E. The cardiomyopathies and myocardites. In:
Braunwald E, ed. Heart disease: a textbook of cardiovascular medicine. 5th
ed. Philadelphia: WB Saunders Co; 1997. p.1780-3.
9. Bersano EP, Zago AJ, Reali JT, Mattos AG. [Hemodynamic and
cineangiographic study in patients with primary endomyocardiopathy of
the obliterative type]. Arq Bras Cardiol. 1979;32(1):31-8.
4. Vianna Cde B, Barretto AC, Bellotti G. [Correlation between eosinophilia
and endomyocardial fibrosis. Current status]. Arq Bras Cardiol.
1990;54(4):247-50.
5.
6.
314
Brindeiro Filho D, Cavalcanti C. [Value of Doppler echocardiography in the
diagnosis and management of endomyocardial fibrosis]. Arq Bras Cardiol.
1996;67(4):279-84.
Barretto AC, Mady C, Oliveira SA, Arteaga E, Dal Bó C, Ramires JA. Clinical
meaning of ascites in patients with endomyocardial fibrosis. Arq Bras Cardiol.
2002;78(2):196-9.
Arq Bras Cardiol. 2015; 105(3):309-315
10. Mady C, Barretto AC, Mesquita ET, Silva PR, Cardoso RH, Bellotti G, et al.
Maximal functional capacity in patients with endomyocardial fibrosis. Eur
Heart J. 1993;14(2):240-2.
11. Barretto AC, Mady C, Pileggi F. [Endomyocardial fibrosis: longitudinal followup of patients not treated with surgery]. Arq Bras Cardiol. 1996;67(4):285-8.
12. Barreto AC, Oliveira SA, Bó CD, Stolf N, Mady C, Arteaga E, Bellotti G.
Cirurgia para endomiocardiofibrose melhora a qualidade de vida e a
preservação das válvulas reduzem a morbidade e mortalidade. Tema livre
do LIII Congresso Brasileiro de Cardiologia. Resumo disponível no endereço
eletrônico: http://educacao.cardiol.br/congresso/liii/temas/336.asp.
Ponczek MAK e cols.
Choque cardiogênico tardiamente após cirurgia de endomiocardiofibrose
Correlação Anatomoclínica
13. de Oliveira SA, Dallan LA, Barretto AC, Mady C, Jatene AD. [Endomyocardial
fibrosis surgery with atrioventricular valve preservation]. Arq Bras Cardiol.
1996;67(4):289-95.
19. Parrillo JE, Borer JS, Henry WL, Wolff SM, Fauci AS. The cardiovascular
manifestations of the hypereosinophilic syndrome. Prospective study of 26
patients, with review of the literature. Am J Med. 1979;67(4):572-82.
14. Moraes F, Lapa C, Hazin S, Tenorio E, Gomes C, Moraes CR. Surgery
for endomyocardial fibrosis revisited. Eur J Cardiothorac Surg .
1999;15(3):309-12.
20. Mocumbi AO. Endomyocardial fibrosis: a form of endemic restrictive
cardiomyopathy. Glob Cardiol Sci Pract. 2012;2012(1):11.
15. Moraes CR, Buffolo E, Moraes Neto F, Rodrigues JV, Gomes CA, Branco JN,
et al. [Recurrence of fibrosis after endomyocardial fibrosis surgery]. Arq Bras
Cardiol. 1996;67(4):297-9.
21. Brockington IF, Olsen EG. Löffler’s endocarditis and Davies’ endomyocardial
fibrosis. Am Heart J. 1973;85:308-22.
16. de Freitas HF, de Castro PP, Chizzola PR, Bocchi EA. [Heart transplantation in
a patient with endomyocardial fibrosis]. Arq Bras Cardiol. 2005;84(1):49-50.
22. Roberts WC, Ferrans VJ. Pathologic anatomy of the cardiomyopathies
- idiopathic dilated and hypertrophic types, infiltrative types, and
endomyocardial disease with and without eosinophilia. Human Pathol.
1975;6(3):287-342.
17. Connor DH, Somers K, Hutt MS, Manion WC, D’Arbela PG. Endomyocardial
fibrosis in Uganda (Davies’ disease). 1. An epidemiologic, clinical and
pathologic study. Am Heart J. 1967;74(5):687-709.
23. Schneider U, Jenny R, Turina J, Turina M, Hess OM. Long-term follow
up of patients with endomyocardial fibrosis: effects of surgery. Heart.
1998;79(4):362-7.
18. Connor DH, Somers K, Hutt MSR, Manion WC, D’Arbela PG.
Endomyocardial fibrosis (Davies’ disease). II. An epidemiologic, clinical
and pathologic study. Am Heart J. 1968;75(1):107-24.
24. Moraes F, Lapa C, Hazin S, Tenorio E, Gomes C, Moraes CR. Surgery
for endomyocardial fibrosis revisited. Eur J Cardiothorac Surg .
1999;15(3):309-12.
Arq Bras Cardiol. 2015; 105(3):309-315
315
Voltar ao Índice da Capa
Relato de Caso
Drogas Anabolizantes e Infarto do Miocárdio - A Propósito de um
Caso Clínico
Anabolic Drugs and Myocardial Infarction – A Clinical Case Report
Rui Pontes Santos, Adriana Pereira, Henrique Guedes, Carolina Lourenço, João Azevedo, Paula Pinto
Serviço de Cardiologia, Centro Hospitalar Tâmega e Sousa, Penafiel – Portugal
Introdução
Na maioria dos casos de infarto do miocárdio (IM) em
indivíduos jovens, os fatores de risco cardiovasculares tradicionais
continuam a ter uma importância preponderante. No entanto,
nessa idade se devem igualmente ter em consideração outras
causas, como ocorre com o abuso de drogas.
Os esteroides anabolizantes são derivados sintéticos da
testosterona, muitas vezes utilizados ilicitamente por atletas
com o intuito de aumentar o seu desempenho esportivo.
Existe uma associação entre a utilização desses agentes
e o aumento do risco cardiovascular1. O hormônio do
crescimento humano (hGH – Human Growth Hormone)
é igualmente utilizado para aumentar o rendimento
esportivo, apesar do risco de complicações cardiovasculares2.
O clembuterol é um potente β2-agonista que também possui
efeitos anabólicos. Atualmente ainda pouco se conhece sobre
o seu potencial risco cardiovascular3.
Apesar de terem sido descritos casos de infarto do
miocárdio (IM) associado a uso de anabolizantes, não
encontramos na literatura relatos da utilização simultânea
desses três tipos de medicamentos.
Relato do Caso
Masculino, 25 anos, caucasiano, sem fatores de
risco cardiovascular ou outros antecedentes patológicos
relevantes conhecidos. Dos seus hábitos se destacavam a
prática de culturismo e o consumo regular, nos seis meses
anteriores, de esteroides anabolizantes, hGH e clembuterol.
O último ciclo, iniciado seis semanas antes do episódio
aqui descrito era constituído por: oxandrolona 40 mg/dia
(todos os dias); clembuterol 0,08 mg/dia (todos os dias);,
mesterolona 50 mg/dia (todos os dias); hGH 10 UI/dia (todos
os dias); nandrolona 600 mg/dia (2x/semana); cipionato de
testosterona 400 mg/dia (2x/semana); estanozolol 100 mg/dia
Palavras-chave
Anabolizantes/efeitos adversos; Hormônio do Crescimento
Humano; Infarto do Mocárdio; Isquemia Miocárdica;
Clembuterol; Levantamento de Peso.
Correspondência: Rui Pontes Santos •
Centro Hospitalar Tâmega e Sousa. Centro Hospitalar Tâmega e Sousa, Lugar
do Tapadinho, Guilhufe. CEP 4564-007, Penafiel – Portugal
E-mail: [email protected]
Artigo recebido em 12/10/14; revisado em 11/01/15; aceito em 12/01/15.
DOI: 10.5935/abc.20150111
316
(3x/semana); drostanolona 200 mg/dia (3x/semana);
trembolona 200 mg/dia (3x/semana); propionato de
testosterona 100 mg/dia (3x/semana); boldenona 400 mg/dia
(2x/semana); e metenolona 200 mg/dia (2x/semana).
Negou hábitos tabágicos ou consumo de outras drogas.
Iniciou queixas de dor intensa de localização retrosternal
e características opressivas, sem irradiação ou outra
sintomatologia acompanhante, que durou cerca de duas
horas e que associou a fadiga muscular após um treinamento.
Cerca de 24 horas após o episódio inicial, houve recorrência
da dor que agravava com a inspiração (diferente da dor
inicial), pelo que recorreu ao Serviço de Urgência.
Quando da admissão no Serviço de Urgência, encontrava‑se
assintomático e o exame objetivo revelou estabilidade
hemodinâmica e febre (38,4°C), não apresentando outras
alterações relevantes. O eletrocardiograma (ECG) mostrava
ritmo sinusal, 83 b.p.m., com sinais de infarto das paredes
inferior e posterior em fase subaguda (Figura 1). Analiticamente
apresentava elevação dos marcadores de necrose do miocárdio:
CPK de 1987 UI/L (valor de referência (vr) < 172 UI/L);
troponina I de 48,97 ng/mL (vr < 0,05 ng/mL) – valor à admissão
e que posteriormente apresentou um padrão decrescente;
BNP de 115 pg/mL (vr < 100 pg/mL) e PCR de 33,3 mg/L
(vr < 7,5 mg/L), com pico máximo no internamento de
204,4 mg/L. O estudo da coagulação era normal. Iniciou dupla
antiagregação plaquetar com ácido acetilsalicílico e clopidogrel
e anticoagulação com fondaparinux.
Foi admitido na Unidade de Cuidados Intensivos Cardíacos
com o diagnóstico de IM com supradesnivelamento do
segmento ST de localização posteroinferior, em fase subaguda,
em classe I de Killip Kimball, associado a provável pericardite
pós-infarto. A avaliação ecocardiográfica revelou hipocinésia
dos segmentos médios e basais das paredes inferior, posterior
e lateral do ventrículo esquerdo (VE). Destacou-se também a
presença de ligeira hipertrofia concêntrica do VE, e a função
sistólica global biventricular era conservada.
Cerca de 48 horas após o início dos sintomas realizou
angiografia coronariana que mostrou uma imagem filiforme
no 1/3 proximal da artéria coronariana direita, sugestiva
de trombo intraluminal, que não condicionava estenose
significativa (Figura 2). Não revelou alterações sugestivas
de doença coronariana epicárdica aterosclerótica. Dado o
trombo ser de pequenas dimensões, foi decidido manter a
anticoagulação até o final da internação, continuando com a
dupla antiagregação em doses de manutenção.
Ao longo da internação, o paciente apresentou
evolução clínica favorável, tendo-se mantido elétrica e
hemodinamicamente estável, sem recorrência da dor e com
Santos e cols.
Drogas anabolizantes e infarto do miocárdio
Relato de Caso
Figura 1 – ECG na admissão com sinais de infarto das paredes inferior e posterior em fase subaguda.
melhora analítica. Teve alta ao oitavo dia de internação,
assintomático e medicado com ácido acetilsalicílico
(150 mg od), clopidogrel (75 mg od), bisoprolol (5 mg od),
ramipril (2,5 mg od) e rosuvastatina (10 mg od).
Iniciou seguimento em consulta de Cardiologia,
verificando–se que um ano após a alta hospitalar se mantinha
abstinente relativamente a substâncias anabolizantes e
assintomático do ponto de vista cardiovascular. O ECG e o
ecocardiograma realizados na última consulta mantinham
as alterações descritas previamente. Realizou também uma
prova de esforço que não mostrou alterações sugestivas de
isquemia do miocárdio.
Discussão
Apesar da sua raridade, já foram descritos alguns
casos de IM em indivíduos jovens, sem fatores de risco
cardiovasculares e que utilizavam esteroides anabolizantes4-7.
Ainda que não seja totalmente compreendida a relação causa
efeito, foram propostas hipóteses para explicar os seus efeitos
adversos cardiovasculares8.
Alguns estudos atribuem um potencial trombótico aos
esteroides anabolizantes. Esses parecem estar associados ao
aumento da agregação plaquetar, consequência da produção
aumentada de tromboxano A2 e da diminuição da produção
de prostaciclina. Juntamente com essas alterações parecem
existir efeitos na cascata da coagulação, nomeadamente um
aumento da atividade da trombina, que também contribuem
para um estado de hipercoagulabilidade 1. Esses efeitos
adversos são exacerbados pela desidratação e pelo estresse
catecolaminérgico, que frequentemente ocorrem em associação
à prática desportiva8.
Também a hGH foi associada a complicações
cardiovasculares. O abuso desse hormônio contribui para
um aumento da frequência cardíaca e do débito cardíaco, e
consequentemente para hipertrofia ventricular concêntrica
e disfunção diastólica, podendo mesmo em determinados
doentes promover isquemia/necrose e insuficiência cardíaca
com compromisso da função sistólica2.
O clembuterol, quando administrado oralmente, parece
ter um potencial anabólico, contribuindo para o aumento
da massa muscular3. Apesar de existir pouca informação
sobre as potenciais complicações cardíacas, já foram
descritos dois casos de IM, em que o clembuterol poderá
ter tido um papel fundamental9-10. Especula-se que os seus
efeitos cronotrópicos e inotrópicos positivos, assim como a
redistribuição da circulação coronariana poderão favorecer
a isquemia miocárdica8.
Sendo assim, os autores colocam a hipótese de esse paciente
ter tido um IM no contexto do abuso de anabolizantes.
Acreditamos, portanto, que se trate de um infarto do tipo 2,
em que a formação de um trombo intraluminal se deveu ao
estado de hipercoagulabilidade associado a uso de esteroides
anabolizantes. Nesse caso é relevante também realçar o possível
efeito sinérgico de uso concomitante de hGH e clembuterol.
Foi demonstrado que ambos os agentes promovem a isquemia
miocárdica, pelo que admitimos que os três fármacos poderão
ter sido determinantes para o desfecho final.
Em conclusão, a utilização de substâncias anabolizantes
parece ser um fator de risco para o desenvolvimento de
síndrome coronariana aguda. Dessa forma, reforça-se a
ideia de que é fundamental excluir uma história prévia de
consumo de medicamentos ilícitos na presença de um IM,
particularmente em doentes com baixo risco cardiovascular.
Arq Bras Cardiol. 2015; 105(3):316-319
317
Santos e cols.
Drogas anabolizantes e infarto do miocárdio
Relato de Caso
Figura 2 – A coronariografia mostrou trombo intraluminal no 1/3 proximal da artéria coronariana direita.
Contribuição dos autores
Obtenção de dados: Santos RP, Pereira A, Guedes H.
Análise e interpretação dos dados: Santos RP, Pereira A,
Guedes H. Redação do manuscrito: Santos RP, Lourenço C.
Revisão crítica do manuscrito quanto ao conteúdo intelectual
importante: Santos RP, Lourenço C, Azevedo J, Pinto P.
Potencial conflito de interesse
Declaro não haver conflito de interesses pertinentes.
318
Arq Bras Cardiol. 2015; 105(3):316-319
Fontes de financiamento
O presente estudo não teve fontes de financiamento
externas.
Vinculação acadêmica
Não há vinculação deste estudo a programas de
pós‑graduação.
Santos e cols.
Drogas anabolizantes e infarto do miocárdio
Relato de Caso
Referências
1.
Vanberg P, Atar D. Androgenic anabolic steroid abuse and the cardiovascular
system. Handb Exp Pharmacol. 2010;(195):411-57.
2.
Holt RI, Sönksen PH. Growth hormone, IGF-I and insulin and their abuse in
sport. Br J Pharmacol. 2008;154(3):542-56.
3. Spann C, Winter ME. Effect of Clenbuterol on athletic performance. Ann
Pharmacother. 1995;29(1):75-7.
4. Ilhan E Demirci D, Güvenç TS, Calık AN. Acute myocardial infarction and
renal infarction in a bodybuilder using anabolic steroids. Turk Kardiyol Dern
Ars. 2010;38(4):275-8.
5. Güneş Y, Erbaş C, Okuyan E, Babalik E, Gürmen T. Myocardial infarction
with intracoronary thrombus induced by anabolic steroids. Anadolu Kardiyol
Derg. 2004;4(4):357-8.
6.
Stergiopoulos K, Brennan JJ, Mathews R, Setaro JF, Kort S. Anabolic steroids,
acute myocardial infarction and polycythemia: a case report and review of
the literature. Vasc Health Risk Manag. 2008;4(6):1475-80.
7. Garg P, Davis G, Wilson JI, Sivananthan M. Intravascular ultrasound
and angiographic demonstration of left main stem thrombus-high-risk
presentation in a young adult with anabolic steroid abuse. Am Heart Hosp
J. 2010;8(2):E125-7.
8. Deligiannis A, Björnstad H, Carre F, Heidbüchel H, Kouidi E, PanhuyzenGoedkoop NM, et al. ESC study group of sports cardiology position paper
on adverse cardiovascular effects of doping in athletes. Eur J Cardiovasc Prev
Rehabil. 2006; 13(5):687-94.
9. Goldstein DR, Dobbs T, Krull B, Plumb VJ. Clembuterol and anabolic
steroids: a previously unreported cause of myocardial infarction with normal
coronary arteriograms. South Med J. 1998; 9(8):780-4.
10. Kierzkowska B, Stańczyk J, Kasprzak JD. Myocardial infarction in a 17-yearold body builder using clenbuterol. Circ J. 2005;69(9):1144-6.
Arq Bras Cardiol. 2015; 105(3):316-319
319
Voltar ao Índice da Capa
Imagem
Pseudoaneurisma Ventricular Esquerdo Secundário à Endocardite da
Válvula Mitral
Left Ventricular Pseudoaneurysm Secondary to Mitral Valve Endocarditis
Bruno Bochard-Villanueva1 e Jordi Estornell-Erill2
Departamento de Cardiologia, Consórcio Hospital Geral Universitário de Valência1, Unidade de Imagem Cardíaca ERESA, Consórcio Hospital
Geral Universitário de Valência2 – Espanha
Paciente de 76 anos de idade, do sexo femino, com
história recente de endocardite da válvula mitral, admitida
para realizar um ecocardiograma transesofágico (ETE) de
acompanhamento após quatro semanas de tratamento
com antibióticos. O ecocardiograma mostrou um espaço
pulsátil perivalvular anecogénico de 32 x 23 mm, com
um orifício estreito comunicando ao ventrículo esquerdo
na posição posterior mitral subanular compatível com
pseudoaneurisma (Painel A). O ETE tridimensional em
tempo real permitiu observar a sua relação com estruturas
adjacentes (Painel B-C). Uma angiografia coronariana por
TC, realizada posteriormente, confirmou esses resultados
e não mostrou nenhuma estenose coronária significativa
Palavras-chave
Disfunção Ventricular Esquerda / complicações; Insuficiência
Cardíaca; Doença das Valvas Cardíacas; Endocardite Bacteriana,
Ecocardiografia Transesofagiana; Tomografia Computadorizada
por Raios X.
Correspondência: Bruno Bochard-Villanueva •
Consorcio Hospital General Universitario de Valencia. Avenida Tres Cruces 2,
Valencia, Valencia – Espanha
E-mail: [email protected]
Artigo recebido em 06/04/2015; Artigo revisado em 13/04/2015; aceito em
06/05/2015.
DOI: 10.5935/abc.20150071
320
(Painel D-E). Com isso, a cirurgia foi indicada e uma placa
de pericárdio bovino foi implantada com sucesso.
Contribuição dos autores
Concepção e desenho da pesquisa: Bochard-Villanueva
B. Obtenção de dados: Bochard-Villanueva B, Estornell‑Erill
J. Análise e interpretação dos dados: Bochard-Villanueva B,
Estornell-Erill J. Redação do manuscrito: Bochard-Villanueva B.
Potencial Conflito de Interesse
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo não teve fontes de financiamento externas.
Vinculação Acadêmica
Não há vinculação deste estudo a programas de pós‑graduação.
Bochard-Villanueva & Estornell-Erill
Pseudoaneurisma micótico ventricular esquerdo
Imagem
Figura 1 – A. Ecocardiograma transesofágico (ETE) mostrando um espaço pulsátil perivalvular anecogénico de 32 x 23 mm correspondendo com pseudoaneurisma
(PA) basal inferior. B, C. ETE tridimensional em tempo real mostrando o PA e sua relação com estruturas adjacentes. D. Angiografia cardíaca por TC, Imagem de
renderização de volume 3D mostrando o PA e artérias coronárias. E. Projeção de intensidade máxima, reconstrução em pixels. Eixo curto ao nível da válvula mitral,
mostrando o PA. Observe a severa calcificação do anel mitral (seta).
Arq Bras Cardiol. 2015; 105(3):320-321
321
Voltar ao Índice da Capa
Carta ao Editor
Adesão Terapêutica e Capacidade Funcional na Insuficiência Cardíaca
Therapeutic Adherence and Functional Capacity in Heart Failure
Márcia Maria Carneiro Oliveira, Elieusa e Silva Sampaio, Roque Aras Júnior
Universidade Federal da Bahia – UFBA, Salvador, BA – Brasil
Prezado Editor,
A insuficiência cardíaca (IC) tem se tornado um grande
problema de saúde pública, pois se configura como a via
final da maioria das cardiopatias1. Um dos principais fatores
que levam à descompensação na IC é a baixa adesão dos
pacientes ao tratamento2.
Programas de intervenção educacional para o manejo da
doença crônica e monitoração clínica da IC estão associados
a uma melhor adesão ao tratamento3,4. Observou-se, em
um ensaio clínico não controlado com 25 pacientes de um
ambulatório de IC, que a intervenção educacional melhorou
os seguintes indicadores: dosagem de função renal com
melhora da taxa de filtração glomerular estimada (TFGe;
mediana: V0 = 61 vs. V1 = 68) e peptídeo natriurético do
Palavras-chave
Insuficiência Cardíaca; Adesão à Medicação; Assistência
ao Paciente.
Correspondência: Márcia Maria Carneiro Oliveira •
Programa de Pós-Graduação em Medicina e Saúde da Universidade Federal
da Bahia. Rua Acajutiba, Quadra 8, Lote 13 B, Pernambués. CEP 41120-700,
Salvador, BA – Brasil
E-mail: [email protected]
Artigo recebido em 21/06/15; revisado em 26/06/15; aprovado em 06/07/15.
tipo B (BNP), escore de adesão ao tratamento e capacidade
funcional pelo teste de caminhada de 6 Minutos (TC6’).
No questionário de adesão ao tratamento, foram
abordados: uso correto dos medicamentos, peso diário,
restrição de sal e líquidos, ingestão de bebida alcoólica e
assiduidade em consultas e exames. O escore de adesão
pode variar de zero a 10 pontos4. Na avaliação da adesão,
foi observada melhora comparando-se o período pré(V0) e pós-intervenção (V1), com mediana de V0 = 5,0
vs. V1 = 6,1 (p = 0,006). Evidenciou-se, na V0, que os
pacientes considerados não aderentes procuraram o serviço
de emergência nos últimos 30 dias com mais frequência
que os considerados aderentes (p = 0,013) e, na V1, 100%
dos pacientes relataram não ter procurado a emergência no
período. Após intervenção educacional, os pacientes com
IC sistólica com fração de ejeção do ventrículo esquerdo
baixa (FEVE ≤ 40%) apresentaram melhora do escore de
adesão (p = 0,006) e melhora clínica com diminuição
de classe funcional (CF) e perda de peso (p = 0,022).
Quanto ao TC6’, os pacientes que apresentaram melhor
desempenho no teste foram aqueles considerados
aderentes ao tratamento, com CF III, tempo de IC de 12
a 16 anos, FEVE entre 24 e 29%, e etiologia hipertensiva.
Foi observada melhora clínica e da função renal nos pacientes
com IC ambulatoriais submetidos à intervenção educacional
que apresentaram maior adesão à terapêutica otimizada.
DOI: 10.5935/abc.20150114
Referências
1. Reis FJ, Fernandes AM, Bahia RL, Sahade V, Rodrigues Junior ES. A
importância de serviços especializados e multidisciplinares para pacientes
com insuficiência cardíaca e seu impacto na saúde pública. Gazeta méd
Bahia. 2007;77(1):31-6.
2. Fonarow GC, Abraham WT, Albert NM, Stough WG, Gheorghiade M,
Greenberg BH, et al. OPTIMIZE-HF Investigators and Hospitals. Factors
identified as precipitating hospital admissions for heart failure and clinical
outcomes: findings from OPTIMIZE-HF. Arch Intern Med. 2008;168(8):847-54.
322
3. Cruz FD, Issa VS, Ayub-Ferreira SM, Chizzola PR, Souza GE, Moreira LF, et
al. Effect of a sequential education and monitoring programme on qualityof-life components in heart failure. Eur J Heart Fail. 2010;12(9):1009-15.
4. Bocchi EA, Cruz F, Guimarães G, Pinho Moreira LF, Issa VS, Ayub Ferreira
SM, et al. Long-term prospective, randomized, controlled study using
repetitive education at six-month intervals and monitoring for adherence
in heart failure outpatients: the REMADHE trial. Circ Heart Fail.
2008;1(2):115-24.
Notícias
Calendário
70º Congresso Brasileiro de Cardiologia
XXXII Congresso Brasileiro de Arritmias Cardíacas
18 a 21 de setembro de 2015
4 a 6 de novembro de 2015
Curitiba (PR)
São Paulo (SP)
http://congresso.cardiol.br/70/
http://departamentos.cardiol.br/sobrac/
XII Congresso Sergipano de Cardiologia
XII Congresso Brasileiro de Cardiogeriatria
15 a 17 de outubro de 2015
6 a 7 de novembro de 2015
Local a confirmar
Curitiba (PR)
http://sociedades.cardiol.br/sbc-se/
http://departamentos.cardiol.br/decage2014/
XIV Congresso Catarinense de Cardiologia
XXV Congresso Paraense de Cardiologia
23 a 24 de outubro de 2015
6 a 7 de novembro de 2015
Florianópolis (SC)
Belém (PA)
http://sociedades.cardiol.br/sc/
http://sociedades.cardiol.br/pa/
XII Congresso de Hipertensão Arterial
IX Congresso Amazonense de Cardiologia
29 a 31 de outubro de 2015
13 a 14 de novembro de 2015
Goiânia (GO)
Local a confirmar
http://departamentos.cardiol.br/sbc-dha/profissional/
http://sociedades.cardiol.br/am/
XXII Congresso Nacional do Derc
XXV Congresso Goiano de Cardiologia
29 a 31 de outubro de 2015
26 a 28 de novembro de 2015
Recife (PE)
Local a confirmar
http://departamentos.cardiol.br/sbc-derc/
http://sociedades.cardiol.br/go/
323
Veja na Próxima Edição
Vol. 105, Nº 4, Outubro 2015
Angioplastia com e sem Stent
Custos de Tratamento da Síndrome Coronariana Aguda sob a Perspectiva do Sistema de Saúde
Suplementar
Vanessa Teich, Tony Piha, Lucas Fahham, Haline Bianca Squiassi, Everton de Matos Paloni, Denizar Vianna Araújo, Paulo Miranda
Cirurgia Cardíaca – Adultos
Senning Paliativo no Tratamento de Cardiopatias Congênitas com Hipertensão Pulmonar Grave
Juliano Gomes da Penha, Leina Zorzanelli, Antonio Augusto Barbosa-Lopes, Edimar Atik, Leonardo Augusto Miana, Carla
Tanamati, Luiz Fernando Caneo, Nana Miura, Vera Demarchi Aiello, Marcelo Biscegli Jatene
Coronariopatia Crônica
Ansiedade, Depressão e Distúrbios Psicológicos Gerais em Pacientes com Fluxo Coronariano Lento
Mehmet Baran Karataş, Ebru Şahan, Kazım Serhan Özcan, Yiğit Çanga, Barış Güngör, Tolga Onuk, Göktürk İpek, Yasin
Çakıllı, Emre Arugaslan, Osman Bolca
Epidemiologia
Mortalidade em Idosos por Doenças Cardiovasculares: Análise Comparativa de Dois Quinquênios
Grasiela Piuvezam, Wilton Rodrigues Medeiros, Andressa Vellasco Costa, Felipe Fonseca Emerenciano, Renata Cristina
Santos, Danilo Silveira Seabra
324
SUPERIORIDADE
NA COMBINAÇÃO DE
EFICÁCIA E SEGURANÇA,
SOMENTE ELIQUIS®
É SUPERIOR.1*
demonstrada com
menores taxas de
sangramento
maior vs. varfarina.1
SUPERIORIDADE
SUPERIORIDADE
demonstrada na
redução do risco
de AVC/Embolia
Sistêmica
vs. varfarina.1
demonstrada
em redução de
mortalidade
vs. varfarina.1
SEGURANÇA
em relação a
sangramento maior
semelhante ao AAS.3
ELIQUIS®, o único inibidor direto do fator Xa que demonstrou perfil de segurança
superior à varfarina e semelhante ao AAS em sangramento maior.1-3
SUPERIORIDADE
SUPERIORIDADE
demonstrada no desfecho
de sangramento maior
vs. varfarina.2
demonstrada em redução
de mortalidade vs. varfarina.2
SUPERIORIDADE
SEGURANÇA
demonstrada na redução de AVC/
embolia sistêmica vs. varfarina.2
semelhante ao AAS em relação
a sangramento maior.3
ELIQUIS (apixabana) COMPRIMIDOS REVESTIDOS - USO ADULTO. Reg. MS – 1.0180.0400 ELIQUIS (apixabana) é um potente inibidor do fator Xa, impedindo o desenvolvimento de trombos. É rapidamente absorvido com tempo médio de início de ação entre 3-4 horas após a tomada. Indicações: prevenção de eventos de
tromboembolismo venoso em pacientes adultos que foram submetidos à artroplastia eletiva de quadril ou de joelho e para reduzir o risco de acidente vascular cerebral (AVC), embolia sistêmica e óbito em pacientes com fibrilação atrial não-valvular. Contraindicações: hipersensibilidade à apixabana ou a qualquer componente da
fórmula; em casos de sangramento ativo clinicamente significativo; pacientes com doença hepática associada à coagulopatia e ao risco de sangramento clinicamente relevante. Advertências e precauções: Insuficiência renal: deve ser administrado com cautela em pacientes com insuficiência renal grave (clearance de creatinina
15 - 29 mL/min) e não é recomendado para pacientes em diálise ou com clearance de creatinina < 15 mL/min; nenhum ajuste de dose é necessário em pacientes com insuficiência renal leve ou moderada. Insuficiência hepática: pode ser usado com cautela em pacientes com insuficiência hepática leve ou moderada (Child Pugh
A ou B). Não é recomendado em pacientes com insuficiência hepática grave (vide interações medicamentosas). Pacientes com intolerância à galactose, deficiência de lactase ou má-absorção de glicose-galactose: não devem tomar este medicamento. Risco hemorrágico: os pacientes devem ser cuidadosamente monitorados em
relação aos sinais de sangramento; uso com precaução em condições de risco aumentado de hemorragia, tais como: distúrbios hemorrágicos congênitos ou adquiridos; doença ulcerativa gastrintestinal em atividade, endocardite bacteriana; trombocitopenia; disfunções plaquetárias; história de acidente vascular cerebral hemorrágico;
hipertensão grave não controlada e cirurgia recente cerebral, da coluna vertebral ou oftalmológica. A administração de ELIQUIS deve ser interrompida se ocorrer hemorragia grave. Não é recomendado para pacientes com doença hepática associada à coagulopatia e ao risco de sangramento clinicamente relevante. Punção ou anestesia
espinhal/epidural: cateteres por via epidural ou intratecal devem ser removidos pelo menos 5 horas antes da primeira dose do ELIQUIS; o risco também pode ser aumentado por punção epidural ou espinhal traumática ou repetida. Os pacientes devem ser monitorados com frequência para os sinais e sintomas de comprometimento
neurológico (por exemplo, dormência ou fraqueza nas pernas, disfunção da bexiga ou intestino). Antes da intervenção neuroaxial, o médico deverá considerar o potencial benefício versus o risco em pacientes anticoagulados ou em pacientes a serem anticoagulados para tromboprofilaxia. Pacientes com válvulas cardíacas protéticas:
a segurança e eficácia de ELIQUIS não foram estudadas em pacientes com válvulas cardíacas protéticas, com ou sem fibrilação atrial. Portanto, o uso não é recomendado nesses pacientes. Gravidez: categoria de risco B, não deve ser utilizado por mulheres grávidas sem orientação médica. Interações medicamentosas: inibidores
da CYP3A4 e gpP (cetoconazol, itraconazol; inibidores daprotease do HIV; diltiazem; naproxeno, amiodarona, verapamil, quinidina), indutores de CYP3A4 e de gpP (rifampicina, fenitoína, carbamazepina, fenobarbital ou erva de São João), anticoagulantes, inibidores da agregação plaquetária e AINEs (vide bula completa). Em estudos
realizados em indivíduos sadios, a apixabana não alterou significativamente a farmacocinética da digoxina, naproxeno ou atenolol. Reações adversas: os eventos adversos mais frequentes em pacientes no pós-cirúrgico ortopédico que participaram de estudos clínicos controlados foram: anemia (incluindo anemia pós-operatória e
hemorrágica e os respectivos parâmetros laboratoriais), hemorragia (incluindo hematoma e hemorragia vaginal e uretral), náusea e contusão. Já na indicação para a prevenção do AVC, embolia sistêmica e óbito em pacientes com fibrilação atrial não-valvular, os mais frequentes foram hemorragia (oculares, vasculares, epistaxe, do
trato gastrintestinal e urinário) e contusão. Vide bula completa. Posologia: deve ser engolido com água, com ou sem alimentos. 1) na prevenção de eventos de tromboembolismo venoso em pacientes adultos que foram submetidos à artroplastia eletiva de quadril (a duração do tratamento recomendada é de 32 a 38 dias após a cirurgia)
ou de joelho (a duração do tratamento recomendada é de 10 a 14 dias após a cirurgia): a dose recomendada é de 2,5 mg duas vezes ao dia, por via oral e deve ser tomada 12 a 24 horas após a cirurgia. ELIQUIS não é recomendado em pacientes submetidos à cirurgia de fratura do quadril (esse uso não foi estudado em ensaios
clínicos). Não há necessidade de ajuste de dose em pacientes idosos ou com insuficiência renal leve a moderada. 2) na diminuição de risco de AVC, embolia sistêmica e óbito em pacientes portadores de fibrilação atrial não-valvular: a dose recomendada de ELIQUIS é de 5 mg duas vezes ao dia, por via oral. Idade, peso corporal,
creatinina sérica: em pacientes com pelo menos 2 das características a seguir, idade ≥ 80 anos, peso corporal ≤ 60 kg ou creatinina sérica ≥ 1,5 mg/dL, a dose recomendada de ELIQUIS é de 2,5 mg duas vezes ao dia. Convertendo de ou para anticoagulantes parenterais: em geral, a mudança do tratamento de anticoagulantes
parenterais para ELIQUIS (e vice-versa) pode ser feita na próxima dose agendada. Convertendo de ou para varfarina ou outros antagonistas de vitamina K: ao trocar para ELIQUIS, a varfarina ou o outro antagonista de vitamina K deve ser descontinuado e a administração de ELIQUIS deve ser iniciada quando a relação normalizada
internacional (RNI) estiver abaixo de 2,0. Ao trocar a medicação de ELIQUIS para varfarina ou outro tratamento de antagonista de vitamina K, continuar a administração de ELIQUIS por 48 horas após a primeira dose de varfarina ou do outro tratamento de antagonista de vitamina K. Superdose: não há antídoto para o ELIQUIS; a
superdose pode resultar em um maior risco de sangramento. VENDA SOB PRESCRIÇÃO MÉDICA. A persistirem os sintomas, o médico deverá ser consultado. (ELI04) Rev0613.
CONTRAINDICAÇÕES: HIPERSENSIBILIDADE À APIXABANA OU A QUALQUER COMPONENTE DA FÓRMULA; EM CASOS DE HEMORRAGIA ATIVA CLINICAMENTE SIGNIFICATIVA; PACIENTES COM DOENÇA HEPÁTICA
ASSOCIADA À COAGULOPATIA E A RISCO DE HEMORRAGIA CLINICAMENTE RELEVANTE. INTERAÇÕES MEDICAMENTOSAS: INIBIDORES DA CYP3A4 E GPP (CETOCONAZOL, ITRACONAZOL; INIBIDORES DA PROTEASE DO HIV; DILTIAZEM; NAPROXENO), INDUTORES DE CYP3A4 E DE GPP (RIFAMPICINA, FENITOÍNA, CARBAMAZEPINA, FENOBARBITAL OU ERVA-DE-SÃO-JOÃO); ANTICOAGULANTES, INIBIDORES DA AGREGAÇÃO
PLAQUETÁRIA E AINES. EM ESTUDOS REALIZADOS EM INDIVÍDUOS SADIOS, A APIXABANA NÃO ALTEROU SIGNIFICATIVAMENTE A FARMACOCINÉTICA DA DIGOXINA, NAPROXENO OU ATENOLOL.
Referências bibliográficas: 1. Mitchell SA, Simon TA, Raza S et al. The efficacy and safety of oral anticoagulants in warfarin-suitable patients with nonvalvular atrial fibrillation: systematic review and metaanalysis. Clin Appl Thromb Hemost. 2013;19(6):619-31. 2. Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981–992. 3. Connolly
SJ, Eikelboom J, Joyner C, et al., Apixaban in Patients with Atrial Fibrillation, N Engl J Med, 2011; 364(9): 806-817.
*Versus varfarina na prevenção de AVC e embolia sistêmica em pacientes com FA não valvar.
A PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
Anúncio destinado exclusivamente à classe médica.
ABR/15












