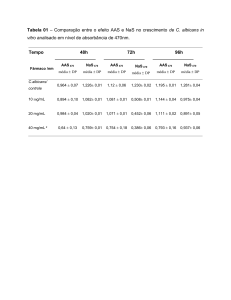
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
Artigo
de Revisão
Aterotrombose e antiagregantes plaquetários
Atherothrombosis and antiplatelet drugs
2
Marcos Vinicius Ferreira Silva, Karine Silvestre Ferreira, Cristina de Mello Gomide Loures, Luci Maria Sant'Ana Dusse,
Lauro Mello Vieira, Arthur Gonçalves Assini, Josianne Nicácio Silveira, Maria das Graças Carvalho
Resumo
Abstract
A aterotrombose é uma doença do sistema circulatório
cujas manifestações clínicas mais significativas (infarto
do miocárdio e acidente vascular encefálico) representam
atualmente as principais causas de mortalidade, com
expectativa de que sua incidência aumente nos próximos
anos. O uso clínico de antiagregantes plaquetários
encontra-se firmemente consolidado como terapia de
escolha na prevenção primária e secundária de eventos
clínicos relacionados à aterotrombose. A presente revisão
tem como objetivo realizar uma descrição dos aspectos
gerais da aterotrombose e dos principais fármacos
antiagregantes plaquetários, com uma descrição breve
de seus aspectos farmacodinâmicos e farmacocinéticos.
Atherothrombosis is a circulatory system disease
whose most significant clinical manifestations
(myocardial infarction and stroke) are today the
leading causes of death worldwide, expected to
increase over the coming years. The clinical use of
antiplatelet agents is firmly established as the therapy
of choice in primary and secondary prevention of
clinical events related to atherothrombosis. This
review offers a description of the general aspects of
atherothrombosis and the main antiplatelet drugs,
with a brief outline of their pharmacodynamic and
pharmacokinetic aspects.
Palavras-chave:
Aterotrombose;
Doenças
cardiovasculares; Inibidores da agregação de plaquetas
Keywords: Atherothrombosis; Cardiovascular
diseases; Platelet aggregation inhibitors
Introdução
morrerão anualmente somente devido a complicações
cardiovasculares2.
A aterotrombose se associa a uma série de
complicações, sendo as mais importantes a doença
arterial coronariana (DAC), cujas principais
manifestações são a angina instável e o infarto agudo
do miocárdio, com ou sem elevação do segmento ST; o
acidente vascular encefálico isquêmico (AVEi) e o
ataque isquêmico transitório, além da doença arterial
obstrutiva periférica (DAOP)1. Estima-se que 17,3
milhões de pessoas tenham morrido devido às doenças
cardiovasculares (DCV) em 2008, sendo 80 % dessas
mortes em países de baixa e média renda. Segundo as
projeções, em 2030 cerca de 23,6 milhões de pessoas
Desse modo, torna-se relevante um maior entendimento
sobre as doenças aterotrombóticas e o uso de
antiagregantes plaquetários, medicamentos largamente
utilizados na prevenção primária e secundária de tais
doenças, seus benefícios e possíveis complicações,
principalmente face à perspectiva do envelhecimento
da população. Conclui-se que este assunto deve receber
dos profissionais especializados na área especial
atenção, e cuidados devem ser dispensados aos
pacientes para que se atinjam melhores resultados com
essa terapêutica tão amplamente utilizada.
Departamento de Análises Clínicas e Toxicológicas - Faculdade de Farmácia - Universidade Federal de Minas Gerais (UFMG) - Belo
Horizonte, MG - Brasil
Correspondência: Marcos Vinícius Ferreira Silva
E-mail: [email protected]
Rua Ciro Vaz de Melo, 514 ap. 4 - Dona Clara - 31255-840 - Belo Horizonte, MG - Brasil
Recebido em: 08/11/2012 | Aceito em: 17/04/2013
221
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
Os fatores de risco para as doenças aterotrombóticas
incluem os fatores genéticos e os adquiridos. Relatos
da literatura citam alguns fatores de risco genéticos:
fator V Leiden3, mutação no gene da protrombina4,
mutações nos genes da antitrombina, proteína C e
proteína S5 e as mutações nos genes das enzimas
5,10-metilenotetrahidrofolato redutase (5,10-MTHFR)
e cistationina β-sintetase (CBS)6, embora todos esses
fatores de risco estejam mais bem estabelecidos para
trombose venosa. Já os principais fatores de risco
adquiridos são: hipertensão7, dislipidemias8, diabetes
mellitus9, tabagismo10 e obesidade11.
A ocorrência de doenças aterotrombóticas relaciona-se
à existência prévia de lesões ateroscleróticas, que se
iniciam por um processo crônico de injúria ao endotélio
arterial podendo ter diversas origens, incluindo as
forças de cisalhamento que se encontram aumentadas
na hipertensão, a hipercolesterolemia, a presença de
produtos de glicação avançada (AGE) no diabetes
mellitus, tabagismo, presença de complexos imunes e
infecções. A disfunção/lesão endotelial leva ao
aumento de permeabilidade, que favorece o processo
de passagem de LDL (lipoproteína de baixa densidade)
da luz vascular para a íntima12. As partículas de LDL
acumuladas no espaço subendotelial interagem com
elementos lá presentes, como proteoglicanos
(especialmente o sulfato de dermatano e o sulfato de
condroitino) que estimulam sua modificação
(agregação, glicosilação, proteólise enzimática e
principalmente oxidação) aumentando sua
aterogenicidade e sua retenção na íntima arterial. A
LDL moderadamente oxidada leva ao recrutamento
de monócitos para o local da lesão, através da indução
da expressão de fatores de adesão, as glicoproteínas
ICAM-1 (molécula de adesão intercelular-1) e
VCAM-1 (molécula de adesão vascular-1) na superfície
das células endoteliais. Após a adesão dos monócitos
à parede vascular, outras moléculas específicas como
a proteína quimiotática de monócitos-1 e o fator
estimulador de colônia de monócitos atraem-nos ao
espaço subendotelial onde se diferenciam em
macrófagos1,12-14. Os macrófagos podem converter a LDL
moderadamente oxidada em LDL altamente oxidada,
que se liga a receptores do tipo scavenger nos
macrófagos e entra nas células, convertendo-os em
células espumosas que, após se saturarem com
lipídeos, podem liberar diversos tipos de produtos,
incluindo colesterol (esterificado e oxidado)
acentuando o processo de dano endotelial e
participando assim no processo de evolução da lesão
aterosclerótica. As alterações no endotélio podem
ainda levar à interação das plaquetas com a parede
vascular e à liberação do fator de crescimento derivado
das plaquetas (PDGF), que estimula as células
musculares lisas da artéria a sintetizar matriz
extracelular13.
222
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
Recentemente, identificou-se importante papel da
netrina-1 no processo de formação da placa
aterosclerótica. Observou-se que essa proteína
envolvida no desenvolvimento neuronal e expressa em
diversos tipos celulares, inclusive células endoteliais
e macrófagos, tem função inibitória sobre a migração
de leucócitos. A expressão da netrina-1 pelas células
espumosas aprisionadas no interior da placa tem efeito
inibitório sobre sua egressão do interior da mesma.
Adicionalmente, a netrina-1 também é fator de
quimiotaxia para células musculares lisas que, ao
serem atraídas para o interior da lesão aterosclerótica,
levam ao espessamento da íntima arterial e ao
crescimento da placa. O efeito da netrina-1 na inibição
de emigração de macrófagos da placa aterosclerótica
tem sido amplamente estudado como possível alvo
terapêutico para a redução de tal tipo de lesão15.
Sabe-se atualmente que tanto a imunidade celular
quanto a imunidade humoral estão intimamente
ligadas à patogênese das lesões ateroscleróticas.
Observa-se que linfócitos T são reativos à forma
oxidada da LDL, e que esses linfócitos reativos
exibem fenótipo Th1, produzindo e liberando
citocinas pró-inflamatórias (interferon-γ, IL-1, IL-12, IL-15,
IL-18, e TNF). Observa-se também que nas placas
ateroscleróticas, há um desequilíbrio entre o número de
células Th1 e Th2, já que há um baixo número de células
Th2, acompanhado por aumento da quantidade de células
Th1. A imunidade humoral também é importante na
patogênese da aterosclerose. Anticorpos IgG e IgM
contra a LDL oxidada são encontradas no plasma,
formando imunocomplexos presentes na placa
aterosclerótica. Tais anticorpos são associados à
progressão e extensão da aterosclerose e devem, portanto,
ser considerados fator de risco para doença coronariana16.
A maior parte dos eventos cardiovasculares de origem
arterial deve-se ao rompimento de placas ateroscleróticas,
causada pela ruptura da capa fibrosa, formação de
trombo sobreposto à lesão e consequente oclusão
arterial. São placas mais vulneráveis à ruptura aquelas
que apresentam certas características específicas
(Figura 1), como a presença de inflamação ativa, capa
fibrosa fina com grande núcleo lipídico, desnudamento
endotelial com consequente agregação plaquetária,
hemorragia no interior da placa, dentre outros17.
Antiagregantes plaquetários
As plaquetas desempenham um papel essencial na
patogênese das doenças aterotrombóticas, justificando
a utilização de fármacos antiagregantes plaquetários
na prevenção, tanto primária quanto secundária, de
eventos aterotrombóticos. A Figura 2 resume
brevemente os alvos farmacológicos dos principais
antiagregantes plaquetários disponíveis:
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
Figura 1
Comparação entre as placas estável e instável
Adaptado de van Lammeren17
Figura 2
Receptores dos principais antiagregantes plaquetários
TXA2R: receptor de tromboxano A2 ; PAR-1: receptor de protease ativada 1; P2Y 12: receptor de ADP;
GPIIb /IIIa: Glicoproteína II b/IIIa - receptor de fibrinogênio/fibronectina. Fonte: Mackman47
223
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
Á cido acetilsalicílico (AAS)
O mecanismo de ação do ácido acetilsalicílico
(AAS) baseia-se na inativação permanente das
isoenzimas ciclooxigenase 1 e 2 (COX-1 e COX-2).
Essas isoenzimas catalisam a conversão do ácido
araquidônico (derivado dos fosfolipídeos da
membrana celular via conversão desses fosfolipídeos
pela fosfolipase A 2) em prostaglandina H2 (PGH2).
A PGH 2 é um intermediário biossintético instável,
que dá origem, através de diversas isomerases, a
uma série de prostanoides bioativos, incluindo o
tromboxano A2 (TXA2) e prostaciclina (PGI2)17,18.
Inicialmente, o AAS se liga a um resíduo de arginina
na posição 120, um sítio de ligação comum a todos os
anti-inflamatórios não esteroides. A seguir, acetila
irreversivelmente um resíduo de serina (na posição 529
na COX-1 e na posição 516 na COX-2), prevenindo o
acesso do ácido araquidônico ao sítio catalítico da
enzima. O AAS possui uma afinidade muito maior pela
COX-1 que pela COX-2, o que explica a necessidade de
doses maiores para a atividade anti-inflamatória e
analgésica do AAS (uma vez que a maioria dos
mediadores inflamatórios e associados à dor é
produzida via COX-2), se comparadas às doses
necessárias à ação antiplaquetária18.
As plaquetas maduras expressam apenas COX-1,
enquanto o endotélio vascular é capaz de expressar
tanto COX-1 quanto COX-2. Plaquetas e endotélio
vascular produzem primariamente TXA 2 e PGI2,
respectivamente, sendo o TXA 2 sintetizado e
produzido pelas plaquetas em resposta a uma série
de estímulos, como a presença de colágeno, trombina
e ADP, induzindo a agregação plaquetária através do
receptor de TXA2 acoplado à proteína G. A ligação do
TXA2 a seu receptor na superfície das plaquetas leva
a uma cascata que culmina na ativação da integrina
de membrana αIIbβ3 (também chamada glicoproteína
GPIIb/IIIa), que auxilia no processo de agregação entre
as plaquetas. O TXA2 apresenta, portanto, uma função
na amplificação da resposta da plaqueta a diversos
agonistas, além de ser um potente vasoconstritor e
pró-aterogênico. A PGI 2, por outro lado, inibe a
agregação plaquetária, induz à vasodilatação, inibe
a proliferação de células musculares lisas vasculares
e protege o miocárdio contra estresse oxidativo, sendo,
portanto, antiaterogênica. Devido à menor
sensibilidade da COX-2 ao AAS, em doses baixas, não
são observados efeitos decorrentes da inibição da
COX-2 endotelial, como hipertensão, redução da função
renal ou interferência na ação de fármacos diuréticos
ou inibidores da enzima conversora de angiotensina18.
A absorção do AAS ocorre principalmente no estômago
e porções superiores do intestino delgado, por meio
224
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
de difusão passiva pelas membranas gastrintestinais.
Após a absorção, o AAS entra em contato com as
plaquetas na circulação portal, onde o fármaco
apresenta concentrações muito mais elevadas que na
circulação sistêmica. Embora o tempo de meia-vida do
AAS varie de 15-20 minutos, o efeito antiplaquetário
dura toda a vida útil da plaqueta, visto que a inibição
da COX pelo fármaco é irreversível e, uma vez que as
plaquetas são anucleadas, esse efeito pode ser revertido
apenas pela geração de novas plaquetas. Formulações
de liberação controlada têm se mostrado úteis para se
reduzir a biodisponibilidade sistêmica, evitando assim
os efeitos deletérios resultantes da inibição da
produção de PGI2 e PGE2, cuja principal manifestação
é o sangramento gastrintestinal, visto que essas
prostaglandinas atuam reduzindo a secreção ácida no
estômago e estimulando a formação de muco protetor.
Além disso, ao atingir a circulação sistêmica, o fármaco
inibe a COX-2 das células endoteliais, levando à
redução nos níveis de PGI2, favorecendo a agregação
plaquetária19-21.
Observa-se que ocorre um fenômeno de baixa
responsividade ao tratamento com AAS em alguns
indivíduos, fenômeno esse conhecido como "resistência
ao AAS" ou "falha ao AAS". A resistência ao AAS pode
ser definida como22:
• falha do AAS em prevenir eventos cardiovasculares
associados à oclusão vascular – também chamada de
resistência clínica ao AAS, ou mais corretamente, falha
do tratamento. Ocorre principalmente porque muitos
outros processos que não são inibidos pelo AAS
também levam à agregação plaquetária.
• falha do AAS em prevenir a atividade plaquetária in
vivo e in vitro – terminologia usada em trabalhos que
avaliam a agregação plaquetária por meio da
determinação do tempo de sangramento e da
agregometria por transmissão de luz.
• falha do AAS em inibir a produção de TXA2 –
utilizado principalmente quando o foco do trabalho
é a resposta farmacológica ao tratamento com AAS.
A influência do AAS na produção de TXA 2 é
mensurada pela dosagem dos níveis plasmáticos de
tromboxano B 2 (TXB 2), um metabólito estável do
tromboxano A 2, ou da dosagem dos níveis urinários
de 11-dihidrotromboxano B2 (11-dhTXB2), formado
pela biotransformação do TXB223.
São reconhecidos vários fatores que levam à
resistência ao AAS, sendo os principais
mecanismos22:
• Reduzida biodisponibilidade do AAS;
• Competição do AAS com outros anti-inflamatórios
não esteroides, como o ibuprofeno, pelo sítio de ligação
(Ser529) à COX-1;
• Renovação acelerada das plaquetas, introduzindo
plaquetas não inibidas na circulação;
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
• Produção de TXA2 pela COX-2 insensível ao AAS em
plaquetas recém-formadas;
• Presença teórica de uma variante da COX-1 pouco
sensível à inibição pelo AAS.
A resistência ao AAS é um fenômeno também associado
a diversos fatores como obesidade e controle glicêmico
inadequado24.
Tienopiridinas
A agregação plaquetária é um processo que depende
da interação de diversos agonistas solúveis com seus
respectivos receptores. Os fármacos da classe das
tienopiridinas atuam inibindo a agregação plaquetária
através da inibição seletiva e irreversível dos receptores
de ADP, chamados receptores P2Y. As plaquetas
apresentam dois subtipos de receptores P2Y: o receptor
P2Y1, que se acopla à proteína Gq e, após ser ativado
pelo ADP, leva a uma mudança de forma da plaqueta e
agregação rápida e reversível; e o receptor P2Y12,
acoplado à proteína Gi, que, após ser ativado, inibe a
adenilclicase, resultando em redução dos níveis de
AMPc, com consequente amplificação da resposta
plaquetária, com estabilização dos agregados e
secreção dos conteúdos dos grânulos plaquetários.
Embora a ativação de ambos os receptores seja
necessária para a agregação plaquetária, o receptor
P2Y12 é considerado o principal receptor de ADP e,
devido à sua expressão mais restrita, tem se tornado
um alvo terapêutico muito interessante para a terapia
antiplaquetária25,26.
A utilização do clopidogrel em terapia combinada com
o AAS foi alvo de diversos ensaios clínicos. A metaanálise de Helton et al.27, envolvendo cinco desses
ensaios, evidencia a eficácia da terapia combinada em
comparação à monoterapia com AAS. Os ensaios
utilizados foram: CURE (Clopidogrel in Unstable Angina
to Prevent Recurrent Events), CREDO (Clopidogrel for the
Reduction of Events During Observation), CLARITY-TIMI 28
(Clopidogrel as Adjunctive Reperfusion Therapy-Thrombolysis
in Myocardial Infarction 28), COMMIT (Clopidogrel and
Metoprolol in Myocardial Infarction Trial) e CHARISMA
(Clopidogrel for High Atherothrombotic Risk and Ischemic
Stabilization, Management and Avoidance). Como
resultado, a mortalidade nos pacientes em terapia
combinada foi 6,3 % vs. 6,7 % nos pacientes que
usavam apenas AAS (p=0,026). A incidência de infarto
do miocárdio e AVE foi 2,7 % vs. 3,3 % (p<0,0001) e
1,2 % vs. 1,4 % (p=0,002), respectivamente27.
Ticlopidina
A ticlopidina é um pró-fármaco que sofre metabolização
hepática pelas enzimas do citocromo P450, dando
origem a no mínimo 13 metabólitos, sendo a maioria
inativa. Apenas um metabólito apresenta atividade
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
antiplaquetária por meio da inibição irreversível do
receptor P2Y1228.
Usualmente, administra-se a ticlopidina por via oral,
na dose de 250 mg duas vezes ao dia. A absorção da
ticlopidina é rápida, e sua biodisponibilidade é de
cerca de 90 %, sendo a concentração plasmática
máxima atingida após 1-3 horas de uma dose oral de
250 mg. Após 2-3 semanas de administração de
ticlopidina duas vezes ao dia, as concentrações
plasmáticas do fármaco praticamente triplicam, devido
à sua acumulação. A meia-vida de eliminação da
ticlopidina é de 24-36 horas após uma dose oral de
250 mg, e de até 96 horas após um regime de 14 dias de
doses repetidas. A ticlopidina apresenta efeito
antiplaquetário retardado, sendo que o nível máximo
de inibição da agregação plaquetária só é observado
dentro de 8-11 dias, o que a torna inadequada quando
é necessário um efeito antiplaquetário imediato26,29.
A ticlopidina tem caído em desuso devido à sua
associação a reações adversas graves e potencialmente
fatais, como neutropenia grave e púrpura
trombocitopênica trombótica26,29.
Clopidogrel
O clopidogrel, assim como a ticlopidina, sofre
metabolização hepática pelas enzimas do citocromo
P450, em especial CYP2C19 e CYP3A4/5, dando
origem após duas etapas a um metabólito ativo
denominado SR26334, que possui meia-vida
relativamente curta (cerca de oito horas). Apenas
concentrações plasmáticas baixíssimas, da ordem de
1 ng/mL são encontradas após a administração de
doses usuais do fármaco. O metabólito ativo inibe
irreversivelmente o receptor de ADP P2Y12 através da
formação de uma ligação dissulfeto com um resíduo
de cisteína no receptor, inibindo assim a ativação e
agregação plaquetária26.
Usualmente, administra-se o clopidogrel com uma dose
de ataque de 300 mg, seguido de dose de manutenção
de 75 mg/dia. Cerca de 4-5 horas após a administração
da dose de ataque, a atividade plaquetária é inibida
em até 30 %, atingindo um estado de equilíbrio de
40-50 % de inibição com a administração diária da
dose de manutenção. A inibição da atividade
plaquetária pelo clopidogrel é dependente da dose,
mas não há relação de proporcionalidade. Observa-se
que, com uma dose de ataque de 600 mg, a inibição
máxima da atividade plaquetária é atingida mais
cedo, em torno de 2-3 horas após a administração do
fármaco, e é também mais intensa, com redução
adicional de 10-15 % em relação à dose de 300 mg. Na
maioria dos pacientes, não há ganhos significativos
com doses de ataque acima de 600 mg28,30.
225
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
A eficácia do tratamento com clopidogrel apresenta
grande variabilidade interindividual em relação à
inibição da agregação plaquetária, podendo ocorrer
baixa responsividade ao tratamento com esse fármaco
em situações nas quais a terapia está sendo
corretamente seguida. A resistência ao clopidogrel
pode ter diversas origens, sendo as mais importantes:
• Polimorfismos nos genes que codificam enzimas
do citocromo P450, principalmente a CYP2C19,
levando à redução na biotransformação do
clopidogrel em seu metabólito ativo, ocasionando
menor responsividade do indivíduo às doses usuais
do fármaco. Não foram relatados polimorfismos nos
genes do receptor P2Y 12 que levem à resistência ao
clopidogrel 31,32.
• Interações farmacológicas, principalmente com
fármacos da classe dos inibidores da bomba de
prótons (principalmente o omeprazol) que também
são metabolizados pela CYP2C19, resultando na
deficiência da formação do metabólito ativo do
clopidogrel, causando redução em seu efeito
antiplaquetário. Também a atorvastatina, um fármaco
hipolipemiante da classe das estatinas, pode levar à
baixa responsividade do tratamento com clopidogrel,
uma vez que ambos possuem a enzima CYP3A4 em
suas respectivas vias de biotransformação, e a
atividade dessa enzima pode ser inibida pela
atorvastatina33.
Prasugrel
O prasugrel é uma tienopiridina de terceira geração,
hidrolisada no trato gastrintestinal, dando origem a
um metabólito intermediário que é então
biotransformado pelas enzimas hepáticas do
citocromo P450 em única etapa, dando origem ao
metabólito ativo que se liga irreversivelmente ao
receptor P2Y12. Após a administração de dose de ataque
de 60 mg de prasugrel, uma inibição máxima da
ativação plaquetária (da ordem de 60-70 %) é obtida
em 2-4 horas. Durante o tratamento de manutenção
com 10 mg diárias do fármaco, atinge-se estado de
equilíbrio com cerca de 50 % de inibição da atividade
plaquetária28.
A rota de ativação in vivo do prasugrel explica a
menor dependência em relação a enzimas do
citocromo P450 para a eficácia do tratamento com esse
fármaco34. Suas principais vantagens em relação ao
clopidogrel são a instalação rápida da atividade
antiplaquetária, a maior inibição da agregação
plaquetária proporcionada pelas doses usuais e a
possibilidade de utilização em casos de baixa
responsividade ao clopidogrel, visto que os mesmos
são causados por fatores que afetam determinadas
enzimas do citocromo P450 e que não interferem na
farmacocinética do prasugrel35.
226
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
O prasugrel foi comparado ao clopidogrel quanto à
eficácia e à segurança pelo ensaio TRITON-TIMI 38
(Trial to Assess Improvement in Therapeutic Outcomes by
Optimizing Platelet Inhibition with Prasugrel-Thrombolysis
in Myocardial Infarction), um ensaio clínico randomizado,
duplo-cego, de fase III. Nesse ensaio ficou constatada
a maior capacidade do prasugrel em reduzir o risco de
ocorrência dos desfechos primários do estudo (infarto
agudo do miocárdio não fatal, AVE não fatal e morte
por doença cardiovascular). Nos pacientes tratados
com prasugrel (10 mg/dia), a incidência de desfechos
primários foi 9,9 % vs. 12,1 % nos tratados com
clopidogrel (75 mg/dia) (p<0,001). Verificou-se
ainda que o prasugrel foi responsável pela redução
na incidência de trombose associada à presença de
próteses expansíveis (stents) (1,1 % vs. 2,4 %,
p<0,001)36. Já o ensaio TRILOGY-ACS (Targeted Platelet
Inhibition to Clarify the Optimal Strategy to Medically
Manage Acute Coronary Syndromes)37 não encontrou
diferenças significativas entre as eficácias de
prasugrel e clopidogrel (13,9 % vs. 16 % de ocorrência
dos desfechos primários, p=0,21), indicando que os
dois fármacos não apresentam diferença de eficácia
em pacientes com angina instável e infarto miocárdico
sem elevação do segmento ST37.
Ticagrelor, cangrelor e elinogrel
O ticagrelor, o cangrelor e o elinogrel são análogos do
ADP que inibem diretamente (sem a necessidade de
conversão in vivo) e reversivelmente os receptores
P2Y1235. O ticagrelor foi aprovado recentemente para
uso clínico, tendo sido encontrada eficácia superior
ao clopidogrel na prevenção de infarto miocárdico,
AVE ou morte por fatores cardiovasculares em
pacientes com síndrome coronariana aguda.
Segundo o ensaio PLATO (PLATelet inhibition and
patient Outcomes)38, a incidência desses eventos foi 9,8 %
nos usuários de ticagrelor vs. 11,7 % nos usuários de
clopidogrel (p<0,001). Recomenda-se como posologia
do ticagrelor a utilização de dose de ataque de 180 mg,
seguida por doses de manutenção de 90 mg, duas vezes
ao dia38.
O cangrelor, por possuir baixa biodisponibilidade por
via oral, é administrado por via endovenosa,
resultando em rápida instalação do efeito inibitório
(atingindo o pico 15 minutos após a administração
do fármaco e o estado de equilíbrio em 30 minutos
após o início da infusão). A inibição da atividade
plaquetária decai aos níveis anteriores ao tratamento
cerca de 1 hora após o término da infusão39.
O elinogrel é um agente antiplaquetário que pode ser
administrado tanto por via endovenosa quanto por
via oral, característica interessante quando se deseja
um rápido início de ação pela administração
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
endovenosa e uma sutil transição para a terapia por
via oral. Esse fármaco ainda está em fase de estudos
clínicos, nos quais se tem observado uma maior
inibição da agregação plaquetária induzida por ADP
se comparado ao clopidogrel35,39.
As diretrizes da Sociedade Europeia de Cardiologia
para síndrome coronariana aguda sem supra de ST
(ESC Guidelines for the Management of Acute Coronary
Syndromes in Patients Presenting without Persistent
ST-Segment Elevation)40 recomendam a adição de um
dos inibidores do receptor P2Y12 à terapia com AAS
sempre que possível, sendo o clopidogrel um fármaco
de terceira escolha, reservado para os casos em que
não seja possível a administração de prasugrel e
ticagrelor40.
Inibidores da GPIIB/IIIA
Diversas vias podem levar à agregação plaquetária,
tornando a eficácia clínica do AAS e das
tienopiridinas apenas parcial, uma vez que esses
fármacos modulam a agregação mediada por TXA2
ou ADP sem afetar a agregação induzida por outros
agonistas como a trombina. A ativação da
glicoproteína IIb/IIIa (GPIIb/IIIa), uma integrina da
membrana plaquetária, representa a via final comum
do processo de agregação das plaquetas,
representando um alvo terapêutico de grande
interesse. Sendo assim, foram desenvolvidos os
inibidores da GPIIb/IIIa, fármacos que inibem a ligação
do fibrinogênio, fator de von Willebrand (FvW) e
outros possíveis agonistas à GPIIb/IIIa ativada29.
Os representantes dessa categoria atualmente
disponíveis para uso clínico são:
• Abciximab (um fragmento Fab de anticorpo
monoclonal quimérico (rato/humano) dirigido
contra a GPII b /III a ). Após a administração do
fármaco, o anticorpo se liga aos receptores inibindo
a agregação plaquetária até 18-24 horas após a
interrupção da infusão. A posologia recomendada
para o abciximab é a administração endovenosa em
forma de bolus de 0,25 mg/kg, seguida por uma
infusão de 0,125 mg/kg/min, por 12 horas ou mais41.
• Eptifibatide (um heptapeptídeo cíclico unido por
ligações dissulfeto). Os estudos farmacocinéticos
indicam que o eptifibatide, após a injeção de bolus de
135 µg/kg via endovenosa, atinge um pico
plasmático de 879±251 ng/mL após 5 minutos, com
uma meia-vida de 1,1±0,17 horas29.
• Tirofiban (um derivado não peptídeo da tirosina).
Quando administrado a 0,15 mg/kg/min por quatro
horas, o tirofiban produz 97 % de inibição da agregação
plaquetária mediada por ADP, com um aumento de 2,5
vezes no tempo de sangramento. O tirofiban apresenta
meia-vida plasmática de 1,6 hora e é excretado
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
inalteradamente pelas vias renal e biliar. Após o fim
da infusão, estima-se que a agregação plaquetária
comece a retornar ao normal dentro de 1,5 hora29.
Segundo a Diretriz Europeia para síndrome
coronariana aguda sem supra de ST 40, o uso de
inibidores da GP IIb/IIIa é recomendado em pacientes
já submetidos à terapia dupla (AAS+ inibidor P2Y12)
em pacientes submetidos a angioplastia coronariana
de alto risco (com troponina elevada, trombo visível)
se o risco de sangramento é baixo. Eptifibatide ou
tirofiban podem ser administrados em conjunto com o
AAS antes da angioplastia coronariana em pacientes
que não utilizaram fármacos inibidores do receptor
P2Y12. Em pacientes de alto risco, recomenda-se
administrar eptifibatide ou tirofiban em adição à
terapia dupla se há um processo isquêmico em
andamento e o risco hemorrágico é baixo40.
Inibidores da fosfodiesterase
Os principais representantes dessa classe são o
dipiridamol e o cilostazol. O dipiridamol é um agente
antiagregante plaquetário e vasodilatador, capaz de
inibir a agregação plaquetária através do aumento
do nível de AMPc intracelular, o qual pode ser obtido
através da inibição da fosfodiesterase (PDE), enzima
responsável por degradar o AMPc e pela diminuição
da captação de adenosina, que atua nos receptores
A 2 estimulando a adenilciclase plaquetária. O
dipiridamol tem sido empregado nas doses orais de
300-400 mg/dia, sendo depurado através de
biotransformação hepática, com meia-vida de
eliminação de 10 horas. A biodisponibilidade do
dipiridamol é extremamente variável (27-88 %), o que
exigiu o desenvolvimento de formulações de liberação
controlada de dipiridamol que aumentaram a
biodisponibilidade do fármaco e tornaram-nas mais
previsíveis42,43.
Estudos recentes têm avaliado a eficácia de
formulações contendo doses baixas de AAS associadas
ao dipiridamol em liberação controlada. A associação
dos dois fármacos parece levar a efeito protetor. O
segundo estudo European Stroke Prevention Study
(ESPS-2) 44 concluiu que o uso dessa associação
reduz o risco de AVE em 23 % e de infarto miocárdico
em 20 %, se comparado ao AAS isolado 44.
O cilostazol é um inibidor reversível da
fosfodiesterase tipo III, com ações antiagregante
plaquetária e vasodilatadora, além de ser capaz de
reduzir a proliferação de células musculares lisas
vasculares. Associado ao AAS e ao clopidogrel, na
posologia de 100 mg duas vezes ao dia, o cilostazol
parece potencializar a inibição da agregação
plaquetária43.
227
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
Antagonistas do receptor de trombina
A trombina gerada pela cascata da coagulação é
potente ativador das plaquetas através de sua ação em
receptores plaquetários acoplados à proteína G,
chamados receptores ativados por protease (PAR-1
e PAR-4). O PAR-1 possui afinidade 10-100 vezes maior
pela trombina que o PAR-4, justificando sua escolha
sobre o PAR-4 como alvo terapêutico. Os antagonistas
do PAR-1, representados pelo vorapaxar e pelo
atopaxar, inibem a agregação plaquetária dependente
de trombina por impedir a ligação da mesma a seus
receptores plaquetários35.
Após a administração por via oral, o vorapaxar é
rapidamente absorvido, sendo o pico da atividade
antiplaquetária atingida dentro de 1-2 horas. A
excreção do vorapaxar é principalmente por via fecal,
sendo extremamente lenta, com uma meia-vida de
eliminação de 159-311 horas, inibindo a função
plaquetária até quatro semanas após a interrupção do
tratamento. Os ensaios clínicos de fase 1 demonstraram
que a posologia mais adequada do vorapaxar é dose
de ataque de 40 mg, seguida por doses de manutenção
de 2,5 mg, uma vez ao dia. Dois estudos de fase 3 que
buscavam avaliar a eficácia e a segurança do vorapaxar
sofreram alterações recentes, devido ao aumento de
risco de hemorragia intracranial em pacientes com
histórico de AVE isquêmico, levando à retirada de tais
pacientes do estudo TRA-2ºP-TMI 50 (Thrombin
Receptor Antagonist in the Prevention of Atherothrombotic
Ischemic Events-TMI 50) e ao fim do estudo TRA-CER
(Thrombin Receptor Antagonist for Clinical Event Reduction
in Coronary Syndrome)45,46.
Os resultados dos estudos clínicos envolvendo o
atopaxar foram considerados satisfatórios o
suficiente para se iniciar os ensaios de fase 3. No
entanto, o aumento na incidência de sangramentos,
disfunção hepática, prolongamento do intervalo QT
e a falta de evidências sobre a relação entre a dose e
a eficácia e o risco de sangramentos podem ser
fatores que dificultem a utilização clínica desse
fármaco35.
Face à frequência e gravidade das doenças
aterotrombóticas e em consonância com a necessidade
de adoção de medidas terapêuticas de prevenção
primária e secundária, deve-se envidar esforços
substanciais na busca de novos antiagregantes
plaquetários e/ou de novos protocolos de tratamento
envolvendo dupla-antiagregação, que possam trazer
maiores benefícios à população no sentido de se evitar
manifestações aterotrombóticas sem, todavia,
predispor a eventos hemorrágicos.
228
Agradecimentos
Luci Maria Dusse e Maria das Graças Carvalho agradecem
ao CNPq pela bolsa de produtividade em pesquisa.
Potencial Conflito de Interesses
Declaro não haver conflitos de interesses pertinentes.
Fontes de Financiamento
O presente estudo não teve fontes de financiamento
externas.
Vinculação Acadêmica
Este artigo representa parte do Trabalho de Conclusão de
Curso (TCC) de graduação em Farmácia de Marcos
Vinicius Ferreira Silva pela Universidade Federal de Minas
Gerais.
Referências
1. Vi l e s - G o n z a l e z J F, F u s t e r V, B a d i m o n J J .
Atherothrombosis: a widespread disease with
unpredictable and life-threatening consequences. Eur
Heart J. 2004;25(14):1197-207.
2. World Health Organization (WHO). [Internet].
Cardiovascular diseases. Fact sheets 317. [cited 2012 Apr
10]. Available from: <http://www.who.int/
mediacentre/factsheets/fs317/en/index.html>
3. Eitzman DT, Westrick RJ, Shen Y, Bodary PF, Gu S,
Manning SL, et al. Homozygosity for Factor V Leiden
leads to enhanced thrombosis and atheroclerosis in
mice. Circulation. 2005;111(14):1822-5.
4. Burzotta F, Leone AM, Paciaroni K, De Stefano V, Rossi
E, Testa L, et al. G20210A prothrombin gene variant and
clinical outcome in patients with a first acute coronary
syndrome. Haematologica. 2004;89(9):1134-8.
5. Soare AM, Popa C. Deficiencies of proteins C, S and
antithrombin and factor V Leiden and the risk of
ischemic strokes. J Med Life. 2010;3(3):235-8.
6. Hankey GJ, Eikelboom JW, Ho WK, van Bockxmeer
FM. Clinical usefulness of plasma homocysteine in
vascular disease. Med J Aust. 2004;181(6):314-8.
7. Teles CPS, Tavares Filho SC, Sousa ACS, Barreto Filho
JAS. Hipertensão: um estado pró-trombótico. Rev Bras
Hipertens. 2007;14(4):245-51.
8. Sposito AC, Caramelli B, Fonseca FA, Bertolami MC,
Afiune Neto A, Souza AD, et al; Sociedade Brasileira de
Cardiologia. IV Diretriz brasileira sobre dislipidemias e
prevenção da aterosclerose. Departamento de
Aterosclerose da Sociedade Brasileira de Cardiologia.
Arq Bras Cardiol. 2007;88(supl.1):2-19.
9. Tufano A, Cimino E, Di Minno MN, Ieranò P, Marrone
E, Strazzullo A, et al. Diabetes mellitus and
cardiovascular prevention: the role and the limitations
of currently available antiplatelet drugs. Int J Vasc Med.
2011;2011:250518.
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
10. Heitzer T, Ylä-Herttuala S, Luoma J, Kurz S, Münzel T,
Just H, et al. Cigarette smoking potentiates endothelial
dysfunction of forearm resistance vessels in patients
with hypercholesterolemia. Role of oxidized LDL.
Circulation. 1996;93(7):1346-53.
11. Lieb W, Pencina MJ, Lanier KJ, Tofler GH, Levy D, Fox
CS, et al. Association of parental obesity with
concentrations of select systemic biomarkers in
nonobese offspring: the Framingham Heart Study.
Diabetes. 2009;58(1):134-7.
12. Badimón L, Vilahur G, Padró T. Lipoproteins, platelets and
atherothrombosis. Rev Esp Cardiol. 2009;62(10):1161-78.
13. Brasileiro Filho G. Bogliolo patologia. 7a. ed. Rio de
Janeiro: Guanabara-Koogan; 2006.
14. Gawaz M. The evolving science of atherothrombotic
disease. Eur Heart J Suppl. 2008;10(Suppl I):I4-7.
15. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon
B, Ray TD, Rayner KJ, et al. The neuroimmune guidance
cue netrin-1 promotes atherosclerosis by inhibiting the
emigration of macrophages from plaques. Nat
Immunol. 2012;13(2):136-43.
16. Pereira IA, Borba EF. The role of inflammation, humoral
and cell mediated autoimmunity in the pathogenesis of
atherosclerosis. Swiss Med Wkly. 2008;138(37-38):534-9.
17. van Lammeren GW, Moll LF, Borst GJ, de Kleijn DP, de
Vries JP, Pasterkamp G. Atherosclerotic plaque
biomarkers: beyond the horizon of the vulnerable
plaque. Curr Cardiol Rev. 2011;7(1):22-7.
18. Patrono C, García Rodríguez LA, Landolfi R, Baigent C.
Low-dose aspirin for the prevention of
atherothrombosis. N Engl J Med. 2005;353(22):2373-83.
19. Dai Y, Ge J. Clinical use of aspirin in treatment and
prevention of cardiovascular disease. Thrombosis.
2012;2012:245037.
20. Brown N, May JA, Wilcox RG, Allan LM, Wilson AM, Kiff
PS, et al. Comparison of antiplatelet activity of
microencapsulated aspirin 162,5 Mg (Caspac XL), with
enteric coated aspirin 75 mg and 150 mg in patients
with atherosclerosis. Br J Clin Pharmacol.
1999;48(1):57-62.
21. Pignone M, Williams CD. Aspirin for primary prevention
of cardiovascular disease in diabetes meIlitus. Nat Rev
Endocrinol. 2010;6(11):619-28.
22. Cattaneo M. Aspirin and clopidogrel: efficacy, safety,
and the issue of drug resistance. Arterioscler Thromb
Vasc Biol. 2004;24(11):1980-7.
23. Eikelboom JW, Hirsh J, Weitz JI, Johnston M, Yi Q, Yusuf
S. Aspirin-resistant thromboxane biosynthesis and the
risk of myocardial infarction, stroke, or cardiovascular
death in patients at high risk for cardiovascular events.
Circulation. 2002;105(14):1650-5.
24. Ertugrul DT, Tutal E, Yildiz M, Akin O, Yalçin AA, Ure OS,
et al. Aspirin resistance is associated with glycemic control,
the dose of aspirin, and obesity in type 2 diabetes
mellitus. J Clin Endocrinol Metab. 2010;95(6):2897-901.
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
25. Brunton LL, Chabner BA, Knollmann BC, eds. Goodman
& Gilman: as bases farmacológicas da terapêutica. 12a.
ed. Porto Alegre: McGraw-Hill; 2012.
26. Marczewski MM, Postula M, Kosior D. Novel
antiplatelets agents in the prevention of cardiovascular
complications - focus on ticagrelor. Vasc Health Risk
Manag. 2010;6:419-29.
27. Helton TJ, Bavry AA, Kumbhani DJ, Duggal S, Roukoz
H, Bhatt DL. Incremental effect of clopidogrel on
important outcomes in patients with cardiovascular
disease: a meta-analysis of randomized trials. Am J
Cardiovasc Drugs. 2007;7(4):289-97.
28. Wallentin L. P2Y12 inhibitors: differences in properties
and mechanisms of action and potential consequences
for clinical use. Eur Heart J. 2009;30(16):1964-77.
29. Patrono C, Baigent C, Hirsh J, Roth G; American
College of Chest Physicians. Antiplatelet drugs:
American College of Chest Physicians evidence-based
clinical practice guidelines (8th edition). Chest.
2008;133(6 Suppl):199S-233.
30. Fuchs FD, Wannmacher L. Farmacologia clínica:
fundamentos da terapêutica racional. 4a. ed. Rio de
Janeiro: Guanabara-Koogan; 2010.
31. Vlachojannis GJ, Dimitropoulos G, Alexopoulos D.
Clopidogrel resistance: current aspects and future
directions. Hellenic J Cardiol. 2011;52(3):236-45.
32. Kwan J, Htun WW, Huang Y, Ko W, Kwan TW. Effect of
proton pump inhibitors on platelet inhibition activity of
clopidogrel in Chinese patients with percutaneous
coronary intervention. Vasc Health Risk Manag.
2011;7:399-404.
33. Bates ER, Lau WC, Angiolillo DJ. Clopidogrel-drug
interactions. J Am Coll Cardiol. 2011;57(11):1251-63.
34. Damman P, Woudstra P, Kuijt WJ, de Winter RJ, James
SK. P2Y12 platelet inhibition in clinical practice. J
Thromb Thrombolysis. 2012;33(2):143-53.
35. Michelson AD. Advances in antiplatelet therapy.
Hematology Am Soc Hematol Educ Program.
2011;2011:62-9.
36. Eshaghian S, Shah PK, Kaul S. Advances in antiplatelet
treatment for acute coronary syndromes. Heart.
2010;96(9):656-61.
37. Roe MT, Armstrong PW, Fox KA, White HD, Prabhakaran
D, Goodman SG, et al; TRILOGY ACS Investigators.
Prasugrel versus clopidogrel for acute coronary
syndromes without revascularization. N Engl J Med.
2012;367(14):1297-309.
38. Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson
H, Held C, et al; PLATO Investigators. Ticagrelor versus
clopidogrel in patients with acute coronary syndromes.
N Engl J Med. 2009;361(11):1045-57.
39. Siller-Matula JM, Krumphuber J, Jilma B. Pharmacokinetic,
pharmacodynamic and clinical profile of novel
antiplatelet drugs targeting vascular diseases. Br J
Pharmacol. 2010;159(3):502-17.
229
Rev Bras Cardiol. 2013;26(3):221-30
maio/junho
40. Hamm CW, Bassand JP, Agewall S, Bax J, Boersma E,
Bueno H, et al; ESC Committee for Practice Guidelines.
ESC Guidelines for the management of acute coronary
syndromes in patients presenting without persistent
ST-segment elevation: The Task Force for the
management of acute coronary syndromes (ACS) in
patients presenting without persistent ST-segment
elevation of the European Society of Cardiology (ESC).
Eur Heart J. 2011;32(23):2999-3054.
41. Born G, Patrono C. Antiplatelet drugs. Br J Pharmacol.
2006;147(Suppl 1):S241-51.
42. Hall R, Mazer CD. Antiplatelet drugs: a review of their
pharmacology and management in the perioperative
period. Anesth Analg. 2011;112(2):292-318.
230
Silva et al.
Aterotrombose e antiplaquetários
Ar
tigo de Revisão
Artigo
43. Patrono C, Andreotti F, Arnesen H, Badimon L, Baigent
C, Collet JP, et al. Antiplatelet agents for the treatment
and prevention of atherothrombosis. Eur Heart J.
2011;32(23):2922-32.
44. Shulga O, Bornstein N. Antiplatelets in secondary stroke
prevention. Front Neurol. 2011;2:36.
45. Abdulsattar Y, Ternas T, Garcia D. Vorapaxar: targeting
a novel antiplatelet pathway. P T. 2011;36(9):564-8.
46. White HD. Oral antiplatelet therapy for atherothrombotic
disease: current evidence and new directions. Am Heart
J. 2011;161(3):450-61. Erratum in: Am Heart J.
2011;162(3):569.
47. Mackman N. Triggers, targets and treatment for
thrombosis. Nature. 2008;451(7181):914-8.