Imunologia
2º aula
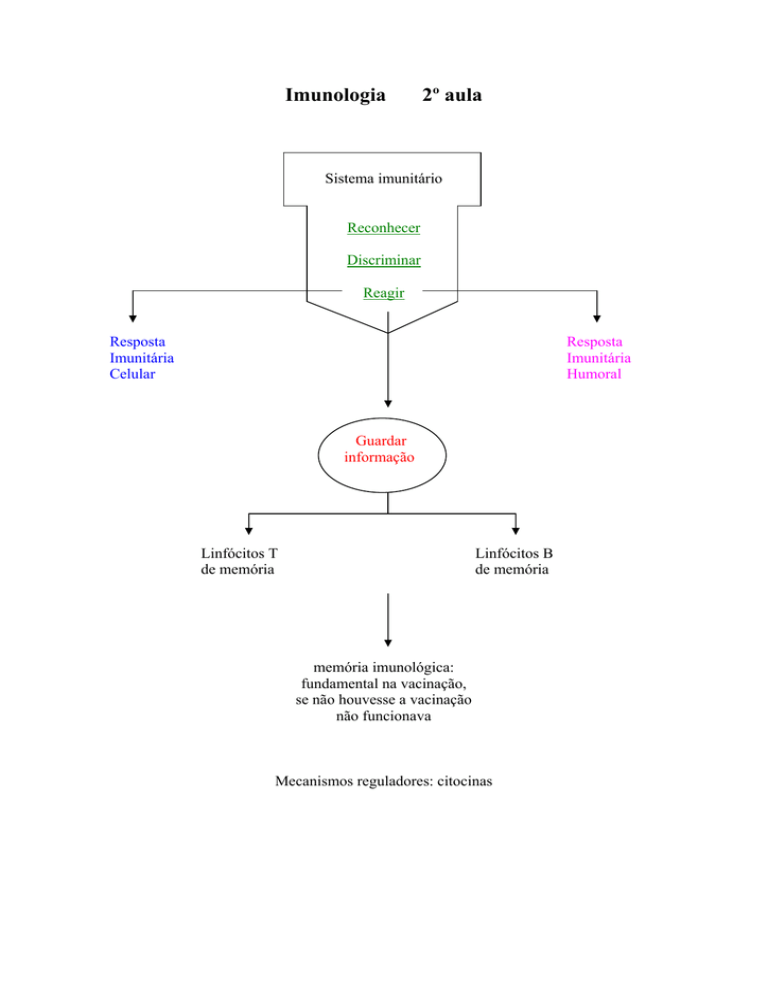
Sistema imunitário
Reconhecer
Discriminar
Reagir
Resposta
Imunitária
Celular
Resposta
Imunitária
Humoral
Guardar
informação
Linfócitos T
de memória
Linfócitos B
de memória
memória imunológica:
fundamental na vacinação,
se não houvesse a vacinação
não funcionava
Mecanismos reguladores: citocinas
Resposta imunitária
O que é fundamental é termos o Ag (antigénio) - apresentação antigénica
Para os linfócitos se aperceberem do Ag há células apresentadoras do Ag (APC)
que preparam o Ag para que ele seja apresentado aos linfócitos.
Essa apresentação dá-se aos linfócitos T
pode adquirir
capacidade
citotóxica
estimula macrófagos
que têm capacidade
citotóxica
recruta linfócitos B
para se transformarem
em plasmócitos
(produzem Ac)
NOTA: APC - qualquer célula que pode processar e apresentar péptidos antigénicos em
associação com a classe II, MHC e enviar um sinal co-estimulatório necessário para a
activação das células T. Há APCs profissionais (células B, células dendríticas e
macrófagos) e APCs não profissionais (que só funcionam por períodos curtos na
presença do Ag, são as células do epitélio do timo, etc)
Existem 3 tipos de linfócitos T:
- CD4 TH2
- CD4 TH1
tanto podem levar a produção de Ac como a toxicidade
- CD8
Antigénio (definição): estruturas moleculares que são reconhecidas especificamente
pelo sistema imunitário
(receptores das células T) TCR------- linfócitos T
(imunoglobulinas)
Igs -------- linfócitos B
↓
não são albuminas
Uma célula não é um antigénio, tem muitos Ags (moléculas) _ pode-se falar em células
antigénicas
Proteínas do sangue: - globulinas
- albuminas
As Igs são semelhantes a anticorpos mas não são o mesmo!
Antigenicidade - conceito de uma molécula capaz de se ligar ou reagir com o sistema
imunitário
Imunogenicidade - conceito de uma molécula capaz de produzir uma resposta
imunitária. É a estimulação da resposta imunitária.
Hapteno:
(no livro)
Ag sem imunogenicidade. Estrutura que se liga ao Ac mas não estimula resposta
imunitária ( o professor considera mais simples e não concorda muito com este conceito
de Hapteno, para ele alguns Ag têm apenas antigenicidade,, outros têm também
imunogenicidade).
Superantigénio:
Molécula pode estimular 1000 TCR (1000 células diferentes)
O antigénio tem especificidade quanto a um Ac ou a um TCR
Ags (classificação):
1- localização
celulares (à superfície da célula)
não celulares (solúveis) _ são proteínas moleculares que
não estão em células
2- Natureza química
proteínas (mais antigénicas do q eu qualquer outra
estrutura)
polissacarídeos
lípidos (glicolípidos)
3- estimulação imunitário
linfócitos T
linfócitos T+B
linfócitos B
4- origem
naturais (existem na
natureza
espontaneamente)
Auto Ags a)
Alo Ags
b)
Xeno Ags c)
sintéticas
artificiais
a) Ags do próprio organismo
ex: Ags do grupo sanguíneo, a nossa albumina
b) se os nossos Ags (transfusão sanguínea) são Ags de indivíduos diferentes da mesma
espécie
c) Ags de uma espécie diferente, por exemplo, os nossos antigénios serem injectados
num coelho
Complexidade molecular e antigenicidade
Para haver antigenicidade tem de haver complexidade molecular.
Uma pequena molécula pode ser Antigénica, mas pode não ser Imunológica.
É a configuração espacial da molécula que leva à antigenicidade e imunogenicidade.
Uma proteína com estrutura quaternária tem maior antigenicidade do que uma com
estrutura secundária.
O que é o epitopo? São as regiões imunologicamente activas de um Ag que se liga a
receptores membranares antigénicos _ (específicos) em linfócitos ou Acs secretados.
Complementaridade da ligação Ag/Ac
Epitopo do Ag
Paratopo do Ac
complementaridade
Ags: epitopos e valências
Epitopos
funcionais
(estão acessíveis)
Cadeia
polipeptídica
Epitopos ocultos
(não funcionais)
Valência do Ag:
Valência total:
10 (n.º de epitopos totais)
Valência funcional: 5 (apenas 5 estão acessíveis)
Esta acessibilidade do epitopo depende da configuração da molécula.,
Sequenciais _ na estrutura da molécula há um conjunto de a.a.
sequenciais que constituem o epitopo
Epitopos
Não sequenciais _ os a.a. que constituem o epitopo não são
sequenciais. Se a molécula desenrolar, os 2
compostos de a.a. separam-se e os epitopos
perdem-se por desnaturação
Influência da conformação molecular na ligação Ag-Ac
Podemos reconstruir artificialmente o epitopo :
- pode ter cadeia aberta _ não dá reacção
- ou criar pontes dissulfeto _ reacção semelhante ao epitopo natural
configuração do epitopo é essencial para a resposta imunitária
Acessibilidade do epitopo e antigenicidade
Índice de protusão da molécula:
- qto maior é o índice, mais exterior está a molécula
- qto menor é o índice, mais escondida está a molécula
Não é a visibilidade do epitopo que é importante, ele pode estar bastante escondido.
Efeito portador
Hapteno ao ser ligado a um portador e for injectado há resposta imunitária
O portador faz com que o Ag sem imunogenicidade passe a ter imunogenicidade
passa a ter capacidade de estimular sistema imunitário.
Produzem-se
3 tipos de Ac
Contra o Ag
Contra o portador (molécula que auxilia o Ag)
Contra o portador e Ag simultaneamente
Alergia à penicilina (é um antigénio sem imunogenicidade):
Quando injectada liga-se a proteínas da pele (por ex:) e transforma-se em estruturas Ag sem imunogenicidade
portador que estimulam o sist. Imunitário
Adjuvantes: fazem com que o Ag sem imunogenicidade ou que dificilmente desperta
imunogenicidade, desperta essa resposta (melhora a resposta imunitária).
Quando se usa: aumenta imunogenicidade do Ag, quando este:
Apresenta
Baixa imunogenicidade
está em
pequena quantidade de Ag
Como actuam?
1- alguns prolongam persistência do Ag
2- aumentam o sinal co-estimulador
3- induzem formação de granuloma
4- estimulam de forma não específica os linfócitos
Imunologia
3ª aula
Os adjuvantes vão aumentar a imunogenicidade (capacidade de estimular a resposta
imunitária) dos antigénios.
Efeitos dos adjuvantes:
- a) uns provocam a resistência dos antigénios
- b) outros aumentam o sinal co-estimulatório
- c) outros induzem a formação de granuloma
- d) outros estimulam inespecificamente os linfócitos
a) Prolongando a presença do antigénio, vai de forma simples melhorar a
imunogenicidade (o antigénio fica mais tempo sendo mais fácil estimular o sistema
imunitário).
b) Na apresentação antigénica, quando o antigénio é apresentado, não basta ele ser
apresentado directamente a uma célula, é necessário um sinal co-estimulatório. Isto é,
um linfócito para responder, não responde ao primeiro sinal necessitando de um
segundo sinal confirmatório _ co-estimulação. O adjuvante dá muitas vezes esse sinal
conseguindo assim que o antigénio seja mais imunogénico.
c) Induzindo a formação do granuloma, havendo células apresentadoras, mais
facilmente o antigénio é apresentado e estimula o sistema imunitário.
Injecção de adjuvantes → a infiltração de linfócitos e de fagócitos → origina uma
densa massa rica em macrófagos - o granuloma. Uma vez que estes macrófagos estão
activados, este mecanismo leva à activação das células Th.
Outra situação dá-se quando a resposta imunitária não é devidamente estimulada,
acabando os linfócitos por entrar em morte celular programada (apoptose). A apoptose é
uma morte celular programada que resulta da desintegração do DNA da célula, nas
células normais necessita de um indutor de morte. Nos linfócitos esse indutor não é
necessário, basta que não existam estímulos suficientes para que o linfócito entre em
morte celular. Isto tem lógica porque se o linfócito está programado para responder a
estímulos, se ele deixar de ter estímulos deixa de ter razão de existir. Sempre que faltem
os estímulos o linfócito entra em morte celular.
Quando fazemos uma estimulação ao sistema imunitário, colocando um Ag A num
organismo vamos ter uma resposta designada primária, que se dá cerca de 1 a 2
semanas depois (podendo até ser mais) em relação à injecção do antigénio dependendo
do animal e do antigénio.
Respostas primárias e secundárias ao Ag
Antigene A
+ Antigene B
Serum antibody level
Antigene A
secondary anti-A response
(é muito mais intensa, ocorre após um
período mais curto e é mais duradoura!)
Primary anti-A
response
⏐
0
⏐
14
//
⏐
0
primary anti-B response
⏐
6
⏐
14
Time, days
Se voltar a injectar o animal com o mesmo antigénio A, vai dar-se uma resposta
secundária que será muito mais intensa que a primária.
Se inocularmos uma injecção com antigénios A e B, vai dar-se uma resposta
secundária ao Ag A e uma resposta primária ao Ag B em tudo semelhante à resposta
primária do Ag A.
As respostas primárias são as primeiras que se dão em relação ao antigénio,
sendo a resposta específica para cada Ag. A resposta secundária por 2a injecção do
mesmo Ag é muito mais intensa e é muito mais duradoura do que a resposta primária.
Este princípio é o mesmo que se aplica na vacinação: administrar uma dose e mais tarde
administrar outra dose para estimular o mais possível o sistema imunitário de modo a
que essa resposta imunitária secundária se mantenha por muito mais tempo.
O que nos interessa em relação a um antigénio ( vírus, bactéria) é termos
resistência e estarmos protegidos contra esse mesmo Ag. A imunidade duradoura só
acontece se houver memória imunológica. Por vezes basta-nos termos uma resposta
imunitária (não sendo necessária memória imunitária) por proliferação linfocitária,
pelos linfócitos efectores, ou pela produção de anticorpos, bastando para destruirmos ou
controlarmos o antigénio.
Antigénios: resposta imunitária
Tolerância
Antigénio
Qualquer substância
(“estranha”) que se liga
especificamente a um Ac ou a
um receptor Tcell. É sinónimo
de imunogenicidade
Memória
imunológica
Resposta imunitária
Baixa dose
Alta dose
Desgaste
Quimera
Imunidade
+
Proliferação
linfocitária
Linfócitos
efectores
++
Produção
de anticorpos
Por vezes nós não conseguimos responder ao antigénio. Quando isso acontece
passamos de uma situação de tolerância (ao Ag) a uma situação de alergia, isto é, nós
não somos capazes de responder ao antigénio..
A tolerância é um fenómeno muito interessante pois pode depender de baixa
dose ou alta dose de antigénio. Um Ag em baixa dose pode não ser imunogénico,
portanto é tolerado - não estimula.. No caso de haver um adjuvante já deixa de haver
tolerância em baixa dose. Curiosamente o antigénio também pode ser tolerado em alta
dose, como é o caso dos tumores. O sist. imunitário não reage a essa grande quantidade
de antigénios que dão tolerância e não estimulação ao sistema imunitário. Há também
outros processos mais complexos como é o caso dos desgastes e das quimeras ao
sistema imunitário (uma célula tumoral, hoje expressa um antigénio tumoral, amanhã já
expressa outro. Portanto, enquanto o sistema imunitário vai reagir contra um antigénio
que ela expressava esta semana, para a semana ou no dia a seguir já tem outro, e,
portanto o sistema imunitário pode ter quimeras não tendo uma actuação correcta. A
tolerância pode assim surgir de várias formas, no entanto nós não pretendemos que isso
aconteça.
Os linfócitos derivam da medula óssea, duma célula imatura por um rearranjo
genético que vai se transformando. Nessa evolução desde a célula imatura até um
linfócito maduro, e, depois este linfócito poder transformar-se num plasmócito, o
antigénio é fundamental para que haja proliferação linfocitária, isto é o linfócito não
prolifera se não tiver o estímulo do antigénio. Há como que uma selecção do Ag pelo
respectivo .grupo de linfócitos. Os linfócitos frente à estimulação do antigénio vão
proliferar podendo gerar células de memória, transformar-se em plasmócitos e levar à
produção de anticorpos. Assim para haver produção de anticorpos necessitamos de
antigénios.
Anticorpo e imunoglobulina são praticamente a mesma coisa: imunoglobulina é
a estrutura físico-química do anticorpo. No entanto uma coisa é estrutura e outra é
funcionalidade. Se a Ig se consegue ligar ao Ag é um Ac, se não se conseguir ligar não é
um anticorpo. Pode-se quase dizer que todas as Igs podem funcionar como anticorpo.
Por vezes não nos é fácil olhar para uma Ig e dizer onde está o Ag que lhe é específico.
As Igs tem classes e subclasses. A estrutura de uma Ig consiste em duas cadeias
polipeptídicas pesadas (peso molecular elevado) e duas cadeias leves. Existem ainda
entre elas ligações dissulfeto fundamentais para que a molécula mantenha a sua
configuração espacial.
A sequência polipeptídica das cadeias pesadas é variável, existindo 5 cadeias
polipeptídicas diferentes (γ, α, μ, δ e ε). Se uma Ig tiver cadeias pesadas γ será uma Ig
G, e assim sucessivamente (ver esquema a seguir). As 2 cadeias pesadas são iguais,
assim como as leves são iguais entre si. Em relação às subclasses existem pequenas
variações que darão origem por exemplo à Ig A1 e A2.
Imunoglobulinas/Anticorpos
(classes e subclasses)
5 classes
5 classes
Tipos de
cadeias pesadas:
γ
IgG
IgG1
IgG2
IgG3
IgG4
4 subclasses de IgG
α
IgA
IgA1
IgA2
2 subclasses de IgA
μ
δ
ε
IgM
a existência de subclasses implica diferenças
funcionais nas Igs!
IgD
IgE
sequências polipeptídicas
(se tiver cadeia pesada γ é uma IgG
se tiver cadeia pesada α é uma IgA)
A nível da filogenia reparamos que os invertebrados não têm Ig. Nos vertebrados
reparamos que quanto mais evoluído o ser vivo mais Igs ele tem. As respostas vão ser
mais acentuadas nos seres mais evoluídos. Isso pode ser vantajoso ou não: se não
produzíssemos Ig E não tínhamos alergias (o coelho não tem Ig E logo não tem
alergias), no entanto a Ig E vai ser-nos útil para a defesa contra parasitas.
Houve quem dissesse que como as Ig migravam todas na banda gama poderiam
chamar-se gamaglobulinas, não sendo isto verdade. Num perfil electroforético
verificamos que a única que migra quase tudo na zona gama é a classe G. Quanto à A
migra mais na zona beta-gama; a M migra muito mais na zona beta e alfa2; a D e a E
também ficam pela zona alfa2. logo é um erro muito grande chamarmos gamaglobulinas
às imunoglobulinas.
Separação electroforética das proteínas
+
-
Albumina
Absorvância
__
γ
__
depois da imunização
__
α (1 e 2)
β
antes da imunização
__
⏐
⏐
⏐
⏐
⏐
distância
Nas cadeias leves e nas pesadas há um terminal amina e um carboxilico. Nestas
cadeias há zonas variáveis e zonas relativamente constantes, tanto nas cadeias leves
como nas pesadas. A Ig que tem que adaptar o epitopo ao antigénio, para se adaptar ao
antigénio vai necessitar de variabilidade (diferentes antigénios têm diferentes
sequências de a.a..). O Ag vai assim ligar-se na zona variável da cadeia leve e da
pesada.
Uma Ig pode ligar-se a 2 epitopos. Uma zona importante é a zona da charneira
(dobradiça) que permite a flexibilidade da molécula necessária para a ligação ao
epitopo.
Se degradarmos a Ig com enzimas proteolíticas (por exemplo a pepsina) vamos
ter um fragmento Fab2. Se for uma digestão com cafeína surgem 2 fragmentos: Fab e
Fc. Fab é a abreviatura de fragment antigen binding (fragmento que se liga ao
antigénio). O Fc é a abreviatura de fragmento cristalizável (no coelho pois no homem
não são cristalizáveis tendo no entanto ficado o nome). O Fab e o Fc são designações
fundamentais na imunologia para percebermos onde se liga o antigénio ( é o Fab) e
onde há outras propriedades biológicas (que é o Fc).
Imunologia
4º aula
A molécula da Ig tem várias regiões (entre elas os domínios), entre as quais
temos a região FAB (local de ligação ao Ag), a região FC (responsável pela
funcionalidade da Ig), as cadeias leves (L) e pesadas (H), e a zona da charneira. Há
também o ponto de ligação aos glúcidos na zona constante 2 da cadeia pesada (CH2) →
as Igs são assim glicoproteínas!
As zonas VH, VL, CL e CH são denominadas domínios.
Cada cadeia leve e pesada, numa Ig contém uma região aminoterminal variável
(V) que consiste em 100-110 a.a. e difere de Ac para Ac. A restante porção (nas duas
cadeias leves e pesadas da Ig) são as regiões constantes (C) que recebem uma variação
limitada que irá definir:
-
os 2 subtipos diferentes cadeias leves (existentes na Ig)
as 5 subclasses diferentes de cadeias pesadas
A ligação ao epitopo dá-se entre as zonas VH e VL, havendo aqui pontos
especiais de ligação _ as CDRs (complementary determinating regions), que são um
conceito de hipervariabilidade de Ig que lhe permite ligar-se a qualquer epitopo (logo
Ag). São as CDRs, regiões moleculares onde reside a maioria das diferenças estruturais
entre os diferentes Acs que constituem o local de ligação Ag-Ac na molécula de Ig. As
CDRs estão presentes nos domínios V de ambas as cadeias leves e pesadas das Igs.
Há 3 regiões complementares ( no domínio VH, temos: CDR1,CDR2 e CDR3; no
domínio VL, temos também: CDR1, CDR2 e CDR3) que se orientam
tridimensionalmente, permitindo a ligação ao epitopo.
Variabilidade das CDRs ( regiões determinantes complementares)
As Igs conseguem uma configuração espacial que é adaptável ao Ag devido às
grandes diferenças aminoacídicas nestas regiões. Os CDRs têm uma variabilidade muito
mais acentuada do que as outras regiões da Ig, permitindo uma maior adaptabilidade ao
Ag. (ver gráfico do livro)
É a partir das modificações aminoacídicas (nas regiões das CDRs) que se dá uma
ligação eficaz → a ligação tem que ser reversível mas forte! O encaixe com o Ag dá-se
em forma de pinça 3 dedos que liga eficazmente o paratopo ao epitopo.
antigénio
“pinças moleculares” que vão agarrar o epitopo
CDR1
epitopo
CDR2
CDR3
Movimentação espacial da Ig
Os Ag podem ter os epitopos afastados, pelo que a Ig tem de efectuar
movimentos espaciais para se poder ligar especificamente ao Ag. A Ig tem 2 paratopos:
um em cada Fab.
NOTA: a digestão com Pa pain da IgG produz :
- 2 fragmentos iguais _ os Fab (“fragment antigene binding”), com actividade
antigénica
- 1 Fc (“fragment crystallizable”) que cristaliza com o abaixamento da
temperatura
O Ag de bactéria pode ter 2 epitopos bastante distanciados, situação na qual a Ig
tem necessidade de movimentação espacial que permite que os paratopos se coloquem
nas regiões complementares dos epitopos. Esse movimento está demonstrado: antes da
ligação a Ig modifica-se em determinadas posições _ os CDRs têm que estar
convenientemente dispostos para que haja ligação.
Antigénio (epitopos)
FAB
Charneira
rodar
FC
glúcidos
Classes de Ig: estrutura geral
Apesar das Ig dependerem da configuração aminoacídica, elas também têm
configurações diferentes.
A IgA e a IgE são semelhantes à IgG, no entanto, a IgE tem mais uma região
constante na cadeia pesada (4 em vez de 3 como é o caso da IgD e da IgG ).
A IgM é um pentâmero (5 monómeros) com cadeia de junção. Esta também tem
4 regiões constantes na cadeia pesada como a IgE. A IgM pode ligar-se a 10 (2x5)
epitopos ( 10 ou menos Ag pois um Ag pode ligar-se com mais de um epitopo). É muito
rica em glúcidos _ grande glicosilação da IgM ao contrário da IgG que tem poucos
glúcidos.
A IgA apresenta uma configuração dimérica também por cadeia de junção.
A IgG3 tem uma estrutura diferente das outras: possui uma zona de charneira
alongada com muitas pontes dissulfeto ao contrário das outras. Genericamente a IgG1
(que tem pouca glicolisação), a IgG2 e a IgG3 são semelhantes, tendo a IgG3 a charneira
mais alongada (logo características funcionais diferentes).
A IgE tem a particularidade de se ligar a alergenos (mais frequentemente,
podendo também ligar-se a Ag) → ela veicula alergias. A IgE e a IgD têm muitos
glúcidos.
A IgA tem 2 formas:
IgA1: solúvel, encontra-se mais no sangue sendo a mais frequente; é
monomérica tendo um colar de glúcidos à volta da charneira (isto
tem significado biológico)
SIgA: dimérica, com cadeia de junção (ligação das subunidades) e
com peça secretora → Ig das secreções (fica mal dizer Ig secretora,
ela não secreta: existe nas secreções)
Produção de SIgA:
O plasmócito (que pode estar na submucosa do brônquio) produz IgA. Esta,
através da sua cadeia de junção dimeriza → a IgA, na parte basal das células epiteliais,
encontra um receptor para poliIg, então, o conjunto é internalizado numa vesícula para
se dirigir para o lúmen do brônquio (o receptor é que dá origem à peça secretora) →
quando passa para o lúmen temos: 2 IgA mais a peça secretora (que foi produzida nas
células epiteliais e não no plasmócito).
Membrana basal de uma célula epitelial
Plasmócito
lúmen
peça secretora
Receptor para
Ig polimerizada
IgA
dimérica
endocitose
liga-se
vesícula
Clivagem
enzimática
SIgA
(componente secretória
ligada à Ig dimérica)
A IgA passa facilmente para as secreções _ a vantagem é termos Ac contra Ag
que provenham do exterior através das vias digestiva, respiratória ou genito-urinárias.
Sem IgA de secreções a vida pode não ser compatível.
A IgA é das secreções, logo, no leite humano encontra-se a IgA de secreções,
lisozimas, etc, porque o leite é o meio fundamental que a defesa para o recém nascido.
A criança, quando amamentada com leite materno tem menos desconfortos ao nível do
tubo digestivo do que com outro tipo de leite.
Características imunológicas do leite humano:
Ac
Citocinas
Células
→ protecção contra doenças provocadas por imunodeficiência
→ estimulação do sistema imunitário do bebé
→ controlo da resposta inflamatória e do crescimento microbiológico
→ imunomodelação/imunocompetência
Glicolisação (incorporação de açúcares):
As proteínas são predominantes em relação aos glúcidos, no entanto, sem
glúcidos as Igs não funcionam!
A glicolisação dá-se sempre na zona CH2. Na posição 297 (asparagina) há
sempre glicolisação (nem que seja pouca)
IgG
glicolisação
IgA
+
(IgM, IgD, IgE)
Na charneira também pode haver glicolisação → as primeiras IgA não tinham glúcidos
nessa zona, tendo a charneira desprotegida → alguns microrganismos (agentes
patogénicos) especializaram-se desenvolvendo proteases, destruindo a IgA pela
charneira → Resposta: formação de um colar de glúcidos para impedir a acção das
proteases.
Quando a cadeia polipeptídica se está a formar, há a possibilidade (no retículo
endoplasmático) de oligossacarídeos serem “cortados” (por acção de glicosil
transferase) e ser transferido o açúcar para a proteína (nomeadamente para a
asparagina). O complexo de Golgi permite vesiculação e secreção que também é
importante para que o oligossacarídeo seja transferido, permitindo a glicolisação das
Igs.
Papel dos carbohidratos na funcionalidade das Igs
Os carbohidratos interferem na:
- solubilidade
- diversidade
- secreção
- fixação complementar
- receptor de fixação de FC
- pureza de sangue
- conformação
Estas funções dependem não apenas dos carbohidratos, mas também de oligossacarídeos
presentes nas Igs.
Isotipos de Ig
Os isotipos dizem respeito às classes e subclasses das Igs. Nestes isotipos, as
concentrações de glúcidos são variáveis (as IgG têm menos enquanto as IgM, IgD e IgE
têm mais).
IgG
IgA
IgM
IgD
IgE
% carbo.
Nível
serum
(mg/ml)
Serum half-life
(dias)
Synthesis Rate
(mg/kg/day)
2-3
7-11
10-12
9-14
12-13
9,5-12,5 b)
1,5-2,6
0,7-1,7
0,04
0,0003
6
5
3
2,5 a)
7
0,4
0,016
23 a)
33
65 c)
a) Enquanto as IgG têm grande semivida (aproximadamente 3 semanas) as IgE têm uma
semivida de aproximadamente2,5 dias. As Igs com muitos glúcidos têm uma semivida
mais reduzida. Porquê? Resposta: O elevado número de glúcidos permite uma
funcionalidade acrescida, sendo mais fácil encontrar receptores, emitir sinais, etc, isto
provoca mais gastos, mais trabalho, logo, a Ig é mais desgastada, reduzindo assim a
semivida.
b) A IgG é a que aparece em maior concentração, enquanto as IgE e IgD surgem em
baixíssima concentração.
c) A síntese em mg/Kg (peso corporal)/dia é mais acentuada na IgA (e não na IgG!).
Porquê? Resposta: Estamos a falar de Igs no sangue, ora, visto que a IgA também se
encontra nas secreções, vai haver uma grande necessidade de renovação desta Ig, assim,
IgA tem que ser muito sintetizada para fazer frente às necessidades do sangue e das
secreções.
Imunologia
5ª aula
Na última aula foi visto que existem várias classes e isotipos de Igs, e que estas
Igs apresentam características diferentes: níveis de concentração sanguínea (em que
temos mais IgA, pois também existe nas secreções), tempo de semivida (por exemplo é
completamente descabido dosearmos semanalmente as IgG de um doente, pois tem uma
semivida de aproximadamente 3 semanas, enquanto já é lícito dosearmos as IgE com
essa frequência).
Mas basicamente o que nos vai preocupar para além daquilo que já vimos dos
Ac, é termos conhecimento que na maturação e deflecção dos linfócitos T para a
produção de Ac, há uma fase ainda bastante precoce quando o linfócito se torna maduro
em que começam a aparecer Igs na superfície dos linfócitos. Portanto, não são Igs
segregadas (que existem nos líquidos biológicos) mas são Igs que existem à superfície
do próprio linfócito. Não se deve esquecer que só o plasmócito é que segrega Igs. Os
linfócitos B têm Ig na sua superfície mas não as segregam. Então a essa Ig de superfície,
que está na membrana dos linfócitos B, chamamos receptor do linfócito B (é o BCR –
B cell receptor, à semelhança do que acontece com os receptores dos linfócitos T, em
que lhes chamávamos TCR (T cell receptor) podemos chamar neste caso, BCR, isto é B
cell receptor, que não é mais do que uma Ig de membrana).
Muitas vezes os alunos ficam com a ideia que se trata apenas de Ig à superfície
do linfócito, o que não é verdade. Está realmente uma Ig à superfície da membrana do
linfócito, mas estão 2 estruturas repetitivas adjacentes ao linfócito que no seu conjunto
formam o receptor do linfócito B. Assim, o receptor do linfócito não é apenas uma
molécula de Ig membranar, mas tem mais essas 2 moléculas heterodiméricas que se
chamam Igβ e Igα (não têm nada a ver com qualquer classe de Ig, sendo apenas
estruturas acessórias que tomam essa designação).
Assim, B-cell receptor é um complexo proteico transmembranar composto por
mIg (imunoglobulina membranar) e mais 2 heterodímeros (Igβ/ Igα) ligados por pontes
dissulfeto
É este complexo que constitui integralmente receptor deligação ao Ag nas
células B
Receptor das células B
Igα
Igβ
Igα
Igβ
Membrana plasmática
Para além da molécula de Ig servir como receptor para o linfócito B, os Ac tem outros
tipos de funcionalidade.
Vimos que o Ac serve para se ligar ao Ag, têm portanto aquelas zonas
específicas do Fab que se vão ligar aos epitopos. Mas para além disso, as Ig contam
com receptores celulares que são todos para o Fc.
NOTA: Fc-receptor (FC-R) – receptor específico para a porção Fc de certas
classes de Ig. Está presente em linfócitos, macrófagos e outras células.
O Fc tem assim receptores em muitos tipos de células, nomeadamente monócitos e
macrófagos, nos neutrófilos, nos mastócitos e nos basófilos, e também nas plaquetas.
Praticamente, todas as células do sangue e algumas dos tecidos têm receptores para as
Igs. Isto significa que se por exemplo uma Ig se liga a um Ag pelo Fab e pelo Fc pode
ligar-se a uma célula do nosso organismo e com isso despertar um sinal nessa célula.
Por exemplo, numa alergia o alergeno liga-se a uma IgE. Como a IgE tem
receptores FC de alta afinidade nos mastócitos e nos basófilos (encontrando-se ligada a
estes), quando o alergeno se liga à IgE, a IgE vai fazer com que o mastócito liberte os
seus grânulos e com eles crie alterações vasoactivas que dão por exemplo uma rinite,
asma, bronquite, etc... No fundo estes receptores FC a nível de células são muito
importantes para que o Ac possa exercer as suas funções. Não basta o Ac ligar-se ao Ag,
ele tem ainda de se ligar a células do nosso organismo para poder exercer as suas
funções. Outro exemplo que pode ser dado é o da IgG que se liga a uma bactéria, mas
não a consegue destruir. No entanto, ligando o Fc a um macrófago, faz com que o
macrófago vá englobar a Ig mais a bactéria. Depois de englobar o conjunto, o
macrófago vai destruir a bactéria.
Resumindo: há receptores FC numa série de células. Estes receptores FC também
já têm uma codificação por CDs (Clusters of differentiation (CD) – Uma colecção de
Acs monoclonais que todos reconhecem um Ag encontrado num particular tipo(s) de
células diferenciado(s) (isto apenas tem interesse a nível laboratorial)). Devemos ficar
com a ideia que existem receptores de baixa afinidade e receptores de alta afinidade e
que estão presentes em bastantes células.
Habitualmente, o que acontece quando há um estímulo pelo Ag, é que várias
células se dividem (neste caso linfócitos B), resultando a proliferação de vários clones
celulares (e não apenas um). O Ag ao estimular o sistema imunitário vai estimular
vários clones celulares _ a isto chama-se uma proliferação policlonal (há vários clones
desenvolvidos. Há ainda a situação em que a proliferação é de apenas um clone
(monoclonal)). Habitualmente o que acontece é haver vários clones (várias famílias de
células a proliferar) e assim chamar-se uma proliferação policlonal.
Pode acontecer: → o Ag estimular um linfócito B e este proliferar dando origem
a várias células, transformar-se em plasmócito e produzir Ac; no entanto também pode
acontecer a estimulação se repetir, isto é, já na existência de células de memória de
linfócitos de memória haver novamente a estimulação por este Ag.
Uma situação é este Ag nunca ter sido conhecido pelo sistema imunitário (é a
primeira estimulação que este Ag faz), a outra situação é já haver células de memória e
este Ag voltar a estimular o sistema imunitário. Quando há uma primeira resposta ao Ag
apenas se produz IgM. Quando se dá uma resposta secundária (o mesmo Ag volta a
estimular o sistema imunitário) a resposta é predominantemente de IgG e muito menos
de IgM. É o que se chama uma comutação isotípica dos anticorpos. O interesse disto é
termos, por uma lado, Ac com muito maior especificidade para o Ag (isto é o interesse
biológico). Por outro, visando o interesse prático que em laboratório se tira deste facto,
é que, doseando os Ac podemos apercebermo-nos se foi uma resposta primária ou se foi
uma resposta secundária (porque na resposta primária são produzidas IgM e na resposta
secundária são produzidas IgG).
Serum antibody level
Antigene A
Antigene A
+ Antigene B
secondary anti-A response
Primary anti-A
response
IgG
primary anti-B response
IgM
⏐
0
IgM
⏐
14
//
⏐
0
⏐
6
IgM
⏐
14
Time, days
Outro conceito fundamental na funcionalidade de Ac que é necessário saber, é
que quando nascemos obviamente o nosso sistema imunitário está imaturo, e apenas
temos Ac dados pela parte materna. Algumas IgG podem atravessar a barreira
placentária fazendo com que o recém nascido se apresente com grandes quantidades de
IgG materna. À medida que o tempo passa esta IgG materna vai desaparecendo como é
óbvio, dado a sua vida, a sua capacidade protéica de se manter em funcionamento, e
chegando aos 9-10 meses de idade já não temos praticamente nenhuma IgG materna.
Em compensação o nosso sistema imunitário (no recém nascido) começa a produzir Igs
(na vida intra uterina já há pequena produção de IgM, mais tarde começa a haver
produção de IgG e IgA (mas pode assistir-se a um crescimento muito intenso da IgG, e
progressivamente a um aumento da IgM e da IgA). No total de Igs , quer elas sejam de
origem materna, quer sejam produzidas pelo recém nascido, entre os 3 meses e os 6/8/9
meses (dependendo da evolução do recém nascido) há uma baixa transitória dos Ac,
porque ele perdeu os Ac cedidos pela mãe e ainda não produziu suficientes ele próprio.
Nascimento
% adulto
Ig mg/100ml
1200_
60%
1000_
Total Igs
800_
600_
60%
IgG Materna
IgG
400_
_
150_
100_
50_
200
IgM
75%
IgA
20%
׀ ׀ ׀ ׀ ׀ ׀ ׀ ׀ ׀ ׀ ׀ ׀ ׀ ׀ ׀
1 2 3 4 5 6 7 8 0 2 4 6 8 10 12
Meses
A este período de baixa de anticorpos, chamamos o período de imunodeficiência
transitória do recém nascido. Essa imunodeficiência tem uma característica curiosa que
é ser habitualmente concomitante no tempo com o aparecimento dos primeiros dentes.
Será por isso frequente ouvirmos as mães dizerem que os dentes lhe trazem imensos
problemas intestinais, diarreias, etc. Os dentes não causam problema nenhum (a não ser
o desconforto de nascerem), o que acontece é que a criança ao mesmo tempo está
imunodefeciente fazendo infecções gastrointestinais com mais frequência ( ou otites e
outras patologias).
-
Em suma, quanto aos aspectos funcionais das Igs pode considerar-se:
Neutralização de Ags (os Ac podem neutralizar Ag e serem extremamente úteis)
Activação do complemento (sistema proteico complexo que tem importância na
destruição de Ags
Opsonização (quando Ac se liga a macrófago para destruir bactéria _
fagocitose)/ligação FC
Citotoxicidade (ADCC _ antibody dependent celular citotoxicity)
Sinalização de actividades celulares
Imunomodelação (modificação do sistema imunitário)
Intervenção na patologia:
- imunodefeciências
- hipersensibilidades
- autoimunidade
- síndromas imunoproliferativos
- por agentes patológicos
- por células neoplásicas
Acs monoclonais: como já vimos, a maioria dos Ags tem muitos epitopos e por isso,
induz a proliferação e a diferenciação duma grande variedade de clones de célula B,
cada um dos quais oriundo de uma célula B primária que reconhece um epitopo
particular. Daqui resulta uma resposta policlonal de Acs que pode facilitar a
localização, fagocitose, enfim, traz vantagens para a nossa protecção imunitária.
Contudo, esta heterogenicidade de Acs, “in vitro” reduz muitas vezes a eficácia
de um antisoro, para o seu uso em pesquisas, diagnósticos e terapêuticas → Para
este fim é preferível anticorpos monoclonais.
Quando temos uma animal que é injectado, vai ser estimulado pelo Ag, respondendo
produzindo Ac contra este Ag. Mas como normalmente um Ag tem vários epitopos, os
Ac produzidos pelo animal vão ser contra todos esses epitopos. Desenvolveu-se então
uma técnica em que os linfócitos B deste animal sejam ligadas a células de mieloma
(células plasmáticas cancerosas). Deste modo faz-se a “fusão” entre um dos diferentes
Acs produzidos em resposta ao Ag (específico para um dos seus epitopos) com uma
célula de mieloma. Com isto faz-se uma célula híbrida (hibridoma), e cada uma destas
células híbridas vai produzir apenas um Ac do tipo monoclonal – uma vez que o
hibridoma possui as propriedades de crescimento e imortalidade daas células cancerosas
e secreta os Acs produzidos pelas Células B.. Como interesse clínico, estes Ac
monoclonais servem sobretudo para diagnóstico “in vitro” (os vários CDRs são
detectados por Ac monoclonais), e para diagnóstico “in vivo” em que o Ac monoclonal
pode ser ligado por exemplo a uma substância radioactiva que ao ser injectada no
indivíduo podemos fazer o traçado desse Ac monoclonal. Pode servir ainda como meio
terapêutico (como um fármaco) ou como transportador terapêutico (leva o fármaco até
onde desejamos).
Uso Clínico dos Anticorpos Monoclonais
Diagnóstico “in vitro”
Diagnóstico “in vivo” (imagiológico)
anticancerígenos
imuno-estimuladores
Imuno-supressores
Terapêutico (como um fármaco)
(atenção aos riscos de
cancro)
Transportador terapêutico (de toxinas, enzimas, etc)
Note-se que se existissem estes Ac monoclonais no nosso organismo estaríamos
perante uma patologia.
Na tentativa de obtenção destes linfócitos havia um problema: os linfócitos B
morriam rapidamente (passadas poucas horas) ou diferenciavam-se em plasmócitos
produzindo Ac. Para contornar este problema, cientistas partiram do princípio que o
linfócito B tem especificidade (para o epitopo) e memória (para o mesmo epitopo) mas
vida curta. Descobriram que as células de mieloma (tumor maligno) tinham
imortalidade e proliferação contínua (como célula cancerosa ela tem capacidade de
divisão descontrolada sendo assim praticamente imortal).
Em condições de cultura especiais e com determinados produtos químicos,
conseguiram unir a especificidade e a memória do linfócito B com a imortalidade e
proliferação da célula de mieloma. Passado algum tempo há a formação de uma nova
célula chamada hibridoma. Esta célula híbrida tem como particularidade fazer a
produção contínua de um Ac monoclonal (sempre igual e com o mesmo epitopo). Mas
se injectarmos o Ac num animal que tem 100 epitopos vamos ter 100 células híbridas,
sendo necessário seleccionar a que nos interessa. O trabalho mais difícil é assim
escolher o hibridoma apropriado.
Imunologia
6ª aula
Como foi visto anteriormente, numa electroforese as Igs não migram apenas na
zona gama. Por isso considera-se errada a designação de gamaglobulinas (dada as Igs)
ou a de gamapatias (designação das patologias que derivam das imunoglobulinas).
Vamos pois adoptar uma outra designação, que é a de síndromas imunoproliferativas,
para substituir o antigo termo de gamapatias.
Em relação à resposta imunoinflamatória, existem diferentes patologias que
podem surgir desta resposta inflamatória. A inflamação habitualmente é paralela à
resposta imunológica ou antecede-a um pouco. A resposta imunoinflamatória é pois,
uma resposta habitual perante um estímulo do organismo humano. A resposta normal a
esse estímulo é uma resposta policlonal, que no que diz respeito a estas células vai
abranger macrófagos, neutrófilos, linfócitos.
Resposta imunoinflamatória
Proliferação monoclonal
Hipersensibilidade
Hiper-resposta
Inflamação
Proliferação
Policlonal
Erro de resposta
Resposta Normal
Hipo-resposta
Autoimunidade
Imunodeficiência
Qualquer uma destas células vai ser estimulada a proliferar de uma forma
harmoniosa mas policlonal, em que todas elas começam a proliferar mais ou menos
simultaneamente. No entanto, como em tudo, se há um desequilíbrio vai surgir
patologia. Esse desequilíbrio, no que diz respeito à resposta imunoinflamatória, poderá
ser uma hipo-resposta, e então vamos ter imunodeficiências. Poderá haver um erro da
resposta, isto é, o nosso organismo começa a reagir contra ele próprio, e então vamos ter
patologia autoimune, que é a agressão contra o nosso próprio organismo.
Referente à resposta temos hipersensibilidades, ou então, uma proliferação monoclonal.
Nessa proliferação monoclonal, aquilo que se passa é que vamos ter uma neoplasia (que
na gira popular é habitualmente designada por um cancro). As síndromas
imunoproliferativas estão dentro das neoplasias da linha linfocitária. São, no seu
contexto lato, proliferações malignas de células da linha linfocitária (que é a linha
principal de resposta imunológica) que apresentam características monoclonais. Dentro
das síndromas imunoproliferativas temos as síndromas imunoproliferativas B (e neste
caso a monoclonalidade vai incidir sobre os linfócitos B), temos síndromas
imunoproliferativas T (relativamente aos linfócitos T) e aquilo que designamos por
linfocitárias não B, não T (que é uma proliferação de células “Natural Killer” ou NK.
Síndromas imunoproliferativas
Conceito
Proliferações malignas de células da linha linfocitária apresentando
características monoclonais
linf. B
Classifi
cação
Linfocitária B
mieloma múltiplo
macroglobulinémia de Waldenstrom
Linfocitária T
síndroma de Sezary
Linfocitária não B,
não T
proliferação de células “Natural
Killer”
Nas linfocitárias B, as duas patologias major são o mieloma múltiplo e a
macroglobulinémia de Waldenstrom. Relativamente às T, temos a designada síndroma
de Sezary, que é a proliferação de linfócitos T auxiliares ( ou T helpers) que
fenotipicamente se marcam pelos seus linfócitos. Relativamente a este tipo de
classificação, posicionamos as síndromas imunoproliferativas B em primeiro lugar,
porque são de facto elas as mais frequentes dentro deste tipo de proliferação maligna.
Daqui em diante iremos falar predominantemente das síndromas imunoproliferativas B,
precisamente porque são elas que preocupam na grande maioria pela sua frequência a
parte médica. Então, fazendo a destrinça de uma proliferação dita normal de uma
proliferação clonal que vai dar origem a uma monoclonalidade o que é que se passa?
Habitualmente, perante um estímulo, habitualmente um antigénio, vamos ter uma
proliferação de vários clones de células. No caso dos linfócitos B, teremos vários
linfócitos B a proliferar, numa situação normal. Perante esse estímulo iremos depois
encontrar os linfócitos B que se diferenciam em plasmócitos no valor normal de Igs.
Mas encontramos um valor aumentado de IgG, IgM, IgA, IgD e IgE.
No caso de uma proliferação clonal (proliferação clonal porque nos referimos à
parte B, T e “Natural Killer”), teremos os plasmócitos a proliferar. Mas, há um estímulo
e as células a por si só (sem que haja uma razão aparente para isso), um clone único de
células começa a proliferar e como que vai frenar a proliferação dos outros clones. Este
vai predominar e vai dar origem a células rigorosamente iguais e que continuam, sem
estímulo aparente, a proliferar em contínuo. Vamos ter um grande aumento deste tipo de
clone. E este complemento monoclonal, no caso de se tratar de linfócitos B, vai ser
evidente pelo aparecimento de Igs em excesso e um número de um único tipo de Igs
quer no soro quer na urina.
Células normais
Célula plasmática clonal
Valor Normal de Igs Policlonais
Componente Monoclonal
- soro
- urina
Continuando com as síndromas imunoproliferativas B por serem de facto as
mais preocupantes, pela sua maior frequência o que encontramos nas síndromas
imunoproliferativas B é a síntese de uma Ig monoclonal. E, essa Ig monoclonal tem
origem num único clone de plasmócitos. Ou, se não for um plasmócito, num único
clone de células que se terá diferenciado até um determinado estado de maturação.
Diferenciação dos linfócitos B
IgM
IgA
μ
m IgD
m IgM
m IgM
s IgM
IgE
IgG
“Stem Cell”
Célula
Pré-B
B virgem
B activada ou plasmócito Imaturo
Plasmócito
A Ig que vai ser sintetizada tem uma estrutura molecular idêntica, isto é, nós
estamos perante uma proliferação maligna (as células tem determinadas características
de malignidade, mas a sua maquinaria interior de produção protéica continua a
funcionar excelentemente, e daí que o aparecimento daquilo que os linfócitos B
sintetizam ( e vão sintetizá-la de uma forma harmoniosa que é a imunoglobulina).
Síndromas Imunoproliferativas B
- classificação Linfoma não
Hodgkin
“Stem Cell”
Macroglobulinémia
de Waldenstrom
m IgD
m IgM
m IgM
s IgM
85%
85%
Mieloma
múltiplo
m IgM + IgG
s IgM + IgG
m IgG + s IgG
m IgA + s IgA
85%
Leucemia Linfoide crónica
A Ig começa a surgir em concentrações desastrosas, em que ela está a proliferar
daquele único clone, e as outras Igs quase que deixam de aparecer. Vamos ter então
uma estrutura molecular com uma sequência de aminoácidos rigorosamente igual
(cadeias pesadas iguais, cadeias leves iguais). Isto vai conferir uma microtipia (aquelas
que pertencem à mesma classe, que têm a mesma isotipia), alotipia (diferenças
antigénicas das Igs presentes nas regiões constantes das cadeias pesadas e das cadeias
leves, que qualquer um de nós pode ter) e idiotipia iguais (É a sua capacidade de
anticorpo, a sua especificidade de anticorpo. Essa especificidade de anticorpo vai ser
sempre a mesma na Ig monoclonal. Isto confere à Ig uma identidade de carga eléctrica
que se vai reflectir em termos laboratoriais.
Imunoglobulinas Monoclonais
origem
Um único clone de plasmócito
Estrutura Molecular
Identidade de
carga eléctrica
Sequência de a.a. igual
Cadeias pesadas iguais
Cadeias leves iguais
Iso, alo e idiolipias iguais
Qualquer tipo de exame laboratorial que se faça na pesquisa de Igs monoclonais
vai reflectir a tal monoclonalidade, a tal identidade no que diz respeito à carga eléctrica,
ao peso molecular, a estrutura molecular por ser rigorosamente iguais).
A imunoelectroforese está aqui mais pequena*, não por erro do tamanho da
letra, foi de propósito porque embora tenha sido um exame importantíssimo à uns anos
atrás deixou praticamente de se fazer em favor da imunofixação, que de facto detecta
concentrações mais baixas de Ig monoclonal (sendo muito mais sensível nesta área).
Também temos a electroforese capilar. Não devemos no entanto esquecer que se
suspeitarmos de uma proliferação monoclonal da linha linfocitária temos que fazer em
simultâneo o estudo quer no soro quer na urina. Não devemos pedir só a pesquisa de Ig
monoclonal no sor, temos que pedir também na urina (porque o rim mielomatoso, como
se chama, é aquele que vai ser mais tocado em termos de organismo humano). Também
não devemos esquecer a imunofluorescência, porque muitas vezes o plasmócito não vai
segregar contra o soro a tal Ig, ela vai manter-se dentro do citoplasma e só vai ser
detectada por imunofluorescência. Temos sempre que fazer uma quantificação em termos
de valores de Igs, fazer o doseamento das cadeias leves e a respectiva relação K e λ. Que
tipos de cadeias leves é que temos? K e λ.
Meios de Detecção de Imunoglobulinas Monoclonais
Electroforese
* Imunoelectroforese
Imunofixação
Electroforese capilar
Estudo simultâneo
no soro e na urina
Imunofluorescência
Plasmócitos, linfócitos
Quantificação das Igs
Doseamento de cadeias
leves e respectiva relação
k/λ
Nefelometria
Relativamente às proliferações monoclonais, o que se passa é que a mais
frequente cadeia leve nas tais síndromas imunoproliferativas é a K. O mieloma do tipo
G é o mais frequente e o do tipo GK mais frequente ainda. Quanto à cadeia K há um
ditado mais da classe médica que diz: “Quem tem K sempre escapa”. Isto, porque as λ
são de facto muito mais agressivas, porque a parte λ vai dar origem a determinados
fragmentos que depositam com muito mais frequência no rim, e portanto, o rim passa a
ser um rim patológico mais rapidamente quando há cadeias leves do tipo λ.
Relativamente à pesquisa das Igs, como elas vão proliferar destas 4 maneiras
diferentes, os exames laboratoriais têm que abranger e focar este leque de proliferação
monoclonal. Podemos ter uma síntese harmoniosa de uma Ig completa com cadeias
pesadas e cadeias leves (pode ser ela do tipo G, do tipo M ou do tipo A). Podemos ter a
síntese da tal Ig monoclonal completa, mas vai se juntar a isto a síntese isolada de
cadeias leves. Poderemos ter só cadeias leves livres, separadas portanto das cadeias
leves, a proliferar e vamos constatar, quando elas já estão em grande concentração no
soro, a sua passagem para a urina (e vão passar a ter o nome de quem as encontrou,
como é habitual também, que designamos sempre por proteínas Bence Jones). As
proteínas Bence Jones são as cadeias leves livres que encontramos na urina, são as
cadeias leves livres termosolúveis. Só que esta termosolubilidade é irregular, e,
portanto, falsos negativos também acontecem nesta pesquisa. Para além destas 3
hipóteses que encontramos atrás, e daí essa técnica que é a imunofluorescência que é a
presença de imunoglobulinas introcitoplasmáticas. É de facto a síndroma
imunoproliferativa mais rara (ou se nos esquecemos muitas vezes de pesquisar por
imunofluorescência a presença destas Igs no meio citoplasmático.
Isto vai ser vulgar na prática. É o proteinograma electroforético, é aquele exame
clássico que se faz na pesquisa da monoclonalidade, que justifica o facto de não
chamarmos as imunoglobulinas de gamaglobulinas (porque elas não migram só na
região gama, temos a IgG que migra predominantemente nesta região, mas, temos por
exemplo a IgA que migra na região beta. Mas porque é que este não é o único exame a
fazer? Precisamente porque na migração electroforética (em que vamos separar as
proteínas pela carga eléctrica, pelo peso molecular), vamos encontrar nesta migração
não só Igs. Encontramos também aquilo que se designam por proteínas de resposta
inflamatória e que vão aumentar muito quando estamos por exemplo só com uma gripe,
com uma constipação. E, como elas migram nestas áreas (beta, gama) podemos
encontrar um pico, e esse pico não corresponder a uma Ig normal. Num proteinograma
electroforético vamos encontrar, numa resposta fisiológica um traçado com altos e
baixos policlonol. Dito policlonol porque temos vários clones de células a proliferarem
com intensidades diferentes. Se tivermos uma monoclonalidade (que se verifica na zona
beta-gama de migração) é um pico de base estreita e muito alto.
O traçado monoclonol vai reflectir a proliferação de um único clone, porque
vemos numa linha harmoniosa, o enxertar de uma foice ou de uma meia lua que reflecte
realmente uma intensidade de proliferação muito veloz.
A imunofixação substituiu a electroforese. Aqui, vamos ter nessas bandas uma
imunoglobulina ou um antisoro para uma determinada Ig.
Relativamente às síndromas imunoproliferativas, a etiologia ainda é,
infelizmente, muitas vezes discutida. Temos uma componente genética na cabra, e essa
componente genética vem ao nosso conhecimento precisamente porque há famílias
tocadas por este tipo de patologia, estas síndromas imunoproliferativas, e elas mantêm
sempre uma alotipia semelhante. Isto é, as cadeias pesadas têm a tal antigenicidade nas
regiões constantes das cadeias pesadas ou leves semelhantes. Essa alotipia é marcante
nestas famílias assim como determinado tipo de HLAs. No entanto, vimos que
apareceram muitas síndromas imunoproliferativas em determinadas etapas após a
segunda guerra mundial, após exposições a radiações, a tóxicos químicos ou então, por
exemplo relacionado com a presença do herpes vírus associado ao sarcoma de Kaposi
(que é um sarcoma que predomina neste momento nos indivíduos HIV).
Síndromas Imunoproliferativas
- Etiologia Factores
Genéticos
Factores
Ambientais
Radiações
Tóxicos Químicos: herbicidas e pesticidas
Herpes Vírus associado ao Sarcoma de Kaposi
Relativamente então às síndromas B vamos classificá-las, sabendo de que tipo
são, qual é a sua incidência e se aparece ou não a tal proteína de Bence Jones (que são
as cadeias leves livres na urina).
O mieloma múltiplo mantém-se sempre em primeiro lugar por causa da sua
frequência. A frequência dele vai ultrapassar largamente a doença de Waldenstrom, com
a macroglobulinémia de Waldenstrom. E, tal como já foi referido, vamos ter em
primeiro lugar o mieloma múltiplo IgG, seguido da IgA, da IgM, e que muito poucos
são do tipo IgD e IgE, porque ele segue as tais concentrações das Igs no soro (em que
temos maior concentração das G, seguido da A e da M, e, apenas uma concentração
vestigial das Igs D e E
Síndromas Imunoproliferativas
Patologia
Mieloma múltiplo
Tipo
IgG
IgA
IgM
IgD
IgE
PBJ isolada
Doença de Waldenstrom IgM
Linfoma não Hodgkin
IgM e às vezes
IgG ou IgA
Leucemia linf. crónica
IgM
às vezes IgG
ou IgA
* Proteína de Bence Jones
Incidência
Incidência PBJ*
50%
25%
0,5%
1,5%
0,01%
20%
Todas
60%
70%
100%
100%
Maioria
Todas
80%
10-20%
Maioria
5-15%
Maioria
Por outro lado temos também mieloma múltiplo, com proteína de Bence Jones
isolada (20% deles acontece isto, o que é uma grande frequência). Relativamente à
doença de Waldenstrom, tipicamente na macroglobulinémia encontramos apenas IgM.
No linfoma não Hodgkin encontramos IgM, ocasionalmente G ou A. Na leucemia
linfoide crónica IgM, G ou A. Temos que saber a destrinça deste tipo de síndroma
imunoproliferativa B. Nesse aspecto, temos que fazer e pedir mais exames
complementares do que apenas a pesquisa de Igs monoclonais. Porque, aquilo que vai
distinguir um linfoma não Hodgkin e uma leucemia linfoide crónica de uma doença de
Waldenstrom (que é aquela em que prolifera mais IgM) é a quantidade de IgM e a
presença moderada ou grande de hiperlinfocito A?.
Há várias consequências fisiopatológicas que vão assumir a presença desta
monoclonalidade. E são essas consequências que nos vão ajudar a fazer o diagnóstico
correcto.
Dependentes da proliferação celular, nós vamos ter uma invasão dos tecidos _
no mieloma múltiplo o tecido mais invadido é de facto a medula óssea
(predominantemente). Dependentes da secreção proteica exagerada da tal Ig
monoclonal, vamos ter aumento da concentração proteica. E depois vamos ter
detalhadamente, consoante a propriedade físico-química das proteínas que estiverem a
ser sintetizadas na grande maioria da interacção proteína-proteína, proteína-célula,
vamos ter também consequências fisiopatológicas. Vamos ter, se houver cadeias leves
livres predominantemente, uma amiloidose (com disposição destes fragmentos de Ig
predominantemente a nível hepático e renal).
Síndromas Imunoproliferativas
- consequências Fisiopatológicas Dependentes da proliferação celular
Alta concentração
protéica
Invasão do tecido
Dependentes de secreção protéica
Dependentes das propriedades físico-químicas das proteínas
Interacção proteína-proteína e proteína-célula
Dependentes da actividade da Ig
Dependentes de outras funções biológicas
Activação
(redes de
citocinas)
dos
osteoblastos
Polineuropatia
Anemia hemolítica com crioglobulinas
Amilose
Síndroma de hiperviscosidade e crioglobulinémias
(lipol II)
Falta de reactividade contra Ags estranhos
Especificidade contra auto Ags
Rim “mielomatoso” _ deposição de cadeias
leves
Teremos uma síndroma de hiperviscosidade quando é a IgM que está em grande
concentração. Precisamente porque a IgM é a maior Ig, aquela que tem maior peso
molecular e que vamos ter 5 componentes a constituir uma única Ig. e essa Ig é a que
vai conferir maior viscosidade pelo seu grande peso molecular.
E teremos também o aparecimento de crioglobulinas. São Ig que vão precipitar
com o frio. Há pessoas que toleram muito mal o frio, a nível das mãos por exemplo, que
são as regiões mais expostas e que sentem progressivamente mal cada vez que vão
passando de uma década para a outra, e vão envelhecendo. Precisamente porque têm
crioglobulinas, durante inverno por exemplo, se a temperatura corporal baixa, vai uma
precipitação e a formação de pequenos aglomerados a nível das extremidades que estão
mais expostas.
Dependentes da actividade das Igs monoclonais, da sua especificidade vamos ter
depois as tais características que, no caso do mieloma múltiplo, essas Igs têm uma
especificidade característica para os osteoclastos. E, neste caso vão activar osteoblastos,
e ao activá-los vão destruí-los e a sua destruição vai dar origem a lesões osteolíticas (a
lacunas grandes nos ossos chatos e longos). O aparecimento posterior de uma
osteoporose com fragilidade óssea, e daí fracturas espontâneas que vão depois ter
consequências. Isto é, o indivíduo vai a andar e tem noção que vai fracturar o nervo. Ou
então, sente uma dor forte a nível da coluna pois fracturou uma vértebra. Isto é
característico do mieloma múltiplo, esta fragilidade óssea. Dependente doutras
componentes biológicas como consequências fisiopatológicas teremos uma
imunodeficiência características destas síndromas. Se só temos uma Ig a proliferar, se as
outras são frenadas na sua síntese, este indivíduo não vai ter a mesma capacidade de
defesa que um indivíduo que não tem uma síndroma imunoproliferativa (vai haver uma
imunodeficiência). Muitas vezes especificidade contra Ag e também caracteristicamente
o rim “mielomatoso” (mielomatoso entre aspas porque no caso da doença de
Waldenstrom também vai haver um rim da síndroma imunoproliferativa mas que não
prejudica o rim mielomatoso).
Aspectos clínicos do mieloma múltiplo _ Um mieloma tem uma determinada
tríade clássica. Isto é, vamos verificar uma plasmocitose medular sempre superior a
10%. Estes plasmócitos proliferam de tal maneira na medula que vão inibir por exemplo
glóbulos vermelhos e todo outro leque de células. Vão ocupar quase que inteiramente a
produção celular. No caso do mieloma, a síntese de Ig monoclonal é evidente no soro e
na urina, e as lesões ósseas também. São lesões osteolíticas que vão dar origem às tais
fracturas patológicas, que por sua vez, em 80% dos casos de mielomas temos lesões
ósseas. E, em 20% destes 80, vamos ter fracturas patológicas que vão ser com grande
frequência a causa de morte. Termos também anemia _ uma anemia normotípica,
normotrónica, que aparece também por inibição das outras células de serem
sintetizadas. A hipercalcémia aparece precisamente pela destruição óssea _ há
destruição óssea grande e daí o aparecimento do aumento de cálcio no soro. A falência
renal é pela disposição habitualmente das cadeias leves livres a nível renal. A infecção,
essa, é evidente pela imunodeficiência, precisamente porque há apenas um clone de
linfócitos a proliferar. Tudo isto irá, portanto, ser esta frequência nas causas de morte.
Nem todas as formas clínicas são malignas. Nós vamos ter muitas vezes p aparecimento
daquilo que chamamos síndromas imunoproliferativas de significado indeterminado (ou
“benignas”) e teremos ainda síndromas imunoproliferativas transitórias. Neste caso o
complemento monoclonal é sempre muito inferior àquele que vai aparecer nas formas
clínicas sintomáticas do mieloma múltiplo, da doença de Waldenstrom, da doença das
cadeias pesadas. Temos um complemento monoclonal que na grande maioria das vezes
é detectado por acaso em exames que se pedem. Há estas formas clínicas assintomáticas
que muitas vezes o indivíduo é catalogado como portador de uma neoplasia sem a ter.
E, portanto, vai começar a fazer exames de rotina, vai ser um indivíduo que vai sentir
uma diminuição da sua qualidade de vida sem razão porque ele vai ser chamado
rotinamente a fazer os tais “check ups” porque vai ser catalogado como portador de tal
neoplasia e não é na realidade. Daí a necessidade de se ter conhecimento de que há
síndromas imunoproliferativas benignas.
Síndromas Imunoproliferativas
- Aspectos clínicos -
Formas clínicas assintomáticas
Síndromas Imunoproliferativas
de significado indeterminado ou
“benignas”
Associadas a:
- processos inflamatórios/infecciosos
- osteomielite tuberculose,
pielonefrite, artrite reumatoide
- neoplasias _ intestinos, mama
- polineuropatias idiopáticas
- lipodistrofias: Doença de
Gaucher hipercolesterolémia
familiar
Formas clínicas
sintomáticas
Síndromas
Imunoproliferativas
- mieloma múltiplo
Transitórias
- doença de Waldenstrom
Associadas a:
- doença das cadeias pesadas
- terapêutica
- infecções virusais
(presumíveis)
- cirurgia cardíaca
- alguns casos de cadeias pesadas
Alfa
- transferência placenta nos
recém nascidos
Relativamente aquelas que não estão sempre presentes mas que aparecem
transitoriamente, a grande maioria delas está associada a determinado tipo de
terapêutica. Ou a infecções virosais, já com processos relacionados com a parte
bacteriana, cirurgias o por hipótese isto acontecer no recém nascido por transferencias
placentárias.
Imunologia
7ª aula
Habitualmente os Ag podem ser derivados de organismos vivos (como é o caso
dos fungos, das bactérias, dos parasitas e dos vírus), mas também ser simplesmente
proteínas estranhas.
Perante esta situação, num organismo vivo de um vertebrado (pois os invertebrados não
têm sistema imunitário), podem surgir 2 tipos de respostas:
- Resposta Humoral: que é a estimulação dos linfócitos B: estes diferenciam-se
em plasmócitos que vão produzir Acs que ao se ligarem aos Ags os vão tentar eliminar
a produção, que se vão ligar aos Ags e que tentam eliminar.
A eliminação do Ag não é uma realidade a 100%. Isto é, alguns Ags, por
exemplo algumas bactérias, são facilmente eliminadas pela produção de Acs (porque os
Acs permitem que as bactérias sejam fagocitadas e assim sejam eliminadas), mas
raramente os Acs conseguem destruir por si só um organismo vivo. Portanto, se formos
infectados por um fungo, um parasita, uma bactéria ou por um vírus, raramente o Ac
sozinho consegue eliminar esse agressor. O Ac precisa de mais alguma coisa _ pode ser
a fagocitose. O complexo de um Ac e uma bactéria tem de ser fagocitado por um
macrófago para assim ser eliminado, ou então, outro meio pode ser por exemplo a
activação de um complemento. Se a resposta não for dada por Acs, nós podemos te a
outra resposta que é a resposta celular.
- Resposta celular: é um pouco complexa. Basicamente ela pode adoptar uma via
de activação por linfócitos, que são chamados linfócitos “helpers”. São linfócitos
CD4Th2 (convém saber!) que auxiliam o linfócito B a transformar-se no plasmócito, e
assim a produzir Acs. A outra hipótese da resposta celular é serem estimulados
linfócitos citotóxicos. Esses linfócitos citotóxicos vão eles próprios (ou através de
células intermediárias, como por exemplo o macrófago) leva à destruição do Ag. Apesar
de na imagem no nosso livro dar a impressão que tudo acaba apenas com alterações do
“self”, isso não é verdade, termina na eliminação (ou pelo menos na tentativa) do Ag
agressor.
Resposta imunoinflamatória: células principais
Sem apresentação antigénica, o sistema imunitário não funciona correctamente.
Habitualmente, uma estimulação directa dos Ag, não acontece. O que acontece é ser
necessária uma apresentação antigénica para que os linfócitos respondam.
Se quiséssemos fazer um sumário do que são as células mais importantes (e
consequentemente das que mais vão ser faladas ao longo do estudo da imunologia)
poderia dizer-se que numa resposta imunoinflamatória (muitas vezes diz-se resposta
imunoinflamatória e não imunitária porque habitualmente a resposta imunitária tem
também uma componente inflamatória) as principais células são praticamente todas já
nossas conhecidas. Os linfócitos B, os responsáveis pela parte humoral, pela
transformação em plasmócito e produção de Acs.
Temos os linfócitos T, em que basicamente temos 2 grandes tipos: os CD4 e os
CD8. Os CD4, complementam 2 subtipos: os Th1 e os Th2. Os CD8, habitualmente são
citotóxicos. Os Th2 são os “helpers” que habitualmente auxiliam os linfócitos B. Os Th1
são linfócitos que também promovem citotoxicidade.
Existem ainda outras células, algumas bem evidentes na sua importância (como
por exemplo as células apresentadoras de Ags), são células variáveis.
As células fagocíticas, nomeadamente os monócitos (existe no sangue), os
macrófagos (existe nos tecidos). Podemos ainda englobar os neutrófilos. Teremos
também as células NK, as células “Natural Killer”, (células que têm citotoxicidade
espontânea e que matam espontaneamente). Estas células NK são linfócitos, ou pelo
menos células linfoides, isto é, células da linha linfocitária. São maiores que os
linfócitos, têm uns grânulos no citoplasma.
De todas estas células, as únicas que têm especificidade para o Ag (no tal
conceito imunológico de que tem que haver uma resposta específica) são os linfócitos B
e T. Todas as outras, incluindo as células NK, são células inespecíficas (são células que
não conseguem distinguir um Ag doutro Ag.
Podíamos eventualmente agrupá-las de uma outra forma, em que algumas vão
ficar de fora obviamente, agrupando-as como células efectoras da resposta imunitária
(onde continuamos fundamentalmente a ter os linfócitos B e os linfócitos T (CD4 e
CD8). Já se sabe que estes linfócitos CD4 não são apenas linfócitos “helpers”, também
há os que promovem efeitos citotóxicos (Th1 e Th2)).
O que caracteriza os linfócitos B é haver neles imunoglobulinas de membrana
que podem ligar-se especificamente ao Ag. Os linfócitos T, qualquer que seja o tipo
deles, têm o TCR (T cell receptor) que permite ligar-se especificamente ao Ag (ou se
quisermos ao epitopo). Teríamos ainda um outro grupo de células, que são as células
apresentadoras de Ag (os APC) em que há as células profissionais de apresentação
antigénica e há aquelas que apresentam de vez em quando. (não nos podemos fiar muito
nestas, o que nos interessa são as células profissionais de apresentação). As células
profissionais de apresentação são: os macrófagos; os linfócitos B (que para além de ser
uma belíssima célula efectora é uma belíssima célula apresentadora de Ags) que
obviamente nos remetem também para os linfócitos T.
Temos ainda outro conjunto muito vasto de células, que são as células dendrídicas, em
que temos por exemplo as células dendrídicas foliculares (que existem por exemplo nos
gânglios linfáticos, nos vasos, etc).
Temos células interdigitantes que existem em vários órgãos e temos por exemplo
células de Langerhans que existem na pele. Todas estas células são portanto as
profissionais da apresentação antigénica e como se pode ver, se alguma se destaca é
talvez a célula dendrídica pois existe em todo o organismo ainda que com configurações
diversas e portanto vai se ela uma das protagonistas da apresentação antigénica. No
entanto, todas elas são importantes: os macrófagos são importantes, os linfócitos B são
importantes, todas elas são importantes.
De onde é que vêm estas células? Na medula óssea há as linhagens
hematopoiéticas, as linhagens celulares que levam á formação do sangue e pensas que
há uma célula indiferenciada, uma célula pluripotente inicial, e dessa célula se formam
4 linhagens principais de diferenciação hematopoiética. Essas 4 linhagens são a
Eritroide (que leva à formação dos glóbulos vermelhos), a Megacariotípica (que leva
à formação das plaquetas), a Mieloide (que leva à formação de monócitos e de
granulócitos) e a Linfoide (que leva à formação de linfócitos). O sistema imunitário não
funciona sem os receptores que existem nos eritrócitos, não funciona sem os produtos
químicos derivados das plaquetas, será assim importante a abrangência da percepção de
como se formam as células.
Todos nós somos iguais, todas as células hematológicas são iguais, mas há as
mais iguais e as menos iguais. Isto é, da célula pluripotente inicial, da célula
hematopoiética pluripotente indiferenciada, temos 2 hipóteses de diferenciação: ou vai
para a parte linfoide e se transforma na linhagem linfoide, ou se transforma numa outra
linhagem que depois dá origem a todas as outras. Isto é, apesar de tudo um eritrócito
está mais perto dum macrófago sob o ponto de vista de linhagem do que um linfócito
estará perto de qualquer uma destas linhagens. A linha linfoide separa-se logo, isto
dentro da evolução de uma estrutura familiar, o linfócito vem directamente do primeiro
elemento dessa família, enquanto todos os outros derivam progressivamente por divisão
da célula que dá origem. Os linfócitos assumem-se claramente como sendo diferentes de
todos os outros. Normalmente o que acontece é que a mielopoiese (a formação das
células do sangue ) se inicia no fígado fetal (a cerca de 6 semanas de gravidez, numa
situação muito precoce da vida embrionária) e depois esta tal célula que é a célula
progenitora de todas as outras, exceptuando da parte linfoide que vem directamente da
célula inicial.
Interessa saber que desde a célula linfoide original, a célula mãe progenitora geral, nós
podemos vir a ter linfócitos T (CD4 ou CD8) (todos os linfócitos T são CD3, por isso,
se quiséssemos ser correctos deveríamos chamar-lhes CD3CD4 e CD3CD8, uma vez
que eles exibem em permanência os 2 marcadores). Temos os linfócitos B que podem
ser CD19 ou CD20 (não têm que ser concomitantes, há alguns que têm CD19, há outros
que têm CD20 ou as duas coisas) ao contrário do que acontece com os anteriores em
que tinham que ser todos CD3, nestes é CD19 ou CD20, que depois se transformam em
uns plasmócitos que podem ser marcados por CD38 ou CD85 (embora o plasmócito
seja uma célula difícil de marcar pois é uma célula em transição, está apenas a ser
produzida para formar Acs. E temos as células NK que se marcam pelo CD56 ou pelo
CD16. É conveniente ir sabendo isto porque vamos cada vez mais utilizar isto quer na
prática de medicina ao pedir análises, ou para interpretar resultados ou funcionalidades
do sistema imunitário(é habitual não se falar de uma célula NK mas sim de uma CD56).
Embora não haver um consenso , a maioria dos autores pensa que as células
dendrídicas (células apresentadoras de Ags) derivam de um progenitor mieloide, há
quem pense que os monócitos se podem transformar não só em macrófagos como em
células dendrídicas, mas não se deve pensar que uma monócito se pode transformar num
neutrófilo, isto não está correcto. Efectivamente, um monócito pode chamar neutrófilos
pela interleucina 8, mas não se pode transformar em monócito.
Devemos ainda ter a ideia que a célula que existe em maior quantidade no sangue é o
glóbulo vermelho. Dentro dos leucócitos (glóbulos brancos) os neutrófilos são mais ou
menos predominantes (50 a 60 %), os linfócitos 20 a 40 %, os monócitos 1 a 3 %, os
eosinófilos 1 a 3 % e os basófilos inferiores a 1 %.
Porque é que temos tantos neutrófilos? Porque temos que poupar energia e não
podemos ter quantidades enormes de uma célula que gaste muita energia, e o linfócito
gasta muita energia. Outra razão é que o neutrófilo morre em quantidades enormes
todos os dias (milhões) que tem que ser bastante renovada, não sendo possível ter
poucas pois caso fossem eliminadas não teríamos outras para as substituir.
Ainda não se sabe muito bem como é que as células dendrídicas podem surgir, é
uma célula que em microscopia tradicional se apresenta cheia de prolongamentos. A
conclusão a que devemos chegar é que com tanta forma de chegar até estas células, se
uma linha se perder podemos logo ter outra.
Uma vez as células do sangue produzidas na medula óssea nós necessitamos de
linfócitos B e T maduros para funcionar. A maturação dos linfócitos dá-se no timo para
os linfócitos T e na medula óssea para os B (embora ambos sejam produzidos na medula
óssea). Os órgãos linfoides primários, que têm a ver com a produção e o
amadurecimento do sistema imunitário são a medula óssea e o timo. Os órgãos linfoides
secundários (também chamados periféricos) são aqueles para onde depois vão os
linfócitos T e B.
Num osso esponjoso temos progenitores B a partir dos quais se vai dar uma
maturação por contacto com células da própria medula óssea (reticulares do estroma).
Depois dá-se a passagem destas células progenitoras a células pré B por um processo de
selecção. Os pré linfócitos que não cumpram determinadas características (como não
agredir o nosso organismo) são eliminados normalmente por fagocitose ou por apoptose
(morte celular programada), sendo cerca de 75 % de linfócitos eliminados. As que
escapam passam para os seios venosos da medula óssea, destes vão para os seios
centrais e destes vão para o sangue. Inicialmente estas células ainda são incapazes de
reagir com Ags, adquirindo essa capacidade assim que sejam estimuladas por Ags. As
células B saem amadurecidas da medula óssea, mas precisam dum estímulo do Ag para
que se transformem em plasmócitos ou em células de memória (estimulação essa que se
dá num órgão linfoide secundário e não na medula óssea).
Há possibilidade técnica de sabermos em que parte da medula se está a dar a
formação de linfócitos B e de saber se estes já foram estimulados ou não (no sangue),
isto através dos CDs. Outra hipótese é repararmos que só existem imunoglobulinas a
partir de determinada fase da sua evolução.
No caso da maturação dos linfócitos T, vai haver necessidade de eles se
deslocarem até ao timo. O timo tem uma zona de cápsula, uma zona de córtex e uma
zona de medula. É altamente vascularizado e tem vários tipos de células ( como as
interdigitantes por exemplo), tem macrófagos, tem células epiteliais da medula e do
córtex, e tem muitos timócitos (que são os percursores os linfócitos T. Após
abandonarem a medula e vai para o timo, o linfócito atinge uma determinada fase em
que é denominado timócito). Há também células (nurse cell) que vão ensinar ao
linfócito algum comportamento no que diz respeito à resposta antigénica, pois interessa
que ele seja capaz de respondera todos os Ags, exceptuando os do nosso organismo. As
nurse cell vão assim dar instruções aos timócitos para que eles não reajam contra as
estruturas do nosso organismo (contra o “self”) e possam reagir contra qualquer outros
agressores.
Imunologia aula nº 8
A maturação dos linfócitos T dá-se no timo. Este, é um órgão que involui, isto é,
é um órgão que regride após o nascimento (na criança e no adolescente ainda tem
alguma secreção, enquanto no adulto acaba por ser um órgão residual), o que quer dizer
que a maturação dos linfócitos apenas se dá no período mais jovem da vida (sabe-se que
no idoso ainda pode haver maturação de linfócitos no timo, só que a um ritmo
excepcionalmente mais baixo do que no jovem). Se percebermos que os linfócitos T
podem ter vidas superiores a 30 anos, entendemos que toda a instrução que se possa dar
ao sistema imunitário, por aquilo que se chama o modular do sistema imunitário, se dá
na fase jovem. Devemos utilizar antibióticos apenas quando necessário, deveríamos
evitar toda a alimentação incorrecta, como seja não utilizar açúcares, pois tudo isso
pode perturbar a maturação do sistema imunitário. Outra coisa que perturba bastante
essa maturação é o stress.
Maturação dos linfócitos T
Os linfócitos vêm da medula óssea, alguns amadurecem na medula óssea (como
os linfócitos B) enquanto outros migram para o timo onde vão ser amadurecidos (que
são os linfócitos T).
São provenientes da medula óssea e chegam ao timo. No timo há uma região
medular e uma região cortical (por baixo da cápsula do timo). Os linfócitos saem do
vaso sanguíneo (que os traz da medula óssea) e vão para a região subcapsular,
chamando-se linfócitos pré-T (ainda não são linfócitos T). Quando estes linfócitos préT chegam a esta região subcapsular, começam a dividir-se rapidamente (há uma
proliferação linfocitária pré-T, isto é, uma divisão acentuada dos linfócitos pré-T). A
seguir, os linfócitos começam a deixar esta região subcapsular e migram para a região
central do timo, entrando no córtex do timo.
No córtex é que eles vão exprimir o TCR, isto é, antes disto o linfócito pré-T
ainda não tinha TCR. O TCR surge no córtex do timo, particularmente por acção das
“nurse cell”, das células do tecido epitelial do timo, etc... Isto é, um conjunto de células
que dão informações ao linfócito no sentido dele poder exprimir o TCR.
A partir do momento em que o linfócito pré-T adquire o TCR, vai passar a
timócito (tudo isto no córtex do timo), passando a exprimir 2 moléculas _ o CD4 e o
CD8. Os timócitos vão assim apresentar simultaneamente, para além do TCR, CD4 e
CD8. Estas moléculas são capazes de se ligar ao MHC (major histocompatibility
complex) fazendo com que o linfócito possa saber que está a contactar com uma célula
do próprio organismo ou com uma célula estranha ao organismo. Portanto, o TCR serve
para detectar o Ag, enquanto o CD4 e o CD8 servem para detectar se as estruturas são
do organismo ou não.
No córtex do timo, os timócitos vão entrar progressivamente para o seu interior (do
timo, portanto da periferia para a parte central, encontrando-se no entanto ainda no
córtex) encontrando as chamadas células epiteliais do córtex ******, que são células
alongadas. Estas células epiteliais exprimem-se como MHC da classe 1, enquanto outras
se exprimem como MHC da classe 2. Elas exprimem esse MHC como uma
identificação de que são daquele organismo (quase como a matrícula de um automóvel
serve para identificar o proprietário). Depois, o que vai acontecer é que alguns destes
timócitos (no córtex do timo) vão entrar em contacto com o MHC (neste caso da classe
1). O CD8 liga-se ao MHC da classe 1 e, simultaneamente, há oportunidade do TCR do
linfócito entrar em contacto com uma estrutura antigénica do nosso organismo. O
linfócito passa assim a reconhecer a estrutura antigénica do nosso organismo por essa
ligação do epitopo ao TCR, ao mesmo tempo que o CD8 se liga ao MHC da classe 1.
Isto é um processo clássico de apresentação antigénica em que, por um lado, temos uma
célula MHC do nosso organismo e que exprime um Ag e, por outro lado, temos um
linfócito T que através do CD8 se liga ao MHC e assim consegue reconhecer aquele Ag.
Isto serve para que o linfócito possa saber que aquele Ag existe no nosso organismo. O
mesmo acontece exactamente a outros timócitos, que em vez de se ligarem pelo CD8 se
ligam pelo CD4, neste caso, ao MHC da classe 2.
Imagine-se que nesta passagem pelo córtex do timo, eles não se ligam ao MHC
quer da classe 1 quer da classe 2, vai haver falta de sinais libertadores de apoptose, o
que faz com que o timócito entre em apoptose e morra. Isto tem toda a lógica, porque
um timócito que não conseguisse perceber quais são as estruturas do organismo onde
está poderia ser extremamente agressivo para esse organismo. Se pelo contrário o
timócito se ligou ao MHC, quer da classe 1 quer da classe 2, eles são seleccionados,
chamando-se a isto uma selecção positiva. São seleccionados os timócitos que
positivamente se ligaram aos MHC quer da classe 1 quer da classe 2 (temos portanto um
processo de selecção no córtex do timo). Após essa selecção positiva, os linfócitos vão
penetrar na medula do timo.
Mal entrem na medula do timo, vão encontrar as chamadas células
interdigitantes (que são células apresentadoras de Ag) que não são mais do que uma
variedade das células dendrídicas. Só aqui vão chegar os timócitos que se ligaram ao
MHC da classe 1 ou da classe 2. Esta célula interdigitante vai funcionar como uma
armadilha para o timócito. Isto é, o timócito já tinha previamente (no córtex) tido a
oportunidade de reconhecer o MHC da casse 1 ou o MHC da classe 2. quando chega à
medula, uma célula apresentadora (célula interdigitante) vai apresentar um Ag do nosso
organismo ao timócito, e, das duas uma: ou o timócito se liga fracamente a esta célula
apresentadora ou o timócito se lida fortemente a esta célula. Se o timócito se ligar
fortemente à célula dendrídica, esta (célula dendrídica) vai emitir sinais apoptóticos e
portanto destroi estes timócitos. Todos os timócitos que se fixem fortemente ao MHC
da célula interdigitante vão ser destruídos, havendo assim uma selecção negativa,
porque todos os que se ligam são destruídos e não seleccionados como anteriormente.
Na primeira fase foram seleccionados os linfócitos que conseguiram reconhecer o
MHC, na segunda fase estas células vão testar se reconhecem o MHC, num
conceito de reconhecer mas não agredir ou se reconhecem o MHC num conceito de
reconhecer e agredir. Se agridem, têm que ser destruídos. Se não agridem tudo
bem: os linfócitos sabem quais são as estruturas (Ags) do nosso organismo, mas
não agridem esses Ags. É isso que se pretende, ter linfócitos imunocompetentes
mas que não agridam os nossos Ags.
Em resumo: nós vamos ter previamente uma selecção positiva no córtex do
timo, vamos depois ter uma selecção negativa no córtex do timo. O resultado é que
menos de 1% dos linfócitos ultrapassam as selecções positiva e negativa. Este filtro é
realmente apertado: de todos os linfócitos que entram no timo (que são muitos e que se
dividem), menos de 1% é que conseguem sair como linfócitos T. Por outro lado, os
timócitos que se ligam pelo CD4 ao MHC perdem o CD8, e por sua vez, os timócitos
que se ligam pelo CD8 ao MHC perdem o CD4. O que quer dizer que neste processo
final de selecção negativa (do timócito para o linfócito) o facto mais importante é ficar
apenas com o CD4 ou com o CD8, consoante se ligou ao MHC da classe 1 ou ao MHC
da classe 2. portanto, quando o linfócito sai do timo, já só é CD4 ou CD8, enquanto
como timócito era simultaneamente CD4 e CD8.
Como se pode ver, este é um processo (maturação do linfócito T no timo)
altamente selectivo, em que grande parte das células são destruídas. Biologicamente,
isto pode parecer um contra-senso, mas é a única forma de haver uma filtragem correcta
de células que sejam autoreactivas (células reactivas contra nós próprios). No entanto
fica sempre uma situação muito comprometida que é aquilo de se ligar fortemente ou
fracamente ao MHC. Isto é, nesta selecção negativa, há sempre oportunidade de um
linfócito (apesar de não se ligar fortemente ao MHC) ser um linfócito autoreactivo.
Passou n filtro, pois não se ligou tão intensamente ao MHC que justificasse que fosse
destruído, passando mais tarde a ser um linfócito que vai agredir.
Os linfócitos foram assim amadurecidos no timo, saem da medula, entram num
vaso sanguíneo e a partir dessa saída do timo eles vão ser distribuídos pelo nosso
organismo. Habitualmente, ao saírem do timo, vão para uns órgãos linfoides
secundários (baço, gânglios linfáticos, etc) onde podem aguardar pela estimulação do
Ag, pois como é fácil de perceber, até aqui o linfócito ainda não encontrou um Ag que
não fosse do seu organismo. O linfócito é portanto totalmente naíve quanto a Ags
estranhos ao organismo, sendo portanto ao nível dos órgãos linfoides que ele vai entrar
em contacto com eles.
Tal como para os linfócitos B, na diferenciação celular de linfócitos T, há alguns
marcadores que estão praticamente sempre presentes (o CD3 fica presente mesmo já no
córtex do timo, estando o CD3 sempre constante neste processo de maturação, daí que
todos os linfócitos T sejam CD3). O CD1 apenas se exprime numa determinada fase de
maturação no córtex, durante a fase de selecção positiva. Durante toda a passagem pelo
córtex, os timócitos têm CD4 e CD8, havendo a selecção para CD4 ou CD8 na medula
(pois na sua forma circulante os linfócitos T são apenas ou CD4 ou CD8). A presença
simultânea de CD4 e de CD8, implica que ele ainda esteja numa fase muito precoce da
sua maturação, a menos que tenha acontecido algo de anómalo e que tenha feito com
que o linfócito tenha vindo para o sangue sem terminar a sua maturação.
Agora, vamos ver uma coisa que por vezes talvez se confunde um bocadinho
com maturação, mas que já não tem a ver com maturação que é o facto dos linfócitos
(quer os B, quer os T) uma vez amadurecidos, quer na medula, quer no timo, irem para
os órgãos linfoides secundários (periféricos). A medula e o timo são os órgãos linfoides
primários. Quanto aos órgãos linfoides secundários é de realçar toda a estrutura linfoide
associada ao intestino, que normalmente se chama GALT (Gut Associated Lymphoid
Tissue _ tecido linfoide associado ao intestino). Este GALT tem uma importância vital,
associando-se muito a outra estrutura linfoide secundária, que é o BALT (Bronchia
Associated Lymphoid Tissue). Tanto o GALT como o BALT, fazem parte daquilo que
genericamente chamamos de MALT (Mucosal Associated Lymphoid Tissue) que é
uma estrutura linfoide associada às mucosas. É muito importante termos noção destas
estruturas pelo seguinte: nós dependemos destas estruturas para viver, apesar delas não
nos mostrarem a sua presença.
Temos portanto os linfócitos maduros que saíram do timo ou da medula, mas
estes linfócitos maduros não conhecem minimamente quais são os Ags externos ao
nosso organismo. A oportunidade deles os conhecerem, é por exemplo no GALT, ao
nível das vilosidades do intestino. Dentro dessas vilosidades há zonas chamadas centros
????????, onde vão existir linfócitos T e linfócitos B. O contacto com os Ag alimentares
e bacterianos que existem no intestino é que vai estimular estes linfócitos. O GALT é
assim um local indutor de estimulação dos linfócitos. Os linfócitos saíram “naíves” quer
da medula, quer do timo, dirigindo-se até à estrutura linfoide do intestino. No intestino
há presença de Ags que vão estimular os linfócitos (T e/ou B). Esses linfócitos
activados vão ser os linfócitos de memória e os linfócitos efectores de que nós vamos
dispor. Mais curioso do que isso, é que os linfócitos que são estimulados no intestino
não só se destinam ao próprio intestino, como vão fazer uma migração e vão para toda a
estrutura glandular do organismo (salivar, mamário, lacrimal, etc) e também para todas
as mucosas (isto é, mucosa digestiva, particularmente a mucosa das vias respiratórias e
também a mucosa genito-urinária). Todas as mucosas e estruturas glandulares do nosso
organismo depende dos linfócitos amadurecidos no intestino.
Numa situação de jejum prolongado, concretamente 10 dias de jejum, há uma
queda brutal do número de leucócitos, notavelmente dos linfócitos. Isto é, o indivíduo
passa jejum e a partir de 2-3 dias, entra numa situação de imunodeficiência porque
deixou de estimular os linfócitos a nível intestinal. O problema disto não é um problema
de jejum. É um problema de jejum que às vezes somos obrigados a fazer, sobretudo
quando numa situação de doença não podemos mais ter alimentação entérica, e é
necessário fazer a nutrição parentérica. Se isto acontecer há uma redução da produção
de Acs. Há uma redução do GALT, isto é, dos linfócitos T e B no intestino e há um
prejuízo particular da imunidade das vias respiratórias. Normalmente, é frequente que
pessoas que tenham uma alimentação parentérica total, tenham muito mais infecções
respiratórias. A pessoa perde a sua alimentação entérica, alimentação entérica essa que
mantém a imunocompetência, preserva a mucosa intestinal como uma barreira para não
deixar entrar bactérias. O indivíduo que tenha essa alimentação parentérica vai
recuperar a sua imunidade assim que iniciar novamente uma alimentação entérica (os
Ags da alimentação vão estimular os linfócitos). Isto é um conceito que resulta dos
últimos 3 anos do conhecimento da área imunológica, com grande reflexo na parte
clínica (há 5 anos não se alimentava o doente com uma alimentação entérica, sendo isso
hoje algo de fundamental. Todos os profissionais de saúde sabem que devem fazer uma
alimentação entérica sempre que possível).
Portanto, há inicialmente uma maturação dos linfócitos, havendo depois
necessidade desse linfócitos serem estimulados. Essa estimulação leva a uma
apresentação antigénica. Depois disso dá-se uma expansão clonal dos linfócitos, isto é,
o linfócito que foi estimulado divide-se progressivamente dando um clone (uma família)
alargado de linfócitos, portanto uma expansão clonal. Este linfócito terá teoricamente
uma de duas funções: ou ter acção citolítica e destruir a célula apresentadora ou destruir
o Ag agressor, ou levar à produção de Acs e esses Acs reagirem contra o Ag. A partir
desta fase, nós apenas temos necessidade de manter um clone de linfócitos como
memória daquela estimulação. Não precisamos de ter estes linfócitos todos activados
durante toda a vida. Seria realmente ridículo que ainda tivéssemos os linfócitos que
combateram a gripe de anos atrás. Necessitamos pois de eliminar todos os linfócitos que
já não sejam necessários. Este processo é um processo de apoptose, é um processo que
induz o próprio linfócito leva a que sejam destruídas todas as células que já não sejam
necessárias. Se por exemplo um vírus, como é o caso do HIV, nos conseguir induzir a
apoptose dos linfócitos, facilmente também os destroi, e, aquilo que seria um
mecanismo normal de eliminarmos apenas células que já não são úteis, passa a ser um
mecanismo que vai perturbar o sistema imunitário por eliminação genérica dos
linfócitos.
Um último conceito muito importante para se perceber como é que este sistema
imunitário funciona, é ter a noção para além daquilo que já se sabe (produção de
linfócitos na medula óssea e maturação na medula ou no timo), eles saem para o sangue,
indo deste para os órgãos linfoides secundários (gânglios linfáticos, amígdalas, etc).
destes órgãos linfoides secundários eles podem passar para os tecidos, e destes podem
ser recuperados pela linfa e regressarem ao sangue. A isto chama-se recirculação
linfocitária.
Esta recirculação linfocitária, curiosamente, envolve um número muito pequeno
de linfócitos. Apenas 2 % de todos os linfócitos estão neste processo de recirculação. O
que quer dizer que quando fazemos uma picadinha numa veia para tirar sangue, formase uma janelinha que permite olhar para dentro do nosso organismo, janelinha essa
através da qual não conseguimos ver mais de 2% dos linfócitos do nosso organismo. O
que quer dizer que 98% dos linfócitos não são possíveis de ver quando recolhemos
sangue líquido. Devemos por isso ser extremamente cuidadosos nas conclusões que se
tirem numa amostra de 2% (provavelmente ninguém acreditaria numa sondagem de 2%
seria representativo num acto eleitoral). Felizmente, nalguns casos estes 2% são
realmente o espelho daquilo que se passa no sistema imunitário, mas há muitos casos
em que não são.
Para de 2%, os linfócitos só ficam no sangue cerca de 30 minutos (eles saem do
sangue e vão para os tecidos) o que equivale a 50 vezes por dia nós renovarmos os
linfócitos (logo não teremos a mesma coisa às 8 da manhã e por exemplo à noite).
Esta recirculação não bem assim como se dizia. Isto é, à semelhança de nós
andarmos a fazer um circuito a pé ou de automóvel por determinadas ruas
predeterminadas, podemos fazer uns atalhos. É frequente que os linfócitos possam sair
rapidamente do sangue e irem para os tecidos, sem passarem pelos órgãos linfoides
secundários, como também é frequente eles serem impedidos de ir dos tecidos para a
linfa, e portanto ficarem armazenados nos tecidos e não retornarem ao sangue. É uma
das coisas que nos vai ser proposta quando falarmos da sida, porque o desaparecimento
dos linfócitos CD4, que durante muito tempo se pensou que era meramente porque eles
eram destruídos, quando eles também ficam armazenados nos tecidos.
Durante muito tempo, o fígado foi esquecido como órgão ligado ao sistema imunitário.
Pensava-se que realmente era o baço e a medula. O fígado é no entanto um órgão de
importância vital para o sistema imunitário, nomeadamente porque todos os linfócitos
sinalizados para morrer vão para o fígado. Em qualquer patologia em que haja uma
destruição importante de linfócitos, eles vão ser sinalizados para morrer, indo para o
fígado, que pode vir a ser um órgão altamente afectado porque vai receber todos aqueles
linfócitos danificados que vão libertar enzimas, que produzir agressão a nível do tecido
hepático.
Imunologia
aula nº 9
Tecido Linfoide Associado a mucosas
- Estimulação Linfocitária no GALT O GALT é uma estrutura fundamental para que haja estimulação dos linfócitos.
No epitélio intestinal há um conjunto de células que têm permeabilidade para os Ags. È
fácil de se perceber que, se as células não tivessem permeabilidade para os Ags, não
seria possível ocorrer estimulação dos linfócitos que se encontrassem na mucosa
digestivas. Ao entrar nestas células, os Ags vão entrar em contacto com linfócitos B
(LB) e com linfócitos T (LT). Isto vai levar à proliferação destas células com o
consequente ganho de memória imunológica frente aos Ags de estimulação.
Ciclo Celular
Para que o linfócito possa cumprir o seu ciclo celular, ele inicia sob a forma de
um linfócito “naive” (uma linfócito que tem todas as estruturas de reconhecimento do
Ag, nomeadamente as imunoglobulinas de superfície, mas que não tem qualquer
especificidade para o Ag).
Este linfócito inicia o ciclo celular numa fase inicial, chamada G0. Ele entra de
seguida numa fase G1, em que há uma activação de proliferação. Depois desta fase
G1, ele poderá entrar em 2 subfases (uma mais precoce e outra mais tardia), em
que o linfócito apenas se está a preparar para uma proliferação (logo para uma
divisão celular). De seguida entra na fase G2, em que há uma duplicação do DNA
para que ele se possa dividir. Habitualmente, esta fase G2 segue-se a uma fase M
(fase de mitose) em que o linfócito se divide em 2 células.
O que é que pode acontecer neste processo proliferativo?
Resposta: Se for um linfócito B, ele pode dar um plasmócito, em que esse
plasmócito produz Acs (plasmócito esse que fica numa fase G0 mas que também pode
originar um ciclo proliferativo G1, G2, M) ou pode dar células de memória (que
também ficam numa fase G0, mas que podem entrar num ciclo celular e assim
proliferar).
Tal como é importante as células proliferarem, também é importante que as
células sejam contidas (paradas) nessa proliferação, senão, estaríamos sempre com
linfócitos a proliferarem sem razão para isso.
Num linfócito activado existem várias estruturas que vão “decidir” se o linfócito
activado vai proliferar ou se vai morrer. Essas estruturas, são sobretudo os
receptores de citocinas e um conjunto de expressões (condicionadas por vários
genes) que habitualmente são designadas como sendo as estruturas ligadas à
apoptose. Assim, se o que prevalecer for a presença de receptores de citocinas e um
estímulo positivo nessa célula (um conjunto de sinais continuado de activação), esse
linfócito B vai entrar na fase G1, G2 e M, originando quer plasmócitos quer células
de memória. Se não prevalecerem estes estímulos e eles forem inapropriados (ou
cessarem), o linfócito em vez de proliferar vai entrar em apoptose e morre.
Apoptose e Resposta Imunitária
O sinal de morte celular é um sinal em várias fases, durante o qual a célula pode
libertar-se da apoptose (quase até à parte final). Pode haver um sinal de morte celular e
na fase seguinte a célula ser libertada da apoptose.
Há estruturas genéticas que previnem a apoptose, como por exemplo o BCL2 e o
BCLXL, enquanto outras promovem largamente a apoptose, como por exemplo as
caspazes. É fácil perceber que a maioria das células tumorais (nomeadamente as células
cancerosas) têm uma grande quantidade de BCL2, conseguindo assim inibir a sua
própria apoptose, não sendo assim sensíveis à morte celular ( quer por quimioterapia,
quer pelo nosso próprio sistema imunitário).
As células podem assim ditar um pouco do que seja no sentido de morte ou no
sentido de proliferação.
Necrose/Apoptose
É importante perceber que a apoptose não tem nada a ver com a necrose.
A necrose é um processo de morte celular completamente diferente, acontecendo
numa agressão que acaba por destruir a célula. A célula aumenta de volume (as
mitocondrias aumentam de volume tornando-se floculentas, inchadas), seguindo-se uma
desintegração da célula, levando á libertação do conteúdo da célula, o que causa muita
inflamação (a necrose de um tecido tem muita inflamação associada).
Estimulação Linfocitária e Apoptose
Pelo contrário, a apoptose leva ao encolhimento da célula. Depois, há uma
fragmentação por formação de bolhas com uma membrana à volta (onde se encontra o
conteúdo citoplasmático e nuclear já desintegrado), sendo estas bolhas que vão ser
fagocitadas. Logicamente, a inflamação associada á apoptose é muito mais pequena que
a inflamação associada á necrose (contrariamente ao que vem escrito em muitos lados, a
apoptose também causa inflamação – se há fagocitose, é porque há algum estímulo
inflamatório).
Indução da Resposta Imunitária
A fase inicial de toda a resposta imunitária é a apresentação antigénica. A
apresentação antigénica dá-se com uma condicionante, que é o reconhecimento das
estruturas benéficas do nosso organismo. Para que os linfócitos saibam que a célula
apresentadora é uma célula do nosso organismo, há a presença do MHC (complexo
maior de histocompatibilidade) que é apresentado por todos os tipos de células
apresentadoras e que pode ser de 2 tipos: da classe II ou da classe I. Os MHC são
entidades genéticas das nossas células. Se forem MHC da classe II ela consegue
apresentar o Ag a linfócitos CD4, se forem da classe I ela apresenta a o Ag a linfócitos
CD8.
Isto condiciona que, quando tivermos uma apresentação pela classe I aos
linfócitos CD8, vamos ter aquilo que classicamente chamamos imunidade celular, em
que a resposta vai ser dada particularmente através de células. Se for uma apresentação
pela classe II aos linfócitos CD4, poderá (em muitos casos) dar-se uma resposta por Acs
(depois da transformação em plasmócito do linfócito), tomando a designação de
imunidade humoral (porque depende de Acs, substâncias que estão em líquidos
biológicos).
Células Apresentadoras de Ags (APCs)
Quais são as principais células apresentadoras de Ag?
Essas células vão ser divididas em 2 grupos:
um grupo em que estão as que exprimem MHC da classe II, indo
portanto apresentar o Ag aos linfócitos T CD4 (os linfócitos B como
células apresentadoras, as células dendrídicas e os macrófagos)
um grupo de todas as células nucleadas do nosso organismo que
exprimem o MHC da classe I e que apresentam o AG aos linfócitos T
CD8
Genericamente, todas as células nucleares exprimem MHC da classe I, podendo
assim apresentar o Ag aos linfócitos CD8. temos depois células especializadas que
exprimem MHC da classe II que apresentam aos linfócitos CD4 ( e que são por exemplo
os linfócitos B, as células dendrídicas e os macrófagos).
Macrófagos, Monócitos e Fagocitose
O macrófago como célula apresentadora tem uma característica particular: ele
funciona basicamente através da fagocitose. Contudo, não é necessário haver fagocitose
para haver apresentação antigénica (ele utiliza a fagocitose para fazer apresentação
antigénica, não sendo no entanto necessário que haja fagocitose para que haja
apresentação antigénica). A ingestão de uma bactéria, e a respectiva degradação pelas
enzimas lisosómicas, leva a que estruturas desta bactéria sejam acopladas ao MHC da
classe II (que estava no interior do macrófago) e que depois isto seja expresso á
superfície do macrófago. Isto é, pequenos fragmentos da bactéria são acoplados ao
MHC (que depois ficam “agarrados” à membrana celular do macrófago) indo este
conjunto originar o estímulo para a apresentação antigénica.
O Sistema Fagocítico Mononucleado
- Representação Sistémica e dos Tecidos É importante saber que os macrófagos e os monócitos fazem parte de um
conjunto muito vasto de células (ao qual poderíamos chamar sistema fagocítico
mononucleado) que têm uma representação quer sistémica, quer nos tecidos. A
representação sistémica (no sangue) é o monócito. Depois, temos células que, apesar de
não parecer, são macrófagos – as células de Kupfer no fígado (que são macrófagos
especializados existentes no fígado). No rim, temos ainda células do mesângio que são
também macrófagos modificados; temos ao nível do pulmão os macrófagos alveolares;
temos ao nível das serosas (pericárdio, peritoneu, etc) macrófagos especializados das
serosas; temos ao nível do cérebro as células da micróglia; temos no baço macrófagos
especializados chamados seios esplénicos; e, temos ainda nos gânglios linfáticos
macrófagos especializados.
Contudo, macrófagos que não apresentem função fagocítica, apresentam função
de apresentação antigénica.
Células de Langerhans
Do mesmo modo que os macrófagos constituem um conjunto muito vasto de
células, temos ainda outro conjunto muito importante, que é o das células dendrídicas.
Se tivermos agressão antigénica, será sobretudo através das vias de entrada naturais do
Ag que são as mucosas e a pele. Portanto, nós não poderíamos estar desprotegidos na
pele em relação à apresentação antigénica. Assim, na epiderme, nós vamos ter células
que são queratinócitos que são células muito importantes na resposta inflamatória e
vamos ter células de Langerhans que são células apresentadoras de Ag, que são capazes
de captar o Ag ao nível da parte mais superficial da pele, transportar esta informação
através dos vasos linfáticos e, depois, a célula de Langerhans transforma-se numa célula
dendrídica nos gânglios linfáticos onde vai apresentar o Ag ao linfócito. A célula de
Langerhans capta o Ag à superfície da célula, caminha para a profundidade da pele, vai
por um linfático aferente até um gânglio linfático onde se transforma numa célula
dendrídica e apresenta a informação antigénica.
Isto é importante por 2 conceitos:
-
primeiro, nós podemos ter uma apresentação antigénica a uma
distancia considerável, por exemplo uma unha encravada num pé,
havendo aí uma apresentação antigénica e o gânglio que sofre é por
exemplo um gânglio inguinal (porque será aquele que no trajecto da
apresentação foi o primeiro onde a célula apresentadora (neste caso a
célula de Langerhans) se transformou e efectuou esta apresentação);
-
por outro lado, ao migrarem, se elas forem fortemente
estimuladas para apresentar Ag, as células de Langerhans (que existem
quer na pele quer nas mucosas) podem migrar praticamente todas, o
que quer dizer que poderíamos deixar de ter estas células porque elas
tinham ido todas para os gânglios linfáticos mais próximos no sentido
de apresentar Ags. É uma coisa que acontece na realidade, sobretudo na
mucosa do colo uterino, em que os herpes vírus vão fazer um estímulo
muito grande das células apresentadoras (células de Langerhans). As
células de Langerhans vão condensar aqueles vírus nos gânglios
linfáticos mais próximos; deixam ficar células de Langerhans no colo
uterino; entretanto há mais herpes vírus que surgem, conseguem
transformar uma célula normal em célula maligna e essa célula maligna
pode proliferar facilmente pois o nosso sistema imunitário não a
conseguiu ver. Vê-se assim facilmente como é que um processo
aparentemente de
susceptibilidade.
defesa
se
transforma
num
processo
de
Apresentação Antigénica (Ags Exógenos/Ags Endógenos)
Podemos ter apresentação antigénica para Ags exógenos (que é talvez o mais
evidente, como é p caso por exemplo de uma bactéria que entrou). Quando isto
acontece, normalmente, a apresentação é de Ags exógenos é feita através do MHC da
classe II. Mas, também pode haver a apresentação de Ags endógenos, cuja apresentação
é feita pelo MHC da classe I.
O que é que são Ags endógenos? São Ags que existem dentro da própria
célula: quer sejam naturais (estruturas da própria célula ou de degradação da célula),
quer sejam motivados por uma infecção de agressores intracelulares (um vírus, por
exemplo, uma vez no interior da célula vai formar alterações, vai levar à produção de
novas proteínas, novas estruturas que estão dentro da célula e que vão ser apresentadas
no conceito de MHC da classe I.
Um elemento intracelular é habitualmente apresentado aos CD8, pela exposição
da classe I. Elemento extracelular habitualmente é apresentado aos CD4 pela exposição
da classe II.
Apresentação Antigénica – MHC da Classe I
Considerando que já temos um Ag endógeno dentro da célula, por exemplo a
proteína um vírus, que estando dentro da célula implica uma apresentação antigénica
restrita ao MHC da classe I. Há um Ag intracelular, mas também uma estrutura
chamada proteasoma (estrutura capaz de degradar proteínas em pequenos peptídeos ou
mesmo em aminoácidos) e o TAP (o transportador de peptídeos). O TAP vai assim
transportar peptídeos de modo a que o Ag possa ser acoplado ao MHC da classe I (os
MHC quer da classe I quer da classe II estão dentro do retículo da célula). Forma-se
uma vesícula de transporte (estamos no citoplasma da célula) com o MHC da classe I
mais o respectivo peptídeo e esta vesícula de transporte acaba por surgir à superfície da
célula, onde temos a chamada expressão membranar do MHC da classe I, mais o
respectivo peptídeo (mais o Ag). A apresentação de outras estruturas que não sejam
proteicas (que são as mais frequentes) não é bem assim. Um proteasoma, que é uma
estrutura proteolítica, não pode actuar sobre um lípido.
Uma vez expresso o MHC da classe I e o Ag, há uma ligação específica do Ag ao TCR
e a fixação do CD8 ao MHC da classe I. Esta troca de informações é basicamente feita
através de uma rede de citocinas. Produzem-se citocinas quer da célula apresentadora
quer do linfócito CD8. Para além da rede de citocinas, podem formar-se ligações entre
outros pares de moléculas, como seja por exemplo um sinal indutor de apoptose do FAS
(CD95) ligante, o FAS L (CD95L), que existe no linfócito CD8. O resultado deste
processo é que esta célula que tinha vírus teve um sinal de morte através da ligação
deste par molecular, para além de ter sido induzida a morrer por uma citocina, o TNF
(dois sinais de morte: o TNF e o CD95). O resultado normal seria a célula apresentadora
morrer e o vírus ser destruído.
Apresentação Antigénica – MHC da Classe II
Outro caso pode ocorrer, mas com um Ag extracelular, por exemplo uma
bactéria. Pode haver 2 formas de se dar a primeira fase da apresentação antigénica:
- uma é dar-se endocitose (e não fagocitose), com formação de uma
vesícula de endocitose. A célula capta aquela estrutura mas não tem a mínima
intenção de a degradar (de fazer um fagolisosoma, um fagosoma, etc)
- a outra hipótese é haver fagocitose. Embora isto inicialmente possa
parecer muito igual, na fagocitose vai haver hidrólise do Ag, enquanto na
endocitose não vai haver hidrólise do Ag. No caso da fagocitose vai haver uma
hidrólise enzimática do Ag. Aqui, ao contrário do último caso, tudo vai ser
hidrolisado, quer sejam peptídeos, lípidos, etc, pois trata-se de uma hidrólise
enzimática.
Seja por endocitose, seja por fagocitose, o resultado vai ser a formação de
estruturas moleculares mais pequenas, que em princípio se vão ligar ao MHC da classe
II. Esta ligação ao MHC da classe II é um processo um pouco mais complicado.
Habitualmente, o MHC da classe II está tapado por uma estrutura proteica chamada
cadeia invariável. Para que as nossas células não estejam sempre a fazer apresentação
antigénica há uma estrutura de protecção (uma espécie de tampa) que é colocada no
MHC da classe II para que este não fique disponível. Para que o Ag se possa ligar ao
MHC da classe II, esta cadeia tem que ser fragmentada.
Depois disto ocorrer, vai formar-se uma vesícula de transporte que inclui o MC
da classe II e o respectivo Ag que vai ser apresentado. Dá-se a expressão deste conjunto
MHC da classe II mais Ag à superfície da célula apresentadora e a ligação ao
linfócitoCD4 (célula apresentadora do MHC da classe II e o Ag; o linfócito CD4 com o
TCR específico para o Ag e o CD4 que se liga ao MHC da classe II ). Dá-se também a
ligação de outros pares moleculares que permitam uma maior estabilização da ligação
entre estas duas células. Estes pares moleculares são normalmente o LFA1, ICAM1( é
um par de estabilização molecular) – LFA1 por parte do linfócito e INCAM 1 por parte
da célula apresentadora. Outro par muito importante é o CD28 no linfócito CD4 e o
CD80/CD86 na célula apresentadora. Esta estrutura global de ligação é que permite que
o linfócito seja activado e possa assim responder. Não basta a ligação do Ag ao TCR e
do CD4 ao MHC da classe II, é necessária a formação destes outros pares de ligação. O
resultado (à semelhança do que acontecia com a apresentação da classe I) vai ser a
formação de uma rede de citocinas. O linfócito responde com citocinas e a célula
apresentadora produz também citocinas. Aqui, vai haver uma grande diversidade de
citocinas que vão ter influencia quanto à formação de um linfócito CD4Th1 ou
CD4Th2.
Apresentação do Antigénio pelos LB (Linfócitos B)
Sendo o linfócito B a apresentar o Ag, ele tem forçosamente que ir apresentar a
um linfócito CD4 (porque um linfócito b tem MHC da classe II). O linfócito B tem à
sua superfície imunoglobulinas (portanto, Acs na membrana). Numa primeira fase o Ag
é captado por essas imunoglobulinas que se encontram na membrana do linfócito B.
Depois dá-se uma endocitose do conjunto do Ag mais a imunoglobulina (o linfócito B
não participa). Depois dá-se todo o processo já visto dentro do citoplasma (actuação do
proteasoma, do transportador de peptídeos, etc) e o Ag mais o MHC vai ser expresso à
superfície do linfócito (não no contexto da imunoglobulina como estava antes mas no
contexto do MHC mais Ag). Na etapa seguinte dá-se a verdadeira apresentação
antigénica: um linfócito B com MHC da classe II mais o respectivo peptídeo está a
apresentá-lo a um linfócito CD4, no contexto do TCR e do CD4 (iremos ter aqui
também a ligação do CD4 com o MHC da classe II). Vamos imaginar , por uma questão
prática, que o CD4 é um Th2 que é um linfócito que vai depois estimular linfócitos B.
Na fase seguinte, este linfócito CD4 é um linfócito que vai produzir interleucina 4 (é um
linfócito Th2, basicamente referido como linfócito helper), e este linfócito CD4
produzindo interleucina 4 vai estimular outro linfócito B que tenha receptores para a
interleucina 4. Estes linfócitos B entram em proliferação, em expansão clonal,
dividindo-se até G2 M (G2 mitose). Aqui estes linfócitos vão dar linfócitos memória ou
por transformação em plasmócitos, vão produzir Acs (encerrando-se assim o ciclo).
Imunologia
10ª aula
As células têm a capacidade de enviar e receber sinais. Essa comunicação celular
é assegurada por pequenas moléculas proteicas chamadas citocinas.
NOTA: Apesar do livro adoptado ser recente, este poderá ter alguma falhas e algumas
incorrecções nesta área. Isto advém do facto desta área se encontrara em pleno
desenvolvimento (que nos dá muitas perspectivas a nível médico, pois pensa-se que
muitas terapêuticas poderão incidir sobre essas moléculas (em vez de utilizar
antibióticos que destroem tudo, chegando inclusive a ser mais prejudicial para o
hospedeiro do que para a bactéria, poderemos utilizar estas moléculas para uma defesa
anti-infecciosa, anti-cancerosa, etc.).
Há 50 anos atrás, havia já a noção de que algumas destas moléculas tinham
actividade antivírus e que outras activavam os macrófagos. Foi necessário quase duas
décadas para que a designação citocina fosse adoptada. Não havia até aí conceito de que
estas moléculas eram produzidas numas células e actuavam noutras (havendo assim
uma comunicação entre células).
Assim, o termo citocina foi proposto em 1974, mas houve uma relutância
enorme na sua apresentação. Aquilo que nos é hoje por demais evidente no conceito de
citocina, isto é cinética entre células (algo que se move entre as células em
comunicação), naquela altura foi extremamente mal aceite.
Começa-se a pôr a hipótese de serem produzidas por leucócitos e actuarem
sobre eles (daí o termo de interleucinas). Curiosamente, foi o termo interleucina que ,na
altura, vingou. Fazem-se depois alguns estudos na área química, de purificação parcial
de citocinas, produção de Acs ani-citocinas, e chega-se a uma conclusão muito
importante: existem vários nomes diferentes para a mesma molécula. Isto é, consoante o
grupo de investigação ou consoante a área que tivesse sido mais desenvolvida (por
exemplo em relação aos virologistas, em relação aos bacteriologistas, em relação aos
imunologistas, etc, a citocina tinha uma designação diferente, o que era grave, pois
ainda hoje , em algumas publicações vem designações que vieram de algumas equipas
mas que não era a designação internacional, acabando por haver muitas confusões.
Depois dos anos 80, começa o estudo das citocinas. Porquê? Porque há a
possibilidade de produzirem Acs monoclonais contra citocinas e contra os seus
receptores, e portanto a partir daí estudar molécula a molécula. Finalmente, começa a
haver manipulação genética, disponibilidade de citocina recombinante, estudos
funcionais, protocolos terapêuticos (primeiras abordagens terapêuticas).
Tal como nos anos 60 houve dificuldade em dar nome às moléculas, nos anos
90 nota-se a dificuldade da caracterização funcional e a limitação dos modelos animais.
Nesta área assim como outras que se prendem coma imunologia, os modelos animais
são todos muito pouco interessantes. Os modelos animais servem apenas para
desenvolvimento de alguns conceitos e de imunologia básica, mas quando os
pretendemos passar para o ser humano, temos grandes dissabores. Muitas vezes,
moléculas extremamente activas no animal não são activas no ser humano ou têm
acções adversas extremamente evidentes. Por isso, a experimentação animal tem
bastantes limitações nesta área.
O que é interessante, é por exemplo fazermos manipulação genética num animal,
e por exemplo fazer o “knock out” de um gene, abolindo a expressão de um
determinado gene saber o que acontece. Contudo, o animal não tem tanta redundância
como o ser humano, isto é, o animal pode ter só uma citocina para uma determinada
função e nós podemos, por exemplo, ter 20 citocinas para a mesma função. O que quer
dizer que se fazemos um “knock out” genético no animal ele perde aquela citocina (não
pode ter aquela função), mas no ser humano, se tivermos um defeito genético nessa
área, temos outras citocinas que podem suprir a falta daquela.
O outro problema que vamos encontrar quando pretendermos ler algo sobre isto,
é encontrar uma definição difícil e uma classificação difícil.
A definição é difícil por se tentar colocar todas as famílias de citocinas no
mesmo saco (e elas são muitas!) e, obviamente não podemos definir coisas diferentes,
metendo-as todas juntas. A sugestão que se pode dar é ou uma definição mais
complicada, ou uma mais simples. Podem chamar-se de proteínas de baixo peso
molecular (são realmente pequenas proteínas). São frequentemente glicosiladas,
também sendo esta informação importante, porque por recombinação genética como se
sabe as proteínas não são glicosiladas e, portanto, o funcionamento de uma citocina
recombinante nem sempre é igual à citocina dativa. São reguladoras celulares
produzidas por diferentes células, actuando em particular o sistema imunoinflamatório.
Esta definição pretende limitaras citocinas, nomeadamente ao sistema
imunoinflamatório (pois vamos ver que há citocinas que actuam na parte
hematopoiética: para que haja crescimento de glóbulos vermelhos são necessárias
citocinas, mas essas citocinas não são as que se prendem com a parte
imunoinflamatória).
Outra hipótese de definição, é a de que são moléculas de comunicação celular,
actuando como modificadoras das respostas biológicas.
Quanto à classificação, há uma grande sobreposição de conceitos e famílias, com
tentativa de classificação por função, por família (ou grupo) e por estrutura, quer das
citocinas, quer dos receptores (porque podemos classificar a estrutura da citocina (o que
não é tão fácil quanto isso) mas também podemos classificar o receptor, uma vez que
ela tem que actuar algures.
Só para tentarmos ficar com uma noção de que elas são muitas, repare-se que
clonadas são cerca de 150, com actividade biológica que insistem em ser utilizadas são
umas 20-30, portanto são muitas, o que é natural pois as células necessitam de sinais
diversos para comunicar (sendo de realçar que vamos ter os acrónimos anglosaxónicos,
não utilizamos siglas portuguesas).
Que tentativas de classificação é que poderia haver?
Na classificação por função, poderia dizer-se que há mediadoras da imunidade natural,
há reguladoras da activação de crescimento e diferenciação linfocitária, há reguladoras
da imunoinflamação, há estimuladoras da hematopoiése. De acordo com outro autor, e
em relação na mesma à função, já poderíamos dizer que elas são citostáticas, citotóxicas
ou antivírus, activadoras das células do sistema imunitário Th1 e Th2, reguladoras da
inflamação, estimuladoras da hematopoiése. Embora alguns grupos se sobreponham
(sejam parecidos), outros são completamente distintos. Acaba por ser uma classificação
em que muitos (para não dizer todos) estão em desacordo.
Outra tentativa de classificação que pareceu bastante mais interessante, mas que
apesar de tudo também não surtiu muito efeito, era por família (ou por grupo) de
moléculas, porque se sabe que há interleucinas, porque se sabe que há quimiocinas, há
interferões, há factores de crescimento celular e há outras. O problema é mesmo haver
outras, o que torna a classificação difícil, pois se algumas não as conseguimos
classificar, começamos obviamente a ter limitações.
De acordo com outro autor, poderíamos ser um pouco mais extensos na
tentativa, e assim, teríamos interleucinas, quimiocinas, interferões, factores de
crescimento hematopoiético-celular, acrescentando reguladoras do crescimento celular e
factores d e necrose celular. É uma tentativa. Não quer dizer que nesta situação não
sejam introduzidas todas as citocinas, mas se quiséssemos ver com mais pormenor,
iríamos ver que há factores de crescimento hematopoiético que também estarão neste
grupo que provavelmente dentro das citotoxinas também são factores de crescimento
hematopoiético, acabando também por ser confuso.
Por estrutura, a situação melhorou um pouco, embora também tenha algumas
dificuldades porque basicamente há 2 tipos básicos de cadeias ou alfa, ou beta, e, dentro
das alfa podem ser de cadeia curta ou de cadeia longa (sendo possível colocar aqui a
maior parte das citocinas) e dentro das cadeias beta teríamos por grupos CMS
nomeadamente, por exemplo interleucina 1 ou factores de transformação celular. Ainda
haveria outras estruturas alfa-beta de cadeia curta que são sobretudo factores de
crescimento celular, e finalmente, as chamadas estruturas em mosaico. Para além das
duas principais (relativamente às quais não há grande polémica) teríamos ainda mais
duas possibilidades de estrutura já bastante mais difíceis de entender no conceito prático
da questão.
Portanto, talvez não valha a pena preocuparmo-nos demasiado com a
classificação, se entendermos que é necessário uma classificação (porque é: como tudo
na vida se não houver classificação, vai haver uma grande desordem e assim ninguém
entende nada), mas é necessário encontramos uma nova classificação. E, talvez esta
nova classificação possa ter a ver com coisas tão simples como por exemplo,
historicamente, haver grupos de interleucinas (pois há interleucinas até à vinte e tal).
Por exemplo as quimiocinas será outro grupo. Se há factores de crescimento, será outro
grupo, os interferões, os CMS, outros factores de modificação celular. Poderá ser uma
tentativa, o que não quer contudo dizer que por estrutura elas não venham a ser
consideradas nesta tentativa (depende um pouco do que for o futuro da classificação
destas moléculas).
Seja qual for a tentativa de classificação, ela não deve ser inventada sem
critérios, sendo fundamental sabermos porque é que a utilizamos.
É importante perceber que dentro deste esquema de classificação, as funções
delas são extremamente diversas. E, se as funções são extremamente diversas, uma
coisa que não podemos fazer é classificá-las por função. Isto porque se elas têm tantas
funções iríamos colocar-nos numa classificação extremamente difícil.
Abolindo a hipótese da função, é necessário reparar que elas podem interferir em
praticamente tudo que seja modificação celular, desde proliferação, diferenciação,
mudança de fenótipo, levar à secreção de Acs, levar à migração de células, etc. têm
assim funções muito variadas.
Interessa agora perceber como é que se forma a chamada rede de citocinas. Até
aqui tentamos vê-las isoladamente numa tentativa de classificação, vamos agora ver
como é que na prática elas podem funcionar. Na prática temos citocinas por um lado e
receptores das citocinas por outro. Isto é por demais evidente na maioria das estruturas
químicas do nosso organismo, temos que ter a estrutura química e temos que ter o
receptor onde essa estrutura vai actuar.
No entanto isto começa a complicar, porque a citocina ao ser produzida pode
não ir actuar directamente no receptor por encontrar antagonistas (há substâncias que
são antagonistas da citocina, portanto substâncias que a impedem de actuar sobre o
receptor), por encontrar substâncias miméticas (substâncias que são como que sócias da
citocina e estimulam a função das citocinas) e por encontrar proteínas de transporte (que
podem transportar a citocina quer para o local correcto (o receptor), quer eventualmente
para um local incorrecto, impedindo-a assim de actuar). Temos assim impedimento da
actuação, aumento da actuação e modificação da actuação.
Em relação aos receptores, começa por acontecer logo uma coisa curiosa: os
receptores têm um controlo muito variado, o receptor não é algo que exista de forma
espontânea na célula. O receptor pode ser uma substância induzida, e, uma célula no
tempo 0 (zero) não ter receptor, e num tempo 1 passar a exprimir esse receptor. Nem
sempre o receptor está disponível. Teremos 3 tipos de receptores
Receptores celulares (que são evidentes), sendo receptores que se
encontram na célula, e, a citocina ao actuar sobre eles pode levar a que
a célula dê uma resposta.
Receptores solúveis, que são receptores que não estão na célula, ,as
que se encontram nos líquidos biológicos. Estando nos líquidos
biológicos, estes receptores solúveis tanto podem ser favoráveis à acção
da citocina (isto é ampliar a acção da citocina – efeito agonista), como
ter uma efeito antagonista, bloqueando a acção da citocina.
Receptores de esgoto, que serve para que todas as citocinas que
estejam a mais sejam eliminadas. É fundamental numa comunicação
celular. Durante muito tempo não se sabia para que é que eles existiam
e demos pouco valor a estas estruturas.
Vamos ver concretamente em relação aos receptores solúveis, o que é que se
passa, porque é que uns são antagonistas e outros são agonistas. Vamos ver o caso da
interleucina 2. A interleucina 2 tem 3 subunidades:
a subunidade α
a subunidade β
a subunidade γ
O que habitualmente solubiliza é a subunidade α, que se desprende da célula
ficando nos líquidos biológicos. Quando se produz interleucina 2, se não houver
receptor solúvel, a interleucina 2 vai actuar nos receptores das células e as células
respondem. Mas se existir o receptor solúvel, a interleucina 2 liga-se a ele e como perde
este ponto de ligação já não se pode mais ligar a outra célula. Ela ficou assim bloqueada
funcionalmente com o receptor solúvel e já não actua na célula. Isto quer dizer que o
receptor solúvel tem acção antagonista na IL2 (interleucina 2). Normalmente estes
receptores solúveis denominam-se SR (soluble receptor).
Vamos ver agora o caso da IL6. A IL6 tem um receptor que também tem 3
subunidades, aliás, se quisermos ser mais objectivos, a IL6 tem 2 subunidades e a IL11
tem também 2 subunidades. O que interessa é já não funciona como a IL2, mas o que
acontece é que para a IL6 actuar, tem que se ligar primeiro a um receptor, e depois de se
ligar a esse receptor, este conjunto sinaliza outro que é a CD130. isto é, o que estimula a
célula, é o conjunto IL6 mais receptor da IL6 (este conjunto estimula o CD130). Se não
houver receptor solúvel, a IL6 liga-se ao receptor, o receptor dá um sinal ao CD130, o
CD130 internaliza o sinal, e a célula responde.
Se houver receptor solúvel o que é que acontece? O receptor solúvel liga-se à
IL6, e, em qualquer célula em que haja CD130 este conjunto vai estimular a célula.
Portanto, haver receptores solúveis, significa maior oportunidade de estimular células –
efeito agonista, efeito potencializador, e não efeito antagonista como no outro caso. O
interesse prático de tudo isto, é sobretudo percebermos se, na terapêutica, um receptor
estimula ou bloqueia a acção da citocina. Cometeram-se muitos erros por não se
conhecer estes factos. Isto é, bloqueava-se ou inibia-se o receptor solúvel a IL2 e havia
um determinado efeito, e fazia-se o mesmo para a IL6 e o efeito era exactamente o
oposto. É fundamental percebermos como é que as coisas funcionam.
Outro conceito importante na área dos receptores das citocinas, é o que se passa
em relação, por exemplo, ao TNF (factor de necrose tumoral). Mais uma vez existe
diferença entre o modelo animal e o modelo humano. No modelo animal o factor de
necrose tumoral é realmente uma citocina anti-tumoral (faz regredir tumores
extremamente avançados em questão de horas ou dias. Contudo, no sistema humano, o
TNF é um falhanço sob o ponto de vista de acção anti-tumoral.
De qualquer forma, o TNF tem 2 receptores. O que é curioso, é que o TNF, tendo 2
receptores, o R1 e o R2, consoante o receptor a que se ligue o TNF, pode levar a
sinais de activação da célula ou a sinais de morte da célula. Note-se que a mesma
citocina, só porque actua num receptor diferente, pode estimular a célula ou matála. Obviamente que é fundamental em qualquer terapêutica (ou tentativa) de TNF,
sabermos qual o receptor é que está a ser envolvido. O R2 leva a uma activação e a
um sinal anti-apoptótico, enquanto o R1 leva a um sinal apoptótico.
Mas talvez outras coisas se compliquem particularmente em relação às
quimiocinas. As quimiocinas são um grupo dentro das citocinas, e neste grupo das
quimiocinas nós temos basicamente 3 famílias: a família TXT, a família TC e a família
T. Para cada um destes subgrupos, existem receptores, só que estes receptores podem ter
4 tipos de expressão.
Haverá receptores específicos (que são raros), específicos porque, por exemplo
um receptor para a IL2 será só para a IL2. Mas, é extremamente difícil encontrar um
receptor só para uma quimiocina. O que habitualmente há, é os chamados receptores
partilhados: servem para várias quimiocinas. Há ainda outros receptores chamados
mistos. Mistos, porque servem para qualquer citocina mas não só. Não só, porque vários
agressores utilizam-nos como por exemplo alguns parasitas. O plasmódio utiliza este
tipo de receptores para nos infectar, isto é, o receptor duma célula recebe não só para as
nossas citocinas (neste caso quimiocinas), como serve para o parasita como porta de
entrada e assim infectar as células. Finalmente, temos receptores de quimiocinas que são
induzidos por vírus. Isto é, somos infectados por um vírus, o vírus leva à produção de
receptores de quimiocinas e nós passamos a ter uma função imunológica completamente
diferente, porque passamos a ter receptores que não devíamos ter, perturbando
logicamente a função do nosso sistema imunitário. Nestes partilhados, fala-se
particularmente do CXCR para a família CXC, e fala-se do CCR para a família CC.
O interesse de se chamar a atenção para este facto, é porque, particularmente em
relação ao HIV, para alem do CD4 ser um dos alvos do HIV, particularmente o CXCR4
e oTCR5 são os alvos privilegiados do HIV. Isto é, durante muito tempo, pensamos que
o HIV só utilizava o CD4 como porta de entrada para o nosso organismo, e, qualquer
tentativa de terapêutica falhou porque não podíamos bloquear o CD4 e pensávamos que
o CD4 era a única porta de entrada. Até que se percebeu que estas pequenas moléculas
de CCR5 e CXCR4eram verdadeiras portas de entrada para o vírus, e neste momento,
qualquer tentativa de bloquear estes receptores tem dado uma melhoria excepcional de
combate contra a infecção do HIV.
As citocinas não têm uma forma de acção banal como outras moléculas que
existem. Elas podem ter basicamente 3 tipos de acções.
A célula produtora pode produzir a citocina ela actuar sobre a própria célula produtora,
o que é um tipo de acção invulgar no nosso organismo, mas que acontece muito nas
citocinas (chama-se a isto uma acção autócrina). A citocina pode actuar nas células
vizinhas (chama-se a isto uma acção parácrina) e a citocina pode ainda actuar em
células à distância (por aquilo que se chama uma acção endócrina), actuando como
uma hormona.
Diferentes citocinas podem ter origem na mesma célula ou em células distintas.
Quando falamos das citocinas, temos que imaginar que elas podem ser produzidas na
mesma célula todas, ou que pelo contrário, cada uma estar a ser produzida em células
distintas.
Podem ter uma acção cinérgica – várias citocinas no organismo humano podem
ter uma acção semelhante entre elas.
Podem ter uma acção antagónica. Podem ter uma acção redundante (o
cinérgico especializa e o redundante estimula, é ao fim e ao cabo o mesmo tipo de
função) e raramente tem uma acção específica (é muito difícil dizer-se que esta citocina
serve para isto e para nada mais), normalmente tem vários tipos de acções.
Talvez as mais específicas que se possa referir seja a acção da IL2, uma vez que
a IL2, apesar de actuar noutras coisas, é sobretudo uma citocina fundamental na
proliferação e activação dos linfócitos T. Para que o linfócito se active, é fundamental
que ele produza IL2 e que exprima o receptor da IL2. Se um linfócito não produzir IL2
nem exprimir receptor para a IL2, o linfócito não tem capacidade para proliferar (se isto
não acontecer ele entra em apoptose). Quando ele está activado , tem marcadores
próprios da sua activação. O que é fundamental perceber é que falta de IL2 ou falta de
receptor de IL2 leva a que o linfócito entre em apoptose e não consiga proliferar ( o IL2
tem uma acção autócrina).
Pelo contrário, o TNF tem uma acção verdadeiramente endócrina – pode actuar
localmente, mas também pode actuar à distância. Por exemplo, quando há uma
agressão, há produção de TNF, o TNF pode levar à febre e ao sono (acção
verdadeiramente endócrina que pode chegar ao cérebro quando há por exemplo
agressão de um dedo). Para além desta acção, o TNF actua praticamente sobre todas as
células do nosso organismo (sobre o osso, sobre a estrutura muscular, sobre os
fibroblastos, sobre os adipócitos, sobre o fígado, o cérebro, o sistema
imunoinflamatório, os endotélios, portanto, o TNF é uma citocina com acção endócrina
que se estende a qualquer parte do organismo). O TNF pode inclusivamente promover
situações extremamente graves, como seja a sépsis e o choque térmico, habitualmente
fatais.
Mas, provavelmente, a área que nós devemos detalhar mais é a acção das
citocinas sobre o sistema imunitário. Isto porque é a área que nós temos que perceber
totalmente, para podermos entender como é que o sistema imunitário funciona. Os
mecanismos que nos foram propostos quer na resposta celular quer na resposta humoral
podem ser outros, mas basicamente são citocinas. Aquilo que regula a resposta
imunitária são as citocinas. Vimos isso em relação à apresentação antigénica, o
estabelecimento de uma rede de citocinas entre a célula apresentadora e o linfócito, quer
da parte do linfócito para a célula apresentadora, quer da célula apresentadora para o
linfócito. O que queremos ver é exactamente a acção das citocinas nos linfócitos. A
acção básica das citocinas nos linfócitos, para além de ser a acção proliferativa, a acção
principal delas vai ser na polarização dos linfócitos, na orientação dos linfócitos no
sentido de eles adquirirem novas capacidades funcionais. Esta principal polarização vai
ser o tal contexto Th1 e Th2 dentro dos linfócitos CD4.
Imunologia
11ª aula
A área das citocinas é sem dúvida aquela que vai ter mais importância ao nível
da fisiopatologia, sendo uma área muito abrangente que acaba por tocar muitas outras
áreas da patologia humana.
No sistema imunitário as citocinas vão funcionar como mecanismo regulador.
Entre a célula apresentadora e o linfócito é fundamental que se gerem redes de citocinas
(redes no conceito que nos foi proposto de haver citocinas, de haver receptores e
eventualmente entre as citocinas e os receptores haver estruturas que podem facilitar ou
dificultara acção das citocinas. As citocinas são variáveis consoante a apresentação
antigénica e consoante se trate de uma célula CD4 ou CD8.
Mas, talvez a área mais importante das citocinas e da imunologia seja a dos
linfócitos CD4 e a dos seus subtipos. Os subtipos fundamentais dos linfócitos CD4
(embora depois possamos ver que há outros) são, basicamente os Th1 e os Th2. Os CD4
foram designados como os linfócitos helper, porque se pensava inicialmente que todos
os linfócitos CD4 iam ajudar o linfócito B para que ele produzisse Acs depois da
transformação em plasmócito. Assim, os CD4 ficaram conhecidos como Helpers, tal
como os CD8 ficaram conhecidos como supressores, e daí o Th (da classe 1e o da classe
2). Actualmente, há quem discorde um pouco dessa designação de Helper (que
realmente é meramente histórica) lhes chame apenas T1 e T2.
Como é que um linfócito CD4 se pode transformar num linfócito Th1 ou
Th2? Numa apresentação antigénica (ou seja num processo de estímulo) os CD4 têm
aquilo que nós poderemos chamar um Th0. Isto é, o CD4 ainda não estava polarizado e
sê-lo ia consoante o microambiente é que ele se inserisse (imaginemos por exemplo que
o CD4 se encontra num ambiente rico em IL-4 ele polarizava para Th2, enquanto que
num ambiente rico em inerferão gama (INF γ), outra citocina, ele polarizava para Th1).
Porque é que isto é importante e não apenas uma descrição académica?
Porque, se o linfócito CD4 polariza para Th2, ele vai exercer efeito helper sobre os
linfócitos B. Os linfócitos B transformam-se assim em plasmócitos e vão produzir Acs.
Portanto, se o linfócito polarizar para Th2, ele vai ser o tal clássico Helper porque vai
auxiliar o linfócito B a produzir Acs. O interesse desta situação é sobretudo de nós
produzirmos Acs que nos servem, por exemplo, para através do eosinófilo fazermos
uma defesa correcta contra parasitas extracelulares (nomeadamente os helmintas). E
precisamos também de Acs sobretudo quando há, por exemplo, toxinas (se tivermos
uma situação de tétano, em que há uma produção de toxina tetânica, nós precisamos de
Acs para quer essas toxinas sejam bloqueadas. São as duas situações básicas em que nós
precisamos de Acs.
Mas também temos outro compromisso que é o de produzirmos IgE. Sabemos
que a IgE se pode ligar a outras células como mastócitos e que estes mastócitos vão dar
reacções alérgicas (nós vamos também, com a produção de Th2, exacerbar a alergia).
Por isso, as células implicadas na resposta Th2 vão ser o linfócito B, o eosinófilo e o
mastócito.
Se pelo contrário polarizarmos o Th1, o que é que vai acontecer? O que vai
acontecer é que o linfócito CD4 Th1 faz muito pouca estimulação do linfócito B
(repare-se que quando muito o linfócito B vai produzir IgM e IgG, nunca IgE e
praticamente quase nunca produz IgA). O que se dá, basicamente, é uma estimulação
muito forte dos macrófagos (especialmente através do INFγ) e com isso gerar
citotoxicidade – o macrófago vai ter capacidade citotóxica.
Por outro lado, como o macrófago tem receptores para o Fc das IgM ou das IgG,
o Ag que se liga a estes Acs pode, ao formar este imunocomplexo (Ig mais Ag), ser
fagocitado pelo macrófago e portanto temos mais uma via de destruição (para além da
citotoxicidade do macrófago, vamos ter ainda a capacidade do macrófago fagocitar
imunocomplexos e assim destruir o Ag (logo o agressor).
Para além das citocinas serem fundamentais na polarização Th1 ou Th2, as
citocinas também estão sempre presentes em qualquer um destes processos de
estimulação.
Por exemplo para um Th2 estimular um linfócito B há necessidade de produzir
IL-4, IL-10 e IL-13. Por exemplo para estimular o eosinófilo, tem que se produzir IL-3 e
IL-5. Repare-se que neste caso, a estimulação do linfócito B não se dá pelas citocinas
IL-4, IL-10 e IL-13, mas pelo interferão gama e pela IL-2. trata-se de linguagens
diferentes, mecanismos diferentes de estimulação celular, que ao fim e ao cabo ditam se
há citotoxicidade ou se há produção de Acs.
Devemos ter noção que se estamos perante um vírus e a nossa polarização for
Th2, nós não vamos conseguir desfazer-nos do vírus, porque os Acs não vão ser
eficazes. Pelo contrário, polarizarmos para Th1, vamos conseguir desfazer-nos do vírus
(isto genericamente em relação a qualquer agressor intracelular). Se pelo contrário o
nosso problema for uma parasitose, por exemplo um helminta, se polarizarmos para Th1
não nos vamos desfazer desse parasita, enquanto que se polarizarmos para Th2 já nos
livramos desse vírus (é por isso fulcral e vital haver uma polarização correcta).
A polarização Th1 está associada particularmente a citotoxicidade, mediada
pelos macrófagos. A polarização Th2 está associada à resposta por Acs. Vimos que
algumas citocinas, nomeadamente o interferão gama (INFγ) e IL-12, estão ligadas à
produção de Th1. Ainda outras como IL-10 e a IL-13 que estão mais ligadas à
produção de Th2. No fundo a polarização Th2 dá-se sempre que tenhamos a
hipersensibilidade imediata (uma alergia, uma rinite, etc), enquanto que a polarização
dá–se sempre que tenhamos uma hipersensibilidade retardada.
Temos ainda que ver que para além das citocinas, as hormonas também têm um
papel decisivo nesta balança Th1/Th2. essas hormonas são principalmente duas: o
cortisol, que polariza para Th2 (mais do que polarizar para Th2, o cortisol implica a
incapacidade dos linfócitos polarizarem para Th1) e a dihidroindianoesterona, que na
sua forma sulfatada polariza para Th1. são hormonas fundamentais que existem em
grandes quantidades no nosso organismo, algumas com níveis variantes ao longo do dia
como é o caso do cortisol.
Mas para termos um exemplo do que isto possa interferir na nossa vida,
imaginemos que o professor nos diz (por uma questão de ordem burocrática e técnica)
que o nosso exame de imunologia vai ser para a semana. No mínimo talvez tivéssemos
um susto! E, ao fazermos essa reacção de susto, iríamos produzir grandes quantidades
de cortisol, e, ao produzirmos grandes quantidades de cortisol, estaríamos a impedir que
a polarização dos linfócitos fosse para Th1. se neste momento estivéssemos perante uma
agressão biológica (por vírus, por bactéria, ou por qualquer outro tipo de agressão
celular) teríamos polarizado o nosso sistema imunitário para o lado incorrecto e não nos
iríamos defender facilmente dessa agressão. Por isso é que se verifica muitas mais
infecções, muitas mais doenças tumorais em indivíduos sob stress.
Pelo lado contrário (e isto acontece porque todos nós temos mecanismos de
recuperação), se houver um susto, há produção de cortisol mas a seguir tentamos
compensar o que aconteceu produzindo dihidroindianoesterona (ao aumentarmos esta
hormona, conseguimos contrabalançar aquela balança e assim responder
correctamente).
Existiria ainda uma terceira população de CD4 que chamaríamos Th3. Estes, são
referidos como linfócitos reguladores.
E qual seria a função destes Th3? Seria fazer uma supressão da resposta
imunitária. Estariam associados à produção de IL-10 e TGF (transforming growing
factor – factor de transformação de crescimento) e seriam estes linfócitos que estariam
associados a uma supressão da resposta imunitária, para que ela não continuasse sem
necessidade. São discutíveis na sua designação (Th3), mas são claramente células que
começam a ser identificadas.
Dentro das citocinas, há as quimiocinas que têm receptores que nos permitem identificar
o que são linfócitos Th1 e o que são linfócitos Th2. Isto é, os Th1 tem receptores CCR5
enquanto os Th2 têm receptores CCR3. O CCR5 pode também ter a designação de
CCCKR5, como o CCR3 pode chamar-se CCCKR3.
Vamos agora complicar um pouco mais, pois a partir de Dezembro do ano
passado, surgiu um novo conceito do desenvolvimento destas células Th1 e Th2.
A evolução destas células Th1 e Th2, dá-se porque este grupo de estudo
conseguiu perceber que os microambientes eram importantes para a apresentação
antigénica (que é aquilo que estimula o linfócito). Deveria haver alguma relação entre a
célula apresentadora e o linfócito que levasse á polarização do linfócito. Efectivamente,
o que estes indivíduos propõem é o seguinte: a polarização Th1/Th2 está muito
dependente das células dendrídicas. As células dendrídicas são células profissionais de
apresentação antigénica. Estas células dendrídicas vão amadurecendo (elas são
produzidas na medula e depois têm amadurecimento progressivo), numa fase inicial,
elas criam o seu amadurecimento através de factores das células onde se encontram
(porque as células dendrídicas estão em praticamente todos os tecidos do nosso
organismo). Elas iriam assim colher informação dos tecidos onde estão, dando-se depois
a polarização inicial da célula dendrídica. Mais tarde a célula dendrídica iria polarizar já
na dependência de patogénios,na dependência da influencia de agressores (bactérias,
vírus, parasitas, etc... Ags em geral). Então, haveria algumas células dendrídicas que
estavam ligadas à produção de factores que levem à polarização Th1, nomeadamente à
produção de INFγ.
Teríamos ao fim e ao cabo, uma célula dendrídica do tipo 1 que está ligada à
produção de INFγ, vai produzir muita IL-12 e vai ter um factor de co-estimulação alto
(na apresentação antigénica para além do Ag é preciso haver um fardo de coestimulação, algo que desse um segundo sinal de estimulação).
Portanto, há muita produção de IL-2, há uma co-estimulação importante e o
linfócito vai polarizar para Th1.
Se pelo contrário, nesta fase de maturação da célula dendrídica houver produção
de prostaglandina E2 e factores de comutação Th2 (para a IL-4, etc) nós vamos ter uma
célula dendrídica que sobretudo vai produzir baixas quantidades de IL-12, mas que tem
grande efeito co-estimulatório, e então a polarização vai ser para Th2. Se há muita IL12, logicamente que no meio estarão Th0, isto é, células que através de eventuais
apresentações antigénicas, não têm uma polarização nem para um lado nem para o
outro. Veja-se que nesta percepção do problema, a IL-12 joga a favor da mesma
polarização para Th1 ou Th2.
O que é que teriam a ver as Th3 com algo que caracterizava células
reguladoras? Seria pelo facto de nalgumas circunstâncias, haver factores colerogénicos
e produção de IL-10, e, as células dendrídicas que estavam no sector Th2 produzirem
pouca IL-12 (por isso é que estão nessa zona de Th2) mas terem um factor de coestimulação muito baixo. Isto é, elas não só não produzem IL-12 como co-estimulam
pouco os linfócitos. Assim, este linfócito vai ficar anérgico, vai ficar como que um
linfócito supressor (um linfócito que não responde). Estas células Th3 seriam muito
próximas das Th2 e portanto não seria um terceiro grupo completamente distinto, um
grupo entre as Th1 e as Th2, mas antes um subgrupo emanado das Th2.
O que são afinal estes sinais que as células dendrídicas podem transmitir
aos linfócitos? São sinais que são de 3 tipos:
Sinais para estimulação do TCR, o que é evidente pois é uma
apresentação antigénica – a célula dendrídica tem de estimular o
linfócito através do TCR).
Sinais de co-estimulação (os sinais que são os pares dos ligantes que
se formam entre a célula apresentadora e o linfócito que permite a coestimulação que a célula realmente responda).
Sinais de polarização. O linfócito CD4 não vai polarizar inteiramente
pelo tal ambiente de citocinas, mas vai polarizar porque a célula
apresentadora (nomeadamente a célula dendrídica) lhe dá um terceiro
sinal que é o sinal de polarização.
Esses terceiros sinais serão a IL-12 (em grande quantidade dá Th1, em baixa
quantidade dá Th2 ou eventualmente Th3) mas também outras substâncias como a
prostaglandina E2 que consegue ser um modelador da IL-12, o próprio INFγ, o TGF β,
moléculas de actividade como o ICAM-1, pares de co-estimulação como o CD80/CD86
e também, curiosamente, a densidade e a afinidade do Ag. Isto é, algo que não
percebíamos, por exemplo, como é que um parasita nos conseguia comutar para Th1 ou
Th2 consoante o seu tipo de divisão.
Alguns parasitas como a Leishmania, que quando precisa de se reproduzir
comuta-nos para Th2. é um parasita que controla o nosso sistema imunitário, e, estando
comutado para Th2 ela pode se reproduzir porque já não tem citotoxicidade a ser
exercida sobre ela. Custava acreditar como é que um parasita conseguia produzir
citocinas para criar os tais ambientes próprios. Ora, se percebermos que este sinal 3 de
polarização pode ser a densidade e a afinidade dos Ags, é muito mais fácil nós
percebermos que, por exemplo a Leishmania pode aumentar ou reduzir a quantidade dos
seus Ags expostos, a própria afinidade desses Ags e com isso levar-nos a uma
polarização para uma área ou para outra. É fundamental percebermos que é através
destes mecanismos que se joga a nossa resposta imunitária e o sucesso ou insucesso da
nossa resposta imunitária.
Um macrófago (que é fundamental na defesa do nosso organismo) pode levar a
citotoxicidade e inflamação ou pelo contrário ser uma célula anti-inlamatória que tenta
para a resposta inflamatória. Este macrófago se for estimulado por um macrófago Th1
(através de INFγ) vai produzir IL-1, IL-2, IL-6, IL-12, TNF α, tudo citocinas próinflamatórias. Vai produzir óxido nítrico e certos reactivos de oxigénio que são
altamente citotóxicos, levando com isso à inflamação e a citotoxicidade. Se pelo
contrário este macrófago for influenciado pela tal célula supostamente Th3 (a tal célula
reguladora) produz TGF, IL-4, IL-10, IL-13. O macrófago vai produzir o antagonista do
receptor da IL-1, vai bloquear a IL-1. Vai produzir um receptor solúvel do TNF (vai
portanto bloquear o TNF). Vai produzir IL-10 que é anti-inflamatória e o resultado vai
ser anti-inflamação, vai ser uma paragem da inflamação. A mesma célula (supostamente
há alguns anos dita apenas uma célula fagocítica)para além da sua capacidade fagocítica
pode condicionar haver citotoxicidade e inflamação ou pelo contrário parar o processo
inflamatório.
Isto é vital num processo de defesa, para além de ser vital em doenças crónicas
como a doença de autoimunes (as doenças reumatismais em geral, em que o macrófago
continua a criar o processo inflamatório em que acabamos por ter uma lesão continuada
mesmo que não haja qualquer agressão).
A resposta imunitária funciona como uma arma explosiva, isto é, as citocinas
permitem que várias coisas (o stress, a infecção, o trauma, o cancro, a própria estrutura
nutricional em que suportamos a própria genética, todos estes mecanismos) em relação
ao sistema imunoinflamatório, sobretudo neste contexto das citocinas, podem levar a
disparos mais ou menos graves no sistema imunoinflamatório, condicionando doença,
mas também garantindo a nossa defesa contra agressões (pelas células inflamatórias,
pela citotoxicidade, etc).
Portanto, o mecanismo de resposta, uma vez tendo disparado, é extremamente
útil mas ao mesmo tempo pode ser extremamente destrutivo. Podemos ter a noção que o
sistema imunitário tenta destruir o agressor e não os nossos constituintes, mas não nos
podemos esquecer que o sistema imunitário está ligado à parte inflamatória e assim
agressão e defesa acabam por se poder confundir.
Neste contexto é fundamental que tenhamos sempre a noção que o sistema
imunoinflamatório é muito fácil de disparar (face a um Ag, face a qualquer coisa que
estimule a parte inflamatória) mas é muito difícil de parar. Aliás, algumas vezes, nem
o devemos parar porque ele está a responder contra uma bactéria e é fundamental que
ele realmente exista. Mas já não é fundamental que ele exista disparado desta forma
quando temos uma rinite, quando temos uma alergia em geral, quando temos
autoimunidade, quando temos uma doença reumatismal.
E o curioso de tudo isto, é que durante muitos anos, naquele conceito clássico de
que havia linfócitos helpers e os linfócitos supressores, acreditou-se que os linfócitos
CD8 seriam os linfócitos supressores, e que neste momento nos são apresentados como
linfócitos citotóxicos. Portanto, o grande dilema da imunologia, é continuar a procurar
os verdadeiros linfócitos supressores. Talvez esses linfócitos supressores sejam aquleas
células reguladoras (aquelas células Th3) mas é preciso provar que de facto elas sejqam
capazes de parar a resposta imunoinflamatória. Que a podem bloquear podem, porque
não respondem, agora se conseguem parar uma resposta já em curso, ainda há dúvidas
sobre isso.
Então o que é que consegue parar a resposta imunoinflamatória?
A apoptose (evidentemente que se as células estão mortas deixam de
existir, logo, pára a resposta).
O eixo neuroimunoendócrino (como vimos, o cortisol polariza para
Th2, e polarizando para Th2 bloqueiam a resposta do Th1).
As chamadas proteínas de fase aguda (porque temos proteínas que
podem, quando há um processo agudo (nomeadamente inflamatório),
originar uma resposta que bloqueia a resposta imunoinflamatória)
Mas particularmente o perfil de citocinas
É um perfil de citocinas (vimos há pouco aquele perfil polarizante das IL-12
para Th1 ou Th2) que permite a supressão da resposta imunoinflamatória. Isto é
importante para vermos que estes mecanismos supressores devem ser dimensionados
para uma acção local, porque não tem qualquer jeito que um mecanismo
imunosupressor se desse em todo o organismo quando o problema era um problema
numa articulação. Se o problema for no joelho, nós precisamos de uma imunosupressão
na articulação do joelho para que não continue aquele processo inflamatório, mas não
precisamos de diminuir a nossa inflamação em todo o nosso organismo. Este perfil de
citocinas adapta-se facilmente a uma acção local. Podemos ter no local próprio a
resposta imunitária de que precisamos e não em mais ponto nenhum.
Uma das propostas que nos foi feita em relação às citocinas (e já deixando um
pouco a parte imunitária para vermos aspectos globais) era a orientação celular. Isto é,
as citocinas funcionariam para chamar as células aos locais próprios. Começou-se
também a perceber que não era meramente as citocinas da IL-8 que era suficiente, tinha
que haver quimiocinas para a chamada das células e haver depois moléculas integradas
nas células do ambiente em que elas se iam colocar - as integrinas e também moléculas
que selectivamente permitissem a adesividade das células. Portando, há chamada e
orientação das células, integrá-las pelo meio e ainda seleccionar a adesividade dessas
células.
Este processo aparentemente muito simples, permitiu que soubéssemos por
exemplo que um linfócito T, para sair dos vasos para os tecidos necessita de selectinas
para se fixar ao endotélio dos vasos, precisa de citocinas como TNF para sair do vaso
para o exterior (para os tecidos) e precisa depois de uma informação de para onde ele
deve caminhar (sobretudo citocinas e quimiocinas). Tudo isto são os mecanismos para
que uma célula chegue a um determinado local. E isto são basicamente os mecanismos
que podemos tentar contrariar com a terapêutica.
O simples recrutamento de um monócito, que era permitido dizer-nos à meia
dúzia de anos atrás que o monócito é recrutado, o monócito margina – vai na corrente
sanguínea, encosta ao endotélio, sai e é activado em macrófagos, tão simplesmente
quanto isto. Neste momento isto não se pode dizer tão simplesmente. Porque para um
monócito ser recrutado e portanto ir para os tecidos e ser transformado em macrófago,
tem que haver um estímulo por parte da célula epitelial que iria estimular todos estes
pares de ligação (veja-se as citocinas que são produzidas). O monócito por sua vez tem
que exprimir todos os receptores de quimiocinas(CCR2, CCR5, CCR1, CCR8, CCR4,
CXCR4) e ao exprimir estas moléculas é que ele pode ser recrutado e ir para os tecidos.
Trata-se de uma complexidade molecular que pode parecer-nos desnecessário, mas
teremos que perceber que não haverá novas terapêuticas nem novos conhecimentos se
nós não soubermos como as coisas funcionam.
Também nos podemos aperceber que o monócito, ao ser recrutado por um
processo de estimulação biológica, se for CXCR4 ou atéCCR5 tem duas portas
fundamentais para que o vírus, em relação ao HIV, possa entrar na célula. O HIV utiliza
o CCR5 e o CXCR4 como portas de entrada. Uma célula ao ser activada propicia
automaticamente a possibilidade de um vírus entrar.
No processo inflamatório (com as suas citocinas e todo o processo da produção
de febre, de cortisol,, de tudo aquilo que acaba por ser uma resposta inflamatória),
habitualmente, o hepatócito acaba por ser estimulado, nomeadamenete por IL-6, IL-1 e
por CRM. O hepatócito ao ser estimulado, produz novas proteínas. E as proteínas que
basicamente ele produz de novo, são as chamadas proteínas de fase aguda (de fase
aguda, porque é um processo agudo, é um processo rápido de resposta biológica). As
proteínas de fase aguda são muitas, sendo a mais carismática a proteína C-reacticva.
Estas proteínas de fase aguda têm como missão, para além de outras, poder controlar a
própria resposta inflamatória.
Um processo inflamatório é muitas vezes aquilo que leva a aparecerem novos Ags no
nosso organismo. Imagine-se um tecido completamente são, por exemplo a nossa pele,
ao ser objecto de um processo inflamatório, há Ags próprios da pele que até então não
estavam expostos e que o passam a ser pelo processo inflamatório. Então, actualmente
temos noção que a resposta inflamatória leva frequentemente a apresentações
antigénicas e pode levar a autoimunidade. Portanto, pode levar a respostas contra o
nosso próprio organismo, precisamente porque o tecido inflamado acaba por expor Ags
que antes estavam ocultos (é assim uma forma de nos auto-agredirmos). Daí que a
resposta inflamatória seja fundamental mas ao mesmo tempo seja capaz de autoagresssão.
Imunologia
12ª aula
A nível celular, há necessidade de termos um determinado conjunto de
moléculas – as citocinas, as selectinas e as integrinas.
As quimiocinas são um subgrupo das citocinas. Todas elas são citocinas, mas há
um subgrupo (tal como há factores de crescimento, interleucina, etc...) que se chama as
quimiocinas. Não é nenhuma família extra, sendo apenas um subgrupo das citocinas.
Dentro do processo de recirculação celular que nos foi apresentado, um aspecto
que será difícil de encontrar, é a identificação de todos os órgãos que não sejam órgãos
linfoides como pertencentes ao sistema imunitário. Basicamente, foi-nos dito que
existiam órgãos linfoides, sendo eles primários e secundários (ou periféricos). Os
primários seriam o timo e a medula óssea. Os secundários seriam os gânglios, o baço,
etc... mas raramente o fígado nos é apresentado como um órgão linfoide. Isto porque,
recentemente, temos vindo a apercebermo-nos que os órgãos imunológicos não são
apenas os órgãos linfoides, mas que há outras estruturas (nomeadamente o fígado) que
também são órgãos imunológicos. Portanto, órgão imunológico não é o mesmo que
órgão linfoide. Há órgãos imunológicos que são não linfoides.
O que é que há de relevante a nível do fígado? Há os hepatócitos (célula
estrutural do fígado), há as células de Kupffer (que já nos foram apresentadas como
células parecidas com macrófagos) que podem ser consideradas “macrófagos”
residentes no fígado (células com capacidade fagocítica e com capacidade de
apresentação antigénica) e as células estreladas, menos conhecidas, que são muito
importantes como estrutura imunológica (neste caso o fígado).
Se efectivamente o fígado funciona como órgão imunológico, temos que
perceber qual é o objectivo deste tipo de activação
As células estreladas (também chamadas células de Hito) são células que têm
muita importância a nível hepático. Devemos saber que o fígado tem a capacidade de se
regenerar, ainda que não na totalidade, sendo por isso um órgão com capacidade
regenerativa e que depende dessas células de Hito (apesar das muitas designações as
mais vulgares são as de célula de Hito ou célula estrelada). A curiosidade subjacente, é
que contrariamente aquilo que se pensava, quem descobriu as células de Hito foi
Kupffer. São sobretudo células de suporte de crescimento parenquimatoso e são
fundamentais para que o fígado possa funcionar como órgão imunológico. Para além da
zona constitucional que o fígado tem (hepatócitos, células de Kupffer, células
estreladas) há outras células imunológicas (que se podem chamar migratórias) que
passam no fígado e que lhe dão a tal consistência imunitária no centro de activação
celular. Estas célula são particularmente macrófagos e neutrófilos (interferindo na
vertente inflamatória) os linfócitos CD8 e CD4 e células nacrópola: todas estas células
podem passar no fígado e inclusivamente residir no mesmo.
A célula de Kupffer é aquela que vai permitir ao fígado apresentar o Ag. Uma
vez que ela está no fígado, ela poderá apresentar Ags (é um macrófago residente). O
curioso é que desde muito cedo se pensou que ela seria uma célula fagocítica
(eventualmente apresentadora de Ags) mas pouco mais. No entanto, quando uma
bactéria invade, a célula de Kupffer é activada, começa a produzir uma série de
citocinas (IL1, IL6, INF, leucotrienos) sendo também uma célula citotóxica por ela
própria, mas mais importante que isso é que ela começa a mostrar moléculas e
adesividade. Essas moléculas de adesividade são particularmente o ICAM I, que é o
CD54 e o ICAM I que é o CD56.
O que vai acontecer é que, por exemplo, o neutrófilo (ou macrófago, linfócito)
que esteja a passar no sangue (é portanto uma zona sanguínea) encontra essas moléculas
de adesividade que vão prender essa molécula circulante. Esta célula é que vai depois
exercer, hipoteticamente, a acção sobre essa célula. A defesa imunológica que se passa
no fígado é uma defesa imunológica em dois passos, em que primeiro a célula de
Kupffer reconhece (ou é activada por) uma bactéria e num segundo passo em que a
célula de Kupffer consegue prender células imunológicas (células imunoinflamatórias),
que podem ser neutrófilos, macrófagos ou outro tipo de células, e ao prender estas
células imunoinflamatórias, são elas que vão exercer o seu papel de defesa, isto é, o seu
papel de resposta imunoinflamatória.
Obviamente, podemos perceber que o fígado, a cada passo da nossa vida, e
consoante aquilo que tenham sido as situações de agressão ou situações de homeosatsia
em que nos envolvemos, pode ter um pequeno volume de linfócitos, assim como pode
ter um volume enorme de linfócitos, dependendo sempre da activação das células de
Kupffer. Assim, verificou-se que talvez isto seja mais importante nos últimos anos em
relação à estrutura hepática, verificou-se por experiências de activação de linfócitos
CD8 (para que haja destruição de um Ac ou de uma bactéria é fundamental que haja
citotoxicidade), utilizando por exemplo albumina que pode promover estimulação
linfocitária (utilizando um soro fisiológico e tendo o fígado uma morfologia normal),
começa a haver um infiltrado linfocitário a nível do fígado, inclusive com destruição ou
lesão do fígado passados 3 dias.
O que é que isto representa? Representa que linfócitos activados (sobretudo
linfócitos CD8) vão entrara no fígado em grandes quantidades, e estes linfócitos perdem
as suas características quando entram no fígado. E estas células CD8 em particular (que
também podem ser CD4) entram em morte programada, isto é, em apoptose dentro do
fígado.
O fígado vai ser como que um reservatório (um “cemitério”) para todos os
linfócitos que tenham sido activados e programados para morte (uma vez que foram
activados), sendo o seu destino natural eles auto-destruírem-se. Daí que o fígado, muitas
vezes, seja um espectador que sofre com a activação linfocitária. Isto porque dá-se uma
activação linfocitária num outro órgão qualquer (na pele, numa mucosa) e esses
linfócitos que são activados a nível celular, vão ser captados pelo fígado e vão ser
destruídos pelo mesmo o fígado vai sofrer a agressão desses linfócitos (que até nem
queriam nada com o fígado) pois como ele é um órgão reservatório de linfócitos
apoptóticos, obviamente ele vai sofrer com a entrada destas células.
A percentagem de linfócitos que morrem por apoptose é mais elevada no fígado
do que nos outros órgãos. Ao morrerem no fígado, os linfócitos libertam as suas
enzimas destruindo o parênquima hepático.
Estes dados são muito importantes para percebermos como é que há lesões
hepáticas quando muitas vezes a patologia está num órgão mais distante. É uma
situação completamente estranha ao fígado.
É importante também salientar a necessidade de migração celular dos linfócitos
dos vasos para os tecidos. Neste tipo de migração, talvez aquilo que seja mais curioso é
o facto dum linfócito circulante ter características morfológicas bastante diferentes dum
linfócito quando vai para um tecido.
Quando está na circulação, o linfócito tem uma morfologia arredondada (mais
ou menos típica do linfócito), no entanto quando se dirige para o tecido, ele adquire a
forma de um peixe (com a particularidade dele se deslocar na direcção da cauda). Há
uma modificação clara do citoesqueleto, para permitir que o citoesqueleto possa aderir,
atravessar para o tecido, etc...
E as duas moléculas fundamentais para permitir a adesividade e essa
modificação do citoesqueleto, são os 2 receptores de quimiocinas: o TCR7 e o TCCR4.
Portanto, se estas moléculas (TCR7 e TCCR4)não se exprimirem, dificilmente o
linfócito poderá exprimir as suas funções de adesividade e de actuação num
determinado tecido.
Outro pormenor relativamente recente e curioso, é perceber-se como é que os
linfócitos podem sair dos vasos quando é necessário, mas em situação normal não
saírem dos vasos. Se tivermos um vaso sanguíneo, que é um endotélio, poderemos ter
uma situação de infecção em que é necessário que os linfócitos saiam dos vasos para os
tecidos, mas também outra situação, que porventura os alunos não conhecem, que é o
processo de aterosclerose.
A aterosclerose é uma patologia vascular que normalmente acarreta patologias
cardiovasculares. A aterosclerose foi durante anos apenas o resultado de uma exposição
lipídica, e bastava uma dieta moderada para que não houvesse esse problema.
Curiosamente, verificou-se que crianças com 2/3 anos tinham placas de ateroma, e não
se podia pensar que uma criança dessa idade tivesse excessos alimentares tão grandes
que levassem à formação de uma placa de ateroma. Daí repensar-se a aterogénese e
chegar-se à conclusão que um dos principais efectores é a resposta imunoinflamatória.
São os linfócitos e os macrófagos que vão invadir os vasos e formar aquelas placas
características de ateroma.
O que interessa percebermos nesta fase, é que normalmente num vaso normal, os
linfócitos encostam-se ao endotélio. O endotélio está muito rico numa substância que é
o FabL (o ligante do Fab) e todos os linfócitos que se liguem ao endotélio são mortos,
porque o FabL induz um sinal apoptótico no linfócito e o linfócito acaba por morrer.
Isto quer dizer que, os linfócitos que no seu fluxo normal, eventualmente encostem-se
ao endotélio, vão ser mortos pelo Fab ligante.
Contudo, se houver aterosclerose ou se houver infecção, há habitualmente a
produção de TNF (uma citocina), e ao haver produção de TNF deixa-se de exprimir o
FabL no endotélio. O FabL deixou de se exprimir a partir daí e o linfócito ao encostar
ao endotélio (quem diz linfócitos diz leucócitos em geral) já não vai encontrar um sinal
de morte, mas vai encontrar antes moléculas de adesividade que lhe permitem fixar-se
ao endotélio e depois sair para os tecidos ou para as estruturas do próprio vaso.
A grande diferença entre uma situação normal e uma situação de infecção ou de
aterosclerose, é exactamente a presença de TNF, neste caso que vai anular o FabL, ao
mesmo tempo que vai permitir a exposição de moléculas de adesividade no endotélio.
Dentro do panorama global de utilidade das citocinas, não se pode deixar de
falar numa área especialmente importante da nossa faculdade, porque estão a tentar
desenvolvê-la o máximo possível que é o do típico envelhecimento, particularmente
ligado a algumas áreas como a bioquímica, a imunologia, etc.
Nos idosos, embora a diferenciação hematopoiética seja normal, a única
diferença que os distingue, é que têm menos capacidade de resposta ao stress
hematológico. Por exemplo um jovem, numa intervenção cirúrgica ou se perder sangue
onde é particularmente grave, consegue fazer uma resposta hematológica capaz. O
idoso, num stress hematológico deste tipo, já não faz a resposta tão bem como um
jovem. Mas neste momento não existe problemas hematopoiéticos no idoso. O que
existe é, a nível do sistema imunitário, deficiências de alguns tipos de células,
nomeadamente os linfócitos T e também algumas células macrófagas (mas
particularmente os linfócitos T). O importante desta situação, é que a deficiência deste
linfócito T (e logicamente uma pior defesa contra infecção, neoplasias, etc...) não
depende praticamente da maturação ou hematogénese, mas parece-nos depender
especialmente da hiperprodução de algumas citocinas.
Isto é particularmente curioso, porque ao fim e ao cabo, num idoso, havendo
hiperprodução de citocinas, pensa-se que nesse idoso não deveria haver nenhuma falta
de defesa imunitária, pois até se formavam mais citocinas que num jovem, o que levaria
a pensar que ele estaria a fazer uma atitude compensatória. O facto é que a
hiperprodução destas citocinas vai condicionar uma deficiente activação dos linfócitos
T. Aliás, já vimos que algumas citocinas polarizam para Th1 e que outras polarizam
para Th2, inclusivamente a IL10 é característica de alergia celular, portanto, falta de
resposta celular. Será portanto principalmente a produção de IL10 que está na
dependência do idoso de uma pior activação dos seus linfócitos.
É ainda em relação aos idosos, ou em relação ao envelhecimento e
principalmente em relação à mortalidade do idoso, que surge uma característica
importante num estudo feito em vários idosos, todos com mais de 65 anos de idade, em
que foram vistos os principais elementos de factor risco de morte. E curiosamente, nesta
avaliação, aquilo que se encontrou que influenciava mais como risco de morte, não foi a
hipertensão, não foi o tabaco, não foi uma série de factores em que normalmente nos
apoiamos (embora sejam importantes e não se possa diminuir o seu valor ou risco de
mortalidade), mas foi o nível elevado de IL6 e o nível elevado de proteína C-reactiva.
Portanto, níveis elevados de uma citocina (IL6) causa um risco de morte elevado de
morte. Daí que em muitas circunstâncias seja muito mais importante mediarmos uma
IL6 (principalmente num idoso) para termos consciência do risco biológico que ele
corre, do que estarmos a atentar em coisas extremamente complexas e vastas.
Este é mais um aspecto curioso em relação às citocinas.
O outro processo que tem a ver com as citocinas, é a relação entre o sistema
neurológico e o sistema imunológico. Teríamos o sistema nervoso central, o sistema
imunitário e a homeostasia que geralmente existe entre estes 2 sistemas que se
comunicam.
O cérebro comunica com o sistema imunitário como os linfócitos comunicam
com o cérebro. Como o sistema imunitário comunica com o cérebro através de várias
moléculas, nomeadamente citocinas, hormonas, neuro-hormonas, etc, e também
substâncias mais banais como cálcio, sistema de activação intracelular, etc.
Mas basicamente, as citocinas são o elemento de ligação entre o cérebro e os
nossos linfócitos, isto é, entre o sistema imunitário e o sistema nervoso. Se esta
homeostasia se perder, nós podemos ter patologia – doenças autoimunes, doenças
infecciosas, doenças neuroinformativas, isto é, doenças psicológicas derivadas da
homeosatsia entre o cérebro e o sistema imunitário e o sistema imunitário com o
cérebro.
Talvez o mais conhecido seja o stress no eixo neuroimunoendócrino. No fundo,
o stress (particularmente o medo ou um susto) leva a uma produção alterada de
neuropeptídeos, que desde o hipotálamo, à pituitária, à suprarenal vão dar toda uma
modificação da fase de produção hormonal, produção hormonal essa que se associa à
produção de citocinas e que indica uma maturação linfocitária T e B modificada, uma
polimerização Th1, Th2 e eventualmente Th3 também, assim como uma lesão dos
tecidos com dificuldade de reparação dos mesmos.
Há coisas curiosas como algumas experiências naturais. Por exemplo, se num
acidente cortarmos a inervação das glândulas submandibulares, qualquer lesão da
orofaringe leva cerca de 10 a 20 vezes mais tempo a cicatrizar.
Isso deve-se exactamente ao facto de que as glândulas submandibulares
conseguem produzir citocinas, factores de crescimento fundamentais para a reparação
epitelial. Quando se perde influência neurológica, nomeadamente neuropeptídeos, ele
deixa de fabricar o factor de crescimento epitelial. Assim, a ferida demora muito mais
tempo a cicatrizar.
Por outro lado, a maturação dos linfócitos é um factor que acontece
principalmente quando se é jovem, e é um facto que vai ditar a nossa capacidade
imunitária durante anos. Isto é, os linfócitos que possam amadurecer hoje, vão viver no
nosso organismo cerca de 30 ou mais anos. Nós devemos ficar com a ideia de que em
stress, apenas há um aspecto pontual, pois todos os linfócitos amadurecidos
incorrectamente sob esta situação de stress podem permanecer lá durante 20 ou 30 anos.
Isto pode ditar que durante 20/30 anos, a pessoa tenha incapacidade de resposta
imunitária. Logicamente que o stress deveria o mais possível ser evitado.
Interessa mais a forma como a pessoa consegue lidar com o stress do que o
stress e si. Se nós conseguimos desmontar o stress (pois cada pessoa tem a sua forma de
desmontar o stress, ) conseguiremos estar mais ou menos efectivos sob o ponto de vista
imunitário.
É de salientar a relação entre a IL6 e as técnicas de Kochus que são as técnicas
de lidar com o stress e de o desmontar. Como vimos, a IL6 era um dos principais
factores de morte nos idosos, sendo curiosa a ligação entre a IL6 e a forma de lidar com
o stress.
Outro aspecto importante que foi durante anos ignorado, foi o acto cirúrgico.
Nas populações mais rurais, mais simples, conserva-se ainda alguma da sabedoria
clássica. Falando com essas pessoas, e havendo por exemplo uma neoplasia, a pessoa
fez um intervenção cirúrgica e foi terrível, ficou muito pior (isto sobretudo com cancros
em situação terminal). A ideia que uma cirurgia não pode ser feita quando há uma
infecção decorre num facto que não se sabia mas que agora é uma realidade.
É que a cirurgia, com lesão dos tecidos, com a anestesia que geralmente está
associada, e particularmente o stress, pode levar a uma resposta imunoinflamatória
(nomeadamente através das citocinas) correcta que leva á reparação dos tecidos e à cura
dos tecidos, como pode levar a uma resposta imunoinflamatória incorrecta que propicia
infecção e a respectiva infecção dos tumores. Isto é ditado pelas citocinas e
particularmente pelo stress.
Diversos indivíduos foram investigados antes de fazerem a sua intervenção
cirúrgica, antes também de entrarem no bloco operatório, uma dia, dois dias e três dias
depois. Curiosamente, quando eles souberam que amanhã iam fazer essa cirurgia,
baixaram brutalmente os níveis dos parâmetros imunológicos. Há uma imunodepressão
causada pelo stress ao saberem que iam ser operados no dia seguinte. Durante a entrada
e a saída não houve grandes alterações, havendo aumento da IL6 e depois do bloco
operatório há pessoas a responderem de modos muito diferentes: há quem apresente um
pico enorme de IL6, tendo feito infecções graves, paralelamente a outras pessoas que
mantiveram níveis razoáveis de IL6.
O stress é assim um dos principais inimigos do sistema imunitário, e ao fim e ao
cabo, da nossa capacidade de defesa.
Mas mesmo nas coisas mais simples, e se agora retirarmos todos aqueles filtros
do sistema imunitário, diferenciação de linfócitos, etc, e virmos aquilo que nos pode
acontecer num dia chuvoso se tivermos uma queda. O traumatismo (lesão) das células
epiteliais é suficiente para se libertarem citocinas. E estas citocinas (IL1, IL6, TNF,
quimiocinas) podem por si só recrutar macrófagos, neutrófilos, linfócitos, e levar a uma
infecção antigénio-independente. Isto porque aqui não há Ag, há uma lesão das células
do tecido endotelial que leva á libertação de citocinas.
Mas aquilo que poderia parecer muito simples, que era a célula endotelial ser
agredida, inicia todo o seu processo de recuperação e defesa. Assim, não devemos ficar
com a ideia de que foi lesada e não consegue recuperar. Numa balança em que temos
dum lado a agressão e do outro a protecção das células endoteliais, numa situação de
apoptose elas vão activar uma resposta inflamatória.
Num traumatismo pode haver uma situação chamada pró-inflamatória, prócoagulante, que seria por exemplo a produção de TNF ou IL1, e esta balança começa a
desequilibrar-se. Isto é, a célula endotelial é agredida.
Contudo, habitualmente a célula endotelial consegue superproteger-se. Ela
responde à agressão através de uma série de expressões genéticas de protecção,
equilibrando a balança, e assim, já não teríamos inflamação mas antes uma resposta
correcta e equilibrada.
Mas se a agressão é demasiado forte, já não há equilíbrio possível na célula
endotelial. Vamos ter os mesmos agressores só que em maiores quantidades, a célula
entra em apoptose, produz citocinas, produz moléculas de adesividade e entramos numa
resposta inflamatória habitualmente local mas também sistémica porque a célula
endotelial já não conseguiu mais equilibrar mais o que aconteceu.
Portanto, em muitas situações do dia-a-dia, nós conseguimos equilibrar as
inflamações.
O TNF é uma citocina da qual precisamos (pois sem ela não vivemos) para
destruir bactérias e outros microorganismos, mas que ao mesmo tempo nos agride. É um
TNF que leva á destruição das nossas células endoteliais, com as células que ele agride.
Temos assim uma dicotomia acção/agressão associada à alta produção de TNF. O TNF
é a mesma molécula mas com os dois tipos de actuação.
Apesar de tudo o que nos foi dito, e apesar da IL6 nos ter sido apresentada como
uma citocina particularmente perigosa (a IL6 pode condicionar morte no idoso, pode
também actuar como pró-inflamatória, etc), segundo alguns autores, a IL6 embora possa
estar relacionada com esses factos, é das poucas que também consegue bloquear (a par
da resposta do sistema nervoso central e dar uma resposta preparada ao sistema
imunitário) a produção de IL1 e de TNF.
Então, a IL6 poderá também ser um dos mecanismos para prepararmos a
resposta imunoinflamatória. Tem também influência a par com o CNS porque deixa de
haver resposta imunitária, bloqueando o TNF e a IL1, levando ainda no fígado, à
produção das proteínas da resposta inflamatória (em que a mais característica será a
proteína C-reactiva, proteína C-reactiva essa que também pode bloquear a acção dos
macrófagos). Isto faz com que a IL6 seja uma proteína muito importante.
Todo este equilíbrio imunitário depende de uma série de circunstâncias, e se
formos ver num conceito mais globalista, e deixarmos de pensar nas pequenas
moléculas (citocinas, linfócitos Th1, Th2, B, etc), se os virmos mais como um todo, o
desenvolvimento imunitário dá-se particularmente na vida intra-uterina (onde
adquirimos memória imunitária). Mas é particularmente após o nascimento que nós
vamos ter tempo e oportunidade para tornar o nosso sistema imunitário confiante. E
para esse sistema imunitário se tornar confiante, é fundamental que haja: infecções,
contacto com o meio ambiente, alimentação entérica e flora comensal.
Portanto, muitas das coisas que vemos habitualmente em publicidade de vários
tipos, são sobretudo imagens extremamente enganosas que vão destruir aquilo que é
fundamental para termos um sistema imunitário vigilante. Da mesma forma que não se
deveria fazer publicidade para não ir à escola, a não aprender, também não se deveria
fazer publicidade a muitas coisas que são erros imunológicos. Por exemplo, a
publicidade a detergentes, sabonetes, a produtos que realmente fazem a assepsia da pele
– se tivermos a nossa pele asséptica morremos.
Quantos de nós não temos alergias cutâneas nesse momento? Por exemplo
em relação à alimentação entérica, cada vez mais são elaborados produtos
completamente assépticos, em que o açúcar foi abulido, e que enfraquecem o nosso
sistema imunitário.
O contacto com o meio ambiente também existe cada vez menos. A maioria dos
edifícios que tem uma circulação central de ar está completamente vedada por filtros em
relação ao exterior.
Nós somos responsáveis por evitar que aquilo que aconteceu durante anos, e que
felizmente está a retroceder, que era que à mínima suposição de infecção, se davam
antibióticos. Isto levou a que a infecção praticamente deixasse de existir levando a
situações dramáticas quer de alergia, quer de autoimunidade.
Assim, para termos um sistema imunitária funcional, é necessário haver estimulação do
mesmo.
Imunologia
13ª aula
O sistema imunitário tem diversidade e essa diversidade depende da plasticidade
de alguns receptores em relação ao Ag, nomeadamente dos linfócitos T e dos B. O TCR
tem uma grande variedade, e o BCR (as Igs ) dos linfócitos B tem também uma grande
diversidade.
Nós temos que pensar que para haver resposta celular, tem que haver activação
destes linfócitos, e essa activação tem que ser percebida.. Isto é, nós temos que ter
capacidade para ver se num doente ou num indivíduo normal os linfócitos activaram ou
não activaram.
Então, há alguma hipótese de saber se o linfócito é ainda um linfócito naive ou
se é um linfócito efector. Uma forma de o fazer é saber se realmente ainda há
necessidade de um sinal co-estimulatório ou não – o linfócito efector já não necessita
desse sinal de activação. Isto é, se tivermos um linfócito já efector, basta estimulá-lo
com Ag (através do BCR) para que ele responda. Se ele for um linfócito naive já não
basta apenas a estimulação pelo Ag, é necessário haver o par co-estimulatório.
Outra forma utilizada em laboratório para saber se um linfócito é naive ou
efector é através do CD45. O CD45 tem uma expressão polimorfa, plástica (que se
modifica) e que ao exprimir a variante CD45RA dizemos que é um linfócito T naive. Se
pelo contrário ele exprimir a variante CD45R0, dizemos que é um linfócito T efector,
um linfócito T activado.
Depois, também há a expressão das moléculas de adesividade que modifica.
Num linfócito efector há uma alta expressão de CD2 que é o LFA-1 (Leucocite
Function Antigene-1) enquanto que no linfócito naive há uma baixa expressão de LFA1.
Também já nos foi dito que a L-selectina exprimia de modo diferente. A Lselectina tem uma expressão alta no linfócito naive e tem uma expressão baixa no
linfócito efector.
O perfil de circulação destas moléculas também é variável, em que os linfócitos
naive vão para os órgãos linfoides secundários, no sentido de reconhecer Ags, enquanto
que os linfócitos efectores vão principalmente para locais onde haja resposta
imunoinflamatória, para os tecidos em geral e também para os órgãos linfoides ditos
terciários.
Outro aspecto é, para além de distinguirmos se é um linfócito naive ou se é um
linfócito efector (activado), nós podermos também tentar perceber que os linfócitos
efectores produzem moléculas diferentes consoante o seu subtipo. Um linfócito
citotóxico (CTL), habitualmente o CD8, produz quantidades enormes de citotoxinas
(perforinas e granzinas). Também têm capacidade de induzir a morte celular por
apoptose (em ligação ao Fás). Pode ainda produzir interferão γ e factor de necrose
tumoral.
Os linfócitos Th1 e Th2 podem distinguir-se nas citocinas que produzem: o INFγ é produzido pelos Th1 (aliás parecido ao que acontece com os CD8) enquanto os Th2
produzem particularmente IL-4,5,10 e 13. A capacidade que estas células têm de se ligar
a estruturas da membrana celular é também diferente pois o Th2 necessita de ligando
CD46, enquanto que o Th1 pode actuar através da via de factor de necrose tumoral.
Portanto, o Th2 não tem capacidade de produzir morte celular, não se consegue
ligar ao Fás nem ao receptor de TNF. O que nós podemos ter na resposta inflamatória
final, é ter citotoxicidade que é fundamental na maioria das defesas biológicas (contra
agressores biológicos: vírus. bactérias, etc). Essa citotoxicidade depende dos linfócitos
T em particular, quer dos CD8, quer dos CD4 Th1. A citotoxicidade confina-se
basicamente a este tipo de células, embora haja uma terceira que é a célula “Natural
Killer” (NK).
Temos também um outro conjunto que não produz citotoxicidade habitualmente,
que são os linfócitos B e os Acs (podem efectuar citotoxicidade mas é só em condições
especiais que depois veremos). E finalmente um conjunto de células inflamatórias que
potencializam (amplificam) a resposta imunoinflamatória.
A citotoxicidade é um passo fundamental para nos defendermos por exemplo de
uma bactéria ou de um vírus.
Como é que se pode induzir citotoxicidade? Temos 2 possibilidades de induzir
citotoxicidade:
-
-
-
numa via, temos a membrana da célula que é agredida. Se a célula
produzir grânulos que tenham granzina e perforina, a perforina faz um
poro na membrana da célula alvo e as granzinas entram no alvo. As
granzinas vão actuar nas caspazes, na cascata da apoptose e portanto
levar a morte celular por apoptose, pois ao fazerem-se estes poros, a
membrana passa da sua permeabilidade e impermeabilidade habitual, a
uma situação de instabilidade de impermeabilidade. E essa
instabilidade permite a entrada de líquido e a célula acaba por rebentar
por mero desequilíbrio osmótico dentro da célula;
outra via diferente (2ª via), é actuar no receptor, no Fás. O fás actua no
receptor que existe na célula alvo e a partir deste momento, este
receptor induz uma activação das caspazes, dá-se uma sinalização
intracelular na célula alvo que leva a morte por apoptose. Estas seriam
as duas vias fundamentais;
haverá ainda uma terceira via, que é a via de TNF. O TNF tem
receptores, o R1 e o R2, e esses receptores do TNF levam também à
activação das caspazes e portanto à apoptose.
Temos assim a via dos grânulos de perforinas e de granzinas, temos a via do Fás
e temos a via do TNF e do respectivo receptor.
Mas a acção citotóxica que se pretende que tenha a resposta imunoinflamatória,
sendo a mais importante por ser a mais específica, seja a dos CTLs (habitualmente
equivalente a CD8).
Numa infecção por vírus o que acontece muito rapidamente é a produção de
citocinas, de INF-α e de INF-β (numa produção rápida de citocinas). Esta produção
rápida de citocinas é desempenhada por uma resposta muito rápida de células NK e só
muito mais tarde é que uma resposta por linfócitos CD8.
Embora esta resposta seja específica e esta das células NK não ser específica
(estamos a falar de respostas) em ambos os casos produzem citotoxicidade. Nós
queríamos libertar-nos desse vírus, e é evidente que as células NK responderam muito
mais rapidamente (embora não de forma específica) e tendo acção citotóxica elas podem
ter muito valor contra o vírus.
As células NK (que não têm especificidade, não têm receptor para o Ag) têm
uma curiosidade. É que elas conseguem conhecer as células do nosso organismo.
Portanto, a célula NK, habitualmente não agride as células do nosso organismo e só irá
agredir estruturas que não sejam do mesmo ou que sejam modificadas no nosso
organismo.
Isto acontece porque como a célula NK tem citotoxicidade (matar as células), ela
precisa de ser sinalizada por um ligando que esteja numa célula infectada por um vírus,
mas é imprescindível que essa célula não esteja a exprimir MHC da classe I. Se a célula
estiver a exprimir MHC da classe I, ela irá ter sinalização para o receptor da célula NK.
Só que havendo MHC da classe I expresso (o MHC da classe I existe em todas as
células nucleadas no nosso organismo) ele vai actuar num receptor que se chama o KIR
(Killing Inibitor Receptor), um receptor inibidor de morte que diz ao NK para não
destruir essas células. Portanto, se houver MHC da classe I, ele é reconhecido pelo KIR
(ou se quisermos, pelo CD94) e portanto o NK é sinalizado para não produzir
citotoxicidade.
Assim, conseguimos habitualmente preservar o nosso organismo das NK.
Contudo, se uma infecção com vírus levar a uma diminuição do MHC da classe I (e
frequentemente os vírus fazem isso) essa células fica completamente exposta à acção
das células NK e portanto a conseguir destruir por citotoxicidade. A NK tem assim 2
tipos de receptor: um receptor de estimulação e um receptor de inibição – o KIR – que
bloqueia no caso de haver expressão do MHC da classe I.
Voltando à diversidade, falamos bastante de linfócitos T e vamos falar agora um
pouco mais de linfócitos B e de Acs.
Os Acs ligam-se aos Ags e por isso mesmo têm intervenção na resposta
imunitária. Os Acs e as Igs nos aspectos funcionais que já nos foram propostos,
promovem:
-
neutralização dos Ags
activação do complemento
sinalização e adesividade celular
imunomodelação
mas destes aspectos funcionais, há dois dos quais ainda não falamos:
-
a opsonização por ligação ao Fc
e a citotoxicidade (ADCC – citotoxicidade celular dependente de Acs)
Embora os linfócitos B e os Acs não estejam vocacionados para citotoxicidade,
os Acs também podem levar a citotoxicidade.
E como é que podem levar a citotoxicidade? sobretudo através de ADCC.
Imaginemos uma célula alvo, célula essa que teria Ags na sua superfície (que poderiam
ser vírus, bactérias), houve uma resposta por Acs que foi dada especificamente pelo Fab
a esse Ag de superfície pela célula alvo. E como há receptores para o Fc (o macrófago,
o neutrófilo, o eosinófilo, as células NK têm receptores para o Fc), o Ac faz uma ponte
entre a célula alvo e uma dessas células, e como qualquer uma dessas células é
citotóxica, vão produzir a morte por citotoxicidade da célula alvo. O Ac pode ter como
função reconhecer especificamente o Ag que havia à superfície da célula alvo e fazer
uma ponte ligação entre a célula alvo e uma dessas células citotóxicas. A isso chama-se:
citotoxicidade celular dependente de Acs – ADCC.
Ao fim e ao cabo, é um processo semelhante à opsonização. O receptor de Fc, a
base principal daquela citotoxicidade, também existe noutras células, nomeadamente em
plaquetas, em mastócitos e em basófilos, em que se o Ac se ligar pelo Fc a uma
plaqueta, a um mastócito ou a um basófilo, não vai acontecer citotoxicidade, mas vai
acontecer a desgranulação (libertação) de substâncias químicas através destas células
que não vão levar a citotoxicidade, mas que vão levar a outras manifestações como seja
por exemplo ao aumento da permeabilidade vascular, edema (saída de líquido do
compartimento vascular para o extravascular) ou por exemplo a uma situação de
broncoconstrição característica da asma.
Portanto, não só os Acs, pelo Fc, podem levar a citotoxicidade, como podem
levar a outras manifestações como seja células também utilizadas pelo Fc que não têm
nada a ver com citotoxicidade, nomeadamente contracção do músculo liso (como é o
caso do brônquio) ou aumento da permeabilidade vascular (como é o caso do edema).
Todo isto mostra no fundo o grande domínio das propriedades biológicas das
Igs. Já vimos que elas podem produzir citotoxicidade, podem ligar-se a outras células,
com o intuito de produzir aumento de permeabilidade vascular ou por exemplo
contracção do músculo liso.
Mas há outras funções que não podemos esquecer. Uma dessas funções, é que
algumas das classes ou subclasses das Igs activam o sistema do complemento. A IgG
em geral activa o complemento, à excepção da IgG4 (que não activa o complemento).
As outras classes não activam o complemento à excepção da IgM que activa fortemente
o complemento. De todas as classes de Igs, a IgM é a que activa mais fortemente o
complemento, depois a IgG3 e depois a IgG. As outras não conseguem praticamente
activar o complemento.
Mas se quisermos perceber porque é que um recém-nascido tem só IgG e não
tem as outras Igs, temos que ter em atenção que a IgG é a única que tem capacidade
para atravessar a barreira placentária. Se por exemplo precisarmos de um Ac a nível de
uma mucosa, os únicos Acs que conseguem fazer o transporte nas mucosas, são as IgA
e um pouco a IgM. Na mucosa (quer seja dum brônquio, quer seja do aparelho
digestivo) nós vamos apenas encontrar IgA ou algumas quantidades de IgM. Por
exemplo para desgranular o mastócito característico duma resposta alérgica, vamos ter
necessidade de IgE pois não pode ser nenhuma das outras 4 Igs.
O complemento é um conjunto complexo proteico, que tem muitas proteínas
(embora tenha basicamente 9 proteínas, mas ele tem muito mais que as proteínas
reguladoras). O complemento é um complexo enzimático e proteico que tem a
capacidade de se activar.
A activação do complemento pode ser aquilo que se chama a via clássica, que é
uma via que depende da reacção entre Ags e Acs, mas que depende de IgG ou de IgM
para ser activado.
Tem uma via alternativa particularmente por superfícies microbianas,
substâncias da membrana microbiana que começa em C3. E tem uma outra via (segundo
o Kuby embora não seja considerada por alguns autores), que é a via das lectinas que
também são substâncias da membrana microbiana (da parede microbiana) que iam
activar o complemento na fracção C4.
Temos a via clássica C1 (através de Acs), via alternativa C3 (através de
substâncias particularmente da superfície microbiana - a via alternativa é sobretudo
conhecida pelas mordeduras dos ofídios, portanto, o veneno de cobra causa uma
activação do complemento por via alternativa), e a via das lectinas que activa o
complemento pela região c4.
Basicamente, esta 3ª via não é tão considerada como as outras.
O que interessa mais na parte imunológica é a via clássica porque estão
envolvidos os Acs (IgG ou IgM), portanto, respostas de Acs a Ags, e a partir daí a
resposta imunitária segue-se pela activação do complemento. Mas também a via
alternativa pode ter a ver com Acs, não com Acs ligados a Ags, mas é com Acs
agregados. Isto é, conjuntos de Acs que não têm nada a ver com Ags, mas o Ac agrega e
ao agregar activa o complemento via alternativa.
Desta activação interessa que se gerem actividades enzimáticas, por exemplo a
C3 –convertase é uma actividade enzimática que vai actuar sobre as fracções seguintes,
fragmentando-as, e com isso começarem a fazer-se fragmentos, por exemplo o C3.
O c3 passa a ter 2 fragmentos – o C3a e o C3b. É uma actividade enzimática
progressiva que vai levar a uma fragmentação do componente do complemento e com
isso há o aparecimento de actividade funcional do complemento. Exemplificando, a
acção dos mastócitos pode dar-se por se terem formado os fragmentos C3a e C5a. O
C3a dependente da fragmentação de C3 e C5a dependente da fragmentação de C5. o
que acontece é que havendo receptores para o C3a e para o C5a no mastócito, quando
estes fragmentos são produzidos, o mastócito que está nos tecidos é activado,
desgranula, liberta mediadores inflamatórios (como por exemplo a histamina), isto leva
à contracção das células endoteliais (com aumento da permeabilidade vascular), leva à
contracção do músculo liso, com alterações do fluxo sanguíneo (aumento desse fluxo),
leva por exemplo ao edema referido há pouco, pode levar à contracção do brônquio
(característico no episódio de asma), tudo isto por activação de C3 e C5, e libertação
dos fragmentos C3a e C5a.
Para além daquilo que já vimos, o fragmento C5a tem a capacidade para chamar
macrófagos e neutrófilos, faz aquilo que se chama uma quimiotaxia.
Imunopatologia:
- imunodeficiencias (ex: SIDA)
- autoimunidade
- hipersensibilidades
Imunologia
14ª aula
A autoimunidade é outro tipo de patologia que é fundamental falarmos. Ela
abrange um grande leque de patologias, algumas delas graves, outras delas não tão
graves mas extremamente importantes sob o ponto de vista social e moral (pois
implicam deficiências ou incapacidades físicas que dificultam o decorrer de uma vida
normal).
A artrite reumatoide é outro exemplo que é das nossas mais conhecidas. Há
ainda a colite ulcerosa que é uma situação menos conhecida mas que cada vez se
encontra mais, que cria problemas que obrigam a que a pessoa tenha uma alimentação
própria para além dos cuidados medicamentosos especiais. Temos ainda a diabetes (na
sua forma adulta) em que há lesão das células que produzem insulina, lesão essa
provocada por Acs e macrófagos.
Uma situação vulgar, é aquela em que se verifica um tom avermelhado da
epiderme (rubor), e que sob o ponto e vista de exame histológico, evidencia uma bolha
subepidérmica em que se vê claramente a entrada de linfócitos, Acs, etc.
Há uma imunofluorescência (visto nas aulas práticas de imunologia em que se
consegue ver auto-Acs contra a membrana basal das mucosas. Portanto, havendo autoAcs que se dirijam contra as estruturas do nosso organismo (neste caso as membranas
basais) em que acabamos por ter as tais bolhas produzidas pelo sistema
imunoinflamatório característico da pele e das mucosas.
Um outro grupo de patologia são as hipersensibilidades. Este é um grupo mais
heterogéneo que os outros (apesar de na aut0imunidade haver a autoimunidade
específica de órgãos e anão específica de órgãos, mas a hipersensibilidade tem mais
grupos).
As hipersensibilidades definem como ocorre resposta adaptativa ao Ag, mas
inapropriada ou exagerada. A hipersensibilidade não é como a autoimunidade em que
há um erro de resposta. Na autoimunidade nós reagimos contra nós próprios, há um erro
na resposta (não tem lógica nenhuma nós agredirmo-nos a nós próprios). Na
hipersensibilidade há uma resposta imunitária em tudo semelhante ao resto (há portanto
uma resposta adaptativa, em que nós estamos a tentar adaptar-nos ao meio – as
agressões que sofremos) mas que ao ser inapropriada ou exagerada acaba por dar
patologia.
Os tipos básicos de hipersensibilidades são classificados com números romanos
(inclui o I, II, III e IV). Há ainda quem acrescente um 5º tipo de hipersensibilidade.
Também há quem as classifique por mediadas por Acs (que será o grupo I, II e III) e as
mediadas por linfócitos T e por macrófagos (que será o grupo IV). Há ainda quem as
classifique como imediatas (I, II ou III) e a retardada seria a IV (para além destas
designações há ainda quem acrescente na III a designação de semi-retardada).
Tipos
I
II
III
imediatas
mediadas por Acs
semi-retardadas
IV
retardada
Evidentemente, classificações de imediata e de retardada tem a ver com o tempo em que
elas aparecem. Há hipersensibilidades que podem aparecer passados horas ou minutos e
há outras que podem surgir passad9os dias (em que a hipersensibilidade será assim
imediata, retardada ou semi-retardada).
Quando falamos de mediadas por Acs e de mediadas por linfócitos T e
macrófagos, elas são-nos por demais evidentes, sendo esta vclassificação genérica,
académica, mas que é a mais eficiente (tipo I, II, III e IV).
A infecção celular tipo I é a que dá reacção alérgica, como por exemplo a febre
dos fenos (que é uma das alergias mais graves por exemplo a pólens – quando temos
por exemplo uma rinite, etc) esta é uma situação mais grave (febre dos fenos) que
acontece na mucosa nasal.
Vamos portanto ter um alergeno (nesta caso ligado ao feno)que vai estimular a
IgE (vai ligar-se à IgE que está fixa sobre o mastócito, no pólen. Os mastócitos vão
desgranular. Desgranulando, vão levar á ‘produção de aminas vasoactivas, originando
resposta inflamatória, aumento da permeabilidade vascular, aumento do fluxo
sanguíneo. Obviamente, o aumento da permeabilidade vascular leva à perda de líquido
da componente vascular para os tecidos. Os mastócitos podem também produzir outras
substâncias, os leucotrienos e as prostaglandinas, que levam a uma reacção mais
retardada. Isto é, há um fenómeno imediato característico dessa reacção alérgica
(hipersensibilidade tipo I) mas pode haver outros fenómenos mais tardios para outras
vias de activação celular (neste caso o mastócito a produzir leucotrienos e
prostaglandinas).
Apesar de ser uma reacção mais retardada, é uma reacção que não demora dias
como outras hipersensibilidades.
Na hipersensibilidade do tipo II (na do tipo I, caracteristicamente havia
mediação por IgE) há fenómenos completamente diferentes. Isto é, a hipersensibilidade
do tipo II está muitas vezes ligada a fenómenos de autoimunidade (não tem nada a ver
com fenómenos de alergia, tem a ver com fenómenos de autoimunidade).
Vejamos por exemplo o caso da Miestenia gravis. A Miestenia gravis é uma
situação em que a força do músculo (estriado, voluntário) começa a diminuir
progressivamente. São indivíduos que acabam por ter dificuldade corporal enorme por
falta de tónus nos músculos em geral. São casos que têm início muito simples, como por
exemplo uma pálpebra que cai (o tónus muscular palpebral foi diminuindo até que não
há força suficiente para que o músculo palpebral se mantenha em cima. São
fenómmenos deste tipo mas acabam por surgir doenças sucesivamente mais graves
como é o caso das miestenias, em que concretamente o que se passa é um bloqueio da
transmissão neuromuscular.numa placa motora vai haver receptores para a acetilcolina
(a acetilcolina é um mediador de transmissão neutromuscular) que são Ags. Nós vamos
produzir Acs contra os receptores da acetilcolina. Portanto, ao produzirmos Acs contra
os receptores da acetilcolina, nós vamos bloquear os receptores. Bloqueando o receptor,
a acetilcolina não pode chegar lá e não pode levar à contracção do músculo.
Logicamente que esta transmissão neuromuscular perde-se e há uma situação de não
resposta muscular (a pálpebra que cai e não se consegue abrir). Mais tarde há perda do
tónus muscular em que o músculo não é estimulado e acaba por perder a sua vitalidade
(há uma perda progressiva de força muscular).
Há ainda a hipersensibilidade do tipo III e que também não é mediada por IgE,
sendo mediada por outros Acs. Também a hipersensibilidade do tipo III pode associarse a lesões autoimunes. Não tem que ser forçosamente lesões autoimunes (há que
entender que apesar de distintas, a autoimunidade e a hipersensibilidade podem ter uma
relação íntima entre as 2 coisas, não têm forçosamente que ser dissociadas).
Vejamos uma perturbação do rim, concretamente numa situação de
glomerulonefrite, em que vamos estar atentos ao endotélio glomerular do rim (a zona
onde se dá a filtração). O glomérulo funciona como um endotélio (com capilares). O
sangue que passa no endotélio vai ser filtrado para que as substâncias que nos interessa
eliminar saiam por esse endotélio e vão depois para o compartimento urinário.
O que acontece, é que se houver Ags e a esses Ags couber a resposta por Acs,
formam-se complexos que nós chamamos de imunocomplexos (em que havia Ags que
levaram à formação de Acs (contra esses Ags) e a esses complexo Ags + Acs chamamos
imunocomplexo).
Esses imunocomplexos (Ics) andam a circular no sangue e são extremamente
lesivos para os endotélios. Os Ics são agressivos mecanicamente, isto é, os Ics aparecem
como uns alfinetes (em que os Acs é que são os alfinetes) – imaginemos um ouriço com
os picos voltados para o exterior. Os Ics ao circularem no endotélio acabam por estar
permanentemente a lesá-lo, porque como que pica o endotélio. Não pica o endotélio
mas é uma estrutura agressiva para o endotélio. Ao acontecer isto, os Ics
(especificamente os Acs) fixam-se sobre os endotélios e acabam por agredi-los. Mas se
isso não bastasse, o que vai acontecer ainda, é que os macrófagos são activados (os Ics
servem como um elemento de captação dos macrófagos) e vão fagocitar esses Ics,
logicamente produzindo enzimas, que vão lesar a membrana basal do glomérulo renal.
Ora, lesando o endotélio, lesando a membrana basal, aquilo que até aí era um filtro que
permitia a saída das substâncias que não nos interessam mantendo as outras, acaba por
ficar destruído (o tal filtro). Em vez dum filtro passamos a ter uma peneira, isto é, sai
tudo o que sejam componentes essenciais ao nosso sangue. A partir daí, nós temos uma
lesão renal em que há perda proteica importante na urina, e que obviamente nos causa
graves problemas de saúde.
Curiosamente esses Ics depositam-se em zonas em que haja alta pressão de
filtração ou de turbulência. Como o glomérulo é uma estrutura em que os vasos
sanguíneos não são rectilíneos, mas são emaranhados, há uma pressão aumentada e há
uma turbulência que faz com que esses Ics se depositem facilmente e daí este tipo de
problemas.
Finalmente, temos a hipersensibilidade do tipo IV (a tal retardada) embora
muitas vezes nos seja apresentada como o fenómeno de “Corpe”(?), todos aqueles que
fizeram a prova tuberculinica têm um bom exemplo de hipersensibilidade retardada.
Faz-se a prova tuberculínica, essa prova só pode ser lida passado algum tempo, e as
pessoas que dêem uma prova positiva apresentam como que uma pápula dura, vermelha
no local da prova tuberculínica. Este é um exempl muito comum.
Mas o que nos interessa talvez mais chamar à atenção é a chamada dermatite de
contacto. É uma forma de hipersensibilidade do tipo IV muito frequente a pessoas que
usem bijutarias que contenham níquel. Esse tipo de dermatite de contacto acontece
porque o níquel funciona como a tal estrutura que funciona como hapteno, isto é, como
um Ag que por si só não é imunogénico. O níquel é um Ag não imunogénico que
quando entra na pele vai ligar-se a proteínas da mesma e o níquel mais as proteínas da
pele são imunogénicas – torna-se portanto num conjunto imunogénico e vai dar-se, ao
nível da pele, uma resposta imunitária. Na pele vai haver células de Langerhans que são
células dendrídicas, células apresentadoras de Ags, e portanto essas células de
Langerhans exprimem MHC da classe II. Vão portanto apresentar o complexo
imunogénico níquel + proteínas da pele aos linfócitos T CD4 (uma vez que exprimem
MHC da classe II), que são linfócitos que existem nas estruturas ganglionares dos
gânglios linfáticos da pele, e a partir daqui gera-se uma resposta, não de Acs, mas uma
resposta celular que se caracteriza por uma resposta inflamatória intensa ( uma
inflamação dependente de Ags) com activação dos macrófagos, com libertação de
citocinas e obviamente com a formação de uma zona vermelha intensa que delimita o
objecto que a causou (seja pulseira, relógio, fio, etc... o objecto vai “marcar” a
inflamação). Todo este processo inflamatório é confinado à apresentação antigénica na
respectiva zona e não envolve as zonas adjacentes. Há uma chamada de linfócitos e de
macrófagos a essa área, sendo essa área que sofre inflamação (e que se apresenta mais a
vermelho).
São estes os principais tipos de hipersensibilidades. Ao fim e ao cabo, o tipo I e
o tipo IV caracteristicamente aparentam causar alergias, enquanto o tio II e o tipo III
caracteristicamente aparentam causar processos autoimunes. Todas elas são respostas
inapropriadas em relação aquilo que pretendemos.
Vamos agora abordar a nutrição e aquilo que tem a ver com imunidade. É uma
informação com alguma dificuldade para os alunos obterem, em que não passava pela
cabeça de ninguém há alguns anos atrás ligar a nutrição ao sistema imunitário.
Esta evolução toda permitiu-nos saber que a nutrição artificial por processos
saudáveis (não por via entérica, mas normalmente por via endovenosa – soro) são
formas de nutrir sem grandes inconvenientes. Devem apenas ser utilizadas quando não
há qualquer hipótese de alimentação entérica – devemos tentar até à última instância a
alimentação entérica. Mesmo num indivíduo politraumatizado, se for possível utilizar
uma alimentação entérica, devemos mantê-la enquanto for possível.
É evidente que a associação de nutrientes para o indivíduo não ficar
imunodeprimido e este processo ligado à infecção é muito antigo. Todos nós sabemos,
infelizmente, que vivemos num mundo em que se verificam situações de má nutrição
em que logicamente estas pessoas têm menos defesas e estão numa situação de
susceptibilidade. Mas só nos anos 70 é que se associou o impacto dos nutrientes no
sistema imunitário. O que essa base histórica antiga permitiu definir, era aquilo que se
designava por uma malnutrição proteíno-calórica (PCM). Isto quer dizer que havendo
falta de calorias, havendo falta de proteínas, haveria uma malnutrição associada a uma
imunodeficiência. E isto foi associado particularmente à infecção. As pessoas nutriamse mal, tinham falta de calorias ou de proteínas tendo mais infecções.
Depois começou-se a perceber (e isto é o nosso ponto de interesse actualmente)
que não era apenas a questão da infecção mas que havia uma disfunção do sistema
imunitário celular, em que praticamente tudo poderia estar envolvido (os CD4, os CD8,
os macrófagos, as células NK, Th1, Th2, as quimiocinas, as citocinas, etc). isto levou a
perceber que elementos patogénicos intracelulares, de que são exemplo a tuberculose, a
herpes, a pneumonia e o sarampo, assim como formas mais graves como a sépsis e a
resposta inflamatória sistémica. Estas doenças estão altamente associadas a uma
malnutrição com células de características proteíno-calóricas em malnutrição por
microelementos. Porque não há só a mal nutrição proteíno-calórica, há também a mal
nutrição por esses elementos. Isto é, sempre que falta o magnésio, o cobre, vitaminas,
etc... sempre que faltar algum destes microelementos, pode ser tão grave como a falta
geral proteíno-calórica.
Em 1987, há nos EUA uma conferência mundial apenas sobre nutrição e
imunologia. Esta conferência foi realmente o passo decisivo para se discutir a nutrição
no conceito imunológico, em que se estabeleceram algumas coisas importantes.
Primeiro, é a relação extremamente complexa entre a nutrição, a imunidade e a
saúde. Não interessa apenas nutrição e imunidade, interessa também o conceito de
saúde. Com certeza que não ficaríamos nada satisfeitos, se aparentemente nos
estivéssemos a nutrir muito bem, tivéssemos um sistema imunitário óptimo e
estivéssemos doentes! O que queremos, é que na verdade este complexo nutriçãoimunidade-saúde seja uma realidade positiva. Então, as clínicas básicas que aqui se
estabeleceram, para posteriormente serem seguidas foi:
-
-
-
levar a um melhor conhecimento dos mecanismos de regulação de
resposta imunitária pelos nutrientes;
saber o que é que acontece (se são os linfócitos T, os B, se são as
citocinas - o que é que está envolvido neste conceito);
revermos aspectos fundamentais da resposta imunitária e métodos
desejados para a avaliar (por exemplo os linfócitos que estão na pele
não têm nada a ver com os linfócitos que estão no pulmão ou nu
intestino. Portanto, se nós quisermos avaliar o sistema imunitário em
relação á nossa resposta no intestino, por exemplo em relação a
agressões que venham por via entérica, não podemos utilizar os
linfócitos da pele);
desenvolver um melhor conhecimento e significado das alterações
imunológicas que se dão no nosso organismo, isto é, nós fazemos por
exemplo uma alimentação com suplementos vitamínicos e
oligoelementos. Imaginemos que temos uma resposta T melhor, será
que clinicamente isto tem algum significado e que vou ter menos
infecções?
Finalmente reavaliar as necessidades dietéticas de diferentes grupos
ou populações. São coisas que infelizmente nunca tinham sido feitas
que é perceber que entre um jovem e um idoso pode haver dietas
completamente diferentes, há características que se aplicam ao jovem e
que não se aplicam ao idoso, como por exemplo, durante o
desenvolvimento de uma criança são fundamentais alguns constituintes
que existem no leite. Mas depois dessa altura, não há prova nenhuma
que estes constituintes tenham alguma utilidade. Neste conceito será
útil dar o leite aos idosos? Apenas como fonte de proteínas e de
calorias, mas não como uma alimentação equilibrada, no conceito de
desenvolvimento neuromuscular que era fundamental na criança. Tudo
isto leva a revisões muito importantes sobre o que são dietas
apropriadas ao organismo.
O piri-piri tem capsaicina, que é uma importante acção no sistema imunitário e
como neurotransmissor. Dando capsaicina a ratos nos quais foi induzida artrite
reumatoide, a doença foi menos grave.
O óleo de fígado de bacalhau tinha vitamina A, a qual se pensava ser antiinfecciosa.
Os polissacarídeos nos cogumelos activam a resposta imunitária, estimulando os
macrófagos e os linfócitos que vão mediar uma acção por citocinas e Acs.
Imunologia
16ª aula
Como sabemos, sempre que entra um Ag no nosso organismo, o nosso sistema
imunitário responde produzindo Acs ou estimulando assistentes celulares da resposta
imunitária, ou então as duas ao mesmo tempo sempre com o intuito de eliminar o Ag
que entrou no nosso organismo.
Temos portanto um Ag que vai desencadear uma resposta inata contra o mesmo.
Num segundo contacto com o Ag, vai ser desencadeada uma resposta imunológica que
em condições normais não se repercute clinicamente, mas em situações de
hipersensibilidade há um exagero da resposta que leva a uma lesão celular ou disfunção
orgânica.
As reacções de hipersensibilidade são vulgarmente conhecidas como alergias.
No entanto há uma noção comum de que as alergias são acção de hipersensibilidade do
tipo I, mediada por IgE contra Ags como por exemplo pólens, mas as reacções de
alergia dizem respeito a todos os tipos de hipersensibilidades.
Para se desencadear uma reacção de hipersensibilidade, vai depender quer das
características do Ag, quer das características do indivíduo no qual está a decorrer essa
reacção de hipersensibilidade. Num indivíduo, o Ag pode desencadear uma resposta por
Acs do tipo I, e num outro indivíduo desencadear uma resposta de hipersensibilidade do
tipo III.
A atopia diz respeito há uma predisposição genética para os indivíduos
desencadearem respostas de hipersensibilidade. Em condições normais, o Ag não
desencadeia reacções de hipersensibilidade em indivíduos não atópicos (isto verifica-se
especialmente em jovens asmáticos, com componente alérgico, sendo indivíduos
atópicos e que geneticamente tem uma predisposição para desencadear este tipo de
reacção de hipersensibilidade do tipo I.
Para além disso, estes factores condicionarem os tipos de hipersensibilidades,
que é o estado imunitário do indivíduo, o tipo de infecções, os fármacos (que podem
desencadear qualquer tipo de hipersensibilidade).
Contudo houve necessidade de classificar estes tipos de hipersensibilidades, o
que foi feito por Gell e Combs. Há assim 4 tipos de reacções. Os 3 primeiros tipos têm
em comum o facto de envolverem a formação Acs, sobretudo na primeira fase. O tipo
IV não tem nada a ver com Acs, indo antes desencadear mecanismos celulares.
Dentro das 3 primeiras temos o tipo I, também conhecida como imediata sendo
uma reacção que ocorre no espaço de minutos ou horas após o contacto com o Ag,
sendo mediada pela IgE.
A do tipo II envolve Ags celulares (ou tecidulares) que se ligam ao IgG. Esta
ligação (este imunocomplexo) vai desencadear mecanismos que vão destruir A célula
alvo (a célula que contém o Ag e á qual o IgG se ligou). São mecanismos de
citotoxicidade
O tipo 3 envolve sobretudo Ags solúveis e a ligação destes a Acs IgG e IgM que
vão circular na circulação sanguínea, indo-se depositar, e juntamente com mecanismos
do complemento vão destruir os tecidos ou os imunocomplexos.
A do tipo IV é conhecida como retardada pois é uma reacção exclusivamente
celular levando mais tempo a ser activa e envolve sobretudo os linfócitos T.
Esta classificação tem defeitos e pode ser considerada artificial porque quando
se dá uma reacção de hipersensibilidade, não apenas um dos tipos a funcionar, havendo
várias a actuar simultaneamente. Para além disso, em relação á hipersensibilidade
celular, há um tipo de reacção que envolve os 4 tipos de hipersensibilidade, sendo
reacções que têm particularidades muito definidas.
Seja como for, em qualquer reacção de hipersensibilidade tem que haver
sensibilização de linfócitos T. Como foi visto havia 3 reacções que eram mediadas
sobretudo por Acs, mas a sensibilização prévia dos linfócitos é uma característica que
tem que acontecer para se dar qualquer tipo de reacção de hipersensibilidade.
Quando há um Ag que é apresentado a uma célula apresentadora de Ag, há um
linfócito T que , num ambiente rico em IL-12 e INF- γ, vai levar a um tipo de
hipersensibilidade retardado.
Se pelo contrário o linfócito é apresentado aos linfócitos Th2, num ambiente rico
em IL-4 e IL-10 que habitualmente é conduzida pela célula mastocitária, vai
desencadear uma reacção de hipersensibilidade imediata com produção de IgE.
Na reacção do tipo I, o Ag que normalmente está envolvido neste tipo de
reacção, é um Ag denominado de alergénio, que no indivíduo atópico vai desencadear
estas reacções de hipersensibilidade imediata. Num primeiro contacto com um destes
alergénios, a célula apresentadora de Ag vai estimular o Th2 produzindo IL-12 e INF- γ,
e por sua vez e por sua vez a célula Th2 vai produzir INF- γ e TGF-β e assim estimular
o linfócito T a produzir Acs. O Ac que é estimulado neste tipo de reacção é a IgE. Esta
produção de IgE é facilitada por um microambiente rico em IL-4, sendo uma IL
produzida pelo mastócito e pelo basófilo que promove o “switching class” de IgG para
IgE. Ig produzida não vai ficar em circulação pois seria degrada rapidamente (
circulação tem uma vida curta) indo ligar-se à superfície do mastócito e do basófilo por
receptores de alta afinidade. Uma vez na superfície do basófilo, num segundo contacto
com Ag vai haver uma ligação directa do Ag à IgE à superfície do mastócito e do
basófilo. Terá que haver necessariamente o “crosss linking”, em que um Ag vai ligar
simultaneamente duas Igs para que haja a activação dos mecanismos bioquímicos que
vai levar à desgranulação dos mastócitos.
Os mastócitos são células que são produzidas na medula óssea e que se vão
encontrar nos tecidos. Tem grânulos no seu citoplasma que têm mediadores préformados (armazenados nessas vesículas) que são libertados quando há activação do
mastócito sendo a histamina, a heparina, o factor activador das plaquetas e tem outros
mediadores que são formados apenas quando há activação do mastócito, nomeadamente
as prostaglandinas, os leucotrienos e os tromboxanos. Para além disso o mastócito tem
ainda a particularidade de produzir IL-3, IL-4, IL-5 e IL-8 que são importantes na
estimulação do linfócito T para a produção de IgE.
O Ag vai fazer o “cross linking” a dois Acs, vai estimular o mastócito a libertar
aos seus grânulos e com a libertação dos grânulos vai haver chamada de células, vai
haver libertação de histamina, que é um dos elementos mais importantes nesta reacção.
A histamina tem como consequência o alterações da permeabilidade vascular e de
contractilidade do músculo liso. Isso pode traduzir-se através de sinais clínicos que vão
ser diferentes consoante o local onde está a ocorrer a reacção alérgica. Por exemplo se
um indivíduo com sistema atópico inalar um alergeno a nível do pulmão, vai
desencadear uma hipersensibilidade do tipo I, e com a libertação de histamina vai haver
contracção do músculo liso da parede do brônquio. Vai haver uma bronco constrição e
esse indivíduo vai fazer um episódio de asma com uma dispneia marcada. Na pele, a
alterações clínicas são o aparecimento de rubor por vasodilatação, eritema por
congestão vascular e edema por alteração da permeabilidade vascular.
Se o alergénio for por exemplo ingerido, vai acontecer uma gastroentrite com
vómitos e diarreia, como reacção ao alergénio alimentar. Como este alergénio alimentar
tem ainda a capacidade de entrar em circulação, é possível haver manifestações noutros
órgãos nomeadamente na pele com aparecimento de eritema e com prurido.
Os ácaros, o pelo dos animais, alimentos, fármacos são capazes de desencadear
reacções alérgicas em indivíduos atópicos. As hipersensibilidades conhecidas como
imediatas são a asma alérgica (quando é por via respiratória inferior que é afectada),
rinite alérgica (quando é por via respiratória superior que é afectada), a conjuntivite
alérgica, a gastroenteropatia alimentar, a urticária na pele. Se a reacção de
hipersensibilidade for generalizada com uma broncoconstrição marcada, pode acontecer
o choque anafilático e o doente pode vir a morrer por insuficiência respiratória, e com
uma hipotensão em choque marcada. Isto acontece em condições de atopia, nas pessoas
normais o Ag não desperta qualquer tipo de resposta imunitária
A hipersensibilidade do tipo II envolve Ags celulares aos quais se vão ligar Acs,
e a formação deste complexo imune Ag + Ac vai desencadear mecanismos que vão
destruir a célula alvo (que contem o Ag à superfície).
Num desse mecanismos, o Ac vai ligar-se ao receptor celular activando o
complemento com formação do complexo major de ataque que vai perfurar a membrana
da célula e assim desencadear um desequilíbrio osmótico na célula. Com a activação do
complemento há simultaneamente libertação da fracção C3b do complemento, e como
sabemos, as células que estão envolvidas na fagocitose têm receptores específicos quer
para a C3b, quer para a porção Fc da Ig e vão reconhecer mais facilmente a célula alvo e
assim destruí-la. É a chamada opsonização – o envolvimento de uma célula pela fracção
C3b do complemento ou por Ig que ficam com a extremidade Fc livre que vai facilitar
o reconhecimento pelas células fagocitárias e permitir mais facilmente a destruição das
células pelo mecanismo de fagocitose.
Outro mecanismo de destruição é desencadeado pelas células NK amada
citotoxicidade celular dependente de Ac e essas células têm também receptores para a
extremidade Fc da Ig indo reconhecer a célula alvo e destruí-la, não por mecanismos de
fagocitose, mas por mecanismos de citotoxicidade (por libertação de enzimas,
nomeadamente granzinas e perforinas).
Esta reacção do tipo II acontece quer com Ag exógenos que combinam com
células de Kupffer, quer com Ag próprios (Ag do “self” – autoAgs). A citotoxicidade é
mediada pelas células de Kupffer, pelos receptores Fc da Ig e vai lançar granzinas e
perforinas para destruir a célula alvo. Um dos exemplos em que acontece uma reacção
do tipo II são as transfusões com incompatibilidade do sistema AB0. o sistema AB0 diz
respeito a Ags que se encontram á superfície do eritrócito em que um indivíduo que
tenha o Ag A vai desenvolver Acs contra o Ag B. Se um indivíduo A receber uma
transfusão de sangue dum indivíduo B, os seus Acs vão unir-se ao eritrócito e
desencadear uma reacção de hipersensibilidade do tipo II activando o complemento,
ocorrendo lise dos eritrócitos.
Outro exemplo ocorre na incompatibilidade Rh. Isto acontece quando uma mãe
Rh negativo gera um feto Rh positivo. Durante o parto pode haver passagem de sangue
Rh positivo do filho para a mãe, e a mãe vai sensibilizar-se e produzir Acs contra o
factor Rh. Numa segunda gravidez em que o bebé seja Rh positivo, os Acs podem
passar através da rede placentária e provocar hemólise dos eritrócitos do bebé.
Estas hipersensibilidades do tipo II nem sempre têm como efeito final a
destruição celular. Em alguns deles há apenas uma alteração duma actividade funcional.
É por exemplo o caso da Miastenia gravis que é uma doença autoimune neurológica em
que o indivíduo tem uma perda de força muscular. Isso deve-se ao facto de que na
sinapse neuromuscular vai haver libertação da acetilcolina, e a célula motora vai ter
receptores para a acetilcolina. Vai haver formação de um Ac que vai bloquear esses
receptores da acetilcolina o que vai impedir que a acetilcolina se ligue aos mesmos não
havendo o desencadeamento do mecanismo de contracção. Este também é um caso de
hipersensibilidade do tipo II, mas em que não houve destruição celular mas antes
inibição de uma actividade funcional. Isto acontece também na anemia por déficit de
vitamina B12 e na doença de Grave em que ao contrário o Ac vai ligar-se ao receptor da
TSH e vai estimular esse receptor e minimizar os efeitos de uma hormona do
hipotálamo.
A anemia perniciosa acontece por déficit de vitamina B12. a vitamina B12 é
ingerida, a célula parietal do estômago vai produzir factores intrínsecos que ajuda a
absorver a vitamina B12 ao nível do ílion. Os indivíduos com anemia perniciosa que
desenvolvem Acs anti-factor intrínseco vão deixar de absorver a vitamina B12 ao nível
do ílion ou então o Ac bloqueia directamente o complexo no ílion.
Quando o nosso sistema imune contacta com Ags bacterianos durante muito
tempo, como acontece em infecções por estreptococos ou em situações de
autoimunidade em que há uma persistência durante muito tempo de Ags podem formarse imunocomplexos e desencadear a resposta de hipersensibilidade do tipo III, também
chamadas imunocomplexos de Combs. Esses complexos depositam-se localmente na
zona em que o Ag entrou ou entrar na circulação e depositar-se em zonas em que há
uma turbulência vascular ou em que há uma alteração da permeabilidade vascular.
Quando se deposita, vai haver activação do complemento com formação do complexo
de ataque que vai tentar eliminar esse imunocomplexo e provocar simultaneamente a
destruição celular e dá-se a libertação dos factores de degradação do complemento C3a
e C5a que são anafilotoxinas que vão estimular a desgranulação do mastócito e chamar
células inflamatórias ao local onde houve a destruição do imunocomplexo. Essas
células, nomeadamente polimorfonucleares são células ricas em enzimas líticas e que
vão libertá-las para a destruição desses imunocomplexos paralelamente à destruição dos
tecidos, nomeadamente destruição das paredes vasculares com necrose fibrinoide. Em
condições normais, nós formamos imunocomplexos circulantes, no entanto esses
imunocomplexos circulantes são removidos da circulação, sendo retirados pelo sistema
reticulo-endotelial, nomeadamente a nível do fígado. Isto acontece porque quando se
forma o imunocomplexo circulante há activação do complemento com libertação de
C3b. Esse c3b vai ligar-se ao Ac e vai solubilizar o imunocomplexo circulante. Como
os eritrócitos têm receptores para essa fracção C3b, os imunocomplexos ligam-se aos
eritrócitos, vão na circulação e são removidos pelas células de Kupffer no fígado ou
pelas células do sistema reticulo-endotelial. Se os imunocomplexos forem produzidos
em grandes quantidades ou se houver alguma sobrecarga no sistema reticulo-endotelial
(ou uma deficiência do mesmo) ou ainda se houver turbulência vascular pode ocorrer a
deposição desses imunocomplexos e desencadear-se reacções de hipersensibilidade do
tipo III.
As reacções de hipersensibilidade do tipo III podem ser localizadas pela reacção
de atos em que há em que há injecção de um Ag solúvel na derme dum animal que foi
previamente estimulado (já houve formação de Acs). Vai haver passagem de Acs da
vénula mais próxima donde se deu a injecção do Ag, vão formar-se imunocomplexos
circulantes com activação do complemento, vai haver libertação das fracções C5a e C3a
que são quimiotáticas para os polimorfonucleares, vai haver migração dos
polimorfonucleares para a zona onde se deu a deposição dos imunocomplexos e, por sua
vez, estimulação do mastócito com desgranulação e libertação de histamina e de
mediadores inflamatórios.
Simultaneamente dentro do vaso há também agregação plaquetar que leva à
libertação de aminas vasoactivas que vai alterar a permeabilidade vascular e permitir a
saída de líquido para os tecidos.
Após a injecção do Ag vai haver a formação de uma zona de eritema e de
edema.
A deposição de imunocomplexos pode acontecer habitualmente em vénulas póscapilares mas pode acontecer em qualquer órgão do nosso corpo. Pode ser na pele, nas
articulações e até no sistema nervos central. Um dos órgãos de eleição para essa
deposição é o rim pois a sua estrutura glomerular condiciona a turbulência vascular para
a deposição. Uma dessas reacções de hipersensibilidade do tipo III são as chamadas
glomerulonefrites devido á estrutura glomerular do rim.
A doença do soro é devida a uma reacção localizada do tipo III. Quando uma
reacção é generalizada, em que um exemplo é a doença do soro, antigamente davam-se
injecções em seres humanos (injecções de soro anti-disteria) que era obtido em animais
de espécies diferentes (no cavalo). Ao administrarmos isso em seres humanos, ia haver
uma reacção exuberante desses imunocomplexos contra as proteínas que são de uma
espécie animal diferente. Ia haver uma deposição generalizada de imunocomplexos, por
exemplo, na pele, nas articulações, no olho, nas meninges, portanto, isto aparecia cerca
de uma semana depois da administração do soro, aparecia um quadro típico de doença
pois o soro confere mau estar com deposição desses imunocomplexos nos órgãos do
corpo.
Na deposição dos imunocomplexos no glomérulo, esses imunocomplexos
encostam-se às paredes do glomérulo, e por alterações da permeabilidade vascular vão
depositar-se para além da membrana basal, indo criar reacções de hipersensibilidade do
tipo III nas paredes do glomérulo, chegando mesmo a destruir o glomérulo renal, o rim,
funcionando mesmo como uma insuficiência renal.
Por fim, temos a reacção de hipersensibilidade do tipo IV que é um tipo de
reacção que leva mais tempo e por isso também conhecida como hipersensibilidade
retardada, porque o que está a ser estimulado são células a migrar para o local onde se
encontra o Ag. É uma hipersensibilidade celular. Enquanto que as outras 3 eram
hipersensibilidades que podiam ser transmitidas de um indivíduo sensibilizado para um
indivíduo não sensibilizado através de Acs séricos, neste caso a hipersensibilidade não
pode ser transmitida por transferência de Acs mas sim por células, nomeadamente por
linfócitos T que tenham sido previamente sensibilizados.
Dentro deste tipo nós podemos separá-los consoante a célula que é estimulada,
isto em 2 grandes grupos:
quando é a célula th1 que é estimulada, habitualmente quando há um
Ag solúvel e que persiste durante muito tempo,
e um em que temos estes 3 tipos – a tuberculínica, a de contacto e a
granulomatosa (tudo hipersensibilidades) quando pelo contacto células
CD8 vão ser estimuladas 8isto acontece normalmente com Ag celular,
há uma reacção de hipersensibilidade retardada do tipo citotóxico.
No caso da hipersensibilidade tuberculínica e de contacto, nós sabemos que a
tuberculose é originada por uma infecção por uma micobactéria, uma bactéria
intracelular que estará dentro da célula e portanto, não podia ser um mecanismo de Acs
que iria regular uma infecção por tuberculose, o linfócito Th1 é estimulado quando há
uma infecção por micobactérias, vai levar à produção de IL-2 que vai estimular outros
linfócitos Th1 que por sua vez vão criar um microambiente onde predomina INF-γ, IL-8
e IL-1, e vai sobretudo recrutar ou chamar células macrofágicas que vão fagocitar a
célula onde se encontra a bactéria.
Isto vai ser acompanhado por mecanismos de inflamação, nomeadamente
inflamação crónica, e um outro género deste tipo de hipersensibilidades que nós temos,
é a dermatite de contacto em que há um Ag que se vai ligar a proteínas existentes na
célula, e esse Ag vai ser captado por células de Langerhans, que vai ao gânglio linfático
estimular o Th1 e depois ocorre uma estimulação maciça de células linfocitárias, no
sentido de orientar outros linfócitos e macrófagos para o local onde houve o contacto
com a tal substância alergénica.
Esta é uma situação que é muito frequente nos homens, porque o botão das
calças habitualmente tem níquel, e que pode desencadear este tipo de reacção. Umas
horas depois do contacto do níquel do botão vai formar-se uma zona de eritema e de
migração de células mononucleadas, nomeadamente os macrófagos, para o local onde o
níquel está a desencadear a tal resposta de hipersensibilidade celular.
Quando nós temos um Ag que desencadeia uma resposta de hipersensibilidade
celular e que permanece durante muito tempo e que não se consegue eliminar, vai haver
uma produção maciça de INF-γ, e o que vai acontecer é que o macrófago vai ser
transformado e estimulado a transformar-se em células epitelióides, que se encontram
em células gigantes mutilnucleadas e que vão dar origem a uma estrutura histológica
que se chama granuloma e que é patogneumónico numa hipersensibilidade retardada. Se
ao microscópio virmos um granuloma, sabemos que está a ocorrer ali uma reacção de
hipersensibilidade retardada, uma reacção granulomatosa crónica.
O macrófago é transformado em célula epitelióide, que por sua vez dá origem à
célula gigante mutinucleada. Isto tem que ser na presença de um Ag consistente, que
não se consiga eliminar, e num microambiente sobretudo rico em INF-γ.
O próximo mecanismo de hipersensibilidade retardada envolve sobretudo a
apresentação de Ags celulares. Linfócitos T e CD8 vão libertar citolisinas e citotoxinas
que vão destruir a célula que apresenta á sua superfície o Ag estranho. É característico a
infecções virusais e das infecções de transenxertos e da resposta contra tumores.
Imunologia
17ª aula
A partir das estatísticas, é possível obtermos um panorama global da incidência
da SIDA a nível mundial, isto apesar de andarem sempre um pouco atrasadas.
Esse panorama não se altera em alguma zonas embora noutras tenda a piorar.
Em 1999, o número total de adultos e crianças que estavam infectados pelo HIV ou que
tenham mesmo SIDA, era de 34,3 milhões de pessoas. Este número por si só é
particularmente alarmante, porque atentando à distribuição geográfica destes números,
vemos que destes 34 milhões 24 a 25 encontram-se na África sub-saariana, isto é,
abaixo do deserto do Saara. Outro grande bloco de infecção do HIV com grande relevo
é a parte sudeste da Ásia. Também poderíamos falar da América latina, mas não tem
tanto peso como as duas regiões anteriores em que a situação é alarmante.
Mas se isto é alarmante, ainda pior é o facto do número de crianças com menos
de 15 anos infectadas com HIV ou já com SIDA perfazer já 1,3 milhões, havendo uma
vez mais maior incidência na zona sul de África.
A imagem talvez mais importante para dar é aquela que um colega africano deu
há algum tempo, de que se formos a África num ano e conhecermos lá um grupo de
pessoas, no ano seguinte esse grupo de pessoas já desapareceu. Realmente, a infecção
atingiu uma proporção tal que o número de óbitos é particularmente importante o que se
traduz numa situação extremamente preocupante.
O número de pessoas infectadas com este problema desde do início do seu
aparecimento até ao final de 1999, representa já 18,8 milhões de pessoas mortas. Isto é,
das 34 milhões de pessoas infectadas, 18,8 milhões já morreram, o que é um saldo
enorme de mortalidade. Uma vez mais o maior número de óbitos regista-se no sul de
África e na Ásia. No resto da Europa, nós já temos mais de 200 mil pessoas mortas, o
que também não é um número particularmente agradável.
Só em 1999 o número de pessoas (adultos e crianças) infectadas de novo foi de
5,4 milhões de pessoas. Repare-se que a nível mundial, houve no ano de 1999, um
número equivalente a mais de metade da população do nosso país infectada de novo
com SIDA – cerca de 4 milhões na África, 800 mil na Ásia, apenas 30 mil na Europa.
Falando agora apenas em crianças (com idade inferior a 15 anos), só durante o
ano de 1999, 620 mil crianças foram infectadas, mais uma vez com uma contribuição
enorme do sul de África.
Se fizermos uma estimativa ao que se passou até agora, temos 34,3 milhões de
pessoas infectadas, 5,4 milhões de novas infecções durante um ano, 2,8 milhões de
mortes só durante 1999 (mais de metade das pessoas infectadas) e o número
cumulativo de pessoas já mortas a atingir quase os 19 milhões de pessoas.
Em 1999 surgiam cerca de 15 mil novas infecções por dia, 13 mil das quais entre
os 15 e os 39 anos, sendo esta uma idade que pode corresponder a uma capacidade mais
produtiva das pessoas quer sob um ponto de vista laboral, quer sob um ponto de vista de
reprodução. O que aconteceu foi que 50% destas novas infecções foram nas mulheres
(logo 50% também nos homens) e cerca de 50% numa idade por volta dos 24 anos. Este
dado é curioso particularmente nas mulheres pois a mulher grávida pode transmitir a
doença ao filho, havendo uma maior prevalência de mulheres grávidas afectadas em
África em zonas urbanas. Mas verifica-se o primeiro sinal positivo se atentarmos a que
o número de mulheres grávidas aumentou até 1990, mas apartir daí, começou a descer
até 1999 de um modo um pouco mais lento do que subiu.
Em África em geral e particularmente no caso do Quénia, há uma prevalência
das raparigas infectadas em relação aos rapazes. Isto é particularmente grave por
aumentar a dificuldade de controlo da doença, pois os rapazes mentem às raparigas e há
uma dificuldade de controlar uma transmissão natural da infecção, como também é
grave pelo facto de que se a rapariga engravida tem todas as possibilidades de transmitir
a doença ao filho.
Vamos agora atentar á parte imunológica da doença, que é o que nos interessa
para esta aula.
Mas apesar de toda aquela desgraça, o que é facto, é que se falarmos de um país
desenvolvido como é o caso dos EUA, no período de 82-97, em relação à diabetes nada
aconteceu, em relação ao cancro nada aconteceu (estamos a falar de número de mortos
por 100000 habitantes) a SIDA começa a aumentar de uma forma muito ténue, e de
repente em pouco anos (cerca de 10) a doença vai diminuir rapidamente ultrapassando o
cancro e as doenças cardiovasculares. Em 93/94/95 a maior causa de morte mesmo em
países desenvolvidos como os estados unidos era a SIDA. Apartir desta data, a situação
melhorou substancialmente. Isto aconteceu devido às terapêuticas antiretrovírus de alta
eficácia (HAART).
Não é intenção destas aulas de imunologia mostrar aos alunos qual é a
constituição do vírus da SIDA (isso pertence a outras cadeiras) mas antes mostrar que
este vírus não é assim tão diferente dos outros vírus, tendo apenas uma estrutura um
pouco mais complexa. Esse vírus tem uma particularidade curiosa: enquanto a maioria
dos vírus conseguem sobreviver em condições hostis durante algum tempo, o vírus da
imunodeficiência adquirida é um vírus extremamente lábil (pouco resistente a condições
adversas). Este vírus tem uma estrutura antigénica importante, em que há uma série de
Ags que se espalham pelo HIV (sem esses Ags nós dificilmente o conseguiríamos
detectar). Esses Ags podem dividir-se nos Ags da parte exterior, os chamados Ags do
envelope (por se encontrarem na parte de fora) e os Ags da parte interior do vírus, os
chamados Ags do core (por se encontrarem na parte de dentro).
Alguns exemplos são a gp120, em que gp é uma glicoproteína, que existe na
parte mais exterior do vírus. Na parte mais interna teremos exemplo a p24 que é uma
proteína. Genericamente, temos mais internamente as proteínas como sejam a p24 e a
p10 e mais externamente as glicoproteínas como seja por exemplo a gp120 e a gp41.
O que é que acontece quando se dá a infecção pelo HIV? A infecção pelo
HIV dá-se de diferentes formas, nomeadamente pela via sexual, pela via hemática em
que o sangue ou por acidentes ou por contacto do sangue comportas de entrada do nosso
organismo (por exemplo um cirurgião ao picar-se com uma agulha infectada pode
contrair o vírus) e ainda por via materno-fetal em que há transmissão do vírus da parte
materna para a parte fetal. Há ainda um outro tipo de transmissão que por vezes não é
mencionado que é a transmissão pelo leite. Uma vez que o leite tem células, tem
linfócitos, e os linfócitos podem estar infectados pelo HIV, logicamente vão infectar o
recém-nascido, durante a amamentação. Por isso, naquela zona de África em que toda
aquela incidência do HIV é desaconselhada a amamentação. É evidente que depende da
situação – se não houver outro recurso alimentar, é óbvio que mais vale amamentar a
criança do que deixá-la morrer à fome.
Os órgãos de comunicação e outros meios sociais perverteram um pouco aquilo
que transmite a SIDA. Então, muitas pessoas ficaram com a ideia genérica que a
transmissão sexual se dava pelo sémen no qual o vírus se andava a passear. É evidente
que o vírus não está aí. Está em linfócitos que existem no sémen normal. Para além dos
espermatozoides e do líquido base, o sémen contém leucócitos (linfócitos). São esses
linfócitos que estão contaminados pelo HIV. Caso o homem esteja infectado com o
HIV, pode fazer fertilização artificial por lavagem do sémen. Isto é, tiram-se os glóbulos
brancos, fica todo o outro conteúdo. Este esperma quando introduzido na mulher, não
tem qualquer hipótese de a infectar. São portanto os leucócitos do sémen que estão
contaminados e que transmitem o vírus.
Dada a transmissão (por qualquer um dos meios atrás referidos) há uma
infecção. E quando se dá essa infecção, a sintomatologia é ligeiramente discreta pode
até nem existir. A existir sintomatologia da infecção, quando muito, o vírus HIV (e não
VIH, pois HIV é conhecido em todo o mundo) exibe uma síndroma clínica aguda muito
discreto e pode até não se notar rigorosamente nada. Poderá traduzir-se por uma
infecção gripal, fadiga, eventualmente algum racho cutâneo ao nível da pele, dores de
cabeça, pode também haver uma linfonedopatia, mialgia, sintomas gastrointestinais. Isto
é, tudo aquilo que se possa associar a uma clínica gripal. Portanto, nenhum de nós
apresenta uma sintomatologia própria, nenhum quadro clínico próprio para o HIV.
Obviamente durante este período de tempo há uma serologia negativa. Serologia
é uma análise de Acs contra as estruturas antigénicas que o vírus tem, por exemplo a
gp120. se nós estivermos a estudar Acs contra as proteínas do vírus dum indivíduo
infectado, nós não detectamos rigorosamente nada. O indivíduo não tem Acs contra o
vírus e dizemos que ele é seronegativo (há uma aumento do vírus, contudo ainda não há
Acs, não há uma resposta imunitária que consiga detectar). Passado algum tempo (que é
variável) que se pode estender de umas semanas a várias semanas, há uma momento em
que o indivíduo se transforma de seronegativo (não ter Acs contra o vírus) a
seropositivo, isto é, passa a ter Acs contra o vírus. O seropositivo apenas representa o
indivíduo que apresenta Acs contra o HIV. É então nesse momento que ele entra na fase
de latência clínica. Latência clínica ou fase de infecção crónica, porque praticamente
não há doença, mas ele é seropositivo. Ele tem o vírus e para além disso tem uma
reacção imunológica contra o vírus. O período em que o indivíduo pode ser seropositivo
vai dos 8 a 10 anos.
Progressivamente, os linfócito CD4 vão diminuir, e numa altura equivale a que o
vírus comece a aumentar novamente de uma fase em que ele praticamente desapareceu,
ou ficou em concentrações muito baixas) os CD4 podem baixar abaixo de um
determinado nível que se caracteriza na verdadeira fase de doença que é a SIDA.
Portanto, a SIDA só surge quando após uma latência clínica, aquele indivíduo
seropositivo passa ater menos de 200 linfócitos CD4 por mm3 . Apartir do momento em
que o indivíduo tem menos de 200 linfócitos CD4 por mm3, o indivíduo passa a ter
SIDA. Obviamente a fase de doença também é variável em que após um período de 2/3
anos o indivíduo pode morrer.
Após o período agudo em que o indivíduo é seronegativo, dá-se uma
seroconversão (com aparecimento de Acs) para seropositivo.
Actualmente nós podemos detectar os Ags do vírus e não apenas os Acs. Se nós
quisermos saber o quanto é recente é a infecção, nós devemos pesquisar os Ags do vírus
e não os Acs. O indivíduo pode ser seronegativo e averiguarmos o vírus. Isto tem a ver
com a questão do “estarei infectado?” e não ter que estar à espera imenso tempo para
saber se está infectado ou não (após se transformar num seropositivo).
Repare-se que o período de seroconversão pode muitas vezes ir até 18 meses.
Isto equivale à pessoa andar durante 18 meses com um stress psicológico enorme, sem
saber se está infectado ou não e se passa a ser um seropositivo ou não.
As informações que possuíamos no ano passado com as informações que temos
deste ano, permitem-nos afirmar que afinal o período de latência clínica nalguns casos
já chega a 16/18 anos. Nalguns casos está indefinidamente parada – há pessoas que
estão infectadas há mais de 16/18 anos e que nunca evoluíram para SIDA. O mais
espectacular de tudo isto , é que há casos de indivíduos, nomeadamente de crianças
seropositivas, que passaram a ser seronegativas. Isto é, deu-se uma seroregressão da
seropositividade (e teoricamente forma por vezes situações completamente limpas do
vírus).
Portanto, o panorama tem melhorado.
Aquilo que se verificou e que já era esperado para 99, foi que indivíduos
chamados típicos (que fazem uma progressão típica da doença) do vírus HIV, tem a tal
fase inicial de período de latência, progressivamente os linfócitos CD4 vão diminuindo,
e neste momento há um aumento de vírus, e que após um período de aproximadamente
8 anos, o indivíduo desenvolve SIDA.
Há outros que são chamados situações de progressão rápida. Vamos ter sempre
uma quantidade elevada de vírus (não uma baixa como anteriormente), acompanhada de
uma resposta imunitária baixa, e os linfócitos CD4 baixam progressivamente, e
rapidamente o indivíduo entra numa situação de SIDA.
Mas pode acontecer uma progressão lenta. São indivíduos que apresentam uma
baixa muito acentuada de Ags, são indivíduos que apesar de não fazerem uma resposta
imunitária muito acentuada, mantêm os níveis de linfócitos CD4. este facto é que lhes
permite não entrar na situação de SIDA são situações de não progressão durante
longo tempo. Devemos manter este nome complicado de “não progressão durante
longo tempo”, pois nada impede que por exemplo passados 50 anos a infecção se
manifeste (sabe-se que alguns indivíduos tem ido até 18 anos de não progressão). São
indivíduos seropositivos, mantêm resposta imunitária, mantêm os níveis de CD4
normais, são indivíduos que não parecem estar a progredir.
Mas porque é que a infecção pelo HIV será tão importante ou tão diferente em
relação aos outros vírus? No fundo, o HIV, tal como outros pode ser apresentado a
linfócitos por células apresentadoras, pode desencadear quer respostas celulares, quer
humorais por Acs, pode ser ingerido por fagocitose, promover lise das células
infectadas, etc. Mas como é que ele foge a estes processos? O primeiro meio, é
desenvolver formas de fugir ao sistema imunitário. Os Acs produzidos contra o vírus,
muitas vezes em vez de destruí-lo, vão camuflá-lo.
A outra forma, e por isso é que o HIV é considerado tão grave, é o facto de ele
utilizar receptores funcionais das nossas células imunitárias. Ele utiliza os receptores,
portas de entrada naturais das células, nomeadamente o CD4, que é um receptor, uma
estrutura natural dos linfócitos e também os receptores das quimiocinas, nomeadamente
o CCR5 e o CXCR4. utilizando receptores de quimiocinas, utilizando o CD4, ele tem
portas de entrada naturais nas células do nosso sistema imunitário.
Então, passado poucas semanas da infecção até temos Acs – anti-p24, antigp120, se até se chama seropositivo porque tem Acs contra o vírus, porque é que esses
Acs não destroem o vírus? Embora tenhamos Acs neutralizantes que até certo ponto até
destroem certos vírus, alguns encontrando-se nas mucosas (aliás a IgA secretora é muito
importante na protecção das mucosas). Por exemplo a infecção por via sexual pode ser
muito variável e depende da quantidade de IgA secretora que haja no compartimento
genital da mulher. Mas quanto a uma eventual função protectora, pode haver
retardamento da doença. A pessoa acaba por infectar, por ser alvo da SIDA, mas acaba
por ter alguma acção protectora como que retardadora da doença. Há ainda esperança
que estes Acs venham a ser importantes na vacinação contra o HIV. Para já são
importantes por serem retardadores da progressão da doença.
Mas se há alguns Acs neutralizantes, é natural que haja mais Acs facilitadores e
Acs camuflados. Isto é, temos Acs que vão como que camuflar o vírus e o sistema
imunitário não consegue ver o vírus (e se não consegue ver o vírus, obviamente que não
o consegue destruir) ou então temos Acs facilitadores.
Se o HIV se ligar a Acs vai formar imunocomplexos. O Ac não neutralizou o
HIV e o imunocomplexo vai ser fagocitado, nomeadamente por macrófagos. E ao ser
fagocitado, o imunocomplexo é introduzido no interior do macrófago, onde o HIV vai
ter possibilidade de se reproduzir. O Ac em vez de destruir o HIV, vai facilitar a
introdução do HIV nas células do nosso organismo.
Portanto, este efeito facilitador e este efeito de camuflagem, contrapõem
largamente os Acs neutralizantes. Na situação normal do indivíduo infectado pelo HIV,
habitualmente os Acs não terão um papel de grande relevo. Repare-se que temos Acs
neutralizantes, facilitadores e de camuflagem, mas que num contexto de vacinação ou
num contexto de atitude terapêutica, os Acs podem ser importantes nomeadamente
como retardadores ou como protectores.