ÁGUA NOS
ALIMENTOS
Prof. Dr. Tiago André Kaminski
INTRODUÇÃO
ÁGUA
Única
substância em abundância nos três estados físicos
Componente majoritário dos seres vivos e dos alimentos
Relacionada à perecibilidade dos alimentos
Altos conteúdos exigem métodos de conservação
Quantidades adequadas e localização determinam
a qualidade dos alimentos
Água, essencial à vida por ser:
Portadora de substâncias nutritivas e de descarte
Altamente reativa e meio das reações
Estabilizadora das configurações biopoliméricas
A MOLÉCULA DE ÁGUA
Formada por 2 átomos de hidrogênio que interagem
com 2 orbitais sp3 de um átomo de oxigênio
Molécula triatômica angular com 2 orbitais não
ligantes com 2 elétrons cada (provenientes do O)
Forma tetraédrica
Fórmula Estrutural:
O
Orbitais orientados de
maneira simétrica sobre
os eixos do orbital original
/ \
H H
Fórmula Molecular:
H2O ou H+OH-
Pares de elétrons não ligantes têm maior repulsão do
que os pares ligantes
Tal repulsão diminui o ângulo H–O–H, que deveria ser
109°28’, para 104°45’
Eletronegatividade produz carga + nos H e – no O
Propriedades físico-químicas
Volume reduzido
RESPONSÁVEIS PELAS PROPRIEDADES
ESPECIAIS DA ÁGUA COMO SOLVENTE
Alto momento dipolar
Alta constante dielétrica
Calor específico
IMPORTANTES PARA COCÇÃO,
ESTERILIZAÇÃO, CONCENTRAÇÃO,
DESIDRATAÇÃO E CONGELAMENTO
Calor latente de fusão
Calor latente de vaporização
Condutividade térmica (+ para o gelo)
Capacidade calorífica (+ para o líquido)
Viscosidade (normal)
Pressão de vapor
PROPRIEDADES COLIGATIVAS
Ponto de ebulição
Ponto de congelamento
Tensão superficial
LIGAÇÕES/PONTES DE HIDROGÊNIO
As forças de atração intermoleculares na água não
podem ser explicadas apenas pelo momento dipolar
Casos de ligações de Van der Walls, chamadas de
PONTES DE HIDROGÊNIO ocorrem entre H (+) e
átomos eletronegativos, como F, O e N (-)
Promovem atração eletrostática entre cargas (+ e –)
de diferentes moléculas de água
Cada molécula de água tem 4 linhas de força:
2 negativas (sítios receptores)
2 positivas (sítios doadores)
Cada molécula de água
pode estabelecer pontes
de hidrogênio com 4
moléculas vizinhas
Embora de baixa energia, a grande incidência é
responsável pelo efeito estereoquímico e manutenção
da configuração espacial
Ligações eletrostáticas dipolo-dipolo com baixo nível
energético = 1 a 10 kcal/mol
Ligação covalente (entre átomos da água) = 118 kcal/mol
É requerida muita energia para romper todas as
ligações e deixar as moléculas de água livres
Alta força de atração explica alta capacidade
calorífica, ponto de fusão, ebulição, ... em comparação
com outras moléculas pequenas
NH3: 3 sítios doadores e 1 aceptor
HF: 1 sítio doador e 3 aceptores
Não formam redes
tridimensionais, apenas
extensas redes
bidimensionais
ESTADOS FÍSICOS DA ÁGUA
Água no estado líquido
Trata-se de um líquido estruturado:
com associações de curto prazo
interconvertidas com rapidez (nano a pico segundos)
mas mantendo uma certa estruturação
Estes agregados estão em permanente formação,
ruptura e movimento na água líquida
Além de diferentes tamanhos e contínua variação,
entre os agregados circulam moléculas
temporariamente livres
Água no estado sólido
No resfriamento, diminui a energia e os movimentos
moleculares
Menor rompimento e maior formação de pontes de H
O sistema fica cada vez mais ordenado, com menos
moléculas livres entre os agregados, até estado
cristalino
Moléculas tomam posições fixas e formam um retículo
cristalino com maior distância entre as moléculas
Maior volume (cerca de 9%)
Até gelo puro não tem apenas moléculas de H20,
contando também com variantes iônicas isotópicas
(H+, H3O+ e OH-)
O gelo convencional contém quantidades “residuais”
de solutos, falhas direcionais, ... admitindo-se que:
Cristais de gelo nunca serão perfeitos
Também deve-se considerar a:
Vibração (0,4 Å a -10°C)
Difusão (concentração de substâncias na fase líquida!)
Apenas a -180°C admite-se a conformação estática
Quando todas pontes de H estão formadas
QUAL É MELHOR PARA O ALIMENTO?
CONGELAMENTO LENTO
CONGELAMENTO RÁPIDO
Na FUSÃO, densidade da água aumenta ou diminui?
o número de vizinhos = ↓ densidade
Menor distância das moléculas vizinhas = ↑ densidade
Diminui
Na temperatura de fusão (0°C) apenas 15% das pontes de
hidrogênio estão rompidas (gelo quebrado)
Água no estado de vapor
No aquecimento, aumenta a energia das moléculas,
que se afastam e rompem ligações de H
Quando o nível de energia atinge a temperatura de
ebulição, as moléculas superficiais passam para o
estado de vapor
Neste estado, não há mais formação dos agregados
entre as moléculas, que ficam muito afastadas
Embora as moléculas de água dissociam-se
totalmente apenas acima de 600°C
PROPRIEDADES SOLVENTES
Natureza dipolar da água é
responsável por dissolver e
dispersar muitas substâncias:
Iônicas
Não iônicas de caráter polar
Não iônicas de caráter apolar
-
-
Conjunto
Disposição tridimensional
- Volume reduzido
- Alto momento dipolar
Elevada constante dielétrica
responsável pelas propriedades da água
como solvente
Solvatação de substâncias iônicas é favorecida
pela oposição do solvente à atração eletrostática
entre íons + e –
Íons grandes e monovalentes, com fracos campos
elétricos, promovem quebra da estrutura reticular
K, Cl, Br, I, Rb, Cs, NH4, NO3, IO3, ClO4, ...
Íons menores e/ou multivalentes, com fortes campos
elétricos, promovem melhor
estrutura reticular
Li, Na, Ca, Ba, Mg, Al, F, OH-, ...
Exemplo clássico = NaCl
Substâncias não iônicos de caráter polar são
dissolvidos com facilidade na água (açúcares, alcoóis
simples, aldeídos, cetonas, ...)
Pequeno volume da água permite penetração em
estruturas cristalinas e moléculas de grande
dimensões, solvatando íons e moléculas
Substâncias não iônicas apolares apenas
interagem com a água
A água minimiza o contato com grupos apolares
(repulsão)
Aumenta o número de agregados e moléculas
agregadas (↓ entropia)
Formação de micelas
Pela maior afinidade da água
pela sua própria estrutura do
que com as estruturas não polares
A quantidade e o tipo de substância na água
influenciam (alteram) as propriedades físicas e a
estrutura da água líquida e sólida
aw
ÁGUA LÍQUIDA
ÁGUA SÓLIDA
PRESSÃO OSMÓTICA (↑)
TAMANHO
PONTO DE EBULIÇÃO (↑)
ESTRUTURA
PONTO DE
CONGELAMENTO
LOCALIZAÇÃO
PRESSÃO DE VAPOR (↓)
ORIENTAÇÃO
...
dos cristais de gelo
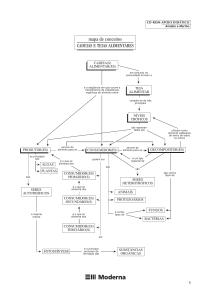
ÁGUA NOS ALIMENTOS
IMPORTÂNCIA
-
Aspectos sensoriais: cor, odor, sabor, textura, aspecto, ...
Conservação: controle da deterioração microbiológica e
enzimática
Métodos de conservação que envolvem água:
-
Secagem
Liofilização
Resfriamento e Congelamento
Fixação de água (adição de NaCl, sacarose, gomas, ...)
Branqueamento
-
entre outros
Usualmente, o conteúdo de água nos alimentos é expresso
pelo valor obtido na determinação da água total
•
•
Mas esse valor não indica a distribuição da água no
alimento
A secagem completa dos alimentos ocorre em 2 etapas
com diferentes níveis de energia:
1ª – consumo de energia ao nível do calor latente de
vaporização
2ª – necessidade de maior nível de energia
Altos teores de água nos alimentos, obtidos a partir de
métodos analíticos convencionais, não correspondem
necessariamente:
- ao maior desenvolvimento de microrganismos
- à maior velocidade nas reações químicas
Assim, admite-se a existência de moléculas de água
com diferentes propriedades e distribuição no alimento:
ÁGUA LIVRE: fracamente ligado ou não ligada ao
alimento, funciona como solvente, permite o
desenvolvimento de microrganismos e reações químicas,
mas pode ser facilmente eliminada
ÁGUA LIGADA (COMBINADA): fortemente ligada ao
substrato, não utilizada como solvente, não disponível
para o desenvolvimento de microrganismos e reações
químicas, além de dificilmente removida do alimento
FORÇA DE LIGAÇÃO DA
ÁGUA COM O ALIMENTO
ÁGUA CONSTITUCIONAL: é a
porção mais fortemente ligada ao
alimento (pouquíssimas moléculas
fazem parte desta porção)
ÁGUA VICINAL: também fortemente
ligada, principalmente aos
grupamentos polares de moléculas
como proteínas e açúcares
ÁGUA MULTICAPA: mais fracamente
ligada ao alimento (externamente),
sobrepõe as camadas de água vicinal
ATIVIDADE DE ÁGUA (aW)
Relaciona conteúdo de água X perecibilidade
Estabelece uma estreita relação entre o teor de
água de um alimento e sua conservação
Normalmente: ↓ água = alimento ↓ perecível
Indica a intensidade de associação da água com
componentes não aquosos do alimento, ou seja, o
teor de água livre (disponível) nos alimentos
Como determinar a aw?
aw = P / Po = na = n2 / n1 + n2
Onde:
P = pressão de vapor da água no alimento
Po = pressão de vapor da água pura (na mesma T°C)
na = fração molar da água no alimento
n1 = n° de moles do soluto
n2 = n° de moles do solvente
Outras maneiras...
aw = f / fo = URE / 100
Onde:
f = fugacidade do solvente na solução
fo = fugacidade do solvente puro
URE = umidade relativa do equilíbrio
É regra geral que:
0 < aw < 1
↓ temperatura = ↓ aw
Na prática
Amostra é inserida em
uma câmara fechada
Até atingir o equilíbrio (peso constante)
Mede-se a UR dentro da câmara através de:
Higrômetros
elétricos
Ponto de orvalho
aw X congelamento
“A pressão de vapor da água de um alimento
congelado é igual à pressão de vapor do gelo na
mesma temperatura”, assim:
-
Se T°C é maior que o ponto de congelamento
aw depende da composição da amostra e da temperatura
-
Se T°C é menor que o ponto de congelamento
aw independe da composição da amostra e depende
exclusivamente da temperatura
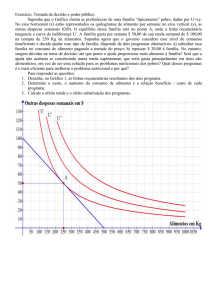
ISOTERMAS DE SORÇÃO
São gráficos que relacionam a quantidade de água
e atividade de água de um alimento
Importância das isotermas
Prever aw em diferentes umidades
Avaliar a estabilidade físico-química durante
mudanças de umidade
Melhorar processos de conservação a partir de
concentração e desidratação
Formular misturas de alimentos sem transferência de
umidade entre ingredientes
Determinar barreira de umidade necessária à
embalagem
Determinar a temperatura ideal de alimentos
congelados
ZONA I (A): aw entre 0,0 e 0,2-0,3
água fortemente ligada ao alimento (água constitucional + água
vicinal)
não congela a -40°C (não serve como solvente e reativo)
ZONA II (B): aw entre 0,3 e 0,8
água fracamente ligada ao alimento (água multicapa)
ZONA III (C): aw entre 0,8 e 0,99
água livre (presa fisicamente ao alimento)
facilmente eliminada por procedimentos de desidratação
disponível para desenvolvimento microbiano e reações químicas
limite entre as zonas I e II é denominado de MONOCAMADA BET
Isotermas são dependentes da temperatura
(mais importante para valores de aw inferiores a 0,5)
HISTERESE
Histerese é a diferença entre a isoterma de adsorção
(hidratação) e de dessorção (desidratação)
Na mesma aw e temperatura = maior conteúdo de
água na dessorção do que na hidratação
Ocorre principalmente na zona II
Parâmetro muito importante para a reidratação de
produtos desidratados
Ex.: diferença de isotermas de celulose microcristalina
Por que ocorre a histerese?
Na dessorção, praticamente toda água ligada é
eliminada, enquanto na adsorção, a água encontra
menos pontos de interações com o alimento,
devido interações entre constituintes não aquosos
Os capilares do alimento
retêm água na adsorção,
dificultando a distribuição
da água captada
Pressão de vapor da água é
maior para penetrar nos
capilares do alimento do que
para sair
Grau de histerese depende da:
Natureza do alimento (constituintes, forma, viscosidade, ...)
Temperatura
Velocidade de dessorção
Quantidade de água eliminada na dessorção
Influência da composição e estado físico de
um alimento sobre a fixação de água
Proteínas e amido retêm mais água na região inferior
da isoterma do que lipídios e açúcares
Frutas desidratadas (↑ açúcares) são higroscópicas em
“alta” umidade relativa (ex.: sacarose, mas não é
estável, pois cristaliza e perde água)
O estado físico (cristalino/amorfo) e a granulometria
afetam na fixação de água
pH e força iônica afetam a fixação de água em
alimentos proteicos
ISOTERMAS DE ADSORÇÃO DE ÁGUA PARA DIVERSOS ALIMENTOS
aw e CONSERVAÇÃO DOS ALIMENTOS
Oxidação de lipídios (rancificação)
É uma das principais alterações em alimentos
Ocorre mais intensamente em baixa e alta umidades
Em baixa aw (0 a 0,2), oxigênio age sobre ácidos graxos:
Produz compostos voláteis e odores desagradáveis
Destrói vitaminas lipossolúveis pela ação de radicais livres
Forma compostos tóxicos
Altera textura dos alimentos proteicos, diminuindo
solubilidade, digestibilidade e valor nutricional das
proteínas
Formação de compostos carboxílicos que podem participar
de reações de escurecimento não enzimático
Um pouco de água diminui contato dos lipídios com
oxigênio
Mas como os lipídios são fluidos, permitem a mobilidade
de algumas enzimas
Água em excesso (a partir de aw 0,5) a água favorece a
oxidação dos lipídios, pela:
Formação de peróxidos
Formação de radicais livres
Mobilidade de íons, metais, ...
Máxima estabilidade ocorre na área próxima à
camada monomolecular de água
Diversos alimentos requerem antioxidantes como EDTA
(hidrossolúvel) e BHT (lipossolúvel)
Escurecimento não enzimático
Inicialmente, observa-se aumento destas reações com o
incremento da aw
Reações de Maillard: condensação de compostos com
grupamentos carbonila (açúcares redutores) e amínicos
(aminoácidos e proteínas)
Caramelização: degradação de açúcares redutores e
não redutores com formação de polímeros pardos
Alteram a cor e o sabor dos alimentos
Reduzem o valor nutricional dos alimentos
Estas reações são favorecidas em maior aw, pois a
água serve como meio de movimentação dos substratos
(açúcares e proteínas)
-
-
Após atingir um pico de velocidade, a intensidade
destas reações diminui, supostamente por:
Excesso de água prejudicar o equilíbrio das reações,
já que é um produto destas reações
Diluição dos constituintes
OXIDAÇÃO DE LIPÍDIOS + ESCURECIMENTO NÃO ENZIMÁTICO:
Fatores limitantes para conservação de um alimento com
baixo e médio conteúdo de água
Reações enzimáticas
Maior teor de água favorece o encontro das enzimas
com os substratos
As principais enzimas que alteram os alimentos são as
amilases, proteases e lipases, que podem ser
constituintes normais dos alimentos ou provenientes de
microrganismos
BRANQUEAMENTO = Procedimento que pode ser
realizado previamente à desidratação ou
congelamento dos vegetais para inativar enzimas
Desenvolvimento de microrganismos
Em aw<0,6 o alimento pode ser considerado
microbiologicamente estável
A aw limitante para o desenvolvimento de
microrganismos depende de:
pH
Temperatura
Potencial
de oxirredução
Nutrientes disponíveis
Natureza do soluto se empregado para ↓ aw
Bactérias exigem ↑ aw para desenvolvimento:
Fungos
produtores de micotoxinas se desenvolvem
apenas a partir de 0,7
Abaixo de 0,86 não ocorre desenvolvimento de
bactérias patogênicas
DIAGRAMA DE ESTADO
Relaciona TEMPERATURA e COMPOSIÇÃO do
alimento
Em pressão constante
Através de um sistema aquoso binário (soluto único)
Como alimentos são “sistemas complexos”...
Não podem ser representados por diagramas de estado
binários
Necessitam de diversos diagramas para representar suas
diferentes regiões e componentes
Uma aproximação pode ser representada pelo soluto
dominante
TLm: linha de ponto de
derretimento
TSm: linha de saturação
Tg: transição vítrea
Td: desvitrificação
Diversos
procedimentos de
conservação dos
alimentos visam
diminuir a mobilidade
Concentração
Resfriamento, ...
MOBILIDADE MOLECULAR (Mm)
Também conhecida como MOBILIDADE DE SOLUTOS
aw permite apenas uma estimativa incerta da vida de
prateleira dos alimentos, pois não há como prever
zonas de maior ou menor movimentação de moléculas
Mm relaciona propriedades dos alimentos com a
difusão
Teoricamente, é o melhor indicador da estabilidade
dos alimentos, porém de pouca viabilidade prática
(por isso aw é mais utilizada)
Em temperatura ambiente as reações
não costumam ser limitadas pela difusão
Taxa de reação química depende de:
D = difusão (probabilidade de encontro)
A = colisão (frequência/tempo)
Ea = energia de ativação
Já em alimentos desidratados,
resfriados, concentrados, ... há menos
água disponível como solvente ou
reagente
Zonas de água líquida podem formar
soluções altamente concentradas e
viscosas no alimento... até estado vítreo
Era isso...