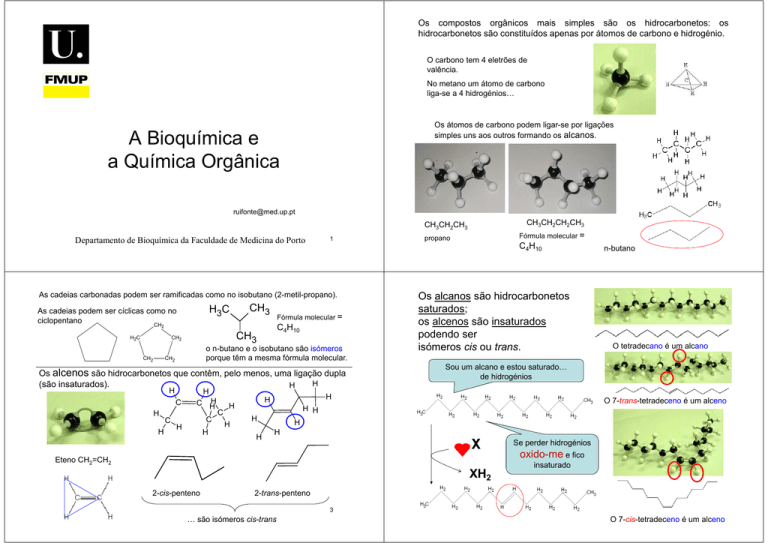
Os compostos orgânicos mais simples são os hidrocarbonetos: os
hidrocarbonetos são constituídos apenas por átomos de carbono e hidrogénio.
O carbono tem 4 eletrões de
valência.
No metano um átomo de carbono
liga-se a 4 hidrogénios…
Os átomos de carbono podem ligar-se por ligações
simples uns aos outros formando os alcanos.
A Bioquímica e
a Química Orgânica
[email protected]
CH3CH2CH2CH3
CH3CH2CH3
Departamento de Bioquímica da Faculdade de Medicina do Porto
1
C4H10
As cadeias carbonadas podem ser ramificadas como no isobutano (2-metil-propano).
H 3C
As cadeias podem ser cíclicas como no
ciclopentano
CH
CH3
Fórmula molecular =
C4H10
2
H2C
CH3
CH2
CH2
o n-butano e o isobutano são isómeros
porque têm a mesma fórmula molecular.
CH2
Os alcenos são hidrocarbonetos que contêm, pelo menos, uma ligação dupla
H
(são insaturados).
H
H
C
H
H
C
H
H
C H
C
H
H
C
H
Os alcanos são hidrocarbonetos
saturados;
os alcenos são insaturados
podendo ser
isómeros cis ou trans.
2
n-butano
O tetradecano é um alcano
Sou um alcano e estou saturado…
de hidrogénios
H
H
H
Fórmula molecular =
propano
O 7-trans-tetradeceno é um alceno
H H
H
H
H
H
Se perder hidrogénios
oxido-me e fico
Eteno CH2=CH2
XH2
2-cis-penteno
insaturado
2-trans-penteno
3
… são isómeros cis-trans
4
O 7-cis-tetradeceno é um alceno
O benzeno é um hidrocarboneto aromático: é um anel
com 6 carbonos e 3 duplas ligações conjugadas.
Os
hidrocarbonetos
costumam
classificar-se em
Tal como o colesterol também o metanol
e o etanol contêm um grupo hidroxilo:
são álcoois.
Aromáticos: com um ou mais anéis benzénicos
O glicerol é um poliálcool e
contém 2 hidroxilos primários
e 1 secundário.
Alifáticos: cadeias carbonadas lineares ou ramificadas
(ou cíclicas mas sem duplas ligações conjugadas)
A fenilalanina contém um anel benzénico: é um aminoácido
aromático.
Os éteres (R1-O-R2) podem ser
entendidos como resultando da ligação de
2 álcoois com perda de água: o éter etílico
é formado por 2 resíduos de etanol.
perhidro-fenantreno
Alguns lipídeos complexos contêm uma
ligação éter entre o resíduo de um
álcool gordo e o resíduo de glicerol
ciclopentano
Colesterol: ciclopentano-perhidro-fenantreno
Fenantreno
hidroxilado no carbono 3, dupla ligação no carbono 5,
5
dois grupos metilo (nos carbonos 10 e 13) e
uma cadeia alifática ramificada com 8 carbonos no carbono 17.
Se substituirmos o átomo de O por um átomo de S num grupo hidroxilo (-OH)
obtemos um grupo tiol (-SH).
6
No éter etílico (R1-O-R2), R1 e R2 são grupos etilo
Um plasmalógeno
Quando dois compostos que contêm grupos tiol reagem entre si com perda de
átomos de hidrogénio (oxidação) e ficam ligados pelos átomos de enxofre, a
ligação resultante diz-se dissulfureto (R-S-S-R).
Estou oxidado
porque perdi
hidrogénios
Glutatião (forma reduzida); GSH
GSH
XH2
GSSG
GSH
Cisteína
Coenzima A (CoA ou CoASH)
Grupo (ou ligação) dissulfureto
7
Dissulfureto do glutatião (forma oxidada); GSSG
Na metionina (um aminoácido) um grupo
metilo liga-se à restante molécula por uma
ligação sulfureto (R-S-R).
8
Os aldeídos têm grupos C=O;
o aldeído mais simples é o metanal,
cujo nome vulgar é “formol”.
CH2O
Os glicídeos (= hidratos de carbono) são derivados aldeídicos
(aldoses) ou cetónicos (cetoses) de poliálcoois.
O
HC
A oxidação de hidroxilos primários dá origem a aldeídos.
HO
A oxidação do etanol dá origem ao etanal (ou acetaldeído).
Com a perda
de hidrogénios
fiquei mais
oxidado que o
etanol
C
H2C
gliceraldeído
O gliceraldeído (aldotriose)
OH
H2C
e a dihidroxiacetona (cetotriose)
H
OH
são os monossacarídeos mais simples
…e são isómeros entre si;
isómeros “de posição” pois
diferem na posição do grupo
carbonilo.
H2C
dihidroxiacetona
A oxidação de hidroxilos secundários dá origem a cetonas.
A oxidação do 2-propanol dá origem à propanona (ou acetona).
9
grupos aldeído e cetónico = grupo carbonilo (nome coletivo)
Os monossacarídeos (ou oses) com número de carbonos superior a 4
são mais estáveis quando formam estruturas cíclicas que nas formas
lineares.
O rearranjo molecular
que resulta da reação
entre um grupo
carbonilo e um grupo
hidroxilo chama-se:
grupo (ou ligação)
semiacetal
HC
OH
H
C
OH
a frutose (uma cetohexose)
HO
C
H
também
H
C
OH
H
C
OH
H2C
glicose
H2C
A glicose (uma aldohexose) e
OH
são monossacarídeos
…e também são isómeros entre si;
isómeros de posição.
C6H12O6
C
O
HO
C
H
H
C
OH
H
C
OH
H2C
frutose
OH
10
Os acetais podem ser compreendidos como resultando da
reação entre um semiacetal e um álcool com perda de água.
Glicose
(180 g / mol)
Glicose
(180 g /
mol)
um resíduo de
glicose →
← outro resíduo
de glicose
Ligação acetal
11
OH
C3H6O3
O
Com a perda
de hidrogénios
fiquei mais
oxidado que o
2-propanol
O
C
Maltose
(342 g / mol)
A hidrólise (a reação inversa da reação representada) da ligação acetal (ou
glicosídica tipo O) da maltose leva à libertação de duas moléculas de glicose
12:
a maltose é formada por dois resíduos de glicose.
Em Bioquímica, se não estamos a tratar de reações ácido base, pode dizer-se
palmitato (ou ácido palmítico) para nos referirmos coletivamente ao conjunto:
A oxidação de grupos aldeído origina grupos carboxilo. Os
compostos que têm grupos carboxilo são ácidos carboxílicos.
Ao perder um protão fiquei
desprotonado; neste caso tb fiquei
com carga elétrica: fiquei ionizado
Ao ganhar um
oxigénio fiquei
oxidado
ácido palmítico
C
H3C
+ palmitato
ácido
acético
O
OH
C
H3C
acetato
O
O
-
…a mesma regra se aplica a todos os ácidos e respetivas bases (ou sais).
acetaldeído
Reação de dissociação
protónica (ou protólise).
Ácido propiónico ou propionato
Ácido pirúvico ou piruvato
Ácido láctico ou lactato
Os grupos carboxílicos
que sofreram
dissociação protónica
chamam-se grupos
carboxilato.
Reação de
oxidação
Em Bioquímica, se não estivermos a falar de reações ácido-base (como as de
13
dissociação protónica), podemos dizer ácido acético (ou acetato) para nos
referirmos coletivamente ao conjunto ácido acético + acetato.
Ácido succínico ou
succinato
Ácido cítrico ou
14
citrato
Quando um ácido
carboxílico é
dissolvido em água
tende a ionizar-se
(sofrer protólise)
libertando protões e
o despectivo sal (ou
base).
Quando uma
base é dissolvida
num meio que
contém protões
tende a ligar
protões
convertendo-se
no ácido
correspondente.
Resumindo. Quando um álcool se oxida gera-se um aldeído (ou uma cetona).
Quando um aldeído se oxida gera-se um ácido carboxílico. Quando um ácido
carboxílico sofre protólise gera-se o sal (ou base) correspondente.
CH3CHOHCOOH → CH3CHOHCOO- + H+
CH3CHOHCOO- + H+ → CH3CHOHCOOH
A ligação de um grupo carbonilo
a um grupo hidroxilo com
rearranjo molecular gera uma
ligação semiacetal
etanol
Quando o pH do meio é mantido a um determinado valor a proporção relativa das
formas dissociada (desligada do protão) e não dissociada (ligada ao protão) depende
da força do ácido e do valor do pH. O pKa do ácido láctico é 3,7…
acetaldeído
ácido acético
acetato
A ligação de um grupo semiacetal
a um álcool com perda de água
gera uma ligação acetal.
Semiacetal + hidroxilo
H2O
pH = 1
>
pH = 3,7
=
pH = 7
<
15
16
Os ésteres podem ser entendidos como resultando da reação entre um álcool
e um ácido com perda de água: a hidrólise de um éster liberta os resíduos
constituintes do éster, ácido + álcool.
Um éster de colesterol é
formado por um resíduo
de colesterol e um
resíduo de um ácido.
A hidrólise de um tioéster liberta ácido + tiol: a acetil-coenzima A contém
coenzima A ligada ao ácido acético (acetato) por uma ligação tioéster.
colesterol
ácido gordo
Acetil-CoA
+ H 2O
→
CoA
+ ácido acético
Ao contrário dos grupos ésteres (e tioésteres) que são apróticos (não ligam nem
libertam protões) um dos produtos da sua hidrólise é um ácido.
H2O
Um triacilglicerol
glicerol + 3 ácidos gordos
17
hidrólise
Os ésteres são muito mais hidrofóbicos que os álcoois e os ácidos que os constituem.
Quando, num éster, o ácido é o ácido fosfórico (ou o seu sal, o
fosfato) a ligação diz-se fosfoéster.
A hidrólise da ligação
Ácido fosfórico; Pi
fosfoéster que
existe na glicose-6fosfato leva à
libertação de glicose
+ fosfato (ou Pi);
Glicose6-fosfato
glicose
a glicose-6-fosfato
contém um resíduo
de glicose e outro
resíduo de fosfato.
18
protólise
As ligações que podem ser entendidas como resultando da reação entre dois
ácidos (ou sais) com perda de água designam-se de ligações anidrido.
grupo
carboxilo
ligação
anidrido
ácido fosfórico;
fosfato inorgânico; Pi
A hidrólise da ligação fosfoanidrido (liga dois fosfatos) do pirofosfato (ou difosfato) gera
fosfato inorgânico: PPi + H2O → 2 Pi. O pirofosfato contém dois resíduos de fosfato.
Quando, num éster, o ácido é o ácido sulfúrico (ou o seu sal, o sulfato) a ligação diz-se
sulfoéster.
Pi
Pi
PPi
A hidrólise da ligação fosfoanidrido que liga os fosfatos beta (β
β) e gama (γγ ) do ATP
gera fosfato inorgânico + ADP:
ATP + H2O → ADP + Pi.
Ácido sulfúrico
Glicose3-sulfato
glicose
A glicose-3-sulfato
contém um
resíduo de glicose
e outro de sulfato
19
ligados por uma
ligação sulfoéster
ATP
γ
β
α
ADP
20
O amoníaco (NH3)
é uma base que,
quando aceita um
protão, se converte
no
ião amónio (NH4+).
Resumindo. Quando um éter sofre hidrólise libertam-se dois álcoois.
acetal + H2O →
semiacetal + álcool
éster + H2O → ácido + álcool
tioéster + H2O → ácido + tiol
As aminas resultam da substituição de um ou mais hidrogénios
do amoníaco (ou do ião amónio) por cadeias carbonadas.
fosfoéster + H2O →
ácido fosfórico (fosfato) + álcool
OH
sulfoéster + H2O →
ácido sulfúrico (sulfato) + álcool
H
anidrido + H2O → 2 ácidos (sais)
OH
amida + H2O →
ácido + amina ou amoníaco (amónio)
21
prolina
(contém amina
secundária =
azoto liga-se a
2 carbonos)
lisina
H
N
H
Glicosamina
22
Glicosamina com o grupo amina protonado
Os aminoácidos são compostos orgânicos que contém, pelo menos, um
grupo carboxílico e um grupo amina.
Nos aminoácidos que fazem parte das proteínas existe sempre um grupo
amina no carbono 2 (ou α) e um grupo carboxílico que contém o carbono 1.
São exemplos:
histidina (contém anel
imidazol… que é um
heterociclo aromático)
H
H
E também:
glicina,
o aminoácido mais
simples
H
HO
fosfoanidrido + H2O →
2 ácido fosfórico (fosfatos)
(também
contém
um grupo
amina no
carbono
6)
O OH
H
Os grupos amida podem ser compreendidos como sendo o resultado da
reação entre um ácido e o amoníaco (ou de um ácido e um grupo amina) com
perda de água.
amida
A hidrólise de uma
amida gera um
ácido e amoníaco...
R
N C
H
O
amoníaco
…que aceitando um protão se converte em amónio.
(ao contrário do amoníaco e das aminas, os grupos
amida não aceitam nem cedem protões: são apróticos)
glutamina
glutamato
ou ácido
glutâmico
(contém
grupo
carboxilo
no carbono
5)
H
H+
amónio
ácido
carboxílico
NH4+
amoníaco
ácido
glutâmico
triptofano (contém anel indol
23
…que é um heterociclo
aromático)
A glutamina é um aminoácido com um grupo amida no carbono 5;
a hidrólise do grupo amida gera amónio e glutamato...
24
Nos peptídeos e nas proteínas os resíduos dos aminoácidos estão ligados por
ligações amida. Quando a ligação amida envolve o grupo α-amina de um
aminoácido e o grupo carboxílico do carbono 1 doutro aminoácido a ligação
diz-se peptídica.
Uma molécula diz-se quiral quando a sua imagem num espelho plano não
é sobreponível consigo própria mesmo se a rodarmos e fizermos rodar as
ligações simples.
glicil-glicina
α
α
H2O
glicina + glicina
ligação amida; neste caso tb se
diz peptídica
A hidrólise completa de
uma proteína (das suas
ligações peptídicas)
liberta os aminoácidos
constituintes dessa
proteína.
“As nossas mãos são enantiómeros.
Estes dois modelos
representam a mesma
molécula: a glicina, o único
aminoácido “relevante” que não
tem carbonos assimétricos.
O único carbono assimétrico do(s)
gliceraldeído(s) é o carbono 2.
n H2O
Todas as moléculas quirais
têm, pelo menos, um
Nas proteínas as ligações
aminoácido-aminoácido são
ligações peptídicas.
Ao contrário dos
gliceraldeídos L e D, a
glicina e a dihidroxiacetona
não são moléculas quirais
(não têm nenhum carbono
assimétrico).
“
O gliceraldeído-L
e o gliceraldeído-D são
moléculas quirais; entre si são enantiómeros
(um tipo de isómeros óticos).
25
O
O
O
O
N
N
De acordo com a convenção
de Fischer, quando se
representam no plano do papel
estruturas com carbonos
assimétricos, os carbonos
alinham-se por ordem
numérica na vertical e os
carbonos a ele ligados estão,
na estrutura tridimensional,
atrás do plano do papel.
carbono assimétrico: um
carbono ligada a quatro
átomos (ou grupos de
26 .
átomos) todos diferentes
Sempre o mesmo gliceraldeído-D
A identidade dos dois modelos fica evidente se fizermos
rodar a ligação (simples) assinalada.
Tal como a glicina também a
dihidroxiacetona não tem carbonos
assimétricos.
Estes dois modelos representam a
mesma molécula: a dihidroxiacetona
(a cetose mais simples).
A identidade dos dois modelos fica evidente
se fizermos rodar as ligações (simples)27
assinaladas.
gliceraldeído-L
gliceraldeído-D
Os gliceraldeídos L e D têm configurações invertidas no último (neste caso, o único)
28
carbono assimétrico. Orientados de acordo com a convenção de Fischer, o hidroxilo
deste carbono fica à esquerda no gliceraldeído-L e à direita no gliceraldeído-D.
As enzimas distinguem os isómeros D e L porque (em geral) apenas uma
delas tem uma estrutura que é complementar e “encaixa” no centro cativo da
enzima.
Enzima que liga o
gliceraldeído-D
A glicose-L e a glicose-D são enantiómeros e distinguem-se por terem uma
configuração invertida em todos os carbonos assimétricos (os carbonos 2, 3,
4 e 5).
As plantas
e os
animais
sintetizam
glicose-D.
A glicose-L
sintetizase no
laboratório
Gliceraldeído-D
Gliceraldeído-L
Isto permite compreender que na esmagadora maioria dos casos só exista na natureza
um dos enantiómeros de uma determinada substância.
Por isso, num contexto bioquímico, é desnecessário dizer gliceraldeído-D,
glicose-D, lactato-L ou alanina-L
…nos seres vivos
todo o gliceraldeído é gliceraldeído-D
toda a glicose é glicose-D
todo o lactato é lactato-L
29
toda a alanina é alanina-L
A galactose, a glicose e a manose são monossacarídeos distintos e
todos têm 4 carbonos assimétricos. São todos de tipo D porque no
último carbono assimétrico (o carbono 5) o OH está virado para a
direita.
Último
carbono
assimétrico
com OH
virado para
a esquerda.
Último
carbono
assimétrico
com OH
virado para
a direita.
30
As moléculas das glicoses L e D são a imagem em espelho uma da outra.
A alanina-L e a alanina-D também são enantiómeros.
Mas porque só têm um carbono assimétrico também se dizem epímeros.
Só a alanina-L faz parte das proteínas.
A galactose e a
glicose são
epímeros entre si
A glicose e a
manose são
epímeros entre si
A galactose
e
são diasteroisómeros.
alanina-L
Em certas bactérias intestinais,
os aminoácidos de tipo D
(como a alanina-D)
podem existir como substâncias
isoladas ou em peptídeos com
poucos resíduos (menos de 10).
alanina-D
Com a exceção da glicina (que não é quiral) “todos” os aminoácidos são de tipo L.
a manose
Nos seres vivos todo o
lactato é
lactato-L.
lactato-L
31
O lactato-D
é uma substância que
pode ser obtida no
laboratório mas não
existe nos seres vivos.
lactato-D
Nota: moléculas representadas respeitando convenção de Fischer. O grupo amina32está
voltado para a esquerda no carbono assimétrico (o único) da alanina L; por isso é L.
Quando as oses (monossacarídeos) assumem a forma cíclica (formação do
semiacetal) passa a haver mais um carbono assimétrico (o que na forma linear
era o do grupo carbonilo) que passa a designar-se de carbono anomérico.
A glicose α e a glicose β são um tipo particular de isómeros óticos:
Na maltose o resíduo de glicose que contribuí para a ligação acetal (glicosídica tipo O)
com o grupo semi-acetal é o anómero α e a ligação diz-se α (1→4).
Na celobiose o resíduo de glicose que contribuí para a ligação acetal (glicosídica tipo
O) com o grupo semi-acetal é o anómero β e a ligação diz-se β (1→4).
são anómeros.
Glicose α
Glicose β
α(1→4)
A glicose α e a glicose β estão em equilíbrio químico (não enzímico)
interconvertendo-se uma na outra via forma linear.
β(1→4)
34
33
Resumindo isomerias:
Isómeros são substâncias diferentes com a mesma fórmula molecular. Podem ser:
Bibliografia
a) isómeros de cadeia como no caso do n-butano e do 2-metil-propano.
1. Chang, R. (1994) Química, 5ª edn, McGraw-Hill, Lisboa.
2. Meisenberg, G. & Simmons, W. H. (1998) Principles of Medical
Biochemistry, Mosby, St. Louis.
3. Murray, R. K., Granner, D. K. & Rodwell, V. W. (2006) Harper's Illustrated
Biochemistry, 27th edn, Lange, Boston.
4. Vargas, J. J. & Macarulla, J. (1979) Fisiquimica fisiologica, 5ª edn,
Interamerica, Madrid.
5. Morrison, R. & Boyd, R. (1992) Química Orgânica, 13ª edn, Fundação
Caloust Gulbenkian, Lisboa.
6. Fontes R., Alçada M.N. (2011) A Bioquímica e a Química Orgânica.
b) isómeros de posição como no caso do gliceraldeído (D ou L) e da dihidroxiacetona.
c) isómeros cis-trans como no caso do 2-trans-buteno e do 2-cis-buteno.
d) isómeros óticos (diferem na configuração dos “substituintes” ligados aos carbonos
assimétricos)
(dois isómeros óticos são sempre compostos quirais:
compostos com, pelo menos, um carbono assimétrico,
como os casos da glicose-D ou da alanina-L)
1- O antónimo de enantiómeros (como no caso das glicoses D e L) é
diasteroisómeros (como o caso da galactose-D e manose-D)
Isómeros 2- Duas substâncias são
óticos
epímeros uma da outra
quando se distinguem na
configuração de apenas um
carbono assimétrico.
2a- Simultaneamente epímeros e
enantiómeros
(caso do lactato-L e lactato-D).
2b-Simultaneamente epímeros e
diasteroisómeros (caso do galactose-D e
glicose-D; também da manose-D e glicose-D).
Os anómeros são um caso particular dentro dos epímeros-diasteroisómeros;
caso da glicose-D-α e glicose-D-β
35
36