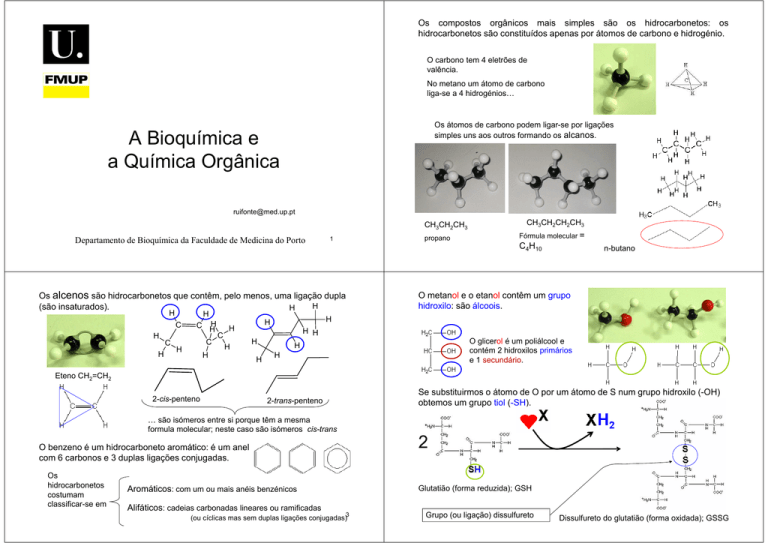
Os compostos orgânicos mais simples são os hidrocarbonetos: os
hidrocarbonetos são constituídos apenas por átomos de carbono e hidrogénio.
O carbono tem 4 eletrões de
valência.
No metano um átomo de carbono
liga-se a 4 hidrogénios…
Os átomos de carbono podem ligar-se por ligações
simples uns aos outros formando os alcanos.
A Bioquímica e
a Química Orgânica
[email protected]
CH3CH2CH3
Departamento de Bioquímica da Faculdade de Medicina do Porto
propano
1
C
H
H
C
H
H
C H
C
H
C
H
H
2
n-butano
O metanol e o etanol contêm um grupo
hidroxilo: são álcoois.
H
H
H
Fórmula molecular =
C4H10
Os alcenos são hidrocarbonetos que contêm, pelo menos, uma ligação dupla
H
(são insaturados).
H
H
CH3CH2CH2CH3
H H
H
H
O glicerol é um poliálcool e
contém 2 hidroxilos primários
e 1 secundário.
H
H
Eteno CH2=CH2
2-cis-penteno
Se substituirmos o átomo de O por um átomo de S num grupo hidroxilo (-OH)
obtemos um grupo tiol (-SH).
2-trans-penteno
… são isómeros entre si porque têm a mesma
formula molecular; neste caso são isómeros cis-trans
2
O benzeno é um hidrocarboneto aromático: é um anel
com 6 carbonos e 3 duplas ligações conjugadas.
Os
hidrocarbonetos
costumam
classificar-se em
Glutatião (forma reduzida); GSH
Aromáticos: com um ou mais anéis benzénicos
Alifáticos: cadeias carbonadas lineares ou ramificadas
3
(ou cíclicas mas sem duplas ligações conjugadas)
Grupo (ou ligação) dissulfureto
Dissulfureto do glutatião (forma oxidada); GSSG
Os aldeídos têm grupos C=O;
o aldeído mais simples é o metanal,
cujo nome vulgar é “formol”.
CH2O
Os glicídeos (= hidratos de carbono) são derivados aldeídicos
(aldoses) ou cetónicos (cetoses) de poliálcoois.
O
HC
A oxidação de hidroxilos primários dá origem a aldeídos.
HO
A oxidação do etanol dá origem ao etanal (ou acetaldeído).
Com a perda
de hidrogénios
fiquei mais
oxidado que o
etanol
C
H2C
gliceraldeído
O gliceraldeído (aldotriose)
OH
H2C
e a dihidroxiacetona (cetotriose)
H
OH
são os monossacarídeos mais simples
…e são isómeros entre si;
isómeros “de posição” pois
diferem na posição do grupo
carbonilo.
H2C
dihidroxiacetona
A oxidação de hidroxilos secundários dá origem a cetonas.
A oxidação do 2-propanol dá origem à propanona (ou acetona).
5
grupos aldeído e cetónico = grupo carbonilo (nome coletivo)
Os monossacarídeos (ou oses) com número de carbonos superior a 4
tendem a formar estruturas cíclicas; as moléculas na forma cíclica são
muito mais abundantes que as que estão na forma linear.
O rearranjo molecular
que resulta da reação
entre um grupo
carbonilo e um grupo
hidroxilo chama-se:
grupo (ou ligação)
semiacetal
HC
OH
H
C
OH
a frutose (uma cetohexose)
HO
C
H
também
H
C
OH
H
C
OH
H2C
glicose
H2C
A glicose (uma aldohexose) e
OH
são monossacarídeos
…e também são isómeros entre si;
isómeros de posição.
C6H12O6
C
O
HO
C
H
H
C
OH
H
C
OH
H2C
frutose
OH
6
Os acetais podem ser compreendidos como resultando da
reação entre um semiacetal e um álcool com perda de água.
Glicose
(180 g / mol)
Glicose
(180 g /
mol)
um resíduo de
glicose →
← outro resíduo
de glicose
Ligação acetal
7
OH
C3H6O3
O
Com a perda
de hidrogénios
fiquei mais
oxidado que o
2-propanol
O
C
Maltose
(342 g / mol)
A hidrólise (a reação inversa da reação representada) da ligação acetal (ou
glicosídica tipo O) da maltose leva à libertação de duas moléculas de glicose8:
a maltose é formada por dois resíduos de glicose.
Resumindo. Quando um álcool se oxida gera-se um aldeído (ou uma cetona).
Quando um aldeído se oxida gera-se um ácido carboxílico. Quando um ácido
carboxílico sofre protólise gera-se o sal (ou base) correspondente.
A oxidação de grupos aldeído origina grupos carboxilo. Os
compostos que têm grupos carboxilo são ácidos carboxílicos.
Ao perder um protão fiquei
Ao ganhar um
oxigénio fiquei
desprotonado; neste caso tb fiquei
oxidado
com carga elétrica: fiquei ionizado
acetato
etanol
ácido
acético
acetaldeído
acetaldeído
A ligação de um grupo carbonilo
a um grupo hidroxilo com
rearranjo molecular gera uma
ligação semiacetal
Reação de dissociação
protónica (ou protólise).
ácido acético
A ligação de um grupo semiacetal
a um álcool com perda de água
gera uma ligação acetal.
Semiacetal + hidroxilo
Os grupos carboxílicos
que sofreram
dissociação protónica
chamam-se grupos
carboxilato.
Reação de
oxidação
acetato
H2O
Em Bioquímica, se não estivermos a falar de reações ácido-base (como as de
9
dissociação protónica), podemos dizer ácido acético (ou acetato) para nos
referirmos coletivamente ao conjunto ácido acético + acetato.
Os ésteres podem ser entendidos como resultando da reação entre um álcool
e um ácido com perda de água: a hidrólise de um éster liberta os resíduos
constituintes do éster, ácido + álcool.
10
Quando, num éster, o ácido é o ácido fosfórico (ou o seu sal, o
fosfato) a ligação diz-se fosfoéster.
A hidrólise da
ligação
Ácido fosfórico; Pi
fosfoéster que
Glicose6-fosfato
glicose
Um triacilglicerol
As ligações que podem ser entendidas como resultando da
reação entre dois ácidos (ou sais) com perda de água designamse de ligações anidrido. Se os 2 ácidos forem o ácido fosfórico a ligação
glicerol + 3 ácidos gordos
Ao contrário dos grupos ésteres que são apróticos (não ligam nem libertam
protões) um dos produtos da sua hidrólise é um ácido.
diz-se fosfoanidrido. A hidrólise da ligação fosfoanidrido que liga os fosfatos beta (β
β)
e gama (γγ ) do ATP gera ADP + fosfato inorgânico (Pi) .
ATP + H2O → ADP + Pi.
H2O
hidrólise
ATP
protólise
existe na
glicose-6-fosfato
leva à libertação
de glicose +
fosfato (ou Pi).
11
γ
β
α
ADP
12
O amoníaco (NH3)
é uma base que, quando
aceita um protão, se
converte no
ião amónio (NH4+).
O OH
OH
H
H
N
R
N C
H
O
amoníaco
(ao contrário do amoníaco e das aminas, os grupos
amida não aceitam nem cedem protões: são apróticos)
OH
glutamina
Glicosamina com o grupo
amina protonado
H
H
A hidrólise de uma
amida gera um
ácido e amoníaco...
ácido
carboxílico
…que aceitando um protão se converte em amónio.
As aminas resultam da substituição de um ou mais hidrogénios do amoníaco (ou do
ião amónio) por cadeias carbonadas.
H
Os grupos amida podem ser compreendidos como sendo o resultado da
reação entre um ácido e o amoníaco (ou de um ácido e um grupo amina) com
perda de água.
amida
H+
amónio
NH4+
amoníaco
H
HO
H
H
ácido
glutâmico
Os aminoácidos são compostos
orgânicos que contém, pelo menos, um
grupo carboxílico e um grupo amina.
glicina,
o aminoácido mais
simples
13
A glutamina é um aminoácido com um grupo amida no carbono 5;
a hidrólise do grupo amida gera amónio e glutamato...
14
Ao contrário dos gliceraldeídos L e D, a glicina não é uma molécula quiral (não
têm nenhum carbono assimétrico).
Uma molécula diz-se quiral quando a sua imagem num espelho plano não
é sobreponível consigo própria mesmo se a rodarmos e fizermos rodar as
ligações simples.
Estes dois modelos representam a mesma molécula:
a glicina, o único aminoácido “relevante” que não tem
carbonos assimétricos.
O
O
“As nossas mãos são enantiómeros.
O
O
“
O único carbono assimétrico do(s)
gliceraldeído(s) é o carbono 2.
N
N
Todas as moléculas quirais
têm, pelo menos, um
O gliceraldeído-L
e o gliceraldeído-D são
moléculas quirais; entre si são enantiómeros
(um tipo de isómeros óticos).
carbono assimétrico: um
carbono ligada a quatro
átomos (ou grupos de
15 .
átomos) todos diferentes
A identidade dos dois modelos fica evidente se fizermos rodar a ligação (simples) assinalada.
16
De acordo com a convenção
de Fischer, quando se
representam no plano do papel
estruturas com carbonos
assimétricos, os carbonos
alinham-se por ordem
numérica na vertical e os
carbonos a ele ligados estão,
na estrutura tridimensional,
atrás do plano do papel.
As enzimas distinguem os isómeros D e L porque (em geral) apenas uma
delas tem uma estrutura que é complementar e “encaixa” no centro cativo da
enzima.
Enzima que liga o
gliceraldeído-D
Sempre o mesmo gliceraldeído-D
Gliceraldeído-D
Gliceraldeído-L
Isto permite compreender que na esmagadora maioria dos casos só exista na natureza
um dos enantiómeros de uma determinada substância.
gliceraldeído-L
gliceraldeído-D
Por isso, num contexto bioquímico, é desnecessário dizer gliceraldeído-D,
glicose-D, lactato-L ou alanina-L
…nos seres vivos
Os gliceraldeídos L e D têm configurações invertidas no último (neste caso, o único)
17
carbono assimétrico. Orientados de acordo com a convenção de Fischer, o hidroxilo
deste carbono fica à esquerda no gliceraldeído-L e à direita no gliceraldeído-D.
A glicose-L e a glicose-D são enantiómeros e distinguem-se por terem uma
configuração invertida em todos os carbonos assimétricos (os carbonos 2, 3,
4 e 5).
A glicose-L
sintetizase no
laboratório
As plantas
e os
animais
sintetizam
glicose-D.
A galactose, a glicose e a manose são monossacarídeos distintos e
todos têm 4 carbonos assimétricos. São todos de tipo D porque no
último carbono assimétrico (o carbono 5) o OH está virado para a
direita.
A galactose e a
glicose são
epímeros entre si
A glicose e a
manose são
epímeros entre si
A galactose
Último
carbono
assimétrico
com OH
virado para
a esquerda.
todo o gliceraldeído é gliceraldeído-D
toda a glicose é glicose-D
todo o lactato é lactato-L
18
toda a alanina é alanina-L
e
são diasteroisómeros.
a manose
Último
carbono
assimétrico
com OH
virado para
a direita.
19
As moléculas das glicoses L e D são a imagem em espelho uma da outra.
20
Quando as oses (monossacarídeos) assumem a forma cíclica (formação do
semiacetal) passa a haver mais um carbono assimétrico (o que na forma linear
era o do grupo carbonilo) que passa a designar-se de carbono anomérico.
A glicose α e a glicose β são um tipo particular de isómeros óticos:
Na maltose o resíduo de glicose que contribuí para a ligação acetal (glicosídica tipo O)
com o grupo semi-acetal é o anómero α e a ligação diz-se α (1→4).
Na celobiose o resíduo de glicose que contribuí para a ligação acetal (glicosídica tipo
O) com o grupo semi-acetal é o anómero β e a ligação diz-se β (1→4).
são anómeros.
Glicose β
Glicose α
A glicose α e a glicose β estão em equilíbrio químico (não enzímico)
interconvertendo-se uma na outra via forma linear.
α(1→4)
21
Bibliografia
1. Chang, R. (1994) Química, 5ª edn, McGraw-Hill, Lisboa.
2. Meisenberg, G. & Simmons, W. H. (1998) Principles of Medical
Biochemistry, Mosby, St. Louis.
3. Murray, R. K., Granner, D. K. & Rodwell, V. W. (2006) Harper's Illustrated
Biochemistry, 27th edn, Lange, Boston.
4. Vargas, J. J. & Macarulla, J. (1979) Fisiquimica fisiologica, 5ª edn,
Interamerica, Madrid.
5. Morrison, R. & Boyd, R. (1992) Química Orgânica, 13ª edn, Fundação
Caloust Gulbenkian, Lisboa.
6. Fontes R., Alçada M.N. (2011) A Bioquímica e a Química Orgânica.
23
β(1→4)
22










