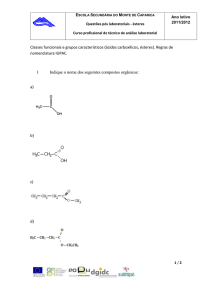
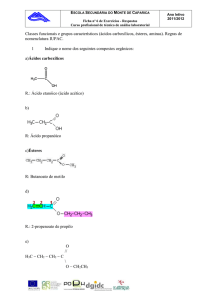
Obtenção
Os ésteres são compostos orgânicos cujas moléculas possuem
o grupo acilato (COO) ligado a doisradicais orgânicos (iguais ou
não) ou a um radical orgânico e um hidrogênio.
O grupo acilato dispõe-se na cadeia carbônica como um grupo carbonilo
ligado ao oxigênio (heteroátomo). Assim, a fórmula geral dos ésteres é
RCOOR’:
semelhante á classe dos enóis, muitos ésteres possuem odor agradável
característicos de frutos e podem ser obtidos através dos extratos de plantas
que têm na sua composição ésteres deácidos carboxílicos e alcoóis de
baixa massa molecular.
O
R-C
O
R-C
OH
Ácido carboxílico
O – R’
Éster orgânico
Nomenclatura Oficial
Para o radical R sem ramificações, deve-se nomeá-la de acordo com o
número de átomos de carbono; determina-se a saturação das ligações, para
em seguida, completar com o radical R’.
Caso o radical R seja ramificado, deve-se nomear os radicais de acordo com
a posição na cadeia (numerando-se os átomos de carbono); nomear a
cadeia R quanto ao número de átomos de carbono; determinar a saturação
das ligações e complementar com o radical R’.
deve-se completar a nomenclatura de todo o radical R com o sufixo ATO
Grupo orgânico
Nº DE ÁTOMOS DE
CARBONO
TIPO DE LIGAÇÃO
ENTRE C
PREFIXO
PARTE
INTERMEDIÁRIA
OATO
SUFIXO
de
que
substitui o
hidrogênio
A
Nomenclatura Usual
Os ésteres mais comuns recebem determinadas
nomeações para o radical R que fogem da
nomenclatura oficial:
Na saponificação há formação de um sal orgânico e um álcool. Sendo muito
utilizada na indústria de produtos de limpeza (sabões e detergentes),
alimentícia e de medicamentos.
A cera de abelha é um éster.
Os ésteres, nas condições ambientes, se apresentam como líquidos ou sólidos,
dependendo da quantidade de carbono.
Os primeiros membros da série, os que apresentam baixa massa molecular, são
líquidos incolores, de cheiro agradável. No entanto, à medida que se aumenta a
massa molecular, vão se tornando líquidos xaroposos, viscosos e gordurosos, até
se tornarem sólidos (aspecto de cera), daí ocorre a perda de cheiro agradável.
São compostos insolúveis em água, porém são solúveis em álcool, éter e
clorofórmio. Como não apresentam pontes de hidrogênio, os ésteres têm ponto de
ebulição menor que o dos álcoois e ácidos de mesma massa molecular.
Os ésteres são utilizados na preparação de extratos artificiais que imitam o
odor e o gosto de frutas, por isso são usados na fabricação de xaropes, doces,
pastilhas, refrescos, etc.
Os ésteres ocorrem naturalmente na natureza na forma de essências de frutas,
nos óleos e gorduras (glicéridos), nas ceras e nos fosfátides (lecitina do ovo e
cefalina do cérebro).
Vejamos para que são utilizadas cada uma dessas formas:
Essências: são usadas para imitar o sabor e o aroma de algumas frutas, são
também chamadas de flavorizantes ou aromatizantes e muito usadas em
indústria de alimentos para dar cheiro e sabor aos produtos. Exemplo: o
flavorizante acetato de pentila é um ingrediente do grupo dos ésteres, e é
usado para dar sabor artificial de banana em alimentos.
Óleos e gorduras: são os ésteres mais usados em nosso dia-a-dia, são
encontrados em produtos como óleo de soja, margarina e azeite de oliva.
Ceras: usadas na fabricação de graxas para sapatos, cera para dar brilho a
pisos, papel manteiga, velas, etc. A cera de abelha e a cera de carnaúba
também fazem parte da classe de ésteres.
Alguns ésteres são usados como medicamentos, os de cadeia carbônica mais
longa e que existem nos óleos e gorduras são aproveitados na produção de
sabões.
EXEMPLOS
O
Etanoato de
H3C - C
O – CH3
O
H3C- CH2 - C
O – CH2 - CH3
Propanoato de
etila
metila
H3C – O - CH3
H 3C – O
São compostos orgânicos em que o oxigênio está
diretamente ligado a duas cadeias carbônicas (ou
seja, a dois grupos alquila ou arila).
ÓXI
Grupo menor
Grupo maior
ÉTER
ílico
1º Grupo
2º Grupo
Ordem alfabética
EXEMPLOS
H3C – O – CH2 – CH3
Nomenclatura oficial: metóxi-etano
Nomenclaturas usuais: éter etílico-metílico ou éter etil-metílico
H3C – CH2 – O – CH2 – CH3
Nomenclatura oficial: etóxi-etano
Nomenclaturas usuais: éter dietílico ou éter etílico
Obtenção
Os ésteres são obtidos pela ação de um ácido orgânico ou inorgânico
sobre um álcool, com liberação de água. Assim, para que a reação seja
catalisada, pode-se adicionar ácido clorídrico (HCl) que, a partir da sua
dissociação, aumenta a concentração de íons H+ no meio e desloca o
equilíbrio da reação para o lado da formação do éster:
Observe que a reação de esterificação acima não é 100% completa (assim
como nenhuma outra). Portanto, coexistem num equilíbrio dinâmico o ácido
acético, o álcool etílico, o etanoato de etila e a água líquida.
A reação de saponificação, em meio básico, chega muito mais perto de 100%
de eficiência que a de esterificação. Consistindo na reação de um éster (de
origem vegetal ou animal) com uma base de Arrhenius
:
CH3-COO-CH3 + NaOH → [CH3-COO][Na] + CH3-OH
Na saponificação há formação de um sal orgânico e um álcool. Sendo muito
utilizada na indústria de produtos de limpeza (sabões e detergentes),
alimentícia e de medicamentos.
Obtenção
Exercícios
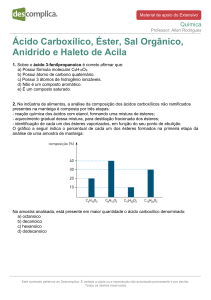
1 ) O aroma natural de baunilha, encontrado em doces e sorvetes, deve-se ao
composto de nome vanilina, cuja fórmula estrutural está reproduzida a seguir:
Em relação à molécula de vanilina, é
correto afirmar que as funções químicas
encontradas são:
a) hidrocarboneto, éter e éster
b) hidrocarboneto, ácido e fenol
c) aldeído, álcool e éter
d) aldeído, éster e fenol
e) aldeído, éter e fenol
2 )O butirato de etila, largamente utilizado na indústria, é a molécula que confere sabor de
abacaxi a balas, pudins, gelatinas, bolos e outros. Esse composto é classificado como
a) hidrocarboneto
b) éster
c) aldeído
d) ácido
e) ácido carboxílico
3 ) Escreva as fórmulas estruturais dos seguintes éteres:
a) Metoxipropano
b) Metoximetano
c) Propoxibutano
d) Etoxibenzeno
e )Etil-propil-éter
f) Butil-etil-éter
g) Difenil-éter
h) Metoxi-sec-butano:
i) Óxido de etileno
j) Éter metil-terc-butil
k) 1,2-epoxipropano
4) Indique o ácido e o álcool que são necessários para a reação de obtenção do
éster propanoato de metila.
a) Ácido acético e metanol.
b) Ácido metanoico e propanol.
c) Ácido propílico e etanol.
d) Ácido etanoico e propanol.
e) Ácido propílico e metanol.
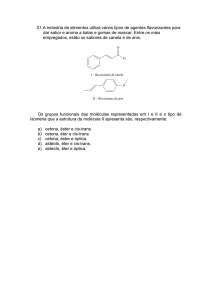
5 ) Deseja-se obter a partir do geraniol (estrutura A) o aromatizante que tem
o odor de rosas (estrutura B).
Para isso, faz-se reagir o geraniol com:
a) álcool metílico (metanol).
b) aldeído fórmico (metanal).
c) ácido fórmico (ácido metanoico).
d) formiato de metila (metanoato de metila).
e) dióxido de carbono.
Resposta 3 a 1 = e 2= b
4e
5 C
RESPOSTA 5
Pela fórmula, sabemos que o geraniol é um álcool (possui o grupo OH
ligado a um carbono saturado). Então, ele precisa reagir com um ácido
carboxílico para produzir o aromatizante que, pela fórmula, podemos
ver que é um éster. Observe que o OH do geraniol foi substituído pelo
grupo “ ─ CH ═ O”. Isso nos indica que a hidroxila do geraniol juntou-se
a um átomo de hidrogênio que estava ligado a esse grupo, formando a
água como produto. Portanto, o ácido que reage com o geraniol para
formar o aromatizante com odor de rosas é o ácido fórmico ou ácido
metanoico: