Cap. 15 - Equilíbrio Químico
Filipe Braga - 15900
José Hilário -15861
Prof. Élcio Barrak
O Conceito de Equilíbrio
A Constante de Equilíbrio
Equilíbrio Heterogêneos
Cálculo de Constantes de Equilíbrio
Aplicações das Constantes de Equilíbrio
O Princípio de Le Châtelier
O Conceito de Equilíbrio
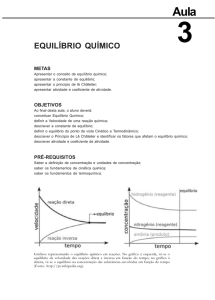
Quando uma reação atinge o equilibrio?
Quando:
velocidade de formação dos produtos apartir do
reagente = velocidade de formação dos reagentes
apartir do produto
Reação direta: A
B
Reação inversa: B
A
A reação pode ser demostrada tanto no sentido
direto quanto no sentido inverso
A
B
Quando o equilíbrio químico se estabelece?
Quando as pressões parcias de A e B não variam.
Quando a reação chega ao equilíbrio, a reação
chega ao fim?
Não! A reação atinge o equilíbrio dinâmico.
Equilíbrio químico:
N2 + 3H2
2NH3 (processo de Haper)
A constante de Equilíbrio
Quantidade de NH3 pruduzido no equilíbrio
depende das quantidades N2 e H2
Se colocado apenas NH3 em um recipiente,
uma mistura de equilíbrio NH3, N2 e H2 será
formada
A condição de equilíbrio pode ser atingida
a partir de qualquer sentido
Lei da Ação da Massa: suponhamos que
temos a equação geral de equilíbrio
aA
+bB
cC + dD
Há constante de equilíbrio em relaçao da
pressão parcial:
Keq= (PC)c
d
a
b
(PD) /(PA) (PB)
Constante de equilíbrio em relação com a
concetração:
Keq= (C)c (D)d /
a
b
(A) (B)
Ordem de grandeza das constants de
equilíbrio: Keq>1, equilíbrio encontra-se à
direita; predominam os produtos.
Keq<1, equilíbrio encontra-se à
esquerda;predominam os reagentes
Equilíbrios heterogêneos
Se um sólido ou um líquido puro está envolvido
em um equilíbrio heterogêneo, sua
concentração não é incluída na expressão da
constante de equilíbrio para a reação
Mesmo não aparecendo na espressão da
contante, sólidos e líquidos puros tem que estar
precentes no equilíbrio
Cálculo de Constantes de
Equilíbrio
Kc somente é calculado com [ mol/l] dos
elementos no estado de equilíbrio
H2(g) + I2(g)
Início
1,00x10-3M
2HI(g)
2,00x10-3M
oM
Variação
-0,935x10-3M
-0,935x10-3M
+ 1,87x10-3M
Equilíbrio
0,065x10-3M
0,065x10-3M
1,87x10-3M
Cálculo de Constantes de
Equilíbrio
Kc somente é calculado com [ mol/l] dos
elementos no estado de equilíbrio
H2(g) + I2(g)
Início
1,00x10-3M
2HI(g)
2,00x10-3M
oM
Variação
-x M
-x M
+ 2x M
Equilíbrio
(1,00 - x) M
(1,00 - x) M
2x M
Cálculo de Constantes de
Equilíbrio
Relação entre Kc e Kp :
PV=nRT
P=(n/V)RT
Pa=[A]RT
Substituindo P em Kc :
Kp = Kc (RT)Δn
N2 + 3H2
,
onde Δn é:
2NH3
Δn = 2 - 4 = -2
Aplicações das Constantes
de Equilíbrio
Quociente racional (Q):
Q = [Produtos]n / [Reagentes]n
QeK
[ mol/l ]
Q>K
[ Re ] e [ Pro ]
Q=K
[ Re ] e [ Pro ]
Q<K
[ Re ] e [ Pro ]
Sentido
O Princípio de Le Châtelier
“ Se um sistema em equilíbrio for
pertubado por uma alteração da
temperatura, da pressão, ou da
concentração de um dos componentes,
o sitema deslocará a sua posicão de
quilíbrio de modo a anular o efeito de
pertubação. ”
“Ação e reação”
O Princípio de Le Châtelier
[ ] dos reagentes ou produtos, K = cte
Volume - Pressão , K = cte
Temperatura , K altera
O Princípio de Le Châtelier
[ ] dos reagentes ou produtos, K = cte
N2(g) + 3H2(g)
Se [H2]
Se [H2]
2NH3(g)
O Princípio de Le Châtelier
Volume - Pressão , K = cte
N2(g) + 3H2(g)
2NH3(g)
Se P
V
[ ]
Se P
V
[ ]
O Princípio de Le Châtelier
Temperatura , K altera
2NO2(g) H= 58,0 kJ
N2O4(g)
Endo.
Exo.
T
K
R + Calor
P
T
K
R + Calor
P
T
K
R
P + Calor
T
K
R
P + Calor
O Princípio de Le Châtelier
Efeito de um Catalizador
“ O catalizador aumenta a velocidade
na qual o equilíbrio é atingido, mas
não altera a composição da mistura
reacional no equilíbrio.”
O Princípio de Le Châtelier
Diminui a Energia de Ativação (Dir-Ind)
N2(g) + 3H2(g)
2NH3(g)
Cat.: Ferro misturado com
óxido metálico
Referências Bibliográficas
Química - A Ciência Central - Theodore L. Brown, H. Eugene Lemay,
Bruce E. Bursten
http://www.ufsc.br/coperve/vestibular2000/imagens/quimica4.gif