SP, 13/03/15
Ciências
- Transformações físicas e químicas.
Transformações químicas e transformações físicas:
Transformações químicas são processos onde as substâncias iniciais (reagentes)
transformam-se em substâncias finais (produtos). Os produtos têm composição e
propriedades químicas diferentes quando comparados às substâncias iniciais, ou seja,
são substâncias novas.
Já as transformações físicas são processos onde as substâncias sofrem alterações sem
que haja mudança na constituição química. Não se formam substâncias novas.
Exemplos: mudança de estado de agregação (gelo
água liquida); mistura (água +
sal); deformação (lata amassada)
ATENÇÃO: Reagentes são as substancias iniciais e produtos são as substâncias
finais de uma transformação química.
É errado falar em reagentes e produtos quando se trata de uma transformação
física.
Indícios de transformações químicas:
- Mudança de cor;
- Mudança de cheiro;
- Mudança de temperatura;
- Mudança de textura;
- Mudança de sabor;
- Liberação de um gás;
- Emissão de luz;
- Formação de um precipitado (formação de uma nova substância no estado sólido, o
precipitado; com o tempo, o sólido formado se deposita no fundo do recipiente, isto é,
sofre decantação).
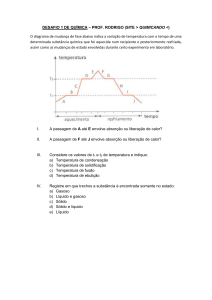
ATENÇÃO: As transformações que sofrem mudança de temperatura são divididas
em dois grupos:
Endotérmicas – há queda de temperatura.
Exotérmicas – há aumento de temperatura.
Transformações químicas que ocorrem no dia a dia:
- Fritura de um bife, de batata e de ovo: nos três casos há formação de novas
substâncias, com cor, cheiro, textura e sabor diferentes.
- Ação das enzimas sobre os alimentos: as enzimas decompõem os alimentos em novas
substâncias, que têm propriedades e composição químicas diferentes. As proteínas
são transformadas em aminoácidos, os carboidratos em glicose e as gorduras em ácidos
graxos e glicerol.
- Combustão: no motor do carro e da moto ocorre uma transformação química chamada
combustão, que que transforma as substâncias iniciais em substâncias novas.
- Remédios: os remédios são feitos a partir de substancias iniciais que se transformam
em produtos capazes de ajudar na cura de doenças. Esse processo é químico pois as
substâncias formadas tem propriedades (como a própria propriedade na cura) e
composição diferentes.
- Cerveja: para que a cerveja seja feita, ocorre a fermentação e formam-se novas
substâncias (gás carbônico, glicose e álcool).
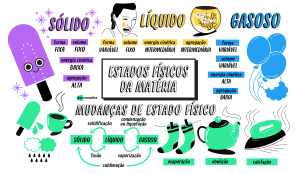
Estados de agregação:
Cada estado de agregação apresenta características próprias (o volume, a densidade e
a forma), que podem se alterar de acordo com a variação de temperatura e de pressão.
Sólido:
Forma constante.
Volume constante.
Moléculas se movimentam
pouco e estão sujeitas a
grandes forças de coesão,
pois estão próximas.
Líquido:
Forma não é constante.
Volume constante.
Moléculas estão mais
distantes e a forças de
coesão são bem menores.
Devido às forças de coesão
os sólidos tem forma
definida.
Por estarem mais soltas, as
moléculas apresentam
maior mobilidade.
Gasoso:
Forma não é constante.
Volume não é constante.
Moléculas estão muito
distantes e por isso, as
forças de coesão entre
elas são extremamente
fracas.
Por estarem muito distantes,
as moléculas apresentam
grande mobilidade.
Evaporam muito rápido.
Mudanças de estado:
- Fusão: Passagem do estado sólido para o líquido (ex.: de gelo para água)
- Vaporização (ebulição): Passagem do estado líquido para o gasoso causada por um
aumento de temperatura (ex.: água fervendo)
- Condensação: Passagem do estado gasoso para o líquido (ex.: formação de gotas de
água no lado externo do copo gelado)
- Solidificação: Passagem do estado líquido para o sólido (ex.: de água para gelo)
- Sublimação: Passagem do estado sólido para o gasoso (ex.: gelo seco)
- Sublimação inversa: Passagem do estado gasoso para o sólido.
ATENÇÃO: A mudança de estado de agregação não pode ser considerada um
indicio de transformação química, pois, muitas vezes, ocorrem mudanças de
estado nas transformações físicas (ex.: latas de bebidas transformadas em novas
latas), uma vez que quando uma substância muda de estado não sofre alterações
em sua composição.
Lei de Lavoisier/ Lei da Conservação de Massas:
"𝑁𝑎 𝑛𝑎𝑡𝑢𝑟𝑒𝑧𝑎 𝑛𝑎𝑑𝑎 𝑠𝑒 𝑐𝑟𝑖𝑎, 𝑛𝑎𝑑𝑎 𝑠𝑒 𝑝𝑒𝑟𝑑𝑒; 𝑡𝑢𝑑𝑜 𝑠𝑒 𝑡𝑟𝑎𝑛𝑠𝑓𝑜𝑟𝑚𝑎"
A Lei de Lavoisier ou Lei da Conservação de Massas foi uma frase criada pelo
químico francês Antoine Lavoisier que diz que há somente a transformação de
substâncias reagentes (substâncias iniciais) em outras substâncias, sem que haja
perda ou ganho de matéria.
Conforme provado por Lavoisier, a massa em uma reação química se conserva. No
entanto, se a transformação envolver substâncias gasosas, o sistema deve ser fechado
para que essa lei seja válida.
ATENÇÃO: A Terra é um sistema fechado em termos de matéria e aberto em
termos de energia.